Лекция № 13. Электрический ток в электролитах и газах.
I.Электрическая диссоциация молекул в растворах. Закон Ома для жидкостей.
При прохождении тока через проводники 2-го класса на электродах происходит выделение вещества (химические процессы) – электролиз.
| Схема опыта по исследованию проводимости водных растворов различных веществ. |
Прохождение тока в растворах объясняется появлением ионов.
Распад молекул на ионы называется электролитической диссоциацией, он происходит при растворении вещества.
Теория электролитической диссоциации разработана Р. Клаузиусом (1857 г.) и разработана С. Аррениусом (1887 г.). Большое значение имеют также работы русского ученого И.А. Каблукова.
Наряду с диссоциацией при соударениях возможны обратные процессы воссоединения разноименных ионов в нейтральные молекулы –
В установившемся электролите всегда существует динамическое равновесие | К Щ С |
Способность диссоциировать у различных жидкостей – различна. Для количественной характеристики степени диссоциации вводится коэффициент степень диссоциации α.
α – определяется соотношением числа диссоциированных молекул, т.е. он показывает – какая доля молекул растворенного вещества распалась на ионы.
α зависит: 1) от природы растворителя;
2) от природы растворяемого вещества;
3) от концентрации раствора;
4) от температуры.
Электрический ток в жидкостях обусловлен упорядоченным движением ионов. При отсутствии внешнего поля ионы в электролите совершают тепловое движение.
При перемещение иона возникает сила трения, пропорциональная средней скорости движения иона:
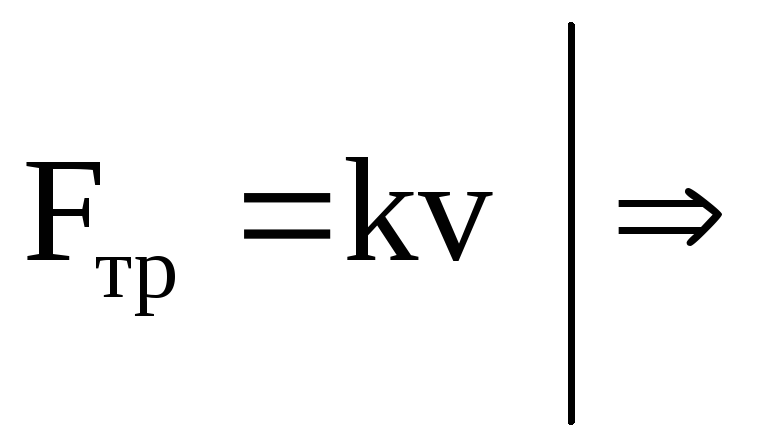
 ,
,
где k– коэффициент трения.
С другой стороны движение иона происходит под действием электрической силы:
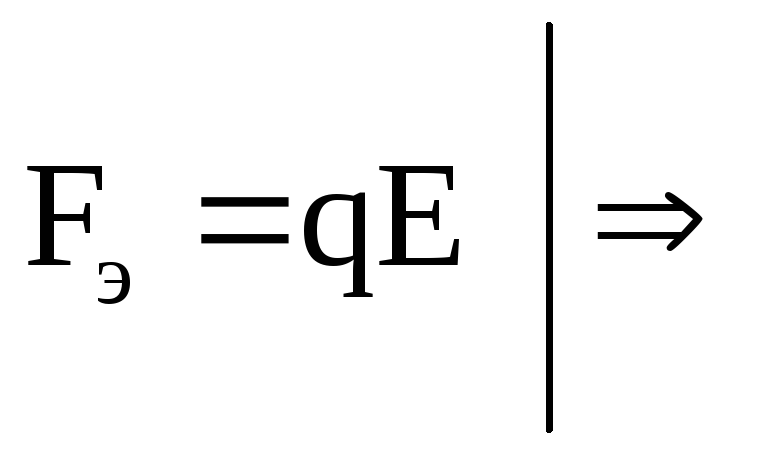

Для установившегося режима:
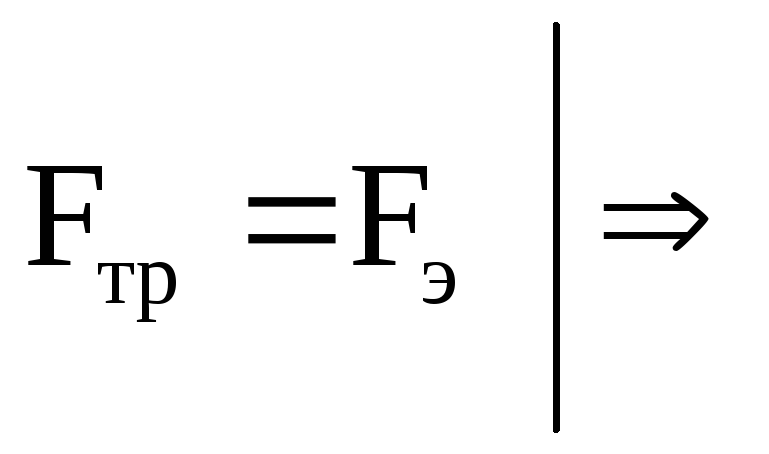
 ,
,где b– подвижность ионов.
Подвижность – скорость ионов при Е=1 
Плотность тока в электролите равна:
j=j++j–
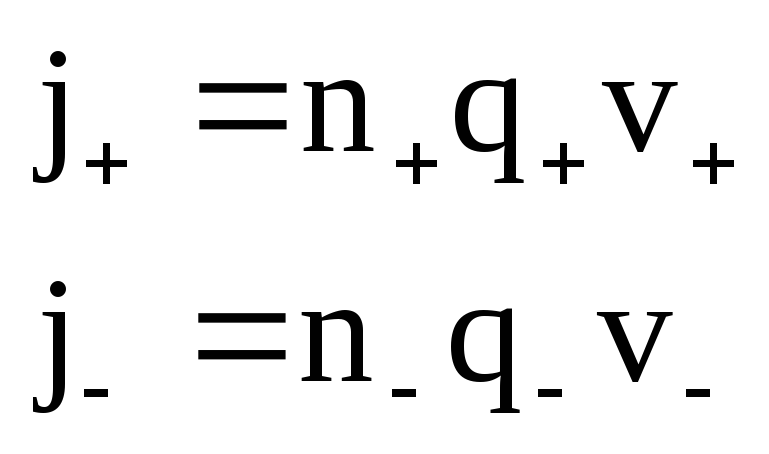 ,
,
где n– концентрация ионов.
Для бинарных электролитов справедливо:
n+=n–=n,
где – коэффициент диссоциации;
n– число молекул растворенного вещества в единице объема электролита.
Полагая также q+=q–=q, имеем:
j=αnqv++αnqv–=αnq(v++v–)
Учитывая, что v+=b+E;v–=b–E
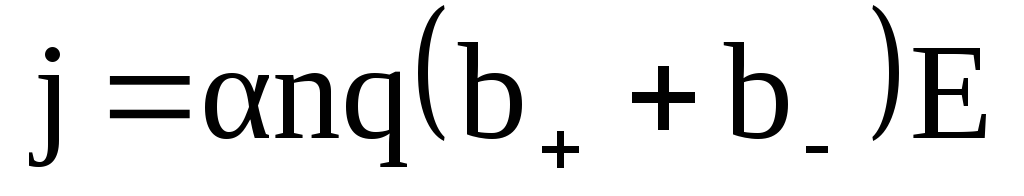 –закон Ома для электролитов(1)
–закон Ома для электролитов(1)
Сравнивая эту формулу с дифференциальной формой закона Ома j=E, получим:
γ = nq(b+ + b–)
II. Электролиз.Законы Фарадея.
При пропускании тока через электролитическую ванну электронные потоки в электродах замыкаются ионными потоками электролита. При этом у анода будет происходить превращение анионов в нейтральные атомы с отдачей электронов аноду; у катода – превращение катионов в нейтральные атомы с получением электронов от катода.
У поверхности электродов происходит выделение веществ – это сущность электролиза.
Законы электролиза (Фарадея).
1 закон | Масса вещества, выделившегося на электроде, прямопропорциональна заряду, прошедшему через электролит. |
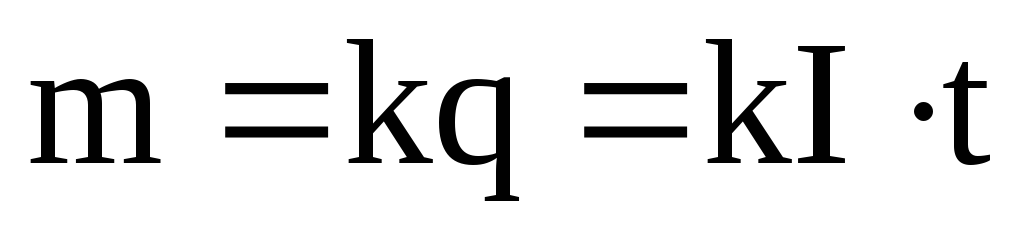 , (2)
, (2)
где k– электрохимический эквивалент.
2 закон | Электрохимические эквиваленты прямопропорциональны их химическим эквивалентам х. |
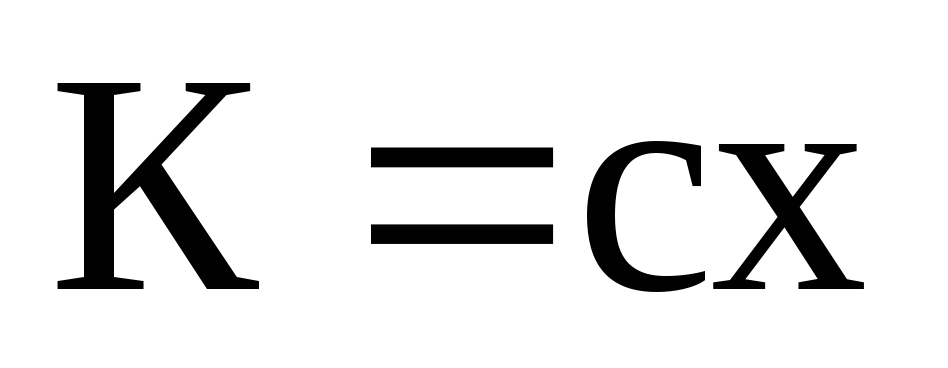 , (3)
, (3)
где 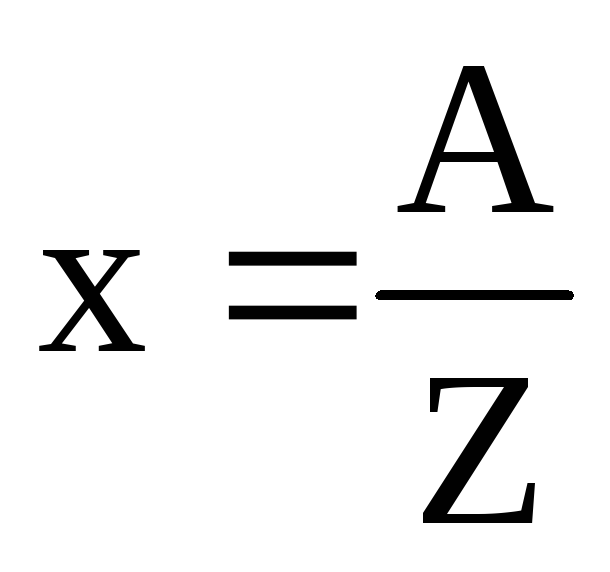 :
А – атомный вес вещества,Z– его валентность.
:
А – атомный вес вещества,Z– его валентность.
 – число Фарадея – равно электрическому
заряду, который нужно пропустить через
электролит для выделения на электроде
1 моля вещества.
– число Фарадея – равно электрическому
заряду, который нужно пропустить через
электролит для выделения на электроде
1 моля вещества.

3 закон | Объединенный закон. |
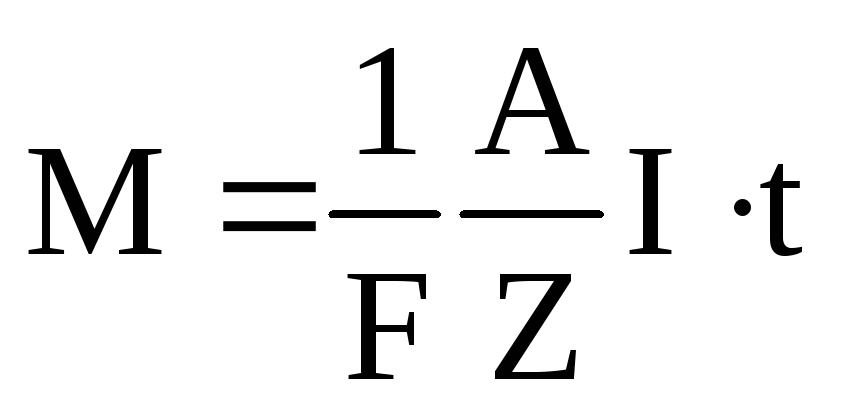 (4)
(4)
Применение электролиза:
получение металлов в электрометаллургии (расплавы) Na,Al
Очистка или рафинирование металлов (Cu)
Электролитическое разложение воды на Н2и О2
Гальванопластика (изображение предметов)
Гальваностегия (покрытия)
Электролитическая полировка
7.7. Электрический ток через электролиты. Закон Ома для электролитов
Растворы солей, кислот и щелочей в воде и в других растворителях хорошо проводят электрический ток. Это связано с тем, что молекулы растворенного вещества диссоциируют, т.е. распадаются на положительные и отрицательные ионы. Если при растворении не происходит диссоциации молекул, то раствор не является проводником электрического тока.
О пределим
плотность тока j в жидкости, т.е. заряд,
переносимый за одну секунду через
площадку единичной площади, перпендикулярную
направлению движения ионов (рис. 7.17).
Так как перенос зарядов осуществляется
ионами обоих знаков, то
пределим
плотность тока j в жидкости, т.е. заряд,
переносимый за одну секунду через
площадку единичной площади, перпендикулярную
направлению движения ионов (рис. 7.17).
Так как перенос зарядов осуществляется
ионами обоих знаков, то
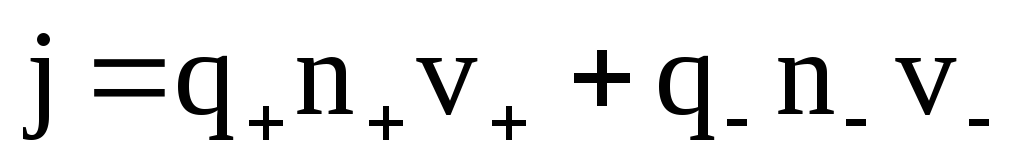 ,
(7.52)
,
(7.52)
где q+ и q— – заряды положительных и отрицательных ионов;
n+ и n— – концентрации этих ионов;
v+ и v— – средние скорости упорядоченного движения этих ионов.
Учитывая, что раствор в целом нейтрален, можно записать
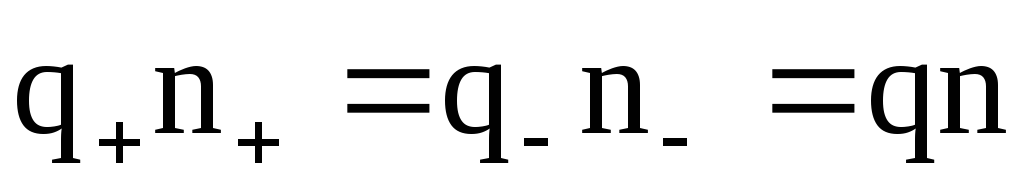
где q – заряд иона любого знака;
n – концентрация ионов этого же знака.
Величина заряда иона обусловлена потерей или сохранением валентных электронов при диссоциации молекулы. Обозначив валентность иона через z, для заряда иона будем иметь
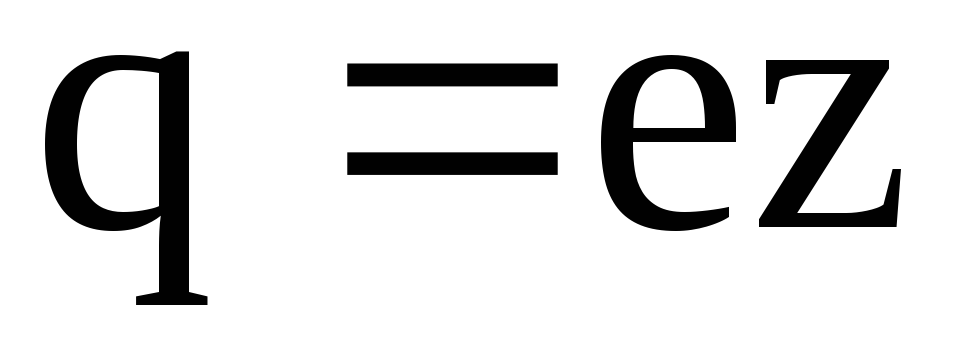 , (7.54)
, (7.54)
где e – абсолютное значение заряда электрона.
Учитывая формулы (7.53) и (7.54), получим
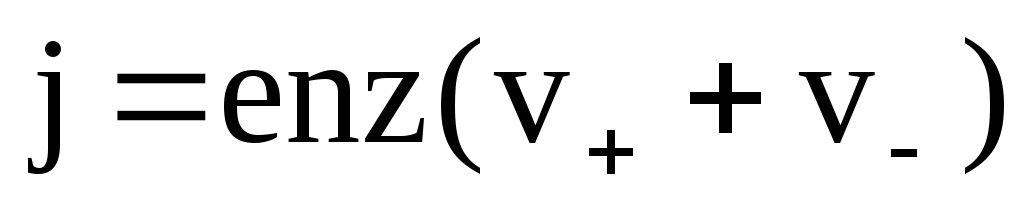
В электрическом поле на ионы действуют две силы: сила, действующая со стороны электрического поля, и сила внутреннего трения.
Сила со стороны электрического поля
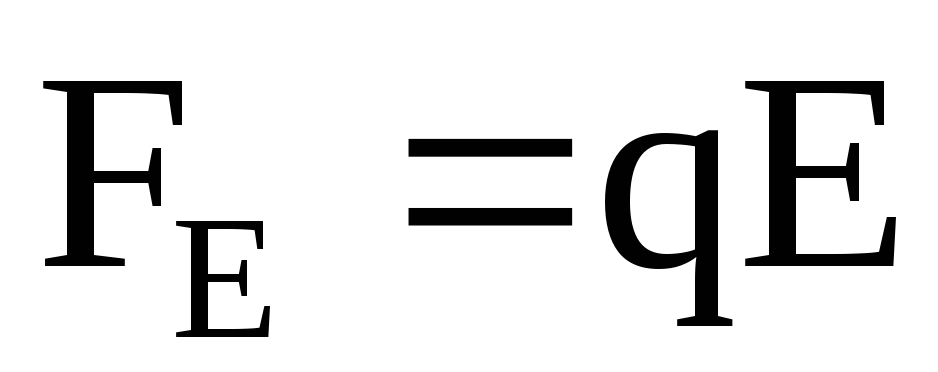 ,
(7.56)
,
(7.56)
где E – величина напряженности электрического поля.
Сила внутреннего трения, если предположить, что ион имеет форму шара с радиусом r, то согласно закону Стокса
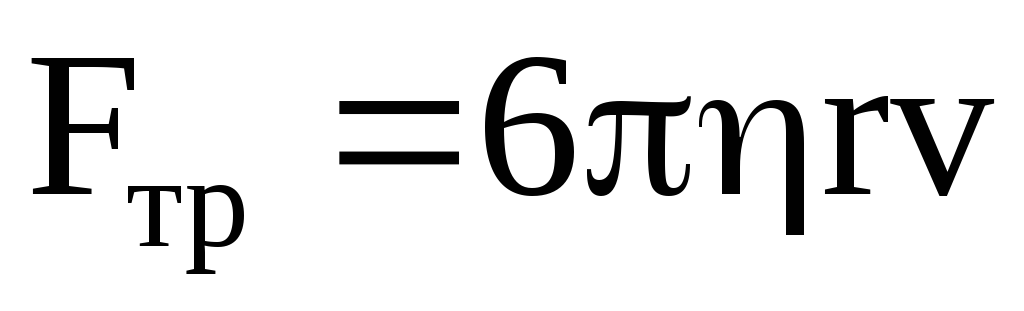 ,
(7.57)
,
(7.57)
где – коэффициент вязкости жидкости.
При
установившемся движении (которое
наступает практически одновременно с
появлением электрического поля) F
 ,
,
откуда
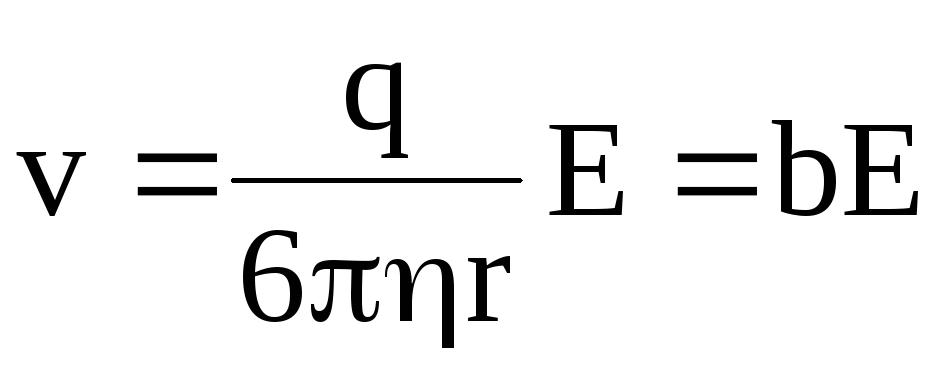 ,
(7.58)
,
(7.58)
где 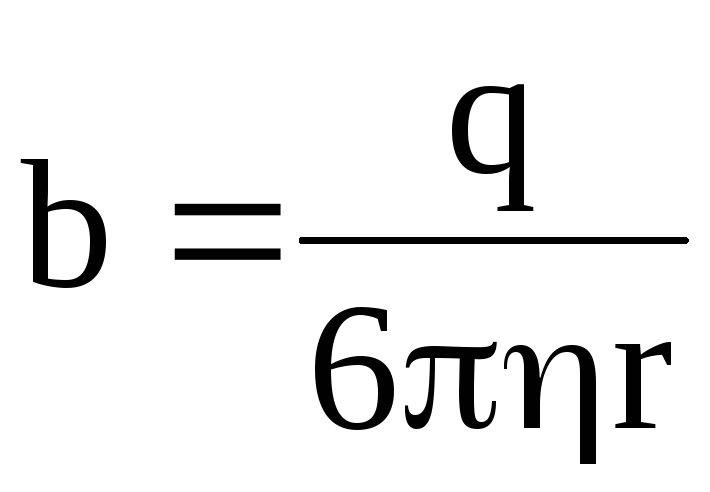 – подвижность иона.
– подвижность иона.
Таким образом, подвижность иона b равна отношению скорости движения иона к напряженности электрического поля:
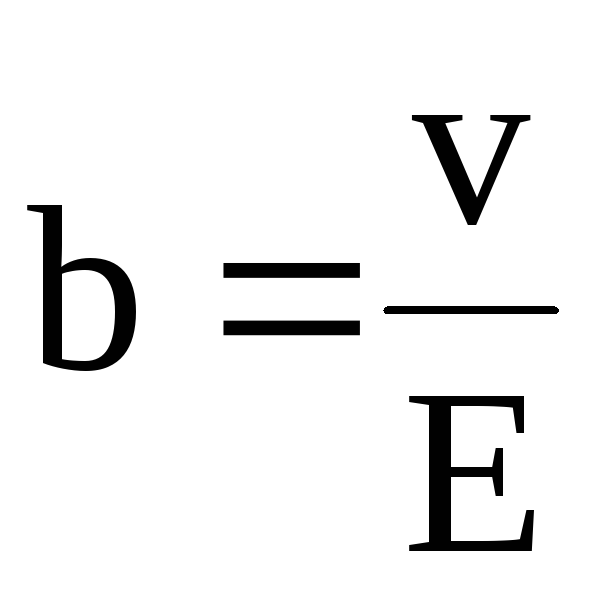 . (7.59)
. (7.59)
Как видно из формулы (7.58), подвижность ионов возрастает с повышением температуры (за счет уменьшения вязкости жидкости). Скорость движения ионов пропорциональна напряженности электрического поля.
Учитывая соотношение (7.58) для плотности электрического тока, получим
 (7.60)
(7.60)
или
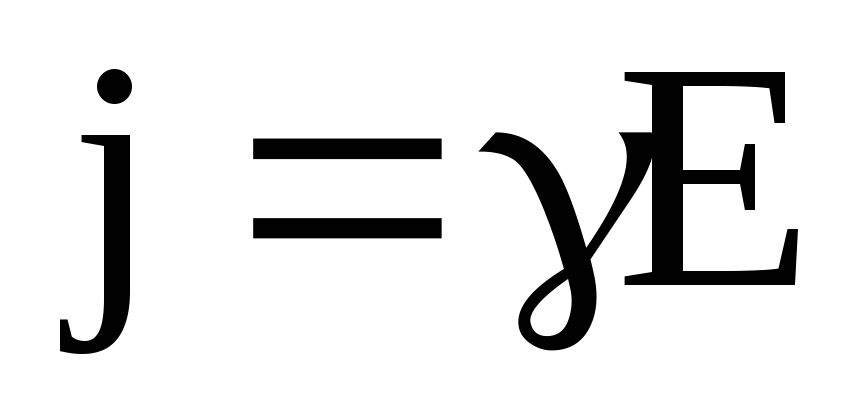 , (7.61)
, (7.61)
где 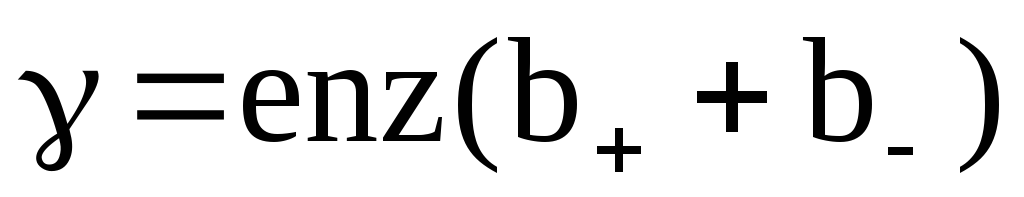 — удельная проводимость электролита.
— удельная проводимость электролита.
Выражения (7.60) и (7.61) представляют собой закон Ома в дифференциальной форме для электролитов.
Из формулы (7.60) для удельного сопротивления электролита имеем
 .
7.62)
.
7.62)
Так как с повышением температуры подвижность и концентрация ионов возрастают, то, согласно формуле (7.62), с повышением температуры сопротивление электролитов уменьшается.
Концентрация ионов зависит от степени диссоциации, характеризующейся коэффициентом диссоциации . Коэффициент диссоциации определяется отношением концентрации n ионов к концентрации no молекул растворенного вещества:
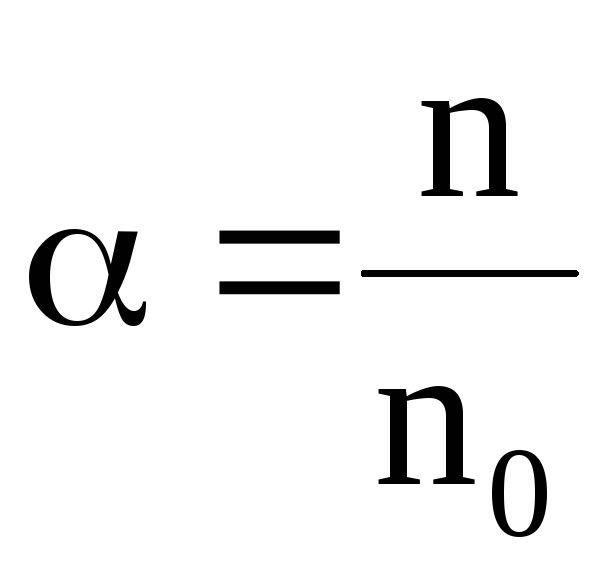 . (7.63)
. (7.63)
Откуда
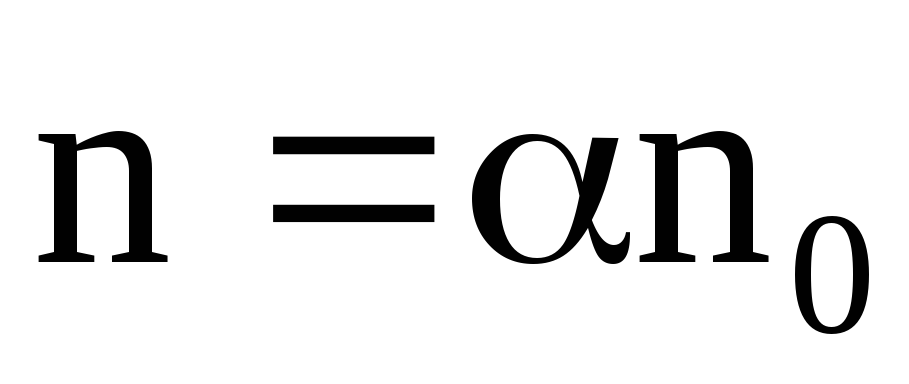 .
(7.64)
.
(7.64)
Концентрация недиссоциированных молекул
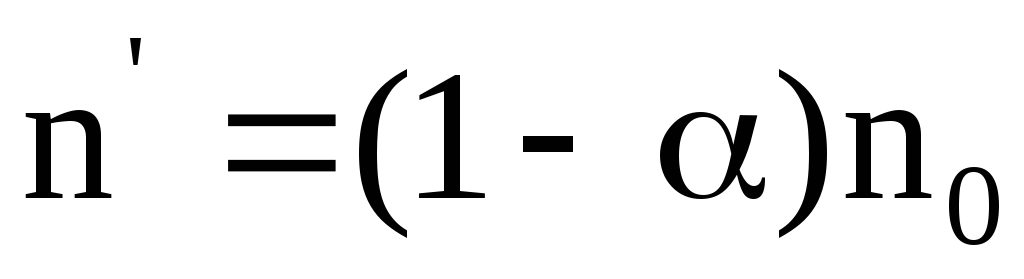 .
(7.65)
.
(7.65)
В
растворе одновременно и непрерывно
происходит как диссоциация молекул,
так и молизация ионов, т.е. соединение
ионов в нейтральные молекулы. В условиях
равновесия интенсивности процессов
диссоциации молекул и молезации ионов,
изменяющих состав раствора в
противоположных направлениях, равны.
В процессе диссоциации молекул скорость
изменения концентрации ионов каждого
знака 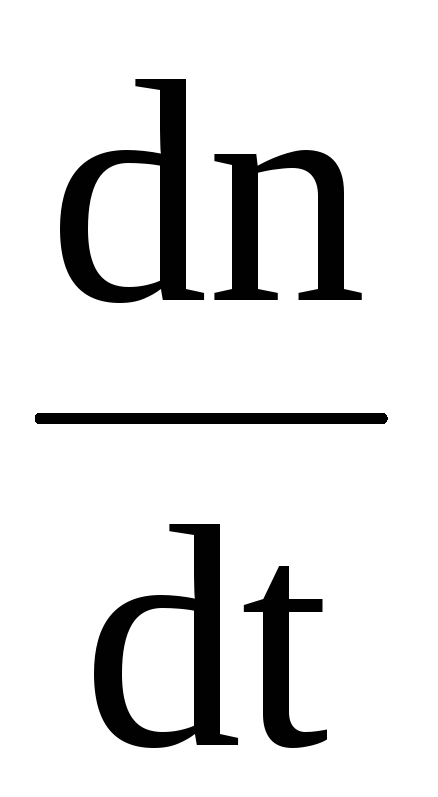 пропорциональна концентрацииn‘ недиссоциированных молекул:
пропорциональна концентрацииn‘ недиссоциированных молекул:
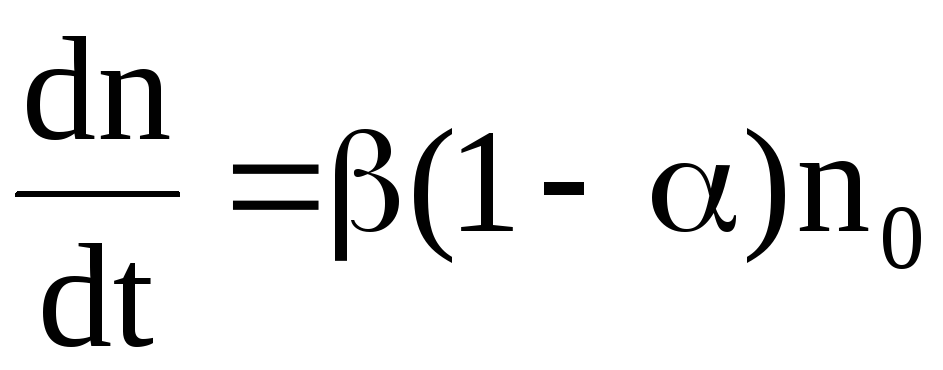 ,
(7.66)
,
(7.66)
где – коэффициент пропорциональности.
Скорость
изменения концентрации недиссоциированных
молекул  в результате ионизации ионов
пропорциональна произведению концентраций
положительных и отрицательных ионов:
в результате ионизации ионов
пропорциональна произведению концентраций
положительных и отрицательных ионов:
 ,
(7.67)
,
(7.67)
где — коэффициент пропорциональности.
При
равновесии 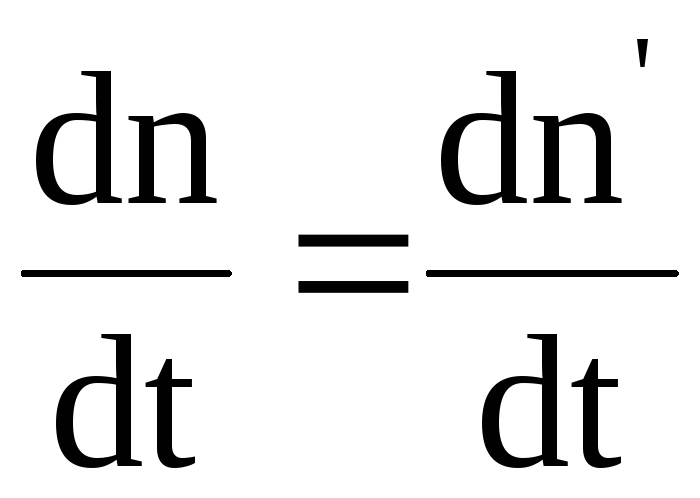 ,
поэтому с учетом (7.66) и (7.67) можно получить
формулу, связывающую коэффициент
диссоциации с концентрацией растворенного
вещества:
,
поэтому с учетом (7.66) и (7.67) можно получить
формулу, связывающую коэффициент
диссоциации с концентрацией растворенного
вещества:
 . (7.68)
. (7.68)
Очевидно, что коэффициент диссоциации зависит от концентрации растворенного вещества. При очень слабой концентрации (no 0) равенство (7.68) дает
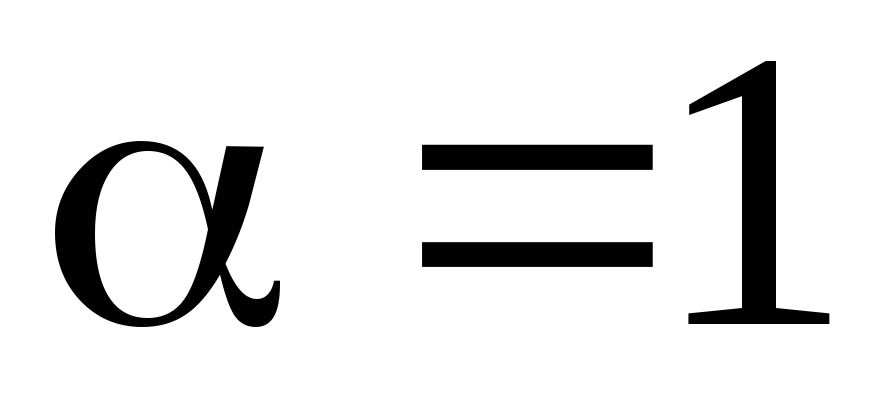 .
(7.69)
.
(7.69)
Если <<1, то из (7.68) получаем
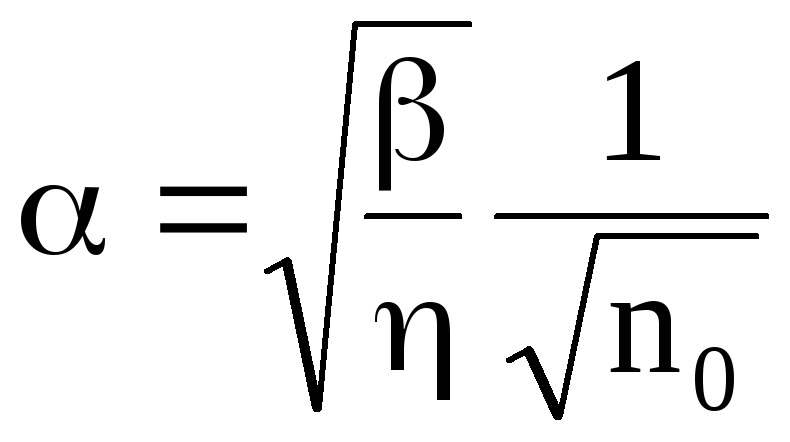 .
(7.70)
.
(7.70)
Таким образом, коэффициент диссоциации уменьшается при увеличении концентрации растворенного вещества.
С
учетом 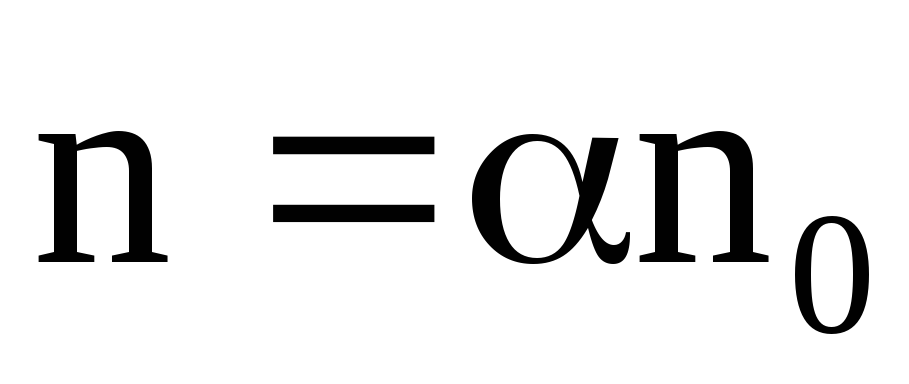 уравнение для плотности тока в
электролитах можно записать так:
уравнение для плотности тока в
электролитах можно записать так:
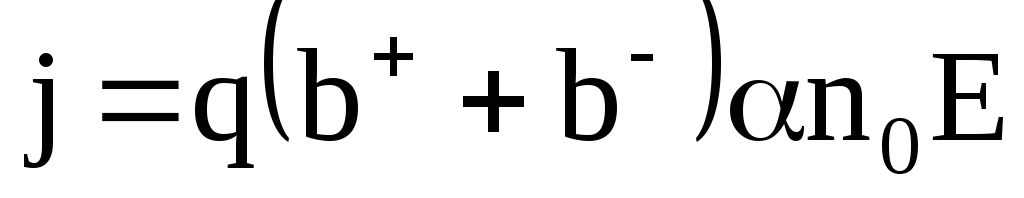 .
(7.71)
.
(7.71)
Подвижность ионов и коэффициент диссоциации в широких пределах изменения напряженности электрического поля не зависят от напряженности электрического поля E.
При небольшой концентрации раствора коэффициент диссоциации и сумма подвижностей ионов (b+ + b—) приблизительно постоянны. Следовательно, при малой концентрации раствора электропроводимость пропорциональна концентрации. При увеличении концентрации зависимость электропроводности от концентрации значительно усложняется.
Надо отметить, что величина тока через столб электролита в любом его сечении одна и та же, хотя на первый взгляд она должна быть разной.
Представим, что имеется три сечения столба электролита 1, 2, 3 (рис. 7.18).
Ч ерез
сечение 1 проходят только отрицательные
ионы, через сечение 3 – только положительные
ионы, а через сечение 2 – и те и другие.
Поэтому создается впечатление, что ток
через сечение 2 больше, чем через сечения
1 и 3. Это неверно, ток через любое сечение
должен быть одним и тем же, иначе между
сечениями будет накапливаться заряд.
Выполнение закона сохранения заряда
в электролитах обусловлено тем, что
скорость упорядоченного движения и
концентрация ионов разных знаков
непостоянны вдоль выбранной оси ОХ.
ерез
сечение 1 проходят только отрицательные
ионы, через сечение 3 – только положительные
ионы, а через сечение 2 – и те и другие.
Поэтому создается впечатление, что ток
через сечение 2 больше, чем через сечения
1 и 3. Это неверно, ток через любое сечение
должен быть одним и тем же, иначе между
сечениями будет накапливаться заряд.
Выполнение закона сохранения заряда
в электролитах обусловлено тем, что
скорость упорядоченного движения и
концентрация ионов разных знаков
непостоянны вдоль выбранной оси ОХ.
В центральной области столба электролита концентрации положительных и отрицательных ионов примерно равны, следовательно, объемная плотность заряда близка к нулю. У положительного электрода (анода) скапливаются отрицательные ионы. Объемная плотность заряда отрицательна. У отрицательного электрода (катода) имеется положительный объемный заряд.
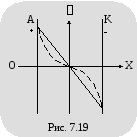
Н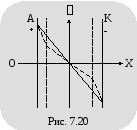
 а
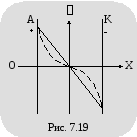
рисунке 7.19 показано изменение потенциала
между электродами (при заданной разности
потенциалов между ними), вызванное
объемными зарядами. Сплошная линия
соответствует изменению потенциала в
вакууме, пунктирная – в том же
пространстве, заполненном электролитом.
На рисунке 7.20 для сравнения показано
изменение потенциала в межэлектродном
промежутке, в который введены две сетки.
Левая сетка заряжена отрицательно по
отношению к аноду и имитирует отрицательный
объемный заряд. Правая сетка заряжена
положительно по отношению к катоду и
имитирует положительный объемный
заряд. Сравнение кривых изменения
потенциала в межэлектродном пространстве
показывает, что изменение потенциала
в первом и втором случаях почти одинаково.
а
рисунке 7.19 показано изменение потенциала
между электродами (при заданной разности
потенциалов между ними), вызванное
объемными зарядами. Сплошная линия
соответствует изменению потенциала в
вакууме, пунктирная – в том же
пространстве, заполненном электролитом.
На рисунке 7.20 для сравнения показано
изменение потенциала в межэлектродном
промежутке, в который введены две сетки.
Левая сетка заряжена отрицательно по
отношению к аноду и имитирует отрицательный
объемный заряд. Правая сетка заряжена
положительно по отношению к катоду и
имитирует положительный объемный
заряд. Сравнение кривых изменения
потенциала в межэлектродном пространстве
показывает, что изменение потенциала
в первом и втором случаях почти одинаково.
Постоянство величины электрического тока в электролитах обусловлено тем, что напряженность электрического тока, а следовательно, и скорость упорядоченного движения ионов в разных точках объема диэлектрика разные. В центральной области они меньше, чем в других областях.
7.7. Электрический ток через электролиты. Закон Ома для электролитов
Растворы солей, кислот и щелочей в воде и в других растворителях хорошо проводят электрический ток. Это связано с тем, что молекулы растворенного вещества диссоциируют, т.е. распадаются на положительные и отрицательные ионы. Если при растворении не происходит диссоциации молекул, то раствор не является проводником электрического тока.
О пределим
плотность тока j в жидкости, т.е. заряд,
переносимый за одну секунду через
площадку единичной площади, перпендикулярную
направлению движения ионов (рис. 7.17).
Так как перенос зарядов осуществляется
ионами обоих знаков, то
пределим
плотность тока j в жидкости, т.е. заряд,
переносимый за одну секунду через
площадку единичной площади, перпендикулярную
направлению движения ионов (рис. 7.17).
Так как перенос зарядов осуществляется
ионами обоих знаков, то
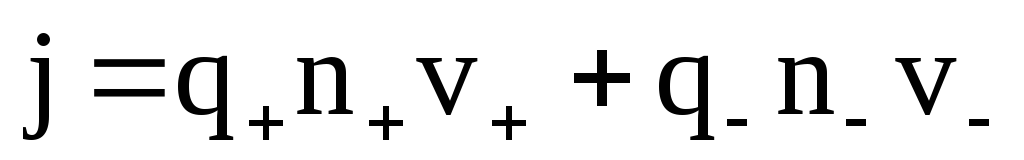 ,
(7.52)
,
(7.52)
где q+ и q— – заряды положительных и отрицательных ионов;
n+ и n— – концентрации этих ионов;
v+ и v— – средние скорости упорядоченного движения этих ионов.
Учитывая, что раствор в целом нейтрален, можно записать
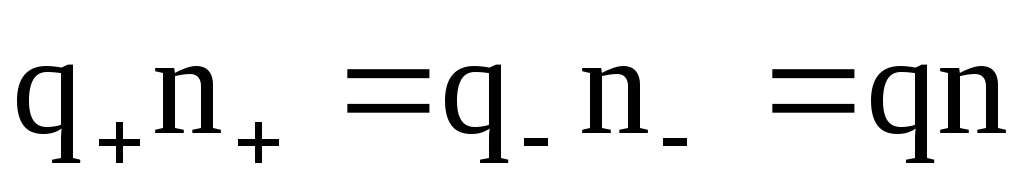 , (7.53)
, (7.53)
где q – заряд иона любого знака;
n – концентрация ионов этого же знака.
Величина заряда иона обусловлена потерей или сохранением валентных электронов при диссоциации молекулы. Обозначив валентность иона через z, для заряда иона будем иметь
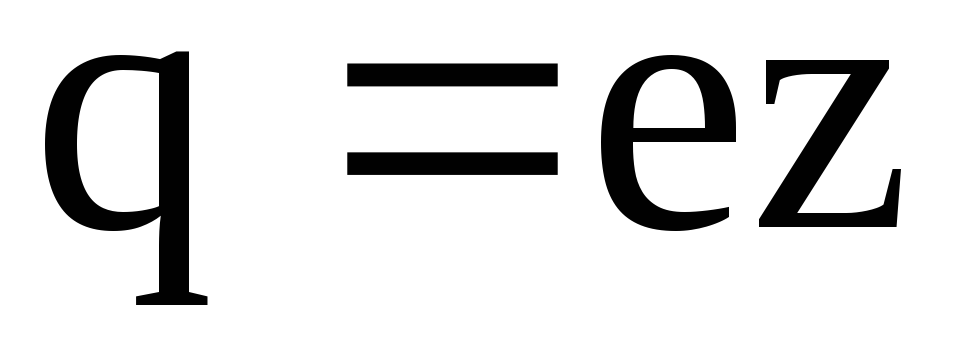 , (7.54)
, (7.54)
где e – абсолютное значение заряда электрона.
Учитывая формулы (7.53) и (7.54), получим
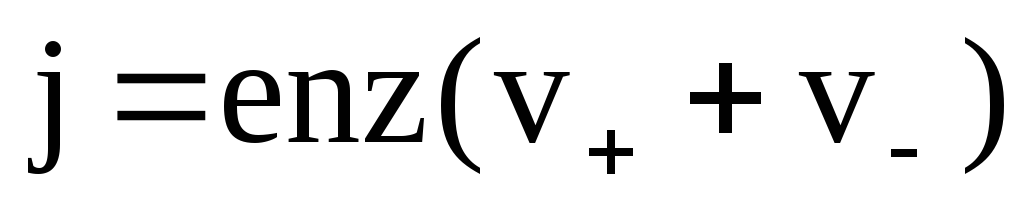 .
(7.55)
.
(7.55)
В электрическом поле на ионы действуют две силы: сила, действующая со стороны электрического поля, и сила внутреннего трения.
Сила со стороны электрического поля
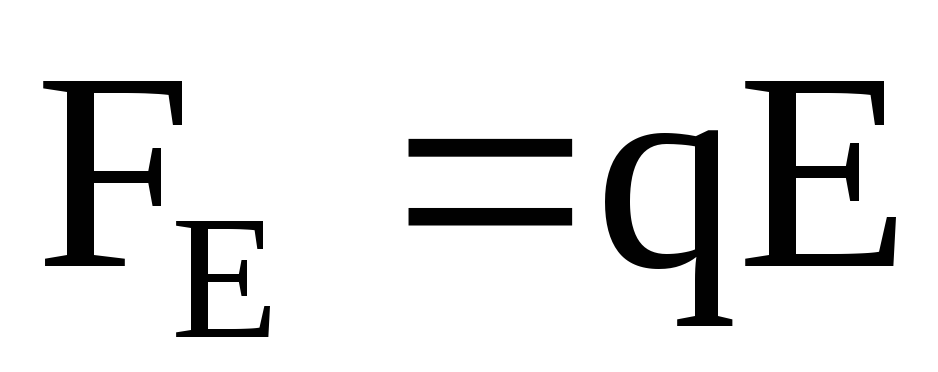 ,
(7.56)
,
(7.56)
где E – величина напряженности электрического поля.
Сила внутреннего трения, если предположить, что ион имеет форму шара с радиусом r, то согласно закону Стокса
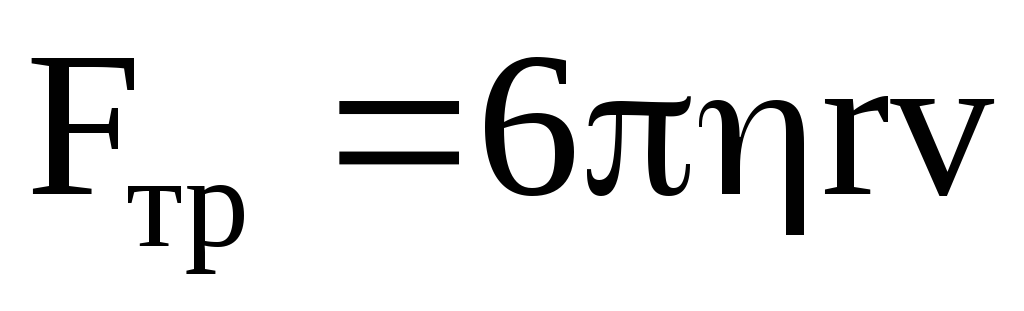 ,
(7.57)
,
(7.57)
где – коэффициент вязкости жидкости.
При установившемся движении (которое наступает практически одновременно с появлением электрического поля) FE = Fтр, следовательно имеем
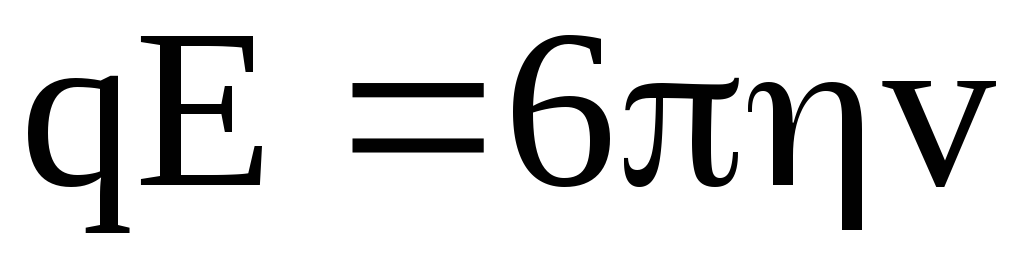 ,
,
откуда
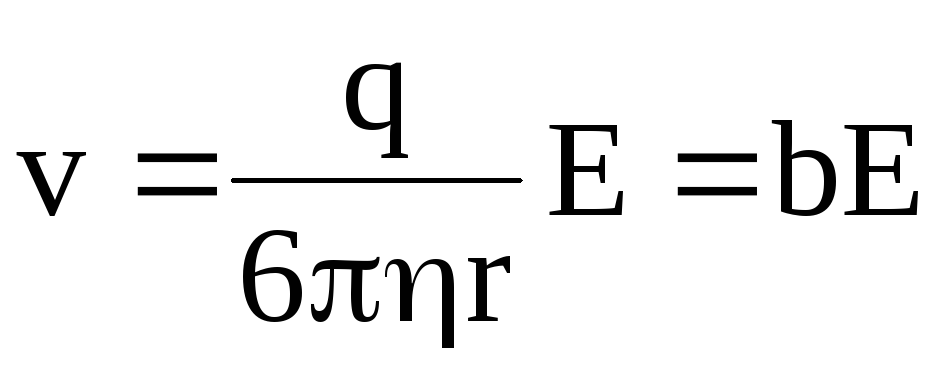 ,
(7.58)
,
(7.58)
где 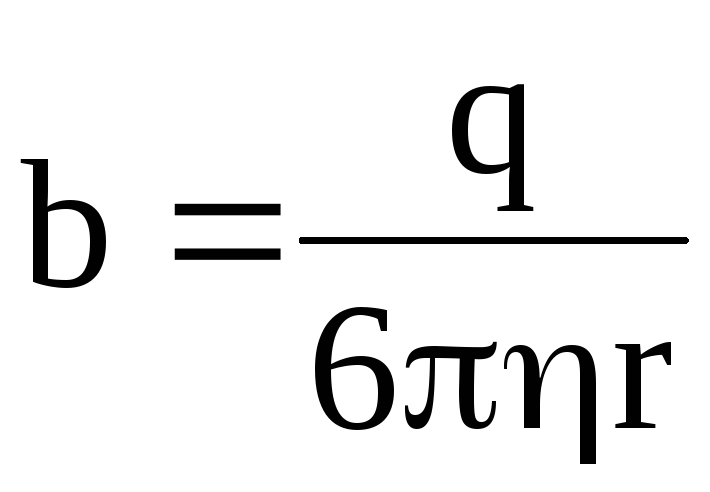 – подвижность иона.
– подвижность иона.
Таким образом, подвижность иона b равна отношению скорости движения иона к напряженности электрического поля:
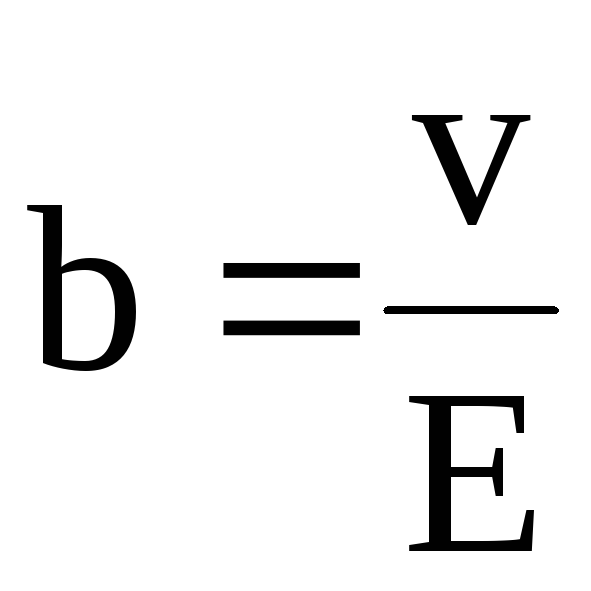 . (7.59)
. (7.59)
Как видно из формулы (7.58), подвижность ионов возрастает с повышением температуры (за счет уменьшения вязкости жидкости). Скорость движения ионов пропорциональна напряженности электрического поля.
Учитывая соотношение (7.58) для плотности электрического тока, получим
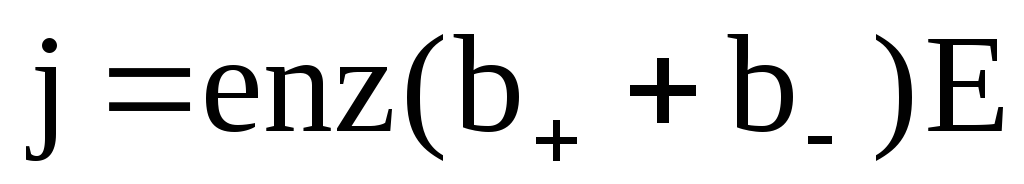 (7.60)
(7.60)
или
 , (7.61)
, (7.61)
где  — удельная проводимость электролита.
— удельная проводимость электролита.
Выражения (7.60) и (7.61) представляют собой закон Ома в дифференциальной форме для электролитов.
Из формулы (7.60) для удельного сопротивления электролита имеем
 .
7.62)
.
7.62)
Так как с повышением температуры подвижность и концентрация ионов возрастают, то, согласно формуле (7.62), с повышением температуры сопротивление электролитов уменьшается.
Концентрация ионов зависит от степени диссоциации, характеризующейся коэффициентом диссоциации . Коэффициент диссоциации определяется отношением концентрации n ионов к концентрации no молекул растворенного вещества:
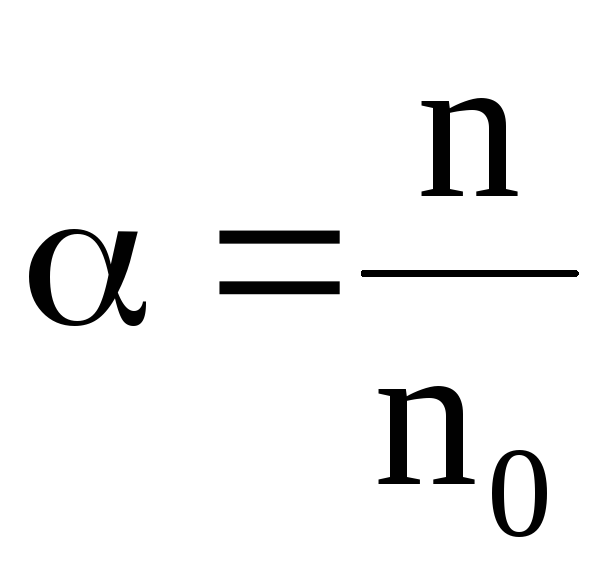 . (7.63)
. (7.63)
Откуда
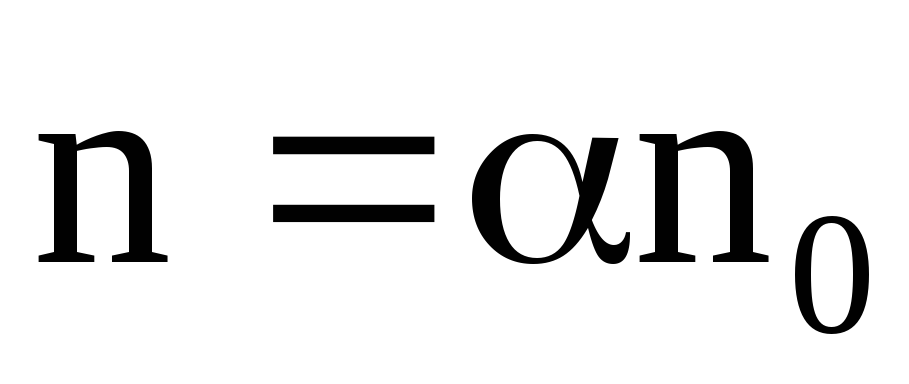 .
(7.64)
.
(7.64)
Концентрация недиссоциированных молекул
 .
(7.65)
.
(7.65)
В
растворе одновременно и непрерывно
происходит как диссоциация молекул,
так и молизация ионов, т.е. соединение
ионов в нейтральные молекулы. В условиях
равновесия интенсивности процессов
диссоциации молекул и молезации ионов,
изменяющих состав раствора в
противоположных направлениях, равны.
В процессе диссоциации молекул скорость
изменения концентрации ионов каждого
знака  пропорциональна концентрацииn‘ недиссоциированных молекул:
пропорциональна концентрацииn‘ недиссоциированных молекул:
 ,
(7.66)
,
(7.66)
где – коэффициент пропорциональности.
Скорость
изменения концентрации недиссоциированных
молекул 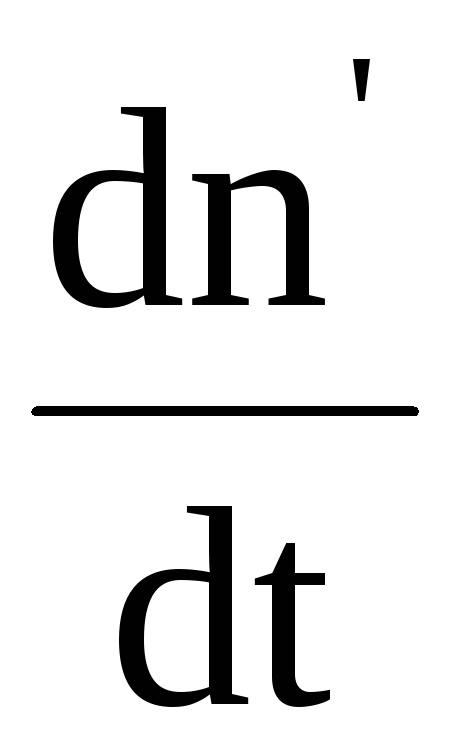 в результате ионизации ионов
пропорциональна произведению концентраций
положительных и отрицательных ионов:
в результате ионизации ионов
пропорциональна произведению концентраций
положительных и отрицательных ионов:
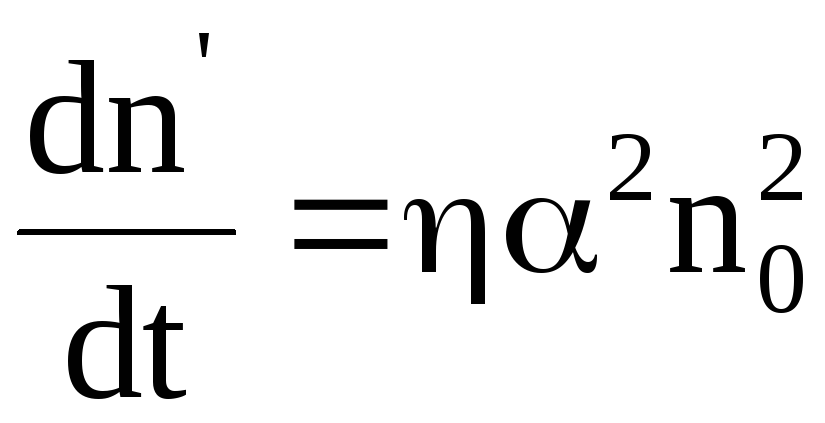 ,
(7.67)
,
(7.67)
где — коэффициент пропорциональности.
При
равновесии 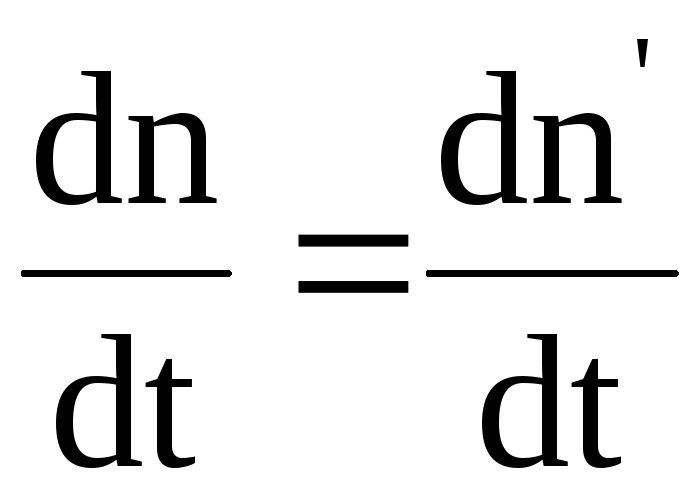 ,
поэтому с учетом (7.66) и (7.67) можно получить
формулу, связывающую коэффициент
диссоциации с концентрацией растворенного
вещества:
,
поэтому с учетом (7.66) и (7.67) можно получить
формулу, связывающую коэффициент
диссоциации с концентрацией растворенного
вещества:
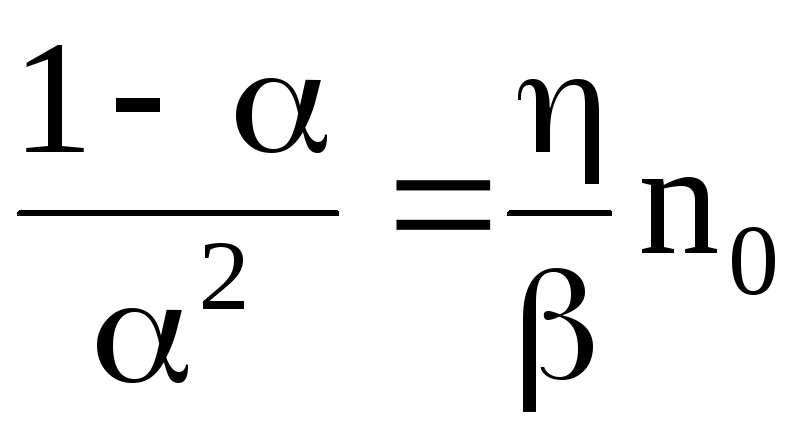 . (7.68)
. (7.68)
Очевидно, что коэффициент диссоциации зависит от концентрации растворенного вещества. При очень слабой концентрации (no 0) равенство (7.68) дает
 .
(7.69)
.
(7.69)
Если <<1, то из (7.68) получаем
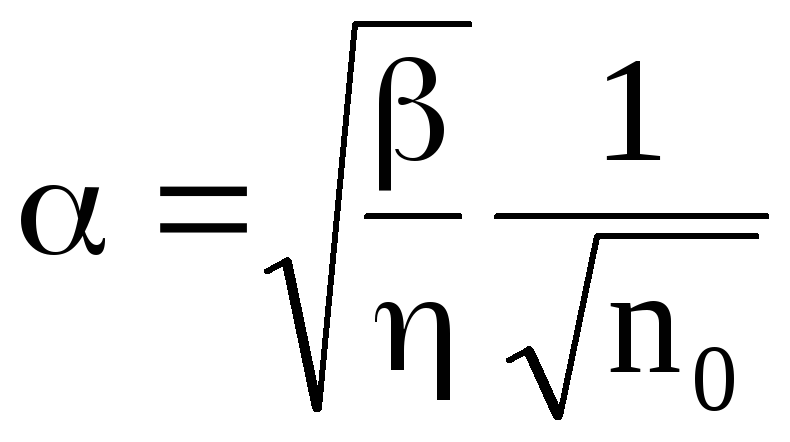 .
(7.70)
.
(7.70)
Таким образом, коэффициент диссоциации уменьшается при увеличении концентрации растворенного вещества.
С
учетом 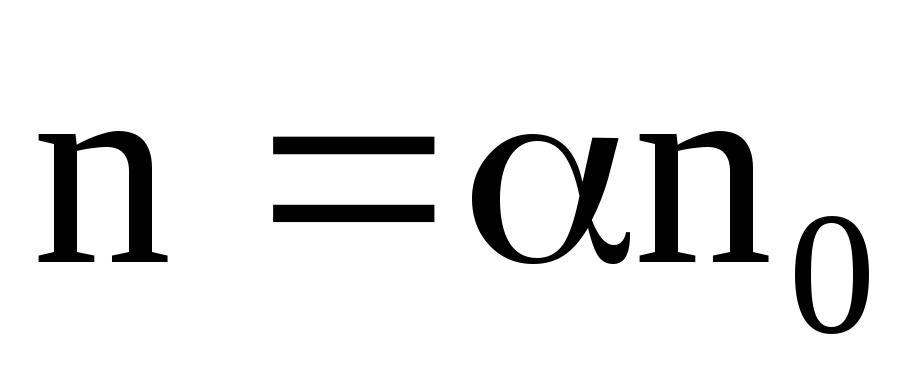 уравнение для плотности тока в
электролитах можно записать так:
уравнение для плотности тока в
электролитах можно записать так:
 .
(7.71)
.
(7.71)
Подвижность ионов и коэффициент диссоциации в широких пределах изменения напряженности электрического поля не зависят от напряженности электрического поля E.
При небольшой концентрации раствора коэффициент диссоциации и сумма подвижностей ионов (b+ + b—) приблизительно постоянны. Следовательно, при малой концентрации раствора электропроводимость пропорциональна концентрации. При увеличении концентрации зависимость электропроводности от концентрации значительно усложняется.
Надо отметить, что величина тока через столб электролита в любом его сечении одна и та же, хотя на первый взгляд она должна быть разной.
Представим, что имеется три сечения столба электролита 1, 2, 3 (рис. 7.18).
Ч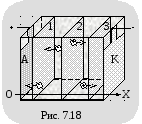 ерез
сечение 1 проходят только отрицательные
ионы, через сечение 3 – только положительные
ионы, а через сечение 2 – и те и другие.
Поэтому создается впечатление, что ток
через сечение 2 больше, чем через сечения
1 и 3. Это неверно, ток через любое сечение
должен быть одним и тем же, иначе между
сечениями будет накапливаться заряд.
Выполнение закона сохранения заряда
в электролитах обусловлено тем, что
скорость упорядоченного движения и
концентрация ионов разных знаков
непостоянны вдоль выбранной оси ОХ.
ерез
сечение 1 проходят только отрицательные
ионы, через сечение 3 – только положительные
ионы, а через сечение 2 – и те и другие.
Поэтому создается впечатление, что ток
через сечение 2 больше, чем через сечения
1 и 3. Это неверно, ток через любое сечение
должен быть одним и тем же, иначе между
сечениями будет накапливаться заряд.
Выполнение закона сохранения заряда
в электролитах обусловлено тем, что
скорость упорядоченного движения и
концентрация ионов разных знаков
непостоянны вдоль выбранной оси ОХ.
В центральной области столба электролита концентрации положительных и отрицательных ионов примерно равны, следовательно, объемная плотность заряда близка к нулю. У положительного электрода (анода) скапливаются отрицательные ионы. Объемная плотность заряда отрицательна. У отрицательного электрода (катода) имеется положительный объемный заряд.
Н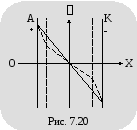
 а
рисунке 7.19 показано изменение потенциала
между электродами (при заданной разности
потенциалов между ними), вызванное
объемными зарядами. Сплошная линия
соответствует изменению потенциала в
вакууме, пунктирная – в том же
пространстве, заполненном электролитом.
На рисунке 7.20 для сравнения показано
изменение потенциала в межэлектродном
промежутке, в который введены две сетки.
Левая сетка заряжена отрицательно по
отношению к аноду и имитирует отрицательный
объемный заряд. Правая сетка заряжена
положительно по отношению к катоду и
имитирует положительный объемный
заряд. Сравнение кривых изменения
потенциала в межэлектродном пространстве
показывает, что изменение потенциала
в первом и втором случаях почти одинаково.
а
рисунке 7.19 показано изменение потенциала
между электродами (при заданной разности
потенциалов между ними), вызванное
объемными зарядами. Сплошная линия
соответствует изменению потенциала в
вакууме, пунктирная – в том же
пространстве, заполненном электролитом.
На рисунке 7.20 для сравнения показано
изменение потенциала в межэлектродном
промежутке, в который введены две сетки.
Левая сетка заряжена отрицательно по
отношению к аноду и имитирует отрицательный
объемный заряд. Правая сетка заряжена
положительно по отношению к катоду и
имитирует положительный объемный
заряд. Сравнение кривых изменения
потенциала в межэлектродном пространстве
показывает, что изменение потенциала
в первом и втором случаях почти одинаково.
Постоянство величины электрического тока в электролитах обусловлено тем, что напряженность электрического тока, а следовательно, и скорость упорядоченного движения ионов в разных точках объема диэлектрика разные. В центральной области они меньше, чем в других областях.
Ток в электролитах и газах. Потенциал ионизации. Закон Ома для электролитов и газов. Электрофорез.
Если в электролит или расплав ввести две твердотельных пластинки (электроды) и подать на них напряжение, то возникает электрический ток, который создаётся направленным движением ионов. Достигнув соответствующих электродов, ионы отдают или приобретают электроны и превращаются в нейтральные атомы или молекулы. В результате химических реакций вторичные продукты либо оседают на электродах, либо переходят в раствор. Явление осаждения составных частей электролита на электродах получило название электролиза. Материалы, в которых при прохождении тока происходят химические превращения, относятся к проводникам второго рода.
Количественно электролиз описывается законами Фарадея:
 ,
,  , (19)
, (19)
где m – масса осевшего на электроде вещества, k – его электрохимический эквивалент, i = f(t) – сила тока, t – время его протекания, F – число Фарадея (F = 96,497∙106 Кл/моль.), М – молярная масса вещества, z – валентность, F/z – называется химическим эквивалентом вещества.
Если величина тока I в процессе электролиза не меняется, то (18) принимает вид: 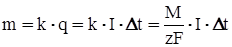 (20)
(20)
В растворе процессы диссоциации и рекомбинации идут параллельно. В конечном итоге в растворе при постоянных внешних условиях устанавливается динамическое равновесие. Этому состоянию соответствует определенная степень диссоциации, которую принято характеризовать коэффициентом диссоциации – α, который показывает долю распавшихся молекул растворенного вещества – α = n‘ / n0. При невысоких температурах ионы бывают окружены облепившими их ионами растворителя. Это явление получило название сольватации (для водных растворов – гидратации), а сам комплекс из иона и удерживаемой его силовым полем оболочки из молекул растворителя называют сольватом.Отношение  (21)
(21)
называется подвижностью ионов,которая представляет среднюю
скорость дрейфа заряженных частиц в поле с напряженностью 1 В/м). [b] = м2 / (В·с). Подвижность ионов b зависит от их природы, свойств растворителя и температуры. Для установившегося движения плотность тока в электролите будет:
j = (n+ q+ b+ + n— q— b—)Е (22)
Величина в скобках не зависит от напряженности поля – Е. Это значит, ток в электролитах подчиняется закону Ома. Если каждая молекула диссоциирует на два иона, то
j = αnq(b+ + b—)Е. (23)
Выражение
γ = αnq(b+ + b—) (24)
представляет собой электропроводность электролита. Как видно из выражения (23), проводимость электролитов растет с повышением температуры, т.к. при этом увеличивается коэффициент диссоциации и подвижность ионов. Зависимость γ от концентрации довольно сложная (рис.): Для слабых растворов, когда α ≈ 1, γ растет пропорционально с. В дальнейшем с увеличением концентрации коэффициент диссоциации α убывает, поэтому рост проводимости замедляется, а затем даже начинает уменьшаться.Электрофорез – направленное движение заряженных частиц (ионов, капелек жидкости, взвешенных и коллоидных части) под воздействием электрического поля в какой-то среде. Скорость упорядоченного движения при электрофорезе определяется уравнением Смолуховского: 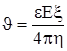 , (25)
, (25)
где ε – диэлектрическая проницаемость среды, Е – напряженность электрического поля, η – вязкость среды, ξ – электрокинетический (дзета) потенциал.
Газ становится проводником электричества только, когда некоторая часть его молекул ионизируется. Для ионизации газ надо подвергнуть воздействию какого-либо ионизатора: например, электрический разряд, рентгеновское излучение, радиации или УФ-излучение, пламя свечи.
При ионизации газов происходит вырывание из внешней электронной оболочки атома или молекулы одного или нескольких электронов, что приводит к образованию свободных электронов и положительных ионов. Электроны могут присоединяться к нейтральным молекулам и атомам, превращая их в отрицательные ионы. Электрический ток в газах называется газовым разрядом. Т.о., ток в газах создается ионами обоих знаков и электронами. Газовый разряд при таком механизме будет сопровождаться переносом вещества, т.е. ионизированные газы относятся к проводникам второго рода.
Для того чтобы оторвать от молекулы или атома один электрон, необходимо совершить определенную работу Аи, т.е . затратить определенную энергию. Эту энергию называют энергией ионизации, значения которой для атомов различных веществ лежат в пределах 4÷25 эВ. Количественно процесс ионизации принято характеризовать величиной, которая называется потенциал ионизации:
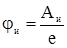 .
.
ГЛАВА VI. ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ, ДИЭЛЕКТРИКАХ И ПОЛУПРОВОДНИКАХ. § 24. Закон Ома для электролитов : КУРС ОБЩЕЙ ФИЗИКИ Том 2 : Юридическая библиотека
Электролитами называются вещества, молекулы которых состоят из ионов противоположных знаков, удерживаемых друг около друга кулоновскими силами притяжения. К электролитам относятся кислоты, щелочи и соли. При растворении электролитов в воде значительная часть молекул в растворе распадается на ионы. Вода имеет высокую диэлектрическую проницаемость (s =81), в силу чего электрическое взаимодействие между ионами сильно уменьшается. Сравнительно небольшая кинетическая энергия молекул, обусловленная их тепловым движением, достаточна при этом, чтобы вызвать их диссоциацию. Это явление называется электролитической диссоциацией.
Таким образом, при растворении электролитов в воде или в другой полярной жидкости в ней возникает значительное количество свободных ионов обоего знака, тем большее, чем выше концентрация растворенного электролита. Обозначим число свободных положительных ионов в единице объема раствора электролита через л+ и отрицательных ионов — через Заряды ионов кратны элементарному заряду е= 4,8- Ю-10 СГС ед. заряда и зависят от валентностей ионов. Обозначим эти валентности соответственно через
и z_. Так как раствор в целом нейтрален, то суммарные заряды положительных и отрицательных ионов в единице объема по абсолютной величине равны друг другу:
n+zJre = n_z_e. (24.1)
Для упрощения дальнейшей записи введем сокращение
— — (24.2)
При растворении в воде, например, серной кислоты H,,S04 последняя диссоциирует на положительно заряженные ионы водорода
и кислотный остаток, несущий двойной отрицательный заряд: HaS045=г 2Н+-(-S07-. Следовательно, в этом случае г+=\ и z_ = 2, а число ионов водорода в растворе п+ соответственно в два раза больше, чем число отрицательных ионов п_.
Высокая диэлектрическая проницаемость воды обусловлена тем, что молекулы НгО представляют собой жесткие диполи, обладающие значительным электрическим дипольным моментом. Ближайшие к иону электролита дипольные молекулы воды поворачиваются к нему противоположно заряженными полюсами и притягиваются, образуя вокруг иона своеобразное «облако», перемещающееся вместе с ним. Это облако не вполне стабильно; в результате теплового движения отдельные молекулы отрываются от иона, а на их место приходят другие. При движении иона в раст- воре под радиусом иона следует понимать \ радиус г его гидратной оболочки У (рис. 2.52).
I ^^^ 1 ®та °б°лочка препятствует обратному сое-
, (+) г »н динению (рекомбинации) ионов в нейт-
Рч j ральные молекулы. Само притяжение к окру- \ \\/ жающим диполям и является тем фактором,
yj^ Js который ослабляет внутримолекулярные связи // » и обусловливает диссоциацию молекул на со
ставляющие их ионы.
Рис. 2.52. Если в растворе электролита создать элек
трическое поле напряженностью Е, то положительные ионы начнут двигаться по полю, а отрицательные — против поля и возникнет электрический ток. Рассмотрим для примера положительный ион с зарядом z+e. На этот ион в электрическом поле будет действовать сила
Рэл = 2+еЕ. (24.3)
Под ее действием ион начнет ускоренно двигаться вдоль поля, и скорость его направленного движения v+ будет возрастать. Вследствие большого радиуса гидратной оболочки движущийся в растворе ион испытывает значительную силу трения Етр. Рассматривая ион вместе с оболочкой как твердый шарик радиуса г+, движущийся в вязкой жидкости с коэффициентом внутреннего тре- иия (вязкостью) т), можно определить силу трения по закону Стокса:
Ртр = -6ЛТ)Г+У+. (24.4)
По мере увеличения скорости иона возрастает сила трения и уменьшается его ускорение. Практически через очень короткий промежуток времени сила трения станет равной по величине силе электрического поля, и ион далее будет двигаться равномерно с некоторой постоянной скоростью v+. При равномерном движении
геометрическая сумма сил, действующих на ион, равна нулю:
Рэл + Ртр=0.
или
г+еЕ — 6лг]г + у+ = 0. Отсюда можно найти искомую скорость иона:
г+е
-k+E. (24.5)
+ 6ПГ|Г +
Коэффициент пропорциональности
6дг|г+ (24.6)
называется подвижностью положительного иона. Он зависит от заряда и размера иона и от вязкости раствора. Из (24.5) следует, что А+ = г>+ при £=1. Иными словами, подвижность иона численно равна скорости его равномерного движения при напряженности электрического поля, равной единице.
Аналогичным образом мы получим для отрицательных ионов
где
(24.8)
— подвижность отрицательного иона. При комнатной температуре подвижности ионов в воде имеют порядок
ejcM в\м
С повышением температуры вязкость раствора резко падает и подвижности ионов соответственно возрастают.
В § 20 предыдущей главы нами было выведено выражение для плотности электрического тока при направленном движении однозарядных частичек одного знака:
) = печ. (24.9)
Эту формулу легко обобщить на растворы электролитов, содержащие ионы обоих знаков:
j =n+z+ev++n_(—z_e)v_. (24.9а)
место v+ и v_ их выражения (24.5) и (24.7)
учим
j = n«(A+ + M Е, (24,10)
Подставляя в (24.9а) вместо v+ и v_ их выражения (24.5) и (24.7) и учитывая (24.2), получим
т. е. закон Ома в дифференциальной форме. Коэффициент пропорциональности в этой формуле
y=nze(k+ (24.11)
есть электропроводность раствора электролита, которая зависит от концентрации свободных ионов и от нх подвижностей. В противоположность металлам электропроводность растворов электролитов возрастает с температурой благодаря увеличению подвижностей ионов.
Около металлических электродов, опущенных в раствор электролита, картина процесса усложняется и возникает целый ряд побочных явлений. Если внутри электролита ток переносится зарядами
обоего знака, то вблизи, например, отрицательного электрода — катода — отрицательно заряженные ионы уходят от него, их концентрация л_ падает практически до нуля и ток переносится только положительными ионами — катионами. В противоположность этому к положительному электроду—аноду— подходят только отрицательные ионы—анионы (рис. 2.53). Поэтому вблизи электродов перестает соблюдаться равенство (24.2) и электрическое поле искажается.
Подходя к электродам, ионы разряжаются и превращаются в нейтральные атомы или радикалы. При этом анионы отдают свои избыточные электроны металлическому аноду. Двигаясь по внешней цепи, эти свободные электроны доходят до катода и переходят оттуда на подошедшие катионы, разряжая последние, как это схематически показано на рис. 2.53.
Нейтрализовавшиеся атомы оседают на электродах. Если они химически активны, то у электродов протекают вторичные реакции, приводящие в конечном счете к разложению воды. Так, например, при разрядке иона Na+ на катоде выделяется атом Na, бурно реагирующий с водой:
Na+HsO-*NaOH+H.
В результате натрий обычно уходит в раствор, где он опять ионизуется, а на катоде выделяется газообразный водород. Выделение на электродах первичных или вторичных продуктов разложения раствора при прохождении через него электрического тока называется электролизом.
|
jl « |
|
— |
|
— |
©—©— |
^ — |
|
|
|
— |
|
|
|
|
|
|
|
/ |
|
|
‘ ©—- ^ |
Рис 2.53
Электролиз слегка подкисленной воды с разложением ее на водород и кислород впервые наблюдал в 1802 г. В. В. Петров. В настоящее время электролиз воды применяется для получения чистого водорода и для обогащения воды так называемой тяжелой водой DjO. В обычной воде рек, морей и океанов всегда присутствует в небольшом количестве тяжелая вода. В процессе электролиза на катоде выделяется главным образом легкий водород, а остаток обогащается дейтерием.
Количественные законы выделения вещества при электролизе были экспериментально установлены в 1836 г. М. Фарадеем В отличие от металлов перенос электрического заряда в растворах электролитов связан с переносом вещества самого электролита и выделением этого вещества на электродах. Если за некоторое время t у электрода разрядятся N ионов валентности z, то они перенесут с собой к электроду суммарный заряд
q=Nez. (24.12)
Разряжаясь у электрода, эти ионы оставляют на нем массу
M—Nm, (24.13)
где т— масса одного осаждающегося атома.
Разделим второе из этих равенств на первое. Тогда полученное отношение
^ = ^ = К (24.13а)
есть постоянная величина, не зависящая от количества прошедших через раствор ионов; она называется электрохимическим эквивалентом данного вещества.
Отсюда мы получаем первый закон Фарадея-
M=Kq = KIt (24.14)
— количество М выделившегося на электроде вещества прямо пропорционально протекшему через раствор количеству электричества q. Электрохимический эквивалент К численно равен массе вещества М, выделившейся на электроде прн прохождении через электролит единицы количества электричества (^=1). Для серебра электрохимический эквивалент равен
КАг= 1,18.10-‘ кг/к.
Преобразуем выражение (24.13а) для К, умножив его числитель и знаменатель на число Авогадро Na. Тогда получим
^ т_ mN0 1 А
ег N0ez ~ N0e Т ‘
Здесь A—mN^—атомный вес вещества, А[г — так называемый
химический эквивалент этого вещества, а
N0e=F (24.15)
— так называемая константа Фараде я. Отсюда получается второй закон Фарадея:
*=7 7- (2416)
—электрохимический эквивалент данного вещества К прямо пропорционален его химическому эквиваленту Ajz. Объединяя оба закона, получим
Отсюда можно установить физический смысл постоянной Фарадея: F=q при
т. е. постоянная Фарадея численно равна количеству электричества, которое должно пройти через раствор для выделения на электроде одного килограмм-эквивалента (кг-экв) данного вещества. Измерения дают
£=9,6487 -10′ к1кг-экв.
Из (24.15) видно, что, измерив F и иайдя заряд электрона е, можно определить третью универсальную постоянную — число Авогадро Nt.
Первым практическим применением электролиза был изобретенный в 1838 г. Б. С. Якоби метод гальванопластики. Пропуская длительное время ток через раствор медной соли, Якоби получил на катоде медную пластинку однородной толщины, повторявшую форму катода. В настоящее время электролитические методы широко применяются для получения и очистки цветных металлов, для создания антикоррозийных покрытий и в ряде других областей техники.
Таким образом, при прохождении электрического тока в электролитах его энергия расходуется на различные химические реакции. Обратные процессы получения электрического тока за счет энергии химических превращений, протекающие в гальванических элементах и аккумуляторах, подробно разбираются в курсе общей химии.
Закон Ома для электролитов
Распространение потенциала действия по миелинизированным волокнам
Механизм проведения возбуждения по нервным волокнам зависит от их типа. Существуют два типа нервных волокон: миелиновые и безмиелиновые.По миелинизированному волокну ПД распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах безмиелиновых волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. ПД, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до критического уровня, что приводит к возникновению в них новых ПД, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье ПД возбуждает 2-ой, 3-ий, 4-ый и даже 5-ый, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Это увеличивает скорость распространения ПД по миелинизированным волокнам по сравнению с немиелинизированными. Кроме того, миелинизированные волокна толще, а электрическое сопротивление более толстых волокон меньше, что тоже увеличивает скорость проведения импульса по миелинизированным волокнам. Другим преимуществом сальтаторного проведения является его экономичность в энергетическом плане, так как возбуждаются только перехваты Ранвье, площадь которых меньше 1 % мембраны, и, следовательно, необходимо значительно меньше энергии для восстановления трансмембранных градиентов Na+ и K+, расходующихся в результате возникновения ПД, что может иметь значение при высокой частоте разрядов, идущих по нервному волокну.Чтобы представить, насколько эффективно может быть увеличена скорость проведения за счёт миелиновой оболочки, достаточно сравнить скорость распространения импульса по немиелинизированным и миелинизированным участкам нервной системы человека. При диаметре волокна около 2 µм и отсутствии миелиновой оболочки скорость проведения будет составлять ~1 м/с, а при наличии даже слабой миелинизации при том же диаметре волокна — 15-20 м/с. В волокнах большего диаметра, обладающих толстой миелинововой оболочкой, скорость проведения может достигать 120 м/с.Скорость распространения потенциала действия по мембране отдельно взятого нервного волокна отнюдь не является постоянной величиной — в зависимости от различных условий, эта скорость может очень значительно уменьшаться и, соответственно, увеличиваться, возвращаясь к некоему исходному уровню.
Основные формы активного состояния возбудимой ткани – возбуждение и торможение. Возбуждение – это активный физиологический процесс, который возникает в ткани под действием раздражителя, при этом изменяются физиологические свойства ткани. Возбуждение характеризуется рядом признаков:
1) специфическими признаками, характерными для определенного вида тканей;
2) неспецифическими признаками, характерными для всех видов тканей (изменяются проницаемость клеточных мембран, соотношение ионных потоков, заряд клеточной мембраны, возникает потенциал действия, изменяющий уровень метаболизма, повышается потребление кислорода и увеличивается выделение углекислого газа).
По характеру электрического ответа существует две формы возбуждения:
1) местное, нераспространяющееся возбуждение (локальный ответ). Оно характеризуется тем, что:
а) отсутствует скрытый период возбуждения;
б) возникает при действии любого раздражителя;
в) отсутствует рефрактерность;
г) затухает в пространстве и распространяется на короткие расстояния;
2) импульсное, распространяющееся возбуждение.
Оно характеризуется:
а) наличием скрытого периода возбуждения;
б) наличием порога раздражения;
в) отсутствием градуального характера;
г) распространением без декремента;
д) рефрактерностью (возбудимость ткани уменьшается).
Электрограмма-график активности какого-либо органа .Видами электрограмм являются:
Электроэнцефалограмма- график электрической активности головного мозга, получаемый в процессе электроэнцефалографии.
Электрокардиограмма-запись сокращения сердца;
Электромиограмма-запись биоэлектрических потенциалов,возникающих в скелетных мышцах.
Различают также электрограмму сна и т.д
Модель Эйнтховена.ЭКГ
Эйнтховен предложил снимать разность биопотенциалов сердца между вершинами равностороннего треуг.(треугольника Эйнтховена),которые приблизительно расположены на правой и левой руке и левой ноге.В данном случае расположение точек установки электродов измерительного устройства по Эйнтховену получили название стандартных отведений электрокардиограммы:1 отведение-электроды устанавливаются на правой и левой руке,2 отведение-на правой руке и левой ноге,3 отведение-на левой руке и левой ноге.Поскольку амплитуда тканевых биопотенциалов пропорциональна проекции вектора возбуждения(дипольного момента)на стороны треуг.Эйнтховена,то из рисунка ясно,что наибольшая амплитуда ЭКГ будет регистрироваться во втором стандартном отведении.
Электрокардиография регистрирует биоэлектрический потенциал работающего сердца; электрический сигнал в этом случае примерно в 100 раз мощнее. Электрические сигналы регулируют работу сердца. Прямым результатом электрокардиографии является получение электрокардиограммы (ЭКГ) — графического представления разности потенциалов возникающих в результате работы сердца и проводящихся на поверхность тела. На ЭКГ отражается усреднение всех векторов потенциалов действия, возникающих в определённый момент работы сердца.
Применение: Определение частоты и регулярности сердечных сокращений (например, экстрасистолы (внеочередные сокращения), или выпадения отдельных сокращений — аритмии).Показывает острое или хроническое повреждение миокарда (инфаркт миокарда, ишемия миокарда).Может быть использована для выявления нарушений обмена калия, кальция, магния и других электролитов. Выявление нарушений внутрисердечной проводимости (различные блокады).Метод скрининга при ишемической болезни сердца, в том числе и при нагрузочных пробах. Даёт понятие о физическом состоянии сердца (гипертрофия левого желудочка).Может дать информацию о внесердечных заболеваниях, таких как тромбоэмболия лёгочной артерии.В определённом проценте случаев может быть абсолютно неинформативна. Позволяет удалённо диагностировать острую сердечную патологию (инфаркт миокарда, ишемия миокарда) с помощью кардиофона.
Для измерения разности потенциалов на различные участки тела накладываются электроды.
Нормальная ЭКГ: Соответствие участков ЭКГ с соответствующей фазой работы сердца
Обычно на ЭКГ можно выделить 5 зубцов: P, Q, R, S, T. Иногда можно увидеть малозаметную волну U. Зубец P отображает работу предсердий, комплекс QRS — систолу желудочков, а сегмент ST и зубец T — процесс реполяризации миокарда.
Отведения Каждая из измеряемых разниц потенциалов называется отведением. Отведения I, II и III накладываются на конечности: I — правая рука — левая рука, II — правая рука — левая нога, III — левая рука — левая нога. С электрода на правой ноге показания не регистрируются, он используется только для заземления пациента.
Электропроводность– способность веществ проводить электрический ток, обусловленная наличием в них подвижных заряженных частиц (электронов, ионов и др.). Электропроводность (L) является величиной, обратной электрическому сопротивлению (R).При подаче на объект разности потенциалов (U) через него потечет электрический ток силой (I), величина которой пропорциональна электропроводности (L):
I = L • U или I = U / R.Величина электропроводности зависит от количества электрических зарядов и их подвижности. Чем больше количество зарядов и их подвижность, тем больше электропроводность.Вещества по отношению к постоянному току делят на проводники и диэлектрики. Проводники электрические – вещества, хорошо проводящие электрический ток благодаря наличию в них большого количества подвижных заряженных частиц. Они делятся на электронные (металлы), ионные (электролиты) и смешанные, где имеет место движение как электронов, так и ионов (например, плазма). Диэлектрики – твердые, жидкие и газообразные вещества, очень плохо проводящие электрический ток. Удельное сопротивление постоянному току у них составляет 108-1017 Ом • см. Особое место занимают полупроводники – вещества, электропроводность которых при обычных условиях весьма низка, но она резко возрастает с температурой. На их электропроводность влияют и другие внешние воздействия: свет, сильное электрическое поле, поток быстрых частиц и др.
Электропроводность живых тканей определяется концентрацией ионов и их подвижностью, которые весьма неодинаковы в различных тканях, в связи с чем биологические объекты обладают свойствами как проводников, так и диэлектриков. Удельная электропроводность целых органов и тканей существенно меньше, чем составляющих их сред. Ее наибольшие величины (0,6-2,0 См • м-1) имеют жидкие среды организма (кровь, лимфа, желчь, моча, спинно-мозговая жидкость), а также мышечная ткань (0,2 См • м-1). Напротив, удельная электропроводность костной, жировой, нервной ткани, а в особенности грубоволокнистой соединительной ткани и зубной эмали чрезвычайно низкая (10-3-10-6 См • м-1).
Закон Ома для электролитов
J= g E
J- плотность тока в электролите
Е напряженность электрического поля.
g- электропроводность электролита
a — коэффициент диссоциации, отношение концентрации ионов к
концентрации молекул вещества.
q – заряд ионов
n0- концентрация молекул растворенного ввещества.
h- вязкость жидкости
r – радиус сольвата.
Электрический импеданс -это отношение комплексной амплитуды напряжения гармонического сигнала, прикладываемого к двухполюснику, к комплексной амплитуде тока, протекающего через двухполюсник. При этом импеданс не должен зависеть от времени: если время t в выражении для импеданса не сокращается, значит для данного двухполюсника понятие импеданса неприменимо.Понятие импеданса применимо, если при приложении к двухполюснику гармонического напряжения, ток, вызванный этим напряжением, также гармонический той же частоты. Электрический импеданс состоит из реактивной и активной составляющей: Z = R + Xc
Между зависимостями Z(f) и e(f) имеется связь, но это не идентичные процессы. Например, крутые и пологие участки Z(f) и e(f) обычно совпадают.
Принято считать, что дисперсия импеданса ) отражает более широкий круг электромагнитных процессов в биоткани и более выражено зависит от процессов жизнедеятельности (на этот счёт имеются обширные экспериментальные данные).По зависимости импеданса Z от частоты можно судить об уровне обмена веществ. Также имеется возможность оценить степень жизнеспособности органов и тканей.
Импеданс реальных элементов может быть измерен специальными приборами: измерителем RLC или анализатором импеданса. Эти приборы позволяют производить измерения в широком диапазоне частот и при различных напряжениях смещения.
Применение импеданса
Введение импеданса позволяет описывать поведение двухполюсника с реактивными свойствами при воздействии на него гармонического сигнала. Кроме того, в случае негармонического сигнала импеданс применяется столь же успешно. Для этого сигнал раскладывается на спектральные компоненты при помощи ряда Фурье или преобразования Фурье и рассматривается воздействие каждой спектральной компоненты. Вследствие линейности двухполюсника сумма откликов на спектральные компоненты равна отклику на исходный негармонический сигнал.
При гальванизацииткани орг-ма подвергаются воздействию пост. Электрического тока(до 50 мА) от внешнего источника напряжения. При этой физиотерапии основными механизмами,определяющими лечебный эффект,являются ионная поляризация,накопление ионов на клеточных мембранах и изменение функционального состояния тканей.Для проведения гальвинизации используется выпрямитель постоянного тока,напряжение с которого при помощи металлических электродов,пропускают через организм.Между электродами и тканями устанавливается матерчатая прокладка,смоченная электропроводящим раствором(обычно р-ром NaCl). Необходимость в такой прокладке объясняется тем,что электрическое сопротивление на границе между электродом и биологическим объектом достаточно велико и из-за этого в этом месте выделяется большое кол-во тепла и возможен ожог ткани.Во-вторых,при пропускании электрич. Токов через электролит в результате электрохим. Реакций могут образовываться токсические вещ-ва,которые вызывают химич. Раздражание кожи.Наряду с гальванизацией в последние годы достаточно широкое распространение получил лекарственный электрофорез.Теоретическую основу метода составляет теория электролитической диссоциации Аррениуса,согласно которой молекулы электролитов при растворении в большей или меньшей степени распадаются на положит. и отриц. ионы,способные направленно двигаться в поле пост.тока.В соответствии с ионной теорией лекарственные вещ-ва при электрофорезе вводятся в орг-м соответственно их полярности:катионы-с анода,анионы-с катода . Основными путями проникновения лекарств в ткани явл.выводные протоки потовых и сальных желез.
Действие переменного тока на организм существенно зависит от его частоты. При низких, звуковых и ультразвуковых частотах переменный ток, как и постоянный, оказывает раздражающее действие на биологические ткани. Это обусловлено смещением ионов растворов электролитов, их разделением, изменением их концентрации в разных частях клетки и межклеточного пространства.
Действие переменного тока используют в методе диатермии
При прохождении через ткани переменного тока ионы электролитов, входящих в состав тканей, приходят в колебательное движение. С увеличением частоты тока время движения ионов в одном направлении, следовательно, и их максимальное смещение уменьшаются. Соответственно уменьшается и раздражающее действие тока. При частоте колебаний порядка несколько сотен килогерц смещение становится соизмеримым со смещением в процессе теплового (молекулярного) движения, и переменный ток никакого раздражающего действия на ткани организма не оказывает.
Тепловое действие тока при диатермии определяется, в основном, ионными потерями, т.е. выделением тепла, происходящим при колебательном движении ионов. В связи с относительно низкой частотой, используемой при диатермии, диэлектрические потери в тканях невелики.
Под влиянием раздражения импульсным током волна возбуждения быстро распространяется по мышечным волокнам. Происходит пассивное сокращение мышцы.
При прохождении через ткани импульсных однонаправленных токов низкой частоты в тканях происходят те же физико-химические явления, что и при воздействии постоянным током. Однако процессы эти происходят дискретно в зависимости от частоты импульсов, а степень их выраженности и физиологический эффект зависят от частоты, формы, длительности импульсов, скважности и адекватности их функциональным возможностям тканей.
Основными параметрами импульсного тока являются: частота повторения импульсов, длительность импульса; форма импульсов, обусловленная крутизной переднего и заднего фронтов; амплитуда. В зависимости от этих характеристик они могут оказывать возбуждающее действие и использоваться для электростимуляции мышц или оказывать тормозящее действие, на чем основано их применение для электросна и электроаналгезии. Реобаза-минимальная сила раздражающего тока при большой длительности его действия.Хронаксия-минимальное время действия тока,равного2-м реобазам.
Электрическое поле-одна из составляющих эл-маг. поля,особый вид материи,существующий вокруг тел или частиц,обладающих эл.зарядом.
УВЧ-терапия-метод электролечения,основанный на воздействии на орг-м больного преимущественно ультравысокочастотного электромагнитного поля.Физическое действие УВЧ заключается в активном поглощении Е поля тканями и преобразовании ее в тепловую Е.Основное теплообразование происходит в тканях,плохо проводящих эл.ток. Интенсивность теплообразования зависит от мощности воздействия
Маг поле — составляющая электромагнитного поля, появляющаяся при наличии изменяющегося во времени электрического поля. Кроме того, магнитное поле может создаваться током заряженных частиц, либо магнитными моментами электронов в атомах.
Индуктотермия-метод электролечения,действующим фактором которого явл.высокочастотное переменное маг.поле.Действие Е этого поля вызывает появление наведенных вихревых токов,механич.Е которых переходит в тепло.Расширяются сосуды,ускоряется кровоток,снижается артериальное давление,улучшается коронарное кровообращение.Происходит также понижение тонуса мышц,что имеет знач.при спазме гладкой мускулатуры.Показаниями к назначению индуктотермии явл.хронич.воспалит.забол. внутр.органов,органов малого таза,ЛОР-органов,забол. и и травмы ОД-аппарата и т.д
Редуцированный глаз -условная оптическая система, обладающая теми же свойствами в смысле преломления лучей, как и настоящий глаз, но значительно более удобная для всякого рода расчетов. Как известно, всякая система сферических оптических поверхностей, через центры которых можно провести прямую, имеет шесть кардинальных точек: а) две главные точки, б) две узловые точки и в) две фокусные точки. Если поместить предмет в первой главной точке, то его изображение, равное по величине предмету, будет казаться находящимся во второй. Луч, проходящий через первую узловую точку, кажется после преломления выходящим из второй узловой точки. В человеческом глазу главные и узловые точки чрезвычайно близки одни к другим и потому возможно без особенной ошибки вместо всех преломляющих поверхностей глаза условно взять одну оптическую поверхность. Такой воображаемый условный глаз и носит название Р. г. Он имеет показатель преломленияь равный 1,33, радиус оптической поверхности—■ 5 мм, фокусное расстояние—15,5 мм и расстояние до «сетчатки—22,6 мм
Опти́ческая си́ла — величина, характеризующая преломляющую способность осесимметричных линз и центрированных оптических систем из таких линз. Измеряется оптическая сила в диоптриях
Обратно пропорциональна фокусному расстоянию системы.Оптическая сила положительна у собирающих систем и отрицательна в случае рассеивающих. Оптическая сила светопреломляющей системы глаза составляет 60 — 65 диоптрий. Около 70 % оптической силы дает преломление света на поверхности роговой оболочки, остальное приходится на долю хрусталика. С возрастом в результате потери влаги эластичность хрусталика уменьшается и он становится более плоским.
Оптическую силу системы дальнозоркого глаза нужно, наоборот, усилить, чтобы изображение попало на сетчатку.
АККОМОДАЦИЯ ГЛАЗА — изменение преломляющей силы глаза, обеспечивающее его способность ясно видеть предметы, находящиеся на различных расстояниях. Физиологический механизм АККОМОДАЦИИ ГЛАЗА состоит в том, что при сокращении волокон ресничной мышцы глаза происходит расслабление ресничного пояска, с помощью которого хрусталик прикреплен к ресничному телу . При этом уменьшается натяжение сумки хрусталика, и он благодаря своим эластическим свойствам становится более выпуклым. Расслабление ресничной мышцы ведет к утолщению хрусталика (рис.). Иннервация ресничной мышцы осуществляется глазодвигательным и симпатическим нервами.
АККОМОДАЦИЯ ГЛАЗА возможна в пределах, ограниченных ближайшей и дальнейшей (наиболее отдаленной) точками ясного зрения. Первая определяется наименьшим расстоянием, на котором можно читать мелкий шрифт; вторая — наибольшим расстоянием, на котором ясно различим предмет при отсутствии АККОМОДАЦИЯ ГЛАЗА. Увеличение преломляющей силы оптической системы глаза, достигаемое при максимальном напряжении АККОМОДАЦИИ ГЛАЗА, называют объемом, или силой АККОМОДАЦИИ ГЛАЗА. Объем АККОМОДАЦИЯ ГЛАЗА снижается с возрастом вследствие уменьшения эластичности хрусталика.
Механизм фоторецепции связан с распадом молекул родопсина и йодопсина при действии световой энергии. Это запускает цепь биохимических реакций, которые сопровождаются изменением проницаемости мембран в палочках и колбочках и возникновением потенциала действия. После распада зрительного пигмента следует его ресинтез, что происходит в темноте и при наличии витамина А. Недостаток в пище витамина А может приводить к нарушению сумеречного зрения (куриная слепота). Цветовая слепота (дальтонизм) объясняется генетически обусловленным отсутствием в сетчатке одного или нескольких типов колбочек.
Возбуждение нейросенсорной клетки передается посредством центрального отростка на 2-й биполярный нейрон. Тела биполярных нейронов лежат во внутреннем ядерном слое сетчатки. В этом слое, кроме биполярных нейронов, находятся ассоциативные нейроны еще двух типов: горизонтальные и амакринные. Биполярные нейроны соединяют палочковидные и колбочковидные зрительные клетки с нейронами ганглионарного слоя. При этом колбочковидные клетки контактируют с биполярными нейронами в соотношении 1:1, тогда как с одной биполярной клеткой образуют соединения несколько палочковидных клеток.
Горизонтальные нервные клетки имеют много дендритов, с помощью которых контактируют с центральными отростками фоторецепторных клеток. Аксон горизонтальных клеток также вступает в контакт с синаптическими структурами между рецепторной и биполярной клетками. Здесь возникают множественные синапсы своеобразного типа. Передача импульсов через такой синапс и далее с помощью горизонтальных клеток может вызывать эффект латерального торможения, что увеличивает контрастность изображения объекта. Сходную роль выполняют амакринные нейроны, расположенные на уровне внутреннего сетчатого слоя. У амакринных нейронов нет аксона, но есть разветвленные дендриты. Тело нейрона играет роль синаптической поверхности. Ганглионарные клетки образуют слой такого же названия. Это наиболее крупные нервные клетки сетчатки. Они составляют 3-й компонент нейронной цепи. Аксоны этих клеток дают слой нервных волокон, формирующих зрительный нерв.
Поддерживающие элементы в сетчатке представлены глиальными клетками (мюллеровыми волокнами) и астроцитами. Мюллеровы волокна — это крупные нейроглиальные клетки с отростками, которые располагаются вертикально по всей толщине сетчатки, оплетают нейроны сетчатки, выполняя поддерживающую и трофическую функции. Ядра клеток располагаются на уровне внутреннего ядерного слоя. Наружные отростки клеток заканчиваются многочисленными цитоплазматически-ми выростами (микроворсинками), которые формируют наружную пограничную мембрану, а внутренние — завершаются на границе со стекловидным телом (формируя внутренюю пограничную мембрану). В сетчатке есть желтое пятно с центральной ямкой. Это — место наилучшего видения. Здесь много колбочковых нейронов. Имеется также слепое пятно, которое соответствует месту выхода зрительного нерва.
Одна из основных функций глаза — острота зрения, или способность распознавания минимальных по размеру объектов на максимальном расстоянии.
Человеческий глаз способен работать при очень больших колебаниях яркости. Приспособление глаза к различным уровням яркости называется адаптацией.
Различают световую и темновую адаптации.
Световая адаптация — снижение чувствительности глаза к свету при большой яркости поля зрения. Механизм световой адаптации: работает колбочковый аппарат сетчатки, зрачок суживается, зрительный пигмент подымается с глазного дна.Темновая адаптация — повышение чувствительности глаза к свету при малой яркости поля зрения. Механизм темновой адаптации: работает палочковый аппарат, зрачок расширяется, зрительный пигмент опускается ниже сетчатой оболочки. При яркостях от 0,001 до 1 кд/кв.м происходит совместная работа палочек и колбочек. Это так называемое сумеречное зрение.
Спектральная чувствительность. Человеческий глаз лучше всего различает цвета в средней части спектра — от голубого до оранжевого. Здесь достаточно изменения длины волны на 1 — 2 нм для того, чтобы почувствовать изменение цвета. В области красного и фиолетового цветов разностный порог резко увеличивается, доходя до десятков и сотен нанометров.
Зависимость цветового тона от освещенности (яркости). При нормальной дневной освещенности рассеянным светом хорошо воспринимаются все цвета спектра. Если освещенность снижается (сумеречное состояние), то красный, зеленый и синий цвета сохраняют свой цветовой тон, а промежуточные между ними изменяются в направлении сближения с основными. Так, оранжевый становится краснее, желтый приближается к оранжевому, голубой и фиолетовый синеют; желто-зеленые и зелено-голубые теряют свои оттенки и приближаются к спектральному зеленому. Если яркость световых потоков снижается почти до состояния темноты — различаются только три основных цвета — красный, зеленый и синий. В сгущающихся сумерках последним исчезает синий цвет, превращаясь в белесый, а красный превращается в черный. Изменение цветов при уменьшении их яркости называют явлением Бецольда — Брюкке.
Трехкомпонентная теория цветового зрения:
Согласно этой теории, в нашем органе зрения существуют три цветоощущающих аппарата: красный, зеленый и синий. Каждый из них возбуждается в большей или меньшей степени, в зависимости от длины волны излучения (света). Затем возбуждения суммируются аналогично тому, как это происходит при слагательном смешении цветов. Сумма возбуждений ощущается нами как тот или иной цвет. Авторы этой теории — М. В. Ломоносов, Т. Юнг и Г. Гельмгольц. Трехкомпонентная теория хорошо объясняет важнейшие закономерности цветового зрения — адаптацию, индукцию, цветовую слепоту, спектральную чувствительность глаза, зависимость цвета от яркости и др. Однако, следует заметить, что в наше время известны факты, свидетельствующие о более сложной картине функционирования органа зрения.
Дальтонизм, или цветовая слепота – это состояние, при котором нарушено нормальное восприятие некоторых цветов. Связана данная патология с нарушением функции некоторых клеток сетчатки глаза, которые отвечают за восприятие цвета.Причина дальтонизма может быть наследственной природы или связана с заболеванием зрительного нерва либо сетчатки. Для приобретенного дальтонизма характерно то, что патология имеет место только в том глазу, где имеется поражение сетчатки или зрительного нерва. Кроме того, он характеризуется прогрессирующим ухудшением и затруднением в различении синего и желтого цветов.Наиболее часто при дальтонизме имеет место трудность в различении красного и зеленого цвета.При наследственном дальтонизме, который встречается чаще, патология отмечается в обоих глазах, при этом состояние со временем не прогрессирует, как при приобретенном. Наследственный дальтонизм в разной степени выраженности имеет место у 8% мужчин и 0,4% женщин. Отмечено, что наследственный дальтонизм сцеплен с X-хромосомой и практически всегда передается от матери-носителя патологического гена к сыну.Дальтонизм может быть как частичным, когда имеет место трудность в различении с отдельных цветов, так и полным, при котором затруднено различие всех цветов. Как правило, полный дальтонизм довольно редко и обычно в сочетании с другими серьезными врожденными дефектами глаза.Клетки, ответственные за восприятие цвета в сетчатке глаза – это колбочки. Эти клетки обычно сконцентрированы в самой центральной части сетчатки – макуле. Колбочки бывают трех типов: первый тип – в котом содержится пигмент, чувствительный к красному цвету, второй – с пигментом к зеленому цвету и третий – с пигментом к синему.Дальтонизм – нарушение восприятия цвета – появляются в том случае, когда имеет место отсутствие, либо недостаток какого-либо пигмента, либо когда он функционально нерабочий. Нормальное цветовое зрение называется трихромазией. В случае, когда одного цветового пигмента недостаточно для цветового зрения, говорят об аномальной трихромазии. При полном же отсутствии какого-либо пигмента имеет место дихромазия.
Устройство микроскопа
Оптическая система микроскопа состоит из основных элементов — объектива и окуляра. Они закреплены в подвижном тубусе, расположенном на металлическом основании, на котором имеется предметный столик.В современном микроскопе практически всегда есть осветительная система (в частности, конденсор с ирисовой диафрагмой), макро- и микро- винты для настройки резкости, система управления положением конденсора.В зависимости от назначения, в специализированных микроскопах могут быть использованы дополнительные устройства и системы.
Иммерсия в микроскопии — это введение между объективом микроскопа и рассматриваемым в нём предметом жидкости для усиления яркости и расширения пределов увеличения изображения.Увеличение микроскопа-это произведение увеличения объектива на увеличение окуляра.Предел разрешения-это наименьшее расстояние между 2-мя близко расположенными точками предмета,различимыми в микроскоп.Разрешающая способность-это способность микроскопа давать раздельные изображения мелких деталей рассматриваемого предмета.
Устройство,позволяющее получать поляризованный свет из естественного наз. поляризатором .При этом через поляризатор проходит поляризованный свет,интенсивность которого равна половине интенсивности падающего света.При вращении поляризатора относит.луча естественного света поворачивается плоскость колебаний вышедшего плоскополяризованного света,но интенсивность его не изменяется. Вращение плоскости поляризации заключается в повороте плоскости поляризации плоскополяризованного света при прохождении через вещ-во. Вещ-ва,обладающие таким св-вом наз.оптически активными. Метод сахариметрии широко используют в медецине для опред.конц.сахара в моче,в биофизич.исследованиях,а также в пищевой пром. Соответствующие измерит.прборы наз.сахариметрами.Сахариметр позволяет измерять не только конц.,но и удельное вращение.Вращение плоскости поляризации р-рами обусловлено взаимод.электромаг.волны с ассиметрич.молек.растворенного оптич.активного вещ-ва.
Закон Малюса — зависимость интенсивности линейно-поляризованного света после его прохождения через поляризатор от угла между плоскостями поляризации падающего света и поляризатора.
Свет с иной (не линейной) поляризацией может быть представлен в виде суммы двух линейно-поляризованных составляющих, к каждой из которых применим закон Малюса. По закону Малюса рассчитываются интенсивности проходящего света во всех поляризационных приборах, например в поляризационных фотометрах и спектрофотометрах. Потери на отражение, зависящие от и не учитываемые законом Малюса, определяются дополнительно
Давление света— давление, производимое светом на отражающие или поглощающие тела.
Фото́н — элементарная частица, квант электромагнитного излучения (в узком смысле — света). Это безмассовая частица, способная существовать только двигаясь со скоростью света. Электрический заряд фотона также равен нулю.
Если фотоны обладают импульсом, то свет, падающий на тело, должен оказывать на него давление. Согласно квантовой теории, давление света на поверхность обусловлено тем, что каждый фотон при соударении с поверхностью передает ей свой импульс.
Дифракция электронов на решетке кристалла никеля становится заметной лишь при таких скоростях движения электронов, при которых их дебройлевская длина волны становится сравнимой с постоянной решетки.При этом условии дифракционная картина, получаемая от электронного пучка, становится подобной картине дифракции пучка рентгеновских лучей с такой же длиной волны. На рисунке 4 представлены фотографии дифракционных картин, наблюдающихся при прохождении пучка света и пучка электронов у края экрана.Гипотеза де Бройля и атом Бора. Гипотеза о волновой природе электрона позволила дать принципиально новое объяснение стационарным состояниям в атомах. Для того чтобы понять это объяснение, выполним сначала расчет длины дебройлевской волны электрона, движущегося по первой разрешенной круговой орбите в атоме водорода. Это значит, что в атоме водорода, находящемся в первом стационарном состоянии, длина дебройлевской волны электрона в точности равна длине его круговой орбиты! Этот результат позволяет выразить постулат Бора о стационарных состояниях в такой форме: электрон вращается вокруг ядра неопределенно долго, не излучая энергии, если на его орбите укладывается целое число длин волн де Бройля
. В 1924 г. французский физик Луи де Б рой ль впервые высказал идею, согласно которой одновременное проявление корпускулярных и волновых свойств присуще не только свету, но и любому другому материальному объекту. Эта идея была лишь теоретической гипотезой, так как в то время наука не располагала экспериментальными фактами, которые бы подтверждали существование волновых свойств у элементарных частиц и атомов. В этом заключалось существенное отличие гипотезы де Бройля о волновых свойствах частиц от гипотезы Эйнштейна о существовании фотонов света, выдвинутой им после открытия явления фотоэффекта.
Гипотеза де Бройля существовании волн материи была детально разработана, и полученные из нее следствия могли быть подвергнуты экспериментальной проверке. Основное предположение де Бройля заключалось в том, что любой материальный объект обладает волновыми свойствами и длина волны связана с его импульсом таким же соотношением, каким связаны между собой длина световой волны и импульс фотона. Найдем выражение, связывающее импульс фотона р с длиной волны света . Импульс фотона определяется формулой: P=mc. Из уравнения Е=mс2=hv (2)можно определить массу фотона.Вычисленная таким образом из опытных данных длина волны совпала по значению с дебройлевской длиной волны.Интересны результаты другого опыта, в котором пучок электронов направлялся на монокристалл, но расположение приемника и кристалла не изменялось. При изменении ускоряющего напряжения, т. е. скорости электронов, зависимость силы тока через гальванометр от ускоряющего напряжения имела вид, представленный на рисунке 3. Электронный пучок испытывал наиболее эффективное отражение при скоростях частиц, удовлетворяющих — условию дифракционного максимума.Последующие эксперименты полностью подтвердили правильность гипотезы де Бройля и возможность использования уравнения для расчета длины волны, связанной с любым материальным объектом. Обнаружена дифракция не только элементарных частиц (электрон, протон, нейтрон), но и атомов.Выполнив расчеты длины дебройлевской волны для различных материальных объектов, можно понять, почему мы не замечаем в повседневной жизни волновых свойств окружающих нас тел. Их длины волн оказываются столь малыми, что проявление волновых свойств невозможно обнаружить. Так, для пули массой 10 г, движущейся со скоростью 660 м/с, длина дебройлевской волны равна
Фотометрия — раздел оптики, в котором исследуются энергетические характеристики света при его испускании, распространении и взаимодействии с телами. Оперирует фотометрическими величинами. Фотометри́ческая величина́ — аддитивная физическая величина, определяющая временно́е, пространственное, спектральное распределение энергии оптического излучения и св
Читайте также:
Рекомендуемые страницы:
Поиск по сайту
«Электрический ток в жидкости». 11-й класс
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
— раскрыть понятие физической природы электрического тока в жидкостях, опытное подтверждение электронной теории;
— продолжить формирование естественно-научных представлений по изучаемой теме;
— создать условия для формирования познавательного интереса, активности учащихся;
— формирование адаптивной системы обучения;
— формирование креативного мышления;
— формирование коммуникативного мышления.
Оборудование: интерактивный комплекс SMART Board Notebook, локальная сеть компьютеров, Интернет.
Метод ведения урока: комбинированный.
Эпиграф урока:
Жизнь ставит цели науке; наука освещает
путь жизни.
Н.К. Михайловский
План урока:
I. Оргмомент.
II. Работа в группах.
III. Обсуждение итогов, монтаж презентации.
IV. Рефлексия.
V. Домашнее задание (Г.Я. Мякишев “Электродинамика” 10-11 класс, 3.4-3.6).
Ход урока
— Добрый день! Садитесь.
Сегодня наша работа будет происходить по группам.
Задания группам:
- Природа электрического тока в растворах и расплавах электролитов
- Электролиты. Электролитическая диссоциация
- Опыт Фарадея по электролизу
- Закон Фарадея
- Вольт – амперная характеристика тока в жидкостях. ЭДС поляризации
- Применение электролиза
Содержание задания групп:
Электрический ток в электролитах. Законы Фарадея для электролиза
Электрический ток в электролитах обусловлен движением положительных и отрицательных ионов. В растворах солей, щелочей, кислот происходит распад молекул на ионы – электролитическая диссоциация. Из-за взаимодействия с полярными молекулами воды молекулы растворяемых веществ распадаются на разноименные заряженные “осколки” — ионы. Положительно заряженными оказываются ионы металлов и водорода, а отрицательно заряженными – кислотные остатки и гидроксильная группа (ОН).
Рассмотрим этот процесс на примере бромида калия KBr.
Взаимодействие атомов брома и калия в молекуле бромида калия упрощенно можно представить как взаимодействие двух ионов: положительного заряженного иона К+ и отрицательно заряженного Br—. Объясняется это тем, что единственный валентный электрон у калия слабо связан с атомом. При образовании молекулы KBr можно схематически изобразить в виде диполя. (рис 1). При растворении соли бромида калия в воде молекулы KBr попадают в окружение молекул воды, которые тоже являются диполями. В электрическом поле, создаваемой молекулой KBr, молекулы вды ориентируются, как показано на рисунке 2. при этом они растягивают молекулу KBr настолько, что незначительная встряска при столкновении с другими молекулами, участвующими в тепловом движении, разрушает ее. Часть молекул KBr распадаются – диссоциирует на ионы K+ и Br—.
Степень диссоциации, т.е. доля молекул растворенного вещества, которые распадаются на ионы, зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Наряду с процессом диссоциации в растворах электролитов происходит и обратный процесс. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать. При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь воссоединяются в нейтральные молекулы. При наступлении динамического равновесия концентрация ионов (при неизменной температуре).
Ионная проводимость растворов и расплавов электролитов
При отсутствии внешнего электрического поля ионы вместе с нераспавшимися молекулами находятся в хаотическом тепловом движении.
Если сосуд с раствором электролита включить в электрическую цепь, то между электродами образуется электрическое поле, и ионы в растворе придут в упорядоченное движение (рис.3). положительно заряженные ионы станут двигаться по направлению напряженности поля, т.е. к катоду, а отрицательно заряженные ионы – в противоположном направлении, т.е. к аноду.
Отрицательные ионы, пришедшие к аноду и называемые, поэтому анионами, отдают свои лишние электроны аноду, а посредством его и соединительных проводников – положительному полюсу источника, возмещая на нем недостаток электронов. Положительные ионы, пришедшие к катоду и потому называемые катионами, получают недостающие им электроны из избытка их на катоде. Так устанавливается во внешней цепи перемещение электронов от отрицательного полюса источника тока к положительному. При этом через раствор электролита заряд переносится вместе с частицами вещества – ионами. Такую проводимость называют ионной. В расплавах электролитов проводимость так же ионная, так как при плавлении твердых электролитов их молекулы распадаются на положительные и отрицательные ионы. Жидкие же металлы обладают электронной проводимостью.
Электролиз
При прохождении электрического тока через раствор электролита анионы отдают свои лишние электроны на аноде, а катионы на катоде получают недостающие электроны. Таким образом, на электродах при прохождении через раствор электрического тока происходит выделение веществ, входящих в состав электролитов.
Процесс выделения на электролитах вещества, связанный с окислительно-восстановительными реакциями, называют электролизом.
В ряде случаев нейтрализуемые на электродах ионы вступают в химические реакции с растворителем, растворенными веществами или с веществами электродов. Эти реакции называют вторичными.
Так, например, при электролизе раствора медного купороса (CuSO4) на катоде выделяется медь, а на аноде – кислотный остаток SO4., который вступает в реакцию с веществом анода – медью : Cu + SO4 = CuSO4
Благодаря этой реакции концентрация раствора медного купороса остается неизменной. Происходит лишь перенос меди с анода на катод, пока анод полностью не израсходуется.
В случае платинового анода при электролизе раствора медного купороса происходит реакция с растворителем: 2SO4 + 2Н2О —> 2Н2SO4 + О2.
Молекулы серной кислоты попадают в раствор, а молекулярный кислород выделяется в виде пузырьков.
Закон Ома
Для растворов электролитов справедлив закон Ома. При постоянной температуре графиком, выражающим зависимость силы тока от напряжения (вольт-амперная характеристика) для растворов электролитов, является прямая линия. Эта прямая не проходит через начало координат, а “сдвинута” вправо. Это объясняется тем, что при электролизе происходит поляризация электродов, погруженных в раствор электролита, причем ЭДС поляризации имеет знак, противоположный знаку напряжения на электродах.
Закон электролиза
Масса выделившегося вещества равна произведению массы одного иона на число ионов, осевших на электроде за время t:
m=m0i·Ni (1)- масса выделенного вещества, где m0i — масса иона, Ni - число ионов.
Масса иона равна m0i=M/NA (2)- масса иона, где M — молярная (атомная) масса, NA - постоянная Авогадро.
Число ионов, осевших на электроде, Ni=q/q0i (3)- число ионов, где q=I·t — заряд, протекающий через электролиз за t,
q0i=n·e (e — элементарный заряд).
При диссоциации молекул, состоящих из одновалентных атомов, возникают однозарядные ионы.
Подставляем в (1) формулу выражения (2) и (3), учитывая, что q=I·t, q0i=ne:
m=M/(n·e·NA)· I·t.
Закон Фарадея
М. Фарадей
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе: Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
m = kQ = kIt
Величину k называют электрохимическим эквивалентом. Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь m0 и q0 – масса и заряд одного иона – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0. Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA –постоянная Фарадея.
F = eNA = 96485 Кл / моль.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества. Закон Фарадея для электролиза приобретает вид:
Технические применения электролиза
Гальваностегия — покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т.д.) с целью предохранения от окисления и придания изделию привлекательного внешнего вида. Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет (рис. 3.8). Анодом служит пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними.
Гальванопластика — электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т.д.). С рельефного предмета делают восковый или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом служит медная пластинка. Когда на слепке нарастет достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Остается точная медная копия оригинала.
В полиграфической промышленности такие копии (стереотипы) получают с оттиска набора на пластичном материале (матрица), осаждая на матрицах толстый слой железа или другого материала. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор стирается), то использование стереотипов позволяет значительно увеличить тираж.
Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати и с большим числом иллюстраций.
Осаждая металл на длинный цилиндр, получают трубы без шва.
Процесс получения отслаиваемых покрытий был разработан русским ученым Б. С. Якоби, который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора (в Санкт-Петербурге).
Рафинирование меди
Медь является лучшим материалом для изготовления проводников, но для этого она должна быть лишена каких бы то ни было примесей. Очищение меди от примесей называется рафинированием (очисткой) меди. Массивные куски (толстые листы) неочищенной меди, полученной при выплавке из руды, являются анодом, а тонкие пластинки из чистой меди — катодом. Процесс происходит в больших ваннах с водным раствором медного купороса. При электролизе медь анода растворяется; примеси, содержащие ценные и редкие металлы, выпадают на дно в виде осадка (шлама), а на катоде оседает чистая медь. Таким же образом производят рафинирование некоторых других металлов.
Получение алюминия
При помощи электролиза получают алюминий. Для этого подвергают электролизу не растворы солей этого металла, а его расплавленные оксиды.
В угольные тигли (рис. 3.9) насыпают глинозем (оксид алюминия Аl2O3), полученный путем переработки бокситов — руд, содержащих алюминий. Тигель служит катодом. Анодом являются угольные стержни, вставленные в тигель. Сначала угольные стержни опускают до соединения с тиглем и пропускают сильный ток. Глинозем при прохождении тока нагревается и расплавляется. После этого угли поднимают, ток проходит через жидкость и производит электролиз. Расплавленный алюминий, выделяющийся при электролизе, опускается на дно тигля (катод), откуда его через особое отверстие выпускают в формы для отливки.
Описанный способ пол




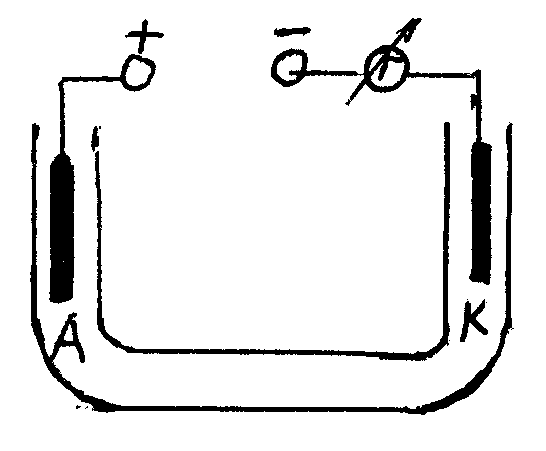
 ислоты:HClH++Cl–
ислоты:HClH++Cl– елочи:
NaOH Na+ + OH–
елочи:
NaOH Na+ + OH–