Горение водорода — Википедия
Эта статья описывает физико-химические процессы горения водорода; о ядерном горении водорода в звёздах см. Протон-протонный цикл.Водород считается одним из наиболее перспективных видов топлива и зарекомендовал себя как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств[1]. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее взрывоопасны смеси с составом близком к стехиометрическому, в стехиометрической смеси на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота и других не участвующих в горении газов по объёму составляет примерно 21 % : 79 % = 1:3,72, объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет ≈0,42[2]. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода в воздухе, от 4—9 объёмных процентов в бедных смесях и до 75 % в богатых смесях. Приблизительно в этих же пределах он способен и детонировать
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей[4]. С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
В 1766 г. Генри Кавендиш получил водород в реакции металла с кислотой:
- Fe+h3SO4⟶FeSO4+h3{\displaystyle {\ce {Fe + h3SO4 -> FeSO4 + h3}}}.
В лабораторных условиях гремучий газ можно получить электролизом воды в реакции:
- 2h3O⟶2h3+O2{\displaystyle {\ce {2h3O -> 2h3 + O2}}}.
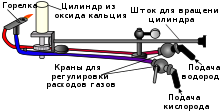
В XIX веке для освещения в театрах использовался так называемый друммондов свет, где свечение получалось с помощью пламени кислород-водородной смеси, направленного непосредственно на цилиндр из негашёной извести, которая может нагреваться до высоких температур (белого каления) без расплавления. В пламени кислород-водородной смеси достигается высокая температура, и также в XIX веке это нашло применение в паяльных лампах для плавления тугоплавких материалов, резки и сварки металлов. Однако все эти попытки применения гремучего газа были ограничены тем, что он очень опасен в обращении, и были найдены более безопасные варианты решения этих задач.
В настоящее время водород считается перспективным топливом для водородной энергетики. При горении водорода образуется чистая вода, поэтому этот процесс считается экологически чистым. Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Кинетическая схема горения водорода[править | править код]
Горение водорода формально выражается суммарной реакцией:
- 2h3+O2⟶2h3O{\displaystyle {\ce {2h3 + O2 -> 2h3O}}}.
Однако эта суммарная реакция не описывает разветвлённые цепные реакции, протекающие в смесях водорода с кислородом или воздухом. В реакциях участвуют восемь компонентов: H2, O2, H, O, OH, HO2
В силу того, что механизм горения водорода является одним из наиболее простых по сравнению с механизмами горения прочих газообразных топлив, таких, например, как синтез-газ или углеводородные топлива, а кинетические схемы горения углеводородных топлив включают в себя все компоненты и элементарные реакции из механизма горения водорода, он изучается чрезвычайно интенсивно многими группами исследователей
Критические явления при воспламенении[править | править код]
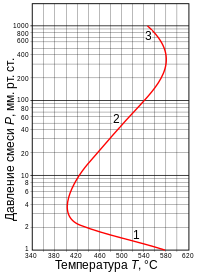 Полуостров самовоспламенения смеси H2 + O2. Цифрами 1, 2 и 3 помечены соответственно первый, второй и третий пределы воспламенения[8].
Полуостров самовоспламенения смеси H2 + O2. Цифрами 1, 2 и 3 помечены соответственно первый, второй и третий пределы воспламенения[8].При комнатной температуре стехиометрическая смесь водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Это явление нашло своё объяснение в теории цепных реакций, за которую Н. Н. Семёнов и Сирил Хиншелвуд были удостоены Нобелевской премии по химии 1956 года.
Кривая зависимости между критическими давлением и температурой, при которых происходит самовоспламенение смеси, имеет характерную Z-образную форму, как показано на рисунке. Нижняя, средняя и верхняя ветви этой кривой называются соответственно первым, вторым и третьим пределами воспламенения. Если рассматриваются только первые два предела, то кривая имеет форму полуострова, и традиционно этот рисунок называется полуостровом воспламенения.
В 1960-е года американский инженер Уильям Роудс (William Rhodes) якобы открыл «новую форму» воды, коммерциализированную Юллом Брауном (Yull Brown), болгарским физиком, эмигрировавшим в Австралию. «Брауновский газ», то есть фактически смесь кислорода и водорода, получаемая в аппарате электролиза воды, объявлялся способным очищать радиоактивные отходы, гореть как топливо, расслаблять мышцы и стимулировать проращивание семян[9]. Впоследствии итальянский физик Руджеро Сантилли (en:Ruggero Santilli) выдвинул гипотезу, утверждающую существование новой формы воды в виде «газа HHO», то есть химической структуры вида (H × H — O), где «×» представляет гипотетическую магнекулярную связь, а «—» — обычную ковалентную связь. Статья Сантилли, опубликованная в авторитетном реферируемом журнале International Journal of Hydrogen Energy
- ↑ Sánchez, Williams — review, 2014.
- ↑ Уравнение горения стехиометрической водородно-воздушной смеси: 0,21·2Н2 + 0,21О2 + 0,79(N2 + …) → 0,42H2O + 0,79(N2+…).
- ↑ Гельфанд и др., Водород: параметры горения и взрыва, 2008, с. 85,196.
- ↑ Корольченко, Пожаровзрывоопасность веществ, 2004, с. 311.
- ↑ Konnov A. A. Remaining uncertainties in the kinetic mechanism of hydrogen combustion // Combustion and Flame. — Elsevier, 2008. — Vol. 152, № 4. — P. 507–528. — DOI:10.1016/j.combustflame.2007.10.024.
- ↑ Shimizu K., Hibi A., Koshi M., Morii Y., Tsuboi N. Updated Kinetic Mechanism for High-Pressure Hydrogen Combustion // Journal of Propulsion and Power. — American Institute of Aeronautics and Astronautics, 2011. — Vol. 27, № 2. — P. 383–395. — DOI:10.2514/1.48553.
- ↑ Burke M. P., Chaos M., Ju Y., Dryer F. L., Klippenstein S. J. Comprehensive H2/O2 kinetic model for high-pressure combustion // International Journal of Chemical Kinetics. — Wiley Periodicals, 2012. — Vol. 44, № 7. — P. 444–474. — DOI:10.1002/kin.20603.
- ↑ Льюис, Эльбе, Горение, пламя и взрывы в газах, 1968, с. 35.
- ↑ Ball, Philip. Nuclear waste gets star attention (англ.) // Nature : journal. — 2006. — ISSN 1744-7933. — DOI:10.1038/news060731-13.
- ↑ Ruggero Maria Santilli. A new gaseous and combustible form of water (англ.) // International Journal of Hydrogen Energy : journal. — 2006. — Vol. 31, no. 9. — P. 1113—1128. — DOI:10.1016/j.ijhydene.2005.11.006.
- ↑ J. M. Calo. Comments on «A new gaseous and combustible form of water» by R.M. Santilli (Int. J. Hydrogen Energy 2006: 31(9), 1113–1128) (англ.) // International Journal of Hydrogen Energy : journal. — 2006. — 3 November (vol. 32, no. 9). — P. 1309—1312. — DOI:10.1016/j.ijhydene.2006.11.004.
- ↑ Martin O. Cloonan. A chemist’s view of J.M. Calo’s comments on: «A new gaseous and combustible form of water» by R.M. Santilli (Int. J. Hydrogen Energy 2006:31(9), 1113–1128) (англ.) // International Journal of Hydrogen Energy : journal. — 2008. — Vol. 33, no. 2. — P. 922—926. — DOI:10.1016/j.ijhydene.2007.11.009. Архивировано 20 марта 2012 года.
- ↑ J.V. Kadeisvili. Rebuttal of J.M. Calo’s comments on R.M. Santilli’s HHO paper (англ.) // International Journal of Hydrogen Energy : journal. — 2008. — Vol. 33, no. 2. — P. 918—921. — DOI:10.1016/j.ijhydene.2007.10.030. Архивировано 20 марта 2012 года.
- Льюис Б., Эльбе Г. Горение, пламя и взрывы в газах. 2-е изд. Пер. с англ. под ред. К. И. Щёлкина и А. А. Борисова. — М.: Мир, 1968. — 592 с.
- Гельфанд Б. Е., Попов О. Е., Чайванов Б. Б. Водород: параметры горения и взрыва. — М.: Физматлит, 2008. — 288 с. — 700 экз. — ISBN 9785922108980.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
Обзоры[править | править код]
описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Что такое водород?

Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.
Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 oC) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).
Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Химическая реакция горения

Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).
С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
- H + O2 => OH + O;
- OH + H2 => H2O + H;
- O + H2 = OH + H.
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 oC. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 oC.
Процентное содержание газов в горючей смеси

Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Безопасность горения

Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 oC для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 oC (для других концентраций она может достигать 2500 oC), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 oC). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 oC).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м3 этого газа весит всего 90 грамм. Если сжечь этот 1 м3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.

Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Секреты горения водорода — MEL Science Blog
24 марта 2015г. , Vassili Philippov
Все знают химическую формулу воды: H2O. Большинство сможет написать уравнение реакции получения воды: 2H2 + O2 = 2H2O. Но только единицы из миллиона смогут объяснить, как эта реакция реально идет. Встречайте видео, которое все объясняет.
Водородные пузыри
“Бросая в воду камешки, смотри на круги, ими образуемые; иначе такое бросание будет пустою забавою.” Козьма Прутков
Водородные пузыри классно горят! Я люблю поджигать с детьми их. Детей всегда очень удивляет тот факт, что при сгорании водорода образуется вода. Мы взрослые к этому факту привыкли. Он не кажется нам удивительным. Все знают:
2H2 + O2 = 2H2O
или иными словами
H2 + H2 + O2 = H2O + H2O
Но задумывались ли вы когда-нибудь, как это происходит? Думаете, как в реакции написано: сталкиваются в одном месте две молекулы водорода и одна молекула кислорода и получается две молекулы воды? Как бы не так. Вероятность, что три молекулы столкнутся в одном месте ничтожна. А если не так, то как? Скоро вы узнаете ответ на этот вопрос.
Простой водород, непростая реакция
Водород – это самый простой элемент. Всего один электрон вращается вокруг ядра, состоящего из всего одного протона. Что может быть проще? А вот поди ж ты, реакция горения водорода совсем не такая и простая. Спросите своего знакомого химика, как горит водород? Я ставлю десять к одному, что он не ответит, или ответит неправильно. До середины двадцатого века человечество не знало, как происходит эта реакция. В 1956 году за ее объяснение дали Нобелевскую премию по химии.
На самом деле, это не так уж и сложно. Скоро мы посмотрим под виртуальным микроскопом, что там происходит при горении водорода и все увидим своими глазами. Просто, раньше у ученых не было такого виртуального микроскопа, в который можно подсмотреть за механизмами реакций.
Очень большой бум
Сгорание небольшого пузыря с водородом не очень опасно. Спичка, которой вы будете поджигать пузырь выделит в десятки раз больше энергии, чем сгорающий водород.
Но история водорода знает другие ситуации. Пожалуй, самой трагичной историей был пожар на огромном дирижабле Гинденбург перевозившим 97 пассажиров и членов экипажа в 1937 году из Германии в США.
При посадке возникла искра, приведшая к взрыву водорода, которым был наполнен дирижабль. Эта трагедия унесла жизнь 36 человек и, по сути, поставила крест на всем дирижаблестроении. На самом деле, водород быстро прогорел в самом начале и подавляющая часть тепла выделилась от горения обшивки.
Давайте заглянем внутрь взрыва
Пришло время выполнить обещание, и показать, как же на самом деле горит водород. В этом коротком видео мы погрузимся внутрь взрыва смеси водорода и кислорода так, чтобы стали видны отдельные молекулы. И посмотрим, что же там происходит.
Подписывайтесь на наш Твиттер
Читайте также
Горение водорода — Карта знаний
- Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее опасны околостехиометрические смеси, где на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота по объёму составляет примерно 1:3,76, объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет 2:4,76 ≈ 0,4. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода, от 4 — 9 объёмных процентов в бедных смесях до 75% в богатых смесях, приблизительно в этих же пределах он способен и детонировать.
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей. С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
Источник: Википедия
Связанные понятия
Горе́ние — сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций, сопровождающийся интенсивным выделением тепла. Химическая энергия, запасённая в компонентах исходной смеси, может выделяться также в виде теплового излучения и света. Светящаяся зона называется фронтом пламени или просто пламенем. «Пентабора́н» — также называемый «нонагидри́д пентабо́ра», «стабильный пентабора́н» и «Пентабора́н(9)» для того, чтобы отличать его от соединения бора B5h21 — химическое соединение, которое рассматривалось военными 1950-х годов в США и СССР, в качестве перспективного ракетного/самолетного топлива, называемого также «экзотическим горючим». Молекула состоит из пяти атомов бора и девяти атомов водорода (B5H9) и является одним из бороводородов. В обычных условиях имеет вид бесцветной жидкости с едким… Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1. Обладая 1 а. е. м., водород является самым легким элементом в периодической таблице. Его одноатомная форма (H) — самое распространённое химическое вещество во Вселенной, составляющее примерно 75% всей барионной массы. Звезды, кроме компактных, в основном состоят из водородной плазмы. Самый распространенный изотоп водорода, называемый протием (название редко употребляется; обозначение… Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы. Пла́мя — раскаленная газообразная среда, образующаяся при горении и электроразрядах, состоящая в значительной степени из частично ионизированных частиц, в которой происходят химические взаимодействия и физико-химические превращения составных частиц среды (в т.ч. горючего, окислителя, примесных частиц, продуктов их взаимодействия). Сопровождается интенсивным излучением (в УФ, ИК, видимой части спектра — «свечением») и выделением тепла.Упоминания в литературе
• при горении водорода на воздухе развиваются температуры, достаточные для окисления азота. Поэтому кроме воды среди продуктов горения есть некоторое количество оксидов азота NхОу;Связанные понятия (продолжение)
Кислоро́д (O, лат. oxygenium) — химический элемент 16-й группы, второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы… Жи́дкий водоро́д (ЖВ, жh3, жh3, Lh3, Lh3) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C). Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % — параводород; 0,21 % — ортоводород. Коэффициент расширения… Жи́дкий кислоро́д (ЖК, жO2, LOX) — жидкость бледно-синего цвета, которая относится к сильным парамагнетикам. Является одним из четырёх агрегатных состояний кислорода. Жидкий кислород обладает плотностью 1,141 г/см³ и имеет умеренно криогенные свойства с точкой замерзания 50,5 K (−222,65 °C) и точкой кипения 90,188 K (−182,96 °C). Азо́т (N, лат. nitrogenium) — химический элемент 15-й группы, второго периода периодической системы с атомным номером 7. Относится к пниктогенам. Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха. Один из самых распространённых элементов на Земле. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака). Применяется… Твёрдое ракетное топливо — твёрдое вещество или смесь отдельных веществ, способная гореть без доступа воздуха, выделяя при этом большое количество газообразного рабочего тела, нагретого до высокой температуры. Используется в твердотопливных ракетных двигателях для создания реактивной тяги. К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы верхней строки (или периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) химических свойств элементов при увеличении атомного числа: новая строка начинается тогда, когда увеличивается количество энергетических уровней, что означает попадание элементов с аналогичными свойствами в тот же вертикальный столбец. Первый период содержит меньше всего…Подробнее: Первый период периодической системы
Ге́лий (He, лат. helium) — второй химический элемент периодической системы. Относится к 18-й группе, первому периоду системы и возглавляет группу инертных газов. Как простое вещество представляет собой инертный одноатомный газ без цвета, вкуса и запаха. Ацетилендинитрил — иначе субнитрид углерода, дицианоацетилен C4N2, представляет собой бесцветное вещество способное легко растворяться в углеводородах. Тяжёлая вода́ — обычно этот термин применяется для обозначения тяжёловодородной воды, известной также как оксид дейтерия. Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо двух атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия, а её кислород по изотопному составу соответствует кислороду воздуха. Формула тяжёловодородной воды обычно записывается как D2O или 2h3O. Внешне тяжёлая вода выглядит как обычная — бесцветная… Металли́ческий водоро́д — совокупность фазовых состояний водорода, находящегося при крайне высоком давлении и претерпевшего фазовый переход. Металлический водород представляет собой вырожденное состояние вещества и, по некоторым предположениям, может обладать некоторыми специфическими свойствами — высокотемпературной сверхпроводимостью и высокой удельной теплотой фазового перехода. Оксиликви́т — бризантное взрывчатое вещество, получаемое пропиткой жидким кислородом горючих пористых материалов (уголь, торф, мох, солома, древесина). Оксиликвит относят к взрывчатым веществам Шпренгеля. Взрывчатые свойства такой смеси были открыты в Германии в 1897 году профессором Карлом фон Линде, создателем установки по сжижению газов. К оксиликвитам могут быть отнесены и взрывчатые вещества на основе жидкого озона или его смеси с жидким кислородом, хотя практического применения такие смеси… Мети́л-трет-бути́ловый эфи́р (трет-бутилметиловый эфир, 2-метил-2-метоксипропан, МТБЭ) — химическое вещество с химической формулой СН3—O—C(СН3)3, один из важнейших представителей простых эфиров.Подробнее: Трет-Бутилметиловый эфир
Бо̀роводоро́ды (также бора́ны, гидри́ды бо́ра) — химические соединения бора с водородом. Отличаются высокой химической активностью и чрезвычайно большой теплотой сгорания. Представляют интерес как ракетное топливо. В органическом синтезе находит применение реакция присоединения борана и некоторых алкилборанов к двойной связи алкенов с вовлечением полученных соединений в дальнейшие превращения. Арго́н — элемент 18-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VIII группы) третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон — инертный одноатомный газ без цвета, вкуса и запаха. Шарлье́р (фр. charlière) — аэростат, наполненный водородом, гелием или другими газами легче воздуха. Назван по имени французского учёного и изобретателя Жака Александра Сезара Шарля. Аэростат объёмом 25 м³ совершил свой первый полёт 27 августа 1783 года при стечении 300 тыс. зрителей на Марсовом поле в Париже. Первый полёт «шарльёра» с экипажем (Шарль, Жак Александр Сезар и М. Н. Робер) состоялся 1 декабря 1783 года в Париже. Французский профессор физики Жак Шарль считал, что дымный воздух — это… Экономика метанола — гипотетическая энергетическая экономика будущего, при которой ископаемое топливо будет заменено метанолом. Эта экономика является альтернативой существующих моделей водорода и этанола (Биотопливо). В 2005 году лауреат нобелевской премии Джордж Олах (George Andrew Olah) опубликовал свою книгу Oil and Gas: The Methanol Economy», в которой обсудил шансы и возможности экономики метанола. В книге он предоставляет аргументы против водородной модели и обозначает возможность синтеза… Наноалмаз, ультрадисперсный алмаз — углеродная наноструктура. Имеет кристаллическую решётку типа алмаза: планаксиальный класс кубической сингонии, две гранецентрированных решётки Браве, сдвинутые друг относительно друга на 1/4 главной диагонали. Характерный размер одного нанокристалла 1÷10 нанометров. Наноалмазы, или ультрадисперсные алмазы, можно рассматривать как специфический наноуглеродный материал, входящий в семейство наноуглеродных кластеров вместе с фуллеренами, нанотрубками, нанографитом… Пиро́лиз (от др.-греч. πῦρ «огонь, жар» + λύσις «разложение, распад») — термическое разложение органических и многих неорганических соединений. Метанатор — используемое в газовом хроматографе оборудование, позволяющее детектировать низкие концентрации диоксида и монооксида углерода. Метанатор состоит из пламенно-ионизационного детектора и установленного перед ним каталитического реактора, заполненного мелкодисперсным никелем, где осуществляется гидрирование оксидов углерода в метан. Метан затем детектируется на ПИД. Плуто́ний (обозначается символом Pu; атомное число 94) — тяжёлый хрупкий радиоактивный металл серебристо-белого цвета. В периодической таблице располагается в семействе актиноидов. Каталитическая горелка или беспламенная горелка — разновидность горелки, в которой химические реакции окисления горючего протекают в присутствии катализатора. Такие горелки обычно используются в качестве нагревательных и/или осветительных приборов, а также в химической промышленности. Пар-жидкость-кристалл или ПЖК (в английской литературе — vapor-liquid-solid — VLS)) — механизм роста одномерных структур, таких как нановискеры в процессе химического осаждения из газовой фазы. Рост кристалла вследствие осаждения из газовой фазы обычно протекает очень медленно. Однако возможно введение на поверхность капель катализатора, способного адсорбировать вещество из газа до состояния пересыщенного расплава, из которого и будет происходить его кристаллизация на подложку. Таким образом, физические… Газофазный ядерный реактивный двигатель (ГЯРД) — концептуальный тип реактивного двигателя, в котором реактивная сила создаётся за счёт выброса теплоносителя (рабочего тела) из ядерного реактора, топливо в котором находится в газообразной форме или в виде плазмы. Считается, что подобные двигатели смогут достичь удельной тяги порядка 3000-5000 секунд (до 30-50 кН·с/кг, эффективные скорости истечения реактивной струи — до 30-50 км/с) и тяги, достаточной для относительно быстрых межпланетных полётов… Моноокси́д углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO. Работа в инертной атмосфере — общее название ряда приемов и методов, используемых в химических лабораториях для работы с веществами, чувствительными к действию воздуха. Работа в инертной атмосфере предотвращает деструкцию веществ компонентами воздуха, чаще всего водой и кислородом; реже — углекислым газом и азотом. Общими свойствами всех приёмов работы в инертной атмосфере являются удаление воздуха из реакционного пространства при помощи вакуума, а также использование инертных газов, таких как аргон… Промышленное производство водорода — неотъемлемая часть водородной энергетики, первое звено в жизненном цикле употребления водорода. Водород практически не встречается в природе в чистой форме и должен извлекаться из других соединений с помощью различных химических методов. Область воспламенения газа, пара или взвеси — интервал концентрации горючего вещества, равномерно распределённого в данной окислительной среде (обычно в воздухе), в пределах которого вещество способно воспламеняться от источника зажигания с последующим распространением самостоятельного горения по смеси. Сжиже́ние га́зов включает в себя несколько стадий, необходимых для перевода газа в жидкое состояние. Эти процессы используются для научных, промышленных и коммерческих целей. Углеро́д (C, лат. carboneum) — химический элемент, символизируемый буквой C и имеющий атомный номер 6. Элемент является четырехвалентным неметаллом, т. е. имеет четыре свободных электрона для формирования ковалентных химических связей. Он располагается в 14 группе периодической системы. Три изотопа данного элемента встречаются в окружающем нас мире. Изотопы 12C и 13C являются стабильными, в то время как 14C- радиоактивный (период полураспада данного изотопа составляет 5,730 лет). Углерод был известен… Гексанитробензол — бризантное взрывчатое вещество (из производимых BB конкурентом по силе является разве что CL-20). Бесцветное или желтовато-зеленое (в зависимости от степени очистки) кристаллическое вещество, почти нерастворимое в воде, растворимое в бензоле, толуоле. В кислородосодержащих растворителях, например ацетоне, спирте, эфире растворяется с разложением. Химически неустойчив. На воздухе в присутствии влаги или при действии водного раствора щёлочи превращается в тринитрофлорглюцин C6(OH)3(NO… Детона́ция (от фр. détoner — «взрываться» и лат. detonare — «греметь») — это режим горения, в котором по веществу распространяется ударная волна, инициирующая химические реакции горения, в свою очередь, поддерживающие движение ударной волны за счёт выделяющегося в экзотермических реакциях тепла. Комплекс, состоящий из ударной волны и зоны экзотермических химических реакций за ней, распространяется по веществу со сверхзвуковой скоростью и называется детонационной волной. Фронт детонационной волны… Процесс Клауса — процесс каталитической окислительной конверсии сероводорода. Источник сероводорода — природные и промышленные газы. Природными источниками являются месторождения нефти и газа, вулканическая деятельность, разложение биомассы и т.д. Промышленные источники — переработка нефти и газа (процессы гидроочистки и гидрокрекинга), металлургия и т.д. Озонатор — устройство для получения озона (O3). Озон является аллотропной модификацией кислорода, содержащей в молекуле три атома кислорода. В большинстве случаев исходным веществом для синтеза озона выступает молекулярный кислород (O2), а сам процесс описывается уравнением 3O2 → 2O3. Эта реакция является эндотермичной и легко обратимой. Поэтому на практике применяются меры, способствующие максимальному смещению её равновесия в сторону целевого продукта. Щелочной топливный элемент — (англ. alkaline fuel cell, AFC), наиболее изученная технология топливных элементов, эти элементы летали с человеком на Луну. Сверхкрити́ческий флюи́д (СКФ), сверхкрити́ческая жи́дкость — состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки, является сверхкритической жидкостью. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, низкой вязкостью и при отсутствии межфазных границ поверхностное натяжение также… Холодильный агент (хладагент) — рабочее вещество (может являться жидкостью, газом и даже быть в твердом агрегатном состоянии) холодильной машины, которое при кипении (испарении, плавлении или даже сублимации) отнимает теплоту от охлаждаемого объекта и затем после сжатия передаёт её охлаждающей среде за счёт конденсации или иному фазовому переходу (воде, воздуху и т. п.). Реа́ктор на расплавах солей (жидкосолевой реактор, ЖСР, MSR) — является одним из видов ядерных реакторов деления, в которых основой охлаждающей жидкости является смесь расплавленных солей, которая может работать при высоких температурах (термодинамическая эффективность реактора прямо пропорциональна рабочей температуре), оставаясь при этом при низком давлении. Это уменьшает механические напряжения и повышает безопасность и долговечность. Риформинг — это промышленный процесс переработки бензиновых и лигроиновых фракций нефти с целью получения высококачественных бензинов и ароматических углеводородов. Крипто́н — химический элемент с атомным номером 36. Принадлежит к 18-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VIII группы, или к группе VIIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 83,798(2) а. е. м.. Обозначается символом Kr (от лат. Krypton). Простое вещество криптон — инертный одноатомный газ без цвета, вкуса и запаха. Искусственные источники света — технические устройства различной конструкции и с различными способами преобразования энергии, основным назначением которых является получение светового излучения (как видимого, так и с различной длиной волны, например, инфракрасного). В источниках света используется в основном электроэнергия, но также иногда применяется химическая энергия и другие способы генерации света (например, триболюминесценция, радиолюминесценция и др.). Ударно-волновой синтез или детонационный синтез (англ. shock wave synthesis) — метод механического ударно-волнового воздействия, представляющий собой быстро протекающий процесс, который создает динамические условия для синтеза конечного продукта и его диспергирования до порошка с нанометровым размером частиц. Дейте́рий (лат. deuterium, от греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона. Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой h3O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов…Что взрывается сильнее – чистый водород, кислород или гремучий газ? (видеоэксперимент)
Взрыв водорода vs взрыва кислорода: какой газ выигрывает по силе взрыва?
В чем разница между взрывом водорода и взрывом кислорода, и есть ли она вообще? Давайте взглянем на последовательный поджиг трех шаров и посмотрим на разницу в мощности (при просмотре уменьшите звук):
Разница очевидна, не правда ли?
Кислород, принимая участие в процессе множества взрывов, приобрел репутацию «плохого парня». Некоторые люди даже думают, что кислород взрывоопасен. Как мы можем увидеть из представленного эксперимента, без кислорода хоть и не может произойти необходимый химический процесс для взрыва, сам по себе газ не несет в себе взрывоопасности. По сути, он не более чем дополнение, аксессуар для большого ба-бах!
Горение – суть удаление кислорода из области, окружающей горящий объект, и добавление его к тому материалу, который сжигается. Пожар не может начаться без кислорода. Но сам кислород совершенно безвреден в «химии» пожара. Когда джентльмен с горелкой на длинной ручке перемещается от одного шара к другому, он демонстрирует взрывную способность водорода, кислорода, а также смеси водорода и кислорода, так называемого «гремучего газа», если соблюдена пропорциональность.
Кислород с точки зрения взрыва является настоящим разочарованием (красный шарик). Без инициирующего вещества сам по себе газ под восьмым порядковым номером в таблице Менделеева не способен сделать ничего, кроме не очень громкого «БАХ!». Ну прям ничуть не больше, чем в том случае, если вы в шарик булавкой ткнете. Горения кислорода не происходит.
Поэтому, если поджечь спичку, кислород вокруг нее не воспламенится, он лишь будет поддерживать горение в непосредственном соприкосновении с горящим объектом.
Но первым «на воздух взлетает» шар, наполненный водородом. Происходит впечатляющий взрыв. На самом деле одна из причин, почему это так впечатляет, – это то, что мы можем это видеть. Требуется время, чтобы чистый водород смешался с кислородом в воздухе, и это время позволяет нам увидеть краткое, красивое распространение огня.
Когда взрывается воздушный шар, заполненный водородом и кислородом (тот самый «гремучий газ», включающий от 71 до 80 процентов водорода), взрыв происходит так быстро, что на мгновение кажется, что кто-то ускорил пленку, а звук-то какой от последнего взрыва мощный!
Это легко объяснимо, просто в этом миксе газов необходимые элементы уже смешаны и ждут своего часа: водород, воспламеняемый при помощи кислорода.
Этот гремучий газ стал одной из самых больших головных болей инженеров проектирующих водородные автомобили. При аварии и разгерметизации баллона с водородом, газ может смешаться в необходимой пропорции, и будет достаточно небольшой искры для очень мощного взрыва. В связи с этим на водородных автомобилях ставятся специальные ячейки для хранения опасного газа.
Кстати, водород и кислород, соединяясь, образуют всем известную Н2О. Этот эксперимент использует огонь, чтобы создать воду. Потрясающе!
Вода горит! А также ЭГЭ и волны-убийцы / Habr
Водяная спичка — устройство для поджигания воды и проведения интересных опытов с взрывами.Это конечно не термоядерный взрыв, но что водородный, это точно! Опыт безопасен, так как водород сгорает мгновенно, без накопления опасных объемов.
Предполагаю, что подобная буря в стакане, в масштабах планеты является источником возникновения интересных явлений — волн-убийц и цунами неизвестного происхождения, которые появляются буквально из ниоткуда, обрушиваются на судно и так же бесследно исчезают. На данный момент отсутствует внятное объяснение причин возникновения таких волн.
Возможно, все происходит так…
Анимация “Водяной”
При попадании молнии на поверхность Мирового океана, происходит водородный взрыв, а при удачном сочетании глубины воды и рельефа дна, направления удара и величины напряжения, продолжительности импульса и длительности его фронта — формируется огромная одиночная волна в результате импульсного электролиза поверхностного слоя воды, рассматриваемого в этой статье. Не последнюю роль в явлении играет резонанс.
В районе Бермудского треугольника эти условия выполняются наиболее часто, поэтому он получил свою печальную известность.
Примерно одна миллионная из 250 миллионов молний, ежегодно бьющих по поверхности Мирового океана, рождает супер-волну.
Белая волна — насыщенная газами вода, в которую попадают экипажи низколетящих летательных аппаратов, не является вымыслом и она присутствует в опытах. Вписывается в эту теорию и возникающий при ударе молнии электромагнитный импульс (ЭМИ), выводящий из строя навигационное оборудование.
В отличие от других экзотических способов поджигания воды, рассматриваемый вариант прост и имеет 100% повторяемость. Опыт показывает огромную скорость и производительность электролиза воды при коротком импульсном воздействии, а также позволяет безопасно исследовать электрогидравлический эффект и молнию в лабораторных условиях. Прибор можно использовать для изучения условий формирования блуждающих волн. В дальнейшем станет реальностью создание автоматических устройств, которые сгенерируют встречную волну для гашения разрушительных цунами и волн-убийц в охраняемых прибрежных зонах.
Предположение проверено и подтверждено на небольшом макете. GIF-анимация “Водяной” — формы волн: “одиночная башня”, “белая стена”, а также чудо-юдо с глазами и другие красивые элементы из воды, полученные при начальном для возникновения эффекта напряжении 145 вольт, показаны в тексте выше.
Любой желающий может повторить опыт и проверить предположение.
При нахождении электрода на поверхности жидкости, легко достигается эффект горения воды.
Анимация “Вода горит”
Огниво для воды.
Более года назад вышла статья “Импульсный электролиз на Google Science Fair”, где в опытах по поджиганию воды использовался батарейный вариант импульсного электролизера. С тех пор утекло много соленой воды и был создан новый вариант устройства под названием водяная спичка (ВС). Батарейный вариант из прошлой статьи будет ВС-1, сегодняшний сетевой — ВС-2.
Ключевыми особенностями устройств являются:
— тонкий электрод — чем тоньше, тем лучше;
— работа на поверхности жидкости или в глубине, при помощи изолированного по длине катода;
— импульсный режим работы;
— короткое время импульса и длительная пауза;
— крутой фронт импульса;
— вода с большой соленостью в качестве рабочей жидкости.
Водород выделяется из воды при импульсном воздействии на поверхностный слой с использованием тонкого катода (отрицательный электрод, если кто не знает, да и сам постоянно забываю) и мгновенно сгорает в присутствии кислорода. Процесс выделения/сгорания очень быстрый, поэтому имеет взрывообразный характер. К счастью жителей планеты, процесс является затухающим — сколько водорода выделяется за время импульса, столько и сгорает. Устройство использует соленую воду, так как пресная требует большие напряжения для создания аналогичных размеров водородного пламени.
Работа прибора основана на электрогидравлическом эффекте (ЭГЭ), открытом великим российским ученым Юткиным. Чтобы никому не было обидно, можно утверждать, что в других странах этот эффект действовал задолго до его открытия в виде обыкновенной молнии. Но даже обычная молния до сих пор изучена не полностью — эльфы, джеты, спрайты, а также космические лучи для запуска процесса подтверждают это.
В устройствах, работающих на эффекте ЭГЭ, требуется высокое напряжение, разрядники, а также другие большие и опасные штучки. Но соленая вода и современные комплектующие позволяют собрать прибор на базе ручки от старого паяльника, используя относительно низкое рабочее напряжение. Хотя не обошлось без микроконтроллера, схема доступна для повторения любым радиолюбителем.
В предыдущем эксперименте с поджиганием воды моя роль сводилась к созданию импульсного электролизера. Результаты опытов оказались интересными, но дочка вместо исследования ЭГЭ готовится к ЕГЭ — это новомодное увлечение все больше и больше поглощает умы и время подрастающей молодежи, а также деньги их родителей. Поэтому, экспериментальных данных в этом рассказе будет мало, желающие почитать подробности могут это сделать в предыдущей статье. Я свой интерес удовлетворил созданием более мощного устройства и коротким фильмом.
Теория ЭГЭ.
Юткин в своих опытах использовал напряжение всего лишь 20…50 кВ и более, а емкость до 1 мкФ. Теория была опубликована в работе “Электрогидравлический эффект и его применение в промышленности”, в формате djVu находится тут.
То, что творится при ударе молнии в воду с ее напряжением в миллионы и миллиарды вольт трудно себе представить, так как энергия, запасенная в конденсаторе, и выделяющаяся при его разряде пропорциональна квадрату напряжения и определяется по формуле: W=СU^2/2.
По сравнению с разрядниками Юткина и тем более молнией, ВС-2 является детской игрушкой, но она позволяет исследовать явление в безопасных режимах в стакане на столе. Вышеприведенную формулу для расчета энергии можно использовать лишь частично, так как ВС-2 управляет количеством энергии, поступающей на катод, и разряд конденсатора производится не полностью.
По теории ЭГЭ считается, что причиной роста давления жидкости является расширение паровоздушной смеси, образовавшейся в результате мгновенного вскипания жидкости в канале стримера из-за его огромной температуры.
Но по результатам предыдущих опытов с ВС-1 можно сделать вывод, что источником роста давления является огромная скорость электролиза, а следовательно — выделение водорода и его последующее горение с большой скоростью (взрыв) в присутствии растворенного в воде кислорода.
То есть, при разряде происходит практически мгновенное разложение молекул воды на атомы водорода — топливо и кислорода — окислитель, и последующий взрыв гремучей смеси в зоне катода (кислород растворен в воде и пополняется из зоны анода).
Скорее всего, наблюдаемое кипение жидкости происходит в результате кавитации, после произошедшего взрыва водорода.
Чем больше плотность тока (определяется напряжением и диаметром катода), и чем короче фронт импульса, тем большее число молекул воды участвует в процессе электролиза и тем больше водорода выделяется при каждом импульсе.
Можно сделать вывод, что в ЭГЭ первичным является высокоскоростной электролиз, который порождает все последующие эффекты.
Гром — звук от молнии, является результатом взрыва водорода при разложении молекул воды, находящихся в атмосфере. Но если в атмосфере вследствие низкой плотности и высокой сжимаемости воздуха слышен лишь взрыв, то в воде образуются волны.
Каждый взрыв индивидуален. Сложный характер движения жидкости иллюстрирует фотография с “чудом-юдом”, где видна траектория движения разгоряченного после взрыва конца электрода.
Исследование импульсного электролиза на границе воздух-жидкость, а также с использованием тонкого закрытого электрода, погруженного в жидкость, позволит изучить явление более подробно. Данные опыты являются началом экспериментов, которые желательно продолжить с использованием современных научных приборов, более совершенной измерительной и записывающей техникой. Желательно провести измерение уровня ЭМИ. В некоторых фрагментах видео (особенно при использовании быстродействующего транзистора) заметно “захлебывание” звукового тракта камеры, чем это вызвано — воздействием ЭМИ на микрофон или его перегрузкой из-за резкого звука, непонятно.
Создание ВС-2.
За основу электрической схемы ВС-2 был взят импульсный электролизер ВС-1 из предыдущей разработки.
Трансформатор, показанный на схеме, любой доступный и он находится вне платы ВС-2. Можно его не использовать, если производится питание от электрической сети. Но при этом существует риск поражения электрическим током.
В качестве задающего генератора использован микроконтроллер PIC12F675, который формирует необходимую длительность импульсов.
Излишки напряжения (предполагалась работа до 800 В) гасятся на балластном резисторе, который выполнен из сборки полуваттных резисторов. Экономичность генератора импульсов и большая скважность работы способствуют низкому уровню мощности, выделяемой на данном резисторе. Последовательное соединение и большое количество резисторов препятствуют их пробою на предельных напряжениях.
Данный вариант блока питания был выбран из-за простоты, надежности, а также в связи с тем, что предполагалась работа не от сети 220 В, где можно получить на накопительных конденсаторах лишь 311 В, а от разделительного повышающего трансформатора, позволяющего значительно поднять напряжение. Из того, что имелось в наличии собрана схема из трех трансформаторов и получено переменное напряжение 544 В, из которого после выпрямления и фильтрации получается 769 В постоянного напряжения. Это уже что-то, по сравнению с 145 В, использованных в ВС-1.
Из предыдущих опытов стало понятно, что одним из факторов, влияющих на производительность установки, является минимальная длительность фронта импульса, поэтому схемотехника устройства направлена на увеличение крутизны:
— короткая длина электродов и проводов, размещение силовых элементов в непосредственной близости от электродов для уменьшения индуктивности силовой части схемы;
— мощный драйвер MOSFET TC4452, управляющий силовым транзистором;
— новейший супер-пупер транзистор в качестве скоростного ключа: CREE Z-FET™ MOSFET на карбиде кремния (SiC) CMF10120D с параметрами Qg = 47 nC, максимальным напряжением 1200 В, сопротивлением RDS(on) = 160 mΩ и импульсным током 49 А.
При отладке на макете (работа на длинных проводах) все работало отлично. После установки на ручку паяльника и сокращении длины проводников до электродов, первый экземпляр ключа не выдержал работы на высоком напряжении 769 вольт и был заменен на его брата-близнеца. При его высокой стоимости это было шоком. Разработка силовой электроники, это затратная область деятельности.
Второй экземпляр также не смог долго продержаться. Скорее всего, происходит выброс напряжения при отключении импульса, и транзистор вылетает по превышению максимального напряжения, пополняя список жертв эксперимента. Результат контрольного измерения — пробой по всем выводам. В следующий раз, при наличии большого количества транзисторов, можно поискать область безопасной работы между 311 и 769 В.
При работе устройства пробой транзистора наблюдается так: длительность импульса уже не ограничена контроллером, и на электроде, при касании поверхности воды происходит выделение значительной энергии. Электрод не выдерживает и немного сгорает, разбрызгивая частички меди — работает предохранителем. Фрагмент виден в середине фильма “Вода горит!” (ниже по курсу).
Помимо сокращения длительности фронта, другой путь увеличения добычи водорода, а следовательно высоты пламени — увеличение напряжения на электродах. Предполагалась получение напряжения импульса до 800 В, поэтому пришлось использовать пару конденсаторов. Два последовательно соединенных конденсатора 47 мкФ х 450 В дают результирующую емкость 23,5 мкФ х 900 В.
Богатырские накопительные конденсаторы, используемые в схеме, как и Илья Муромец лежали очень долго, поэтому была проведена их формовка. Для этого, на протяжении двух суток последовательно соединенные конденсаторы находились под выпрямленным сетевым напряжением 220 В. В первые сутки напряжение на них менялось следующим образом:
С1 — 241, 235, 216, 203, 196, 190, 187, 184, 179, 175, 172, 165, 162, 155, 154 В.
С2 — 065, 072, 104, 120, 127, 134, 139, 141, 145, 148, 154, 160, 159, 153, 153 В.
Суммарное напряжение на конденсаторах зависит от величины сетевого напряжения в соответствии с формулой U=220х1,414=311 В. На вторые сутки разница напряжений не превышала 1 вольта, что является показателем окончания процесса формовки.
Ручка ВС-2 взята от паяльника ЭПСН 220 В, 40 Вт. В ней имеются углубления и упоры, которые позволяют надежно зафиксировать печатную плату с элементами.
При работе устройства происходит значительный разброс капель соленой воды, поэтому компоненты устройства расположены внутри защитной пластиковой бутылки.
Как было доказано в опытах с ВС-1, высота факела пламени зависит от толщины электрода. Электроды ВС-2 изготовлены из медной проволоки диаметром 1,7 мм. Анод должен значительно превышать по размеру катод.
Тонкий медный катод диаметром 0,07 мм (меньше найти не удалось) припаян к концу несущего электрода. При уменьшении диаметра необходимо подобрать параметры импульса (напряжение, длительность, пауза), чтобы электрод практически не разрушался при коротком импульсном воздействии.
Как следует из экспериментов с ВС-1, при взрыве водорода образуется воронка и происходит колебание поверхности жидкости. При последующих импульсах волны набегают на электрод, и поверхностный взрыв превращается в подводный — происходит “захлебывание” электрода, и уменьшение высоты пламени водорода. Удержать электрод точно на поверхности в условиях сильного шторма при помощи одной руки (вторая управляет процессом фотосъемки) становится затруднительно. Чтобы облегчить задачу, в программе ВС-2 длительность импульса уменьшена вдвое — до 100 мксек, а продолжительность паузы между импульсами увеличена втрое — до 300 мсек по сравнению с программой работы ВС-1.
Программа работы ВС-2.
start:
HIGH GPIO.2 ‘ включение ключа
PAUSEUS 100 ‘ длительность импульса 100 мксек
LOW GPIO.2 ‘ отключение ключа
PAUSE 300 ‘ продолжительность паузы 300 мсек
GOTO start
Если разрешить включение подтягивающих резисторов и установить миниатюрный выключатель между выводами контроллера 7 и 8, то можно сделать две частоты выходных импульсов:
@ DEVICE INTRC_OSC_NOCLKOUT, MCLR_OFF, WDT_ON, CPD_OFF, PWRT_ON, PROTECT_ON, BOD_ON ‘ BANDGAP0_ON
‘ генератор внутренний, 4МГц, GP4 и GP5 фунцционируют как порты ввода-вывода
‘ MCLR внутренне подключен к питанию, GP3 работает как канал порта ввода
‘ сторожевой таймер WDT включен
‘ CPD защита памяти данных EEPROM отключена
‘ PROTECT защита памяти программ включена
‘ ON=enabled — включен=разрешено, OFF=disabled — отключен=запрещено
INCLUDE «modedefs.bas»
DEFINE NO_CLRWDT 1 ‘ не вставлять CLRWDT
DEFINE OSC 4
‘ Настройка контроллера
OPTION_REG = %01111111 ‘ разрешим включение подтягивающие резисторы, предделитель подключаем к WDT,
‘ коэффициент деления для WDT=1:128 (при F=4 МГц время отключения около 2,8 сек)
ANSEL = 0 ‘ цифровой режим работы аналоговых входов
CMCON = %00000111 ‘ отключение компаратора
‘ Текст программы
start: ‘
CLEARWDT
HIGH GPIO.2
PAUSEUS 100 ‘ 100 мксек
LOW GPIO.2
IF GPIO.0 = 0 THEN
PAUSE 100 ‘ 100 мсек
ELSE
PAUSE 300 ‘ 300 мсек
ENDIF
GOTO start
END
Фото и видео
Брызги воды разлетаются от электрода на расстояние более метра, поэтому съемку пришлось проводить на большом удалении.
Необходимо использовать защитное стекло на объектив и желательно прикрыть фотоаппарат, так как соленая вода для электроники, это не очень хорошо.
В идеале желательно использовать высокоскоростную камеру, но за неимением таковой, съемка велась на зеркалку Nikon D7000 с объективом 18-105 мм.
Фотографирование лучше проводить в ручном режиме, так как при маленьком времени импульса автоматика не справляется.
Перед съемкой как можно точнее сфокусировать закрепленный на штативе аппарат на место предполагаемых взрывов с помощью дополнительного высококонтрастного объекта, так как поймать фокусировку по воде трудно. По пробным съемкам выставить время выдержки.
Теперь можно рассчитать вероятность получения удачного снимка:
— время импульса — 100 мксек;
— пауза между импульсами — 0,3 сек;
— скорострельность аппарата в непрерывном высокоскоростном режиме — 6 кадров в секунду;
— выдержка, выставленная для снимка — 1/100 сек.
То есть вероятность крайне низкая.
Скорость выделения водорода огромная, поэтому получить четкое изображение факела пламени с такой выдержкой нереально. Уменьшая выдержку для получения красивого снимка столба пламени, мы делаем еще меньшую вероятность попадания вспышки в кадр. Как вариант, можно попробовать приспособления для автоматической синхронизации, но эти устройства отсутствуют.
Все вспышки, пойманные за время съемки, а также другие фотографии, относящиеся к этому проекту, можно посмотреть в альбоме. При анализе снимков видно, что каждый удар индивидуален, хотя электрод расположен почти одинаково. Поэтому формирование высокой волны на море, при ударе молнии, имеет даже меньшую вероятность, чем получение удачного снимка.
С видео все проще, но рассмотреть место взрыва подробно становится затруднительным.
Видео “Вода горит!” Показаны три фрагмента работы.
1. Скоростной транзистор CMF10120D при работе с напряжением 311 В.
2. CMF10120D в момент, когда он пробит при работе с напряжением 769 В.
3. Устаревший транзистор 2SK1358 при работе с напряжением 311 В.
Гифка “водяной” вначале статьи, была сделана из старых кадров с участием ВС-1. Для модели ВС-2 закрытый электрод не изготавливался, так как будет очень большой разброс капель.
Эффективность процесса.
Одним из самых интересных вопросов — КПД при получении водорода, хотя он сразу и сгорает.
К полезной части, для оценки КПД, относятся электромагнитный импульс излучений в различных диапазонах спектра, колебание поверхности жидкости, выброс капель, звуковая волна — но это трудно оценить в виде цифр. Наиболее простым способом определения выработки является визуальная оценка объема водорода по кадрам видеосъемки или фотографиям области пламени.
Для четкого определения границ необходимо поснимать взрывы заранее известного объема водорода, а затем анализировать вспышки при проведении импульсного электролиза поверхностного слоя. Хотя опытные химики и взрывники наверняка и без предварительных взрывов смогут определить границы водорода, участвующего в процессе.
Так как разряд заряженного конденсатора при импульсе происходит не полностью, то формулу по расчету его энергии использовать некорректно.
Затраты энергии считаются по анализу осциллограммы на небольшом резисторе, включенном в цепь электрода или на токоограничительном резисторе блока питания.
При предварительных испытаниях устройства, когда супер-транзистор недолго работал при высоком напряжении, высота пламени водорода достигала трех сантиметров, но на видео это не успело попасть, и объем остался неизвестен. После выхода из строя двух современных ключей, за неимением лучшего, был установлен транзистор 2SK1358, который не отличается выдающимися параметрами, что заметно даже по характеру звука в фильме “Вода горит”. Поэтому для установки ВС-2 объем водорода не определялся, а дальнейшая работа производилась на “пониженном” напряжении 311 В. В предыдущих опытах с ВС-1 выработка определялась по размеру пламени, потребление — по падению напряжения на резисторе в цепи электрода.
Характер взрыва водорода в смеси с кислородом и чистого можно посмотреть в фильме, найденном на youtube.
Продолжение работ.
Работа по импульсному электролизу перспективна и интересна людям, у некоторых имеется желание повторить и продолжить опыты. Был замечен интерес к ней со стороны людей, уже занимающихся подобными исследованиями, что очень похвально. Результатов пока не видно, но это дело времени.
В Интернете выложено большое число видео с процессом электролиза. Как правило, электролиз проводят при неотключаемом напряжении — постоянном или переменном. При этом остро встает проблема сохранности электрода, который изготавливают из материалов, устойчивых к высокой температуре.
В случае же импульсного воздействия, как правило, производится полный разряд накопившего энергию конденсатора на водную среду, высоковольтный ключ/разрядник производит лишь включение цепи.
Фишкой установок ВС-1 и 2 является то, что можно ограничить длительность импульса до минимально возможной. При этом, благодаря маленькому диаметру электрода, плотность тока в импульсе достигает огромных величин, но короткое время воздействия не позволяет разрушить даже тонкую медную проволоку. При достаточно высокой частоте следования импульсов можно добиться визуального эффекта непрерывного горения водорода на поверхности воды.
По результатам эксперимента можно сделать вывод, что для начальных опытов достаточно выпрямленного сетевого напряжения, желательно — гальванически развязанного от сети при помощи трансформатора. Потребление энергии устройством небольшое, так как ВС-2 работает в импульсном режиме с большой скважностью.
Схему можно упростить, что уменьшит размеры устройства. Накопительный конденсатор достаточно использовать один, емкостью 10…47 мкФ на напряжение 450 В. Составной балластный резистор можно изготовить из трех-четырех последовательно соединенных резисторов.
При доработке устройства можно ввести регулировку длительности импульса, паузы, напряжения на накопительном конденсаторе, предусмотреть режим одиночных импульсов.
Изучайте, исследуйте, это действительно интересно, и выкладывайте свои результаты.
Интересный фильм “Повелители молний” был снят автором Антоном Войцеховским в рублике «ЕХперименты». В фильме, в частности, упоминается испытательный полигон ВНИЦ ВЭИ, расположенный в городе Истра. На базе этого научного заведения можно начать исследования условий возникновения волн-убийц при попадании молнии в морскую воду. Продолжить опыты можно уже на море, создав там мощную установку для получения молниеносного напряжения.
Ссылки.
1. Альбом с фотографиями.
2. ВС-2. Электрическая схема.
3. ВС-2. Печатная плата.
4. ВС-2. Программа работы.
5. ВС-2. Повышающий трансформатор, оказался практически невостребованным.
Количество молний.
Общее количество молний 1,4 миллиарда в год.
350 миллионов — 25 % молний ударяет в земной шар.
Приблизительно 250 миллионов (точнее 248,5 миллионов) — 71 % молний приходится на поверхность Мирового океана.
Количество волн-убийц.
Спутники зафиксировали за три недели по всему земному шару более 10 одиночных гигантских волн, высота которых превышала 25 метров.
За год количество волн составит 173 штуки.
Итого: На 250 миллионов молний приходится 173 больших волны. Грубо можно сказать, что примерно каждая миллионная молния рождает огромную волну.
P.S.
Выступление на конференции «ХТЯиШМ–20» с обобщением результата работ.
Как оказалось «Молнии играют роль в образовании горного ландшафта».
А отсекать глыбы вполне может и ЭГЭ, что демонстрировал Юткин, в результате попадания молнии в воду, содержащуюся в каналах или пустотах горного массива.
Горение водорода — Википедия. Что такое Горение водорода
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств[1]. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее опасны околостехиометрические смеси, где на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота по объёму составляет примерно 1:3,76, объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет 2:4,76 ≈ 0,4. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода, от 4 — 9 объёмных процентов в бедных смесях до 75% в богатых смесях, приблизительно в этих же пределах он способен и детонировать[2].
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей[3]. С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
Получение

В 1766 г. водород получил Генри Кавендиш в реакции металла с кислотой: Fe + H2SO4 → FeSO4 + H2 (газ). В лабораторных условиях гремучий газ можно получить электролизом воды в реакции H2O → H2 + 0,5 O2.
Применение
В XIX веке для освещения в театрах использовался так называемый друммондов свет, где свечение получалось с помощью пламени кислород-водородной смеси, направленного непосредственно на цилиндр из негашёной извести, которая может нагреваться до высоких температур (белого каления) без расплавления. В пламени кислород-водородной смеси достигается высокая температура, и также в XIX веке это нашло применение в паяльных лампах для плавления тугоплавких материалов, резки и сварки металлов. Однако все эти попытки применения гремучего газа были ограничены тем, что он очень опасен в обращении, и были найдены более безопасные варианты решения этих задач.
В настоящее время водород считается перспективным топливом для водородной энергетики. При горении водорода образуется чистая вода, поэтому этот процесс считается экологически чистым. Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Кинетическая схема горения водорода
Горение водорода формально выражается глобальной реакцией H2 + 0,5 O2 → H2O. Однако эта глобальная реакция не позволяет описать разветвлённые цепные реакции, протекающие в смесях водорода с кислородом или воздухом. В реакциях участвуют восемь компонентов: H2, O2, H, O, OH, HO2, H2O, H2O2. Подробная кинетическая схема химических реакций между этими молекулами и атомами включает более 20 элементарных реакций с участием свободных радикалов в реагирующей смеси. При наличии в системе соединений азота или углерода число компонентов и элементарных реакций существенно увеличивается.
В силу того, что механизм горения водорода является одним из наиболее простых по сравнению с прочими газообразными топливами, такими как синтез-газ или углеводородные топлива, а кинетические схемы горения углеводородных топлив включают в себя все компоненты и элементарные реакции из механизма горения водорода, он изучается чрезвычайно интенсивно многими группами исследователей[4][5][6]. Однако, несмотря на более чем столетнюю историю исследований, этот механизм до сих пор изучен не полностью.
Критические явления при воспламенении
 Полуостров самовоспламенения смеси H2 + O2. Цифрами 1, 2 и 3 помечены соответственно первый, второй и третий пределы воспламенения[7].
Полуостров самовоспламенения смеси H2 + O2. Цифрами 1, 2 и 3 помечены соответственно первый, второй и третий пределы воспламенения[7].При комнатной температуре стехиометрическая смесь водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Это явление нашло своё объяснение в теории цепных реакций, за которую Н. Н. Семёнов и Сирил Хиншелвуд были удостоены Нобелевской премии по химии 1956 года.
Кривая зависимости между критическими давлением и температурой, при которых происходит самовоспламенение смеси, имеет характерную Z-образную форму, как показано на рисунке. Нижняя, средняя и верхняя ветви этой кривой называются соответственно первым, вторым и третьим пределами воспламенения. Если рассматриваются только первые два предела, то кривая имеет форму полуострова, и традиционно этот рисунок называется полуостровом воспламенения.
Спорные теории
В 1960-е года американский инженер Уильям Роудс (William Rhodes) якобы открыл «новую форму» воды, коммерциализированную Юллом Брауном (Yull Brown), болгарским физиком, эмигрировавшим в Австралию. «Брауновский газ», то есть фактически смесь кислорода и водорода, получаемая в аппарате электролиза воды, объявлялся способным очищать радиоактивные отходы, гореть как топливо, расслаблять мышцы и стимулировать проращивание семян[8]. Впоследствии итальянский физик Руджеро Сантилли (en:Ruggero Santilli) выдвинул гипотезу, утверждающую существование новой формы воды в виде «газа HHO», то есть химической структуры вида (H × H — O), где «×» представляет гипотетическую магнекулярную связь, а «—» — обычную ковалентную связь. Статья Сантилли, опубликованная в авторитетном реферируемом журнале International Journal of Hydrogen Energy[9], вызвала жёсткую критику со стороны коллег, назвавших утверждения Сантилли псевдонаучными[10], однако некоторые другие учёные выступили в поддержку Сантилли[11][12].
Примечания
- ↑ Sánchez, Williams — review, 2014.
- ↑ Гельфанд и др., Водород: параметры горения и взрыва, 2008, с. 85,196.
- ↑ Корольченко, Пожаровзрывоопасность веществ, 2004, с. 311.
- ↑ Konnov A. A. Remaining uncertainties in the kinetic mechanism of hydrogen combustion // Combustion and Flame. — Elsevier, 2008. — Vol. 152, № 4. — P. 507–528. — DOI:10.1016/j.combustflame.2007.10.024.
- ↑ Shimizu K., Hibi A., Koshi M., Morii Y., Tsuboi N. Updated Kinetic Mechanism for High-Pressure Hydrogen Combustion // Journal of Propulsion and Power. — American Institute of Aeronautics and Astronautics, 2011. — Vol. 27, № 2. — P. 383–395. — DOI:10.2514/1.48553.
- ↑ Burke M. P., Chaos M., Ju Y., Dryer F. L., Klippenstein S. J. Comprehensive H2/O2 kinetic model for high-pressure combustion // International Journal of Chemical Kinetics. — Wiley Periodicals, 2012. — Vol. 44, № 7. — P. 444–474. — DOI:10.1002/kin.20603.
- ↑ Льюис, Эльбе, Горение, пламя и взрывы в газах, 1968, с. 35.
- ↑ Ball, Philip (2006). «Nuclear waste gets star attention». news@nature. DOI:10.1038/news060731-13. ISSN 1744-7933.
- ↑ Ruggero Maria Santilli (2006). «A new gaseous and combustible form of water». International Journal of Hydrogen Energy 31 (9): 1113–1128. DOI:10.1016/j.ijhydene.2005.11.006.
- ↑ J. M. Calo (November 3, 2006). «Comments on «A new gaseous and combustible form of water» by R.M. Santilli (Int. J. Hydrogen Energy 2006: 31(9), 1113–1128)». International Journal of Hydrogen Energy 32 (9): 1309–1312. DOI:10.1016/j.ijhydene.2006.11.004.
- ↑ Martin O. Cloonan (2008). «A chemist’s view of J.M. Calo’s comments on: «A new gaseous and combustible form of water» by R.M. Santilli (Int. J. Hydrogen Energy 2006:31(9), 1113–1128)». International Journal of Hydrogen Energy 33 (2): 922–926. DOI:10.1016/j.ijhydene.2007.11.009.
- ↑ J.V. Kadeisvili (2008). «Rebuttal of J.M. Calo’s comments on R.M. Santilli’s HHO paper». International Journal of Hydrogen Energy 33 (2): 918–921. DOI:10.1016/j.ijhydene.2007.10.030.
Литература
- Льюис Б., Эльбе Г. Горение, пламя и взрывы в газах. 2-е изд. Пер. с англ. под ред. К. И. Щёлкина и А. А. Борисова. — М.: Мир, 1968. — 592 с.
- Гельфанд Б. Е., Попов О. Е., Чайванов Б. Б. Водород: параметры горения и взрыва. — М.: Физматлит, 2008. — 288 с. — 700 экз. — ISBN 9785922108980.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.



