Электролизёр | Oxygen Not Included Вики
Электролизер
Вода заходит с одной стороны, жизненно важный кислород выходит с другой. Преобразует воду в кислород и водород.Прекращает работу, если достигнуто предельное атмосферное давление.
АвтоматизацияЛогический порт
Приёмник сигнала
Потребление
Вода -1000 г/сЭнергия -120 Вт
Вход жидкостной трубы
Выход
Кислород +888 г/сВодород +112 г/с
Тепло
+1.25 кДТЕДубликантская Тепловая Единица. 1 ДТЕ = 1055.06 Дж
Внутреннее хранилище
Вода 2 кг
Электролизёр (Electrolyzer) — механизм, который даёт ясно понять, что для получения кислорода не обязательны водоросли. Как и электролизёр в реальной жизни, при помощи электрического тока расщепляет молекулы воды на молекулы кислорода и водорода с минимальной температурой 70°C. Способен быстро заполнить комнату газом (как кислородом, так и водородом, так что будьте внимательны).
Является самым эффективным источником выработки кислорода. Как и диффузор кислорода, прекращает работу, если в комнате установилось максимальное давление (1800 г на клетку).
Также подробнее об применении электролизёра можно изучить в статье «электролизёрная».
Применение
Для работы требуется подведённая жидкостная труба с чистой водой и энергия. Электролизер желательно ставить в отдельной комнате, так как кислород и водород выходят прямо в окружающую среду, и имеют высокую температуру. Для отделения водорода и кислорода можно использовать газовый насос и фильтр. Образующийся в процессе работы водород можно использовать для водородного генератора или запитать им анти энтропийный термо-обнулитель. На один электролизёр в среднем требуется 1 насос и 0.5-1 фильтра (в случае использования только одного электролизёра требуется только один фильтр). Экономичнее ставить на два насоса один фильтр — выходы труб насосов объединить в одну трубу к одному фильтру, тогда электролизёр будет большую часть времени работать на полную мощность. В дальнейшем, когда в колонии будет примерно 16 дубликантов или больше, потребуется ставить на 1 или на 2 постройки (электролизёр, насос, фильтр) больше.
Насос будет откачивать водород в водородный генератор или анти энтропийный термо-обнулитель, а все остальные газы (поначалу может откачать немного других газов, помимо кислорода, но после полного их откачивания уже будет качать только кислород) отправлять на базу.
Так как электролизёр выдаёт водород и кислород с минимальной температурой в +70°C, то будет эффективней охлаждать не саму комнату (так как она всегда будет стремиться к температуре >+70°C и чтобы не тратить лишнее время/энергию), а выходящий кислород в соседней комнате. При этом комнату с электролизёрами полностью изолировать теплоизоляционными плитками (чтобы не нагревать окружающее пространство), а водород сжигать (тем самым избавляясь от высокой температуры) или запасать в окружённых теплоизоляционными плитками помещениях (для дальнейшего использования). Чтобы электролизёры и остальные элементы в изолированной комнате не перегревались, рекомендуется построить их из амальгамы золота, чтобы не рисковать парой градусов так как перегрев насосов и электролизёра начинается с +75°C.
Стоит отметить, что при температуре воды менее 70°C, электролизёр все равно на выходе образует газы с температурой 70°C. Это можно использовать в холодных типах миров для быстрого нагрева атмосферы.
При температуре воды выше 70°C, электролизёр выдаёт газы с температурой воды или даже чуть горячее. Необходимо учитывать это, проектируя систему охлаждения.
При подаче воды с микробами выходные газы будут тоже заражены, но
Электролизёрная | Oxygen Not Included Вики
- Проверить статью на содержание различных ошибок.
- Добавить изображения.
- Проставить для статьи более точные категории.
Теория
Главными элементами электролизёрных комнат являются сами электролизёры и газовый насосы для откачки газа. При работе электролизёр поглощает 1000 грамм воды в секунду, после чего вырабатывает кислород (888 г/с) и водород (112 г/с). Кислород уходит вниз, а водород вверх. При достижении давления газа более 1800 граммов, электролизёр автоматически выключается, поэтому важно держать давление обоих газов возле него ниже этого уровня. Газовый насос способен откачивать газ со скоростью 500 г/с, таким образом, на один электролизёр приходится как минимум 2 газовых насоса.
Далее следует процесс фильтрации, после чего кислород и водород уходят на нужды игрока.
Фильтрация
Существует четыре основных способа отделения газов друг от друга: газовый фильтр, логический фильтр, механический фильтр и без использования фильтров.
Газовый фильтр
Пожалуй является самым ленивым способом отсеять водород от от основного потока газа. Эта схема выгодна тем, что она занимает очень мало места, а для её исполнения не требуется автоматика (или почти не требуется). На фильтре выбираем нужный газ, а трубы от насосов подключаем к входу фильтра.
Использование данной постройки имеет также и существенный недостаток, ведь насос расходует 120 Вт за каждую порцию газа, проходящую через него. Учитывая то, что комната работает от 70 % цикла дня, в долгосрочном периоде бессмысленные потери энергии со временем станут ощутимой проблемой, особенно в начале игры.
Логический фильтр
Существует вариант газового фильтра на автоматике из статьи «Системы автоматизации», почти так же как и газовый фильтр, но расходует 10 Вт вместо 120, причем не за каждую порцию газа, а лишь за выбранную вами. Его суть заключается в том, что сенсор элемента газовой трубы будет отделять газ путём включения одного из газовых контроллеров.
Проблемой является то, что при переполнении трубы в верхний насос может проскочить ненужный газ, поэтому после фильтра нужно обязательно строить защиту от переполнения (она рассмотрена в пункте «Автоматика»).
Механический фильтр
Механический фильтр из статьи «Простые конструкции» не использует энергию вовсе. Работает он по принципу, что на участке трубы расположен мост газовых труб, отправляющий один вид газа вперёд, а второй продолжает идти по мосту которого встречается газовый вентиль.
Без использования фильтров
Как было описано в начале, водород легче
Электролиз — Вики
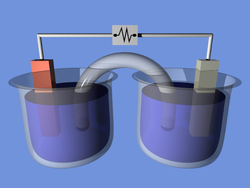
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы —
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия , меди, водорода, диоксида марганца
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
Электролиз Википедия
 | Эта страница требует существенной переработки. |

Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение[ | ]


Электролиз широко применяется в современной пр
Электролиз Википедия
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение
Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t}, если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=MzeNAIΔt{\displaystyle m={\frac {M}{zeN_{A}}}I\Delta t}
- m=MzFIΔt{\displaystyle m={\frac {M}{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=MFz{\displaystyle k={\frac {M}{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A} иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
Растворы
Активные металлы
Менее активные металлы и неактивные металлы
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
Ссылки
| |||
Электролиз — Википедия. Что такое Электролиз

Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом и т.д.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t},если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=μzeNAIΔt{\displaystyle m={\frac {\mu }{zeN_{A}}}I\Delta t}
- m=μzFIΔt{\displaystyle m={\frac {\mu }{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=μFz{\displaystyle k={\frac {\mu }{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A}иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
1. Соль активного металла и бескислородной кислоты:
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): Na++e−=Na0{\textstyle {\ce {Na+ + e- = Na^0}}}
A(+): Cl−−e−⟶Cl0⟶Cl2{\displaystyle {\ce {Cl- — e- -> Cl^0 -> Cl2}}}
Вывод: 2NaCl⟶2Na+Cl2↑{\displaystyle {\ce {2NaCl -> 2Na + Cl2 ^}}}
2. Соль активного металла и кислородсодержащей кислоты:
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}}
K(-): 2Na++2e−=2Na0{\displaystyle {\ce {2Na+ + 2e- = 2Na^0}}}
A(+): 2SO42−−4e−=2SO3+O2{\displaystyle {\ce {2SO4^2- — 4e- = 2SO3 + O2}}}
Вывод: 2Na2SO4⟶4Na+2SO3↑+O2↑{\displaystyle {\ce {2Na2SO4 -> 4Na + 2SO3 ^ + O2 ^}}}
3. Гидроксид: активный металл и гидроксид-ион:
NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}}
K(-): Na++e−=Na0{\displaystyle {\ce {Na+ + e- = Na^0}}}
A(+): 4OH−−4e−=2h3O+O2{\displaystyle {\ce {4OH- — 4e- = 2h3O + O2}}}
Вывод: 4NaOH⟶4Na+2h3O+O2↑{\displaystyle {\ce {4NaOH -> 4Na + 2h3O + O2 ^}}}
Растворы
Активные металлы
1. Соль активного металла и бескислородной кислоты
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): 2h3O+2e−=h3+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 + 2OH-}}}
A(+): Cl−−e−⟶Cl0⟶Cl2{\displaystyle {\ce {Cl- — e- -> Cl0 -> Cl2}}}
Вывод: 2NaCl+2h3O⟶h3↑+Cl2↑+2NaOH{\displaystyle {\ce {2NaCl + 2h3O -> h3 ^ + Cl2 ^ + 2NaOH}}}
2. Соль активного металла и кислородсодержащей кислоты
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}}
K(-): 2h3O+2e−=h3↑+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 ^ + 2OH-}}}
A(+): 2h3O−4e−=O2↑+4H+{\displaystyle {\ce {2h3O — 4e- = O2 ^ + 4H+}}}
Вывод: 2h3O⟶2h3↑+O2↑{\displaystyle {\ce {2h3O -> 2h3 ^ + O2 ^}}}
3. Гидроксид: активный металл и гидроксид-ион
NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}}
K(-): 2h3O+2e−=h3↑+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 ^ + 2OH-}}}
A(+): 4OH−−4e−=O2↑+2h3O{\displaystyle {\ce {4OH- -4e- = O2 ^ + 2h3O}}}
Суммарно: 4h3O+4e−+4OH−=2h3↑+4OH−+4e−+O2↑+2h3O{\displaystyle {\ce {4h3O + 4e- + 4OH- = 2h3 ^ + 4OH- + 4e- + O2 ^ + 2h3O}}}
Вывод: 2h3O⟶2h3↑+O2↑{\displaystyle {\ce {2h3O -> 2h3 ^ + O2 ^}}}
Менее активные металлы и неактивные металлы
1. Соль менее активного металла и бескислородной кислоты
ZnCl2⟷Zn2++2Cl−{\displaystyle {\ce {ZnCl2 <-> Zn^2+ + 2Cl-}}}
K(-): Zn2++2e−=Zn0{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}}
A(+): 2Cl−−2e−=2Cl0{\displaystyle {\ce {2Cl- — 2e- = 2Cl^0}}}
Вывод: ZnCl2⟶Zn+Cl2↑{\displaystyle {\ce {ZnCl2 -> Zn + Cl2 ^}}}
2. Соль менее активного металла и кислородсодержащей кислоты
ZnSO4⟷Zn2++SO42−{\displaystyle {\ce {ZnSO4 <-> Zn^2+ + SO4^2-}}}
K(-): Zn2++2e−=Zn0{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}}
A(+): 2h3O−4e−=O2↑+4H+{\displaystyle {\ce {2h3O — 4e- = O2 ^ + 4H+}}}
Вывод: 2ZnSO4+2h3O⟶2Zn+2h3SO4+O2{\displaystyle {\ce {2ZnSO4 + 2h3O -> 2Zn + 2h3SO4 + O2}}}
3. Гидроксид: невозможно (нерастворим)
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
Ссылки
| |||
Обсуждение:Электролиз Википедия
Не согласен с определением электролита!!! Электролит — это вещество, раствор или расплав которого проводит электрический ток. Статью, на мой взгляд, нужно доработать в области определений. —SeLarin 21:59, 11 июн 2005 (UTC) Правильно, статью надо доработать. Про расплав-то ничего не сказано..
Электрическое поле[ ]
Немного неожиданно звучит утверждение, что ионы в растворе электролита перемещаются под действием электрического поля, создаваемого катодом и анодом. Объясните, на каком электроде разряжаются анионы [Cu(OH)4]2-. Школьникам известно, что на отрицательном.—Назар Саман 10:29, 22 сентября 2010 (UTC)
- В статье вроде всё правильно написано. Это надо разбираться с тем, что там школьникам известно. — Артём Коржиманов 10:44, 22 сентября 2010 (UTC)
- Электродный процесс восстановления двухвалентной меди до металла всегда идёт на катоде, независимо от заряда иона, несущего медь. На аноде по определению возможны только реакции окисления. Таким образом, анионные (отрицательно заряженные) комплексы металлов движутся к катоду (отрицательному электроду), а не отталкиваются им. Это явление лежит в основе меднения, серебрения, золочения, хромирования и много чего ещё.—Назар Саман 10:53, 22 сентября 2010 (UTC)
- А вы уверены, что там есть такие анионы и что именно они являются источником меди для восстановления? Потому что, на мой дилетантский взгляд, логичнее было бы предпололжить, что в растворе «плавают» катионы Cu2+ и анионы OH−, и первые и восстанавливаются до атомарной меди на катоде. — Артём Коржиманов 11:11, 22 сентября 2010 (UTC)
- Простых ионов Cu2+ в водных растворах не бывает вообще, они обязательно координируют вокруг себя другие ионы или молекулы (например, молекулы воды или аммиака). Заряд комплексного иона определяется зарядом и количеством координированных ионов/молекул. Состав комплексного иона определяется составом раствора. В растворе сульфата меди (медного купороса) ионы меди присутствуют в виде катионных комплексов [Cu(H2O)5]2+, и понятно, что при электролизе они движутся к катоду и там разряжаются (медь восстанавливается, то есть ее валентность переходит от +2 к 0). Но применение таких растворов для меднения, например, стальных или железных поверхностей осложняется побочной реакцией восстановления меди самим железом; осадок меди при этом получается рыхлым. Поэтому на практике используют растворы, содержащие медь в виде анионных ко
- Электродный процесс восстановления двухвалентной меди до металла всегда идёт на катоде, независимо от заряда иона, несущего медь. На аноде по определению возможны только реакции окисления. Таким образом, анионные (отрицательно заряженные) комплексы металлов движутся к катоду (отрицательному электроду), а не отталкиваются им. Это явление лежит в основе меднения, серебрения, золочения, хромирования и много чего ещё.—Назар Саман 10:53, 22 сентября 2010 (UTC)



