Промышленный электролиз — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 июня 2017; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 июня 2017; проверки требует 1 правка.Электролиз промышленный — процесс электролиза, применяемый для получения различных металлов, газов и т. п. в промышленных масштабах.
Технологии промышленного электролиза[править | править код]
Технологии промышленного электролиза подразделяются на несколько типов:
- PFPB — технология электролиза с использованием обожженных анодов и точечных питателей
- CWPB — электролиз с использованием обожженных анодов и балки продавливания по центру
- SWPB — периферийная обработка электролизеров с обожженными анодами
- VSS — технология Сёдерберга с верхним токоподводом
- HSS — технология Сёдерберга с боковым токоподводом
Сравнение объемов производства в алюминиевой промышленности[править | править код]
Результаты изучения объемов производства алюминия с использованием различных технологий промышленного электролиза, проведённого институтом IAI в 2001 году[1] (в опрос не включены производители из России и Китая).
| Технология | Мировой объем производства (в тоннах) | Объем производства участников опроса (в тоннах) | Доля участников опроса (в процентах) |
|---|---|---|---|
| PFPB | 14172142 | 11795764 | 83,2 |
| CWPB | 2224778 | 1210676 | 54,4 |
| SWPB | 1450260 | 647846 | 44,7 |
| VSS | 4321015 | 1803941 | 41,7 |
| HSS | 2320280 | 469280 | 20,2 |
| Итого: | 24488474 | 15927306 | 65,0 |
Наибольший объем удельных выбросов из электролизеров приходится на процессы электролиза, в основе которых лежит технология Содерберга. Данная технология получила наибольшее распространение на алюминиевых заводах России и Китая. Объем удельных выбросов из таких электролизерах значительно выше относительно других технологий. Количество выбросов фторуглеродов сокращают в том числе и изучая технологические параметры анодного эффекта, снижение которого также влияет на количество выбросов.
- ↑ Willy Bjerke, Robert Chase, Reginald Gibson, Jerry Marks lm-04-367 International aluminium institute anode effect survey results
Электрохимия — Википедия
Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается.
XVI—XVIII столетия[править | править код]
Немецкий физик Отто фон Герике и первый генератор статического электричестваВ 1663 г. немецкий физик Отто фон Герике создаёт первый электрический генератор, который вырабатывал статическое электричество благодаря трению. Генератор представлял собой стеклянный шар с рукояткой, покрытый толстым слоем серы. Шар раскручивался вручную и при трении о подушечки пальцев, образовывалась электрическая искра. Заряженный шар использовали в экспериментах по электричеству.
В середине 18 столетия французский физик Шарль Франсуа Дюфе (Charles François de Cisternay du Fay) делает вывод о существовании двух видов статического электричества. Он высказывает мнение о том, что электричество состоит из двух «флюидов»: положительного и отрицательного. В противовес этой теории Б. Франклин предполагает что статическое электричество состоит из одного «флюида», а заряд объясняется избытком или недостатком такого флюида.
В 1781 г Шарль Огюстен Кулон (Charles-Augustin de Coulomb) излагает «Закон Кулона», описывающий взаимодействие заряженных тел.
Опыт Л. ГальваниБольшой толчок к развитию электрохимии положили опыты в 1771 г. итальянского анатома и физиолога Луиджи Гальвани (Luigi Galvani) с мышцами препарированной лягушки. Гальвани обнаружил, что при наложении на мышцы двух разных металлов, соединённых проводником, мышцы лягушки сокращаются. В 1791 гг. выходит его работа под названием «De Viribus Electricitatis in Motu Musculari Commentarius» («Трактат о силах электричества при мышечном движении»), в котором Гальвани говорит о существовании «Животного электричества», которое активируется в мышцах и нервах, при наложении на них двух металлов. Эта работа стала сенсацией. Он верил, что эта новая сила была одной из форм электричества в дополнение к «природной» форме, образующейся при ударе молнии, вырабатываемой электрическим угрём, а также «не природной», искусственной, образующейся при трении (статическое электричество). Считается, что в работах Гальвани впервые появляется предположение о связи между химическими реакциями и электричеством. 1791 год считается «днём рождения» электрохимии. Многие учёные приняли теорию Гальвани, но А. Вольта (Alessandro Volta) был против неё. Вольта считает, что мышцы являются лишь проводниками электрического тока, но не являются его источником. Тогда Гальвани демонстрирует эксперимент, при котором мышцы сокращались при наложении на них одного металла, а также и без металла — при соединении бедренного нерва с мышцей. А. Вольта на протяжении 8 лет занимается изучением органов угрей и скатов, вырабатывающих электричество. Результатом его исследований стало изготовление в 1799 году первого химического источника тока — «Вольтова столба». Это был исключительно важный (задолго до появления генераторов) источник электрического тока, способствовавший появлению многих открытий, в частности, первое получение в 1808—1809 гг. английским учёным Гемфри Дэви (Humphry Davy) в чистом виде таких металлов как натрий, калий, барий, стронций, кальций и магний.
XIX столетие[править | править код]
В конце XVIII ст. немецкий физик Вильгельм Риттер (Johann Wilhelm Ritter) пишет статью «Гальванизм» и создаёт простой аккумулятор. С У. Николсоном (англ.)) они проводят разложение воды на водород и кислород путём электролиза. Вскоре после этого В. Риттер разрабатывает процесс гальванопокрытия. Он замечает, что количество осаждаемого металла, а также образующегося кислорода, зависит от расстояния между электродами. К 1801 г. Риттер наблюдает термоэлектрический ток и поручает его исследование Томасу Зеебеку (Thomas Johann Seebeck).
В 1820 г. Г. Х. Эрстед открывает магнитный эффект электрического тока, что было эпохальным открытием. Андре-Мари Ампер (André-Marie Ampère) повторяет эксперимент Эрстеда и описывает его математически.
В 1821 г. немецко-эстонский физик Т. Зеебек демонстрирует появление термоэлектрического потенциала в точке соединения двух разнородных металлов, при наличии разницы температуры в этой точке.
В 1827 г. немецкий ученый Г. Ом (Ohm, Georg Simon) представляет свой закон в известной книге Die galvanische Kette, mathematisch bearbeitet» (гальваническая цепь, математическая обработка) и полностью описывает свою теорию электричества.
В 1832 г. знаменитый английский физик Майкл Фарадей (Michael Faraday) открывает законы электролиза и вводит такие понятия как электрод, электролит, анод, катод, анион, катион.
В 1836 г. Д. Даниэль создаёт первичный источник тока. Даниель занимается проблемой поляризации. В 1839 г. английский физик Уильям Роберт Грове (Grove) создаёт первый топливный элемент. В 1866 г. француз Жорж Лекланше (Georges Leclanché) патентует новый элемент — угольно-цинковый гальванический элемент.
В 1884 г. Сванте Аррениус (Svante August Arrhenius) публикует диссертацию «Recherches sur la conductibilité galvanique des électrolytesc» (Исследования гальванической проводимости электролитов). Он говорит, что электролиты распадаются при растворении на положительные и отрицательные ионы.
В 1886 г. Поль Луи Туссен (Paul Héroult) и Чарльз Холл (Charles M. Hall), одновременно и независимо, разрабатывают промышленный способ получения алюминия путём электролиза на основе законов Фарадея.
В 1894 г. Ф. Оствальд (Friedrich Ostwald) завершает важные исследования электропроводности и электродиссоциации органических кислот.
В 1888 г. В. Нернст развивает теорию электродвижущей силы первичного элемента, состоящего из двух электродов, разделённых раствором электролита. Он выводит уравнение, известное как Уравнение Нернста — уравнение зависимости электродвижущей силы и концентрации ионов.
XX столетие[править | править код]
Бурное развитие электрохимии. В 1902 году — создание электрохимического общества, The Electrochemical Society (ECS). 1949 год — образование Международного электрохимического общества, International Society of Electrochemistry (ISE). В 1959 году чешский учёный Ярослав Гейровский (Jaroslav Heyrovský) получает Нобелевскую премию за изобретение и развитие нового вида электрохимического анализа — полярографии.
Советская школа электрохимиков[править | править код]
Традиционно электрохимию разделяют на теоретическую и прикладную.
Теоретическая электрохимия[править | править код]
Теория электролитов[править | править код]
Электрохимия гетерогенных систем[править | править код]
Прикладная электрохимия[править | править код]
Электролиз требует внешнего источника электрической энергии, который обеспечивает возникновение и поддержание принудительного потенциала и протекание электрохимических процессов на аноде и катоде, размещённых в электролитической ячейке (например, в промышленном электролизёре).
Электролиз расплавленного хлорида натрия[править | править код]
Коррозия — термин, применяемый обычно в отношении процесса разрушения металлов ржавчиной, которое вызывается электрохимическими процессами.
Большинство людей знакомо с коррозией железа, в форме оранжево-коричневой или чёрно-бурой ржавчины. Ежегодно коррозия уничтожает приблизительно 10 % выплавляемых чёрных металлов. Другими примерами являются появление чёрных пятен на серебре или позеленение меди. Стоимость замены металлических объектов, выведенных из строя вследствие коррозии, составляет миллиарды долларов США в год.
Коррозия железа и чёрных металлов[править | править код]
Исследования в водных растворах ограничены электрохимической устойчивостью воды, как растворителя. Электролиз расплавленных сред не всегда приемлем, так как простые и комплексные солевые системы, включая эвтектические расплавы, имеют слишком высокую температуру плавления. Неводные растворы в органических растворителях, в жидком диоксиде серы и т. п. позволяют осуществить многие процессы, слишком энергоёмкие или полностью невозможные в воде или расплавах.
| |||
электролиз — Викисловарь
 | В Википедии есть страница «электролиз». |
Содержание
- 1 Русский
- 1.1 Морфологические и синтаксические свойства
- 1.2 Произношение
- 1.3 Семантические свойства
- 1.3.1 Значение
- 1.3.2 Синонимы
- 1.3.3 Антонимы
- 1.3.4 Гиперонимы
- 1.3.5 Гипонимы
- 1.4 Родственные слова
- 1.5 Этимология
- 1.6 Фразеологизмы и устойчивые сочетания
- 1.7 Перевод
- 1.8 Библиография
- 2 Башкирский
- 2.1 Морфологические и синтаксические свойства
- 2.2 Произношение
- 2.3 Семантические свойства
- 2.3.1 Значение
- 2.3.2 Синонимы
- 2.3.3 Антонимы
- 2.3.4 Гиперонимы
- 2.3.5 Гипонимы
- 2.4 Родственные слова
- 2.5 Этимология
- 2.6 Фразеологизмы и устойчивые сочетания
- 3 Казахский
- 3.1 Морфологические и синтаксические свойства
- 3.2 Произношение
- 3.3 Семантические свойства
- 3.3.1 Значение
- 3.3.2 Синонимы
- 3.3.3 Антонимы
- 3.3.4 Гиперонимы
- 3.3.5 Гипонимы
- 3.4 Родственные слова
- 3.5 Этимология
- 3.6 Фразеологизмы и устойчивые сочетания
- 4 Киргизский
- 4.1 Морфологические и синтаксические свойства
- 4.2 Произношение
- 4.3 Семантические свойства
- 4.3.1 Значение
- 4.3.2 Синонимы
- 4.3.3 Антонимы
- 4.3.4 Гиперонимы
- 4.3.5 Гипонимы
- 4.4 Родственные слова
- 4.5 Этимология
- 4.6 Фразеологизмы и устойчивые сочетания
- 5 Кумыкский
- 5.1 Морфологические и синтаксические свойства
- 5.2 Произношение
- 5.3 Семантические свойства
- 5.3.1 Значение
- 5.3.2 Синонимы
- 5.3.3 Антонимы
- 5.3.4 Гиперонимы
- 5.3.5 Гипонимы
- 5.4 Родственные слова
- 5.5 Этимология
- 5.6 Фразеологизмы и устойчивые сочетания
- 6 Осетинский
- 6.1 Морфологические и синтаксические свойства
- 6.2 Произношение
- 6.3 Семантические свойства
- 6.3.1 Значение
- 6.3.2 Синонимы
- 6.3.3 Антонимы
- 6.3.4 Гиперонимы
- 6.3.5 Гипонимы
- 6.4 Родственные слова
- 6.5 Этимология
- 6.6 Фразеологизмы и устойчивые сочетания
- 7 Таджикский
- 7.1 Морфологические и синтаксические свойства
- 7.2 Произношение
- 7.3 Семантические свойства
- 7.3.1 Значение
- 7.3.2 Синонимы
- 7.3.3 Антонимы
- 7.3.4 Гиперонимы
- 7.3.5 Гипонимы
- 7.4 Родственные слова
- 7.5 Этимология
- 7.6 Фразеологизмы и устойчивые сочетания
- 8 Татарский
- 8.1 Морфологические и синтаксические свойства
- 8.2 Произношение
- 8.3 Семантические свойства
- 8.3.1 Значение
- 8.3.2 Синонимы
- 8.3.3 Антонимы
- 8.3.4 Гиперонимы
- 8.3.5 Гипонимы
- 8.4 Родственные слова
- 8.5 Этимология
- 8.6 Фразеологизмы и устойчивые сочетания
- 9 Чувашский
- 9.1 Морфологические и синтаксические свойства
- 9.2 Произношение
- 9.3 Семантические свойства
- 9.3.1 Значение
- 9.3.2 Синонимы
- 9.3.3 Антонимы
- 9.3.4 Гиперонимы
- 9.3.5 Гипонимы
- 9.4 Родственные слова
- 9.5 Этимология
- 9.6 Фразеологизмы и устойчивые сочетания
- 10 Якутский
- 10.1 Морфологические и синтаксические свойства
- 10.2 Произношение
- 10.3 Семантические свойства
- 10.3.1 Значение
- 10.3.2 Синонимы
- 10.3.3 Антонимы
- 10.3.4 Гиперонимы
- 10.3.5 Гипонимы
- 10.4 Родственные слова
- 10.5 Этимология
- 10.6 Фразеологизмы и устойчивые сочетания
| В Викиданных есть лексема электролиз (L181918). |
Морфологические и синтаксические свойства[править]
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | электро́лиз | электро́лизы |
| Р. | электро́лиза | электро́лизов |
| Д. | электро́лизу | электро́лизам |
| В. | электро́лиз | электро́лизы |
| Тв. | электро́лизом | электро́лизами |
| Пр. | электро́лизе | электро́лизах |
электро́лиз
Существительное, неодушевлённое, мужской род, 2-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Корень: -электр-; интерфикс: -о-; корень: -лиз- [Тихонов, 1996].
Произношение[править]
- МФА: [ɛlʲɪkˈtrolʲɪs]
Семантические свойства[править]
Значение[править]
- хим. химический процесс (окислительно-восстановительная реакция) разложения вещества на составные части при прохождении электрического тока через раствор или расплав электролита ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
- —
Гиперонимы[править]
- процесс, реакция
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
| |
Этимология[править]
Происходит от ??
Фразеологизмы и устойчивые сочетания[править]
Перевод[править]
| Список переводов | |
| |
Библиография[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
электролиз
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. электролиз ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
электролиз
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. электролиз ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
электролиз
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. электролиз ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
электролиз
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. электролиз ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
электролиз
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. электролиз ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
электролиз
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. электролиз ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
 | Для улучшения этой статьи желательно:
|
Электролиз — Википедия
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом и т.д.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение
Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t}, если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=MzeNAIΔt{\displaystyle m={\frac {M}{zeN_{A}}}I\Delta t}
- m=MzFIΔt{\displaystyle m={\frac {M}{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=MFz{\displaystyle k={\frac {M}{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A} иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
Растворы
Активные металлы
Менее активные металлы и неактивные металлы
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
Ссылки
| |||
Электролиз — Википедия
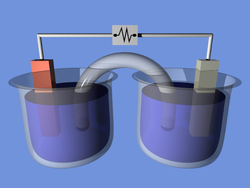
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t}, если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=MzeNAIΔt{\displaystyle m={\frac {M}{zeN_{A}}}I\Delta t}
- m=MzFIΔt{\displaystyle m={\frac {M}{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=MFz{\displaystyle k={\frac {M}{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A} иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
Растворы
Активные металлы
Менее активные металлы и неактивные металлы
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
Ссылки
| |||
Обсуждение:Электролиз — Википедия
Материал из Википедии — свободной энциклопедии
Не согласен с определением электролита!!! Электролит — это вещество, раствор или расплав которого проводит электрический ток. Статью, на мой взгляд, нужно доработать в области определений. —SeLarin 21:59, 11 июн 2005 (UTC) Правильно, статью надо доработать. Про расплав-то ничего не сказано..
Немного неожиданно звучит утверждение, что ионы в растворе электролита перемещаются под действием электрического поля, создаваемого катодом и анодом. Объясните, на каком электроде разряжаются анионы [Cu(OH)4]2-. Школьникам известно, что на отрицательном.—Назар Саман 10:29, 22 сентября 2010 (UTC)
- В статье вроде всё правильно написано. Это надо разбираться с тем, что там школьникам известно. — Артём Коржиманов 10:44, 22 сентября 2010 (UTC)
- Электродный процесс восстановления двухвалентной меди до металла всегда идёт на катоде, независимо от заряда иона, несущего медь. На аноде по определению возможны только реакции окисления. Таким образом, анионные (отрицательно заряженные) комплексы металлов движутся к катоду (отрицательному электроду), а не отталкиваются им. Это явление лежит в основе меднения, серебрения, золочения, хромирования и много чего ещё.—Назар Саман 10:53, 22 сентября 2010 (UTC)
- А вы уверены, что там есть такие анионы и что именно они являются источником меди для восстановления? Потому что, на мой дилетантский взгляд, логичнее было бы предпололжить, что в растворе «плавают» катионы Cu2+ и анионы OH−, и первые и восстанавливаются до атомарной меди на катоде. — Артём Коржиманов 11:11, 22 сентября 2010 (UTC)
- Простых ионов Cu2+ в водных растворах не бывает вообще, они обязательно координируют вокруг себя другие ионы или молекулы (например, молекулы воды или аммиака). Заряд комплексного иона определяется зарядом и количеством координированных ионов/молекул. Состав комплексного иона определяется составом раствора. В растворе сульфата меди (медного купороса) ионы меди присутствуют в виде катионных комплексов [Cu(H2O)5]2+, и понятно, что при электролизе они движутся к катоду и там разряжаются (медь восстанавливается, то есть ее валентность переходит от +2 к 0). Но применение таких растворов для меднения, например, стальных или железных поверхностей осложняется побочной реакцией восстановления меди самим железом; осадок меди при этом получается рыхлым. Поэтому на практике используют растворы, содержащие медь в виде анионных комплексов (гидроксильных, цианидных и др.), которые с железом не реагируют. Для этого просто добавляют в раствор сульфата меди соответствующие вещества в нужных количествах. Пример гидроксильного комплекса меди приведен выше. Медь в таких комплексах все равно имеет валентность +2, что требует её восстановления — а восстановление возможно на катоде и никак не на аноде. Сказанное относится также к серебрению и золочению. Хромирование ведут из растворов хромовой кислоты, в которых +6 валентный хром находится в виде аниона CrO42-.—Назар Саман 11:42, 22 сентября 2010 (UTC)
- Электродный процесс восстановления двухвалентной меди до металла всегда идёт на катоде, независимо от заряда иона, несущего медь. На аноде по определению возможны только реакции окисления. Таким образом, анионные (отрицательно заряженные) комплексы металлов движутся к катоду (отрицательному электроду), а не отталкиваются им. Это явление лежит в основе меднения, серебрения, золочения, хромирования и много чего ещё.—Назар Саман 10:53, 22 сентября 2010 (UTC)
- Подробно сейчас не скажу, не совсем в кондиции, но кратко выскажу мнение. Действительно, по определению катода в электрохимии восстановление происходит именно на нем. И если металл с валентностью, к примеру, +2, входит в состав комплекса с зарядом -1, то восстанавливаться до металла при электролизе он всё равно будет на катоде, отрицательном электроде. Интерпретация процесса восстановления как восстановления именно ионов, например, Cu2+, просто равновесных с комлексным ионом, иногда имеет место, но не вполне корректна — в частности, это видно как смещение поляризационных кривых выделения металла для комплексных ионов по сравнению с простыми. Что же касается «причин» движения ионов в растворе, то электрическое поле — лишь одна из таких причин. И, например, закон Ома для электролитов справедлив лишь в отсутствие градиента концентраций. — OneLittleMouse 11:58, 22 сентября 2010 (UTC)
- Всё сказанное OneLittleMouse справедливо. Механизм перемещения анионов к катоду приблизительно таков: Анионы сорбируются на катоде, несмотря на одинаковый с ним заряд, и восстанавливаются на нём. Соответственно их концентрация в прикатодном пространстве уменьшается, т.е. возникает градиент концентраций. В соответствии с законом Фика, возникает диффузионный поток, направленный в данном случае против сил электростатического взаимодействия.—Назар Саман 12:09, 22 сентября 2010 (UTC)
- Я так понимаю, утверждается, что в этом случае существенную роль играет диффузия частиц, а не упорядоченное движение под действием электрического поля. Это, наверное, следует как-то отметить в статье. — Артём Коржиманов 12:34, 22 сентября 2010 (UTC)
- Да, существенную, вместе с упорядоченным движением под действием электрического поля. Так же, как и «школьный» разряд простых ионов на катоде в какой-то степени тоже имеет место, но вместе с разрядом комплексных, при этом часто концентрация свободных ионов очень мала и ток за счет их разряда незначительный. OneLittleMouse 12:50, 22 сентября 2010 (UTC)
- Имеются в виду не «школьные» простые или свободные катионы, а аквокомплексы. Их равновесная концентрация в щелочных растворах действительно незначительна, иначе они проявляли бы себя в химической реакции типа Cu(2+) + Fe → Cu + Fe(2+). Комплексование катиона меди, нипример, цианидом существенно изменяет его окислительно-восстановительный потенциал как в химических, так и в электрохимических реакциях. А в электролитических ваннах хромирования о «свободных» ионах и речи быть не может. —Назар Саман 13:08, 22 сентября 2010 (UTC) —Назар Саман 13:08, 22 сентября 2010 (UTC)
- Распишете в статье все это? Механизм элетропроводности растворов, электрическую подвижность, числа переноса, понятие фонового электролита и прочие кунштюки. Неплохо бы при этом и электропроводности расплавов и твердых тоже коснуться. OneLittleMouse 13:19, 22 сентября 2010 (UTC)
- Хочет душа в рай, да грехи не пускают. Не могу, коллега! Источников под рукой нет, по жизни цейтнот. Изредка прорываюсь сюда для разрядки, по разнообразным темам, а в этом случае требуется систематический подход. Из головы статья не получится. Я как раз на Вас рассчитываю. К тому же, в электрохимии расплавов и твердых тел я не разбираюсь.—Назар Саман 13:34, 22 сентября 2010 (UTC)
- Может быть, позже попробую. Уж больно обширна тема — если подходить к проблеме хоть сколько-нибудь серьёзно, то работы потребует преизрядно… Может, следует разбить на кусочки и тот же механизм электропроводности выделить в отдельную статью. В общем, влёт что-то накатать пока не возьмусь, но в планах на будущее отмечу. OneLittleMouse 15:36, 22 сентября 2010 (UTC)
- Если что, пишите на мою страницу. Я время от времени заглядываю. Удачи Вам, коллега!—Назар Саман 16:16, 22 сентября 2010 (UTC)
- Может быть, позже попробую. Уж больно обширна тема — если подходить к проблеме хоть сколько-нибудь серьёзно, то работы потребует преизрядно… Может, следует разбить на кусочки и тот же механизм электропроводности выделить в отдельную статью. В общем, влёт что-то накатать пока не возьмусь, но в планах на будущее отмечу. OneLittleMouse 15:36, 22 сентября 2010 (UTC)
- Хочет душа в рай, да грехи не пускают. Не могу, коллега! Источников под рукой нет, по жизни цейтнот. Изредка прорываюсь сюда для разрядки, по разнообразным темам, а в этом случае требуется систематический подход. Из головы статья не получится. Я как раз на Вас рассчитываю. К тому же, в электрохимии расплавов и твердых тел я не разбираюсь.—Назар Саман 13:34, 22 сентября 2010 (UTC)
- Распишете в статье все это? Механизм элетропроводности растворов, электрическую подвижность, числа переноса, понятие фонового электролита и прочие кунштюки. Неплохо бы при этом и электропроводности расплавов и твердых тоже коснуться. OneLittleMouse 13:19, 22 сентября 2010 (UTC)
- Всё сказанное OneLittleMouse справедливо. Механизм перемещения анионов к катоду приблизительно таков: Анионы сорбируются на катоде, несмотря на одинаковый с ним заряд, и восстанавливаются на нём. Соответственно их концентрация в прикатодном пространстве уменьшается, т.е. возникает градиент концентраций. В соответствии с законом Фика, возникает диффузионный поток, направленный в данном случае против сил электростатического взаимодействия.—Назар Саман 12:09, 22 сентября 2010 (UTC)
Может всё-таки перенести вывод законов в основную статью: «законы электролиза Фарадея»? Странно тут смотрится вывод. 95.106.164.203 08:14, 17 апреля 2012 (UTC)
- Вы правы, коллега, хотя бы в том, что не следует дублировать информицию. Везде, где есть возможность ограничиться ссылкой, следует ограничиться ссылкой. Ведь это же не толстый том на полке разыскивать. Да и там (в бумажных энциклопедиях) дают внутренние ссылки!—Назар Саман 15:30, 18 апреля 2012 (UTC)
Да перепишите вы статью из БСЭ и не майтесь. Ее грамотные люди писали, в отличие от вас. А у вас с самого начала, в определении электролиза как явления, грубая ошибка —85.26.232.10 10:11, 29 декабря 2012 (UTC)
Применение электролиза для анализа состава воды[править код]
В статье совсем не сказано о том, как с помощью электролиза можно получить сведения о составе воды. Не мог бы кто-нибудь написать об этом?Caesarion 16:41, 9 августа 2013 (UTC)
Электролиз — Википедия. Что такое Электролиз

Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом и т.д.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t},если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=μzeNAIΔt{\displaystyle m={\frac {\mu }{zeN_{A}}}I\Delta t}
- m=μzFIΔt{\displaystyle m={\frac {\mu }{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=μFz{\displaystyle k={\frac {\mu }{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A}иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
1. Соль активного металла и бескислородной кислоты:
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): Na++e−=Na0{\textstyle {\ce {Na+ + e- = Na^0}}}
A(+): Cl−−e−⟶Cl0⟶Cl2{\displaystyle {\ce {Cl- — e- -> Cl^0 -> Cl2}}}
Вывод: 2NaCl⟶2Na+Cl2↑{\displaystyle {\ce {2NaCl -> 2Na + Cl2 ^}}}
2. Соль активного металла и кислородсодержащей кислоты:
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}}
K(-): 2Na++2e−=2Na0{\displaystyle {\ce {2Na+ + 2e- = 2Na^0}}}
A(+): 2SO42−−4e−=2SO3+O2{\displaystyle {\ce {2SO4^2- — 4e- = 2SO3 + O2}}}
Вывод: 2Na2SO4⟶4Na+2SO3↑+O2↑{\displaystyle {\ce {2Na2SO4 -> 4Na + 2SO3 ^ + O2 ^}}}
3. Гидроксид: активный металл и гидроксид-ион:
NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}}
K(-): Na++e−=Na0{\displaystyle {\ce {Na+ + e- = Na^0}}}
A(+): 4OH−−4e−=2h3O+O2{\displaystyle {\ce {4OH- — 4e- = 2h3O + O2}}}
Вывод: 4NaOH⟶4Na+2h3O+O2↑{\displaystyle {\ce {4NaOH -> 4Na + 2h3O + O2 ^}}}
Растворы
Активные металлы
1. Соль активного металла и бескислородной кислоты
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): 2h3O+2e−=h3+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 + 2OH-}}}
A(+): Cl−−e−⟶Cl0⟶Cl2{\displaystyle {\ce {Cl- — e- -> Cl0 -> Cl2}}}
Вывод: 2NaCl+2h3O⟶h3↑+Cl2↑+2NaOH{\displaystyle {\ce {2NaCl + 2h3O -> h3 ^ + Cl2 ^ + 2NaOH}}}
2. Соль активного металла и кислородсодержащей кислоты
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}}
K(-): 2h3O+2e−=h3↑+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 ^ + 2OH-}}}
A(+): 2h3O−4e−=O2↑+4H+{\displaystyle {\ce {2h3O — 4e- = O2 ^ + 4H+}}}
Вывод: 2h3O⟶2h3↑+O2↑{\displaystyle {\ce {2h3O -> 2h3 ^ + O2 ^}}}
3. Гидроксид: активный металл и гидроксид-ион
NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}}
K(-): 2h3O+2e−=h3↑+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 ^ + 2OH-}}}
A(+): 4OH−−4e−=O2↑+2h3O{\displaystyle {\ce {4OH- -4e- = O2 ^ + 2h3O}}}
Суммарно: 4h3O+4e−+4OH−=2h3↑+4OH−+4e−+O2↑+2h3O{\displaystyle {\ce {4h3O + 4e- + 4OH- = 2h3 ^ + 4OH- + 4e- + O2 ^ + 2h3O}}}
Вывод: 2h3O⟶2h3↑+O2↑{\displaystyle {\ce {2h3O -> 2h3 ^ + O2 ^}}}
Менее активные металлы и неактивные металлы
1. Соль менее активного металла и бескислородной кислоты
ZnCl2⟷Zn2++2Cl−{\displaystyle {\ce {ZnCl2 <-> Zn^2+ + 2Cl-}}}
K(-): Zn2++2e−=Zn0{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}}
A(+): 2Cl−−2e−=2Cl0{\displaystyle {\ce {2Cl- — 2e- = 2Cl^0}}}
Вывод: ZnCl2⟶Zn+Cl2↑{\displaystyle {\ce {ZnCl2 -> Zn + Cl2 ^}}}
2. Соль менее активного металла и кислородсодержащей кислоты
ZnSO4⟷Zn2++SO42−{\displaystyle {\ce {ZnSO4 <-> Zn^2+ + SO4^2-}}}
K(-): Zn2++2e−=Zn0{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}}
A(+): 2h3O−4e−=O2↑+4H+{\displaystyle {\ce {2h3O — 4e- = O2 ^ + 4H+}}}
Вывод: 2ZnSO4+2h3O⟶2Zn+2h3SO4+O2{\displaystyle {\ce {2ZnSO4 + 2h3O -> 2Zn + 2h3SO4 + O2}}}
3. Гидроксид: невозможно (нерастворим)
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
Ссылки
| |||



