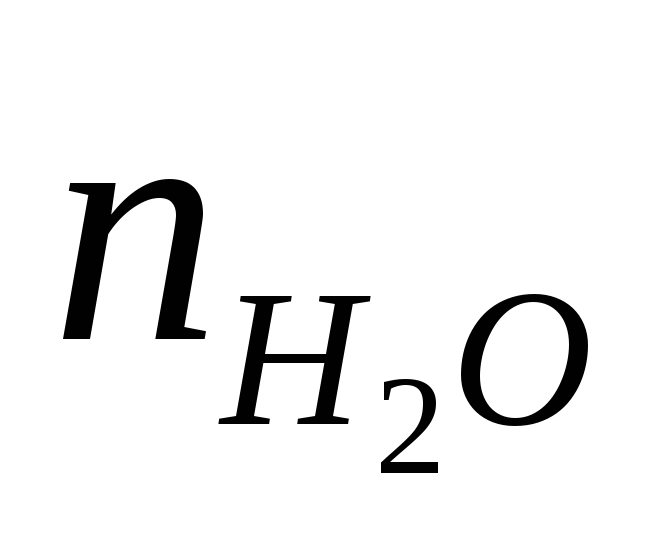Уравнение Нернста. Применение в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:









Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:

Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu2+ и Zn2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:


Далее находим по таблице стандартные потенциалы процессов:

Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:

Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:

Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.

Далее находим по таблице стандартные потенциалы процессов:

Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:

Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Ответ: процесс не идет.
В конце приведем общий алгоритм решения задач с использованием уравнения Нернста:
- 1) Написать уравнения полуреакций, соответствующие процессу.
- 2) Определить, в каком из уравнений концентрации отличаются от стандартных.
- 3) Определить число электронов, участвующих в процессе.
- 4) Рассчитать реальные потенциалы, применяя уравнение Нернста.
- 5) Ответить на вопрос задачи.
Нернста—Петерса уравнение — Справочник химика 21
Поскольку в концентрационном члене уравнения Нернста — Петерса в числителе находятся концентрации исходных веществ, то при записи полуреакции всегда в форме [c.127]Не только комплексообразование изменяет потенциал редокспар. Присутствие любых электролитов, вследствие увеличения ионной силы раствора, вызывает отклонение активностей растворенных веществ от их стехиометрических концентраций. И хотя принято в уравнение Нернста — Петерса подставлять молярные концентрации окисленной и восстановленной форм, -но молярная концентрация равна активности только в очень разбавленных растворах, во всех остальных случаях следует пользоваться уравнением Нернста — Петерса в такой форме [c.135]
Уравнения Нернста типа (6.1>—(6.5 ) и т.д. для окислительно-восстановительных потенциалов иногда называют уравнениями Нернста— Петерса или просто уравнениями Петерса. Уравнения этого типа, выраженные через концентрации, а не через активности, впервые вывел для электродных потенциалов немецкий физико-химик Вальтер Нернст в 1888 г. (тогда понятие активность еще не было известно) на основании своей осмотической теории элеиродных потенциалов. Р. Петерс, сотрудник известного немецкого физико-химика В. Оствальда, показал в 1889 г. применимость уравнения Нернста дш1 окислительно-восстановительных систем.
Способность формы Ared отщеплять электроны и превращаться в форму Аох выражается через ОВ-потенциал пары Аох, Ared, который может быть вычислен по уравнению Нернста — Петерса [c.160]
Формула Нернста справедлива для электродов первого рода, и область ее применения ограничена электродами этого типа. Необходимо отметить, что подобную ограниченность не следует считать непреодолимым недостатком теории Нернста. Так, Петерс(1898) показал, что исходя из основных представлений Нернста, можно получить уравнение для редокси-электродов. Идеи Нернста были развиты
Формула Нернста справедлива для электродов первого рода, и область ее применения ограничена электродами этого типа. Необходимо, однако, отметить, что эту ограниченность не следует считать непреодолимым недостатком теории Нернста. Так, например-Петерс (1898) показал, что используя основные представления, Нернста, можно получить уравнение для редокси-электродов. Идеи Нернста были развиты в работах Батлера (1924), которому удалось кинетическим путем вывести уравнение для различных типов электродов.
В окислительно-восстановительных реакциях имеется возможность воздействия на редокспотенциал участвующих в реакции пар. Действительно, если согласно уравнению Нернста—Петерса редокспотенциал тем выше, чем больше активность (концентрация) окисленной формы данной пары и, наоборот, тем ниже, чем меньше эта концентрация и выше концентрация восстановленной формы [c.132]
НЫХ комплексных соединений, до недавнего времени были практически ограничены аргентометрией и меркуриметрией. Причиной этого ограничения является то, что только небольшое число металлических электродов реагирует правильно на концентрацию своих ионов в растворе в соответствии с уравнением Нернста. Кроме того, работа с такими электродами встречает экспериментальные затруднения. В этом отношении даже от комнлексонов нельзя ожидать суш[ественного расширения области применения таких определений. Совершенно другое положение имеет место в случае методов, основанных на измерении окислительно-восстановительных потенциалов с помощью инертных электродов из благородных металлов. Потенциал платинового электрода в растворе, содержат,ем высшую окисленную и низшую восстановленную формы, дается уравнением Петерса
Из приведенной характеристики обратимых и необратимых систем видно, что только для первых из них равн определяется соотношением активностей Ъкисленной и восстановленной форм, согласно термодинамическому уравнению Нернста. Действительно, экспериментальные данные Петерса на примере системы показали строгое соблюдение этой зависимости в пределах изменения соотношения концентраций компонентов от 1 100 до 100 1. [c.16]
Уравнение окислительного потенциала (в концентрационной форме) впервые приводится в статье Петерса в 1898 г. [54]. Его часто без достаточных к тому основанпй называют уравнением Нернста. Уравнение, выведенное Нерн-стом в 1889 г., представляет собой частный случай уравнения (1.14), когда Ох— это ионы металла пли водорода, а Red — ато.мы металла или молекулы водорода.
Окислительно-восстановительные потенциалы и электроды — Студопедия
Раствор, содержащий одновременно окисленную и восстановленную формы вещества, называют окислительно-восстановительной системой (о/в) системой.
Инертный токопроводящий металл (например, платина или иридий), погруженный в окислительно-восстановительную систему, образует окислительно-восстановительный электрод.
Например: раствор, содержащий соль Cu2+ и соль Cu+ – является окислительно-восстановительной системой.
Cu2+ — окисленная форма;
Cu+ -восстановленная форма.
Электродная реакция
Cu2++1e ↔ Cu+
Примером о/в электрода может служить платиновая пластинка, опущенная в о/в — систему, содержащую окисленную и восстановленную форму вещества.
Рt | Cu2+; Cu+
Стандартный электродный о/в потенциал Е0Сu2+/Cu+ = +0,153 В
Потенциал, возникающий на границе соприкосновения пластинки инертного металла с о/в — системой, называется о/в или red–ox -потенциалом.
На практике определение стандартных о/в потенциалов различных систем проводят по отношению к нормальному водородному электроду при t = 25 °С и рН=0. По этим потенциалам составляют электрохимический ряд активности,который позволяет судить о возможности и направлении о/в процессов.
Чем больше величина стандартного о/в потенциала, тем сильнее окислительные свойства системы.
Чем меньше величина Е0о/в, тем сильнее восстановительные и слабее окислительные свойства вещества.
Величину о/в потенциала рассчитывают по уравнению Нернста-Петерса
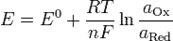
При Т = 298 К уравнение Нернста-Петерса имеет вид
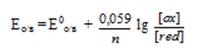
Например, электродный о/в потенциал системы Cu2++1e ↔ Cu+ по уравнению Нернста- Петерса при Т = 298 К равен:

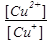 | |||
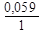 |
Е (Сu2+/Cu) = Е0 (Сu2+/Cu) + lg
По величине стандартных о/в потенциалов можно определять направление самопроизвольного протекания реакций, а также вычислять ЭДС элементов построенных на основе этих реакций.
Чем выше значение стандартного электродного потенциала Е0, тем выше окислительная способность системы, т.е. на этом электроде будет протекать процесс восстановления. На электроде с более отрицательным значением Е0, где выше восстановительная способность системы, протекает процесс окисления.
Например, определим направление реакции:
2Fe3+ + 2I– ↔ 2Fe2+ + I2
Е0 (Fe3+/Fe2+) = 0,77 В – окислитель
Е0 (I2/2I–) = 0,54 В – восстановитель
Потенциал первой системы больше, т.е. способность притягивать электроны у Fe3+ выше, чем у I2. Следовательно, реакция протекает в прямом направлении. Определим ЭДС элемента, построенного на основе этой реакции:
Pt│Fe3+; Fe2+║I—; I2│Pt
ЭДС = 0,77 – 0,54 = 0,23 В.
Электроны перемещаются от более активного о/в электрода (менее положительного)к менее активному о/в электроду (более положительному). Окислительно-восстановительный процесс может протекать в нужном направлении при условии, что ЭДС будет положительна.
Контрольные вопросы
1. Окислительно – восстановительные системы, их классификация.
2. Окислительно-восстановительные электроды. Роль инертного металла в них. Применение в медицине.
3. Окислительно-восстановительные потенциалы.
4. Уравнение Нернста – Петерса для простых и сложных окислительно-восстановительных систем, его анализ.
5. Направление окислительно-восстановительных процессов.
Типовые задачи
Задача1. Рассчитать величину О-В потенциала электрода Pt/ Fe3+, Fe2+, если при 25 0 С
а (Fe3+) = 0,04 моль/дм3; а (Fe2+) = 0,012 моль/дм3. Е0 (Fe3+/ Fe2+) = + 0, 77 В (см. Приложение 3.5.)
Решение:
Е (Fe3+/ Fe2+) = Е0 (Fe3+/ Fe2+) + 0,059 ·1g [Fe3+] /[Fe2+]
Е (Fe3+/ Fe2+) = Е0 (Fe3+/ Fe2+) + 0,059 ·lg 0,04 / 0,012 = 0,77 + 0,059·0,52 = 0,77+0,03 = 0,8 B
Ответ: Е (Fe3+/ Fe2+) = 0,8 В
Задача 2. Электродный потенциал системы Со3+ + 1 е ↔ Со2+ равен Е (Co3+/Co2+) = +1,7 В при Т =298 К. Определите величину соотношения концентраций [Со 3+]/[Со2+], если Е0 (Co3+/Co2+) = +1,81 В (см. Приложение 3.5.).
Решение:
Е (Co3+/Co2+) = Е0 (Co3+/Co2+) + 0,059·1g [Со3+] / [Со2+]
Подставим значения:
1,7 = 1,81 + 0,059 ·1g [Со3+] / [Со2+]
1,7 – 1,81 = 0,059 ·1g [Со3+] / [Со2+]
– 0,1 = 0,059 ·1g [Со 3+] / [Со2+]
1g [Со3+] / [Со 2+] = -0,11 / 0,059 = – 1,86
[Со3+] / [Со2+] = 10 –1,86 = 0,014
Ответ: соотношение концентраций [Со3+] / [Со2+] = 0,014
Задача 3. Определить концентрацию ионов Sn4+ в растворе, содержащем 0,05 моль ионов Sn2+, если Е (Sn4+/Sn2+) = 0,21 В, Е0 (Sn4+/ Sn2+) = 0,15 В.
Решение:
Е (Sn4+/Sn2+) = Е0 (Sn4+/Sn2+) + 0,0295 lg [Sn4+] / [ Sn2+]
0,21 = 0,15 + 0,0295 · lg [Sn4+] / 0,05
0,21 – 0,15 = 0,0295 · lg [Sn4+] / 0,05
lg [Sn4+] / 0,05 = 2,03
[Sn4+] / 0,05 = 10 2,03
[Sn4+] / 0,05 = 107,15
[Sn4+] = 5,36 моль/дм3
Ответ: [Sn4+] = 5,36 моль/дм3
Тестовые задания для самоконтроля
Выберите правильный вариант ответа
01. РЕАКЦИЯ НЕ ЯВЛЯЕТСЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ
1) Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
2) СaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
3) 2NO2+H5IO6 = 2 HNO3 + HIO3+H2O
4) Cl2 + 2NaOH = NaCl + NaClO + H2O
02. ПРИ КОНТАКТЕ О/В СИСТЕМ:
Cd2++ 2 ē↔ Cd0 ; Е0 (Cd2+/Cd0) = – 0,403 В
Cu+ + ē ↔Cu0; Е0 (Cu+/Cu0) = + 0,521 В ОКИСЛИТЕЛЕМ ЯВЛЯЕТСЯ
1) Cd2+
2) Cd0
3) Cu+
4) Cu0
03. НАИБОЛЕЕ СИЛЬНЫЕ ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА ПРОЯВЛЯЕТ СИСТЕМА
1) Сu2+ + е ↔Сu+ Е0 = 0,54В
2) Cr3+ + е ↔ Cr 2+ Е0 = – 0,41В
3) I2 + 2е ↔2 I– Е0 = 0,53В
4) Н2О2 + 2Н+ +2е ↔ 2Н2О Е0 = 1,77В
04.СРЕДИ ПРИВЕДЕННЫХ ЭЛЕКТРОДОВ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМИ ЯВЛЯЮТСЯ
а) Pt|Co3+, Co2+ б) Fe|Fe2+ в) Ag+|Ag г) Cu|Cu2+ д) Pt|Cu2+,Cu+
1) б, в, г
2) а, д
3) г, д
4) а, б, в, г, д
05. СЛОЖНОЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ СИСТЕМОЙ ЯВЛЯЕТСЯ
1) Сu2+ +е ↔Сu+ Е0 = 0,54В
2) Cr 3+ +е ↔ Cr 2+ Е0= – 0,41В
3) I2 +2е ↔2 I– Е0 = 0,53В
4) Н2О2 +2Н+ +2е ↔ 2Н2О Е0 = 1,77В
Вывод уравнения Нернста — Студопедия
Электродные потенциалы. Электрод. Абсолютный и относительный электродный потенциалы. Водородная шкала относительных электродных потенциалов. Факторы, влияющие на величину относительного электродного потенциала (уравнение Нернста).
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение электродного потенциала обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Электрод — часть электрохимической системы, включающая в себя (металлический) проводник и окружающий его раствор (например, Водородный электрод, Хлорсеребряный электрод, Электрод сравнения). Проводник, посредством которого часть электрической цепи, образуемая проводами, соединяется с частью цепи, проходящей в неметаллической среде (ионной жидкости, ионизированном газе и т.п.).
Положительный электрод – анод.
Отрицательный электрод – катод.
Если электродная реакция, записанная в сторону восстановления, является самопроизвольной, то потенциал электрода положителен.
Электродный потенциал в электрохимии — разность электрических потенциалов на границе фаз электрод — электролит. На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода сравнения (напр., нормального водородного). Абсолютное значение электродного потенциала измерить невозможно, поэтому измеряют всегда разность электродных потенциалов — относительный электродный потенциал. Если электродная реакция проходит в равновесных обратимых условиях (при токе, стремящемся к нулю), скачок потенциала между электродом и электролитом называют равновесным потенциалом.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
 ,
,
где
Если в формулу Нернста подставить числовые значения констант 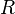 и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим
Уравнение Петерса — Справочник химика 21
Поскольку в концентрационном члене уравнения Нернста — Петерса в числителе находятся концентрации исходных веществ, то при записи полуреакции всегда в форме [c.127]Не только комплексообразование изменяет потенциал редокспар. Присутствие любых электролитов, вследствие увеличения ионной силы раствора, вызывает отклонение активностей растворенных веществ от их стехиометрических концентраций. И хотя принято в уравнение Нернста — Петерса подставлять молярные концентрации окисленной и восстановленной форм, -но молярная концентрация равна активности только в очень разбавленных растворах, во всех остальных случаях следует пользоваться уравнением Нернста — Петерса в такой форме [c.135]
Уравнения Нернста типа (6.1>—(6.5 ) и т.д. для окислительно-восстановительных потенциалов иногда называют уравнениями Нернста— Петерса или просто уравнениями Петерса. Уравнения этого типа, выраженные через концентрации, а не через активности, впервые вывел для электродных потенциалов немецкий физико-химик Вальтер Нернст в 1888 г. (тогда понятие активность еще не было известно) на основании своей осмотической теории элеиродных потенциалов. Р. Петерс, сотрудник известного немецкого физико-химика В. Оствальда, показал в 1889 г. применимость уравнения Нернста дш1 окислительно-восстановительных систем. [c.154]
Указанные ограничения могут быть ослаблены, так как на основе рас-суждений, которые использовались при выводе (5.26), получается система уравнений более общего вида (Петерс [1984]) [c.197]
Способность формы Ared отщеплять электроны и превращаться в форму Аох выражается через ОВ-потенциал пары Аох, Ared, который может быть вычислен по уравнению Нернста — Петерса [c.160]
При /(=16 кривые делятся на две независимые одноэлектронные ступени. Каждая из эти.х двух ступеней может быть описана отдельно при помощи уравнения Петерса [c.250]
Уравнение (1) в его первоначальной форме было предложено Петерсом [46]. Условие обратимости удовлетворяется, если [c.229]
Формула Нернста справедлива для электродов первого рода, и область ее применения ограничена электродами этого типа. Необходимо отметить, что подобную ограниченность не следует считать непреодолимым недостатком теории Нернста. Так, Петерс(1898) показал, что исходя из основных представлений Нернста, можно получить уравнение для редокси-электродов. Идеи Нернста были развиты [c.218]
Формула Нернста справедлива для электродов первого рода, и область ее применения ограничена электродами этого типа. Необходимо, однако, отметить, что эту ограниченность не следует считать непреодолимым недостатком теории Нернста. Так, например-Петерс (1898) показал, что используя основные представления, Нернста, можно получить уравнение для редокси-электродов. Идеи Нернста были развиты в работах Батлера (1924), которому удалось кинетическим путем вывести уравнение для различных типов электродов. [c.215]
Из анализа уравнений Петерса следует, что ОВ-потенциал зависит от природы ОВ-системы (эта зависимость определяется величиной ф ), соотношения концентраций окисленной и восстановленной форм и температуры, а для ОВ-систем 2-го типа— также еще и от активности ионов водорода в растворе. Из уравнений Петерса, кроме того, следует, что ОВ-потенциал не зависит от природы инертного металла, а в общем случае — от природы фазы с электронной проводимостью, следовательно, уравнения Петерса должны быть справедливы не только для границы раздела инертный металл — окислительно-восстановительная система, но и для границы полупроводник (электронный) — ОВ-снстема. [c.481]
Для лучшего описания экспериментальных данных было предложено много эмпирических вариантов уравнения Фрейндлиха. В качестве примера укажем работы Петерса [ ] и Роджерса и Скляра [ ]. [c.87]
Приведенное уравнение называют уравнением Нерн-ста—Петерса. Оно выражает зависимость окислительновосстановительного потенциала от концентрации окислителя и восстановителя и от температуры. Концентра-дионный член уравнения можно представить как лога- [c.125]
НЫХ комплексных соединений, до недавнего времени были практически ограничены аргентометрией и меркуриметрией. Причиной этого ограничения является то, что только небольшое число металлических электродов реагирует правильно на концентрацию своих ионов в растворе в соответствии с уравнением Нернста. Кроме того, работа с такими электродами встречает экспериментальные затруднения. В этом отношении даже от комнлексонов нельзя ожидать суш[ественного расширения области применения таких определений. Совершенно другое положение имеет место в случае методов, основанных на измерении окислительно-восстановительных потенциалов с помощью инертных электродов из благородных металлов. Потенциал платинового электрода в растворе, содержат,ем высшую окисленную и низшую восстановленную формы, дается уравнением Петерса [c.384]
Яркой иллюстрацией влияния ошибки, возникающей в тех случаях, когда не учитываются коэффициенты активности, могут служить результаты, полученные Петерсом в 1898 г. в одном из наиболее ранних количественных исследований обратимых окислительно-восстановительных электродов. Исходя из измерений, проведенных в растворах, содержавших в разных соотношениях хлористое и хлорное железо в 0,1 н. растворе соляной кислоты, Петерс—для стандартного потенциала системы, содержащей двух- и трехвалентное железо— пользуясь вместо отношения активностей отношением концентраций, получил примерно постоянное значение 0,713 в при 17°. В течение нескольких лет этот результат считался правильным, хотя он отличается примерно на 0,07 в от значений стандартного потенциала этой системы, найденных в последнее время. Это расхождение близко к величине той поправки на коэффициенты активности, которая может быть вычислена с помощью уравнения (7), принимая величину ионной силы равной 0,25, что примерно соответствует ионной силе исследованных Петерсом растворов. На самом деле приближенное уравнение Дебая — Гюккеля для столь высокой ионной силы неверно, однако интересно отметить, что оно дает правильный порядок величины поправки, учитывающей активность. [c.367]
Уравнение Петерса. Количественная зависимость ОВ-потенциала от природы ОВ-системы, соотношення активностей окисленной и восстановленной форм, температуры и от активности ионов водорода для систем 1-го и 2-го типа устанавливается уравнениями Оетерса [c.480]
В окислительно-восстановительных реакциях имеется возможность воздействия на редокспотенциал участвующих в реакции пар. Действительно, если согласно уравнению Нернста—Петерса редокспотенциал тем выше, чем больше активность (концентрация) окисленной формы данной пары и, наоборот, тем ниже, чем меньше эта концентрация и выше концентрация восстановленной формы [c.132]
Уравнение нернста петерса — Медицина
18.1. Общая характеристика неравновесных явлений в растворах электролитов.
Рассмотренные ранее (в гл.12) ион-дипольное и ион-ионное взаимодействия относятся к равновесному состоянию раствора, когда оно не изменяется во времени и раствор не подвергается внешнему воздействию. Однако равновесие в растворах электролитов всегда является динамическим, усредненным по времени и по объему. Неравновесные явления в растворах электролитов можно вызвать следующими способами:
изменением концентрации (активности) растворенного вещества в одной части раствора по отношению к другой без изменения химического состава раствора;
наложением электрического поля, которое вызовет направленное перемещение заряженных частиц;
изменением состава раствора по отношению к равновесной концентрации возможных для данной системы веществ.
В первом случае количество перескоков частицы i в единицу времени в направлении уменьшения ее концентрации оказывается больше, чем в обратном направлении, в результате чего возникает диффузионный поток частиц i . Очевидно подобный поток возникает при электролизе.
Во втором случае положение электрического поля изменяет вероятность перескоков заряженных частиц по полю и против поля, в результате чего возникают потоки миграции катионов и анионов, что составляет основу электропроводности электролитов.
В третьем случае изменение состава раствора нарушает ионное равновесие и вызывает химическую реакцию, в ходе которой происходит восстановление ионного равновесия. Ионные реакции в растворах электролитов представляют собой частный случай гомогенных химических реакций и изучаются химической кинетикой. Отличительная особенность – высокая скорость таких реакций и во многих случаях нулевая энергия активации (например, реакция нейтрализации).
18.2. Диффузия и миграция ионов.
Поток диффузии jd ,т.е. количество частиц, диффундирующих через единичную площадь в единицу времени, пропорционален концентрации этих частицCiи градиенту химического потенциала
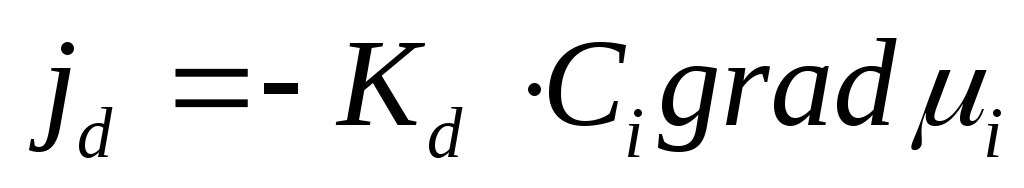
где Kd– константа пропорциональности. Так как 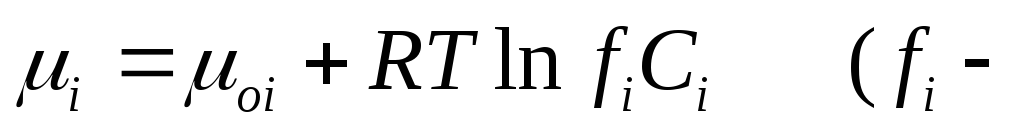 коэффициент активности) и для одномерного случая
коэффициент активности) и для одномерного случая
 — координата), то легко получить закон Фика :
— координата), то легко получить закон Фика :
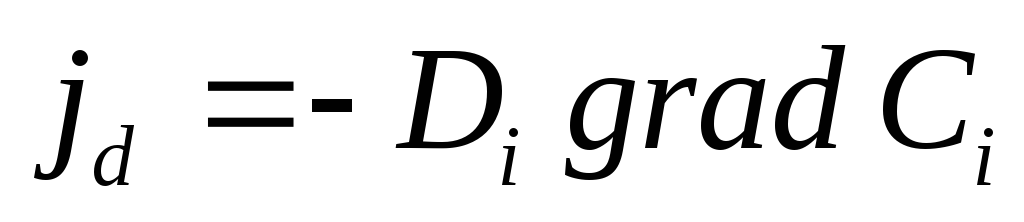
где коэффициент диффузии Di равен

Поток миграции jm пропорционален концентрации ионов Ci и градиенту электрического потенциала
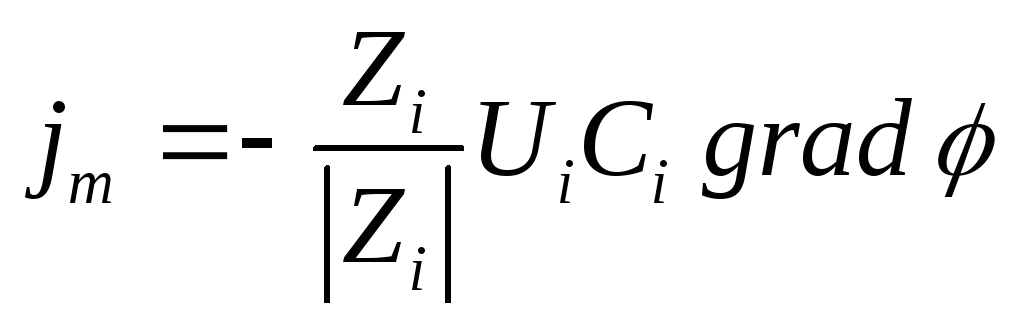
Константой пропорциональности здесь является величина Ui , называемая электрической подвижностью иона, которая определяет среднюю скорость движения иона при единичном градиенте электрического потенциала (или напряженности поля в В/м или В/см).
В общем случае ион движется под действием обоих градиентов и суммарный поток
j = jd + jm
а общей движущей силой является градиент электрохимического потенциала (см. ниже) ηi :

где F – число Фарадея, численно равное заряду 1 моля электронов
(F = 96487 Кл/моль).
Если  то j = 0 т.е. ионы не перемещаются в растворе, т.е. jd + jm = 0 и gradμi = —ZiFgradφ
то j = 0 т.е. ионы не перемещаются в растворе, т.е. jd + jm = 0 и gradμi = —ZiFgradφ
Отсюда
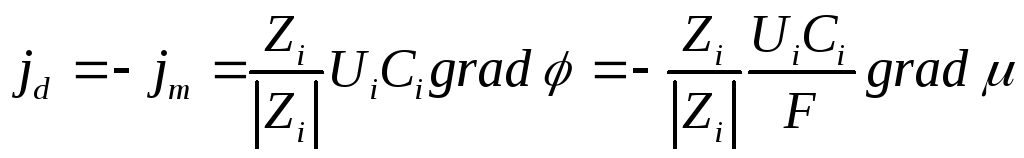
Следовательно 

При 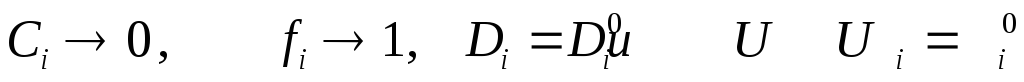
Итак
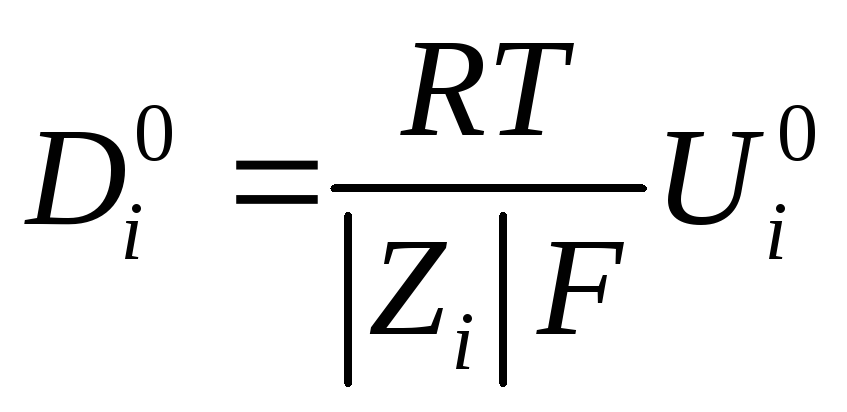
Это уравнение Нернста – Эйнштейна связывает коэффициент диффузии иона с его электрической подвижностью.
18.3. Диффузионный потенциал.
Пусть электролит  который полностью диссоциирует на ионыKZ+ иAZ—,диффундирует из области с концентрациейC1в область с концентрациейC2 (C1>C2). ЕслиD+=D—,то процесс не отличается от обычной диффузии незаряженных частиц, но еслиD+≠D—, то возникают специфические явления.Дело в том. что более подвижный ион обгоняет менее подвижный до тех пор, пока образовавшееся электрическое поле не уравняет их скорости (
который полностью диссоциирует на ионыKZ+ иAZ—,диффундирует из области с концентрациейC1в область с концентрациейC2 (C1>C2). ЕслиD+=D—,то процесс не отличается от обычной диффузии незаряженных частиц, но еслиD+≠D—, то возникают специфические явления.Дело в том. что более подвижный ион обгоняет менее подвижный до тех пор, пока образовавшееся электрическое поле не уравняет их скорости ( ) и уже в этом случае можно говорить об общем потоке электролита, однако это не обычный поток диффузии, поскольку между двумя областями раствора с концентрациямиС1 иС2устанавливается стационарная разность потенциалов
) и уже в этом случае можно говорить об общем потоке электролита, однако это не обычный поток диффузии, поскольку между двумя областями раствора с концентрациямиС1 иС2устанавливается стационарная разность потенциалов
 — диффузионный потенциал.
— диффузионный потенциал.
Если уравнение Нернста – Эйнштейна справедливо при конечных концентрациях ионов KZ+ иAZ—, то для потоков катионов и анионов

Скорость перемещения иона 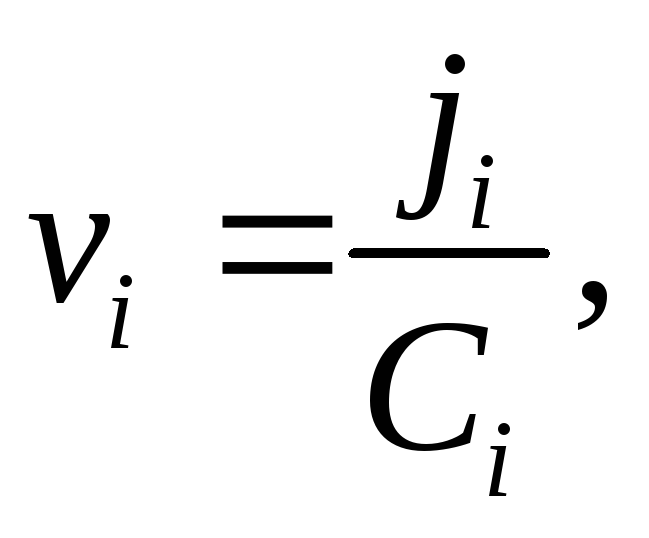 но в стационарных условиях
но в стационарных условиях
 т.е.
т.е. т.е.
т.е.
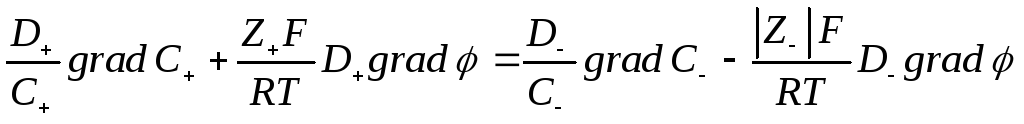
Так как  то
то
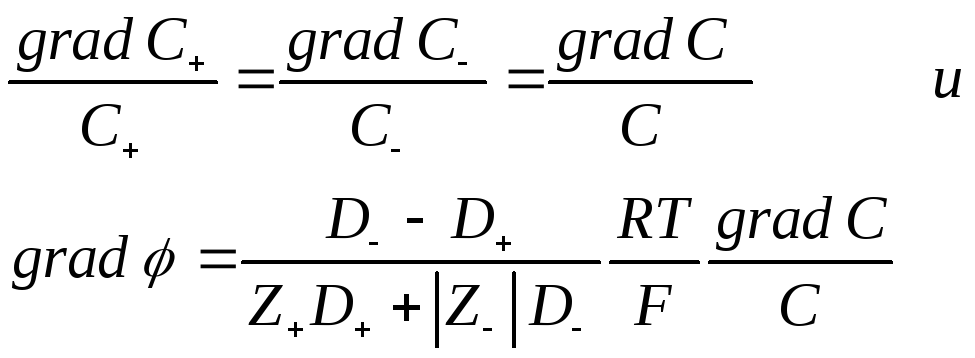
Интегрирование в пределах от С1 доС2дает


18.4. Удельная и эквивалентная электропроводности в растворах электролитов.
Электропроводность раствора электролита обеспечивается за счет потоков миграции ионов, присутствующих в растворе, но эксперимент необходимо проводить так, чтобы не возникал градиент химического потенциала, что достигается использованием переменного тока. Как и для обычных проводников, сопротивление растворов рассчитывается по формуле

где ρ – удельное сопротивление, l— расстояние между электродами,S– площадь электродов. Величина 1/ρ=χназывается удельной электропроводностью, ее размерностьОм-1·м-1 (Ом-1·см-1) илиСн/м(Сн/см), где
1/ρ=χназывается удельной электропроводностью, ее размерностьОм-1·м-1 (Ом-1·см-1) илиСн/м(Сн/см), где
Сн– симекс. Удельная электропроводность характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь 1 м2(или 1 см2) и расположенными на расстоянии 1 м
(или 1 см) друг от друга. При С → 0 величина χстремится к удельной электропроводности чистой воды (примерно 10-5Сн/м). С ростом концентрации электролитаχсначала возрастает в связи с увеличением числа ионов в растворе, однако с ростом концентрации начинает проявляться ион-ионное взаимодействие, приводящее к замедлению движения ионов, а также к их ассоциации. Поэтому почти всегда зависимость удельной электропроводности от концентрации электролита проходит через максимум.
Чтобы выделить эффект ион – ионного взаимодействия удельную электропроводность χделят наZ+ν+C, гдеС – число молей в единице объема
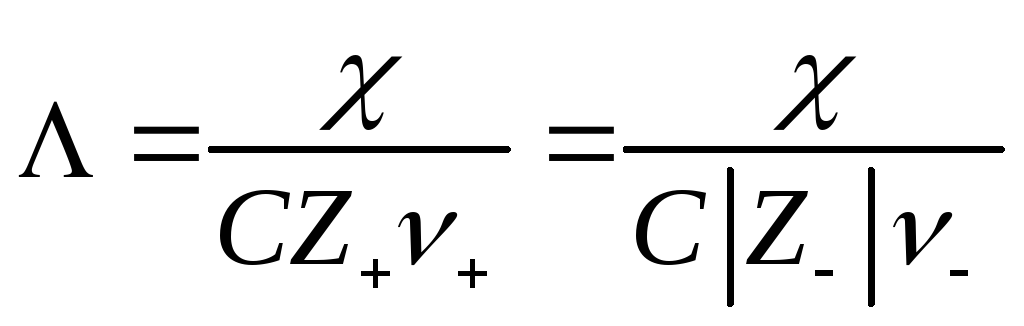
Величина Λ называется эквивалентной электропроводностью: она представляет собой электропроводность объема электролита, содержащего 1 г-экв растворенного вещества и находящегося между двумя параллельными электродами, расположенными на расстоянии 1 м (1 см) друг от друга. Чем меньше концентрация раствора, тем больший его объем приходится на 1 г-экв и, следовательно, тем большая площадь электродов покрыта раствором. Таким образом, уменьшение числа носителей тока в единице объема раствора с его разведением компенсируется увеличением поперечного сечения. Если бы потоки миграции не зависели бы от ион-ионного взаимодействия, то Λ оставалась бы постоянной при всех концентрациях. В реальных системах эквивалентная электропроводность зависит от концентрации, а при С →0 величина Λ стремится к своему предельному значению Λ0, отвечающему отсутствию ион-ионного взаимодействия. В растворах слабых электролитов, где ион-ионное взаимодействие приводит к образованию нейтральных молекул уже при очень низких концентрациях ионов, выход Λ на предельное значение экспериментально наблюдать не удается.
Пример. Электропроводности pаствора КСlпри 250С.
С, моль/л | моль/м3 | χ, См/м | Λ, См·м2/моль |
1 | 103 | 11,19 | 0,01119 |
0,1 | 102 | 1,289 | 0,01289 |
0,01 | 10 | 0,1413 | 0,01413 |
0,001 | 1 | 0,01469 | 0,01469 |
0,0001 | 10-1 | 0,001489 | 0,01489 |
В растворе электролита ток переносится катионами и анионами, поэтому при
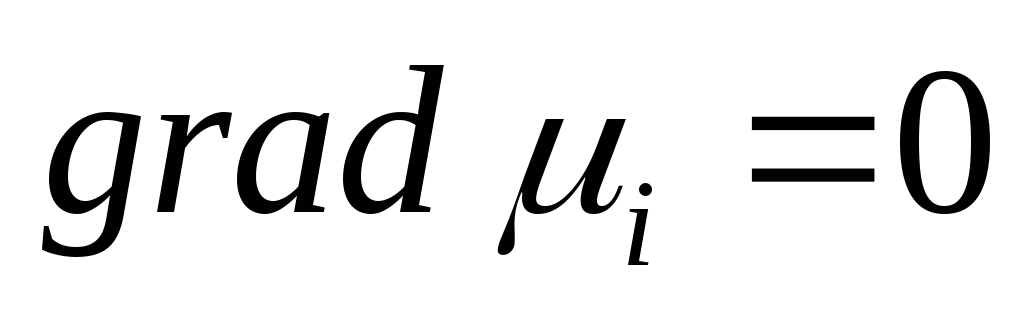 для плотности тока можно записать
для плотности тока можно записать

Для слабого электролита со степенью диссоциации α по условию электронейтральности раствора имеем
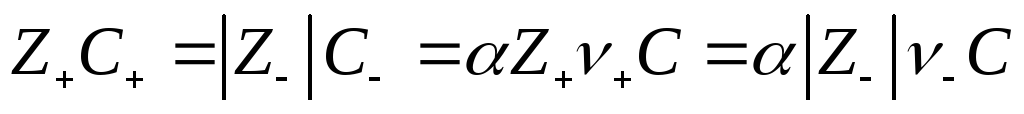 и
и

С другой стороны, по закону Ома

Следовательно,

где величины 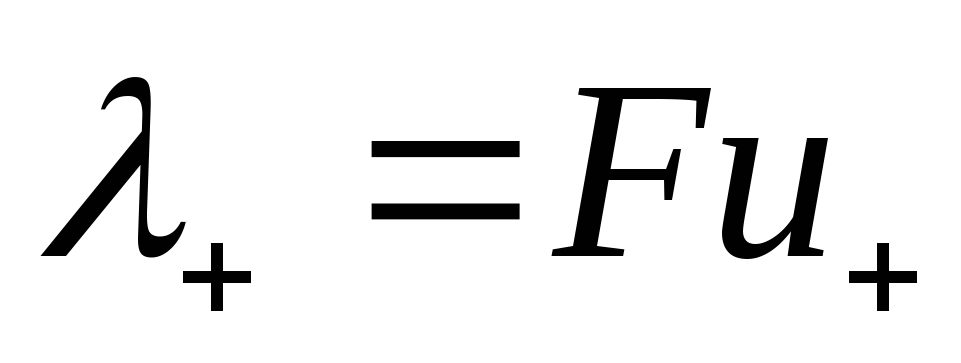 и
и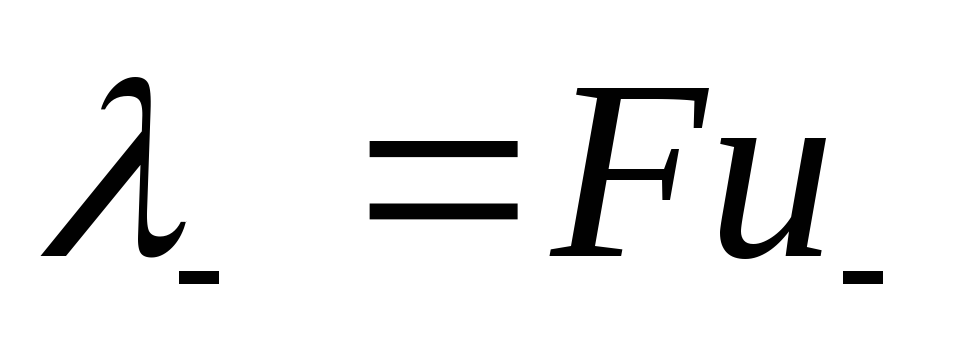 называются ионными электропроводностями (или подвижностями ) ионов. В растворах сильных электролитов α =1 и
называются ионными электропроводностями (или подвижностями ) ионов. В растворах сильных электролитов α =1 и
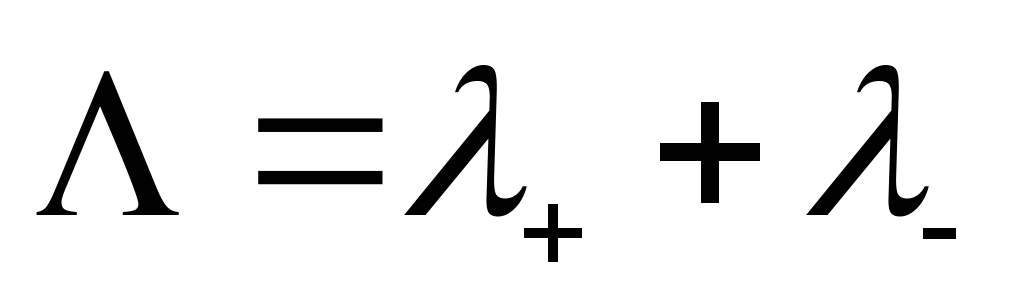
а при бесконечном разведении, когда α→1

где  и
и предельные электропроводности (или подвижности) ионов.
предельные электропроводности (или подвижности) ионов.
Последние три уравнения представляют собой закон Кольрауша, сущность которого состоит в том, что в растворе электролита катионы и анионы переносят электрический ток независимо друг от друга.
В теории Аррениуса предполагалось (гл.12), что подвижность ионов не зависит от концентрации, при этом допущении

однако это справедливо только для разбавленных растворов слабых электролитов. Для последних с учетом закона разведения Оствальда (см. гл.12) можно показать, что 
но для разбавленных растворов сильных электролитов Кольраушем было получено эмпирическое соотношение

которое находится в противоречии с теорией Аррениуса.
18.5. Числа переноса ионов.
Согласно закону Кольрауша эквивалентная электропроводность определяется суммой электропроводностей катиона и аниона, следовательно для нахождения подвижности отдельного иона необходимо дополнительно определить долю тока, переносимую ионами данного вида. Эта доля и называется числом переноса ионов. Для бинарного электролита число переноса
катиона:

аниона:

В таком растворе, очевидно,  а при подстановке величин
а при подстановке величин
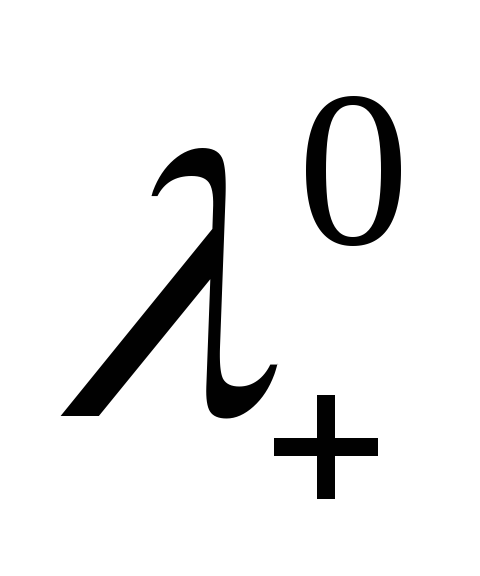 иполучаем предельные числа переноса
иполучаем предельные числа переноса и
и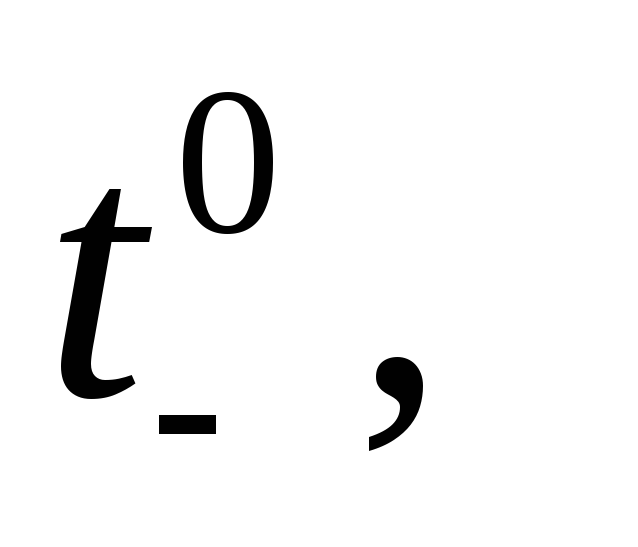 которые определяют долю тока, переносимую катионами и анионами при отсутствии ион-ионного взаимодействия и, вообще говоря,
которые определяют долю тока, переносимую катионами и анионами при отсутствии ион-ионного взаимодействия и, вообще говоря,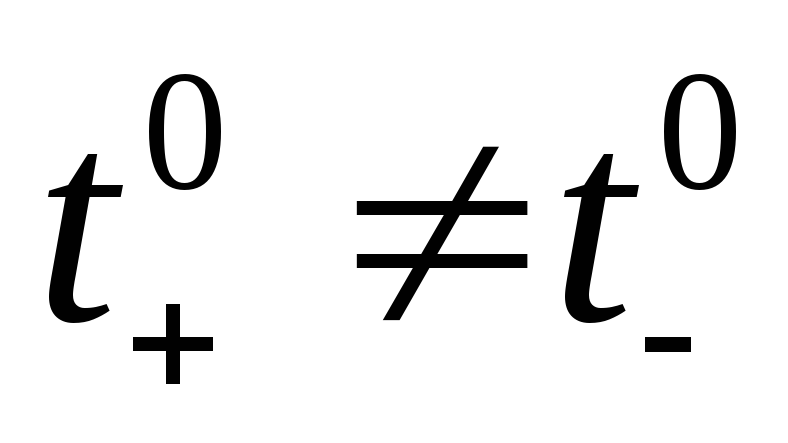 .
.
Существуют следующие экспериментальные методы определения чисел переноса.
Метод Гитторфа, основанный на определении концентрации электролита у катода и у анода после пропускания через раствор определенного количества электричества.
Метод движущейся границы, основанный на смещении границы раздела двух растворов, имеющих общий ион, после пропускания через систему определенного количества электричества.
Измерение диффузионного потенциала (см. следующую главу) поскольку

Из эксперимента следует, что числа переноса зависят от концентрации электролита, а экстраполяция на нулевую концентрацию дает предельные числа переноса 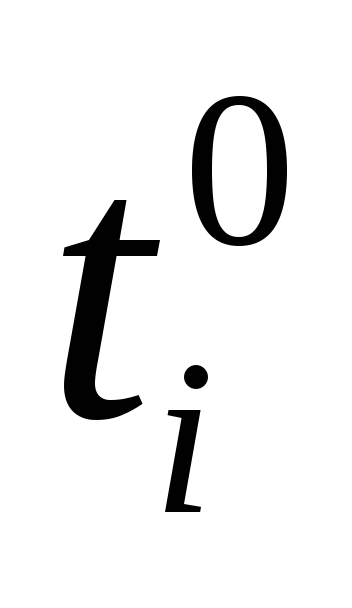 . Эти величины для водных растворов хлоридов металлов следующие (250С)
. Эти величины для водных растворов хлоридов металлов следующие (250С)
Электролит | LiCl | NaCl | KCl | RbCl | CsCl |
| 0,336 | 0,396 | 0,490 | 0,505 | 0,503 |
| 0,664 | 0,604 | 0,510 | 0,495 | 0,497 |
Если электролит полностью диссоциирован, то наблюдаются следующие закономерности зависимости tiот концентрации. Если , то при увеличении концентрацииti практически не изменяется. Если
, то при увеличении концентрацииti практически не изменяется. Если  , то с ростом концентрации число переноса уменьшается, а если
, то с ростом концентрации число переноса уменьшается, а если  число переноса увеличивается.Повышение же температуры мало влияет на число переноса:
число переноса увеличивается.Повышение же температуры мало влияет на число переноса:
Электролит |
| |||
0 | 25 | 45 | 100 | |
LiCl | 0,321 | 0,336 | 0,347 | 0,352 |
NaCl | 0,393 | 0,396 | 0,404 | 0,406 |
KCl | 0,498 | 0,490 | 0,487 | 0,479 |
18.6. Предельная электропроводность ионов.
Предельная эквивалентная электропроводность раствора электролита и предельные числа переноса позволяют определить предельные электропроводности отдельных ионов :

Пример. Предельные электропроводности ионов в воде при различных температурах.
Ион |
| |||||
0 0 | 18 0 | 25 0 | 45 0 | 100 0 | ||
Li+ | 19,4 | 32,8 | 38,7 | 58,0 | 115 | |
Na+ | 26,5 | 42,8 | 50,1 | 73,7 | 145 | |
K+ | 40,7 | 63,9 | 73,5 | 103,5 | 195 | |
Rb+ | 43,9 | 66,5 | 77,8 | 108,6 | — | |
Cs+ | 44,0 | 67,0 | 77,3 | 107,5 | — | |
H+(H3O+) | 225 | 315 | 349,8 | 441,4 | 630 | |
F— | — | 47,4 | 55,4 | — | — | |
Cl— | 41,0 | 66,0 | 76,4 | 108,9 | 212 | |
Br— | 42,6 | 68,0 | 78,1 | 110,7 | — | |
I— | 41,4 | 66,5 | 76,8 | 108,6 | — | |
CH3COO— | 20,1 | 35,0 | 40,9 | — | — | |
OH— | 105 | 171 | 198,3 | — | 450 | |
В поведении ионов при бесконечном разведении имеются две закономерности : 1) увеличение подвижности при повышении температуры; 2) наличие максимума на зависимости  от кристаллографического радиуса иона. Для качественного объяснения можно провести аналогию между миграцией иона под действием электрического поля и движением макроскопического шарика в вязкой жидкости. Согласно закону Стокса скорость движенияvтвердого шарика в вязкой жидкости под действием силыФвыражается уравнением :
от кристаллографического радиуса иона. Для качественного объяснения можно провести аналогию между миграцией иона под действием электрического поля и движением макроскопического шарика в вязкой жидкости. Согласно закону Стокса скорость движенияvтвердого шарика в вязкой жидкости под действием силыФвыражается уравнением :
где η – вязкость жидкости, r– радиус шарика. Сила, действующая на заряд
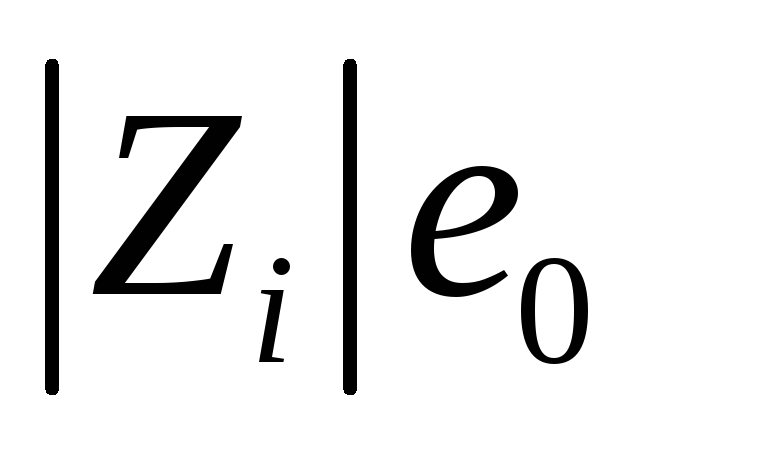 (е0– заряд электрона) в полеХравна
(е0– заряд электрона) в полеХравна а средняя скорость движения иона в бесконечно разбавленном растворе
а средняя скорость движения иона в бесконечно разбавленном растворе . Отсюда с использованием уравнения Стокса получаем:
. Отсюда с использованием уравнения Стокса получаем:
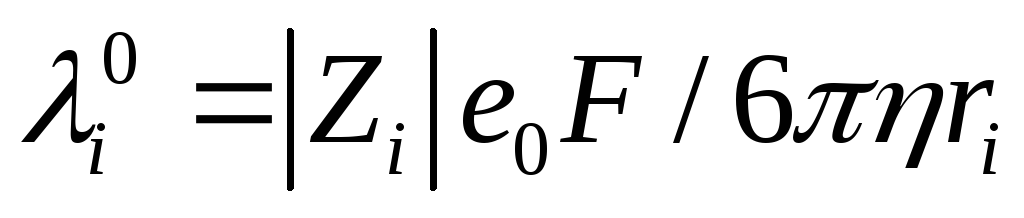
Ионы в растворе окружены гидратной оболочкой, которая движется вместе с ионом. Поскольку ион небольшого кристаллографического радиуса (Li+) гидратирован в большей степени, чем, например,Na+или К+, то различие в радиусах гидратированных ионов сравнительно невелико. Можно, рассчитавri по последней формуле, вычислить объем гидратированного иона, затем за вычетом кристаллографического объема иона, определить объем гидратной оболочкиVS
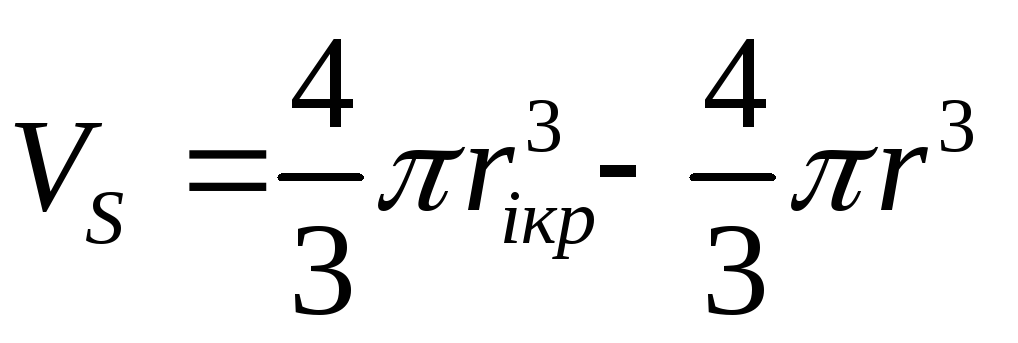
Так как объем молекулы воды составляет величину около 30 Ǻ3, то не составляет труда вычислить среднее число молекул воды  в гидратной оболочке :
в гидратной оболочке :
Ион | Na+ | Li+ | Be2+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | Zn2+ | La3+ |
| 5 | 7 | 13-14 | 12 | 10 | 10 | 9-10 | 12 | 13-14 |
Увеличение электропроводности с ростом температуры с уменьшением вязкости среды и правило Вальдена Писаржевского должно быть справедливо, если в данном интервале температурri =const.
должно быть справедливо, если в данном интервале температурri =const.
Пример. Ацетат – ион в воде
t, 0C | 0 | 18 | 25 | 59 | 75 | 100 | 128 | 153 |
| 0,366 | 0,368 | 0,366 | 0,368 | 0,369 | 0,368 | 0,369 | 0,369 |
Для других растворителей правило Вальдена также справедливо.
С помощью уравнения Нернста-Эйнштейна можно увязать коэфициент диффузии иона при С→ 0 с предельной электропроводностью иона :

а также получить уравнение Стокса-Эйнштейна :
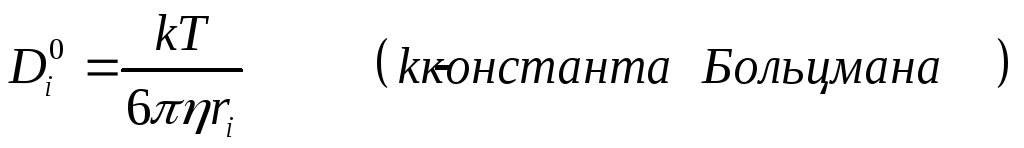
Ионы водорода и гидроксила обладают более высокой подвижностью, чем другие ионы, очевидно, что механизм миграции здесь другой.
Заметим, во-первых, протон локализуется на молекуле воды, образуя ион гидроксония Н3О+, во-вторых, ион гидроксония окружен гидратной оболочкой из 3-4 молекул воды, образуя комплекс Н9О4+. Мало вероятно, что такой комплекс будет более подвижен, чем гидратированный ионNa+. Поэтому предлагается эстафетный или гротгусовский механизм перемещения протона : перескок протона от Н3О+к ориентированной соответствующим образом молекуле воды

Аномально высокая подвижность ионов гидроксила также объясняется перескоком протона:

Так как протон в молекуле воды связан более прочно, чем в ионе гидроксония, то подвижность ионов гидроксила оказывается ниже, чем подвижность иона водорода.
18.7. Ионная атмосфера и зависимость электропроводности от концентрации.
Дебай и Гюккель объяснили закон Кольрауша  наличием ионной атмосферы (см. гл.12), плотность которой увеличивается с повышением концентрации электролита. В неравновесных условиях существование ионной атмосферы обусловливает два эффекта, тормозящих движение центрального иона, которые называются электрофоретическим или релаксационным эффектами.
наличием ионной атмосферы (см. гл.12), плотность которой увеличивается с повышением концентрации электролита. В неравновесных условиях существование ионной атмосферы обусловливает два эффекта, тормозящих движение центрального иона, которые называются электрофоретическим или релаксационным эффектами.
Электрофоретический эффект связан с тем, что ион под действием внешнего элетрического поля перемещается не в неподвижной среде, а в потоке движущихся навстречу ему противоионов, составляющих ионную атмосферу. Следовательно, из предельной подвижности иона следует вычесть подвижность ионной атмосферы, которую можно рассчитать, подставив радиус ионной атмосферы (гл. 12) в уравнение  , полученное нами в предыдущем параграфе.
, полученное нами в предыдущем параграфе.
Релаксационный эффект обусловлен конечным временем разрушения ионной атмосферы. В результате этого центр заряда ионной атмосферы в неравновесных условиях оказывается смещенным на некоторое расстояние позади от движущегося центрального иона. Таким образом возникает некоторая тормозящая электростатическая сила.
Онзагер показал теоретически, что для электролита типа 1 – 1 зависимость электропроводности от концентрации можно представить выражением

Оценка показывает , что электрофоретический эффект дает примерно 2/3 общего понижения электропроводности из-за ион-ионного взаимодействия, а на долю релаксационного эффекта приходится около 1/3 от 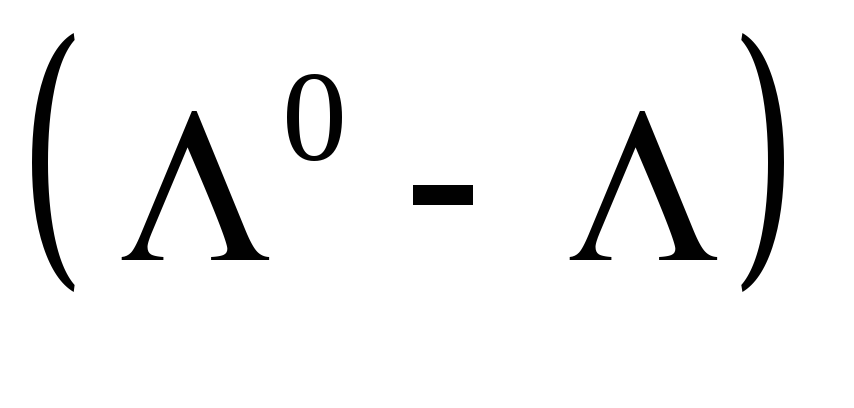 .
.
Теория Дебая –Гюккеля-Онзагера позволяет интерпретировать ряд экспериментальных фактов. В 1927 году Вин обнаружил, что при напряженностях поля порядка 200000 – 400000 В/см после резкого возрастания электропроводность выходит на свое предельное значение Λ0, что находится в противоречии с законом Ома. Но согласно теории Дебая –Гюккеля-Онзагера в этих условиях скорость движения иона становится настолько большой, что ионная атмосфера не успевает образовываться и ее тормозящее действие исчезает. Теоретическая оценка величины напряженности поля дает значение, соответствующее экспериментально наблюдаемому.
В 1928 г. Дебай и Фалькенхаген показали, что при достаточно высокой частоте переменного тока вззаимное смещение иона и ионной атмосферы настолько мало, что ионная атмосфера практически симметрична и эффект релаксации должен исчезнуть. Действительно для солей типа 1 – 1 при С = 0,001 эффект Дебая – Фалькенхагена проявляется при частоте 109Гц. Более того, увеличение электропроводности в эффекте Дебая – Фалькенхагена составляет примерно 1/3 от увеличения Λ в эффекте Вина, как это и следует из теоретической оценки.
Источник: studfile.net
Читайте также
Уравнение Петерса.
Количественная зависимость ОВ – потенциала от природы ОВ – системы (φ°r), соотношения активностей окисленной и восстановленной форм, температуры, и от активности ионов водорода устанавливается уравнением Петерса.
RT а(OX)
1-ый тип: φr = φ°r + ∙ ln
zF a(RED)
mRT a(OX)a(H+)
2-ой тип: φr = φ°r + ∙ ln
zF a(RED)
где φr — ОВ — потенциал, В;
φ°r — стандартный ОВ — потенциал, В;
z – число электронов, участвующих в ОВ – процессе;
а (Ох) – активность окисленной формы, моль/л;
а (Red) – активность восстановительной формы, моль/л;
m — число протонов;
а(н+) – активность ионов водорода, моль/л.
Стандартным ОВ – потенциалом называют потенциал, возникающий на границе раздела инертный металл – раствор, в котором активность окисленной формы равна активности восстановленной формы, а для системы второго типа, кроме того, активность ионов водорода равна единице.
Классификация обратимых электродов.
Рассмотрев принцип работы электродов можно сделать вывод, что по свойствам веществ, участвующих в потенциалоопределяющих процессах, а также по устройству все обратимые электроды делят на следующие группы:
электроды первого рода;
электроды второго рода;
ионоселективные электроды;
окислительно – восстановительные электроды.
Правила, рекомендованные ИЮПАК, при записи гальванических цепей и уравнений реакций, протекающих в них.
Гальванический элемент представляет собой систему, производящую работу, а не потребляющую её, поэтому ЭДС элемента целесообразно считать положительной величиной.
ЭДС элемента рассчитывают, вычитая из числового значения потенциала правого электрода числовое значение потенциала левого электрода – правило «правого плюса». Поэтому схему элемента записывают так, чтобы левый электрод был отрицательным, а правый – положительным.
Границу раздела между проводниками первого и второго ряда обозначают одной чертой: Zn׀ZnSO4 ; Cu׀CuSO4
Границу раздела между проводниками второго рода изображают пунктирной линией: ZnSO4 (р) ׃ CuSO4 (р)
Если на границе раздела двух проводников второго рода используют электролитный мостик, его обозначают двумя чертами: ZnSO4 (р) ׀׀ CuSO4(р).
Компоненты одной фазы записываются через запятую:
Pt|Fe³+, Fe²+ ; Pt, h3 |HCl(p)
Уравнение электродной реакции записывают, чтобы слева располагались вещества в окислительной форме, а справа – в восстановительной:
Zn|ZnSO4(р) : CuSO4 (р) |Cu
Измерение эдс гальванических элементов.
Наибольшее применение в практике нашел компенсационный метод измерения ЭДС. Он основан на включении во внешнюю цепь источника тока, который может скомпенсировать ЭДС исследуемого элемента.
Принципиальная компенсационная схема измерения ЭДС представлена на (рис. 11)
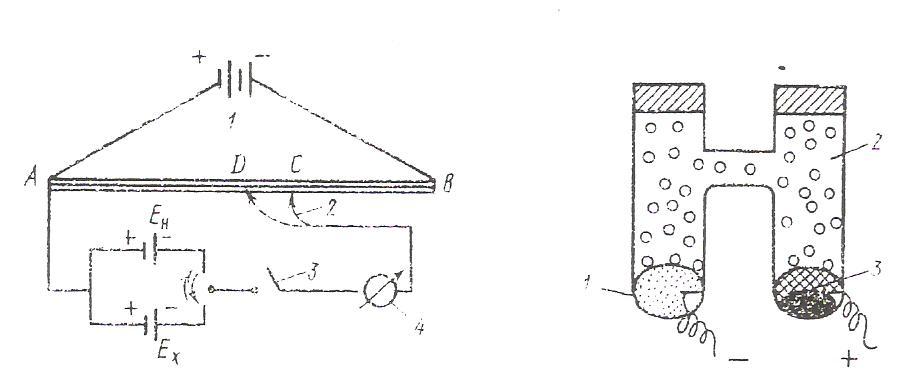
Рис. 11. Компенсационная схема измерения ЭДС: 1-аккумулятор; 2-подвижной контакт; 3-переключатель тока; 4-гальванометр | Нормальный элемент Вестона: 1-(Hg)Cd; 2-CdSO4; 3-Hg+Hg2SO4 |
От аккумулятора 1 на реохорд АВ с большим сопротивлением подают напряжение (2-4 В). Подвижный контакт 2 позволяет менять напряжение. С помощью переключателя тока 3 в цепь включают элемент Вестона с известным значением ЭДС ( Ен = 1,018 В при 298К ). Элемент Вестона подключают одноименными полюсами, чтобы ток от элемента Вестона шёл навстречу току аккумулятора. Передвигая контакт 2, подбирают такое положение на реохорде , чтобы падение напряжения на участке АС равно ЭДС элемента Вестона (Ен). При этом стрелка гальванометра не должна отклонятся от нуля. При таком положении ток в цепи не идёт и система находится в равновесии. Это позволяет найти цену деления реохорда как Ен/Ас (В/м). Затем с помощью переключателя 3 вместо элемента Вестона включают таким же образом исследуемый элемент (Еx). Передвигая контакт 2, находят положение, при котором падение напряжения на участке АД равно Еx. при этом стрелка гальванометра так же не должна отклонятся от нуля в указанном состоянии равновесия:
Ен
Ех = АД
АС
Уравнение Нернста — Химия LibreTexts
Уравнение Нернста позволяет определять потенциал ячейки в нестандартных условиях. Он связывает измеренный потенциал ячейки с коэффициентом реакции и позволяет точно определять константы равновесия (включая константы растворимости).
Введение
Уравнение Нернста получено из свободной энергии Гиббса при стандартных условиях .
\ [E ^ o = E ^ o_ {восстановление} — E ^ o_ {окисление} \ label {1} \]
\ (\ Delta {G} \) также связано с \ (E \) в общих условиях (стандартных или нет) через
\ [\ Delta {G} = -nFE \ label {2} \]
с
- \ (n \) — количество электронов, перенесенных в реакции (из сбалансированной реакции),
- \ (F \) — постоянная Фарадея (96 500 Кл / моль), а
- \ (E \) — разность потенциалов.o — \ dfrac {0.0592 \, V} {n} \ log_ {10} Q \ label {Уравнение Нернста @ 298 K} \]
Вышеприведенное уравнение показывает, что электрический потенциал клетки зависит от коэффициента реакции \ (Q \) реакции. По мере протекания окислительно-восстановительной реакции реагенты расходуются, и, таким образом, концентрация реагентов снижается. И наоборот, концентрация продуктов увеличивается за счет увеличения образования продуктов. По мере того как это происходит, потенциал клетки постепенно уменьшается на , пока реакция не достигнет равновесия, при котором \ (\ Delta {G} = 0 \).{o} _ {cell} \) значения (конечно, без учета изменения \ (n \)).
,Уравнение Нернста — Химия LibreTexts
Электрохимия имеет дело с потенциалом клеток, а также с энергией химических реакций. Энергия химической системы заставляет заряды двигаться, а движущая сила создает потенциал ячейки системы, называемой гальванической ячейкой. Энергетический аспект также связан с химическим равновесием. Все эти отношения связаны вместе в концепции уравнения Нернста .
Вальтер Х. Нернст (1864-1941) получил в 1920 году Нобелевскую премию « в знак признания его работы в области термохимии ».Его вклад в химическую термодинамику привел к хорошо известному уравнению, связывающему химическую энергию и электрический потенциал гальванического элемента или батареи.
Электрическая работа и свободная энергия Гибба
Энергия принимает разные формы: механическая работа (потенциальная и кинетическая энергия), тепло, излучение (фотоны), химическая энергия, ядерная энергия (масса) и электрическая энергия. Краткое изложение дано относительно оценки электрической энергии, поскольку это связано с электрохимией.
Электромонтажные работы
Энергия управляет всеми изменениями, включая химические реакции.В окислительно-восстановительной реакции энергия, выделяемая в реакции из-за движения заряженных частиц, дает разности потенциалов . Максимальная разность потенциалов называется электродвижущей силой (ЭДС), E , а максимальная электрическая работа Вт, является произведением заряда q в кулонах (C) и потенциала D E в вольтах. (= J / C) или ЭДС.
\ (W \ mathrm {\ color {Periwinkle} J} = q \: \ textrm D E \: \ mathrm {\ color {Periwinkle} C \: J / C \: (units)} \)
Обратите внимание, что ЭДС D E определяется природой реагентов и электролитов, а не размером ячейки или количеством материала в ней.Количество реагентов пропорционально заряду и доступной энергии гальванического элемента.
Свободная энергия Гибба
Свободная энергия Гибба D G — отрицательное значение максимальной электрической работы,
\ (\ begin {align}
\ ce \ Delta G & = — W \\
& = — q \: \ ce \ Delta E
\ end {align} \)Уравнение окислительно-восстановительной реакции представляет собой определенные количества реагентов при образовании определенных количеств продуктов.Число ( n ) электронов в таком уравнении реакции связано с количеством переносимого заряда, когда реакция завершена. Поскольку каждый моль электрона имеет заряд 96485 Кл (известная как постоянная Фарадея, F ),
\ (q = n F \)
и,
\ (\ ce \ Delta G = — n F \: \ ce \ Delta E \)
При стандартных условиях
,16.4: Уравнение Нернста — Chemistry LibreTexts
Цели обучения
Убедитесь, что вы полностью понимаете следующие важные идеи. Особенно важно знать точные значения всех выделенных терминов в контексте этой темы.
- Уравнение Нернста связывает эффективные концентрации ( активностей ) компонентов клеточной реакции со стандартным клеточным потенциалом. Для простого восстановления формы M n + + ne — → M, это говорит нам, что потенциал полуячейки изменится на 59/ n мВ при 10-кратном изменении активности иона.
- Концентрации ионов обычно можно использовать вместо активности, когда общая концентрация ионов в растворе не превышает примерно 0,001 M .
- В тех реакциях, в которых участвуют ионы H + или OH — , потенциал клетки также будет зависеть от pH. Графики E против pH, показывающие области стабильности родственных видов, являются очень полезным средством обобщения окислительно-восстановительной химии элемента.
Стандартные клеточные потенциалы , которые мы обсуждали в предыдущем разделе, относятся к клеткам, в которых все растворенные вещества находятся на единице активности , что по существу означает «эффективную концентрацию» 1 М.° \) развивается следующим образом. Начнем с полученного ранее уравнения, которое связывает стандартное изменение свободной энергии (для полного превращения продуктов в реагенты) со стандартным потенциалом
\ [\ Delta G ° = –nFE ° \]
По аналогии мы можем записать более общее уравнение
\ [\ Delta G = –nFE \]
, который выражает изменение свободной энергии для любой степени реакции, то есть для любого значения коэффициента реакции \ (Q \). Теперь мы подставляем их в выражение, связывающее \ (\ Delta G \) и \ (\ Delta G ° \), которое вы помните из главы о химическом равновесии:
\ [\ Delta G = \ Delta G ° + RT \ ln Q \]
, что дает
\ [- nFE = –nFE ° + RT \ ln Q \]
, который можно преобразовать в
\ [\ color {red} {\ underbrace {E = E ° — \ dfrac {RT} {nF} \ ln Q} _ {\ text {применимо при всех температурах}}} \ label {Nernst Long} \]
Это уравнение Нернста , которое связывает потенциал клетки со стандартным потенциалом и с активностями электроактивных частиц.Обратите внимание, что потенциал ячейки будет таким же, как \ (E ° \), только если \ (Q \) равен единице. Уравнение Нернста чаще записывают в логарифмической форме с основанием 10 и для 25 ° C:
\ [\ color {red} {\ underbrace {E = E ° — \ dfrac {0.059} {n} \ log_ {10} Q} _ {\ text {Только для 298 КБ}}} \ label {Nernst Short} \]
Значение уравнения Нернста
Уравнение Нернста говорит нам, что потенциал полуячейки изменится на 59 милливольт на 10-кратное изменение концентрации вещества, участвующего в одноэлектронном окислении или восстановлении; для двухэлектронных процессов изменение составит 28 милливольт за декаду изменения концентрации.{2 +}] \]
становится более положительным (реакция имеет большую тенденцию происходить) по мере того, как концентрация ионов меди уменьшается. Это, конечно, именно то, что предсказывает принцип Ле Шателье; чем больше разбавлен продукт, тем сильнее протекает реакция.
Электроды с равновесием
Уравнение, приведенное выше для полуячейки Cu / Cu 2 + , поднимает интересный вопрос: предположим, вы погружаете кусок меди в раствор чистой воды.При Q = [Cu 2 + ] = 0 разность потенциалов между электродом и раствором должна быть бесконечной! Вам грозит удар током? Вам не о чем беспокоиться; без передачи электронов вам ничего не нужно. Конечно, пройдет совсем немного времени, прежде чем в растворе появятся некоторые ионы Cu 2+ , и если таких ионов всего несколько на литр, то потенциал снизится до 20 вольт. Более того, однако, система настолько далека от равновесия (например, недостаточно ионов для заселения двойного электрического слоя), что уравнение Нернста на самом деле не дает значимых результатов.Такой электрод называется № в равновесии . Какая концентрация ионов необходима для стабилизации электрода? Я действительно не знаю, но я бы с подозрением относился ко всему, что намного меньше 10 –6 M.
Уравнение Нернста работает только с разбавленными ионными растворами
Ионы противоположного заряда имеют тенденцию объединяться в слабосвязанные ионные пары в более концентрированных растворах, таким образом уменьшая количество ионов, которые могут свободно отдавать или принимать электроны на электроде. По этой причине уравнение Нернста не может точно предсказать потенциалы полуячейки для растворов, в которых общая концентрация ионов превышает примерно 10 900 10 –3 М.
Как реально потенциал клеток зависит от концентрации! Уравнение Нернста точно предсказывает клеточные потенциалы только в том случае, если коэффициент равновесного отношения Q выражается в активности. Ионные активности все больше отклоняются от концентраций, когда последние превышают от 10 –4 до 10 –5 М, в зависимости от размеров и зарядов ионов.Если уравнение Нернста применяется к более концентрированным растворам, члены коэффициента реакции Q должны быть выражены в «эффективных концентрациях» или активности электроактивных ионных частиц.Коэффициент активности \ (\ gamma \)) связывает концентрацию иона с его активностью a в данном растворе через соотношение
\ [a = \ gamma c \]
Поскольку электродные потенциалы измеряют активность напрямую, коэффициенты активности могут быть определены путем проведения соответствующих измерений ЭДС на ячейках, в которых известна концентрация интересующего иона. Полученное значение Es можно затем использовать для преобразования концентраций в активности для использования в других расчетах с использованием констант равновесия.
Потенциалы клеток и pH: диаграммы стабильности
Как многие из нас вспоминают из нашей борьбы с уравновешиванием окислительно-восстановительных уравнений в начальных курсах химии, многие реакции переноса электрона включают ионы водорода и ионы гидроксида. Поэтому стандартные потенциалы для этих реакций относятся к pH, равному 0 или 14, при котором соответствующий ион имеет единицу активности. Поскольку часто задействовано несколько ионов H + или OH — , потенциалы, задаваемые уравнением Нернста, могут сильно варьироваться в зависимости от pH.Часто бывает полезно взглянуть на ситуацию с другой стороны, рассмотрев, какие комбинации потенциала и pH позволяют стабильно существовать конкретному виду. Эта информация наиболее эффективно выражается с помощью диаграммы E -vs.-pH, также известной как диаграмма Pourbaix .
Рисунок \ (\ PageIndex {2} \) : Диаграмма стабильности (Поурбэ) для воды. Два значения E °, показанные слева, относятся к «стандартным» условиям активности блока H + (pH = 0) и давлению газа 1 атм.При комбинациях pH и E, которые лежат вне заштрихованной области, парциальные давления O 2 или H 2 превышают 1 атм, что означает разложение воды. Парциальные давления единства, конечно, являются произвольными критериями; в системе, открытой в атмосферу, вода может разлагаться даже при гораздо более низких парциальных давлениях H 2 и давлениях кислорода ниже 0,2 атм. К счастью, в большинстве случаев эти процессы протекают довольно медленно.Как было отмечено в связи с заштрихованной областью на рисунке ниже, вода подвержена разложению под действием сильных окислителей, таких как Cl 2 , и восстановителей, более сильных, чем H 2 .- \ rightarrow H_ {2 (g)} \]
или в нейтральных или щелочных растворах как
,Уравнение Нернста | PVEducation
Перейти к основному содержанию- Меню
- Инструкции
- 1. Введение
- 1. Введение
- Введение
- Солнечная энергия
- Парниковый эффект
- 2. Свойства солнечного света
- 2. Свойства солнечного света
- 2.1. Основы света
- Свойства света
- Энергия фотона
- Поток фотонов
- Спектральная освещенность
- Плотность излучения
- 2.2. Излучение черного тела
- 2.3. Солнечное излучение
- Солнце
- Солнечное излучение в космосе
- 2.4. Земное солнечное излучение
- Солнечное излучение за пределами атмосферы Земли
- Атмосферные эффекты
- Воздушная масса
- Движение Солнца
- Солнечное время
- Угол склонения
- Угол возвышения
- Положение Солнца Положение Солнца
Положение Солнца Калькулятор - Положение Солнца с высокой точностью
- Солнечное излучение на наклонной поверхности
- Произвольная ориентация и наклон
- 2.5. Данные о солнечной радиации
- Расчет солнечной инсоляции
- Измерение солнечной радиации
- Анализ наборов данных солнечной радиации
- Типичные данные метеорологического года (TMY)
- Использование данных TMY
- Среднее солнечное излучение
- Isoflux Contour Графики
- Данные солнечного часа
- Данные облачного покрова
- Освещенность спутников
- 3. Полупроводники и переходы
- Введение
- 3.1. Основы
- Полупроводниковые материалы
- Структура полупроводников
- Проводимость в полупроводниках
- Запрещенная зона
- Собственная концентрация носителей
- Допирование
- Равновесная концентрация носителей
- 3.2. Генерация
- Поглощение света
- Коэффициент поглощения
- Глубина поглощения
- Скорость генерации
- 3.3. Рекомбинация
- Типы рекомбинации
- Срок службы
- Длина диффузии
- Поверхностная рекомбинация
- 3.4. Транспортировка носителей
- Движение носителей в полупроводниках
- Диффузия
- Дрейф
- 3.5. P-n-переходы
- Формирование PN-перехода
- P-N переходные диоды
- Смещение PN-переходов
- Уравнение диодов
- 3.6. Диодные уравнения для PV
- Вывод уравнения идеального диода
- Основные уравнения
- Применение основных уравнений к PN-переходу
- Решение для области истощения
- Решение для квазинейтральных областей
- Определение общего тока
- 4. Работа солнечных батарей
- 4.1. Идеальные солнечные элементы
- Структура солнечных элементов
- Генерируемый свет ток
- Вероятность сбора
- Квантовая эффективность




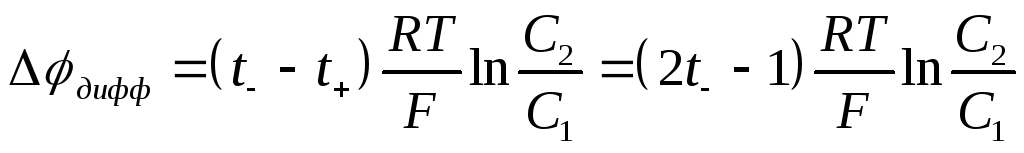


 при температуре (0С)
при температуре (0С)