Этиленгликоль — класс опасности и основные характеристики
Промывка- Промывка
- Промывка труб отопления
- Промывка теплоносителей
- Промывка кондиционера
- Промывка вентиляции
- Промывка пластинчатых теплообменников
- Промывка систем холодоснабжения

Этиленгликоль — базовое вещество, используемое для производства антифризов и теплоносителей (класс опасности этиленгликоля — 3). Благодаря его отличительным параметрам, материалы на его основе эффективны для работы в транспортных системах, в оборудовании, применяемом для охлаждения и отопления. Главное, что стоит помнить, при работе с растворами — этиленгликоль вреден для человека, он токсичен. Требуется особая осторожность и внимательность при обращении.
Особенности этиленгликоля
Этот материал классифицируют как вещество третьей группы опасности. Класс опасности этиленгликоля говорит о способе транспортировки и хранении. Растворы с его содержанием перевозят в специализированных емкостях, оцинкованных резервуарах, которые герметично закрыты. Можно перевозить и в автоцистернах, только их нужно подготовить для этих целей. Водитель должен следовать инструкции во время доставки раствора, чтобы избежать разгерметизации ёмкости.
Этиленгликоль — бесцветная жидкость, не имеющая запаха, обладающая слегка сладковатым вкусом и маслянистой структурой. Физические характеристики дают возможность применять вещество в производстве.
- Температура возгорания составляет от +112 ˚С до +124 ˚С.
- Самовоспламениться может при нагреве до +380 ˚С.
- Раствор на водной основе вместе с дополнительными присадками может замерзать при температуре ниже -65 ˚С.
- При более низком значении начинается образование кристаллов льда.
- Точка кипения чистой жидкости достигается при +121 ˚С.
- Плотность — 11,114 г/куб. см.
Сфера применения
Этиленгликоль может использоваться не только как антифриз, его применяют в промышленности в разных сферах.
- В качестве растворителя для красящих соединений.
- Для производства нитрогликоля — взрывчатого материала.
- В газодобывающей промышленности. Этиленгликоль необходим для формирования гидрата метана в трубопроводе. Кроме этого, вещество поглощает лишнюю воду в трубах.
Чем опасен этиленгликоль?
Материалы, которые относятся к третьей группе опасности (среди них и этиленгликоль) необходимо хранить в герметичных емкостях. Их контакт с окружающей средой должен быть минимизирован. Человеку опасно находиться при концентрации этого вещества в атмосфере больше 5 миллиграмм/метр кубический. Отличительные особенности при постоянном попадании этиленгликоля в организм:
- слабость;
- сонливость;
- вялость;
- в тяжелых случаях — потеря сознания.
Постоянное вдыхание паров эфира приводят к развитию вегетососудистой дистонии.
Все сотрудники, которые имеют отношение к химическому производству и к работе с токсическими веществами третьего класса опасности, должны строго соблюдать все правила техники безопасности. В противном случае не исключен и летальный исход.
На производстве работают в специальных костюмах, надевая:
- респиратор соответствующего класса защиты;
- бахилы;
- халат;
- очки.
Важно закрыть все открытые участки тела и предотвратить попадание паров в дыхательные органы.
Длительность работы раствора
Раствор на базе этиленгликоля может работать в течение 5 лет, не теряя своих характеристик. Затем жидкость подлежит замене. Для того, чтобы определить, когда вещество подлежит замене, проводятся специальные исследования. На основе результатов принимается соответствующее решение. Делают целый ряд тестов, в которых проверяются характеристики рабочей жидкости. Если раствор утратил часть своих свойств, его нужно заменить, чтобы восстановить эффективность работы всей системы и не привести к повреждению отдельных элементов теплообменника. Купить раствор этиленгликоля в воде можно на нашем сайте.
Интересные статьи
Этиленгликоль — Википедия
Материал из Википедии — свободной энциклопедии
| Этиленгликоль | |||
|---|---|---|---|
| |||
| Систематическое наименование | этандиол-1,2 | ||
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол | ||
| Хим. формула | C2H6O2 | ||
| Рац. формула | C2H4(OH)2 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 62,068 г/моль | ||
| Плотность | 1,113 г/см³ | ||
| Температура | |||
| • плавления | −12,9 °C | ||
| • кипения | 197,3 °C | ||
| • вспышки | 111 °C | ||
| Пределы взрываемости | 3,2 ± 0,1 об.%[1] | ||
| Давление пара | 0,06 ± 0,01 мм рт.ст. | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 15,1 ± 0,1[2] | ||
| Показатель преломления | 1,4318 | ||
| Рег. номер CAS | 107-21-1 | ||
| PubChem | 174 | ||
| Рег. номер EINECS | 203-473-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | KW2975000 | ||
| ChEBI | 30742 | ||
| ChemSpider | 13835235 | ||
| Предельная концентрация | 5 мг/м3 | ||
| ЛД50 | 4700 мг/кг (крысы, перорально) | ||
| Токсичность | ядовит | ||
| Фразы риска (R) | R22 | ||
| Краткие характер. опасности (H) | |||
| Меры предостор. (P) | P264, P270, P301+P312, P330, P501 | ||
| Пиктограммы СГС |  | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Этиленглико́ль
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
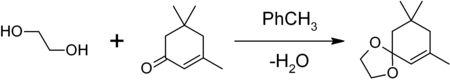
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[4] или комплекса диметилсульфат-ДМФА[5] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен[6][7]. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела)[8]. Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол[9].
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой[10].
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0272.html
- ↑ P. Ballinger, Long F. A. Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds 1,2 // J. Am. Chem. Soc. / P. J. Stang — American Chemical Society, 1960. — Vol. 82, Iss. 4. — P. 795–798. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01489A008
- ↑ Monograph on the Potential Human Reproductive and Developmental Effects of Ethylene Glycol (неопр.) (недоступная ссылка). Дата обращения 8 января 2009. Архивировано 13 января 2009 года.
- ↑ SYNTHESIS 1983, No 3,pp 203—205
- ↑ Liebigs Annalen Chemie 1979, pp 1362—1369
- ↑ CDC — The Emergency Response Safety and Health Database: Systemic Agent: ETHYLENE GLYCOL — NIOSH
- ↑ Архивированная копия (неопр.) (недоступная ссылка). Дата обращения 24 января 2018. Архивировано 15 октября 2018 года.
- ↑ Е.Ю.Бонитенко и др. Отравления этиленгликолем и его эфирами – СПб.: «Изд-во НИИХ СПбГУ», 2003 г. — Medline.Ru
- ↑ Flomenbaum, Goldfrank et al. Goldfrank’s Toxicologic Emergencies. 8th Edition. — McGraw Hill, 2006. — С. 1460, 1465. — 2170 с. — ISBN 0071437630.
- ↑ В. Ф. Крамаренко. Токсикологическая химия. — К.: Выща шк., 1989. — 447 с. — 6 000 экз. — ISBN 5-11-000148-0.
Применение Этиленгликоля
Благодаря своей дешевизне Этиленгликоль нашёл широкое применение в технике. Этиленгликоль является активным коррозионным веществом, относится к жирным органическим соединениям, в связи с чем при производстве водных растворов — незамерзающих жидкостей необходимо использовать присадки для защиты систем от коррозии и пенообразований.
Где применяется Этиленгликоль
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии
- Этиленгликоль теплоноситель в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров
- В производстве целлофана, полиуретанов и ряда других. Это второе основное применение
- Как растворитель красящих веществ
- В органическом синтезе:В составах для противообледенительной обработки лобовых стёкол и самолётов
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив
- В качестве высокотемпературного растворителя
- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля
- При производстве конденсаторов
- При производстве 1,4-диоксана
- Компонент в составе систем жидкостного охлаждения компьютеров
- Как теплоноситель в чиллер-фанкойл
- В качестве компонента крема для обуви (1—2 %)
- В составе для мытья стёкол вместе с изопропиловым спиртом
Таблица плотности и температуры замерзания (начала кристаллизации) водных растворов этиленгликоля
| Концентрация этиленгликоля,% | Плотность раствора, г/см3 при 20оС | Температура замерзания, оС | Концентрация этиленгликоля,% | Плотность раствора, г/см3 при 20оС | Температура замерзания, оС |
| 26,4 | 1,0340 | -10 | 65,3 | 1,0855 | -65 |
| 27,2 | 1,0376 | -12 | 65,6 | 1,0860 | -66 |
| 29,6 | 1,0410 | -14 | 66,0 | 1,0863 | -67 |
| 32,0 | 1,0443 | -16 | 66,3 | 1,0866 | -68 |
| 34,2 | 1,0480 | -18 | 68,5 | 1,0888 | -66 |
| 36,4 | 1,0506 | -20 | 69,6 | 1,0900 | -64 |
| 38,4 | 1,0533 | -22 | 70,8 | 1,0910 | -62 |
| 40,4 | 1,0560 | -24 | 72,1 | 1,0923 | -60 |
| 42,2 | 1,0586 | -26 | 73,3 | 1,0937 | -58 |
| 44,0 | 1,0606 | -28 | 74,5 | 1,0947 | -56 |
| 45,6 | 1,0627 | -30 | 75,8 | 1,0960 | -54 |
| 47,0 | 1,0643 | -32 | 77,0 | 1,0973 | -52 |
| 48,2 | 1,0663 | -34 | 78,4 | 1,0983 | -50 |
| 49,6 | 1,0680 | -36 | 79,6 | 1,0997 | -48 |
| 51,0 | 1,0696 | -38 | 81,2 | 1,1007 | -46 |
| 52,6 | 1,0713 | -40 | 82,5 | 1,1023 | -44 |
| 53,6 | 1,0726 | -42 | 83,9 | 1,1033 | -42 |
| 54,6 | 1,0740 | -44 | 85,4 | 1,1043 | -40 |
| 55,6 | 1,0753 | -46 | 86,9 | 1,1054 | -38 |
| 56,8 | 1,0766 | -48 | 88,4 | 1,0660 | -36 |
| 58,0 | 1,0780 | -50 | 90,0 | 1,1077 | -35 |
| 59,1 | 1,0790 | -52 | 91,5 | 1,1987 | -34 |
| 60,2 | 1,0803 | -54 | 93,0 | 1,1096 | -33 |
| 61,2 | 1,0813 | -56 | 94,4 | 1,1103 | -32 |
| 62,2 | 1,0823 | -58 | 95,0 | 1,1105 | -28 |
| 63,1 | 1,0833 | -60 | 95,5 | 1,1107 | -27 |
| 64,0 | 1,0843 | -62 | 96,5 | 1,1110 | -24 |
| 64,8 | 1,0850 | -64 | 97,0 | 1,1116 | -22 |
Применение этиленгликоля в системах отопления
Данная статья будет посвящена такому теплоносителю как «этиленгликоль», мы поговорим о его свойствах, преимуществах применения. Расскажем, каким образом работает энергоэффективная система отопления на основе этиленгликоля.
Первое, что нужно отметить, что применение этиленгликоля в качестве теплоносителя для систем отопления – достаточно новая технология. Так, в Томской области в 2011 – 2012гг. такое энергоэффективное решение было использовано при строительстве одного из детских садов.
Итак, что же такое «этиленгликоль». Этиленгликоль – это вязкая, бесцветная жидкость, не имеющая запаха. Химическая формула этиленгликоля: C2H4(OH)2. Это токсичное соединение, и, казалось бы, как его можно применять в системе отопления? Но при условиях точного соблюдения технологии и применения только в закрытых системах отопления этиленгликоль становится малоопасным.
Самым важным свойством, которое и обусловило применение этиленгликоля в качестве антифриза, состоит в том, что этиленгликоль сильно уменьшает температуру замерзания воды. Поэтому водные растворы этиленгликоля обладают хорошими теплофизическими свойствами.
Зависимость температуры замерзания теплоносителей от концентрации в них этиленгликоля
| tзамерзания °С | -40 | -30 | -20 | -10 | -5 | 0 |
| Cодержание, % | 53 | 46 | 36 | 24 | 14 | 1 |
Теперь перейдем к самой технологии применения этиленгликоля в качестве теплоносителя для энергосистемы, которая была использована для детского учреждения в Томской области.
В основу данного проекта заложено применение так называемых геотермальных тепловых насосов. Принцип прост: ниже глубины промерзания температура грунта превосходит значение «абсолютного нуля», таким образом, накопленное тепло (геотермальную энергию) из земли грех не позаимствовать. Из физики известно, что энергия не передается от холодного тела (в данном случае от грунта) к горячему. По этой причине система геотермального отопления выполнена из трех контуров, в которых циркулируют жидкости с различными физическими свойствами. Во внешнем отопительном контуре, проходящем на глубине два с половиной метра, циркулирует антифриз — (этиленгликоль). Во внутреннем отопительном контуре через систему труб, пронизывающих все полы детского сада — теплоноситель. Между внешним и внутренним контуром находится теплообменник теплового насоса с закаченным в него хладагентом с низкой температурой кипения.
Теплоноситель первичного «рассольного» контура поглощает тепло из грунта, увеличивая немного свою температуру. В испарителе теплообменника рассол (антифриз) передает тепловую энергию еще более холодному жидкому хладагенту, находящемуся под низким давлением. В этих условиях достаточно небольшой плюсовой температуры, чтобы хладагент перешел в газообразное состояние (испарился). Далее компрессор сильно сдавливает хладагент, вследствие чего температура его заметно увеличивается (около +70°C). Затем горячий хладагент подается в конденсатор, там он передает свою тепловую энергию более холодному теплоносителю, циркулирующему в отопительном контуре здания.
Отдав часть тепла, охлажденный хладагент снова конденсируется (становится жидким), а дросселирующий клапан на границе между конденсатором и испарителем вновь понижает его давление. Затем цикл повторяется.
Необходимо так же отметить, что здание детского сада построено по принципу «термоса»: керамзитобетонные стеновые панели и энергосберегающие окна с пятикамерным стеклопакетом – моментально понизили теплопотери на 25%.
Итак, почему в этой энергоэффективной системе используется именно этиленгликоль, а не какой-нибудь другой антифриз, например пропиленгликоль или ацетат калия? Ответ прост и вытекает из физических свойств этиленгликоля. Во-первых, водный раствор этиленгликоля замерзает при температуре около -60°C в отличие от антифириза на основе ацетата калия, который имеет температуру замерзания ниже -5°C. Во-вторых, пропиленгликоль хоть и является экологически и токсилогически безопасным веществом, но его теплофизические свойства уступают этиленгликолю на 10-20%.
Заключение
В заключении нужно отметить преимущества данного проекта. Во-первых, подобная энергоэффективная схема позволила сократить затраты на отопление примерно на 45%. Фактически детский сад оплачивает счета только за электроэнергию. Конечно, традиционные радиаторы отопления установлены в детском саду, но они необходимы здесь «на всякий случай».
Летом при температуре +25-27°C система тепловых насосов может автоматически переключаться на пассивное охлаждение помещения. Требуемое количество энергии на поддержание комфортного микроклимата сравнимо с затратами на одну лампу накаливания.
Срок службы климатической установки достаточно долговечен, примерно 25-30 лет, а ежегодное профилактическое обслуживание не требует серьезных затрат.
Этиленгликоль | Статьи — Гликоли.Ру
Этиленгликоль — C 2 H 4 (OH) 2 (С 2 Н 6 О 2 ) . органическое соединение, двухатомный спирт Применяют в производстве синтетических смол, искусственного волокна, как антифриз и т.д..
Этиленгликоль (гликоль; 1,2-диоксиетан; 1,2-этандиол), HO-Ch3-Ch3-OH — простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов внутрь организма человека может привести к необратимым изменениям в организме и к летальному исходу.
1. История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцем диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не имел широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для замены глицерина при производстве взрывчатых веществ. В США полупромышленные производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начала первое крупномасштабное производство, основанное на газофазного окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
2. Получение
В промышленности этиленгликоль получают путем гидратации окиси этилена при 10 атм и 190-200 °С или при 1 атм и 50-100 °С в присутствии 0,1-0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашел широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при -45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- как высокотемпературный растворитель.
- Для защиты карбонильной группы путем получения 1,3-диоксалан. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3+Et 2O др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона.
1,3-диоксалан могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалан устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- В складах для противообледенительной обработки лобовых стекол и самолетов.
- Как компонент жидкости «И», который используется для предотвращения обводнения авиационных топлив.
- Как криопротектор
- Для поглощения воды для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенериуют путем осушения и удаления солей.
- Этиленгликоль является исходным сырьем для производства взрывчатого вещества нитрогликоли.
Этиленгликоль применяется также
- При производстве конденсаторов
- При производстве 1,4-диоксана
- Компонент в составе систем жидкостного охлаждения компьютеров
- как компонент крема для обуви (1-2%)
- В составе для мытья стекол вместе с изопропиловым спиртом
3. Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+ I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности. Таблица плотности водных растворов этиленгликоля, 20 °С
| Концентрация% | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
| Плотность, г / мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
4. Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °С. Температура самовоспламенения 380 °С. Температурные пределы воспламенения паров в воздухе, °С: Нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8 — 6,4% (по объему).
Этиленгликоль токсичен. Летальная доза при однократном пероральном употреблении составляет 100-300 мл этиленгликоля (1,5-5мл на 1 кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определенную опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем является этанол и 4-метилпиразол (англ. Fomepizole).
Примечания
- Monograph on the Potential Human Reproductive and Developmental Effects of Ethylene Glycol
- SYNTHESIS 1983, No 3, pp 203-205
- Liebigs Annalen Chemie 1979, pp 1362-1369
- Medline.Ru — Отравление этиленгликолем и его эфирами
- Flomenbaum, Goldfrank et al. Goldfrank’s Toxicologic Emergencies. 8th Edition. — McGraw Hill, 2006. — С. 1460, 1465. — 2170 с. — ISBN 0-07-143763-0
Взято из открытых источников.
Этиленгликоль (моноэтиленгликоль), диэтиленгликоль, пропиленгликоль и их расстворы
Диэтиленгликоль
Физические свойства диэтиленгликоля и этиленгликоля близки. Диэтиленгликоль отличается от этиленгликоля лучшей растворимостью, меньшей летучестью, более высокой температурой кипения и вязкостью. Температура замерзания водного раствора несколько выше чем у этиленгликоля, хотя и незначительно.
Диэтиленгликоль превосходно смешивается с водой и большим количеством различных органических соединений: одноатомными спиртами, пропиленгликолем и другими гликолями, этилцеллозольвом и другими целлозольвами и карбитолами, этаноламином, ацетоном, фенолом, уксусной кислотой, фурфуролом, пиридином в широком интервале температур. В диэтиленгликоле не растворимы минеральные и многие растительные масла.
Применение диэтиленгликоля
Диэтиленгликоль реже используется в качестве антифриза по сравнению с этиленгликолем. Однако скорее это связано не с тем, что он имеет менее подходящие для этой цели свойства (температура замерзания водных растворов и другие характеристики различаются не столь значительно) а с тем, что этиленгликоль является более привычным и доступным продуктом и объем его производства больше. При этом в некоторых случаях применение диэтиленгликоля в смеси этиленгликолем позволяет получать антифризы с более высокими эксплуатационными свойствами.
Диэтиленгликоль используется в качестве избирательного (селективного) растворителя с целью экстракции различных веществ из нефти и нефтепродуктов, таких как ксилол, толуол, бензол, т. к. хорошо растворяет ароматические углеводороды и не способен к растворению парафиновых и нафтеновых углеводородов. Благодаря более высокой растворимости диэтиленгликоль предпочтительней этиленгликоля для этих целей. При этом получаются продукты высокой степени чистоты.
Благодаря высокой гигроскопичности диэтиленгликоль широко используется для удаления водяных паров из газов, прокачиваемых по трубопроводам. Удалять водяные пары необходимо с целью предотвращения образования в трубопроводах конденсата и ледяных пробок. Также с помощью диэтиленгликоля можно очищать газы и от других примесей, например сероводорода и углекислого газа.
Дигликоль применяется в качестве сырья при синтезе различных полимерных материалов: ненасыщенных полиэфирных смол, щелочестойких алкидных смол, термостойких и огнестойких полиуретанов, а также используется при синтезе различных модифицирующих компонентов для полимерных материалов: пластификаторов, стабилизаторов, антиоксидантов, активаторов полимеризации, отвердителей эпоксидных смол.
Опасность диэтиленгликоля
Токсичность диэтиленгликоля ниже чем этиленгликоля. Пары не представляют высокой опасности при вдыхании. Однако прием внутрь также чрезвычайно опасен.
Этиленгликоль нашел широкое применение в технике:
Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при -45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
Как растворитель красящих веществ;
В органическом синтезе:
– в качестве высокотемпературного растворителя.
В составах для противообледенительной обработки лобовых стекол и самолетов.
Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
В качестве криопротектора
Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путем осушения и удаления солей.
Этиленгликоль применяется также
-при производстве конденсаторов
-при производстве 1,4-диоксана
-компонент в составе систем жидкостного охлаждения компьютеров
-в качестве компонента крема для обуви (1-2%)
-в составе для мытья стекол вместе с изопропиловым спиртом.
Водные растворы пропиленгликоля и этиленгликоля
| Раствор | Температура замерзания | Плотностьпри 20˚С | Раствор | Температура замерзания | Плотностьпри 20˚С |
| Пропиленгликоль 30% | -13˚С | 1,023 | Этиленгликоль 30% | -15˚С | 1,038 |
| Пропиленгликоль 35% | -20˚С | 1,028 | Этиленгликоль 35% | -20˚С | 1,045 |
| Пропиленгликоль 40% | -25˚С | 1,032 | Этиленгликоль 40% | -25˚С | 1,052 |
| Пропиленгликоль 45% | -30˚С | 1,035 | Этиленгликоль 45% | -30˚С | 1,058 |
| Пропиленгликоль 50% | -35˚С | 1,038 | Этиленгликоль 50% | -35˚С | 1,064 |
| Пропиленгликоль 55% | -45˚С | 1,040 | Этиленгликоль 55% | -43˚С | 1,071 |
| Пропиленгликоль 60% | -55˚С | 1,042 | Этиленгликоль 60% | -50˚С | 1,077 |
| Пропиленгликоль 65% | -60˚С | 1,043 | Этиленгликоль 65% | -60˚С | 1,083 |
| Пропиленгликоль 70% | -65˚С | 1,044 | Этиленгликоль 70% | -70˚С | 1,088 |
Из-за склонности растворов гликолей к переохлаждению фактическая температура замерзания может отличаться в пределах 2˚С.
Плотность водных растворов этиленгликоля при различных температурах
| Температура,˚С | Концентрация этиленгликоля ГОСТ 19774 высшего сорта в водном растворе (по массе) | |||||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 100% | |
| -45 | 1,11 | 1,125 | 1,137 | |||||||
| -40 | 1,108 | 1,122 | 1,134 | |||||||
| -35 | 1,087 | 1,105 | 1,12 | 1,131 | ||||||
| -30 | 1,086 | 1,103 | 1,118 | 1,129 | ||||||
| -25 | 1,068 | 1,085 | 1,101 | 1,115 | 1,126 | |||||
| -20 | 1,067 | 1,083 | 1,098 | 1,112 | 1,123 | 1,133 | ||||
| -15 | 1,066 | 1,081 | 1,096 | 1,109 | 1,12 | 1,13 | 1,137 | |||
| -10 | 1,017 | 1,32 | 1,048 | 1,064 | 1,079 | 1,094 | 1,107 | 1,117 | 1,127 | 1,134 |
| -5 | 1,016 | 1,31 | 1,047 | 1,062 | 1,077 | 1,091 | 1,104 | 1,114 | 1,123 | 1,131 |
| 0 | 1,015 | 1,03 | 1,046 | 1,061 | 1,075 | 1,088 | 1,101 | 1,111 | 1,12 | 1,127 |
| 5 | 1,014 | 1,029 | 1,044 | 1,059 | 1,073 | 1,085 | 1,097 | 1,108 | 1,116 | 1,124 |
| 10 | 1,013 | 1,027 | 1,042 | 1,056 | 1,07 | 1,083 | 1,094 | 1,105 | 1,113 | 1,120 |
| 15 | 1,012 | 1,026 | 1,041 | 1,054 | 1,067 | 1,08 | 1,091 | 1,102 | 1,10 | 1,117 |
| 20 | 1,011 | 1,024 | 1,038 | 1,052 | 1,064 | 1,077 | 1,088 | 1,098 | 1,106 | 1,113 |
| 25 | 1,009 | 1,022 | 1,036 | 1,05 | 1,061 | 1,074 | 1,084 | 1,094 | 1,102 | 1,11 |
| 30 | 1,007 | 1,021 | 1,034 | 1,047 | 1,058 | 1,071 | 1,081 | 1,091 | 1,099 | 1,106 |
| 35 | 1,006 | 1,019 | 1,032 | 1,045 | 1,055 | 1,067 | 1,078 | 1,087 | 1,096 | 1,103 |
| 40 | 1,004 | 1,017 | 1,029 | 1,041 | 1,052 | 1,064 | 1,074 | 1,084 | 1,093 | 1,099 |
| 45 | 1,002 | 1,014 | 1,026 | 1,038 | 1,049 | 1,06 | 1,071 | 1,081 | 1,089 | 1,096 |
| 50 | 0,999 | 1,012 | 1,023 | 1,035 | 1,046 | 1,057 | 1,067 | 1,077 | 1,085 | 1,093 |
| 55 | 0,996 | 1,009 | 1,021 | 1,032 | 1,043 | 1,054 | 1,064 | 1,073 | 1,082 | 1,089 |
| 60 | 0,994 | 1,006 | 1,018 | 1,029 | 1,04 | 1,051 | 1,06 | 1,069 | 1,078 | 1,085 |
| 65 | 0,991 | 1,003 | 1,014 | 1,026 | 1,037 | 1,047 | 1,057 | 1,065 | 1,074 | 1,081 |
| 70 | 0,988 | 1,0 | 1,011 | 1,023 | 1,034 | 1,044 | 1,053 | 1,062 | 1,07 | 1,078 |
| 75 | 0,986 | 0,997 | 1,008 | 1,019 | 1,029 | 1,04 | 1,05 | 1,058 | 1,066 | 1,074 |
| 80 | 0,983 | 0,994 | 1,005 | 1,016 | 1,026 | 1,036 | 1,046 | 1,054 | 1,063 | 1,07 |
| 85 | 0,979 | 0,99 | 1,001 | 1,012 | 1,022 | 1,032 | 1,042 | 1,05 | 1,059 | 1,067 |
| 90 | 0,976 | 0,987 | 0,997 | 1,009 | 1,018 | 1,028 | 1,038 | 1,046 | 1,055 | 1,063 |
| 95 | 0,973 | 0,983 | 0,993 | 1,005 | 1,014 | 1,024 | 1,034 | 1,043 | 1,051 | 1,059 |
| 100 | 0,969 | 0,98 | 0,99 | 1,0 | 1,01 | 1,02 | 1,03 | 1,04 | 1,047 | 1,055 |
Значения плотности растворов этиленгликоля в воде приведены в г/см3.
Технология разбавления этиленгликоля для изготовления теплоносителя

На протяжении многих лет этиленгликоль считается одним из самых эффективных и универсальных теплоносителей для холодильных установок, отопительных систем, систем кондиционирования воздуха и иного инженерного оборудования, работающего в условиях риска замерзания. Сегодня у потребителя есть два варианта: приобрести готовый состав на основе водно-гликолевого раствора с пакетом антикоррозионных присадок или купить этиленгликоль оптом, а затем довести его до требуемой концентрации. Во втором случае нужно быть предельно аккуратным и учитывать климатические условия использования инженерной системы. Если вы приобретаете готовый раствор с концентрацией не более 25 %, а эксплуатационные характеристики антифриза соответствуют требованиям системы, то заниматься разведением не нужно, достаточно добавить присадки и использовать. Совсем по-иному обстоит дело, если вы заказали водно-гликолевую смесь с концентрацией свыше 40 %. Как утверждают специалисты, использовать раствор с высокой концентрацией (70 % или выше) целесообразно лишь для климатических условий Крайнего Севера. Этиленгликоль с более высокой объемной концентрацией в продаже не встречается, ведь рост содержания основного вещества в водно-гликолевой смеси лишь удорожает конечную стоимость продукта, но не влияет на температуру замерзания антифриза. Чаще всего наблюдается обратный эффект, когда применение высококонцентрированного раствора ведет к ухудшению теплофизических характеристик смеси, что отражается на производительности и износе оборудования.
Свойства этиленгликоля
Вещество относится к классу простых двухатомных спиртов. Агрегатное состояние – маслянистая жидкость, которая имеет температуру замерзания 13 градусов ниже нуля. Такой низкий порог кристаллизации чистого этиленгликоля является существенным недостатком, поэтому расширить температурный диапазон использования можно за счет снижения концентрации и добавления воды. В итоге можно получить универсальный антифриз, который сможет сохранять необходимые теплофизические характеристики при 40-65 градусах ниже нуля. Такой диапазон температур позволяет использовать смесь практически во всех регионах страны. Состав обладает достаточной теплопроводностью и вязкостью, чтобы сделать процесс переноса тепловой энергии быстрым и эффективным.
Рекомендуемые пропорции разведения

Специалисты говорят, что для разведения высококонцентрированного этиленгликоля допустимо использовать лишь умягченную или полностью деминерализованную воду, которая лишена примесей магния или кальция. Это обязательное требование, которое позволяет минимизировать риск образования накипи на стенках трубопроводов и продлить срок эксплуатации оборудования. Заливать в систему концентрированный гликоль недопустимо, ведь он обладает высокой вязкостью, что потребует работы насосного оборудования в экстремальном режиме. Со временем это приведет к выходу из строя последнего, простою систему и внушительным затратам на ремонт.
Как показывает практика, использование деминерализованной воды в качестве одного из компонентов смеси позволяет изменить и верхний диапазон рабочих температур. Для некоторых типов отопительного оборудования это чрезвычайно важно. С увеличением температуры кипения водно-гликолевого раствора уменьшается растворимость гликоля. При разведении антифриза нужно учитывать и климатические условия использования оборудования. Если купить гликоль с концентрацией 40 %, то он будет сохранять первоначальные свойства при охлаждении до 65 градусах ниже нуля. В умеренных климатических широтах такие температуры не встречаются, поэтому в целях экономии антифриза можно развести его водой и изменить температуру замерзания до следующих пределов:
- При разбавлении в соотношении 1 к 1 можно повысить точку кристаллизации до 40 градусов ниже нуля;
- Разведение в пропорции 2 к 3 (на 1 литр этиленгликоля полтора литра воды) меняет температуру замерзания до 30 градусов ниже нуля;
- Разбавление в соотношении литр гликоля на два литра воды – до 20 градусов ниже нуля.
Помним о безопасности
Этиленгликоль – это токсичное вещество, поэтому его использование в отопительных системах допускается лишь при наличии закрытого контура. В двухконтурных котлах возможны утечки, при которых опасное вещество может попасть в систему горячего водоснабжения. Работать с концентрированными гликолями допустимо только при наличии комплекта средств индивидуальной защиты – очков, макси и перчаток.





 (
(