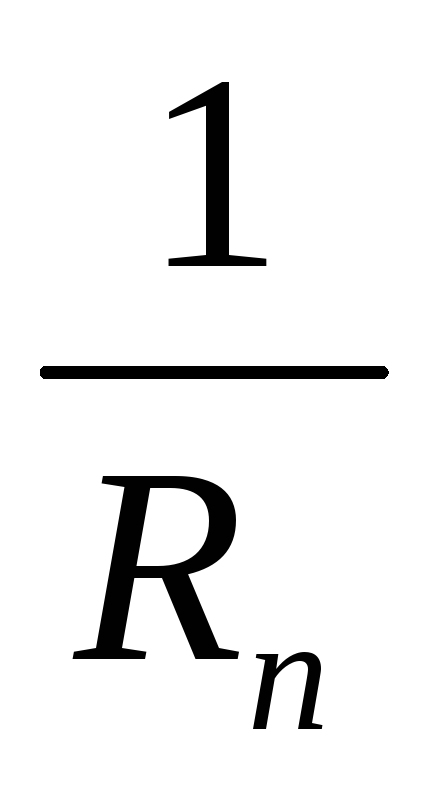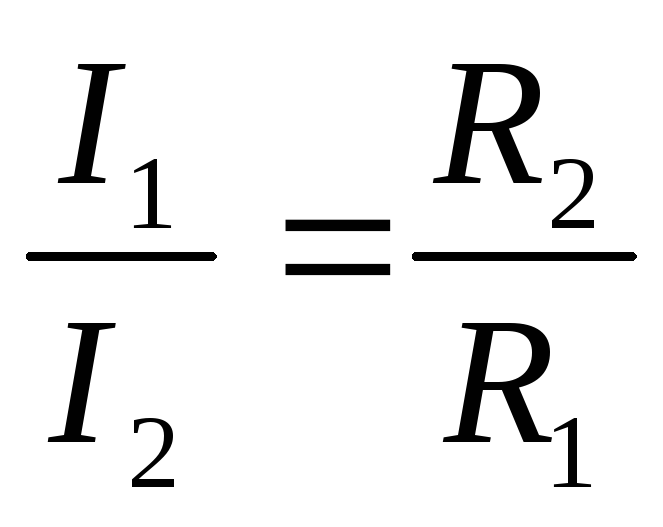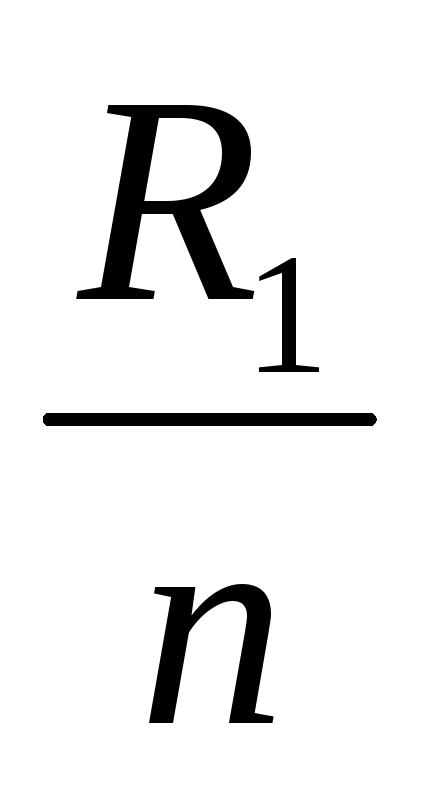§45. Способы соединения аккумуляторов в батареи
В тех случаях, когда ток и напряжение отдельного источника электрической энергии (в том числе аккумулятора) являются недостаточными для нормальной работы электрических потребителей, применяют последовательное, параллельное и смешанное соединения таких источников.
Последовательное соединение. При последовательном соединении аккумуляторов отрицательный электрод первого аккумулятора соединяют с положительным электродом второго, отрицательный электрод второго — с положительным электродом третьего и т. д. (рис. 165, а). Нагрузку (приемник) присоединяют к положительному электроду первого и отрицательному электроду последнего аккумулятора.

При последовательном соединении аккумуляторов их электродвижущие силы согласно второму закону Кирхгофа складываются и результирующая э. д. с. равна сумме э. д. с. отдельных аккумуляторов. Следовательно, чем больше аккумуляторов включено в цепь, тем больше напряжение, под которым находятся приемники (рис. 166).
Эквивалентное внутреннее сопротивление последовательно соединенных аккумуляторов равно сумме их внутренних сопротивлений.
Аккумуляторные батареи составляются из ряда совершенно одинаковых аккумуляторов. При этом на заводе их подбирают
Рис. 165. Последовательное (а) и параллельное (б) соединения аккумуляторов
Рис. 166. Напряжение, приложенное к приемнику, при различном числе последовательно соединенных аккумуляторов
так, чтобы все они имели одинаковые э. д. с. E = Eak и одинаковое внутреннее сопротивление Rak. Поэтому для батареи, состоящей из п аккумуляторов,
E = nEak; Rэкв= nRak
Параллельное соединение. При параллельном соединении все положительные электроды отдельных аккумуляторов соединяют вместе, и они образуют положительный полюс; все отрицательные электроды отдельных аккумуляторов также соединяют вместе, и они образуют общий отрицательный полюс (рис. 165,б). Нагрузку (приемник) присоединяют к общим отрицательному и положительному полюсам. При этом все аккумуляторы будут находиться под одинаковым напряжением U, а общий ток I равен сумме токов, отдаваемых отдельными аккумуляторами. При параллельном соединении п одинаковых аккумуляторов э. д. с. батареи E = Eak
Смешанное соединение. В тех случаях, когда аккумуляторы не обеспечивают возможности получения необходимого тока и напряжения, применяют последовательно-параллельное (смешанное) их соединение (рис. 167). В данном случае в каждой из двух параллельных групп аккумуляторной батареи имеется по два последовательно соединенных аккумулятора.
Аккумуляторные батареи в большинстве случаев составляются из последовательно соединенных аккумуляторов. Смешанное и параллельное соединения аккумуляторов применяют редко, так
Рис. 167. Смешанное соединение аккумуляторов
как в этих случаях трудно обеспечить равномерное распределение тока между параллельными ветвями. Равенство токов I1 и I2 в отдельных ветвях будет иметь место только в том случае, если будут равны э. д. с. Е1 и Е2, действующие в этих ветвях, и их внутренние сопротивления Rэк1 = Rэк2.

Сравнительная характеристика способов соединения источников тока. Способы соединения химических источников электрической энергии
Химические источники электрической энергии (гальванические элементы, аккумуляторы) для совместной работы можно соединять последовательно, параллельно или смешанно. Группа соединенных между собой тем или иным способом источников образует батарею. В батареи объединяют только однородные источники, имеющие одинаковые э.д.с. и внутренние сопротивления.
Последовательное соединение источников электрической энергии применяют в тех случаях, когда напряжение потребителя превышает эдс одного источника, а номинальный ток потребителя не превышает нормальный разрядный ток одного источника .
Чтобы соединить источники в батарею последовательно, нужно отрицательный полюс первого источника (Рис.14) соединить с положительным полюсом второго, отрицательный полюс второго – с положительным полюсом третьего и т.д. Внешнюю цепь подключают к положительному полюсу последнего, т.е. к оставшимся свободным полюсам батареи. В этом случае э.д.с. источников направлены в одну сторону.
Э.д.с. всей батареи при последовательном соединении источников равна их сумме:
E = E 1 + E 2 +…+ E k . (48)
С учетом того, что в батареи соединяют только однородные источники, имеем
где n – число источников, соединенных в батарею;
E k – э.д.с. одного из источников, включенных в батарею.
Внутреннее сопротивление батареи равно сумме внутренних сопротивлений отдельных источников:
r = r 1 + r 2 +…+r k , (50)
r = n·r к, (51)
где r к – внутреннее сопротивление одного из источников, включенных в батарею.
Емкость батареи при последовательном соединении однородных источников равна емкости одного источника
При последовательном соединении источников электрической энергии с одинаковыми внутренними сопротивлениями сила тока в цепи определится по формуле
, (52)
Число источников батарее, необходимых ля получения заданного напряжения U во внешней части цепи
Параллельное соединение источников электрической энергии применяют в тех случаях, когда ток потребителя больше номинального разрядного тока одного источника, а напряжение потребителя равно э.д.с. одного источника. Чтобы соединить источники электрической энергии в батарею параллельно, нужно их положительные полюсы объединить с один узел, а отрицательные – в другой.
При параллельном соединении э.д.с. батареи равна э.д.с. одного источника:
Внутреннее сопротивление батареи
уменьшается во столько раз, сколько источников с сопротивлением r к включено в нее.
Емкость батареи равно сумме емкостей параллельно соединенных источников.
В случае параллельного соединения источников электрической энергии с одинаковыми э.д.с. и внутренними сопротивлениями сила тока в цепи определится по формуле:
где R – сопротивление внешней цепи.
Число источников n батареи, необходимых для получения заданной силы тока во внешней цепи.
I Р – разрядный ток одного источника.
Смешанное соединение источников электрической энергии применяют в том случае, когда напряжение и ток потребителя больше напряжения и разрядного тока одного источника.
Ток в цепи определяют, разбивая источники на равные группы, в которых они соединены последовательно, а затем на ветви, где они между собой соединены параллельно:
где n Г – число источников, соединенных в одну группу;
m – число параллельных ветвей.
Число последовательно соединенных источников n Г в группе и число параллельных ветвей m находят по ранее приведенным формулам.
Пример. Две параллельные группы аккумуляторов, по три последовательно включенных аккумуляторов в каждой, работают на внешнюю цепь сопротивлением 3,55 Ома. Э.д.с. аккумуляторов 2 В, внутреннее сопротивление 0,003 Ома. Определить напряжение батареи, силу тока и мощность, отдаваемую батареей во внешнюю цепь.
Решение. Э.д.с. группы
Е Г = n Г E K = 3·2 = 6 B.
Э.д.с. всей батареи будет равна э.д.с. Е Г одной последовательно соединенной группы, то есть Е б = Е Г = 6 В.
Сила тока во внешней цепи
Напряжение во внешней цепи U = IR = 1,6·3,55≈5,7 В.
Мощность, отдаваемая во внешнюю цепь,
Р = UI = 5,7·1,6 = 9,12 Вт.
Контрольные вопросы и задания
1.Что такое электрический заряд и какова единица его измерения?
2.Как и в соот
Способы соединения аккумуляторов в батареи
В тех случаях, когда ток и напряжение отдельного источника электрической энергии (в том числе аккумулятора) являются недостаточными для нормальной работы электрических потребителей, применяют последовательное, параллельное и смешанное соединения таких источников.
Последовательное соединение. При последовательном соединении аккумуляторов отрицательный электрод первого аккумулятора соединяют с положительным электродом второго, отрицательный электрод второго — с положительным электродом третьего и т. д. (рисунок 29, а). Нагрузку (приемник) присоединяют к положительному электроду первого и отрицательному электроду последнего аккумулятора.
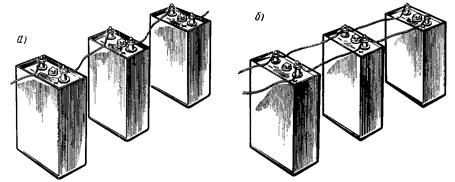
Рисунок 29 — Последовательное (а) и параллельное (б) соединения аккумуляторов
При последовательном соединении аккумуляторов их электродвижущие силы согласно второму закону Кирхгофа складываются и результирующая ЭДС равна сумме ЭДС отдельных аккумуляторов. Следовательно, чем больше аккумуляторов включено в цепь, тем больше напряжение, под которым находятся приемники.
Эквивалентное внутреннее сопротивление последовательно соединенных аккумуляторов равно сумме их внутренних сопротивлений.
Аккумуляторные батареи составляются из ряда совершенно одинаковых аккумуляторов. При этом на заводе их подбирают так, чтобы все они имели одинаковые ЭДС и одинаковое внутреннее сопротивление.
Параллельное соединение. При параллельном соединении все положительные электроды отдельных аккумуляторов соединяют вместе, и они образуют положительный полюс; все отрицательные электроды отдельных аккумуляторов также соединяют вместе, и они образуют общий отрицательный полюс (рисунок 29,б). Нагрузку (приемник) присоединяют к общим отрицательному и положительному полюсам. При этом все аккумуляторы будут находиться под одинаковым напряжением, а общий ток равен сумме токов, отдаваемых отдельными аккумуляторами. При параллельном соединении одинаковых аккумуляторов ЭДС батареи.
Смешанное соединение. В тех случаях, когда аккумуляторы не обеспечивают возможности получения необходимого тока и напряжения, применяют смешанное их соединение (рисунок 30). В данном случае в каждой из двух параллельных групп аккумуляторной батареи имеется по два последовательно соединенных аккумулятора.
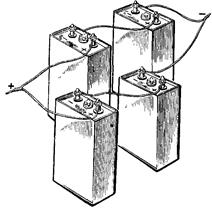
Рисунок 30 — Смешанное соединение аккумуляторов
Аккумуляторные батареи в большинстве случаев составляются из последовательно соединенных аккумуляторов. Смешанное и как в этих случаях трудно обеспечить равномерное распределение тока между параллельными ветвями. Равенство токов I1 и I2 в отдельных ветвях будет иметь место только в том случае, если будут равны ЭДС, действующие в этих ветвях, и их внутренние сопротивления равны.
Вопросы для самоконтроля:
1. Что представляет собой химический источник тока?
2. Что такое электролитическая диссоциация и электролиз?
3. Как возникает ЭДС в гальваническом элементе?
4. Что представляют собой аккумуляторы, и какие бывают?
5. Как устроены кислотные аккумуляторы?
6. Что такое емкость аккумулятора?
7. Каким образом заряжают аккумуляторы и что служит признаками конца заряда у кислотного и щелочного аккумуляторов?
8. Как соединяют аккумуляторы в батареи?
Дата добавления: 2017-11-21; просмотров: 1154;
Похожие статьи:
Тема: Соединение химических источников энергии в батарею
Лабораторная работа № 11
Тема: Соединение химических источников энергии в батарею.
Цель. Произвести соединение первичных элементов, в батарею предварительно рассчитав необходимые их количество для питания задорной нагрузки.
Оборудование и приборы. Первичные элементы с напряжением V и допустимым разрядным током I p, ламповый реостат с номинальным напряжением V , амперметр постоянного тока вольтметр постоянного тока двухполюсным рубильник соединительного провода.
Порядок выполнения.
- Подсчитать мощность лампового реостата по имеющимся надписями на лампочках P=P+P+…P.
- Вычислить ток лампы реостата I=P/V
- Определить необходимое число ветвей в батарее m = I/ I p
- Определить число последовательно соединенных элементов в каждой ветви n = V/V, где V- напряжение одного элемента.
- Вычислить общее количество элементов в батарее N=m*n
- Составить схему соединений элементов в батарею и подключить к ней ламповый реостат с электроизмерительными приборами (рис. 11.1).
Расчет:
I=PU=5,7=1A n= U=6,3=5
6,3 Uo 1,5
m = I = 0,9·1=1 Nz m·n=1,5=5
Ip
Включить рубильник и сравнить показания приборов расчетными данными, сведя их таблицу 11.1.
Таблица 11.1.
Дано Результаты расчетов Показание приборов
Ua (B) U,(B) P,(Bm) Ip (A) I A) m n N U (B) I (A) 1,5 6,3 5,7 1 0,9 1 5 5 6,3 0,9 Вывод: Я научился производить соединение первичных элементов в батарею предварительно заданной нагрузки. Емкость аккумулятора – количество электричества, которое можно получить от элемента во время его разряда.
| Скачать: Лабораторную работу №11 (B) Дата: 09/11/2011 Скачали: 55 Описание: Соединение химических источников энергии в батарею. |
Виды соединений источников тока:
последовательное | параллельное |
К ЭДС
батареи равна алгебраической сумме
ЭДС отдельных источников. Знак Внут. сопротивление батареи r = r1 + r2 + … + rn Частный случай – одинаковые
источники ( | О обязательно одноименные) соединяются в один узел, остальные — в другой. Внутри источников даже при отключенной батареи протекают токи. Расчет ЭДС производится по законам электротехники. Рассмотрим частный случай — одинаковые
источники соединены одинаковыми
полюсами. (В отсутствии нагрузки токов в батарее
нет.) общ. =
rобщ. = I
= |
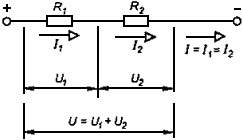
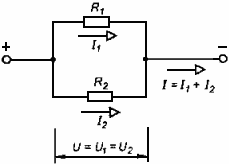
Последовательное и параллельное соединение проводников.
Вид соединения | Последовательное | Параллельное |
Схема соединения |
|
|
Законы: | 1. I=I1=I2= …= In— сила тока одинакова во всех проводниках 2. U=U1+U2 +…+Un — падение напряжения в цепи равно сумме падения напряжений на отдельных участках 3. Общее
сопротивление цепи равно сумме
сопротивлений на отдельных участках
цепи. Падение
напряжения на проводниках прямо
пропорционально их сопротивлениям: Если R1= R2 = … = Rn, то R = nR1 | 1. U=U1=U2 …=Un — напряжение на всех участках цепи одинаково 2. I=I1+I2+…+In— сила тока в разветвленной части цепи равна сумме сил токов, текущих в разветвленных участках цепи 3. Общее
сопротивление цепи равно Сила
тока в участках разветвления цепи
обратно пропорциональна их сопротивлениям Если
R1=
R2 =
… = Rn,
то R
= |
Шунтирование амперметра.
Важным
примером применения последовательного
и параллельного соединения проводов
являются различные схемы включения
электроизмерительных приборов. Допустим,
что имеется некоторый амперметр,
рассчитанный на максимальный ток Imax,
а требуется измерить большую силу тока.
В этом случае параллельно к амперметру
присоединяют малое сопротивление r, по
которому направится большая часть тока.
Его называют обычно шунтом. Сопротивление
амперметра – R, и пусть R/r=n. Сила тока в
цепи, амперметре и в шунте равны
соответственно I, Iа и Iш.
Тогда, 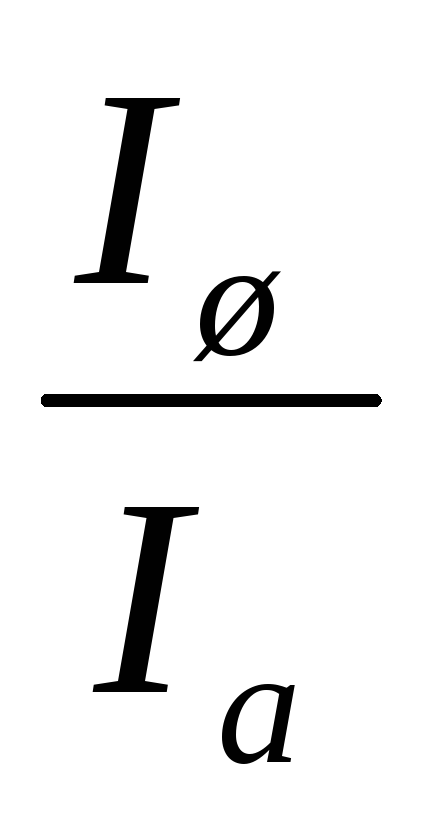 =
=  =
n или Iш = Iаn
Полный
ток I в цепи равен I = Iа + Iш = Iа + Iаn
= Iа(n+1)
или Iа = I
=
n или Iш = Iаn
Полный
ток I в цепи равен I = Iа + Iш = Iа + Iаn
= Iа(n+1)
или Iа = I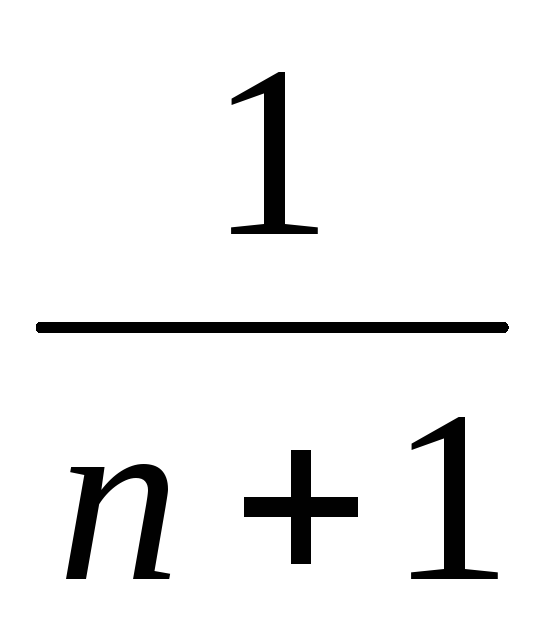 r =
r = 
П араллельное
присоединение шунта к измерительному
прибору с целью изменения его
чувствительности называют шунтированием.
араллельное
присоединение шунта к измерительному
прибору с целью изменения его
чувствительности называют шунтированием.
Схема шунтирования амперметра добавочным малым сопротивлением r.
Лекция по теме «Химические источники тока»
Учебные вопросы
Виды химических источников тока
Классификация гальванических элементов
Принцип действия аккумулятора
Топливные элементы
Виды химических источников тока
Химическими источниками тока (ХИТ) называются электрохимические устройства, в результате работы которых химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию постоянного тока. К ним относятся гальванические элементы, аккумуляторы, топливные элементы. Во всех видах химических источниках тока используются электролиты – водные, неводные, твердые. К достоинствам современных ХИТ относятся относительно высокие КПД (до 0,8) и высокая удельная мощность (количество энергии, отдаваемое в единицу времени единицей массы ХИТ), что позволяет им конкурировать с другими источниками тока. Основным их недостатком является ограниченный срок службы.
Классификация гальванических элементов
Среди большого разнообразия гальванических элементов можно выделить три основных типа.
Первый тип . Пластины из двух различных металлов находятся в растворах солей, содержащих собственные ионы. К этому типу относится медно-цинковый гальванический элемент (элемент Даниэля – Якоби ).
Второй тип. Пластины из двух различных металлов находятся в растворе одного электролита. Примером может служить элемент Вольта, состоящий из двух пластин (Zn и Cu), погруженных в раствор серной кислоты. При его работе происходят следующие процессы:
(-)
А: Zn
Zn2+ + 2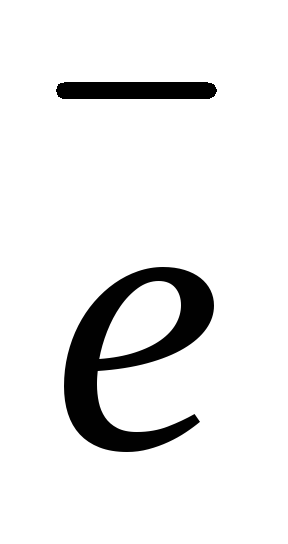 — окисление (анодный процесс)
— окисление (анодный процесс)
(+)
К: 2Н+ + 2
Н2
Н2  —
восстановление (катодный процесс)
—
восстановление (катодный процесс)
Выделяющийся водород насыщает поверхность катода (меди), в результате чего получается электрод другого состава (не медный, а водородный).
Схема гальванического элемента Вольта:
2 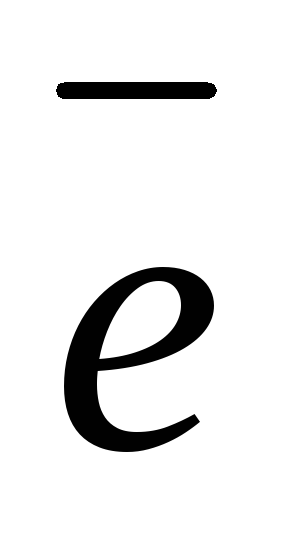

(-) Zn / Zn2+ H2SO4 2H+ / H2 (Cu) (+)
В скобках справа указывается (Сu) — место выделения водорода.
Третий тип. Гальванические элементы составлены из двух совершенно одинаковых по природе электродов (например, медных), погруженных в растворы одного и того же электролита, но различной концентрации. Такие элементы называются концентрационными.
Схема медного концентрационного гальванического элемента:
2 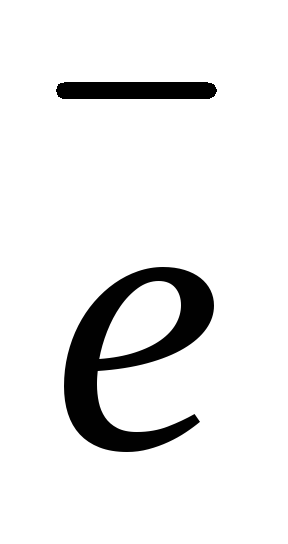

(-) Cu / CuSO4 CuSO4 / Cu (+) ,
C1 < С2
где C1 и С2 — концентрация раствора электролита, моль/л.
Роль анода выполняет электрод, находящийся в более разбавленном растворе, так как его электродный потенциал имеет более низкое значение по сравнению со вторым электродом. ЭДС такого гальванического элемента зависит только от соотношения концентраций потенциалопределяющих ионов (в данном случае от концентрации CuSO4).
Практического значения как источники электрической энергии концентрационные гальванические элементы не имеют.
Принцип действия аккумулятора
Аккумуляторы – гальванические элементы, которые на основе обратимых электрохимических реакций могут многократно накапливать химическую энергию и отдавать ее для потребления в виде электрической энергии постоянного тока.
Аккумуляторы — устройства многоразового действия, сочетающие в себе гальванический элемент и электролизер. Под воздействием внешнего постоянного тока в них аккумулируется (накапливается) химическая энергия, которая затем превращается в электрическую в результате окислительно-восстановительной реакции. Процесс накопления химической энергии называют зарядом аккумулятора, процесс ее превращения в электрическую — разрядом аккумулятора. В первом случае аккумулятор работает как электролизер, во втором – как гальванический элемент.
Устройство и принцип действия всех аккумуляторов одинаков. Основное отличие состоит в материале электродов и типе электролита. На аноде как при разряде, так и при заряде протекает процесс окисления, на катоде – процесс восстановления.
Наиболее распространенными являются кислотные и щелочные аккумуляторы.
Кислотный аккумулятор (свинцовый аккумулятор) представляет собой пластины в виде отливок из хартблея (твердого свинца с примесью сурьмы) ячеистой структуры, собранные в батареи и помещенные в баки из эбонита или полипропилена с электролитом. В ячейки пластин предварительно запрессовывается смесь оксида свинца (PbO) с глицерином, обладающая способностью затвердевать в виде глицерата свинца. Электролитом служит раствор серной кислоты (35 — 40 % раствор H2SO4). При взаимодействии оксида свинца с H2SO4 образуется PbSO4.
PbOтв. + H2SO4(р-р) PbSO4тв. +
H2O
PbSO4тв. +
H2O
При первичной и последующих зарядах аккумулятора, когда он работает как электрохимическая ячейка, PbSO4 на катоде превращается в свинец (Pb), а аноде — в диоксид свинца (PbO2), которые и являются электродами:
(-) К : PbSO4(тв) + 2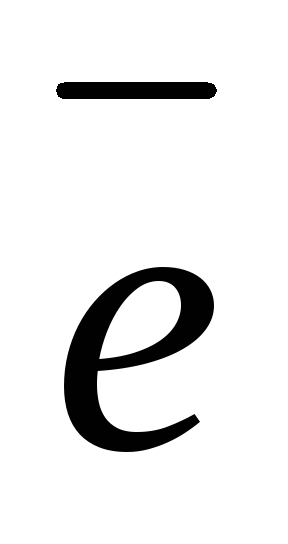
 Pb(тв) + SO
Pb(тв) + SO (р-р)
(р-р)
(+) А : PbSO4(тв) +2 Н2О  PbО2(тв) + 2
PbО2(тв) + 2 + 4 Н+ + SO
+ 4 Н+ + SO (р-р)
(р-р)

2PbSO4(тв) + 2H2O 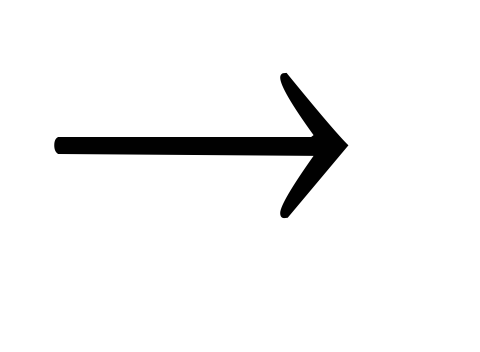 Pb(тв) + PbO2(тв) + 2 H2SO4(р-р)
Pb(тв) + PbO2(тв) + 2 H2SO4(р-р)
ЭДС заряженного аккумулятора приблизительно равна 2 В (если 6 таких аккумуляторов последовательно соединить, получается обычный автомобильный аккумулятор с ЭДС = 12В).
При работе аккумулятора – его разрядке, когда он работает как химический источник тока, на электродах протекают электродные процессы в обратном направлении.
По мере его разрядки расходуются материалы катода (PbО2) , анода (Pb) и электролит — серная кислота. Напряжение на зажимах аккумулятора падает и его необходимо заряжать. Для зарядки аккумулятор подключают к внешнему источнику тока, направление тока противоположно разрядному.
Токообразующие и электродные реакции в свинцовом аккумуляторе можно представить в виде:
Pb(тв) + SO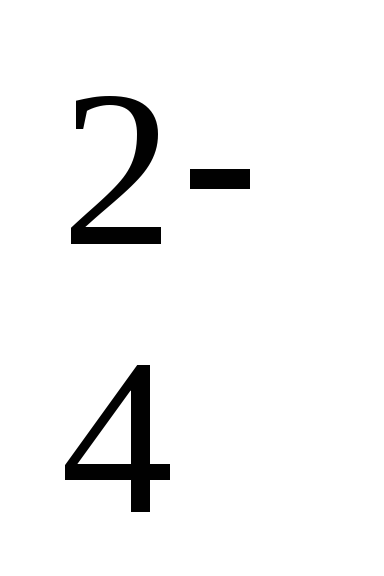 (р-р)
PbSO4(тв) + 2
(р-р)
PbSO4(тв) + 2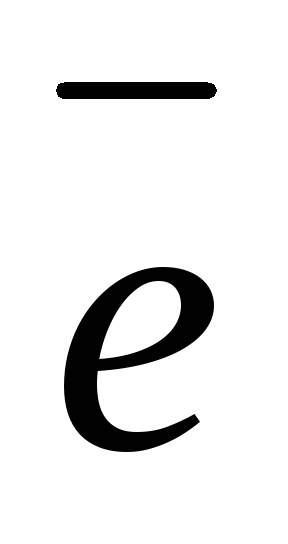
PbО2(тв) + 2 +
4 Н+(р-р)+
SO
+
4 Н+(р-р)+
SO (р-р)
PbSO4(тв) + 2 Н2О
(р-р)
PbSO4(тв) + 2 Н2О

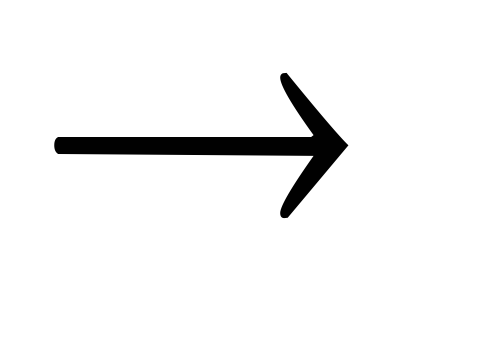 «разрядка»
«разрядка»
Pb(тв) + PbO2(тв) + 2 H2SO4 (р-р) 2 PbSO 4(тв) + 2H2O
 «зарядка»
«зарядка»
Cхема кислотного аккумулятора:
( — ) Pb / Pb2+ │H2SO4 │Pb2+ / PbO2 ( + )
Стандартные
величины потенциалов для электродов
свинцового аккумулятора имеют следующие
значения: 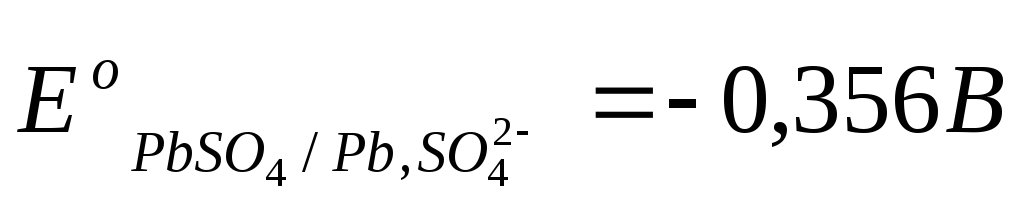 ,
,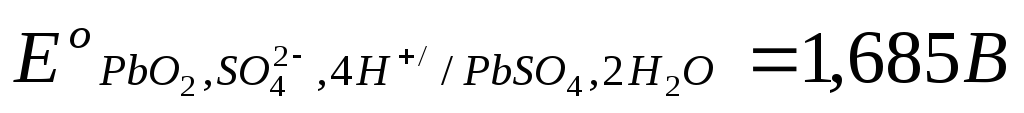 .
.
ЭДС аккумулятора, как химического источника тока, рассчитывается по уравнению:

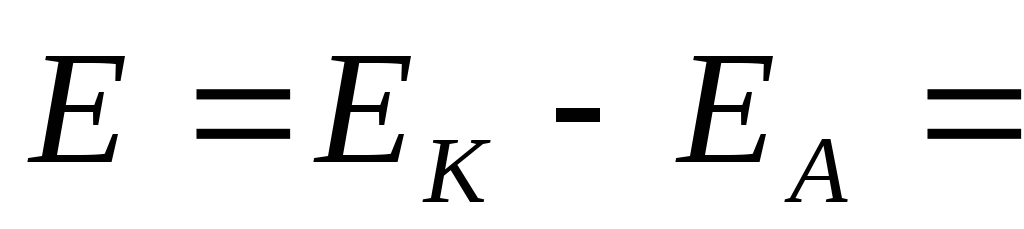 —
— 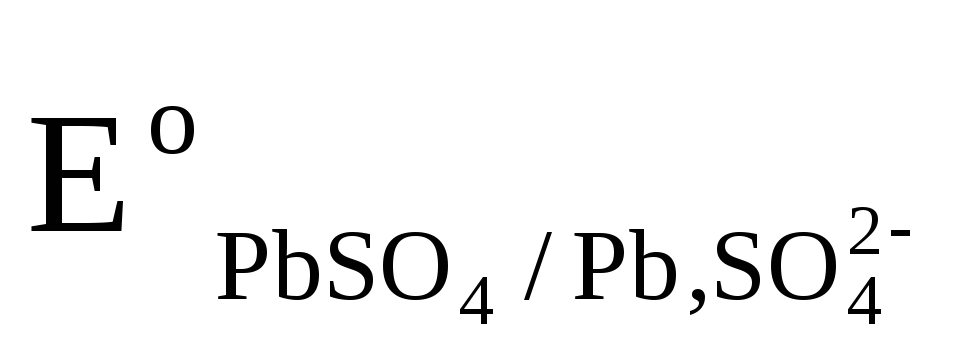 +
+ 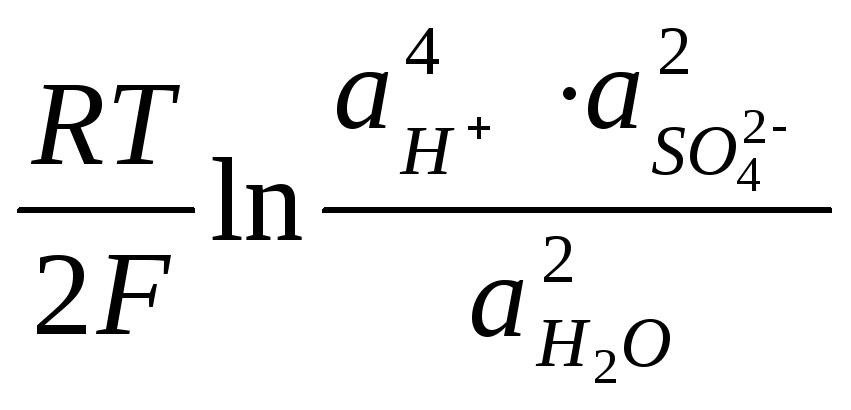
Из данного уравнения видно, что ЭДС аккумулятора зависит от концентрации (активности) серной кислоты, которая возрастает при заряде аккумулятора и уменьшается при его разояде. О степени разряда аккумулятора судят по концентрации электролита, т.е. концентрации H2SO4. Используя концентрированные растворы H2SO4, можно было бы увеличить ЭДС аккумулятора, однако при концентрации H2SO4 больше 39% резко уменьшается электропроводность растворов и увеличивается растворимость свинца, поэтому оптимальными являются 32 — 39 % — ные растворы H2SO4.
Во время заряда аккумулятора растет напряжение на его полюсах. В конце оно достигает такого значения, что начинается электролиз воды, сопровождающийся выделением водорода на катоде и кислорода – на аноде:
(-)
К : 2 Н2О
+ 2 
Н2
Н2 +2
ОН—
+2
ОН—
(+)
А : 4 ОН—
О2 + 2 Н2О
+ 4
+ 2 Н2О
+ 4 

2
Н2О
2 Н2+
О2
Так называемое «кипение» электролита является признаком окончания заряда свинцового аккумулятора. Заряженный аккумулятор может быть сразу использован по назначению. При хранении же из него выливают электролит и промывают водой. В таком виде он может находиться до 2 лет и для его использования достаточно лишь залить электролит. При хранении незаряженного аккумулятора с раствором серной кислоты происходит его «сульфатирование» – образование на пластинках большого количества PSO4. Когда кислотный аккумулятор работает, давая ток, PSO4 осаждается в очень мелкозернистой форме на поверхности электродов. Когда же аккумулятор выключен, мелкозернистый слой рекристаллизуется и образуются более крупные кристаллы, которые могут закупорить поры электрода, уменьшая его поверхность или отрываться от электрода и оседать на дно аккумулятора. Процесс сульфатации является основной причиной выхода аккумулятора из строя, поэтому нужно следить, чтобы аккумулятор не простаивал частично в разряженном состоянии.
Преимущества свинцового аккумулятора – высокий КПД (около 80 %), высокая ЭДС и относительно малое ее изменение при разряде, большая электрическая емкость, устойчивость в работе. Недостатки – большая масса и, следовательно, малая удельная емкость, саморазряд аккумулятора при хранении, малый срок службы (2 – 5 лет), а также токсичность свинца и сильные окислительные свойства H2SO4.
Щелочные аккумуляторы различаются по материалу пластин отрицательно заряженного электрода. Наиболее распространенные из них кадмий — никелевые (Cd — Ni) и железо — никелевые ( Fe – Ni ) аккумуляторы. Активная масса положительных пластин состоит, в основном, из гидратированного оксида никеля (III), кроме того в ней содержится графит, добавляемый для увеличения электропроводности. Электролитом служит раствор КОН (20 %), содержащий небольшое количество LiOH. ЭДС заряженного аккумулятора (Cd — Ni) приблизительно равна 1,3 В.
Химические Источники Тока (ХИТ): Характеристики, Применение

Любая батарейка или аккумулятор дает ток за счет протекающих внутри них химических реакций
Химические источники тока (сокращенно ХИТ) – это источники электродвижущей силы (ЭДС), в которых в электрическую энергию превращается энергия протекающих внутри химических реакций. Используют их сегодня повсеместно – это и современные электромобили и портативная радиоэлектроника, и медицинское оборудование, и портативные компьютеры.
Все это делает источники тока электрохимические очень важным изобретением, которым пользуются вот уже 2-ю сотню лет. Именно про ХИТ мы подробно и поговорим в сегодняшней статье.
Классификация химических источников тока

Классификация ХИТ
Все ХИТ принято подразделять на три основные категории:

Как устроены гальванические батареи
- Первичные гальванические элементы – внутри таких источников происходят химические окислительно-восстановительные реакции, энергия которых и переходит в электрическую. Данные реакции являются необратимыми, поэтому элементы невозможно перезарядить.
- Состоят такие батареи из двух электродов, которые имеют разный электродный потенциал, металлического проводника, по которому могут перемещаться электроны, и электролита, который помогает перемещению ионов между электродами.
Интересно знать! Напомним, что именно поток электронов и приводит к возникновению электрического тока.

Вторичный химический источник тока
- Вторичные ХИТ, они же электрические аккумуляторы – тоже являются гальваническими элементами, однако их особенность заключается в том, что возможна перезарядка.
- В отличие от батарей, которые исчерпывают свою работоспособность при разряде, аккумуляторы могут регенерироваться, то есть повторно накапливать энергию и перезапускать цикл химических реакций.
- Возобновление заряда происходит при пропускании через элемент электрического тока, для чего нужна внешняя цепь. Все мы ежедневно заряжаем свои телефоны и смартфоны, ноутбуки и планшеты. Аккумуляторы применяются практически везде, и это не удивительно – их ресурс намного выше, чем у любой первичной батареи в сотни раз, при том, что цена больше до 10-ти раз.
- Прообраз первой аккумуляторной батареи был создан в далеком 1803 году немецким физиком-химиком И. Риттером. Его устройство имело в составе пятьдесят медных кружков, между которыми было проложено влажное сукно. Когда через него проходил ток от Вольтова столба, изделие само становилось источником электрического тока.

Топливный источник тока химический
- Последним типом химических источников тока являются топливные элементы, или электрохимические генераторы. Основное отличие их от гальванических элементов это то, что вещества необходимые для электрохимической реакции подаются внутрь извне, а продукты от реакций, наоборот, удаляются.
- Подобный подход позволяет организовать долгую непрерывную работу без фактической перезарядки.
- Впервые применять топливные источники тока стали во второй половине 20-го века, несмотря на то, что основные принципы функционирования были открыты в далеком 1839 году. В 1965 году их впервые задействовали в космической технике – это был элемент КК «Джемини». Его изначальное расчетное время работы составляло от суток, до 2-х месяцев. Эти элементы имели достаточное преимущество перед солнечными батареями с буферными химическими батареями в плане массы и габаритов, а также удельной мощности.
- Первая топливная батарея КК «Джемини» состояла из 3 блоков по 32 элемента, каждый из которых выдавал напряжение в 0,8В, и работала на газообразном топливе (кислород и водород).
Характеристики гальванических источников тока

Щелочные аккумуляторы и их свойства
Характеристика химических источников тока включает в себя следующие параметры:

Уравнение Нернста для электродного потенциала
- Электродвижущая сила – этот параметр гальванического элемента зависит от состава используемого электролита и типов металлов, из которых изготовлены электроды. Описывают ЭДС термодинамические функции (уравнение Нернста), приложенные к протекающим электрохимическим процессам.

Измеряется емкость обычно в миллиамперах в час
- Емкость элемента питания – тут все просто, имеется в виду количество энергии, которое элемент может отдать при разряде. Данный параметр напрямую зависит от массы запасенного в батарее реагентов и скорости их превращения. Емкость элемента будет снижаться, если элемент будет охлажден, либо вырастет ток разряда.
- Энергия гальванического элемента. Этот параметр высчитывается путем перемножения емкости на выдаваемое напряжение. Энергия будет уменьшаться по мере роста разрядного тока. Обратный эффект будет достигнут при росте температуры (до определенного уровня) и увеличении используемых реагентов.

Прототип гальванической батареи
- Сохраняемость – по сути, срок годности элемента, в течение которого он способен не менять своих основных характеристик в допустимых пределах.
Совет! Чем выше температура, тем быстрее сокращается срок хранения.
- Плотность энергии – количество запасенной энергии в расчете на единицу массы аккумулятора или его объема.
- Саморазряд первичного химического источника тока – очень важный параметр, указывающий на потерю емкости батареей без подключенной к ней нагрузки. То есть параметр фактически сопоставим со сроком службы элемента.
- Саморазряд химических источников тока вторичных, по сути, то же самое, однако этот параметр меняется во времени. Особенно высоко его значение после полной подзарядки аккумулятора, но по мере разрядки он ослабевает.
Интересно знать! Для никель-кадмиевых аккумуляторов, функционирующих исправно, не допускается потеря более 10% от максимального заряда за 1 сутки. Никель-металлгидридные имеют меньший показатель, а у литий-ионных этот эффект практически отсутствует, растягиваясь на месяцы. Герметичные кислотные аккумуляторы потеряют за год всего 40% своего заряда, однако, если температура воздуха будет выше 20 градусов, процесс потечет куда быстрее, и наоборот, приближаясь к нулю – будет замедляться.
Более подробное строение элементов

Гальваническая батарейка в разрезе
Мы уже дали определение химических источников тока и назвали их основные типы. Теперь давайте рассмотрим немного глубже, как они устроены, и какие химические реакции внутри протекают.

Элемент Даниэля-Якоби
- Итак, начнем с первичных гальванических элементов. В их состав входят реагенты (окислители и восстановители), которые участвуют в прямом преобразовании энергии. Выработка тока прекращается после того, как реагенты полностью израсходуются.
- В качестве примера того, как функционирует элемент, давайте опишем давно известное устройство Даниэля-Якоби. Выше представлена его схема.
- Итак, два электрода (цинковый и медный) опущены в колбы наполненные растворами сульфатов цинка и меди, соответственно.
- Растворы разъединены внутренней цепью (полупроницаемой перегородкой), а электроды соединяются внешней цепью (металлический проводник) через гальванометр, обозначенный на схеме как 2.

Элемент Даниэля
- Когда цепь замкнута, на обоих электродах протекают процессы гидратации ионов металлов. Между самим металлом и его ионами в растворе устанавливается химическое равновесие.
- В связи с тем, что цинк и медь имеют разную активность электродных потенциалов, электроды приобретают разный заряд по величине, то есть концентрация свободных электронов на них будет значительно отличаться.
- Как только будет замкнута внешняя цепь, концентрация электронов придет в равновесие и они по внешнему проводнику начнут перемещаться от цинкового электрода к медному.
- По этой причине концентрация электронов на цинковом электроде начинает уменьшаться, из-за чего происходит смещение равновесия на границе Zn|ZnSO4 в сторону катионов цинка (их образования). Другими словами цинк начинает растворяться.
- С медным электродом происходит обратный процесс – равновесие смещается в другую сторону и начинает образовываться металлическая медь, или другими словами – медь начинает восстанавливаться.
- Если говорить более конкретно, то на цинковом электроде происходит процесс окисления, который в электрохимии называется анодным процессом, а сам электрод – анодом. На медном электроде (катоде) – процесс восстановления, называемый еще катодным.

Классическая солевая батарейка
- Наиболее широко распространились элементы питания, состоящие из марганца и цинка. Они не содержат раствора электролита, поэтому называются сухими.
- Эти элементы при всем конструкционном многообразии делят всего лишь на два типа, в зависимости от рН электролита и состава: солевые и щелочные. Для солевых марганцево-цинковых элементов (МЦ) используется электрохимическая схема Лекланше (Zn|Nh5Cl|MnO2) – в качестве катода выступает цинковый электрод, в качестве анода – электрод их диоксида марганца и графита, а электролитом является паста из муки или крахмала с раствором хлорида аммония.
- В щелочных элементах питания применяется другая схема (Zn|KOH|MnO2). При этом электроды делаются из тех же материалов, а в качестве электролита применяется паста из гидроксида калия.
- Такие элементы обладают большей емкостью, лучше переносят низкие температуры и высокие разрядные токи. Однако они намного сложнее солевых источников, почему и имеют значительно большую цену.
- Данные элементы имеют многоцелевое назначение и применяются в быту повсеместно. Они могут выступать источниками автономного питания для любой радиоаппаратуры, фотоаппаратов, калькуляторов, различных тестовых приборов, часов, фонариков, для запитки схем Биоса материнских плат персональных компьютеров и прочего.

Процесс зарядки аккумуляторных батарей
- Аккумуляторы, или вторичные химические источники тока – отличает эти элементы то, что благодаря воздействию внешнего тока, электрическая энергия может переходить в химическую, а при подключении внешней цепи происходит обратный процесс.
- Одним из часто встречающихся типов таких устройств являются свинцовые аккумуляторы, которые также называют и кислотными.
- В качестве электролита выступает 25-30%-ый раствор серной кислоты, а материалом для электродов служат свинцовые решетки. При взаимодействии этих веществ свинец превращается в следующее соединение — PbSO
- Процессы, протекающие на аккумуляторных электродах, до сих пор до конца не изучены, что говорит об их высокой сложности. Допускается, что одновременно происходят изменения в твердой фазе и в растворе, с зависимостью скоростей этих реакций от условий поляризации.
- Применяются такие элементы в основном в качестве источников питания в автомобилях.
- Помимо кислотных существуют и щелочные аккумуляторы, среди которых больше остальных распространились никель-металлгидридные и никель-кадмиевые устройства, электролитом в которых является гидроксид калия (КОН).
- Для переносной электроники, например, ноутбуков, планшетов, смартфонов используются в основном литий-ионные аккумуляторы, а также литий-полимерные, обладающие приличной емкостью и отсутствием эффекта памяти.
Про литий-ионные аккумуляторы мы поговорим в отдельной главе, так как эти устройства на сегодня в быту самые часто встречающиеся.

Строение электрохимического генератора тока
- Топливные элементы питания, по сути, тоже являются гальваническими, только восстановитель и окислитель находятся вне самого элемента. Они подаются во время работы к электродам раздельно и непрерывно.
- При работе такого элемента сами электроды не расходуются, как в обычных батарейках.
- В качестве окислителя обычно применяется кислород (чистый или из воздуха), а в качестве восстановителя – водород, метан и метанол, которые могут быть как в жидком, так и в газообразном состоянии.
- Электролитом при этом является щелочь.
Литий-ионные аккумуляторные батареи
Теперь, как и обещали, давайте подробно обсудим, что такое литий-ионные аккумуляторы, как они устроены и как ими правильно пользоваться. Тема очень интересная, и поможет не только увеличить объем теоретических знаний, но и практических, которые, к примеру, помогут продлить срок службы вашего телефонного или любого другого аккумулятора.
Строение

На фото — литий-ионный аккумулятор от сотового телефона
- В качестве катода (отрицательного электрода) используется алюминий, а в качестве анода (положительного электрода) – медь. Выполняются они обычно в виде фольги, в форме цилиндра или продолговатого пакета.
- Разделяются электроды пористым сепаратором, который пропитал электролитом.

Схематическое строение литий-ионного аккумулятора
- Все электроды устанавливаются в прочный корпус и подсоединяются к токосъемным клеммам.
- Попутно внутри корпуса могут устанавливаться и отдельные устройства, которые призваны продлить срок службы аккумулятора и сделать эксплуатацию безопасной. К таковым относятся:
- Устройства, реагирующие на изменения температурного коэффициента изменением сопротивления.
- Устройство разрыва контакта между катодом и клеммой, в случае превышения допустимого давления газов внутри.
- Предохранительные клапаны, способные сбрасывать аварийное давление.
- Также используются и внешние устройства электронной защиты, которые также предупреждают аварийный перегрев, перезаряд и короткое замыкание.
- Конструктивно аккумуляторы изготавливают цилиндрического типа (как обычные батарейки) либо призматического (как в телефонах). В первом случае электроды с сепаратором сворачиваются рулоном, а во втором они накладываются друг на друга.
- Литий-ионные аккумуляторы абсолютно герметичные устройства, что продиктовано необходимостью защиты от утечки электролита, а также защитой от попадания внутрь паров воды и кислорода, что приводит к выходу элемента из строя.
Принцип работы

Как работает аккумулятор
Разберем сначала разряд.
- При подключении во внешнюю цепь заряженного аккумулятора, начинает протекать химическая реакция, благодаря которой образуются свободные электроны, которые, как мы помним, «хотят» попасть на катод. Через электролит им не пройти, поэтому они «отправляются в путь» через внешнюю цепь – так образуется ток, который питает подключенные к источнику устройства.
- «Улетевшие» электроны оставляют ионы лития (положительно заряженные), которые через электролит направляются к катоду.
- После полного перемещения электронов, аккумулятор остается разряженным.
Чтобы восполнить запас энергии, процесс нужно обратить вспять. К аккумулятору подключается зарядное устройство, из-за чего электроны устремляются обратно к аноду, пока тот не соберет прежнее количество электронов. Далее цикл может повторяться большое количество раз.
Емкость литий-ионной батареи – это ни что иное, как количество ионов лития, которые могут «прилипнуть» к электродам. Попадают они в кратеры (микроскопические поры на аноде и катоде).

При выходе аккумулятора из строя требуется его замена на новый
- Со временем материал электродов начинает деградировать. По этой причине они уже не могут удерживать прежнее количество ионов лития, то есть происходит потеря емкости. Данный процесс будет продолжаться до тех пор, пока элемент полностью не утратит свою работоспособность.
- Строение литий-ионных аккумуляторов таково, что постоянно требуется контроль за уровнем заряда. С этой целью в симбиозе с ними применяют контроллеры заряда. Эти устройства полностью ведут процесс зарядки, выставляя необходимое напряжение в зависимости от стадии.

Зарядное устройство
- Процесс зарядки через контроллер протекает обычно в следующей последовательности. Вначале подается ток, составляющий 10% от номинального. Напряжение при этом составляет 2,8 Вольт. Далее происходит увеличение тока при достижении напряжением отметки в 4,2 Вольта. Приближаясь к финалу, ток постепенно ослабевает, но напряжение так и остается на достигнутом уровне.
- Описанный процесс, в принципе, универсален, но может отличаться в зависимости от типов аккумулятора и применяемого контроллера.
Характеристики аккумуляторов

Именно такие аккумуляторы установлены в батареи для ноутбуков
Изготавливаемые сегодня литий-ионные аккумуляторы бывают двух видов: таблеточные и цилиндрические.
Все они могут иметь следующие рабочие параметры и характеристики:
- Минимальное рабочее напряжение составляет 2,2-2,5 В;
- Максимальное напряжение обычно не превышает 4,35 В, тогда как маркировка указывает 5 В.
- Время зарядки зависит от мощности зарядного устройства и емкости самого аккумулятора, поэтому обобщить данные достаточно сложно. Обычно этот параметр составляет 2-4 часа.
- Саморазряд при комнатной температуре не превышает 7% в год, что как понимаете, очень мало.
- Работать аккумуляторы могут при температурах от -20 до +60 градусов, естественно, меняя свои рабочие характеристики.
- Аккумуляторы теряют около 20% своей емкости по истечении от 500 до 1000 циклов заряда\разряда.
Для таких аккумуляторов характерны следующие плюсы:
- Высокая плотность энергии, по сравнению с никель-кадмиевыми и никель-металлгидридными аккумуляторами.
- Высокое напряжение одного элемента. Для сравнения один никель-металлгидридный аккумулятор выдает всего лишь 1,2 В, поэтому их используют в количестве 4-х штук, чтобы получить то же рабочее напряжение.
- «Эффект памяти» у них отсутствует, что намного упрощает процесс эксплуатации.

«Эффект памяти» требует особого подхода к заряду аккумулятора
Интересно знать! Эффект памяти – это изменение полезной емкости аккумулятора, из-за нарушения режима зарядки. То есть, если постоянно заряжать не до конца севший аккумулятор, он «запомнит» нижний порог и будет «считать» его нулевым.
- Большое число циклов перезарядки.
- Достаточно длительная эксплуатация.
- Высокий диапазон рабочих температур, что позволяет использовать такие устройства в разных погодных условиях.
- Литий-ионные аккумуляторы более безопасны в плане экологии.
Советы по эксплуатации аккумуляторов
А теперь самые простые советы, которые помогут прослужить вашим аккумуляторам максимально долго.
- Берегите элементы питания от огня и воды – оба фактора чреваты выходом из строя.
- Чрезмерное охлаждение и нагревание, а также резкая смена температур тоже губительны.
- Применяйте соответствующий вашему аккумулятору тип зарядки, коих есть аж 4 штуки.
- Первый – это медленный заряд низким постоянным током. Происходит он в течение довольно длительного времени – до 18 часов. Такой метод подходит почти для всех аккумуляторов и является самым безопасным.
- Второй – быстрый заряд. Происходит в течение 3-5 часов при постоянном токе в 1/3С.
- Третий – дельта V заряд (ускоренный) — начальные ток равен номинальной емкости элемента, напряжение постоянно меняется. Заряд происходит за 1-1,5 часа. При этом возможен перегрев и разрушение устройства.
- Четвертый тип называется реверсивным. При нем длинные импульсы заряда сменяются короткими импульсами разряда. Такой метод наиболее полезен для аккумуляторов с «эффектом памяти».
Совет! Прилагаемая к аккумуляторным батареям инструкция обычно содержит рекомендации по режиму зарядки.
На этом закончим наш обзор. Мы разобрали электрохимические источники тока и получили простейшее представление об их работе. Если вы хотите изучить тему глубже, то уже не обойтись без учебных пособий и видео, которые можно легко отыскать в сети.




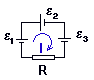 аждый
полюс промежуточного источника
соединяется с одним полюсом предыдущего
или последующих источников.
аждый
полюс промежуточного источника
соединяется с одним полюсом предыдущего
или последующих источников.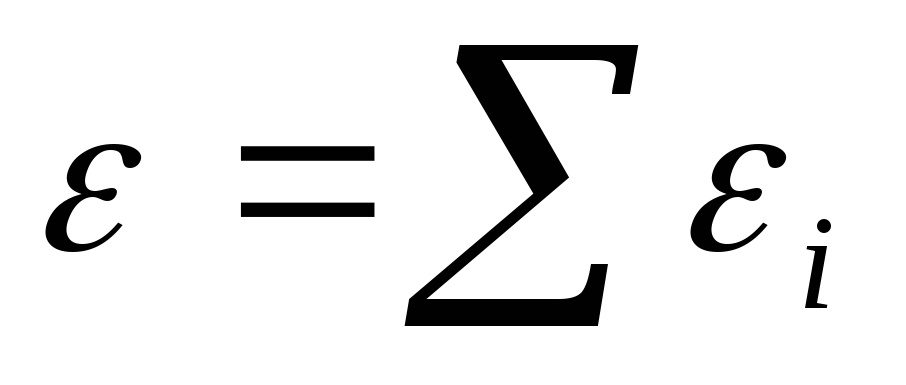
 определяется произвольно выбранным
положит. направлением обхода контура
(см. рис. – по часовой стрелке). Если
при обходе переходим от «-» полюса к
«+», то
определяется произвольно выбранным
положит. направлением обхода контура
(см. рис. – по часовой стрелке). Если
при обходе переходим от «-» полюса к
«+», то  >0. Например, на приведенном рис.:
= 1 — 2 — 3
>0. Например, на приведенном рис.:
= 1 — 2 — 3 1=
1= 2=
…=
2=
…= n и r1 = r2 =… =rn) соединены разноимёнными полюсами. I
=
n и r1 = r2 =… =rn) соединены разноимёнными полюсами. I
= 
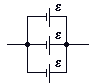 дни
полюса источников (не
дни
полюса источников (не
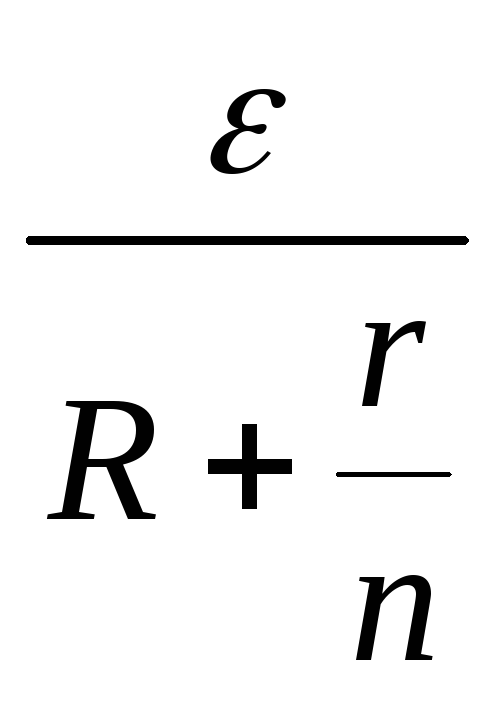
 =
=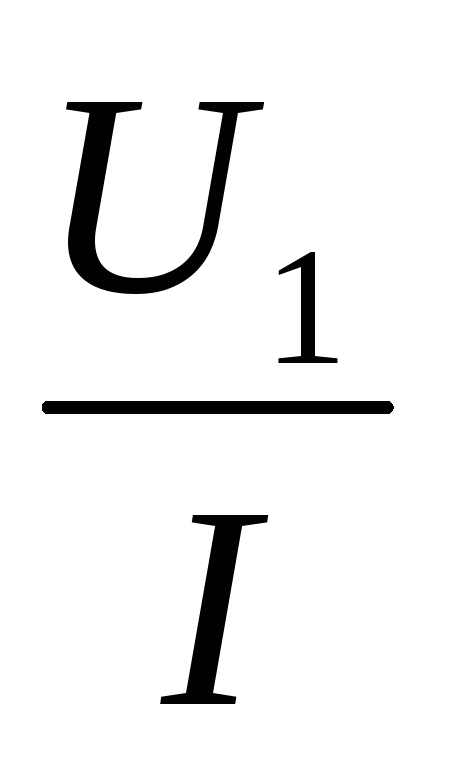 +
+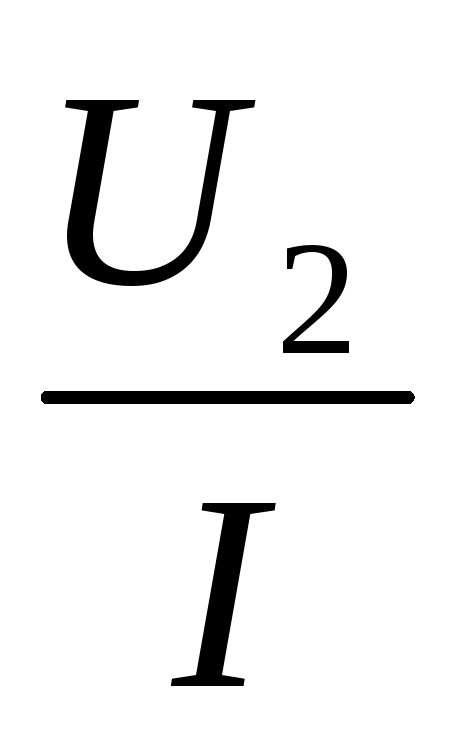 +…+
+…+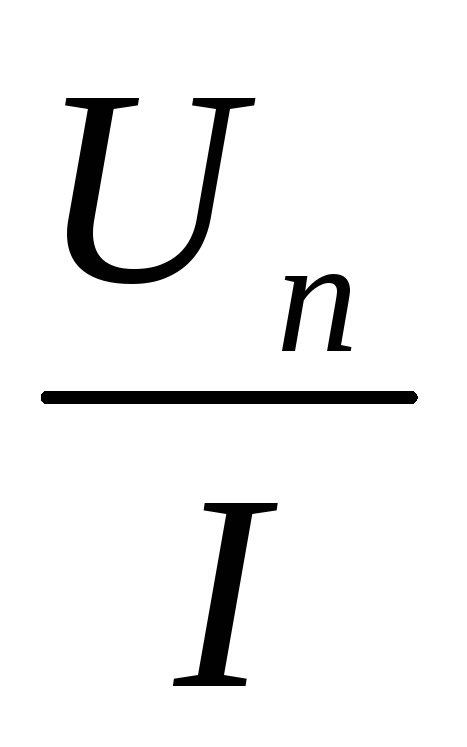
R
=
R1+
R2+
…
+
Rn
R
=
R1+
R2+
…
+
Rn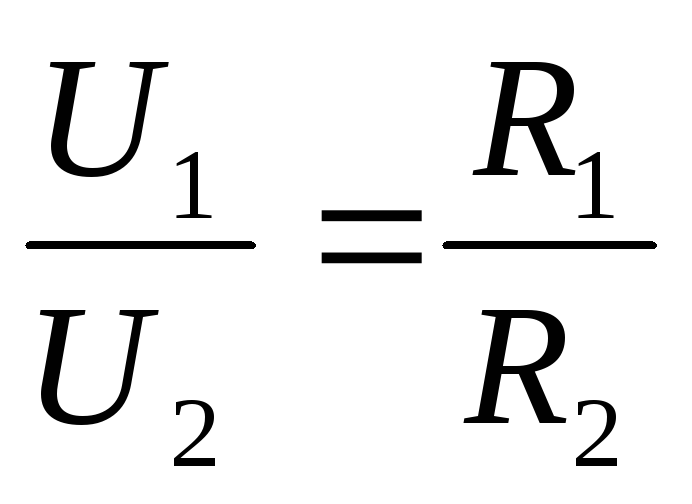
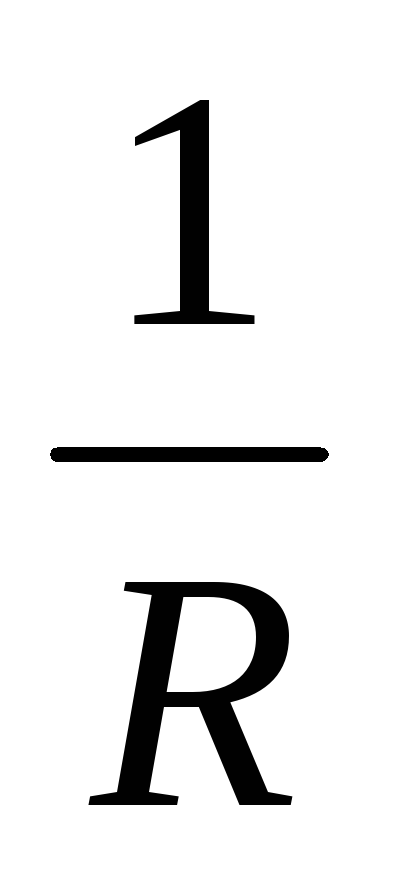 =
=  +
+ 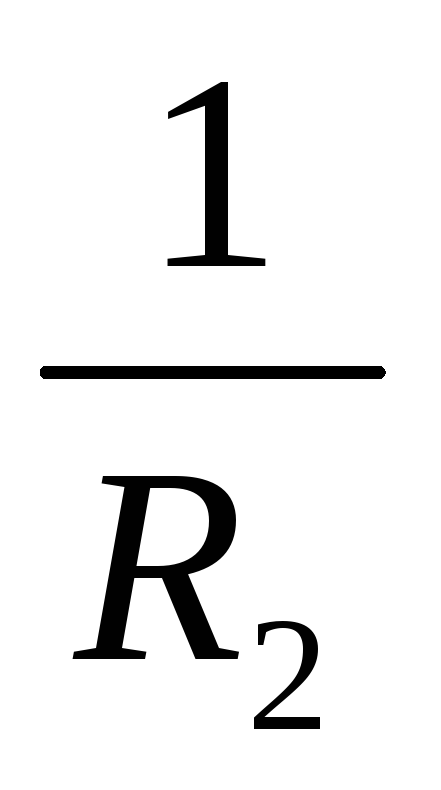 +…+
+…+