для чего необходим, и как работает
Автор Aluarius На чтение 5 мин. Просмотров 2.3k. Опубликовано
Необходимо отметить тот факт, что к современным видам оборудования предъявляются достаточно жесткие требования в плане их качества и корректной работы. Но корректность в основном будет зависеть от параметров питающей электрической сети, особенно от напряжения. Не секрет, что отечественные ЛЭП похвастаться стабильностью этого показателя не могут. Поэтому на питающих контурах устанавливаются различные электронные приборы, обеспечивающие защиту оборудования от перепадов напряжения. Одним из таких приборов является реле напряжения и контроля фаз РНПП 311М.
Этот прибор устанавливается в трехфазных сетях, он контролирует не только напряжение, но и перекос фаз, это когда в разных фазах присутствует разное напряжение.
Есть еще одна ситуация, которая приводит к поломке электрического оборудования. Нормальная работа электрооборудования – это строгий порядок чередования фаз. Нередко можно встретиться с ситуацией, когда в трехфазной сети в каждой фазе находится 220 вольт (относительно земли), но при этом две фазы замкнуты между собой. Такая ситуация называется слипание фаз.
К тому же есть большая вероятность, что напряжение может отклониться от номинального в больших пределах, как вниз, так и вверх. Если напряжение будет завышенным, то его не выдержит ни одно электрооборудование. С пониженным попроще, но и здесь работать электрооборудование с механическим приводом тоже не будет. Моторы просто начнут гореть.
youtube.com/embed/mwlVEk7rhdc?feature=oembed» src=»data:image/gif;base64,R0lGODlhAQABAAAAACH5BAEKAAEALAAAAAABAAEAAAICTAEAOw==»/>
РНПП 311М
Итак, переходим к рассмотрению прибора – реле напряжения и контроля фаз марки РНПП 311М. Это многофункциональное электронное устройство микропроцессорного типа. Почему многофункциональное? Потому с его помощью контролируется и напряжение, и перекос фаз, и слипание фаз (их последовательность). Самое главное, что даже после отключения нагрузки, реле продолжает работать и контролировать питающую сеть. И если что-то в сети не так, он не подаст электричество на оборудование. Как только параметры электрической сети придут в норму, устройство тут же в автоматическом режиме включает питание.
Внимание! Это уникальный прибор, который не только показывает наличие напряжение в каждом фазном контуре и ее величину, но и появление аварийной ситуации, плюс причину этой ситуации.
Настройка защитного прибора достаточно проста, она производится с помощью специальных DIP-переключателей, которые расположены на лицевой стороне корпуса.![]() Какие параметры можно устанавливать с помощью переключателей:
Какие параметры можно устанавливать с помощью переключателей:
- установить контроль (полный) над напряжением в сети;
- при этом учитывать минимальное и максимальное его значение;
- контролировать напряжение в каждой фазе – ее наличие и величину;
- контроль перекоса фаз;
- контроль определенного их чередования, то есть, определения слипания фаз.
Кстати, это устройство может быть использовано и для защиты импортного оборудования, в котором максимальный предел напряжения равен 400 вольт, по сравнению с отечественным 380 В. Плюс ко всему к прибору может быть подключено так называемое оперативное питание, оно может быть как постоянным, так и переменным. Вообще, отличный экземпляр, который показал себя только с положительной стороны.
Что еще можно добавить относительно конструкции и наполнения реле контроля фаз РНПП 311М? Добавим, что дополнительно конструкция прибора снабжена двумя потенциометрами. С их помощью выставляется время: первый выставляет диапазон отключения, второй включения.
Технические характеристики
О некоторых технических характеристиках выше уже упоминалось. О них больше говорить не будем. Остальные же обозначим списком.
- Реле работает при частоте тока 45-65 Гц.
- При минимальном напряжении реле срабатывает через 12 секунд.
- Если произошел обрыв фазы, то отключение сети производится через 0,2 миллисекунды.
- То же самое можно сказать и об автоматическом включении.
- Номинальный перекос фаз (величина) – 60 вольт.
- выдерживает нагрузку не больше 3,0 ВА.
- Сила тока на контактах реле – 5 ампер.
- Может эксплуатироваться при температурах от минус 35С до плюс 55С.
- Вес – 200 грамм.
- Габариты: 35х92х58 мм.
Модификации
Существует достаточно широкая модельная линейка этого электронного устройства. И если марка РНПП 331М предназначается для трехфазной сети, то реле напряжения РН 113 для однофазной. Именно его сегодня часто используют электрики, собирая распределительный шкаф для частных домов и квартир, куда входит однофазная линия на 220 вольт.
И если марка РНПП 331М предназначается для трехфазной сети, то реле напряжения РН 113 для однофазной. Именно его сегодня часто используют электрики, собирая распределительный шкаф для частных домов и квартир, куда входит однофазная линия на 220 вольт.
Этот прибор предназначен для одного – разорвать питающую сеть при скачках напряжения. Конечно, на реле напряжения РН 113, как и на предыдущей модели, можно сделать настройки, выставив минимальный и максимальный показатель. Также здесь выставляется время, после которого устройство должно включиться автоматически при выравнивании до номинальной величины.
По отзывам многих специалистов реле напряжения РН 113 – один из лучших приборов данной модели, используемый в однофазных сетях. В эту же категорию можно отнести реле напряжения РН 111М и РН 116. Кстати, последний может устанавливаться под нагрузку до 3,5 кВт.
Подключить все виды реле несложно. На корпусе есть схемы, в которых разобраться будет не трудно.
принцип работы, конструкция, схемы подключения
Качественное выполнение тех или иных технологических процессов в современном мире обеспечивается за счет высокоточного и дорогостоящего оборудования. Работа которого напрямую зависит от качества поставляемой электроэнергии и состояния электроснабжающих линий. Увы, далеко не все отечественные сети способны обеспечить безопасный режим работы для них, из-за чего создается угроза поломки. Для предотвращения которой используются специальные защитные устройства – реле контроля фаз (РКФ).
Работа которого напрямую зависит от качества поставляемой электроэнергии и состояния электроснабжающих линий. Увы, далеко не все отечественные сети способны обеспечить безопасный режим работы для них, из-за чего создается угроза поломки. Для предотвращения которой используются специальные защитные устройства – реле контроля фаз (РКФ).
Они позволяют отключить нагрузку в случае каких-либо неисправностей в питающей сети. Все что может нести угрозу для оборудования и влияет на результативность его работы или технологический процесс, воспринимается как сигнал к немедленному обесточиванию и реле контроля переводит коммутирующие элементы в отключенное положение.
Конструкция и принцип работы
Рис. 1. Конструктивное исполнение реле на примере устройства CKF-2BTКонструктивно устройство включает в себя входные и выходные контакты, индикаторы нормального электроснабжения и аварийной ситуации, регуляторы, обозначенные на схеме соответствующими номерами (рисунок 1):
- Индикатор аварийной ситуации;
- Индикатор подключенного питания нагрузки;
- Потенциометр, позволяющий выбирать нужный режим;
- Регулятор уровня асимметрии;
- Регулятор снижения напряжения;
- Потенциометр, позволяющий регулировать временную уставку срабатывания.

Далеко не все модели предоставляют весь комплекс настроек по вышеприведенным параметрам. Они зависят от назначения конкретного реле и сферы применения.
Рис. 2. Принципиальная схема работыВ нормальном режиме к цепи питания от источника ЭДС E1 (рисунок 2) подается напряжение к потребителю, будь то двигатель, станок или другое оборудование. Реле контроля фаз R подключается в отпайку через соответствующие клеммы, обозначенные на схеме, как L1, L2, L3 и нулевым проводом N. Внутри устройства собрана логическая схема на транзисторах, которая посылает сигнал с выходных контактов на разрыв катушки пускателя P для отключения. При необходимости сигнал отключения можно настроить как для обесточивания потребителя, так и отключения внешней электрической сети.
В случае аварийной ситуации – пропадания одной из фаз, короткого замыкания, резкого увеличения токов, изменяется гармоническая составляющая электрических параметров сети. На что реагирует устройство защиты и посылает по цепям питания через клеммы 24 и 21 на катушку контактора соответствующий сигнал на отключение.
После срабатывания силовых контактов в практике электроснабжения потребителей может произойти естественное восстановление параметров питающей сети, при которой произойдет выравнивание фаз. При этом реле возвратит контакты во включенное положение, за счет чего реализуется система АПВ и на обмотки двигателя или другого потребителя возобновится подача напряжения.
За счет кнопок «Пуск» и «Стоп» можно осуществлять ручное управление питанием электрического прибора.
Назначение и функции
Данная технология применяется в сети трехфазных нагрузок. Наиболее востребована для защиты электродвигателя синхронного или асинхронного, трехфазных станков высокой точности, технологичной электроники, насосов. Заметьте, что неправильное чередование фаз приведет к низкой эффективности его работы, перегреву и снижению уровня изоляции, что может привести к пробою.
Применяется для следующих целей:
- Для коммутации преобразовательного оборудования, которому важно соблюдение последовательности фаз: источников питания, выпрямителей, инверторов и генераторов;
- Для систем АВР (введения в работу резервных источников питания) или подключения системы аварийного освещения;
- Для специального оборудования – станков, крановых установок, мощность которых составляет не более 100 кВт;
- Для электроприводов трехфазных двигателей, имеющих мощность не более 75 кВт.

Для коммутации однофазной нагрузки данное устройство не используется.
В целом реле контроля фаз применяется для различного промышленного и бытового оборудования и является обязательным предохранителем для тех схем управления, в которых требуется постоянный мониторинг величины напряжения и других параметров внешних линий.
В трехфазных сетях осуществляет контроль:
- уровня напряжения, реализуемая, в преимущественном большинстве, для оборудования такого класса в случаях, когда его величина выходит за установленные пределы;
- чередования фаз – выполнит коммутацию в случае аварийного слипания фаз или при их неверном расположении относительно питающих вводов оборудования;
- пропадания фазы – производит отключение потребителя в случае обрыва фазы и последующего отсутствия напряжения;
- перекоса фаз – производит коммутацию в случае изменения фазного или линейного напряжения по отношению к номинальному значению.

Преимущества реле контроля фаз
В сравнении с другими устройствами аварийных отключений данные электронные реле отличаются рядом весомых преимуществ:
- в сравнении с реле контроля напряжения не зависит от влияния ЭДС питающей сети, так как его работа отстраивается от тока;
- позволяет определять аномальные скачки не только в трехфазной сети питания, но и со стороны нагрузки, что позволяет расширить спектр защищаемых компонентов;
- в отличии от реле, работающих на изменение тока в электродвигателях, данное оборудование позволяет фиксировать еще и параметр напряжения, обеспечивая контроль по нескольким параметрам;
- способно определить дисбаланс уровней питающих напряжений из-за неравномерности загрузки отдельных линий, что чревато перегревом двигателя и снижением параметров изоляции;
- не требует формирования дополнительной трансформации со стороны рабочего напряжения.
В отличии от реле, работающих только по напряжению обеспечивает действующую защиту от регенерированного напряжения, вырабатываемого обратными ЭДС. В случае, когда одно из фазных напряжений пропадает, двигатель продолжает набирать достаточный уровень энергии с остающихся двух. При этом в обесточенной фазе будет генерироваться ЭДС от вращения ротора, который продолжает крутиться от двух фаз в аварийном режиме.
В случае, когда одно из фазных напряжений пропадает, двигатель продолжает набирать достаточный уровень энергии с остающихся двух. При этом в обесточенной фазе будет генерироваться ЭДС от вращения ротора, который продолжает крутиться от двух фаз в аварийном режиме.
Из-за того, что контакторы электродвигателей не размыкаются от реле при такой работе, возникает риск повреждения электрической машины с ее дальнейшей поломкой. Реле контроля, в свою очередь, способно обнаружить смещение фазового угла, за счет чего обеспечивается полноценная защита.
Такая функция особенно актуальна, когда рабочий режим двигателя, в случае его реверсивного вращения, способен повредить вращаемый элемент или травмировать работника. Как правило, такая ситуация возникает при внесении изменений во время обесточивания электрической машины, смене фазных нагрузок, порядка чередования фаз и прочих.
Технические характеристики
Среди технических параметров, реализуемых реле контроля фаз необходимо выделить:
- питающее напряжение;
- диапазон контроля перенапряжения;
- диапазон снижения уровня напряжения;
- границы временной задержки для включения после скачка напряжения;
- границы временной задержки для включения после падения напряжения;
- время, расходуемое на отключение в случае пропадания фазы;
- номинальный ток на контактах электромагнитного реле;
- количество контактов для совершения коммутационных опраций;
- мощность устройства;
- климатическое исполнение;
- механическая и электрическая износоустойчивость.

Схема подключения определяет порядок чередования фаз, поэтому нормальное питание нагрузки возможно при условии их правильного соблюдения на этапе монтажа и настройки. При этом существует возможность регулировки задержки коммутации для различных режимов работы устройства. Таким образом, для двигателей, в момент пуска можно отстроить время задержки срабатывания от 1 до 3 сек, для выдержки пусковых токов.
То же относиться к возможности отстройки аварийного срабатывания в случае перегрузки фаз, где время до коммутации можно регулировать от 5 до 10 сек.
Обзор популярных реле контроля фаз
- Реле РНПП-311 украинского производства является одним из наиболее популярных и подходящих для сетей постсоветского пространства. Аббревиатура расшифровывается как реле напряжения, перекоса и последовательности фаз. Современные модификации, в дополнение к стандартным параметрам способны отслеживать еще и частоту напряжения.
- OMRON K8AB данная модель осуществляет контроль не только за снижением, но и за превышением уровня напряжения, выполняя тем самым функции ограничителя или разрядника, причем, куда более эффективно.
 Имеет ряд модификаций, отличающихся регулировками порогов срабатывания и техническими параметрами.
Имеет ряд модификаций, отличающихся регулировками порогов срабатывания и техническими параметрами. - Carlo Gavazzi DPC01 отличается двумя реле на выходных клеммах устройства. Имеет несколько точек регулировки различных параметров, и переключатель режимов. Предоставляет 7 возможных функций по выставлению задержек, интервалов или цикличных функций.
- Реле ЕЛ-11 отечественного производства контролирует параметры электрической сети, может применяться как в закрытых отапливаемых, так и в не отапливаемых помещениях. Устанавливается в любом положении, но требует защиты от прямого попадания на них солнечных лучей и атмосферной влаги.
Типичные схемы подключения
В большинстве случаев, на корпусе каждого устройства производителем устанавливаются все необходимые данные о способе подключения конкретного реле. Для примера заберем несколько схем известных производителей:
Схема подключения РКФ РНПП-311На схеме показано подключение клеммного ряда к соответствующим фазам линии L1, L2, L3 и нейтрале N. На выходе возможно получить две цепи управления «Выход 1» и «Выход 2», отличающиеся по уровням напряжений.
На выходе возможно получить две цепи управления «Выход 1» и «Выход 2», отличающиеся по уровням напряжений.
Питание осуществляется по вводным каналам L1, L2, L3 и через нейтраль N. На выходе получается два варианта трехфазная трехпроводная система и трехфазная четырехпроводная, для работы с соответствующим коммутатором.
Схема подключения РКФ Carlo GavazziВ отличии от предыдущих вариантов клеммы вводов L1, L2, L3 запитываются через предохранители. Блок регулировки параметров позволяет отстраивать соответствующий режим работы и пределы отключения по ним. Два выхода с возможностью ручной коммутации посылают управленческие сигналы на переключение тех или иных устройств.
Последние две схемы демонстрируют работу вторичных цепей отключения нагрузки с соответствующей временной задержкой по этим клеммам. Как видите, все схемы подключения имеют идентичные компоненты, предназначенные для отслеживания всех параметров сети, способных сигнализировать сбой в электроснабжении трехфазных потребителей.
Использованная литература
- Фигурнов Е. П. «Релейная защита» 2004
- Гуревич В.И. «Электрические реле. Устройство, принцип действия и применения. Настольная книга инженера» 2011
- Басс Э.И., Дорогунцев В.Г. «Релейная защита электроэнергетических систем» 2002
- А. С. Дорофеюка, А. П. Хечумяна, «Справочник по наладке электроустановок» 1975 г
- Чернобровов Н.В. «Релейная защита», 1974 г.
Виды реле контроля фаз
Трехфазные сети нередко испытывают на себе такое явление, как «перекос» фаз. Данная ситуация довольно пагубно сказывается на работе всей электролинии, а также на функционировании электроприборов, которые в данный момент работают от питания. Негативное воздействие происходит именно потому, что непосредственно от порядка фаз и показателя напряжения работают важные устройства, к которым относятся электродвигатели и трансформаторы. Во избежание различных повреждений применяются реле контроля фаз.
Данное устройство крайне необходимо в трехфазной электросети для того, чтобы происходило чередование фаз в правильном порядке.
Конструктивные особенностиВсе современные устройства, в конструкцию которых входят микропроцессоры, отличаются простой настройкой и высокими параметрами надежности. В число таких устройств входят и реле контроля фаз.
Устройства импортного изготовления требуют к себе наибольшего внимания, а именно обеспечения сети электропитания наивысшего качества. Это крайне необходимо, поскольку совсем незначительный перепад или сбой в показателях может обернуться огромными потерями, а также вывести из рабочего состояния довольно дорогостоящее оборудование.
Основа устройства реле данного типа – микросхема, которая контролирует и полностью управляет функционированием изделия. При снижении (полном исчезновении) напряжения в фазах микросхема отправляет определенный сигнал реле, который в дальнейшем приостанавливает нагрузку. Некоторые модели оснащаются специальными индикаторами для фазных напряжений и регулятором периода срабатывания.
Некоторые модели оснащаются специальными индикаторами для фазных напряжений и регулятором периода срабатывания.
Применение реле контроля фаз
На сегодняшний день любое предприятие, административное здание или жилая квартира оснащены огромным числом различного электротехнического оборудования. Все электрические приборы отличаются высокой стоимостью, следовательно, их срок службы должен быть по возможности продлен. Для данной цели как раз и применяются специальные защитные устройства от перепадов в напряжении, от коротких замыканий и перекоса фаз.
Реле контроля фаз активно используется в наши дни и защищает трехфазные устройства. Защита осуществляется в следующих направлениях: от обрыва, перекоса, слипания. Также осуществляется контроль над правильным чередованием фаз.
Кроме того, данные устройства контролируют не только фазы, но и напряжение. Иными словами, реле отслеживает показатель напряжения и при значительном понижении от критической величины обрывает электропитание.
Суть работы
Принцип функционирования – это, так называемый, самовозврат. То есть, реле контроля фаз перестает функционировать в момент, когда происходит срабатывание сигнала об аварийной ситуации. Тогда, когда на механизм передается трехфазное напряжение, все параметры проходят тщательную проверку. Если по итогу проверки все параметры в норме, происходит включение встроенного реле электромагнитного типа. Но в случае, когда даже один параметр находится далеко от нормы, механизм моментально перестает действовать.
По возвращении всех показателей в нормированное состояние прибор в автоматическом режиме возобновляет свою работу.
При аварийных ситуациях происходит отключение нагрузки при помощи реле. К таковым нагрузкам относятся: исчезновение какой-либо фазы, выход за нормированные рамки показателя напряжения, ошибка в подключении трехфазного электропитания.
Использование реле контроля фаз обеспечивает качественную защиту электрической сети и всего электрического оборудования, работающего от нее. Более того, данный прибор помогает осуществлять контроль над объемами потребляемой энергии.
Более того, данный прибор помогает осуществлять контроль над объемами потребляемой энергии.
Торговая сеть «Планета Электрика» имеет в своем ассортименте огромный выбор различного защитного и контролирующего оборудования. К нему относятся и реле контроля фаз. В наших торгово-выставочных залах Вы можете найти устройства от выдающихся мировых производителей: ABB, EATON, Schneider Electric, SIEMENS, TDM ELECTRIC и др.
Статьи по теме:
Реле контроля фаз РППФ
Реле пропадания и последовательности фаз РППФ — это простое решение для защиты от проблем в трехфазной электросети. Прибор предназначен для автоматического отключения если произошло пропадание фазы, слипание фаз, нарушение последовательности фаз, а также для контроля исправности контактов пускателя.
Функциональные возможности
Основные функции, выполняемые реле РППФ:
- Определение пропадания фаз.
- Определение слипания фаз.

- Определение последовательности фаз.
- Определение отсутствия контакта включенного пускателя.
- Индикация состояния фаз (в том числе индикация неисправности в сети).
- Индикация состояния контактов включенного пускателя (в том числе неисправных контактов).
- Формирование всех временных выдержек для отключения и подключения нагрузки при нештатных ситуациях.
Принцип работы
Реле контроля фаз РППФ представляет собой электромагнитное реле, управляемое микропроцессором, который анализирует параметры трехфазной электросети. Если параметры сети соответствуют норме, то происходит включение реле, если нет, то реле не включается. Также, если в процессе эксплуатации параметры сети выйдут из нормы, то реле выключится после задержки в 3 секунды. После восстановления фаз, по истечении трехсекундной задержки, подача напряжения восстановится.
Само выходное реле подключается к автоматике управления конкретного потребителя (как правило, к пускателю). Максимальная нагрузка, напрямую подключаемая к прибору, не должна превышать 10 Ампер. Индикация состояния реле пропадания и последовательности фаз и аварийных ситуаций осуществляется светодиодами.
Монтаж реле производится на стандартную 35-мм DIN-рейку, коммутация осуществляется через стандартные клеммы.
Параметр | Значение |
Максимальный коммутируемый ток при cos ? =1 | 10 Ампер |
Сигнализация причины срабатывания | сигнализация светодиодами |
Время задержки выключения нагрузки | 3 секунды |
Время задержки включения нагрузки | 3 секунды |
Напряжение питания прибора | допустимое от 0 до 430 Вольт |
Потребляемая мощность | не более 1 Вт |
Способ монтажа (подключения) | DIN-рейка |
Габаритные размеры | 5 х 9 х 6,5 см (эквивалент 3 стандартных токовых автомата) |
Реле контроля фаз RKF-03-02
Реле контроля фаз, микропроцессорное, цифровая индикация. Регулировка нижнего и верхнего порога напряжения, гистерезиса, асимметрии, времени аварийного срабатывания и повторного включения. Контроль порядка чередования, обрыва, «слипания» фаз, обрыва нулевого провода. Защита нагрузки от скачкообразного изменения напряжения на 30 В от установленных пороговых значений за 0,1 сек. На DIN-рейку 35мм. 2 модуля ВЫПОЛНЯЕМЫЕ ФУНКЦИИ
— цифровая индикация напряжения
— отключение нагрузки при понижении или превышении заданного напряжения в любой из фаз
— включение нагрузки при восстановлении заданного напряжения
— отключение нагрузки при пропадании любой из фаз
— отключение нагрузки при “перекосе” фаз
— отключение нагрузки при “слипании” фаз
— отключение нагрузки при обрыве нулевого провода
— отключение нагрузки при нарушении порядка чередования фаз
— индикация аварийного состояния
— просмотр значения аварийного параметра
— установка минимального порога напряжения ULo
— установка максимального порога напряжения UHi
— установка напряжения “перекоса” фаз dU
— установка “гистерезиса” напряжения H
— установка времени аварийного срабатывания t1
— установка времени повторного включения t2
— просмотр установленных параметров
Изделие имеет светодиодный дисплей, индицирующий:
-напряжение на каждой фазе;
-причину аварийного срабатывания;
-значение аварийного состояния.
Изделие, в зависимости от исполнения, имеет одну либо две группы переключающих контактов. При замыкании контактов исполнительного реле загорается красный светодиод.
В устройстве используются три кнопки управления и программирования параметров:
— кнопка “ВВОД” — вход в режим программирования из режима индикации и аварийного срабатывания и передвижение по его пунктам.
— кнопка «ВВЕРХ» — увеличение значений устанавливаемых параметров в режиме программирования;
— вход в просмотр установленных значений в режиме индикации;
— просмотр величины аварийного срабатывания.
— кнопка «ВНИЗ» — уменьшение значений устанавливаемых параметров в режиме программирования;
— фиксация и циклический просмотр индикации напряжения.
Если на индикаторе светится символ Lo или Hi — это сигнализирует о выходе за пределы установленных параметров настройки и включение таймера t1 аварийного отключения реле , при этом мигает светодиод соответствующей фазы. Если напряжение ниже установленного значения — светится символ Lo, если выше — Hi. Если в течение времени аварийного отключения t1 не восстановятся параметры настроек, произойдет отключение исполнительного реле. Числовое значение этой причины можно отобразить, нажав кнопку. При восстановлении параметров напряжения в пределах установленных значений реле автоматически включит нагрузку через установленное время повторного включения t2.
При скачкообразном изменении напряжения более 30 вольт от установленных значений, а также изменении порядка чередования фаз, независимо от времени t1 произойдет отключение исполнительного реле через 0,1сек и на индикатор будет выведены символы LLL (при понижении), HHH (при повышении). При нарушении порядка чередования фаз на дисплее светится символ Abc. При превышении напряжения “асимметрии” фаз светится символ dU.
Реле контроля фаз, реле обрыва фаз, реле наличия фаз, обзор выпускаемых реле, краткие технические характеристики, правильно подключить.
Реле контроля напряжения, реле контроля фаз, реле фаз, напряжения, реле обрыва фаз, реле наличия фаз, монитор напряжения.
Эти названия приборов по сути представляют собой один класс изделий предназначенных для контроля за качеством питающего напряжения, защите электрических приборов от выхода из строя.
У разных производителей и в разных источниках они могут называться по — разному, но имеют одно и тоже назначение и порой примерно одинаковый перечень характеристик.
Основные параметры которые могут контролировать реле контроля фаз (далее по тексту мы будем применять разные названия реле, подразумевая один смысл назначения):
— Величину питающего напряжения.
— Наличие напряжения.
— Правильность чередования фаз (в трехфазной сети).
— Обнаруживать короткие провалы питающего напряжения (в некоторых случаях бывает необходимо обнаруживать провалы длительностью от 10 мс).
— Подключение (обрыв нулевого провода) в трехфазной сети с нейтралью.
— Обнаруживать неправильное подключение в трехфазной сети фазных проводов и нулевого провода (перепутывание).
— Асимметрию питающего напряжения, иногда можно встретить название разбаланс фаз.
— На реле контроля фаз, в отдельных случаях, возлагают функцию грубо измерять сопротивление изоляции, это необходимость вызвана тем, что перед подачей напряжения в линию, необходимо контролировать сопротивление изоляции (к примеру менее 500 ком), и если оно находится ниже нормы запрещать подачу трехфазного напряжения (применяется для контроля сопротивления изоляции обмоток электродвигателя и в других случаях).
— Выходные контакты при нормальном состоянии включаются, а при появлении «аварии» разрывают цепь.
— Некоторые модели реле напряжений имеют раздельные контакты на срабатывание реле при превышении напряжения, другая группа при понижении напряжения, в соответствии с установленными уровнями порогов напряжения.
Необходимо отметить, что перечислены основные особенности реле контроля фаз, в отдельных случаях имеются и другие функции реле.
Реле фаз
Большинство современных реле контроля фаз выполнены на элементной базе с использованием микропроцессорной техники, что намного повышает качество изделий и точность контролируемых параметров.Современные реле контроля напряжения могут иметь регулировки контроля ( указаны основные значения применяемые в реле контроля фаз, в основном считаются от номинального значения, имеются реле контроля напряжения в которых регулировка считается не от номинального значения ):
- — Регулируемый верхний порог, до + 30%
- — Регулируемый нижний порог напряжения, до — 30%
- — Величину асимметрии фазных напряжений, регулируемая до 30% (больше в отдельных случаях)
- — Задержку срабатывания при появлении «аварии», регулируемая до 10с (до нескольких минут)
Недостатки реле аналогового типа
В 80-х годах прошлого столетия в Советском Союзе появились первые реле контроля трехфазного напряжения аналогового типа, которые имели крепление на рейку Din и ровную поверхность, название их было ЕЛ-11, ЕЛ-12, ЕЛ-13 и имели достаточно большой корпус с прорезями по бокам для отвода тепла, размер корпуса этих реле фаз составлял 75х45х100мм.
Существенным недостатком аналоговых реле контроля фаз типа ЕЛ являлось:
- нестабильный контроль порогов напряжения
- большое тепловыделение внутри корпуса
- нестабильное срабатывание при слипании фаз
- отсутствии регулировок установки значений порогов напряжения
- достаточно большая потребляемая мощность
С появлением на рынке изделий на базе микроконтроллеров, недостатки в новых реле были устранены, название они получили ЕЛ-11М, ЕЛ-12М, ЕЛ-13М, ЕЛ-11Е, ЕЛ-12Е, ЕЛ-13Е. РКН, РКФ, РНПП. Кроме этих реле фаз, появились и новые реле со специальными функциями, которых не было ранее:
-реле выбора фаз;
-реле приоритета фаз;
-реле контроля напряжения (фаз) коротких провалов;
-реле минимального напряжения;
-реле максимального напряжения.
| Реле контроля фаз ЕЛ-11, ЕЛ-12, ЕЛ-13 | Реле контроля фаз для контроля наличия и порядка чередования фаз. Эта линейка реле аналогового типа начали выпускаться в 80-ых годах. | |
| Реле контроля фаз ЕЛ-11Е, ЕЛ-12Е, ЕЛ-13Е, ЕЛ-15Е | Реле контроля фаз для использования в схемах автоматики для контроля наличия и порядка чередования фаз и величины напряжения. | |
| Реле контроля напряжения HRN-3x | Контролирует превышение/понижение однофазного напряжения. | |
| Реле асимметрии фаз MP35 | Контролирует превышение/понижение, асимметрию трехфазного напряжения. | |
| Реле контроля напряжения/фаз K8AB-PM | Контроль превышение/понижение напряжения и порядка чередования/обрыва фаз в 3-фазных, 3-проводных или 4-проводных линиях. В реле контроля напряжения имеется переключатель для выбора режима работы: 3-фазная 3-проводная или 3-фазная 4-проводная линии. | |
| Реле контроля трехфазного напряжения РНПП-311М | Контролирует повышенное пониженное напряжения и контроль порядка чередования и обрыва фаз в 4-проводных линиях. В реле контроля напряжения имеется регулировка порога срабатывания по Umax/Umin, переключатель типа используемой сети. | |
| Реле контроля однофазного напряжения РНПП-111 | Контролирует повышенное пониженное напряжения и контроль. В реле контроля напряжения имеется регулировка порога срабатывания по Umax/Umin. | |
| Реле контроля трехфазного напряжения РКН-3-14-08 | Контролирует повышенное пониженное напряжения и контроль порядка чередования и обрыва фаз и нулевого провода в 4-проводных линиях. В реле контроля напряжения имеется раздельные регулировки нижнего и верхнего порогов. | |
| Однофазное РКН-1-1-15 | Реле контроля однофазного напряжения РКН-1-1-15, выполнено с раздельной регулировкой верхнего и нижнего порогов 30% вверх и 30% вниз, имеются версии исполнения для контроля напряжения постоянного тока. | |
| Реле выбора фаз РВФ-01 | Реле выбора фаз РВФ-01 Предназначено для определения «лучшей» фазы в трехфазной сети и подключения к однофазной нагрузке. |
Как правильно подключить
Как правильно установить реле обрыва фаз. Обращаем свое внимание на особенности подключения, т.е соблюдать определенные правила к реле трехфазного напряжения (фаз).К этим правилам относятся:
- Реле подключаются к трехфазной сети
- При подключении трехфазного реле в однофазную сеть оно работать не будет, т.е не включится встроенное электромагнитное реле, так как видит АВАРИЮ — обрыв фаз.
- Соблюдать порядок подключения, т.е. фазу А к клемме А (L1), фазу В к клемме B (L2), фазу С к клемме C (L3), при неправильном подключении исполнительное реле не включится т.к. нарушен будет порядок чередования фаз.
- Если реле фаз (напряжения) имеет клемму для подключения нулевого провода N, то к нему необходимо подключать этот провод, если реле фаз работает без нулевого провода, то оно предназначено для контроля трехфазной сети без нулевого провода.
- Большинство реле трехфазной сети для контроля ABC и N, без подключения проводника N работать не будут, т.е не включит встроенное электромагнитное реле в виду АВАРИИ — обрыв нулевого провода.
Реле контроля фаз – как правильно выбрать?
Долговечность электрооборудования напрямую зависит от наличия защитных устройств, и трехфазные электроустановки не стали исключением. Для их защиты используется реле контроля фаз, которое предохраняет оборудование от скачков напряжения, обрыва одной или нескольких фаз, а также от неправильной последовательности фаз. Для обеспечения защищенности электроустановок необходимо сделать правильный выбор защитного оборудования, но из-за большого количества отличительных признаков сделать это оказывается не так просто. При выборе реле контроля фаз, прежде всего, нужно руководствоваться принципом соответствия защитного оборудования как самой электрической сети, так и параметрам оборудования, которое защищает реле.
Основные характеристики реле контроля фаз
Покупатель таких устройств сталкивается с большим количеством технических характеристик, которые непосредственно определяют выбор защитного оборудования. Чтобы не запутаться в них, подробнее остановимся на основных параметрах, на которые нужно обратить внимание при выборе реле как отечественного, так и иностранного производства.
Рабочее напряжение
С определением этого параметра возникает меньше всего проблем, так как реле контроля фаз в большинстве случаев имеют достаточно широкий диапазон рабочего напряжения. Например, отечественные модели ЕЛ11 и ЕЛ11 МТ могут защищать оборудование, напряжение которого составляет 100, 110, 220, 380, 400 и 415 В, но далеко не все реле контроля фаз имеют столь широкий диапазон. Например, модель ЕЛ13 может работать только в сети 220 и 380 вольт.
Пределы срабатывания
Падение напряжения – нередкое явление в электросетях. Реле может защитить от этого благодаря отсечке срабатывания. Например, ранее рассматриваемый прибор ЕЛ11 имеет отсечку 0,7 Uфн, а у ЕЛ13 этот параметр равен 0,5 Uфн. Обращая внимание на предел срабатывания, не стоит забывать о том, что причиной отсечки у некоторых моделей может стать ошибочное подключение фаз, при этом другие модели при точно таком же подключении на это никак не реагируют.
Скорость срабатывания
Чем быстрее устройство отреагирует на аварийную ситуацию, тем лучше, поэтому время срабатывания становится критически важным параметром. Эта характеристика на защитном оборудовании указывается в определенном диапазоне, у модели ЕЛ 11 он составляет 0,1-10 сек, а у ЕЛ 13 – 0,1-15 сек.
Рабочие температуры
Реле контроля фаз может работать в различных климатических условиях, главное, чтобы соответствовал температурный режим оборудования. Например, для экстремальных условий эксплуатации лучше всего подойдут модели, температурный диапазон которых варьируется от -40 до +40 градусов.
Помимо перечисленных выше параметров, у такого оборудования есть и другие характеристики, но они уже не имеют определяющего значения, в том числе масса. Так как вес у всех реле приблизительно одинаковый, незначительная разница в весе никак не повлияет на установку.
Каким реле отдать предпочтение?
Ранее были рассмотрены модели отечественного производства, однако на рынке широко представлены и зарубежные аналоги, что несколько затрудняет выбор для покупателей. Существует стереотип, будто зарубежная техника лучше по определению, но это не совсем так. Отечественное и зарубежное оборудование имеет как положительные, так и отрицательные стороны, поэтому для правильного выбора реле контроля фаз этот вопрос необходимо изучить во всех деталях.
Начнем с преимуществ российского оборудования перед зарубежными аналогами, к которым относятся:
- демократичная цена – реле российского производства стоят в два раза дешевле;
- подходящий температурный диапазон – зарубежные модели не приспособлены для работы при температуре ниже -25 градусов;
- приспособленность для эксплуатации в сложных условиях – отечественные реле бесперебойно работают на металлургических комбинатах, в метрополитенах.
Кроме того, отечественные модели не требуют отдельного питания, чего нельзя сказать о зарубежных аналогах.
Помимо преимуществ, отечественные реле контроля фаз имеют и некоторые недостатки, а именно:
- при слипании фаз устройства с аналоговой обработкой сигнала демонстрируют нестабильную работу;
- высокое тепловыделение – эта особенность наиболее ярко проявляется при монтаже реле в шкафах небольшого размера с плотной установкой;
- непривлекательный дизайн устройства.
Теперь, зная все «за» и против, а также основные характеристики оборудования, можно сделать единственно правильный выбор. Поскольку речь идет о безопасности, то выбор элементов защиты 3-фазного электрооборудования лучше доверить специалистам, поскольку только профессионалы смогут учесть все нюансы монтажа и дальнейшей эксплуатации таких устройств.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Cell Adhesion — обзор
Межклеточная адгезия — фундаментальный процесс развития многоклеточных организмов. Нарушение этого процесса приводит к нарушению гомеостаза и дизонтогенеза. Нарушение межклеточной адгезии также может быть причиной заболевания. У многоклеточных организмов межклеточная адгезия происходит гомотипическим или гетеротипическим образом; напр., гомотипическая межклеточная адгезия формируется между двумя соседними эпителиальными клетками, а гетеротипическая межклеточная адгезия формируется между дифференцирующимися зародышевыми клетками и клетками Сертоли в семеннике.В эпителиальных клетках млекопитающих межклеточная адгезия опосредуется специализированными соединениями, особенно плотными соединениями (TJ), адгезионными соединениями (AJ) и десмосомами. Специфические молекулы клеточной адгезии (CAMs) опосредуют межклеточную адгезию на каждом из механизмов адгезии. Члены семейства нектинов, первоначально идентифицированные как рецепторы вируса α-герпеса, представляют собой САМ, локализованные в AJ. Нектины представляют собой САМ суперсемейства иммуноглобулинов Ca 2 + (Reymond et al., 2001; Satoh-Horikawa et al., 2000; Takahashi et al., 1999) и вносят вклад в разнообразие межклеточной адгезии, действуя совместно с кадгеринами или независимо от них (Takai, Ikeda, Ogita, & Rikitake, 2008; Takai, Miyoshi, Ikeda, & Ogita, 2008). Позже нектиноподобные молекулы (Necls), которые имеют доменную структуру, аналогичную структуре нектинов, были определены как семейство генов, родственных нектинам. Первоначально сообщалось, что Necl-5 и -2 являются рецептором полиовируса человека (pvr; Mendelsohn, Wimmer, & Racaniello, 1989) и опухолевым супрессором при немелкоклеточном раке легкого человека (Kuramochi et al., 2001) соответственно. Неклы имеют много номенклатур, и некл-1 до -4 были недавно переименованы в Cadm-3, -1, -2 и -4 соответственно (таблица 1), но в этой главе используются неклы. Члены нектинов и Necls взаимодействуют в транс, — гомо и транс, — гетеро друг с другом и в цис с рецепторами факторов роста и интегринами. Более того, нектины и Necls связаны с заболеваниями человека, такими как наследственная эктодермальная дисплазия, болезнь Альцгеймера, расстройство аутистического спектра и рак.На следующих страницах мы представляем физические и функциональные свойства нектинов и неклов, а затем резюмируем последние достижения в понимании роли этих молекул в развитии и болезнях.
Таблица 1. Члены семейства Nectin и Necl
| Member | Symbol | Псевдоним | Связанный процесс развития | Связанное заболевание |
|---|---|---|---|---|
| Nectin-1 | pvrl1 | PRR1, HveC и CD111 | Развитие внутреннего уха, развитие коры головного мозга, ведение аксонов, формирование синапсов и развитие зубов | Вирусная инфекция, эктодермальная дисплазия и психические расстройства, связанные со стрессом a |
| Nectin-2 | pvrl2 | PRR2, HveB, Mph и CD112 | Сперматогенез | Вирусная инфекция, болезнь Альцгеймера и рак |
| Нектин-3 | pvrl3 | PRR3 уха и CD113 | Сперматогенез, внутреннее развитие, развитие глаз развитие, развитие коры головного мозга, ведение аксонов, формирование синапсов и развитие зубов t | Психические расстройства, связанные со стрессом a |
| Nectin-4 | pvrl4 | PRR4 | Вирусная инфекция, эктодермальная дисплазия и рак | |
| Necl-1 | Cadm3 | Tsll1 и SynCAM 3 | Миелинизация | Болезнь Альцгеймера a и рак a |
| Necl-2 | Cadm1 | Igsf4, RA175, SgIGSF, Tslc1, SynCAM | и SynCAM, наведение аксонов и формирование синапсов | Расстройство аутистического спектра и рак |
| Necl-3 | Cadm2 | SynCAM 2 | Направление аксонов | Расстройство аутистического спектра и синдром дефицита внимания с гиперактивностью |
| Necl -4 | Cadm4 | Tsll2 и SynCAM 4 | Миелинизация | C ancer a |
| Necl-5 | pvr | CD155 и Tage4 | Вирусная инфекция и рак |
Разделение фаз LIMD1 способствует клеточной механике и дуротаксису, регулируя динамику фокальной адгезии в ответ на force
Abstract
Механическая среда влияет на морфологию, дифференциацию и подвижность клеток.Способность клеток следовать градиентам жесткости внеклеточного матрикса и дуротаксиса связана с развитием, фиброзом и раком. Клетки воспринимают внеклеточные механические сигналы и реагируют на них посредством адгезии клеточного матрикса. Интересно, что созревание фокальных спаек (FAs) взаимно зависит от силы. Как биомеханические сигналы определяют состояние подвижности клеток и как ЖК координируют восприятие силы и самоорганизацию, остается загадкой. LIMD1, член белков домена LIM, локализуется в FA и, как сообщается, негативно регулирует путь Hippo-YAP в ответ на напряжение.Здесь мы идентифицируем чувствительное к силе рекрутирование LIMD1 в FA. Мы обнаружили, что LIMD1 регулирует распространение клеток, поддерживает динамику FA и клеточную силу и имеет решающее значение для дуротаксиса. Интересно, что LIMD1 селективно рекрутирует поздние, но не ранние белки FA посредством разделения фаз на FAs под действием силы. Мы предлагаем модель, в которой локализация LIMD1 в FAs, запускаемая механической силой, служит центром разделения фаз для сборки и организации поздних белков FA, обеспечивая эффективное созревание FA и эффективную клеточную механотрансдукцию.
Передача силы из внеклеточной среды внутрь клетки была увлекательной темой на протяжении десятилетий. Сайты адгезии, опосредованные интегрином, связываются с внеклеточными молекулами и инициируют каскад сборки молекул под плазматической мембраной, создавая высокоорганизованную структуру, которая способна передавать механическую силу 1 . Эти сайты адгезии были тщательно исследованы на предмет их решающей роли в передаче сигналов как изнутри-наружу, так и извне-внутрь, которые необходимы для выживания и подвижности клеток 1-5 .Фокальные адгезии (FA) — это контакты клеточного матрикса, которые созревают из возникающих фокальных комплексов, содержащих интегрины и некоторые другие молекулы, такие как киндлин, талин, FAK и паксиллин 6-8 . Только часть возникающих фокальных комплексов выживает в процессе созревания, и во время этого они растут за счет быстрого рекрутирования поздних белков FA для сборки бляшкообразных структур и сцепления с актиновыми стрессовыми волокнами. Созревшие FA демонстрируют упорядоченную ультраструктуру со слоем передачи силы, зажатым между слоем интегрина и слоем ассоциации с актином 9 .Были идентифицированы специфические межбелковые взаимодействия, участвующие в созревании ЖК 10-12 . Однако, как армия белков FA достигает пространственно-временного контролируемого рекрутирования и сборки, остается невыясненным.
Эффективная передача силы через FA важна для множества клеточных процессов, включая миграцию клеток. Дуротаксис — это тип направленной миграции клеток, при котором клетки реагируют на градиент внеклеточной жесткости 13, 14 . Предполагается, что механизмы, лежащие в основе дуротаксиса мезенхимальных клеток, включают сократительную механочувствительность, зондирование местного субстрата с помощью выступов на основе актина и передачу сигналов фокальной адгезии 15-21 .Колебания силы внутри индивидуальных FAs, как было обнаружено, опосредуют восприятие жесткости ECM в управлении направленной миграцией клеток 15 . Как формирование и динамика сложных белковых ансамблей в местах контакта клетки с ECM координируются с ощущением силы и подвижностью клеток, еще предстоит тщательно исследовать.
Очистка адгезионных комплексов в сочетании с количественной масс-спектрометрией позволила идентифицировать и количественно оценить известные и новые ассоциированные с адгезией белки 22-24 .Блокирование созревания адгезии с помощью ингибитора миозина II blebbistatin заметно нарушает рекрутирование белков LIM домена на сайты адгезии интегрина 24 . LIMD1 является членом белков, содержащих домен LIM, и супрессором опухолей 25-27 . Интересно, что LIMD1 недавно был идентифицирован как регулирующий путь передачи сигналов Hippo / YAP путем связывания и супрессии LATS1 / 2 зависимым от напряжения способом 28 . Роль и механизм, лежащие в основе механо-ощущения LIMD1, неясны.
Путем иммунофлуоресцентного окрашивания мы обнаружили совместную локализацию LIMD1 и фокального маркера адгезии паксиллина (рис. 1а). Мы также заметили, что распределение флуоресцентного сигнала LIMD1 внутри отдельных ЖК смещено в сторону проксимальной области (внутрь клетки и от края клетки), что указывает на его роль в созревании ЖК, а не в раннем образовании ЖК (рис. 1а и Дополнительный рис. 1а). Повышенная локализация LIMD1 в фокальных адгезиях была очевидна при увеличении жесткости субстрата (рис.1б). Подобные результаты были обнаружены, когда мы использовали блеббистатин для подавления сократимости актомиозина (рис. 1e). Эти наблюдения согласуются с предыдущими сообщениями о том, что многие LIM белки компонентов FA рекрутируются силозависимым образом 24 . Следует отметить, что общий уровень белка LIMD1 не отличался между клетками на мягких или жестких субстратах, а также между клетками, обработанными ДМСО или блеббистатином (рис. 1c и дополнительный рис. 1b). Интересно, что когда клетки на мягком субстрате стимулировали активатором RhoA (активатор Rho II), они восстанавливали локализацию LIMD1 в FA (рис.1г). Между тем, когда клетки на стекле обрабатывали блеббистатином или Y27632 для ингибирования сокращения актомиозина, они демонстрировали потерю LIMD1 на FA (рис. 1e). Эти наблюдения демонстрируют чувствительность локализации LIMD1 к жесткости субстрата и клеточной силе. Интересно, что ингибирование киназы фокальной адгезии (FAK) привело к потере локализации LIMD1 на FA, даже когда клетки были посеяны на стекле (дополнительный рис. 1c), что позволяет предположить, что зависящее от силы рекрутирование LIMD1 в FA находится под регуляцией ранних стадий. Сигнальные события FA.В совокупности эти результаты утверждают, что механическая сила, либо от жесткости субстрата, либо от сократимости клеток, действовала на привлечение LIMD1 к FAs.
Рисунок 1. LIMD1 под действием силы локализуется в FA и регулирует динамику FA(a) I: репрезентативные иммунофлуоресцентные изображения, окрашенные антителами LIMD1 (желтый) и паксиллин (пурпурный) в эмбриональных фибробластах мыши (MEF). Локализация LIMD1 и локализация паксиллина в отдельных ЖК показаны в увеличенных прямоугольниках.II: Распределение LIMD1 (желтый) и паксиллина (пурпурный) вдоль направления белой стрелки показано на графике линейной развертки.
(b) Репрезентативные иммунофлуоресцентные изображения локализации LIMD1 на FA на подложках с разной жесткостью. Масштабные линейки, 20 мкм.
(c) Вестерн-блот, показывающий общий уровень белка LIMD1 в MEF на мягких и жестких субстратах. GAPDH используется в качестве контроля загрузки. Гистограмма показывает количественную оценку уровней белка, нормализованных к GAPDH в каждом состоянии (столбцы ошибок: среднее значение с SEM, нс: не значимо).
(d) Репрезентативные иммунофлуоресцентные изображения LIMD1 на мягком субстрате с обработкой 10 мкМ Rho активатором II и без нее. Масштабные линейки, 20 мкм.
(e) Репрезентативные иммунофлуоресцентные изображения LIMD1 на жестком субстрате с обработкой блеббистатином 50 мкМ или без нее. Масштабные линейки, 20 мкм.
(f) Слева: покадровые изображения, показывающие распространение MEF контроля и нокаута LIMD1 (LIMD1 KO). Масштабная линейка 20 мкм. Справа: кривые площади разбрасывания контрольных и MEF LIMD1 KO.Планка погрешности: 95% ДИ.
(g) Покадровые изображения, показывающие образование FA в контроле и KO MEF LIMD1 после вымывания блеббистатина. Масштабная линейка 20 мкм.
(h) Репрезентативные изображения долговечности FA, проанализированные сервером анализа фокальной адгезии (FAAS, faas.bme.unc.edu), цветовой спектр указывает разные временные точки.
(i) Гистограммы, показывающие размер и количество FA (N = 12 ячеек, полоса ошибок: 95% ДИ, * P <0,05, *** P <0,001 по тесту Стьюдента t для сравнения двух групп.нс, не имеет значения). 1 пиксель = 0,18333 мкм.
(j) Частотное распределение долговечности FA в контрольных и LIMD1 KO MEF. Гистограмма отфильтрована, чтобы включить только спайки с продолжительностью жизни более 5 минут (N = 12 ячеек, полоса ошибок: 95% ДИ, *** P <0,001 по критерию Манна-Уитни ).
Чтобы исследовать клеточную функцию LIMD1, мы сгенерировали нокаутные клетки LIMD1 (LIMD1 KO). Мы заметили, что истощение LIMD1 задерживает распространение ячеек (рис. 1f и дополнительное видео 1-2).Таким образом, мы задавались вопросом, не замедлился ли процесс созревания FA при потере LIMD1. Во-первых, мы заметили задержку образования FA в KO-клетках LIMD1 после вымывания блеббистатина (рис. 1g и дополнительное видео 3-4). Затем, чтобы исследовать клеточную функцию LIMD1, мы использовали TIRF живых клеток и сервер анализа фокальной адгезии (FAAS) 29 для анализа динамики FA в глобальном масштабе (рис. 1h и дополнительное видео 5-6). Размер или количество FA остаются неизменными в клетках, обедненных LIMD1 (рис.1i). Однако мы наблюдали значительное снижение продолжительности жизни FA после истощения LIMD1 (рис. 1j). Когда мы построили график продолжительности жизни отдельных FA, мы заметили резкое падение долгоживущих FA в клетках LIMD1 KO (Supplementary Fig. 1d). Эти результаты показывают важную роль LIMD1 в регуляции динамики FA.
Созревание ЖК регулируется клеточной механикой, в то время как оно также влияет на механотрансдукцию и механические свойства клетки. 30-32 . Чтобы исследовать сокращение клеток, мы использовали анализ деформации геля путем погружения контрольных или клеток LIMD1 KO в коллагеновые гели.Клетки LIMD1 KO не смогли деформировать гель до такой степени, как контрольные клетки, что указывает на ослабленную клеточную механику (рис. 2а). Более того, микроскопия силы тяги также выявила снижение клеточной тяги, оказываемой клетками, лишенными LIMD1 (Fig. 2b). Так как LIMD1 обнаруживает чувствительную к силе локализацию и регулирует клеточную силу, и что FAs являются критическими структурами для миграции мезенхимальных клеток, мы затем попытались изучить, влияет ли LIMD1 на дуротаксис — механический сигнал, индуцируемый направленной миграцией клеток.Полиакриламидные гели с градиентом жесткости около 30 кПа / мм были изготовлены, как описано ранее 17 . Гомогенное покрытие внеклеточного матрикса на поверхности геля было продемонстрировано с использованием флуоресцентно меченного фибронектина (рис. 2c). Это исключало, что наблюдаемая направленная миграция была вызвана каким-либо гаптотаксическим сигналом, прилипшим к субстрату. Мы записали фильмы живых клеток как для контрольных, так и для KO-клеток LIMD1, движущихся на этих гелях, и проанализировали скорость, устойчивость и направленность на основе их проекции миграции.Мы не заметили каких-либо значительных различий в скорости миграции или устойчивости между контрольными и KO-клетками LIMD1 (дополнительный рис. 2a, b). Однако мы обнаружили, что контрольные клетки показали направление смещения жесткого конца на градиентном геле, в то время как клетки LIMD1 KO по-прежнему демонстрировали случайную подвижность (рис. 2d и дополнительное видео 7-8). Эти результаты показывают нарушение клеточной механики и потерю дуротаксиса при истощении LIMD1 в клетках.
Рис. 2. Возмущение LIMD1 изменяет клеточную механику и дуротаксис(a) Слева: контрольные и KO MEF LIMD1 культивируются в трехмерных коллагеновых гелях.Морфологию гелевой смеси клетки и коллагена регистрируют через 0, 8, 24 и 48 часов. Масштабная линейка 5 мм. Справа: количественная оценка сокращения коллагенового геля с использованием измерения площади геля (N = 3 эксперимента, планки ошибок: среднее с SD, * P <0,05, *** P <0,001 по тесту Стьюдента t для сравнения двух групп).
(b) Слева: репрезентативные изображения из экспериментов по микроскопии силы тяги (TFM). Цветовой спектр указывает на величину напряжения (Па), при этом области низкого сцепления показаны синим цветом, а области высокого сцепления — красным.Справа: Количественная оценка общей силы из экспериментов TFM, показывающих, что клетки LIMD1 KO проявляют меньшую силу тяги, чем контрольные клетки (N = 5 ячеек, планки ошибок: 95% ДИ, * P <0,05, ** P <0,01 и *** P <0,001 по критерию Стьюдента t для сравнения двух групп. Масштабная линейка 20 мкм.
(c) Справа: репрезентативные изображения Cy3-меченного фибронектина на мягких и жестких участках геля с градиентом жесткости. Шкала 100 мкм. Слева: количественная оценка интенсивности флуоресценции фибронектина в мягких и жестких областях (планка ошибок: 95% ДИ, тест Стьюдента t для сравнения двух групп.нс, не имеет значения).
(d) (I): репрезентативные покадровые изображения, показывающие контрольные и KO MEF LIMD1 во время дуротактической миграции. Масштабная линейка 20 мкм.
(II): индекс прямой миграции (FMI) контрольных и LIMD1 KO MEF. NCon = 43 ячейки, NKO = 52 ячейки.
(III): графики роста углового распределения контрольных (вверху) и LIMD1 KO (внизу) MEF, как в (II).
LIMD1 содержит три домена LIM на С-конце с внутренней неупорядоченной областью (IDR) на N-конце (рис.3а). Используя инструменты биоинформатики, мы предсказали, что белок LIMD1 имеет тенденцию к разделению фаз (рис. 3a). Действительно, когда мы очищали белок LIMD1, мы наблюдали образование капель с разделенными фазами в буфере с низким содержанием соли (рис. 3b). События динамического слияния этих капель также были зафиксированы в растворе, содержащем белок (рис. 3b и дополнительное видео 9). Эти капли показали быстрое восстановление после фотообесцвечивания (рис. 3c и дополнительное видео 10). Чтобы проверить, может ли LIMD1 подвергаться фазовому разделению в клетках, мы использовали оптогенетическую систему на основе Opto-dropt 33 .Воздействие синего света мгновенно индуцировало образование капель LIMD1 как в цитоплазме, так и в сайтах FA (рис. 3d и дополнительное видео 11). В подтверждение того, что LIMD1 претерпевает разделение фаз внутри клеток, эксперименты с FRAP показали, что сохраненный в FA LIMD1 является динамичным (Fig. 3e и Supplementary Video 12), указывая тем самым, что белки LIMD1 внутри FAs быстро обмениваются со своими цитоплазматическими аналогами. Фазовое разделение полагается на мультивалентные взаимодействия, опосредованные IDRs, а также тандемно связанные модульные домены 34, 35 .Затем мы попытались исследовать критические области LIMD1, которые способствовали его свойствам разделения фаз. Удивительно, но усечение LIM доменов (ΔLIM) или IDR (ΔIDR) резко изменило кинетику образования капель LIMD1 в клетках (рис. 3f и дополнительное видео 13-14). Соответственно, потеря LIM доменов значительно ухудшает способность LIMD1 к разделению фаз in vitro (Fig. 3g и Supplementary Fig. 3a).
Рис. 3. Возмущение LIMD1 изменяет клеточную механику и дуротаксис(a) Вверху: схематическое изображение доменной структуры LIMD1.Внизу: область внутреннего нарушения LIMD1, предсказанная IUPred (http://iupred.elte.hu).
(b) Вверху: репрезентативные изображения ДИК и флуоресценции, показывающие, что белок LIMD1 сконцентрирован в сферические капли. Внизу: репрезентативные покадровые изображения, на которых маленькие капли сливаются в более крупные. Масштабная линейка 20 мкм.
(c) Анализ FRAP (восстановление флуоресценции после фотообесцвечивания), показывающий, что белки LIMD1, обогащенные в конденсированных каплях, динамически обмениваются с белками в разбавленной фазе.Справа: количественная оценка FRAP-анализа области, обозначенной пунктирным кружком. Шкала 2 мкм.
(d) Вверху: репрезентативные изображения клеток, экспрессирующих LIMD1-Cry2, образующих капли после воздействия синего света. Внизу: репрезентативное изображение капель LIMD1, сформированных в той же фокальной плоскости, что и FA. Масштабная линейка 20 мкм.
(e) Слева: анализ FRAP, показывающий, что капли LIMD1 внутри FA динамически обмениваются со своими цитоплазматическими аналогами. Справа: количественная оценка анализа FRAP капель, обозначенных пунктирной рамкой.Флуоресценция LIMD1 быстро восстанавливается после фотообесцвечивания. Шкала 5 мкм.
(f) Репрезентативные изображения Δ IDR-Cry2, показывающие несколько кластеров, и Δ LIM-Cry2, показывающие отсутствие кластеров, образованных после воздействия синего света. Масштабная линейка 20 мкм.
(ж) Фазовая диаграмма белков ΔLIM и LIMD1 в различных концентрациях NaCl. Красные кружки указывают на разделение фаз, а синие кружки указывают на отсутствие разделения фаз.
(h) Репрезентативные изображения разделения фаз LIMD1 на участках FA с обработкой DMSO или Y27632.Масштабная линейка 20 мкм.
(i) Типичные изображения, показывающие, что сверхэкспрессия винкулина усиливает образование капель LIMD1 в сайтах FA, но не в цитоплазме. Масштабная линейка 20 мкм.
(j) Типичные изображения, показывающие, что винкулин-ActA перемещает капли LIMD1 в митохондрии. Масштабная линейка 20 мкм.
Поскольку LIMD1 выявил зависящую от силы локализацию FA, мы затем исследовали, повлияет ли механическая сила на разделение фаз LIMD1. Клетки, экспрессирующие Opto-dropt-LIMD1, обрабатывали ДМСО или Y27632 перед воздействием синего света.Мы наблюдали, что ингибирование сокращения актомиозина значительно снижает разделение фаз LIMD1 на сайтах FA (Fig. 3h). Затем мы спросили, как механическая сила повлияет на разделение фаз LIMD1 на ТВС. Взаимодействие между винкулином и LIMD1 было обнаружено с помощью co-IP (дополнительный рис. 3b). Затем мы выдвинули гипотезу, что конформационные изменения винкулина, вызванные механической силой 36 , могут затем локально увеличивать концентрацию LIMD1, позволяя иметь место разделение фаз. В соответствии с этим, клетки, сверхэкспрессирующие винкулин, значительно усиливали образование капель LIMD1 на сайтах FA, в то время как появление капель в цитоплазме уменьшалось (рис.3i). Более того, капли LIMD1 перемещаются в митохондрии, когда клетки сверхэкспрессируют связанный с митохондриями винкулин (винкулин, слитый с ActA) (Fig. 3j and Supplementary Fig. 3c) 36, 37 . В совокупности эти данные показывают, что LIMD1 может подвергаться фазовому разделению как in vitro, так и в клетках, и что его фазовое разделение на FAs реагирует на силу.
Фазовое разделение увеличивает локальную концентрацию определенных белковых компонентов, вызывая немембранную компартментализацию.Мы задавались вопросом, будет ли фазовое разделение LIMD1 действовать полупроницаемо, рекрутируя специфические белки ЖК. Паксиллин и зиксин были выбраны для представления ранних и поздних компонентов ЖК. Во-первых, мы спросили, может ли LIMD1 рекрутировать паксиллин или зиксин in vitro посредством разделения фаз. Мы провели эксперименты по совместному разделению фаз in vitro, в которых присутствовали как LIMD1, так и паксиллин или зиксин. Интересно, что зиксин, но не паксиллин, продемонстрировал сильную совместную локализацию с LIMD1 в каплях, разделенных фазой (рис.4а и б). Следует отметить, что и паксиллин, и зиксин показали резко сниженную способность подвергаться фазовому разделению in vitro по сравнению с LIMD1 (дополнительный рис. 4a). Затем мы исследовали, происходит ли избирательное рекрутирование также в клетках. Опто-капельный циксин или опто-капельный паксиллин показали минимальную реакцию на воздействие синего света (рис. 4c, d и дополнительное видео 15-16). Однако, экспрессируя опто-капельки LIMD1 и GFP-меченный зиксин в одной и той же клетке, мы обнаружили хорошую и быструю совместную локализацию циксина в каплях LIMD1 (рис.4e и дополнительное видео 17-18). Напротив, привлечение паксиллина к каплям LIMD1 практически не обнаруживалось, когда в клетке присутствовали как опто-капельные LIMD1, так и GFP-паксиллин (фиг. 4f и дополнительное видео 19-20). Кроме того, мы также обнаружили рекрутирование поздних белков FA Trip6 и VASP, но не раннего белка FAK FAK в опто-капельки LIMD1 (дополнительный рисунок 4c-e и дополнительный видео 20-26). Взятые вместе, наши наблюдения демонстрируют, что LIMD1 может привлекать определенные компоненты FA через разделение фаз.
Рисунок 4. Фазовое разделение LIMD1 привлекает специфические белки фокальной адгезии(a) Типичные флуоресцентные изображения, показывающие, что белок зиксин-mCherry демонстрирует сильную совместную локализацию с белком LIMD1-GFP в разделенных по фазе каплях. Масштабная линейка 20 мкм.
(b) Типичные флуоресцентные изображения, показывающие, что белок паксиллин-mCherry не совмещается с каплями LIMD1-GFP, разделенными фазами. Масштабная линейка 20 мкм.
(c) Репрезентативные изображения zyxin-mCherry, показывающие несколько кластеров, сформированных после воздействия синего света.Масштабная линейка 20 мкм.
(d) Репрезентативные изображения паксиллина-mCherry, показывающие отсутствие кластеров, образованных после воздействия синего света. Масштабная линейка 20 мкм.
(e) Репрезентативные изображения, показывающие коэкспрессию LIMD1-Cry2 (желтый) и зиксин-GFP (пурпурный) в клетках MDA-MB-231, образуя множество ярких точек, содержащих оба белка, после воздействия синего света. Пунктирные прямоугольники увеличены справа. Масштабная линейка 20 мкм.
(f) Типичные изображения, показывающие коэкспрессию LIMD1-Cry2 (желтый) и паксиллин-GFP (зеленый) в клетках MDA-MB-231.Пунктирные прямоугольники увеличены справа. Масштабная линейка 20 мкм.
Затем мы спросили, повлияет ли нарушение фазового разделения LIMD1 на клеточный механо-ответ. Наблюдая, что усечение либо доменов LIM (ΔLIM), либо IDR (ΔIDR) LIMD1 резко снижает его способность к фазовому разделению, мы затем ввели эти усечения обратно в KO-ячейки LIMD1 и исследовали способность этих спасательных ячеек генерировать силу. . Во-первых, оба ΔLIM и ΔIDR смогли локализоваться на FA (дополнительный рис.5а). Затем были выполнены анализ сократимости геля и микроскопия тягового усилия для оценки клеточной механической силы. Интересно, что ни ΔLIM, ни ΔIDR экспрессирующие клетки не способны восстанавливать деформацию дефектного геля при истощении LIMD1 (рис. 5a и b). Напротив, повторное введение полноразмерного LIMD1 обратно в эти клетки было способно восстановить сокращение клеток (рис. 5a и b). Наконец, мы сравнили способность этих спасательных клеток направленно мигрировать на геле с градиентом жесткости. Примечательно, что клетки, экспрессирующие ΔLIM или ΔIDR, все еще сдерживались в дуротактической миграции по сравнению с клетками LIMD1 KO, спасенными с помощью полноразмерного LIMD1 (рис.5c и дополнительное видео 7-8, 27-29). Взятые вместе, эти результаты предполагают, что свойство LIMD1 может играть важную роль в регулировании механических ответов клеток.
Рис. 5. Нарушение разделения фаз LIMD1 препятствует клеточной механотрансдукции(a) Слева: контроль, LIMD1 KO, KO_FL (LIMD1 KO спасен с помощью LIMD1 полной длины), KO_ ΔIDR (LIMD1 KO спасен с помощью ΔIDR) и KO_ ΔLIM (LIMD1 KO, спасенный с помощью ΔLIM) MEF культивируют в трехмерных коллагеновых гелях.Морфологию гелевой смеси клетки и коллагена регистрируют через 0, 8 и 48 часов. Масштабная линейка 5 мм. Справа: количественная оценка сокращения коллагенового геля с использованием измерения площади геля (N = 3 эксперимента, планки ошибок: 95% ДИ, * P <0,05, *** P <0,001 по тесту Стьюдента t для сравнения двух групп).
(b) Слева: репрезентативные изображения контрольных, LIMD1 KO, KO_FL, KO_ ΔIDR и KO_ ΔLIM MEF из экспериментов по микроскопии силы тяги (TFM). Цветовой спектр указывает на величину напряжения (Па), при этом области низкого сцепления показаны синим цветом, а области высокого сцепления — красным.Справа: количественная оценка общей силы из экспериментов TFM, показывающая различную силу тяги этих пяти клеточных линий (n> 5 клеток, планки ошибок: 95% ДИ, * P <0,05, ** P <0,01 и *** P <0,001. по критерию Стьюдента t для сравнения двух групп, не значимо). Масштабная линейка 20 мкм.
(c) Справа: FMI управления, LIMD1 KO, KO_FL, KO_ ΔIDR и KO_ ΔLIM MEF. N Con = 55 ячеек, N LIMD1 KO = 45 ячеек, N KO_FL = 53 ячейки, N KO_ ΔIDR = 34 ячейки, N KO_ ΔLIM = 42 ячейки.Слева: розовые графики углового распределения пяти клеточных линий справа.
(d) Схематическая модель, показывающая разделение фаз LIMD1 на сайтах FA, запускаемое механическими сигналами при рекрутировании специфических белков FA во время созревания FA.
Итак, наше исследование раскрыло роль LIMD1 в клеточной механике и дуротактической миграции. Мы раскрываем способность LIMD1 подвергаться фазовому разделению и демонстрируем, что как LIM-домены, так и IDR LIMD1 синергетически вносят свой вклад в его свойство фазового разделения.Кроме того, наши данные показывают рекрутирование специфических поздних белков FA за счет фазового разделения LIMD1. Мы предлагаем модель, в которой индуцированное силой обогащение LIMD1 на FAs и последующее разделение фаз вносят вклад в рекрутирование поздних белков FA и в конечном итоге облегчают клеточную механотрансдукцию и дуротаксис (Fig. 5d). Разделение фаз отражает переход расслоения, при котором гомогенный и хорошо перемешанный раствор перестраивается так, что отдельные области пространства заняты определенной концентрацией видов 38 .По сравнению с иерархическим межбелковым взаимодействием, разделение фаз LIMD1 может служить динамическим центром для быстрого набора специфических белков и одновременно обеспечивать высокую проницаемость. Это интригующая возможность, что как LIM-домен-зависимые, так и IDR-зависимые взаимодействия участвуют в достижении специфичности рекрутирования белков. Фазовое разделение, как известно, играет роль во множестве клеточных процессов, включая образование классических безмембранных органелл, сигнальных комплексов, цитоскелета и многих других супрамолекулярных ансамблей 38 .Идентификация разделения фаз белка FA иллюстрирует другое важное физиологическое значение разделения фаз в ответ не только на биохимические воздействия, но и на биомеханические сигналы. Будущие исследования по изучению свойства разделения фаз других компонентов ЖК могут расширить наши представления о межклеточном взаимодействии между ощущением механического микроокружения и регуляцией межклеточных белковых ансамблей.
МЕТОДЫ
Антитела и реагенты
В этом исследовании были использованы следующие антитела: анти-β-актин (ab8226) и анти-GAPDH (ab181602) были приобретены у abcam; анти-α-тубулин (T9026) от Sigma-Aldrich; анти-GFP (598 и M048-3) из MBL; антипаксиллин (610620) от BD Biosciences; анти-LIMD1 (MABD85) от EMD Millipore; антивинкулин (V9131) и антиталин (SAB4200694) от Sigma-Aldrich; анти-P-FAK (Y397, 3283S) от Cell Signaling Technology; анти-RhoA (ARH04) из цитоскелета; вторичные антитела, конъюгированные с пероксидазой хрена (HRP) против мыши (sc-2005) и против кролика (sc-2004) от Santa Cruz Biotechnology.Ослиные антитела против мышиного IgG (H + L) с высокой перекрестной адсорбцией вторичных антител, Alexa Fluor 488 (A-21202) и 555 (A-31570) были приобретены у Life Technologies.
Ингибитор миозина II (блеббистатин, 2946047) был приобретен у EMD Millipore, активатор Rho II (CN03) от Cytoskeleton, ингибитор фокальной адгезии киназы-1 (FAK) (PF 573228) от Sigma-Aldrich, ингибитор ROCK (Y-27632, 13624S) от Cell Signaling Technology. Диметилсульфоксид (ДМСО, 0247C211) был приобретен в Life Science, мини-таблетки с ингибитором протеазы, без EDTA (88666) от Thermo Fisher Scientific, коктейль с ингибитором фосфатазы 3 (P0044) от Sigma-Aldrich.Модифицированные карбоксилатом шарики FluoShperes, конъюгированные с красителем 561 (0,1 мкм, F8887), были приобретены в Thermo Fisher Scientific. Гранулы агарозы с протеином A + G (P2012) были приобретены у Beyotime. CellTracker Green (C7025) и MitoTracker Red (M7512) были приобретены у Invitrogen.
Клеточные линии и культура клеток
Эмбриональные фибробласты мыши (MEF) были любезным подарком лаборатории Джеймса Медведя в Университете Северной Каролины в Чапел-Хилл. и клетки эмбриональной почки человека 293T (HEK 293T) хранились в нашей лаборатории.Клетки пигментного эпителия сетчатки человека (hRPE) и клетки MDA-MB-231 были щедро предоставлены лабораторией Yujie Sun (Пекинский университет, Пекин, Китай).
Клетки культивировали в среде Игла, модифицированной Дульбекко (DMEM) с добавлением 10% фетальной бычьей сыворотки (FBS; PAN, Biotech), 100 Ед / мл пенициллина и 100 мкг / мл стрептомицина при 37 ° C с 5% CO 2 .
Плазмиды и временная инфекция
Плазмида pcDNA3.1-CRY2-sfcherry была любезным подарком лаборатории Yujie Sun.Человеческий limd1, винкулин, зиксин, trip6 и vasp были клонированы из библиотеки кДНК, предоставленной лабораторией Jiahuai Han (Университет Сямэня, Сямэнь, Китай). Паксиллин человека клонировали из библиотеки кДНК, выделенной из клеток HEK293FT. Limd1, паксиллин, винкулин, зиксин, trip6 и vasp были субклонированы в лентивирусный вектор (pLVX-AcGFP-N1) или вектор pLL5.0 для создания стабильных клеточных линий.
КлеткиHEK 293T, MEF, 231 и hRPE трансфицировали в соответствии с протоколом трансфекции ДНК Neofect (KS2000). Через 24–48 ч клетки проверяли на экспрессию флуоресцентного белка с последующей визуализацией или сбором клеточных лизатов.
CRSPR / Cas9-опосредованный нокаут гена LIMD1
Следующие однонаправленные РНК (sgRNA) и праймеры были использованы для создания MEF с нокаутом LIM D1: mLIMD1-sgRNA-1: 5′-ATCGTGGTAGAGATCTCCCA-3-sgIMD -2: 5′-TCCTGTGTGAAATGCAGCAA-3 ‘. Один клон клеток MEF из пула клеток, инфицированных лентивирусом, был отобран и проверен путем секвенирования ДНК.
Вестерн-блоттинг
Для вестерн-блоттинга клетки один раз промывали DPBS и лизировали в соответствующем объеме буфера RIPA (50 мМ трис-HCl, pH 8.0, 150 мМ NaCl, 1% Triton X-100, 0,5% Na-дезоксихолата, 0,1% SDS, 1 мМ EDTA и смесь ингибиторов протеазы) в течение 10 мин на льду. Лизаты центрифугировали при 13 572 g в течение 10 мин и собирали супернатанты. Затем к супернатантам добавляли 5-кратный загрузочный буфер SDS и кипятили в течение 10 мин. Пробы белков обрабатывали на 10% акриламидных гелях SDS-PAGE и переносили на нитроцеллюлозные (NC) мембраны влажным электрофоретическим переносом с последующей инкубацией первичных и вторичных антител при 4 ° C в течение ночи или при комнатной температуре в течение 2 часов.Рентгеновская пленка использовалась для обнаружения и регистрации интенсивности полос. Фиксированная рентгеновская пленка сканировалась и были получены цифровые изображения. Интенсивность полосы была определена количественно с помощью программного обеспечения Fiji (https://fiji.sc).
Коиммунопреципитация
Клетки высевали на чашки диаметром 6 см и трансфицировали pLVX-AcGFP-N1 или винкулин-AcGFP и Limd1-mCherry, затем лизировали 350 мкл буфера для лизиса Pierce IP (25 мМ Tris-HCl, 1 мМ ЭДТА, 150 мМ NaCl, 5% глицерин, 1% NP-40, pH = 7,4) в течение 15 минут на льду.Лизаты центрифугировали при 13 572 g, 4 ° C в течение 10 минут и собирали супернатанты. На образец отбирали 60 мкл лизатов и помещали в чистую микроцентрифужную пробирку в качестве «входных» образцов. Затем к оставшимся лизатам добавляли 2,5 мкг антитела против GFP и инкубировали на вращающемся колесе при 4 ° C в течение ночи. После этого к лизатам с антителом добавляли 50 мкл гранул агарозы с протеином A + G и инкубировали на вращающемся колесе при 4 ° C в течение не менее 3 часов. Затем шарики собирали и промывали трижды.Для ресуспендирования гранул и «входных» образцов использовали 5-кратный буфер для загрузки образцов. Перед разделением с помощью SDS-PAGE образцы кипятили в течение 10 минут и ненадолго замедляли вращение.
Иммунофлуоресценция и визуализационный анализ
Клетки высевали на промытые кислотой покровные стекла, покрытые 10 мкг / мл фибронектина, в течение ночи. Затем клетки фиксировали 4% параформальдегидом при комнатной температуре в течение 15 минут, пермеабилизировали 0,5% Triton X-100 в PBS в течение 10 минут, промывали PBS один раз в течение 5 минут и блокировали 10% бычьим сывороточным альбумином (BSA) в течение 1 часа. .Затем первичное антитело разводили 1: 200 в 1% PBS и инкубировали в течение 1 ч при комнатной температуре. После трехкратной промывки PBS покровные стекла инкубировали с Alexa Fluor 488 или вторичным антителом, конъюгированным с 555, в течение 1 часа при комнатной температуре. После трехкратной промывки в PBS покровные стекла закрывали Prolong Diamond Antifade с DAPI. Изображения были получены с использованием конфокальной системы визуализации Andor Dragonfly.
Получение изображений живых клеток
Изображения живых клеток были получены с разрешением 63 × 1.Линза объектива 4 NA на конфокальной системе визуализации Andor Dragonfly и системе визуализации EVOS M7000 (Thermo Fisher Scientific). Клетки высевали на чашки для культивирования клеток со стеклянным дном, покрытые фибронектином (10 мкг / мл), перед визуализацией. Клетки поддерживали в среде DMEM с добавлением 10% FBS (PAN, Biotech), 100 Ед / мл пенициллина и 100 мкг / мл стрептомицина при 37 ° C на протяжении всего процесса визуализации. Изображения были получены через указанные интервалы. Для визуализации с опто-капельным фазовым разделением клетки покрывали оловянной фольгой, чтобы блокировать свет.
Анализ динамики фокальной адгезии
MEF, временно трансфицированные паксиллином-GFP мыши, помещали в камеру для нагрева (37 ° C) на предметном столике покадрового флуоресцентного микроскопа (IXplore TIRF; Olympus, Япония). Изображения были получены с интервалом в 2,5 минуты и обработаны для оценки различных параметров с помощью Focal Adhesion Analysis Server (FAAS) (http://faas.bme.unc.edu). Долговечность фокальной адгезии рассчитывалась с использованием FAAS, а цифры строились с использованием статистических решений для продуктов и услуг (SPSS).
Изготовление градиентных и однородных полиакриламидных (PA) гелей
Полиакриламидные гели с градиентом жесткости получали, как описано ранее 1 с небольшими изменениями. Каплю 65 мкл смеси, содержащей 10% акриламида, 0,5% бис-акриламида и 2 мг / мл Irgacure (Sigma-Aldrich, 410896), наносили на 24-миллиметровое стеклянное покровное стекло, модифицированное глутаральдегидом, покрытое стеклянным покровным стеклом, сделанным гидрофобным путем обработки Репел-Силан. Градиенты создавались путем первоначального покрытия раствора смеси акриламида непрозрачной маской и затем медленного скольжения по ней с контролируемой скоростью при облучении настольной УФ-лампой.Маску сдвигали с помощью автоматического шприцевого насоса (Chemyx Fusion 200). Для обеспечения полной полимеризации весь раствор смеси акриламида сначала подвергали воздействию УФ-света в течение 10 минут без покрытия (для начального сшивания), а затем маску сдвигали со скоростью 40 мкм / с в течение 10 минут для получения гелей с крутым градиентом жесткости. После фотополимеризации геля гидрофобное покровное стекло удаляли и гель тщательно промывали PBS для удаления непрореагировавших реагентов. Жесткость измеряли с помощью атомно-силовой микроскопии.Для облегчения клеточной адгезии фибронектин был ковалентно связан с гелями, как описано ниже.
Функционализирующий гель PA с фибронектином
Гели полиакриламида (PA) были изготовлены из 40% акриламида и 2% бис-акриламида, смешанных с 10% персульфатом аммония и 1% TEMED, где для создания использовались различные соотношения акриламида и бис-акриламида. гели с известной воспроизводимой жесткостью 2 . Гели наносили на покровные стекла, модифицированные глутаральдегидом. Предварительно смешанные растворы (раствор для замачивания: 137 мМ NaCl, 5% (об. / Об.) Глицерин; 2x буфер для конъюгации: 0.2 M MES, 10% (об. / Об.) Глицерин, pH 4,5; 10x EDC: 150 мМ, 29 мг / мл в деионизированной воде; Готовили 10x NHS: 250 мМ, 29 мг / мл в деионизированной воде). Раствор для замачивания сначала наносили пипеткой на каждую чашку так, чтобы гель был полностью погружен (1,5 мл), затем чашки инкубировали при комнатной температуре в течение не менее 1 часа. После этого смешивали 1 часть 10x EDC, 1 часть 10x NHS, 3 части деионизированной воды и 5 частей буфера для конъюгации 2x. Удалили весь раствор для замачивания с посуды, затем добавили достаточно раствора NHS / EDC, чтобы покрыть поверхность геля (1.5 мл) и чашки инкубировали при комнатной температуре в течение 30 мин в темноте. 20 мкг / мл фибронектина разводили в PBS (1: 100), затем удаляли раствор NHS / EDC. В конце концов, в чашки добавляли раствор фибронектина, затем чашки инкубировали при комнатной температуре в течение не менее 35 минут, чтобы обеспечить прикрепление фибронектина. После этого в каждую чашку добавляли PBS, и чашки хранили при 4 ° C.
Количественное определение и анализ дуротаксиса на геле PA
Дуротаксис анализировали с помощью конфокальной системы визуализации Andor Dragonfly и системы визуализации EVOS M7000 с использованием 10-кратного объектива.Клетки высевали на градиентные гели PA и давали возможность прикрепиться к поверхности геля в течение не менее 8 часов, затем образцы переносили в камеру для культивирования микроскопа (37 ° C, 5% CO2). Покадровые фазово-контрастные изображения снимались каждые 15 минут в течение 16 часов. Координаты и расстояния движения клеток отслеживались с помощью плагина Fiji «Manual Tracking», затем данные отслеживания были импортированы в плагин «Chemotaxis Tool» для создания статистических характеристик, таких как скорость, FMI (индекс прямой миграции), направленность и особенности графика, такие как роза сюжет.
Анализ сократимости
Клетки собирали и ресуспендировали в желаемой среде при 1 × 10 5 клеток / мл. 2% -ную решетку коллагена получали путем смешивания 10 × PBS, NaOH и H 2 O в пробирке на льду, затем в пробирку добавляли коллаген и затем интенсивно перемешивали. Для ресуспендирования клеток использовали 2% коллагена. Затем смесь клеток и коллагена высевали в 48-луночный планшет и культивировали при 37 ° C 5% CO 2 . Фотографии коллагеновых гелей были сделаны через 8, 24 и 48 часов, и ImageJ использовался для подсчета площади коллагеновых гелей в каждый момент времени, затем была построена кривая «время-площадь».
Восстановление флуоресценции после анализа фотообесцвечивания (FRAP)
Клетки культивировали в чашках со стеклянным дном по крайней мере за 8 часов до визуализации. Анализ FRAP выполняли на лазерном сканирующем микроскопе ZEISS 880 при 37 ° C. Сигналы GFP в областях интереса (ROI) были обесцвечены с использованием лазерного луча 488 нм на полной мощности. Разница в интенсивности флуоресценции между предварительным отбеливанием и моментом времени сразу после импульса фотообесцвечивания была нормализована до 100%. Экспериментальный контроль заключался в количественном определении интенсивности флуоресценции аналогичных участков точки / цитоплазмы без фотообесцвечивания.Чтобы извлечь количественную информацию из кривых FRAP, в Microsoft Excel использовались двухчленные аппроксимирующие экспоненциальные уравнения.
Тяговая микроскопия (TFM)
Клетки окрашивали 1 мкМ CellTracker Green в течение 50 мин, а затем высевали на полиакриламидные гели 4 кПа, залитые модифицированными карбоксилатом шариками FluoShperes диаметром 0,1 мкм, конъюгированными с красителем 561. Клеткам давали прилипнуть не менее 8 часов. Растекание клеток деформировало поверхности гелей, изменяя, таким образом, положение внедренных шариков.Флуоресцентные изображения встроенных шариков были получены с помощью конфокальной системы визуализации Andor Dragonfly. После получения изображений шариков добавляли трипсин / ЭДТА для отделения клеток в течение по крайней мере 5 минут и, таким образом, высвобождения сил, опосредованных клетками на геле. Впоследствии были получены изображения положения бусинок без клеточных сил. Силы тяги, проявляемые клетками, анализировали путем измерения смещения гранул, индуцированного клетками. Анализ силы тяги был выполнен с использованием алгоритма MATLAB. Смещение гранул рассчитывали с использованием метода корреляции цифровых изображений на основе градиента (до и после обработки трипсином / ЭДТА).Соответствующая деформация геля была получена методом двумерной гауссовой интерполяции. Поле напряжений (Па) рассчитывалось по деформации геля путем реализации алгоритма на основе преобразования Фурье с использованием функции Буссинеска Грина.
После получения карт силы тяги и флуоресцентных изображений можно рассчитать среднюю величину силы тяги, прилагаемой всей клеткой. Во-первых, контуры клеток извлекались с помощью встроенных морфологических функций в MATLAB. Затем контур ячейки был нанесен на карту силы тяги и установил силу тяги снаружи равной нулю.Наконец, среднюю силу тяги ячейкой можно рассчитать следующим образом: где, | T i | указывает величину тягового усилия на пиксель, а S представляет общую площадь контура ячейки.
Прогнозирование тенденции к расстройству
Тенденция к расстройству LIMD1 была предсказана IUPred (http://iupred.elte.hu).
Конструкции и экспрессия белка
Для рекомбинантной экспрессии в клетках насекомых фрагменты ДНК, кодирующие LIMD1 и ΔLIM, клонировали в вектор pFastbac-HT B с тегом GFP и 6 × His на С-конце.Бакмиды были получены с использованием системы Bac-to-Bac (Invitrogen). Рекомбинантные бакуловирусы были созданы и амплифицированы с использованием клеток насекомых sf9, содержащихся в среде SIM SF (Sino Biological Inc.).
Для продукции белка клетки sf9, выращенные в среде SIM SF (Sino Biological Inc.), инфицировали при плотности 3,0-4,0 × 106 клеток / мл. Через 72 часа после заражения 0,5 л осадка клеток собирали центрифугированием при 4000 g. Осадки клеток суспендировали в буфере для лизиса, содержащем 20 мМ трис-HCl (pH 8.0), 150 мМ NaCl, 5 мМ KCl, 10% глицерина, 20 мМ имидазола, 1 мМ трис (2-карбоксиэтил) фосфин гидрохлорид (TCEP) и смесь ингибиторов протеаз (Complete EDTA-free, Roche) и лизировали с помощью ультразвуковую обработку и очищают центрифугированием (20,0 0 0 об / мин). Белки очищали хроматографией Ni-IDA (Smart-Lifesciences) с последующей эксклюзионной хроматографией с использованием Superdex200 Increase 10/300 (GE Healthcare) в буфере, содержащем 20 мМ трис-HCl pH 8,0, 500 мМ NaCl. Наконец, белки были сконцентрированы, и концентрации были определены с помощью микроспектрофотометрии с использованием теоретических коэффициентов молярной экстинкции при 280 нм.Чистоту белка оценивали с помощью окрашивания гелей для электрофореза в SDS-PAGE окрашиванием кумасси синим.
Анализ фазового перехода in vitro
Подготовка покровных и предметных стекол
Промойте предметные стекла и покровные стекла дважды этанолом, затем высушите на воздухе. Вытрите слайды и покровные стекла насухо тканью для чистки линз. Создайте камеру для визуализации, прикрепив покровное стекло к предметному стеклу с помощью двусторонней ленты, размещенной параллельно друг другу, так что получилась прямоугольная камера с двумя отверстиями на противоположных сторонах, названная проточной камерой.
Анализы фазового разделения
Очищенные белки LIMD1 и ΔLIM разбавляли в растворе с высоким содержанием соли, содержащем 500 мМ NaCl, 20 мМ Трис (pH = 8,2), 1 мМ DTT. Чтобы вызвать разделение фаз на жидкие капли в условиях низкого содержания соли, белки разводили в соответствующих экспериментальных буферах до конечной концентрации 1,6 мМ АТФ, 4 мМ MgCl 2 , 20 мкМ ZnCl 2 и 1 мМ DTT. Перед использованием образцы размораживали, инкубируя их при комнатной температуре в течение 5 мин.Для визуализации капли наблюдали путем инъекции буферных смесей белковой фазы в самодельную проточную камеру для ДВС или флуоресцентной визуализации.
Статистика и отображение данных
Количество биологических и технических повторов и количество образцов указано в подписях к рисункам, в основном тексте и в материалах и методах. Данные представляют собой среднее значение ± SEM или среднее значение ± 95% ДИ. как указано в подписях к рисункам и в подписях к дополнительным рисункам. Тест Стьюдента t и анализ непараметрических тестов были выполнены с помощью GraphPad Prism 7.0. Данные анализа изображений были построены с помощью Prism и OriginPro 2019.
(PDF) Смачивание и фазовое разделение в мягкой адгезии
5
сфера. Определим отступ
V
как объем, занимаемый сферой
ниже плоскости недеформированной поверхности силикона
, а выступ V
как объем упругой сети
, смещенной над недеформированной поверхностью, как указано в
Рисунок 3 (а).Таким образом, мы можем измерить V
жидкость
из наших калибровочных профилей
как V
, отступ
— V
гребень
. Мы вычисляем эти объемы
путем численного интегрирования осесимметричных конфокальных профилей
.
Мы построили график зависимости V
жидкости
от радиуса сферы на вставке на рис.
ure 3 (b). Мы видим, что зависимость V
liquid
от размера сферы
отличается для различных функционализаций поверхности, но
масштабируется примерно как R
3
.Это говорит о том, что V
жидкость
может быть связано с объемом, а не с поверхностными эффектами.
Мы обнаруживаем, что все данные разрушаются, если мы вместо этого построим график
V
жидкость
по сравнению с V
, отступ
, как показано на основной панели Рис.
ure 3 (b). Объем контактной зоны с разделенными фазами
масштабируется по степенному закону с показателем степени 4/3 в этом диапазоне
объемов отпечатков. Чем больше эластичная сетка
сжимается за счет самопроизвольного вдавливания частицы
cle, тем больше объем несжимаемой жидкости, который фаза
отделяет от упругой сетки.Это коллапс
устойчив не только для фторуглеродных функционализированных и
простых сфер кремнезема, но также после изменения баланса
поверхностных энергий путем покрытия сферы и подложки
глицерином. Он может работать даже тогда, когда система находится вне равновесия
, поскольку некоторым из точек данных
, покрытых глиерколем, не было дано достаточно времени, чтобы уравновеситься до их новой глубины вдавливания
. Размерно, предварительный фактор для этого степенного коллапса
должен иметь размерность 1 / [длина].
Фитинг к V
жидкость
= (1 / L
0
) V
4/3
отступ
, мы измеряем L
0
= 38
мкм, что составляет около в десять раз больше длины эластокапилляров.
Мы видели, что во время адгезии с жестким объектом
, податливый гель фаза разделяется около линии контакта
, создавая зону четырехфазного контакта с тремя отдельными линиями контакта
. Общий объем области
с разделением фаз определяется степенью вдавливания и сжимаемостью эластичной сетки геля
.Геометрия этих контактных линий
не зависит от размера частиц
и предполагает, что поверхностное напряжение гель-пар твердого тела,
Υ
gv
, и поверхностное натяжение жидкость-пар, γ
lv
, различны —
ent, и что напряжение твердой поверхности между гелем и
жидкости, Υ
gl
, не равно нулю.
Эти открытия существенно меняют наше понимание
механики адгезии с гелями.Это новое понимание геометрии контакта
и баланса
действующих сил изменяет как будущую теоретическую работу
, так и инженерный дизайн программных интерфейсов. Хотя во многих ситуациях
гель можно рассматривать как единый гомогенный материал
, наши результаты демонстрируют, что в экстремальных или особых условиях
— например, на линии контакта — природа
геля как многослойного. фазовый материал становится критически важным.Это может иметь важные последствия не только для силиконовых материалов
, но и для таких материалов, как гидрогели
, которые недавно были предметом значительных исследований
[41–43]. Поскольку гидрогели
могут быть намного более сжимаемыми, чем силиконовые гели
, исследованные здесь [39, 40], возможно, что они будут еще более подвержены разделению фаз во время контакта.
Мы благодарим Манджари Рандериа и Росс Бауэр за помощь
с пробоподготовкой и Доминика Веллу за полезные обсуждения
и помощь с кодом MATLAB для анализа постоянной кривизны
.Мы подтверждаем финансирование
от Национального научного фонда (CBET-1236086).
R.W.S. также получил финансирование от Исследовательского фонда John Fell Oxford
University Press (OUP).
[1] К. Л. Джонсон и К. К. Л. Джонсон, Контактная механика,
(Cambridge University Press, 1987).
[2] К. Кретон и Э. Папон, Бюллетень MRS 28, 419 (2003).
[3] К. Р. Шулл, Д. Ан, В. -Л. Чен, К. М. Фланиган, А. Дж.
Кросби, Macromol.Chem. Phys. 199, 489 (1998).
[4] R.W Style, C. Hyland, R. Boltyanskiy, J.S. Wettlaufer,
и E.R. Dufresne, Nat. Comm. 4, 2728 (2013).
[5] Л. Пастевка и М. О. Роббинс, PNAS 111, 3298 (2014).
[6] А. Дж. Кросби, К. Р. Шулл, J. Polym. Sci., Часть B: Polym.
Phys. 37 3455, 1999.
[7] C. Creton, MRS Bulletin 28, 434 (2003).
[8] B. N. J. Persson, J. Chem. Phys. 115, 3840 (2001).
[9] И. Као и Ф. Ян, IEEE Trans.Роб. Автомат. 20, 132
(2004).
[10] С. Ким, М. Спенко, С. Трухильо, Б. Хейнеман, В. Маттоли,
и М. Р. Каткоски, 2007 IEEE Int. Конф. Robot Autom,
pp. 1268, 10-14 апреля 2007 г.
[11] Р. В. Мартинес, Дж. Л. Бранч, С. Р. Фиш, Л. Джин, РФ
Шеперд, РМД Нуньес, З. Суо и Г. М. Уайтсайдс,
Adv. Матер. 25, 205 (2013).
[12] С. Ким, К. Лаши и Б. Триммер, Trends Biotech. 31,
287 (2013).
[13] К. Л. Мауэри, А. Дж. Кросби, Д. Ан и К. Р. Шулл,
Langmuir 13, 6101 (1997).
[14] К. Дж. Ван Влит, Г. Бао, С. Суреш, Acta Mater. 51,
5881 (2003).
[15] С. Суреш, Acta Mater. 55, 3989 (2007).
[16] Q. S. Li, G. Y. H. Lee, C. N. Ong, C. T. Lim,
Biochem. Биофиз. Res. Commun. 374, 609 (2008).
[17] Д. Гонсалес-Родригес, К. Геворкян, С. Дуэзан и
Ф. Брошард-Вярт, Science 338, 910 (2012).
[18] К. Л. Джонсон, К. Кендалл, А. Д. Робертс, Proc.
Рой. Soc. А 324, 301 (1971).
[19] D. Maugis, Langmuir, 11, 679 (1995)
[20] D. Long, A. Ajdari, and L. Leibler, Langmuir 12, 5221
(1996).
[21] E. R. Jerison, Y. Xu, L. A. Wilen, E. R. Dufresne,
Phys. Rev. Lett. 106, 186103 (2011).
[22] А. Джагота, Д. Пареткар и А. Гхатак. Phys. Ред. E 85,
051602 (2012).
[23] Д.Paretkar, X. Xu, C. Hui и A. Jagota, Soft Matter
10, 4084 (2014)
[24] С. Мора, Т. Фу, Ж.-М. Fromental, L. M. Pismen,
Y. Pomeau, Phys. Rev. Lett. 105, 214301 (2010).
[25] X. Xu, A. Jagota и C. Hui, Soft Matter 10, 4625
(2014).
Немышечный миозин II занимает центральное место в адгезии и миграции клеток
Holmes, K.C. in Myosins (ed. Coluccio, L.M.) 35–54 (Springer, Нидерланды, 2007). Предоставляет подробный обзор членов селективного класса миозина, включая NM II. См. Также ссылки 2, 3, 6, 7 и 9.
Google Scholar
Mooseker, M. S. & Foth, B. J. in Myosins (изд. Coluccio, L.M.) 1–34 (Springer, Нидерланды, 2007).
Google Scholar
Эль-Мезгуельди, М. и Багшоу, К. Р. в Myosins (изд.Колуччио, Л. М.) 55–93 (Springer, Нидерланды, 2007).
Google Scholar
Ричардс Т. А. и Кавалье-Смит Т. Эволюция домена миозина и первичная дивергенция эукариот. Nature 436 , 1113–1118 (2005).
CAS PubMed PubMed Central Google Scholar
Одрониц Ф. и Коллмар М. Рисование древа эукариотической жизни на основе анализа 2269 вручную аннотированных миозинов 328 видов. Genome Biol. 8 , R196 (2007).
PubMed PubMed Central Google Scholar
Cremo, C. R. и Hartshorne, D. J. in Myosins (изд. Coluccio, L.M.) 171–222 (Springer, Нидерланды, 2007).
Google Scholar
Reggiani, C. & Bottinelli, R. in Myosins (изд. Coluccio, L.M.) 125–169 (Springer, Нидерланды, 2007).
Google Scholar
Кларк, К., Лангеслаг, М., Фигдор, К. Г. и ван Левен, Ф. Н. Миозин II и механотрансдукция: балансирующий акт. Trends Cell Biol. 17 , 178–186 (2007).
CAS PubMed PubMed Central Google Scholar
Conti, M. A., Kawamoto, S. & Adelstein, R. S. in Myosins (ed. Coluccio, L.M.) 223–264 (Springer, Нидерланды, 2007).
Google Scholar
Конти, М. А. и Адельштейн, Р. С. Немышечный миозин II движется в новых направлениях. J. Cell Sci. 121 , 11–18 (2008).
CAS PubMed PubMed Central Google Scholar
Крендель, М. и Мусекер, М.С. Миозины: хвосты (и головы) функционального разнообразия. Физиология 20 , 239–251 (2005).
CAS PubMed PubMed Central Google Scholar
Swailes, N. T., Colegrave, M., Knight, P. J. & Peckham, M. Немышечные миозины 2A и 2B управляют изменениями в морфологии клеток, которые происходят по мере выравнивания и слияния миобластов. J. Cell Sci. 119 , 3561–3570 (2006).
CAS PubMed PubMed Central Google Scholar
Юэн, С.Л., Огут О. и Брозович Ф. В. Немышечный миозин регулируется во время сокращения гладких мышц. Am. J. Physiol. Heart Circ. Physiol. 297 , h291 – h299 (2009 г.).
CAS PubMed PubMed Central Google Scholar
Morano, I. et al. Сокращение гладких мышц без миозина гладких мышц. Nature Cell Biol. 2 , 371–375 (2000). Первая демонстрация того, что NM II может играть роль в сокращении гладких мышц.Авторы используют мышей с нокаутом гладких мышц по миозину для изучения сокращения гладких мышц и показывают, что длительная фаза сокращения обусловлена NM II. См. Ссылку 13 для недавней работы в этой области, которая предполагает, что NM IIB может вносить вклад в состояние «защелкивания» гладких мышц.
CAS PubMed PubMed Central Google Scholar
Нидерман Р. и Поллард Т. Д. Миозин тромбоцитов человека. II. In vitro сборка и структура миозиновых филаментов. J. Cell Biol. 67 , 72–92 (1975).
CAS PubMed PubMed Central Google Scholar
Свиткина Т.М., Верховский А.Б. и Бориси Г.Г. Усовершенствованные процедуры электронной микроскопии визуализации цитоскелета культивируемых клеток. J. Struct. Биол. 115 , 290–303 (1995).
CAS PubMed PubMed Central Google Scholar
Мэнсфилд, С.Г., аль-Ширави, Д. Ю., Кетчум, А. С., Ньюберн, Э. С. и Кихарт, Д. П. Молекулярная организация и альтернативный сплайсинг в Zipper , гене, который кодирует тяжелую цепь немышечного миозина II Drosophila . J. Mol. Биол. 255 , 98–109 (1996).
CAS PubMed PubMed Central Google Scholar
Jana, S. S. et al. Альтернативно сплайсированная изоформа немышечного миозина II-C не регулируется фосфорилированием легкой цепи миозина. J. Biol. Chem. 284 , 11563–11571 (2009).
CAS PubMed PubMed Central Google Scholar
Ли Ю., Лалвани А. К. и Мхатре А. Н. Альтернативные варианты соединения MYH9. ДНК Cell Biol. 27 , 117–125 (2008).
CAS PubMed PubMed Central Google Scholar
Мопен, П., Филлипс, К.Л., Адельштейн, Р. С. и Поллард, Т. Д. Дифференциальная локализация изоферментов миозина-II в культивируемых клетках человека и клетках крови. J. Cell Sci. 107 , 3077–3090 (1994).
CAS PubMed PubMed Central Google Scholar
Колега, Дж. Цитоплазматическая динамика миозина IIA и IIB: пространственная «сортировка» изоформ в движущихся клетках. J. Cell Sci. 111 , 2085–2095 (1998).
CAS PubMed PubMed Central Google Scholar
Висенте-Мансанарес, М., Зарено, Дж., Уитмор, Л., Чой, К. К. и Хорвиц, А. Ф. Регулирование протрузии, динамики адгезии и полярности миозинами IIA и IIB в мигрирующих клетках. J. Cell Biol. 176 , 573–580 (2007).
CAS PubMed PubMed Central Google Scholar
Бао, Дж., Яна, С. и Адельштейн, Р. С. Немышечные изоформы миозина II позвоночных восстанавливают небольшие интерферирующие РНК-индуцированные дефекты цитокинеза клеток COS-7. J. Biol. Chem. 280 , 19594–19599 (2005).
CAS PubMed PubMed Central Google Scholar
Golomb, E. et al. Идентификация и характеристика немышечного миозина II-C, нового члена семейства миозинов II. J. Biol. Chem. 279 , 2800–2808 (2004).
CAS PubMed Google Scholar
Ким, К. Ю., Ковач, М., Кавамото, С., Селлерс, Дж. Р. и Адельштейн, Р. С. Мутации, связанные с заболеванием, и альтернативный сплайсинг изменяют ферментативную и подвижную активность немышечных миозинов II-B и II-C. J. Biol. Chem. 280 , 22769–22775 (2005).
CAS PubMed Google Scholar
Ковач, М., Ван Ф., Ху А., Чжан Ю. и Селлерс Дж. Р. Функциональная дивергенция цитоплазматического миозина II человека: кинетическая характеристика немышечной изоформы IIA. J. Biol. Chem. 278 , 38132–38140 (2003).
CAS PubMed PubMed Central Google Scholar
Wang, F. et al. Кинетический механизм немышечного миозина IIB: функциональные адаптации для создания и поддержания напряжения. J. Biol.Chem. 278 , 27439–27448 (2003). Вместе со ссылкой 26 в этой статье подробно описаны различия в кинетических свойствах NM IIA и NM IIB. Эти исследования обеспечивают механистическую основу для понимания предполагаемой in vivo функции двух из трех изоформ NM II.
CAS PubMed PubMed Central Google Scholar
Ковач, М., Тирумуруган, К., Knight, P.J. & Sellers, J.R. Зависимый от нагрузки механизм немышечного миозина 2. Proc. Natl Acad. Sci. США 104 , 9994–9999 (2007).
CAS PubMed Google Scholar
Bao, J., Ma, X., Liu, C. & Adelstein, R. S. Замена немышечного миозина II-B на II-A спасает мозг, но не сердечные дефекты у мышей. J. Biol. Chem. 282 , 22102–22111 (2007).
CAS PubMed PubMed Central Google Scholar
Накасава, Т.и другие. Критические области сборки немышечного миозина II позвоночных. Биохимия 44 , 174–183 (2005).
CAS PubMed PubMed Central Google Scholar
Сато, М. К., Такахаши, М. и Ядзава, М. Две области хвоста необходимы для изоформ-специфичных функций немышечного миозина IIB. Мол. Биол. Ячейка 18 , 1009–1017 (2007).
CAS PubMed PubMed Central Google Scholar
Сандквист, Дж.C. & Means, A.R. С-концевой хвостовой участок немышечного миозина II управляет изоформ-специфическим распределением в мигрирующих клетках. Мол. Биол. Ячейка 19 , 5156–5167 (2008).
CAS PubMed PubMed Central Google Scholar
Висенте-Мансанарес, М., Коач, М. А., Уитмор, Л., Ламерс, М. Л. и Хорвиц, А. Ф. Сегрегация и активация миозина IIB создает тыл в мигрирующих клетках. Дж.Cell Biol. 183 , 543–554 (2008).
CAS PubMed PubMed Central Google Scholar
Somlyo, A. P. & Somlyo, A. V. Ca 2+ Чувствительность гладкомышечного и немышечного миозина II: модулируется G-белками, киназами и миозинфосфатазой. Physiol. Ред. 83 , 1325–1358 (2003).
CAS PubMed PubMed Central Google Scholar
Вендт Т., Taylor, D., Trybus, K. M. & Taylor, K. Реконструкция трехмерного изображения дефосфорилированного тяжелого меромиозина гладких мышц выявляет асимметрию во взаимодействии между головками миозина и размещением субфрагмента 2. Proc. Natl Acad. Sci. США 98 , 4361–4366 (2001).
CAS PubMed PubMed Central Google Scholar
Селлерс, Дж. Р., Айзенберг, Э. и Адельштейн, Р. С. Связывание тяжелого меромиозина гладких мышц с актином в присутствии АТФ.Эффект фосфорилирования. J. Biol. Chem. 257 , 13880–13883 (1982).
CAS PubMed PubMed Central Google Scholar
Hirata, N., Takahashi, M. & Yazawa, M. Дифосфорилирование регуляторной легкой цепи миозина IIA отвечает за правильное распространение клеток. Biochem. Биофиз. Res. Commun. 381 , 682–687 (2009).
CAS PubMed PubMed Central Google Scholar
Икебе, М., Hartshorne, D. J. & Elzinga, M. Идентификация, фосфорилирование и дефосфорилирование второго сайта киназы легкой цепи миозина на легкой цепи миозина гладких мышц размером 20000 дальтон. J. Biol. Chem. 261 , 36–39 (1986).
CAS PubMed PubMed Central Google Scholar
Умемото, С., Бенгур, А. Р. и Селлерс, Дж. Р. Влияние множественного фосфорилирования гладких мышц и цитоплазматических миозинов на движение в анализе подвижности in vitro. J. Biol. Chem. 264 , 1431–1436 (1989).
CAS PubMed PubMed Central Google Scholar
Шоли, Дж. М., Тейлор, К. А. и Кендрик-Джонс, Дж. Регуляция сборки немышечного миозина с помощью кальмодулин-зависимой киназы легкой цепи. Nature 287 , 233–235 (1980).
CAS PubMed PubMed Central Google Scholar
Вудхед, Дж.L. et al. Атомная модель миозинового филамента в расслабленном состоянии. Nature 436 , 1195–1199 (2005).
CAS PubMed PubMed Central Google Scholar
Юнг, Х. С., Комацу, С., Икебе, М. и Крейг, Р. Взаимодействие голова-голова и голова-хвост: общий механизм выключения активности миозина II в клетках. Мол. Биол. Ячейка 19 , 3234–3242 (2008).
CAS PubMed PubMed Central Google Scholar
Крейг, Р.И Вудхед, Дж. Л. Структура и функция миозиновых филаментов. Curr. Opin. Struct. Биол. 16 , 204–212 (2006).
CAS PubMed PubMed Central Google Scholar
Burgess, S.A. et al. Структуры гладкомышечного миозина и тяжелого меромиозина в свернутом, закрытом состоянии. J. Mol. Биол. 372 , 1165–1178 (2007). Вместе со ссылками 35 и 41–43 это выдающееся структурное исследование, которое показывает преобразование свернутого, заблокированного (10S) состояния в развернутое, активированное (6S) состояние одиночных молекул NM II после фосфорилирования RLC.Эти исследования также показывают взаимодействие двух головок миозина в неактивном состоянии.
CAS PubMed PubMed Central Google Scholar
Мацумура, Ф. Регулирование миозина II во время цитокинеза у высших эукариот. Trends Cell Biol. 15 , 371–377 (2005).
CAS PubMed PubMed Central Google Scholar
Тан, И., Yong, J., Dong, J. M., Lim, L. & Leung, T. Трехкомпонентный комплекс, содержащий MRCK, модулирует ретроградный поток ламеллярного актомиозина. Cell 135 , 123–136 (2008).
CAS PubMed PubMed Central Google Scholar
Мацумура, Ф. и Хартшорн, Д. Дж. Субъединица-мишень миозинфосфатазы: многие роли в функции клетки. Biochem. Биофиз. Res. Commun. 369 , 149–156 (2008).
CAS PubMed PubMed Central Google Scholar
Totsukawa, G. et al. Различная роль ROCK (Rho-kinase) и MLCK в пространственной регуляции фосфорилирования MLC для сборки стрессовых волокон и фокальных адгезий в фибробластах 3T3. J. Cell Biol. 150 , 797–806 (2000).
CAS PubMed PubMed Central Google Scholar
Тоцукава, Г.и другие. Различная роль MLCK и ROCK в регуляции выступов мембраны и динамики фокальной адгезии во время миграции клеток фибробластов. J. Cell Biol. 164 , 427–439 (2004).
CAS PubMed PubMed Central Google Scholar
Nishikawa, M., Sellers, J. R., Adelstein, R. S. & Hidaka, H. Протеинкиназа C модулирует in vitro фосфорилирование тяжелого меромиозина гладких мышц киназой легкой цепи миозина. J. Biol. Chem. 259 , 8808–8814 (1984).
CAS PubMed PubMed Central Google Scholar
Komatsu, S. & Ikebe, M. Фосфорилирование миозина II по Ser1 и Ser2 имеет решающее значение для реорганизации миозиновых филаментов, вызванной нормальным фактором роста тромбоцитов. Мол. Биол. Ячейка 18 , 5081–5090 (2007).
CAS PubMed PubMed Central Google Scholar
Bosgraaf, L.& van Haastert, P.J. Регулирование миозина II в Dictyostelium . Eur. J. Cell Biol. 85 , 969–979 (2006).
CAS PubMed PubMed Central Google Scholar
Even-Faitelson, L. & Ravid, S. PAK1 и aPKCζ регулируют фосфорилирование миозина II-B: новый сигнальный путь, регулирующий сборку филаментов. Мол. Биол. Ячейка 17 , 2869–2881 (2006).
CAS PubMed PubMed Central Google Scholar
Дулянинова Н.Г., Малашкевич, В. Н., Алмо, С. С., Бресник, А. Р. Регулирование сборки миозина-IIA и связывания Mts1 путем фосфорилирования тяжелой цепи. Биохимия 44 , 6867–6876 (2005).
CAS PubMed PubMed Central Google Scholar
Clark, K. et al. TRPM7 регулирует стабильность филаментов миозина IIA и локализацию белка за счет фосфорилирования тяжелых цепей. J. Mol. Биол. 378 , 790–803 (2008).
PubMed PubMed Central Google Scholar
Конти, М. А., Селлерс, Дж. Р., Адельштейн, Р. С. и Эльзинга, М. Идентификация остатка серина, фосфорилируемого протеинкиназой С в немышечных тяжелых цепях миозина позвоночных. Биохимия 30 , 966–970 (1991).
CAS PubMed PubMed Central Google Scholar
Ludowyke, R.I. et al. Фосфорилирование немышечной тяжелой цепи IIA миозина на Ser1917 опосредуется протеинкиназой C II и совпадает с началом стимулированной дегрануляции тучных клеток RBL-2h4. J. Immunol. 177 , 1492–1499 (2006).
CAS PubMed PubMed Central Google Scholar
Ли, З. Х. и Бресник, А. Р. Фактор метастазирования S100A4 регулирует клеточную подвижность посредством прямого взаимодействия с миозином-IIA. Cancer Res. 66 , 5173–5180 (2006).
CAS PubMed PubMed Central Google Scholar
Clark, K. et al. Α-киназы TRPM6 и TRPM7, но не киназа eEF-2, фосфорилируют домен сборки миозина IIA, IIB и IIC. FEBS Lett. 582 , 2993–2997 (2008).
CAS PubMed PubMed Central Google Scholar
Ронен Д.& Ravid, S. Миозин II определяет его паракристаллическую структуру, свойства сборки филаментов и клеточную локализацию. J. Biol. Chem. 284 , 24948–24957 (2009).
CAS PubMed PubMed Central Google Scholar
Хит, Дж. П. и Холифилд, Б. Ф. Передвижение клеток: новое исследование проверяет старые идеи о мембранном и цитоскелетном потоке. Ячейка. Мотил. Цитоскелет 18 , 245–257 (1991).
CAS PubMed PubMed Central Google Scholar
Поллард, Т. Д. и Бориси, Г. Г. Подвижность клеток, управляемая сборкой и разборкой актиновых филаментов. Cell 112 , 453–465 (2003).
CAS Google Scholar
Кестлер, С. А., Ауингер, С., Винзенц, М., Роттнер, К. и Смолл, Дж. В. Дифференциально ориентированные популяции актиновых филаментов, генерируемые в ламеллиподиях, взаимодействуют в толчке и остановке на клеточном фронте. Nature Cell Biol. 10 , 306–313 (2008).
CAS PubMed PubMed Central Google Scholar
Ponti, A., Machacek, M., Gupton, S. L., Waterman-Storer, C. M. & Danuser, G. Две различные сети актина управляют протрузией мигрирующих клеток. Наука 305 , 1782–1786 (2004). Описывает кинетические и композиционные различия между ламеллиподиумом и ламеллумом — двумя актиновыми сетями в выступах.
CAS PubMed PubMed Central Google Scholar
Delorme, V. et al. Активность кофилина ниже Pak1 регулирует эффективность клеточного выпячивания за счет организации ламеллиподиевых и ламеллярных актиновых сетей. Dev. Ячейка 13 , 646–662 (2007).
CAS PubMed PubMed Central Google Scholar
Cai, Y. et al.Немышечная миозин IIA-зависимая сила подавляет распространение клеток и управляет потоком F-актина. Biophys. J. 91 , 3907–3920 (2006).
CAS PubMed PubMed Central Google Scholar
Giannone, G. et al. Периодические сокращения ламеллиподов коррелируют с волнами актина, направленными назад. Cell 116 , 431–443 (2004).
CAS Google Scholar
Джанноне, Г.и другие. Ламеллиподиальный актин механически связывает активность миозина с образованием сайтов адгезии. Cell 128 , 561–575 (2007).
CAS PubMed PubMed Central Google Scholar
Андерсон, Т. В., Воган, А. Н. и Крамер, Л. П. Ретроградный поток и активность миозина II в пределах переднего края клетки доставляют F-актин к ламеллам, чтобы засеять образование пучков нитей актомиозина II с переменной полярностью в мигрирующих фибробластах. Мол. Биол. Ячейка 19 , 5006–5018 (2008).
CAS PubMed PubMed Central Google Scholar
Неметова М., Ауингер С. и Смолл Дж. В. Построение актинового цитоскелета: филоподии участвуют в построении сократительных пучков в ламеллах. J. Cell Biol. 180 , 1233–1244 (2008).
CAS PubMed PubMed Central Google Scholar
Even-Ram, S.и другие. Миозин IIA регулирует подвижность клеток и перекрестные помехи между актомиозином и микротрубочками. Nature Cell Biol. 9 , 299–309 (2007). Устанавливает роль NM IIA в совместной регуляции функций актина и микротрубочек в подвижных клетках.
CAS PubMed PubMed Central Google Scholar
Митчисон Т. и Киршнер М. Динамика цитоскелета и рост нервов. Нейрон 1 , 761–772 (1988).
CAS PubMed Google Scholar
Lin, C. H. & Forscher, P. Продвижение конуса роста обратно пропорционально ретроградному потоку F-актина. Нейрон 14 , 763–771 (1995).
CAS PubMed PubMed Central Google Scholar
Джей П. Ю., Фам П. А., Вонг С. А. и Элсон Э. Л. Механическая функция миозина II в подвижности клеток. J. Cell Sci. 108 , 387–393 (1995).
CAS PubMed PubMed Central Google Scholar
Choi, C. K. et al. Актин и α-актинин регулируют сборку и созревание возникающих спаек моторно-независимым образом от миозина II. Nature Cell Biol. 10 , 1039–1050 (2008).
CAS PubMed Google Scholar
Александрова, А.Y. et al. Сравнительная динамика ретроградного потока актина и очаговых спаек: образование возникающих спаек запускает переход от быстрого потока к медленному. PLoS ONE 3 , e3234 (2008).
PubMed PubMed Central Google Scholar
Хамфрис, Дж. Д. и др. Винкулин контролирует формирование очаговой адгезии путем прямого взаимодействия с талином и актином. J. Cell Biol. 179 , 1043–1057 (2007).
CAS PubMed PubMed Central Google Scholar
Sawada, Y. et al. Определение силы путем механического удлинения субстрата киназы семейства Src p130Cas. Cell 127 , 1015–26 (2006).
CAS PubMed PubMed Central Google Scholar
del Rio, A. et al. Растяжение одиночных молекул палочек талина активирует связывание винкулина. Наука 323 , 638–641 (2009).
CAS PubMed PubMed Central Google Scholar
Фридланд, Дж. К., Ли, М. Х. и Боеттигер, Д. Механически активируемый переключатель интегрина контролирует функцию α5β1. Наука 323 , 642–644 (2009).
CAS PubMed PubMed Central Google Scholar
Цзян, Г., Джанноне, Г., Кричли, Д. Р., Фукумото, Э. и Шитц, М. П. Двухпиконьютонная скользящая связь между фибронектином и цитоскелетом зависит от талина. Nature 424 , 334–337 (2003).
CAS PubMed PubMed Central Google Scholar
Zhong, C. et al. Rho-опосредованная сократимость обнажает скрытый участок в фибронектине и индуцирует сборку фибронектинового матрикса. J. Cell Biol. 141 , 539–551 (1998).
CAS PubMed PubMed Central Google Scholar
Schwaiger, I., Sattler, C., Hostetter, D. R., Rief, M. Спиральная спираль миозина — это действительно эластичная белковая структура. Nature Mater. 1 , 232–235 (2002).
CAS Google Scholar
Schneider, I.C, Hays, C.K. и Waterman, C.M. Сокращение, вызванное эпидермальным фактором роста, регулирует фосфорилирование паксиллина, чтобы временно отделить возникновение тракции от деадгезии. Мол. Биол. Ячейка 20 , 3155-3167 (2009).
Йошиги, М., Хоффман, Л. М., Дженсен, К. К., Йост, Х. Дж. И Беккерл, М. С. Механическая сила мобилизует зиксин из очаговых адгезий к актиновым филаментам и регулирует усиление цитоскелета. J. Cell Biol. 171 , 209–215 (2005).
CAS PubMed PubMed Central Google Scholar
Ван, Х. Б., Дембо, М., Hanks, S.K. & Wang, Y. Киназа фокальной адгезии участвует в механочувствительности во время миграции фибробластов. Proc. Natl Acad. Sci. США 98 , 11295–11300 (2001).
CAS Google Scholar
Гэлбрейт, К. Г., Ямада, К. М. и Шитц, М. П. Взаимосвязь между силой и развитием фокального комплекса. J. Cell Biol. 159 , 695–705 (2002).
CAS PubMed PubMed Central Google Scholar
Чен, К.С. Механотрансдукция — сближающее поле? J. Cell Sci. 121 , 3285–3292 (2008).
CAS Google Scholar
Бенинго, К. А., Дембо, М., Каверина, И., Смолл, Дж. В. и Ван, Ю. Л. Возникающие фокальные спайки ответственны за создание сильных движущих сил в мигрирующих фибробластах. J. Cell Biol. 153 , 881–888 (2001).
CAS PubMed PubMed Central Google Scholar
Бенинго, К.A., Hamao, K., Dembo, M., Wang, Y. L. & Hosoya, H. Сила тяги фибробластов регулируется Rho-зависимой киназой, но не киназой легкой цепи миозина. Arch. Biochem. Биофиз. 456 , 224–231 (2006).
CAS PubMed PubMed Central Google Scholar
Парсонс, Дж. Т. Киназа фокальной адгезии: первые десять лет. J. Cell Sci. 116 , 1409–1416 (2003).
CAS PubMed PubMed Central Google Scholar
Дикин, Н. О. и Тернер, К. Э. Паксиллин достигает совершеннолетия. J. Cell Sci. 121 , 2435–2444 (2008).
CAS PubMed PubMed Central Google Scholar
Mitra, S. K. & Schlaepfer, D. D. Интегрин-регулируемая передача сигналов FAK – Src в нормальных и раковых клетках. Curr.Opin. Cell Biol. 18 , 516–523 (2006).
CAS PubMed PubMed Central Google Scholar
Гейгер, Б., Шпатц, Дж. П. и Бершадский, А. Д. Зондирование окружающей среды через очаговые спайки. Nature Rev. Mol. Cell Biol. 10 , 21–33 (2009).
CAS Google Scholar
Висенте-Мансанарес, М., Чой, К.К. и Хорвиц, А. Р. Интегрины в миграции клеток — актиновая связь. J. Cell Sci. 122 , 199–206 (2009).
CAS Google Scholar
Ballestrem, C. et al. Молекулярное картирование тирозин-фосфорилированных белков в фокальных адгезиях с использованием флуоресцентного резонансного переноса энергии. J. Cell Sci. 119 , 866–875 (2006).
CAS PubMed PubMed Central Google Scholar
Смит, А.и другие. Талин-зависимая фокальная зона LFA-1 образована быстро мигрирующими Т-лимфоцитами. J. Cell Biol. 170 , 141–151 (2005).
CAS PubMed PubMed Central Google Scholar
Верховский А.Б., Свиткина Т.М., Бориси Г.Г. Самополяризация и направленная подвижность цитоплазмы. Curr. Биол. 9 , 11–20 (1999).
CAS PubMed PubMed Central Google Scholar
Ям, П.T. et al. Реорганизация актин-миозиновой сети нарушает симметрию в задней части клетки, чтобы спонтанно инициировать поляризованную подвижность клеток. J. Cell Biol. 178 , 1207–1221 (2007).
CAS PubMed PubMed Central Google Scholar
Мсека, Т., Бамбург, Дж. Р. и Крамер, Л. П. Белки семейства ADF / кофилин контролируют образование ориентированных пучков актиновых филаментов в теле клетки, чтобы вызвать поляризацию фибробластов. J. Cell Sci. 120 , 4332–4344 (2007).
CAS PubMed PubMed Central Google Scholar
Xu, J. et al. Дивергентные сигналы и ансамбли цитоскелета регулируют полярность самоорганизации нейтрофилов. Cell 114 , 201–214 (2003).
CAS PubMed Google Scholar
Ридли, А. Дж. И др.Миграция клеток: интеграция сигналов спереди назад. Наука 302 , 1704–1709 (2003).
CAS PubMed Google Scholar
Эдди, Р. Дж., Пиерини, Л. М., Мацумура, Ф. и Максфилд, Ф. Р. Ca 2+ -зависимая активация миозина II необходима для ретракции уропода во время миграции нейтрофилов. J. Cell Sci. 113 , 1287–1298 (2000).
CAS PubMed PubMed Central Google Scholar
Колега, Дж.Асимметрия в распределении свободного миозина II по сравнению с цитоскелетным миозином II в локомотирующих микрокапиллярных эндотелиальных клетках. Exp. Cell Res. 231 , 66–82 (1997).
CAS PubMed PubMed Central Google Scholar
Chrzanowska-Wodnicka, M. & Burridge, K. Ро-стимулированная сократимость стимулирует образование стрессовых волокон и фокальных спаек. J. Cell Biol. 133 , 1403–1415 (1996). Включает NM II при втягивании задней кромки.
CAS PubMed PubMed Central Google Scholar
Worthylake, R.A., Lemoine, S., Watson, J.M. & Burridge, K. RhoA необходим для ретракции хвоста моноцитов во время трансэндотелиальной миграции. J. Cell Biol. 154 , 147–160 (2001).
CAS PubMed PubMed Central Google Scholar
Etienne-Manneville, S.И Холл, А. Интегрин-опосредованная активация Cdc42 контролирует клеточную полярность в мигрирующих астроцитах через PKCζ. Cell 106 , 489–498 (2001).
CAS PubMed PubMed Central Google Scholar
Gomes, E. R., Jani, S. & Gundersen, G. G. Движение ядер, регулируемое Cdc42, MRCK, потоком миозина и актина, устанавливает поляризацию MTOC в мигрирующих клетках. Cell 121 , 451–463 (2005). Демонстрирует роль NM II в репозиции ядра во время миграции клеток.
CAS PubMed PubMed Central Google Scholar
Lo, C. M. et al. Немышечный миозин IIb участвует в управлении миграцией фибробластов. Мол. Биол. Ячейка 15 , 982–989 (2004).
CAS PubMed PubMed Central Google Scholar
Уоррен Д.Т., Чжан, К., Вайсберг, П. Л. и Шанахан, К. М. Несприн: внутриклеточные каркасы, которые поддерживают архитектуру клетки и координируют клеточную функцию? Expert Rev. Mol. Med. 7 , 1–15 (2005).
PubMed PubMed Central Google Scholar
Nery, F.C. et al. TorsinA связывает KASH-домен неспринов и участвует в связывании ядерной оболочки и цитоскелета. J. Cell Sci. 121 , 3476–3486 (2008).
CAS PubMed PubMed Central Google Scholar
Shewan, A. M. et al. Миозин 2 является ключевой мишенью Rho-киназы, необходимой для локальной концентрации E-кадгерина в межклеточных контактах. Мол. Биол. Ячейка 16 , 4531–4542 (2005).
CAS PubMed PubMed Central Google Scholar
Иванов А.И. и др. Уникальная роль немышечной тяжелой цепи IIA миозина в регуляции эпителиальных апикальных соединений. PLoS ONE 2 , e658 (2007).
PubMed PubMed Central Google Scholar
Ямада, С. и Нельсон, У. Дж. Локализованные зоны активности Rho и Rac управляют инициацией и увеличением адгезии эпителиальных клеток к клеткам. J. Cell Biol. 178 , 517–527 (2007).
CAS PubMed PubMed Central Google Scholar
Кармона-Фонтен, К.и другие. Контактное ингибирование локомоции in vivo контролирует направленную миграцию нервного гребня. Nature 456 , 957–961 (2008).
CAS PubMed PubMed Central Google Scholar
Ilani, T., Vasiliver-Shamis, G., Vardhana, S., Bretscher, A. & Dustin, M. L. Передача сигналов рецептора Т-клеточного антигена и иммунологическая стабильность синапсов требуют миозина IIA. Nature Immunol. 10 , 531–539 (2009).
CAS Google Scholar
Янг П. Э., Ричман А. М., Кетчум А. С. и Кихарт Д. П. Морфогенез у Drosophila требует немышечной функции тяжелой цепи миозина. Genes Dev. 7 , 29–41 (1993).
CAS PubMed Google Scholar
Karess, R.E. et al. Регуляторная легкая цепь немышечного миозина кодируется spaghetti-squash , геном, необходимым для цитокинеза у Drosophila . Cell 65 , 1177–1189 (1991).
CAS PubMed PubMed Central Google Scholar
Winter, C.G. et al. Drosophila Rho-ассоциированная киназа (Drok) связывает опосредованную Frizzled передачу сигналов плоской клеточной полярности с актиновым цитоскелетом. Cell 105 , 81–91 (2001).
CAS PubMed PubMed Central Google Scholar
Скоглунд, П., Rolo, A., Chen, X., Gumbiner, B.M. & Keller, R. Для конвергенции и расширения при гаструляции требуется миозин IIB-зависимая кортикальная актиновая сеть. Разработка 135 , 2435–2444 (2008).
CAS PubMed PubMed Central Google Scholar
Броду, В. и Казанова, Дж. RhoGAP crossveinless-c связывает передачу сигналов без трахеи и EGFR с ремоделированием формы клеток в инвагинации трахеи Drosophila . Genes Dev. 20 , 1817–1828 (2006).
CAS PubMed PubMed Central Google Scholar
Мят, М. М. Изготовление трубок в эмбрионе Drosophila . Dev. Дин. 232 , 617–632 (2005).
CAS PubMed PubMed Central Google Scholar
Барретт, К., Лептин, М. и Сеттлман, Дж.Rho GTPase и предполагаемый RhoGEF опосредуют сигнальный путь для изменений формы клеток в гаструляции Drosophila . Cell 91 , 905–915 (1997).
CAS PubMed PubMed Central Google Scholar
Пилот, Ф. и Лекит, Т. Компартментарный морфогенез в эпителии: от формы клетки к форме ткани. Dev. Дин. 232 , 685–694 (2005).
CAS PubMed PubMed Central Google Scholar
Роло, А., Skoglund, P. & Keller, R. Морфогенетические движения, управляющие закрытием нервной трубки у Xenopus , требуют миозина IIB. Dev. Биол. 327 , 327–338 (2009).
CAS PubMed PubMed Central Google Scholar
Hildebrand, J. D. & Soriano, P. Shroom, актин-связывающий белок, содержащий PDZ-домен, необходим для морфогенеза нервной трубки у мышей. Cell 99 , 485–497 (1999).
CAS PubMed PubMed Central Google Scholar
Бертет, К., Сулак, Л. и Лекит, Т. Миозин-зависимое ремоделирование соединений контролирует интеркаляцию планарных клеток и удлинение оси. Nature 429 , 667–671 (2004).
CAS Google Scholar
Ямамото, Н., Окано, Т., Ма, X., Адельштейн, Р. С., Келли, М. В.Миозин II регулирует расширение, рост и формирование паттерна в протоке улитки млекопитающих. Разработка 136 , 1977–1986 (2009).
CAS PubMed PubMed Central Google Scholar
Corrigall, D., Walther, R.F., Rodriguez, L., Fichelson, P. & Pichaud, F. Передача сигналов Hedgehog является основным индуктором управляемой миозином-II клеточной агрессии в эпителии Drosophila . Dev. Ячейка 13 , 730–742 (2007).
CAS PubMed PubMed Central Google Scholar
Meshel, A. S., Wei, Q., Adelstein, R. S. & Sheetz, M. P. Основной механизм трехмерного транспорта коллагеновых волокон фибробластами. Nature Cell Biol. 7 , 157–164 (2005).
CAS PubMed PubMed Central Google Scholar
Чжан, К., Магнуссон, М.K. & Mosher, D. F. Лизофосфатидная кислота и агенты, дестабилизирующие микротрубочки, стимулируют сборку фибронектинового матрикса посредством Rho-зависимого образования актиновых стрессовых волокон и сокращения клеток. Мол. Биол. Ячейка 8 , 1415–1425 (1997).
CAS PubMed PubMed Central Google Scholar
Дзамба, Б. Дж., Якаб, К. Р., Марсден, М., Шварц, М. А. и Дезимон, Д. В. Кадгериновая адгезия, натяжение ткани и неканоническая передача сигналов Wnt регулируют организацию фибронектинового матрикса. Dev. Ячейка 16 , 421–432 (2009).
CAS PubMed PubMed Central Google Scholar
Конти, М. А., Эвен-Рам, С., Лю, К., Ямада, К. М. и Адельштейн, Р. С. Дефекты адгезии клеток и висцеральной энтодермы после удаления немышечной тяжелой цепи II-A миозина у мышей. J. Biol. Chem. 279 , 41263–41266 (2004).
CAS PubMed PubMed Central Google Scholar
Туллио, А.N. et al. Немышечный миозин II-B необходим для нормального развития сердца мыши. Proc. Natl Acad. Sci. США 94 , 12407–12412 (1997).
CAS PubMed PubMed Central Google Scholar
Tullio, A. N. et al. Структурные нарушения развиваются в головном мозге после удаления гена, кодирующего тяжелую цепь немышечного миозина II-B. J. Comp. Neurol. 433 , 62–74 (2001).
CAS PubMed PubMed Central Google Scholar
Берт Р. А., Джозеф Дж. Э., Милликен С., Коллиндж Дж. Э. и Кайл Б. Т. Описание новой мутации, приводящей к заболеванию, связанному с MYH9 . Тромб. Res. 122 , 861–863 (2008).
CAS PubMed PubMed Central Google Scholar
Каноббио, И.и другие. Измененная организация цитоскелета в тромбоцитах пациентов с заболеванием, связанным с MYH9 . J. Thromb. Гемост. 3 , 1026–1035 (2005).
CAS PubMed PubMed Central Google Scholar
Джонсон, Дж. Дж., Лейс, Л. А., Крумвиде, М. Д. и Уайт, Дж. Г. Критическая роль миозина IIA во внутреннем сокращении тромбоцитов. J. Thromb. Гемост. 5 , 1516–1529 (2007).
CAS PubMed PubMed Central Google Scholar
Calaminus, S. D. et al. Сократимость MyosinIIa необходима для поддержания структуры тромбоцитов во время распространения по коллагену и способствует стабильности тромба. J. Thromb. Гемост. 5 , 2136–2145 (2007).
CAS PubMed PubMed Central Google Scholar
Ху, А., Wang, F. & Sellers, J. R. Мутации немышечного миозина IIA человека, обнаруженные у пациентов с аномалией Мэй-Хегглина и синдромом Фехтнера, приводят к нарушению ферментативной функции. J. Biol. Chem. 277 , 46512–46517 (2002).
CAS PubMed PubMed Central Google Scholar
Kunishima, S., Hamaguchi, M. & Saito, H. Дифференциальная экспрессия полипептидов NMMHC-IIA дикого типа и мутантных полипептидов NMMHC-IIA в клетках крови предполагает клеточно-специфические механизмы регуляции при нарушениях MYH9 . Кровь 111 , 3015–3023 (2008).
CAS PubMed PubMed Central Google Scholar
Pecci, A. et al. Патогенетические механизмы гематологических нарушений у пациентов с мутациями MYH9 . Гум. Мол. Genet. 14 , 3169–3178 (2005). Это исследование анализирует 11 пациентов из 6 семей с 6 различными мутациями NM IIA и предоставляет доказательства того, что дефекты мегакариоцитарного клона возникают из-за гаплонедостаточности NM IIA, тогда как тельца включения в гранулоцитах возникают из-за мутантной формы NM IIA, мешающей форма дикого типа.
CAS PubMed PubMed Central Google Scholar
Леон, К. и др. Ограниченная мегакариоцитами инактивация MYH9 резко влияет на гемостаз, сохраняя при этом агрегацию и секрецию тромбоцитов. Кровь 110 , 3183–3191 (2007).
CAS PubMed PubMed Central Google Scholar
Экли, А.и другие. Аномальная морфология мегакариоцитов и образование протромбоцитов у мышей с ограниченной мегакариоцитами инактивацией MYH9 . Кровь 113 , 3182–3189 (2008).
PubMed PubMed Central Google Scholar
Ma, X., Kawamoto, S., Hara, Y. & Adelstein, R. S. Точечная мутация в двигательном домене немышечного миозина II-B нарушает миграцию отдельных групп нейронов. Мол.Биол. Ячейка 15 , 2568–2579 (2004).
CAS PubMed PubMed Central Google Scholar
Кантрелл, Дж. Р., Халлер, Дж. А. и Рэвич, М. М. Синдром врожденных дефектов брюшной стенки, грудины, диафрагмы, перикарда и сердца. Surg. Гинеколь. Акушерство. 107 , 602–614 (1958).
CAS PubMed PubMed Central Google Scholar
млн лет назад, X., Bao, J. & Adelstein, R. S. Потеря клеточной адгезии вызывает гидроцефалию у мышей, подвергшихся абляции немышечного миозина II-B и мутировавших. Мол. Биол. Ячейка 18 , 2305–2312 (2007).
CAS PubMed PubMed Central Google Scholar
Donaudy, F. et al. Немышечный ген тяжелой цепи миозина MYh24 экспрессируется в улитке и мутирует у пациентов с аутосомно-доминантным нарушением слуха (DFNA4). Am. J. Hum. Genet. 74 , 770–776 (2004).
CAS PubMed PubMed Central Google Scholar
Yang, T. et al. Генетическая гетерогенность фенотипов глухоты, связанных с DFNA4. Am. J. Med. Genet. A 139 , 9–12 (2005).
PubMed PubMed Central Google Scholar
Мясник, Д. Т., Аллистон, Т.& Уивер, В. М. Напряженная ситуация: форсирование прогрессирования опухоли. Nature Rev. Cancer 9 , 108–122 (2009).
CAS PubMed PubMed Central Google Scholar
Медейрос, Н. А., Бернетт, Д. Т. и Форшер, П. Функции миозина II в обороте актиновых пучков в конусах роста нейронов. Nature Cell Biol. 8 , 215–226 (2006).
CAS Google Scholar
Миядзима, Ю.& Kunishima, S. Идентификация первой из мутаций cis в расстройстве MYH9 . Eur. J. Haematol. 82 , 288–291 (2009).
CAS PubMed PubMed Central Google Scholar
Miyazaki, K., Kunishima, S., Fujii, W. и Higashihara, M. Идентификация трех делеционных мутаций в рамке считывания при расстройствах MYH9 , что указывает на важную горячую точку для небольших перестроек в экзоне MYH9 24. Eur. J. Haematol. 83 , 230–234 (2009).
CAS PubMed PubMed Central Google Scholar
De Rocco, D. et al. Идентификация первой дупликации в заболевании, связанном с MYH9 : горячая точка горячего неравного кроссинговера в экзоне 24 гена MYH9 . Eur. J. Med. Genet. 52 , 191–194 (2009).
PubMed PubMed Central Google Scholar
Каприя, М.и другие. Двойная нуклеотидная мутация гена MYH9 у молодого пациента с терминальной стадией почечной недостаточности. Циферблатный трансплантат нефрола 19 , 249–251 (2004).
CAS PubMed PubMed Central Google Scholar
Что такое фокальные спайки? | MBInfo
Фокальные адгезии представляют собой содержащие интегрин, мультибелковые структуры, которые образуют механические связи между внутриклеточными пучками актина и внеклеточным матриксом или субстратом во многих типах клеток [1].Формирование и функция фокальных спаек могут быть описаны с помощью определенных шагов, которые включают в себя инициацию , кластеризацию, рост, созревание и разборку . Они обычно находятся на вентральной поверхности клеток в двумерной культуре ткани и могут рассматриваться как ножки клетки [2], которые функционируют как интерактивные информационные интерфейсы между клетками и их средой.
Исследования показывают, что новые адгезии образуются на переднем крае мигрирующих клеток, увеличиваются в размерах и созревают по мере того, как клетки перемещаются по ним [3].Во время миграции и распространения клеток, фокальные адгезии служат в качестве удерживающих точек, которые подавляют сокращение мембраны и способствуют выпячиванию на переднем крае (rev. [4]). В стационарных ячейках они служат в качестве якорных устройств, поддерживающих морфологию клеток.
Идентификатор видео YouTube: 75ntMVPtP3Y не найдено.
Фокальные адгезии (FA) — это высокодинамичные структуры, которые растут или сжимаются из-за оборота составляющих их белков (обычно известных как «белки зубного налета») в ответ на изменение механических нагрузок (например.грамм. силы, генерируемые актомиозином, внешние силы, действующие через окружающую матрицу или через нее) [5] [6] [7] [8]. В то время как адгезии возникают на периферии клетки, они, по-видимому, перемещаются внутрь относительно центра клетки, когда клетка перемещается по нему [9]. Однако конструкции как таковые в значительной степени неподвижны относительно нижележащей подложки, но для скольжения и медленного изменения положения при разборке и переворачивании соответственно. Их рост коррелирует с относительным перемещением, в то время как состав и организация зависят от изменений в их микроокружении, как показано как in vitro [10] и in vivo [11].В отличие от подосом, ЖК после созревания являются долгоживущими.
Подробно обсуждаются различные стадии жизненного цикла очаговой адгезии и соответствующие морфологические изменения, зависящие от силы. Некоторые компоненты подвергаются обороту, так что ранние зарождающиеся адгезии демонстрируют высокую скорость обновления, а зрелые адгезии демонстрируют повышенную стабильность.
Фокальные сращения постоянно обнаруживаются на концах стрессовых волокон и, следовательно, сильно интегрированы с основной массой цитоскелета.Следовательно, фокальные спайки служат для передачи силы, генерируемой изнутри цитоскелетной сетью, в ECM и наоборот через рецепторы адгезии [12]. Сборка и созревание адгезии в значительной степени зависят от наличия силы, которая, как полагают, вызывает структурные перестройки, которые, в свою очередь, способствуют привлечению дополнительных белков (росту) и вызывают сигнальные каскады, ведущие к полимеризации (усилению) актина (см. Обзор [13]). .
Полимеризация актина и сократительная способность актомиозина генерируют силы, которые воздействуют на механочувствительные белки в связывающем актиновом модуле, модуле рецептора (например,грамм. интегрины), сигнальный модуль и модуль полимеризации актина [14] [15]. Это ведет к сборке и модификации актомиозиновых стрессовых волокон [16] [17], что в конечном итоге приводит к глобальным ответам, таким как направленное движение, рост клеток, дифференцировка и выживание [18] [19] [20] [21] [22]. Таким образом, FA можно в целом описать как механосенсорные машины, которые способны интегрировать несколько пространственно-временных сигналов, преобразовывая и распространяя эти сигналы по множеству путей (см. Обзор [23]), которые влияют на критический процесс принятия решений на клеточном уровне [18] [19 ] [20] [21] [22].
Фокусные адгезии также наблюдались в физиологически значимых сценариях, например, в эндотелиальных клетках на жесткой базальной мембране кровеносных сосудов, динамика которых модулируется сдвигозависимыми изменениями матрикса [24] [25] [26] и у эмбрионов Drosophila . , где FAs обеспечивают развитие, зависящее от поверхностной жесткости (см. обзор [27] [28]). Однако из-за проблем, связанных с визуализацией динамики FA в 3-х измерениях [29] [30], они менее хорошо документированы даже при исследовании с использованием in vitro исследований .Из имеющихся данных известно, что ТВС в 3-х измерениях, как правило, намного меньше и динамичны [30] [31] [32] [33], в то время как вытянутые также видны [33]. Будущие исследования в этом контексте выявят потенциальные клеточные фенотипы, опосредованные адгезией, и их роль в физиологических процессах.
Кардиостимулятор клеточного цикла поддерживает адгезию в ногу с делением | Журнал клеточной биологии
Прилипшие клетки собираются перед делением, но неясно, как отслоение регулируется клеточным циклом.В этом выпуске Jones et al. (2018. J. Cell Biol. https://doi.org/10.1083/jcb.201802088) обнаружили, что киназа CDK1 поддерживает адгезию во время интерфазы за счет фосфорилирования интегриновых адгезомных белков, включая формин FMNL2, и потери этой функции CDK1. активность в G2 вызывает разборку адгезии.
Актомиозиновый цитоскелет используется клетками для различных процессов, требующих механической силы, таких как миграция и деление. Каждый процесс управляется особой структурой актомиозина.Хотя основной сократительный механизм является общим для всех структур актомиозина, каждый имеет уникальное подмножество дополнительных белков, которые определяют его внутреннюю организацию и связывают его с другими клеточными структурами, такими как плазматическая мембрана, ядро или участки клеточной адгезии (Зайдель-Бар и др., 2015). Как конкретные актомиозиновые сети собираются или разбираются в нужное время и в нужном месте, является областью интенсивных исследований. Множественные актомиозиновые структуры могут сосуществовать в клетке одновременно. Однако некоторые организации цитоскелета несовместимы с другими.В этом выпуске Jones et al. обращаются к неподходящей комбинации базальных актомиозиновых стресс-волокон с корковой организацией, необходимой для митоза.
Давно наблюдалось, что адгезивные клетки разбирают свои базальные стрессовые волокна и большую часть адгезионных комплексов клеточного матрикса, прежде чем они собираются в складку для подготовки к делению клетки. Округление клеток важно для освобождения места для митотического веретена и для правильного выравнивания веретена (Luxenburg et al., 2011). Не позволяя клеткам разбирать свои матриксные адгезии, клетки препятствуют округлению и приводят к серьезным дефектам цитокинеза и многоядерным клеткам. Почему необходима разборка адгезий клеточного матрикса и стрессовых волокон? Прежде всего, сильная адгезия клеточного матрикса физически препятствует отслоению клеточной мембраны, необходимому для округления клетки. Во-вторых, белковые компоненты стрессовых волокон могут потребоваться в коре головного мозга для повышения ее сократимости. Наконец, важно, чтобы митотическая кора начиналась как изотропная или однородная сеть, по которой сигналы, исходящие от веретена, будут управлять сборкой цитокинетического кольца.
Jones et al. (2018) исследовали размер и распределение адгезионных комплексов клеточного матрикса и актинового цитоскелета в синхронизированных клетках HeLa и U2OS. Они обнаружили небольшие периферические адгезии и периферический актин в фазе G1, большие спайки и массивные стрессовые волокна по всей клетке в фазе S, а затем возврат к небольшим периферическим адгезиям и актину в фазе G2 в ожидании фазы M. Эти наблюдения согласуются с недавними измерениями силы тяги, выполненными на клетках RPE1, экспрессирующих репортер клеточного цикла, показывающими высокую энергию механической тяги в S-фазе и низкую энергию тяги в G2 (Vianay et al., 2018).
Тогда возникает вопрос, что регулирует разборку адгезионных комплексов и стрессовых волокон во время G2 и как эта разборка координируется с развитием клеточного цикла? На основании своих предыдущих масс-спектрометрических исследований Jones et al. (2018) был кандидат в регулятор: CDK1, циклин-зависимая серин / треониновая киназа, которая в комплексе с циклинами является основным двигателем клеточного цикла. Фосфопротеомика показала, что многие белки комплекса адгезии интегрина являются потенциальными субстратами CDK1, а ингибирование CDK1 привело к потере актиновых стрессовых волокон и существованию только небольших адгезий на периферии клеток, напоминающих фенотип клеток в G2 (Robertson et al., 2015). В текущем исследовании Jones et al. (2018) продолжили, чтобы показать, что циклин A2 является циклином, работающим с CDK1, чтобы способствовать большим комплексам адгезии интегрина и стрессовым волокнам, и они использовали более точную протеомику для идентификации субстратов CDK1 в интерфазных клетках. Среди 26 идентифицированных субстратов было несколько нетрадиционных регуляторов миозина и актина, включая WDR1, PLS3, WASF2 и FMNL2.
Jones et al. (2018) исследовали формин FMNL2, нуклеатор актина и фактор, способствующий удлинению, продемонстрировав как in vitro, так и в клетках, что он фосфорилируется CDK1 по остатку серина 1016.Важно отметить, что фосфомиметик FMNL2-S1016E может частично восстанавливать фенотип клеточной адгезии в клетках с нокдауном CDK1, демонстрируя, что фосфорилирование FMNL2 способствует образованию центральных комплексов адгезии и стрессовых волокон ниже CDK1, но что CDK1 имеет другие мишени во время S-фазы. Интересно, что уровни фосфорилирования FMNL2 не увеличиваются во время фазы S, но они снижаются в G2. Т.о., оказывается, что активность cyclin A2-CDK1 конститутивно необходима для центральных спаек и стрессовых волокон, чтобы появляться и оставаться во время S фазы, а их разборка в G2 является результатом инактивации CDK1.CDK1, как хорошо известно, инактивируется в G2 с помощью Wee1-зависимого фосфорилирования как часть контрольной точки G2 / M (обзор в Hégarat et al., 2016). Однако Джонс и др. (2018) обнаружили, что увеличение экспрессии циклина B1 в G2 важно для инактивации CDK1, поскольку РНКи циклина B1 предотвращает разборку адгезии в G2, как и ингибирование Wee1. Остается неясным, как циклин B1 регулирует активность Wee1 в отношении CDK1.
Недавнее исследование сил, проявляемых эпителиальными клетками в монослое на протяжении клеточного цикла, показало, что за 3 часа до митоза, во время фазы G2, клетки меньше воздействуют на своих соседей, предположительно за счет модуляции их межклеточных соединений (Uroz et al., 2018). Стоит изучить, играет ли инактивация CDK1 также роль в понижающем регулировании напряжения в межклеточных соединениях. Следует отметить, что как формин FMNL2, так и его паралог FMNL3, как было показано, вносят вклад в полимеризацию актина и стабильность адгезивных соединений (Grikscheit et al., 2015; Rao and Zaidel-Bar, 2016).
Наконец, следует отметить, что хотя классические адгезионные комплексы интегринов разбираются во время G2, недавно было сообщено, что сами интегрины остаются на месте.Эти контакты интегрина без бляшек соединяют митотические клетки с нижележащим матриксом на протяжении митоза и направляют повторное распространение дочерних клеток (Dix et al., 2018). Будет интересно проверить, отличается ли вызванная CDK1 разборка сайтов адгезии от разборки, которая происходит, например, на заднем крае мигрирующих клеток, и выяснить, как клетки уравновешивают потерю большинства компонентов своего комплекса адгезии с сохранение достаточной адгезии для сохранения знаний о микро-окружающей среде.
Возвращаясь к вопросу о том, как определенные структуры актомиозина собираются и разбираются в определенные моменты времени и в определенных местах внутри клетки и как эта регуляция координируется с клеточным циклом, мы должны признать, что клетка предложила очень элегантное решение: клеточный цикл.








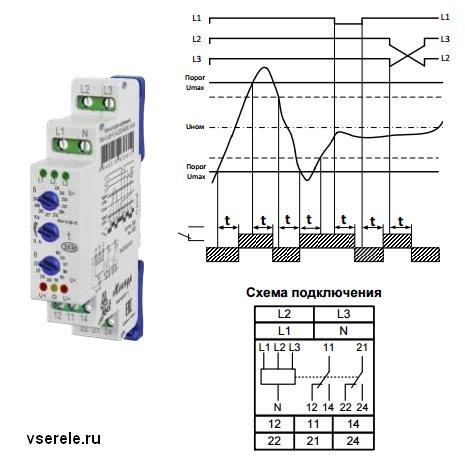 Имеет ряд модификаций, отличающихся регулировками порогов срабатывания и техническими параметрами.
Имеет ряд модификаций, отличающихся регулировками порогов срабатывания и техническими параметрами.