Предмет электрохимии.
ЭЛЕКТРОХИМИЯ
(24 час. лекций и 16 час. решения задач)
Лекция 40
Предмет электрохимии. Проводники первого и второго рода. Законы Фарадея.
Теория электролитической диссоциации Аррениуса. Закон разбавления Оствальда. Причины диссоциации.
Электрохимия является разделом физической химии, в котором изучаются законы взаимосвязи химических и электрических явлений. Основным предметом электрохимии являются процессы, протекающие на электродах при прохождении тока через растворы, электродные процессы. Можно выделить два основных раздела электрохимии : термодинамику электродных процессов, охватывающую равновесные состояния систем электрод — раствор, и кинетику электродных процессов
Электрохимия имеет очень большое значение, т.к. закономерности электрохимии являются теоретической основой для разработки важных технических процессов электролиза и электросинтеза, т.е. получения химических продуктов на электродах при прохождении тока через растворы (получение хлора и щелочей, получение и очистка цветных и редких металлов, электросинтез органических соединений). Важной областью практического применения электролиза является гальванотехника электропокрытие металлами. Другая важная область техники, в основе которой лежат электрохимические процессы, это создание химических источников тока (гальванических элементов, в том числе аккумуляторов), в которых химическая реакция используется как источник электрического тока.
Большое развитие получили электрохимические методы химического анализа (электроанализ, кондуктометрия, потенциометрия, полярография и др.).
Возникновение электрохимии как науки связано с именами Гальвани, Вольта и Петрова, которые на рубеже XVIII и XIX в. открыли и исследовали электрохимические (гальванические) элементы. Деви и Фарадей в первой половине XIX в. изучали электролиз. Быстрое развитие электрохимии в конце XIX в. связано с появлением теории электролитической диссоциации Аррениуса (1887) и с работами Нернста по термодинамике электродных процессов. Теория Аррениуса развита Дебаем и Гюккелем (1923), которые разработали электростатическую теорию.
Для последних десятилетий характерно быстрое развитие электрохимической кинетики, изучение явлений перенапряжения, коррозии, гальванических покрытий и др.
Проводники первого и второго рода.
Твердые и жидкие проводники, прохождение через которые электрического тока не вызывает переноса вещества в виде ионов, называются проводниками первого рода. Электрический ток в проводниках первого рода осуществляется потоком электронов (электронная проводимость
Вещества, прохождение через которые электрического тока вызывает передвижение вещества в виде ионов (ионная проводимость) и химические превращения в местах входа и выхода тока (электрохимические реакции), называются проводниками второго рода. Типичными проводниками второго рода являются растворы солей, кислот и оснований в воде и некоторых других растворителях, расплавленные соли и некоторые твёрдые соли. Как правило, в проводниках второго рода электричество переносится положительными (катионы) и отрицательными (анионы) ионами, однако некоторые твёрдые соли характеризуются
Деление проводников в зависимости от типа проводимости (электронная или ионная) является условным. Известны твёрдые вещества со смешанной проводимостью, например Ag2S, ZnO, Cu2O и др. В некоторых солях при нагревании наблюдается переход от ионной проводимости к смешанной (CuCl).
Проводники второго рода называются электролитами. Это могут быть чистые вещества или растворы. Часто электролитами называют вещества, растворы которых проводят электрический ток. Эти растворы называют растворами электролитов.
8. Проводники первого и второго рода. Физическая химия: конспект лекций
8. Проводники первого и второго рода
Проводники – вещества, проводящие электрический ток благодаря наличию в них большого количества зарядов, способных свободно перемещаться (в отличие от изоляторов). Они бывают I (первого) и II (второго) рода. Электропроводность проводников I рода не сопровождается химическими процессами, она обусловлена электронами. К проводникам I рода относятся: чистые металлы, т. е. металлы без примесей, сплавы, некоторые соли, оксиды и ряд органических веществ. На электродах, выполненных из проводников I рода, происходит процесс переноса катиона металла в раствор или из раствора на поверхность металла. К проводникам II рода относятся электролиты. В них прохождение тока связано с химическими процессами и обусловлено движением положительных и отрицательных ионов.
Электроды первого рода. В случае металлических электродов первого рода такими ионами будут катионы металла, а в случае металлоидных электродов первого рода – анионы металлоида. Серебряный электрод первого рода Ag+/Ag. Ему отвечает реакция Ag+ + e—= Ag и электродный потенциал
EAg+ /Ag = Ag+ / Ag+b0lg a Ag+.
После подстановки численных значений Е 0 и b0 при 25 oС:

Примером металлоидных электродов первого рода может служить селеновый электрод Se2–/Se, Se + 2e—= Se2; при 25 oС ESe2–/Se0 = –0,92 – 0,03lg a Se2–.
Электроды второго рода – полуэлементы, состоящие из металла, покрытого слоем труднорастворимого соединения (соли, оксида или гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить так:

Каломельные электроды – это ртуть, покрытая пастой из каломели, и ртуть, находящаяся в контакте с раствором KCl.
Cl– / Hg2Cl2, Hg.
Электродная реакция сводится к восстановлению каломели до металлической ртути и аниона хлора:

Потенциал каломельного электрода обратим по отношению к ионам хлора и определяется их активностью:

При 25 оС потенциал каломельного электрода находят по уравнению:

Ртутно-сульфатные электроды SO42–/Hg2SO4, Hg аналогичны каломельным с той лишь разницей, что ртуть здесь покрыта слоем пасты из Hg и закисного сульфата ртути, а в качестве раствора используется H2SO4. Потенциал ртутно-сульфатного электрода при 25

Хлорсеребряный электрод представляет собой систему Cl–/AgCl, Ag, а его потенциалу отвечает уравнение:
ECl– /AgCl, Ag = E0Cl–/AgCl, Ag –b lg aCl–
или при 25 оС:
ECl–/AgCl, Ag = 0,2224 – 0,0592 lg a Cl–.
Поделитесь на страничке1 Предмет электрохимии. Проводники первого и второго рода. Законы Фарадея
Лекция 1
Предмет электрохимии. Проводники первого и второго рода. Законы Фарадея.
Теория электролитической диссоциации Аррениуса. Закон разбавления Оствальда. Причины диссоциации.
ПРЕДМЕТ ЭЛЕКТРОХИМИИ.
Электрохимия является разделом физической химии, в котором изучаются законы взаимосвязи химических и электрических явлений. Основным предметом электрохимии являются процессы, протекающие на электродах при прохождении тока через растворы, — электродные процессы. Можно выделить два основных раздела электрохимии : термодинамику электродных процессов, охватывающую равновесные состояния систем электрод — раствор, и кинетику электродных процессов, изучающую законы протекания этих процессов во времени. Электрохимия изучает также теорию электролитов.
Электрохимия имеет очень большое значение, т.к. закономерности электрохимии являются теоретической основой для разработки важных технических процессов — электролиза и электросинтеза, т.е. получения химических продуктов на электродах при прохождении тока через растворы (получение хлора и щелочей, получение и очистка цветных и редких металлов, электросинтез органических соединений). Важной областью практического применения электролиза является гальванотехника — электропокрытие металлами. Другая важная область техники, в основе которой лежат электрохимические процессы, — это создание химических источников тока (гальванических элементов, в том числе аккумуляторов), в которых химическая реакция используется как источник электрического тока.
Большое развитие получили электрохимические методы химического анализа (электроанализ, кондуктометрия, потенциометрия, полярография и др.).
Возникновение электрохимии как науки связано с именами Гальвани, Вольта и Петрова, которые на рубеже XVIII и XIX в. открыли и исследовали электрохимические (гальванические) элементы. Деви и Фарадей в первой половине XIX в. изучали электролиз. Быстрое развитие электрохимии в конце XIX в. связано с появлением теории электролитической диссоциации Аррениуса (1887) и с работами Нернста по термодинамике электродных процессов. Теория Аррениуса развита Дебаем и Гюккелем (1923), которые разработали электростатическую теорию.
Для последних десятилетий характерно быстрое развитие электрохимической кинетики, изучение явлений перенапряжения, коррозии, гальванических покрытий и др.
ПРОВОДНИКИ ПЕРВОГО И ВТОРОГО РОДА.
Твердые и жидкие проводники, прохождение через которые электрического тока не вызывает переноса вещества в виде ионов, называются проводниками первого рода. Электрический ток в проводниках первого рода осуществляется потоком электронов (электронная проводимость). К таким проводникам относятся твёрдые и жидкие металлы и некоторые неметаллы (графит, сульфиды цинка и свинца).
Вещества, прохождение через которые электрического тока вызывает передвижение вещества в виде ионов (ионная проводимость) и химические превращения в местах входа и выхода тока (электрохимические реакции), называются проводниками второго рода. Типичными проводниками второго рода являются растворы солей, кислот и оснований в воде и некоторых других растворителях, расплавленные соли и некоторые твёрдые соли. Как правило, в проводниках второго рода электричество переносится положительными (катионы) и отрицательными (анионы) ионами, однако некоторые твёрдые соли характеризуются униполярной проводимостью, то есть переносчиками тока в них являются ионы только одного знака — катионы (например, в AgCl) или анионы (BaCl2, ZrO2+CaO, растворы щёлочных металлов в жидком аммиаке).
Деление проводников в зависимости от типа проводимости (электронная или ионная) является условным. Известны твёрдые вещества со смешанной проводимостью, например Ag2S, ZnO, Cu2O и др. В некоторых солях при нагревании наблюдается переход от ионной проводимости к смешанной (CuCl).
Проводники второго рода называются электролитами. Это могут быть чистые вещества или растворы. Часто электролитами называют вещества, растворы которых проводят электрический ток. Эти растворы называют растворами электролитов.
ЭЛЕКТРОХИМИЧЕСКИЕ РЕАКЦИИ.
Электрохимические реакции протекают на границе электрод (проводник первого рода) — электролит (проводник второго рода). Они вызваны невозможностью для электронов — носителей тока в электродах свободно двигаться в электролите. Эти реакции состоят в обмене электронами между электродом и ионами (молекулами) в растворе. На катоде электроны переходят от электрода к иону (или молекуле), на аноде — от иона (молекулы) к электроду, при этом ионы (молекулы) теряют или изменяют свой электрический заряд. Это — первичная электрохимическая реакция, продукты которой нередко вступают в дальнейшие реакции, не связанные непосредственно с переносом тока ионами. Примерами катодных реакций могут служить следующие реакции:
Cu2+ + 2e ® Cu (1)
Fe3+ + e ® Fe2+ (2)
2H3O+ + 2e ® H2(г) + 2H2O (3)
На аноде могут протекать реакции типа:
4OH— ® O2 + 2H2O + 4e (4)
Fe2+ ® Fe3+ + e (5)
2Cl— ® Cl2(г) + 2e (6)
Zn ® Zn2+ + 2e (7)
Материал электрода может участвовать в электрохимической реакции [реакция (7)], но может быть и инертным (остальные реакции). В последнем случае на поверхности электрода могут выделяться металлы [реакция (1)] или газы [реакции (3, 4, 6)]. Наконец, электрохимическая реакция может протекать и при отсутствии перехода ионов из раствора к электроду и обратно. В этих случаях перенос электричества осуществляют только электроны, но у поверхности электрода в растворе ионы изменяют свою валентность [реакции (2) и (5)]. Совокупность двух электрохимических реакций, из которых одна протекает на катоде, а другая — на аноде, даёт химическую реакцию электролиза или реакцию, протекающую в электрохимическом элементе :
Cu2+ + 2Cl— ® Cu(т) + Cl2 (1) + (6)
2H3O+ + 2OH— ® 1/2 O2 + H2 + 3H2O (3) + 1/2 (4)
или H2O ® 1/2 O2 + H2
ЗАКОНЫ ЭЛЕКТРОЛИЗА (ЗАКОНЫ ФАРАДЕЯ).
Поскольку прохождение электрического тока через электрохимические системы связано с химическими превращениями, между количеством протекающего электричества и количеством прореагировавших веществ должна существовать определенная зависимость. Она была открыта Фарадеем и получила свое выражение в первых количественных законах электрохимии, названных впоследствии законами Фарадея.
Первый закон Фарадея. Количества веществ, превращённых при электролизе, пропорциональны количеству электричества, прошедшего через электролит.
Dm = kэIt = kэq
Dm – количество прореагировавшего вещества; kэ – некоторый коэффициент пропорциональности; q – количество электричества, равное произведению силы тока I на время t. Если q = It = 1, то Dm = kэ , т.е. коэффициент kэ представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества. Коэффициент kэ называется электрохимическим эквивалентом.
Второй закон Фарадея отражает связь, существующую между количеством прореагировавшего вещества и его природой : при постоянном количестве прошедшего электричества массы различных веществ, испытывающие превращение у электродов (выделение из раствора, изменение валентности), пропорциональны химическим эквивалентам этих веществ :
Dmi /Ai = const
Можно объединить оба закона Фарадея в виде одного общего закона : для выделения или превращения с помощью тока 1 г-экв любого вещества (1/z моля вещества) необходимо всегда одно и то же количество электричества, называемое числом Фарадея (или фарадеем).
Dm = 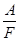 It =
It = 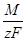 It
It
Точно измеренное значение числа Фарадея
F = 96484,52 ± 0,038 к / г-экв
Таков заряд, несомый одним грамм-эквивалентом ионов любого вида. Умножив это число на z (число элементарных зарядов иона), получим количество электричества, которое несёт 1 г-ион. Разделив число Фарадея на число Авогадро, получим заряд одного одновалентного иона, равный заряду электрона:
e = 96484,52 / (6,022035×1023) = 1,6021913×10-19 к
Законы , открытые Фарадеем в 1833 г., строго выполняются для проводников второго рода. Наблюдаемые отклонения от законов Фарадея являются кажущимися. Они часто связаны с наличием неучтённых параллельных электрохимических реакций. Отклонения от закона Фарадея в промышленных установках связаны с утечками тока, потерями вещества при разбрызгивании раствора и т.д.
В технических установках отношение количества продукта, полученного при электролизе, к количеству, вычисленному на основе закона Фарадея, меньше единицы и называется выходом по току.
При тщательных лабораторных измерениях для однозначно протекающих электрохимических реакций выход по току равен единице (в пределах ошибок опыта). Закон Фарадея точно соблюдается, поэтому он лежит в основе самого точного метода измерения количества электричества, прошедшего через цепь, по количеству выделенного на электроде вещества. Для таких измерений используют серебряный или медный, а также йодный и газовый кулонометры (кулонометрия).
Теория электролитов
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ АРРЕНИУСА. Для электролитов понижение температуры замерзания и осмотическое давление значительно больше соответствующих величин для неэлектролитов. В уравнение для осмотического давления p Вант-Гофф ввел эмпирический коэффициент i > 1, физический смысл которого стал понятен с появлением теории электролитической диссоциации :
p = icRT
Теория электролитической диссоциации была предложена Аррениусом (1884-1887), развившим отдельные высказывания ряда ученых.
Основные положения теории Аррениуса :
Соли, кислоты, основания при растворении в воде и некоторых других полярных растворителях частично или полностью распадаются (диссоциируют) на ионы. Эти ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, а величины коллигативных свойств растворов возрастают прямо пропорционально числу частиц.
Наряду с процессом диссоциации в растворе идет обратный процесс — ассоциация ионов в молекулы. В качестве меры электролитической диссоциации Аррениус ввел величину степени диссоциации a, определяемую как долю молекул, распавшихся на ионы :
a =  =
= 
Для любой обратимой реакции электролитической диссоциации :
Кn+Аn— Û n+Кz+ + n—Az—
сумма n+ + n— равна общему числу n ионов, образующихся при диссоциации одной молекулы, которое равно коэффициенту Вант-Гоффа i :
 i = 1 + (n+ + n— — 1)×a = 1 + (n — 1)×a
i = 1 + (n+ + n— — 1)×a = 1 + (n — 1)×a
Определив коэффициент i, можно по этому уравнению вычислить степень диссоциации a, если известна величина n.
По мере увеличения разведения коэффициент Вант-Гоффа приближается к простому целому числу (2, 3, 4 — в зависимости от числа ионов, образующихся из одной молекулы вещества).
Диссоциация растворенных веществ на ионы подчиняется тем же законам химического равновесия, что и др. реакции :
Кд = 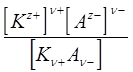
где Кд — константа диссоциации, выраженная через концентрации.
Диссоциация сильных электролитов равна 100% или почти 100%, так что концентрации ионов можно считать равными молярности растворенного вещества, умноженной на z. При диссоциации слабого электролита устанавливается равновесие между недиссоциированными молекулами и ионами. Рассмотрим простейший пример, когда молекула распадается только на два иона :
СН3СООН Û СН3СОО— + Н+
с — aс aс aс
Кд = 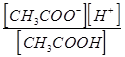 =
= 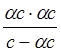 ; Кс =
; Кс = 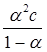
Последнее равенство является простейшей формой закона разведения Оствальда (1888). Чем больше Кс, тем выше степень диссоциации. Т.о., величина Кс может служить мерой силы кислоты, т.е. мерой кислотности. Для электролитов средней силы (Н3РО4 — первая ступень, Са(ОН)2, СНСl2СООН) значения Кс лежат в пределах от 10-2 до 10-4; для слабых электролитов (СН3СООН, NН4ОН) Кс = 10-5 — 10-9; при Кс < 10-10 электролит считается очень слабым (Н2О, С6Н5ОН, С6Н5NН2, НСN).
Если a очень мала, то ее величиной можно пренебречь по сравнению с 1, и формула примет вид :
Кс = a2с ; a = 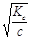
Если электролит распадается больше чем на два иона, то зависимость Кс от a усложняется :
СаCl2 Û Ca2+ + 2Cl—
с (1- a) aс 2aс
Кс = 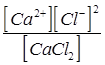 =
=  =
= 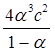
При малой a : a = 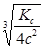
Величина Кс является постоянной только для очень разбавленных растворов, коэффициенты активности которых можно считать равными 1. Вообще же Кс (как и a) зависит от концентрации раствора; Кс иногда еще называют классической константой диссоциации.
Кс (a) зависит также от температуры : зависимость Кс слабых кислот в воде проходит через максимум. Это можно объяснить влиянием двух противоположно направленных воздействий. С одной ст., всякая диссоциация протекает с поглощением тепла, и, следовательно, при повышении Т равновесие должно смещаться в сторону большей диссоциации. С др. ст., при повышении Т диэлектрическая проницаемость воды, служащей растворителем, уменьшается, а это способствует воссоединению ионов. Кс максимальна при той Т, при которой влияние второго фактора начинает преобладать. Обычно изменение Кд с повышением Т невелико.
ПРИЧИНЫ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ.
Твердые вещества, при растворении которых в воде и других полярных растворителях образуются электролиты, являются, как правило, кристаллическими телами, имеющими ионные или близкие к ионным решётки. В чисто ионных решётках не существует молекул вещества. Ионы противоположных знаков, составляющие такую решётку, связаны между собой большими электростатическими силами. При переходе ионов в раствор энергии электростатического взаимодействия ионов в решётке противопоставляется энергия взаимодействия ионов с дипольными молекулами растворителя, который втягивает ионы решётки в раствор. При этом ионы окружаются молекулами растворителя, образующими вокруг иона сольватную (в частном случае — гидратную) оболочку. Энергия взаимодействия ионов различных знаков, перешедших в раствор и окружённых сольватными оболочками, уменьшается по сравнению с энергией их взаимодействия в решётке обратно пропорционально диэлектрической проницаемости растворителя D в соответствии с законом Кулона :
E = — 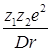
где z1 и z2 — число элементарных зарядов катиона и аниона; r — расстояние между катионом и анионом.
Если энергия взаимодействия ионов с растворителем становится соизмеримой с энергией ионов в кристаллической решётке, то происходит растворение с диссоциацией.
Надо помнить при этом, что при растворении должен уменьшиться изобарный потенциал G системы, а внутренняя энергия (и энтальпия) может как уменьшаться, так и увеличиваться (отрицательная и положительная теплоты растворения).
Взаимодействие дипольных молекул растворителя с элементами кристаллической решётки может привести к образованию электролита даже при растворении веществ, имеющих молекулярную решётку, решётку промежуточного типа или находящихся в газообразном состоянии (атомы в молекулах газа связаны ковалентно).
Ясно, что для осуществления электролитической диссоциации определяющую роль играет взаимодействие ионов с растворителем (в водных растворах — гидратация, в общем случае — сольватация). На важное значение гидратации ионов впервые указали И.А.Каблуков и В.А.Кистяковский. Они положили начало развитию теории электролитов в направлении, которое указывал Д.И.Менделеев, то есть объединили так называемую сольватную теорию и физическую теорию Вант-Гоффа — Аррениуса.
Связь между диэлектрической проницаемостью D растворителя и его способностью образовывать растворы, проводящие электрический ток, отмечалась давно. Вода, диэлектрическая проницаемость которой D = 81 при 18°C, а также HCN (D=107 при 25°C) и HCOOH (D=57 при 25°С) принадлежат к растворителям, вызывающим сильную диссоциацию. Низшие спирты и кетоны, уксусная кислота, пиридин имеют диэлектрические проницаемости в пределах 20-35 и также способны образовывать электролиты, хотя и в меньшей степени, чем вода.
Кроме величины диэлектрической проницаемости важное значение имеет взаимодействие молекул растворителя с молекулами растворённого вещества. Это взаимодействие нередко приводит к образованию новых молекул или молекулярных комплексов, которые в данном растворителе способны диссоциировать на ионы.
8. Проводники первого и второго рода
Электроды первого рода. В случае металлических электродов первого рода такими ионами будут катионы металла, а в случае металлоидных электродов первого рода – анионы металлоида. Серебряный электрод первого рода Ag+/Ag. Ему отвечает реакция Ag+ + e— = Ag и электродный потенциал
EAg+ /Ag = Ag+ / Ag+b0lg a Ag+.
После подстановки численных значений Е 0 и b0 при 25 oС:

Примером металлоидных электродов первого рода может служить селеновый электрод Se2–/Se, Se + 2e— = Se2; при 25 oС ESe2–/Se0 = –0,92 – 0,03lg a Se2–.
Электроды второго рода – полуэлементы, состоящие из металла, покрытого слоем труднорастворимого соединения (соли, оксида или гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить так: АZ–/MA, M, а протекающую в нем реакцию – МА + ze = М + АZ–. Отсюда уравнением для электродного потенциала будет:

Каломельные электроды – это ртуть, покрытая пастой из каломели, и ртуть, находящаяся в контакте с раствором KCl.
Cl– / Hg2Cl2, Hg.
Электродная реакция сводится к восстановлению каломели до металлической ртути и аниона хлора:

Потенциал каломельного электрода обратим по отношению к ионам хлора и определяется их активностью:

При 25 оС потенциал каломельного электрода находят по уравнению:
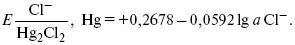
Ртутно-сульфатные электроды SO42–/Hg2SO4, Hg аналогичны каломельным с той лишь разницей, что ртуть здесь покрыта слоем пасты из Hg и закисного сульфата ртути, а в качестве раствора используется H2SO4. Потенциал ртутно-сульфатного электрода при 25 oС выражается уравнением:
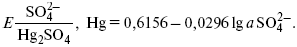
Хлорсеребряный электрод представляет собой систему Cl–/AgCl, Ag, а его потенциалу отвечает уравнение:
ECl– /AgCl, Ag = E0Cl–/AgCl, Ag –b lg aCl–
или при 25 оС:
ECl–/AgCl, Ag = 0,2224 – 0,0592 lg a Cl–.
9. Электроды сравнения
Электроды сравнения – электроды, используемые при измерении электродных потенциалов в паре с используемым электродом. Электродный потенциал – скачок потенциала на границе металл-раствор. Он определяется: природой металла, раствора, концентрацией, температурой. Для сравнения электродных потенциалов нужны стандартные условия: t = 25 °С = 298 К; Р – 1 атм, одномолярный раствор. Абсолютное значение электродного потенциала измерить нельзя. Поэтому измеряют разность потенциалов между данным электродом и электродом сравнения, потенциал которого принимают равным нулю. Часто используют водородный электрод, изготовленный из губчатой платины с сильно развитой поверхностью (платиновая чернь), опускают в раствор H2SO4 – серной кислоты с активностью ионов водорода, равной единице. При этом через раствор пропускается газообразный водород под давлением, который затем адсорбируется платиной. Относительно потенциала водородного электрода все металлы располагают в ряд напряжений, установленный электрически Н. Н. Бекетовым, взаимному вытеснению металлов в зависимости от величины и знака стандартного электродного потенциала. Существуют и другие электроды сравнения: каломельный, хлорсеребряный и другие, в зависимости от различных методов. Конструктивное оформление электрода сравнения разнообразно. Например, для полярографического метода электроды сравнения должны иметь большую поверхность во избежание поляризации их при работе под током.
ЛЕКЦИЯ № 13. Электрохимическая кинетика
Проводники первого рода — Справочник химика 21
Различают две основные группы проводников электрического тока проводники первого рода, электрическая проводимость которых обусловлена электронами, и проводники второго рода, обладающие ионной проводимостью. В особую группу входят полупроводники, прохождение тока через которые обеспечивают, с одной стороны, возбужденные электроны, а с другой — так называемые дырки — вакантные места на энергетических уровнях, которые покинуты возбужденными электронами. Главную роль в электрохимии играют ионные проводники — растворы и расплавы электролитов, некоторые вещества в твердом состоянии, ионизированные газы. При протекании постоянного электрического тока через электрохимические системы на электродах возникают электрохимические реакции, которые подчиняются двум законам Фарадея [c.455]Проводники первого рода [c.423]
Рассмотрим цепь, составленную так, что в начале и конце ее находится один и тот же проводник (Рис. XIX, 16). Такая цепь называется правильно разомкнутой. О правильно разомкнутой цепи, состоящей из двух проводников, говорить не имеет смысла, ибо э.д.с. (Е = А1В—В]А) всегда равна нулю. Если же правильно разомкнутая цепь состоит из трех и более проводников, то по отношению к э.д.с. следует различать цепи, состоящие только из проводников первого рода, и цепи, в которые входят также проводники второго рода. [c.520]
Сдвоенные химические цепи. В сдвоенных химических цепях две простые химические цепи, отличающиеся лишь активностью электролита, имеют один общий электрод и, таким образом, электрически соединены через проводник первого рода в единую цепь. Так, например, простые цепи с хлорсеребряным и водородным электродами можно превратить в сдвоенную цепь с общим водородным электродом [c.204]
В зависимости от природы переносчиков электрических зарядов проводники электрического тока подразделяются на проводники первого рода и проводники второго рода. К первым относятся материалы, обладающие электронной проводимостью. Таковы металлы, графит, плазма и полупроводники. К проводникам второго рода относятся материалы, обладающие ионной проводимостью. Таковы расплавы и растворы электролитов. [c.259]
Кроме напряжения при электролизе нужно учитывать силу тока в цепи. По закону Ома в проводниках первого рода сила тока (/) прямо пропорциональна приложенному напряжению ( ) и обратно пропорциональна сопротивлению (Н). В случае растворов электролитов (в проводниках второго рода) следует принимать во внимание возникновение э. д. с. поляризации, которая противодействует прохождению тока, и потому при вычислении силы тока должна вычитаться из величины приложенного напряжения. [c.436]
Электрический ток в проводниках первого рода осуществляется потоком электронов электронная проводимость). К таким проводникам относятся твердые и жидкие металлы и некоторые неметаллы (графит, сульфиды цинка и свинца). [c.384]
Электропроводность металлов в твердом и в расплавленном состоянии обусловливается тем, что между их частицами осуществляется металлическая связь за счет свободно перемещающихся электронов электронного газа проводники первого рода). [c.162]
К проводникам первого рода относят металлы, в которых электрический ток обусловлен электронной проводимостью [c.35]
Твердые и жидкие проводники, прохождение через которые электрического тока не вызывает переноса вещества в виде ионов, называются проводниками первого рода. [c.384]
Чаще всего электроды состоят из проводника первого рода (металл, уголь) и проводника второго рода (раствор или расплав электролита). Потенциалопределяющие (электродные) процессы представляют собой окислительно-восстановительные реакции, которые можно записать в общем виде [c.466]
Прохождение электрического тока через проводники первого рода не сопровождается переносом вещества в виде ионов. Примером могут служить металлы и полупроводники. Растворы электролитов являются проводниками второго рода. Прохождение через них электрического тока вызывает передвижение вещества в виде ионов и его химические превращения. Ток к проводникам второго рода подводится через проводники первого рода. При прохождении постоянного тока в местах, где изменяется механизм переноса электричества, ионы электролита разряжаются, а нейтральные атомы приобретают заряд. Это электродные процессы. Они подчиняются двум законам, сформулированным М. Фарадеем (1834 г.) [c.180]
Важнейшей количественной характеристикой электрохимического элемента или цепи элементов является электродвижущая сила (э. я. с., обозначаемая в дальнейшем через Е), которая равна разности потенциалов правильно разомкнутого элемента, т. е. разности потенциалов между концами проводников первого рода из одного и того же материала, присоединенных к конечным электродам элемента (цепи). Знак э.д.с. совпадает со знаком суммарной разности потенциалов цепи или противоположен ему, в зависимости от принятой системы знаков. [c.518]
Почему для измерения электрической проводимости растворов необходимо пользоваться приборами, работающими на переменном токе, а для измерения электрической проводимости проводников первого рода допустимо использовать любые приборы (работающие как на постоянном, так и на переменном токе) [c.206]
Для проводников первого рода имеем [c.520]
Необходимым условием равенства нулю э.д.с. цепи проводников первого рода является равенство температур всех кон-таков между различными проводниками. При несоблюдении этого условия возникают термоэлектродвижущие силы, здесь 10 рассматриваемые. [c.521]
Что касается гальвани-потенциалов между различными проводниками первого рода (металлами), то их устранить нельзя. [c.543]
Введение. Проводники электрического тока делятся на электронные, или проводники первого рода, и ионные, или проводники второго рода. [c.380]
К электрическим методам защиты относится также так называемый эле/сгрофенаж, применяемый для борьбы с разрушающим действием блуждающих токов на подземные металлические сооружения. Сущность электродренажа заключается в том, что после нахождения на подземном металлоизделии анодных зон, опасны
Проводники первого рода — Энциклопедия по машиностроению XXL
Проводник первого рода — проводник с электронной электропроводностью. [c.117]Электродами называются проводники первого рода (металлы, уголь), находящиеся в электролите, на которых происходят химические процессы. [c.15]
В простейшей электрохимической системе имеются два электрода и ионный проводник между ними (внутренняя цепь). Электроды замыкаются металлическим проводником (проводником первого рода). Ионным проводником (проводником второго рода) служат растворы или расплавы электролитов. Электродами называются металлические проводники, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Металлический проводник, замыкающий электроды с источником или потребителем электрической энергии, представляет собой внешнюю цепь электрохимической системы. Взаимодействие внутренней и внешней цепей системы обеспечивает ее работу. [c.407]
Электроды. В связи с тем что в разрабатываемых сегодня ТЭ и восстановитель, и окислитель в подавляющем большинстве случаев газообразны, электроды должны обеспечивать трехфазную зону (проводник первого рода — газовый реагент — ионный проводник), в которой реализуется реакция (9.12 а) или (9.12 б). Часто в качестве электродов в ТЭ используются пористые никелевые или угольные (графитовые) электроды. [c.529]
Электродами называются проводники первого рода, поенные в электролит и снабженные проводниками для отвода тока во внешнюю цепь. Для проводников первого рода характерно прохождение тока без переноса вещества в отличие от проводников второго рода. Положительный электрод гальванического элемента называется катодом, а отрицательный анодом. Отрицательно заряженные частицы-—ионы, движущиеся к аноду, называются анионами, а положительно заряженные ионы (катионы) движутся к катоду. [c.17]
Проводники электрического тока делятся на электронные — проводники первого рода, и ионные— проводники второго рода. К первым относятся металлы. Их электропроводность объясняется движением электронов от одного атома к другому. [c.145]
Прохождение тока через проводники второго рода часто сопровождается химическими процессами, которые объединяются общим названием электролиз. Прохождение тока через раствор само по себе не вызывает каких-либо химических превращений, но обычно ток подводится к раствору (электролиту) при помощи проводников первого рода (электродов) и в тех местах, где меняется механизм передачи тока, т. е. на границе электрод — раствор происходят химические превращения. Таким образом, химические превращения происходят на поверхности электродов. [c.145]
Более активный металл обогащает раствор положительно заряженными гидратированными ионами, а сам заряжается отрицательно. Вследствие этого электроны переходят от него к менее активному металлу, где они и ассимилируются, восстанавливая положительно заряженные ионы (катионы). Таким образом, при работе гальванического элемента по металлу — проводнику первого рода— передвигаются электроны, а в растворе электролита — проводнике второго рода—перемещаются ионы. [c.122]
Процесс электролиза. Существует два рода проводников электрического тока. В процессе проникновения электрического тока через проводники первого рода в веществе самого проводника не происходит никаких химических изменений. К таким проводникам относятся металлы, уголь и некоторые другие вещества. К проводникам второго рода относятся кислоты, щелочи, соли и другие химические соединения как в виде водных растворов, так и в расплавленном состоянии. Проводники второго рода, или электролиты, в процессе прохождения через них постоянного электрического тока в местах его ввода и вывода претерпевают существенные изменения. [c.8]
Механизм протекания тока по металлам в твердом и жидком состояниях обусловлен движением свободных электронов, вследствие чего их называют проводниками с электронной проводимостью, или проводниками первого рода. [c.243]
Механизм протекания тока по металлам в твердом и жидком состояниях обусловлен движением свободных электронов, вследствие чего их называют проводниками с электронной проводимостью, или проводниками первого рода. Проводниками второго рода, или электролитами, являются растворы (в основном водные) кислот, щелочей и солей. Прохождение тока через эти проводники связано с переносом вместе с электрическими зарядами частей молекулы (ионов), вследствие чего состав электролита постепенно изменяется, а на электродах выделяются продукты электролиза. [c.260]
В электролитических конденсаторах только одна обкладка (анод) является проводником первого рода (металлом), второй обкладкой служит проводник второго рода (электролит). При анодном включении вентильного металла оксидная пленка в контакте с электролитом может восстанавливаться, поэтому слабые места и частичные нарущения диэлектрика не приводят к его прогрессивному разрушению и рабочая напряженность поля в оксиде может достигать 400—500 МВ/м, т. е. по крайней мере в десятки раз больше, чем в других типах диэлектриков (бумаге, керамике и пр.). Из-за потерь в электролите потери мощности в электролитических конденсаторах примерно на порядок выше, чем в бумажных конденсаторах. Наличие электролита определяет также существенную зависимость емкости и б конденсаторов от температуры и частоты. [c.383]
ПРОВОДНИКИ ПЕРВОГО РОДА -проводники электричества, прохождение тока через которые не связано с переносом вещества. К П. п. р. относятся все металлы. [c.117]
Проводники делятся также на две группы проводники первого рода и проводники второго рода. К проводникам первого рода относятся главным образом металлы, к проводникам вто- [c.144]
Металлы относятся к проводникам первого рода для них характерно прохождение тока, не сопровождающееся химическим изменением материала. В отличие от растворов электролитов электропроводность металлов не связана с переносом веществ и носит название электронной или металлической. [c.9]
Металлы относятся к проводникам первого рода для них характерно прохождение тока, не сопровождающееся химическим изменением материала. [c.6]
При прохождении через электролиты постоянного электрического тока происходит процесс электролиза, сопровождающийся изменением состава электролитов у электродов. В этом отличие электролитов, проводников второго рода, от металлических проводников, или проводников первого рода, не изменяющихся при прохождении тока. [c.7]
В этом соотношении величина является коэффициентом пропорциональности и называется проводимостью. Величина R называется сопротивлением, она зависит от , которое испытывают носители зарядов при движении в среде. Проводники, в которых ток обусловлен перемещением свободных электронов, называются проводниками первого рода. [c.106]
Напряжение Е на штангах ванны складывается из следующих величин а) падения напряжения на преодоление омического сопротивления электролита 2)6) алгебраической разности электродных потенциалов Е — и в) падения напряжений в контактах и проводниках первого рода Ео > т. е. [c.600]
Падение напряжений в контактах и проводниках первого рода складывается из следующих элементов 1) потерь напряжения по длине анодных и катодных штанг 2) потерь напряжения в самих электродах (анодах и катодах — изделиях) 3) потерь напряжения за счет преодоления переходного сопротивления в контактах. [c.601]
Наряду с необходимостью придания поверхностям деталей токопроводящих свойств с различным коэффициентом электропроводности часто возникает потребность решать обратную задачу — обеспечивать более или менее высокими диэлектрическими свойствами поверхности различных проводников первого рода. Последнее достигается нанесением на металлы полимерных или стеклоэмалевых покровных пленок, диэлектрические свойства которых определяются природой пленкообразователя и пигментов. [c.74]
Гальванический элемент — система, состоящая из-проводников первого (металлы) и второго (электролиты) рода, в которой происходит превращение химической энергии в электрическую. Если цинковый и медный, электроды поместить в растворы собственных солей одинаковой активности и соединить проводником, то по нему потечет электрический ток в результате следующих реакций [c.19]
Для получения интегрального уравнения первого рода для плотности электрического тока на поверхности идеального проводника будем считать, что вектор х принадлежит поверхности. Умножим соотношение (3.60) на вектор нормали в точке х и учтем граничное условие для идеального проводника, тогда получим [c.152]
ПРОВОДНИКИ ВТОРОГО РОДА -проводники электричества, прохождение тока через которые связано с переносом вещества. К П. в. р. относятся, в первую очередь, водные растворы солей, оснований, кислот (см. Электролиты). [c.117]
Однако из приведенных выше данных нельзя непосредственно установить, какому ряду они ближе соответствуют ряду нормальных электродных потенциалов [14] или ряду металлов по контактной разности потенциалов, поскольку последовательность расположения металлов в них в основном сохраняется одной и той же. Справедливость корреляции именно с рядом Вольта для контактной разности потенциалов подтверждается следующими соображениями. Ряд нормальных электродных потенциалов отвечает явлениям, происходящим на границе металл — электролит, т. е. между проводниками первого и второго рода. Но, как указывается в работах [1, 12, 15, 16], обычные среды в обычных условиях (вода, смазка, воздух) не оказывают существенного влияния на процесс фреттинг-коррозии. Это может служить прямым доказательством того, что в данном случае мы имеем дело с явлением, протекающим непосредственно на границе между двумя металлами, без какой-либо промежуточной электролитной среды. Такому явлению ближе всего должен соответствовать ряд Вольта для контактной разности потенциалов, а не ряд нормальных электродных потенциалов. [c.149]
В связи с тем что механизм электропроводности в металлах как в твердом, так и в жидком состоянии обусловлен направленным движением свободных электронов под воздействием электрического поля, их принято называть проводниками с электронной проводимостью или проводниками первого рода. В проводниках второго рода или электролитах, к которым относятся растворы, в том числе и водные, кислот, щелочей и солей, прохождение тока связано с переносом вместе с электрическими зарядами ионов вещества в соответствии с законами Фарадея. При этом состав электролита постепенно изменяется и на электродах выделяются продукты элек- Ион тролиза. Следует отметить, что ионные кристаллы в расплавлен-ном состоянии также являются проводниками второго рода. [c.113]
Механизм прохождения тока в металлах — как в твердом, так и в жидком состоянии — обусловлен движением (дрейфом) свободных электронов под воздействием электрического поля поэтому металлы называют проводниками с электронной электропроводностью или проводниками первого рода. Проводниками второго рода, или электролитами, являются растворы (в частности, водные) кислот, щелочей и солей. Прохождение тока через эти вещества связано с переносом вместе с электрическими зарядами ионов в соответствии с закона . и Фарадея, вследствие чего состав электролита постепенно изменяется, а на электродах выделяются продукты электролиза. Ионные кристаллы в расплавленном состоянии также являются проводниками второго рода. Пр1 мером. могут служить соляные закал .ч-ные ванны с злектронагревом. [c.187]
Если анод и катод ТЭ замкнутьг проводником первого рода, то по нему электроны движутся от анода к катоду и на своем пути совершают работу. Хотя процесс превращения химической энергии в электрическую происходит непосредственно в ТЭ, одного ТЭ недостаточно для непрерывного получения электрической энергии. Напряжение ТЭ обычно не превышает 1 В. Электрический ток одного элемента также невелик. Поэтому для увеличения напряжения или тока отдельные ТЭ соединяют в батарею. [c.530]
При помощи двух мостиков, из которых первый снаряжен зернами катионита и промыт дистиллированной водой, а второй снаряжен зернами анионита и также промыт дистиллированной водой, можно построить концентрационный элемент без участия проводников первого рода, замкнув попарно противоположные концы мостиков растворами электролита различной концентрации. При этом конец катионитового мостика, опущенный в разбавленный раствор электролита, оказывается заряженным положительно относительно другого своего конца, опущенного в более концентрированный раствор электролита. Наоборот, конец анионитового мостика, опущенный в разбавленный раствор электролита, оказывается заряженным отрицательно относительно другого своего конца, помещенного в более концентрированный раствор. Этого и следовало ожидать с точки зрения развитых выше представлений об ионной атмосфере ионитов, потому что в первом мостике ионная атмосфера составлена положительно заряженными катионами, а во втором — анионами, несущими отрицательные заряды, причем обе ионные атмосферы в описанной выше концентрационной цепи сильнее прижаты к твердой фазе ионитов в результате осмотического давления со стороны более концентрированного раствора электролита. Вследствие этого абсолютное значение их электростатических потенциалов с йтой стороны уменьшилось, а общее направление тока в цепи определилось превышением разности потенциалов между ионными атмосферами концов мостиков в разбавленном растворе над их разностью потенциалов (направленной в противоположную сторону) в более концентрированном растворе. Наличие тока и его направление легко зарегистрировать, включив последовательно гальванометр в любом [c.485]
Таким образом, механизм прохождения тока через твердые и жидкие металлы обусловлен дрейфом (направленным движением) свободных электронов под воздействием электрического поля, создаваемого в металле приложенным извне напряжением. Поэтому металлы называют проводниками с электронной (металлической) эжктропровод-ностью, иначе проводниками первого рода. [c.12]
По особым химическим и физическим свойствам элементы разделяются яа металлы и металлоиды. Наибольшее отличие между ними заключается в том, что н один металл за исключением незначительных отклонений не растворяется в нейтральных растворителях, кроме того, металлы являются проводниками первого рода, т. е. они проводят электрическую энергию, не разлагаясь сами. Их электропроводность увеличивается с понижением температуры. Кроме того, металлы имеют одноатомную структуру. Отличительным признаком является также их яМеталлический блеск. Удельная теплоемкость, помноженная на атомный вес, дает у большинства металлов постоянную, равную 6,4 (правило Д ю л о н г а-П т и). [c.973]
В атомных ядрах проводников первого рода некоторые электроны имепэт слабую связь с ядрами и поэтому отрываю тся от НИХ легко и оставляют атом. Такие электроны называются свободными. Свободные электроны постоянно перемещаются и находятся в беспорядочном движении внутри проводника. [c.145]
Ионы в электролите так же, как и электроны в проводниках первого рода, йаходятся в хаотическом движении. [c.145]
Носителями электрического тока в проводниках первого рода являются электроны, в проводниках втърого рода — ионы. При этом отрицательные ионы и электроны движутся к положительному полюсу источника тока, а положительно заряженные ионы — к отрицательному полюсу. Электрический ток может быть постоянным и переменным. [c.145]
Передача электрических зарядов может осуществляться с помощью электронов и, с помощью ионов. -В соответствии с этим различают электронную проводимость (первого рода) и ионную проводимость (второго рода). Все металлы относятся к проводникам первого рода. В про-аодниках этого рода перенесение зарядов е связано ни с каким заметным переносом вещества. Все электроны металлов одинаковы и поэтому их перемещение -не связано с изменением химического состава проводника. Масса электронов очень мала и при -самой большой практически возможной электризации нельзя заметить изменения ассы проводника из-за изменения количества электронов в ем. [c.10]
Механизм электропроводности имеет исключительно важное значение для понятия процессов коррозии. В отношении электропроводности все тела можно разделить на два характерных класса электронные проводники или проводники первого рода и ионные проводники или проводники второго рода. Прохождение тока в электронных проводниках, к которк.м принадлежат металлы, определяетсл движением электронов и не сопровождается ощутимым переносом материи наоборот, прохождение тока в ионных проводниках — электролитах или ионных кристаллах— сопровождается переносом вещества. При этом положительно заряженные катионы идут в одну сторону — к катоду, отрицательно заряженные анионы — в обратную, к аноду. [c.26]
Различие механизмов прохождения электрического тока через металлы и электролиты ведет к тохМу, что па границах электронного проводника (проводник первого рода) с электролитом (проводником второго рода) разряжается или, наоборот, образуется эквивалентное току количество ионов и, следовательно, выделяется или растворяется эквивалентпое тО Ку количество вещества. Это положение устанавливается законом Фарадея, по которому прохождение каждых 96 500 кулонов электричества влечет за собой выделение или (в зависимости от направления тока) растворение на электродах 1 грамм-эквивалента вещества. [c.28]
Если проводник находится в магнитном поле, то превращение его в сверхпроводящее состояние сопровождается тепловым эффектом и, следовательно, является фазовым переходом первого рода. В. Кеезом показал, что в этом случае переход определяется уравнением Клапейрона—Клаузиуса. При отсутствии магнитного поля теплота перехода равна нулю и превращение и в s является фазовым переходом второго рода. [c.239]
В якорях электродвигателей применена петлевая обмотка с уравнительными соединениями первого рода. Она состоит из 54 катущек и имеет изоляцию класса Р. Обмотка якоря имеет шаг по пазам 1—14, шаг по коллектору 1—2 (рис. 41,а). Катушка обмотки якоря состоит из четырех элементарных одновитковых секций. Каждая секция в свою очередь состоит из трех параллельных проводников, расположенных по высоте паза, а четыре витка, входящих в катушки, располагаются по ширине паза, т. е. осуществлена горизонтальная укладка. [c.55]
Различие механизмов прохождения электрического тока через ионные проводники и металлы ведет к тому, что на границах проводника второго рода с проводником первого пода (электродах) разряжается или, наоборот, образуется эквивалентное току количество ионов и, следовательно, выделяется или растворяется эквивалентное току количество вещества. Это положение устанавливается законом Фарадея, по которому прохождение каждых 96500 кулонов количества электричества в,лечет за собой выделение или (в зависимости от направления тока) растворение на электродах 1 грамм-эквивалента вещества. В переносе электричества участвуют все ионы раствора, в меру их подвижности и концентрации, однако на электродах в данных условиях могут выделяться далеко не все имеющиеся в растворе ионы. Ионы, не участвующие в электродном процессе, естественно, будут накапливаться в приэлектродном электролите (если нет заметной конвекции в растворе). [c.26]
проводники первого и второго рода.
Представление о электричестве люди имели уже давно. Впервые это явление было замечено еще учеными древней Греции, оно наблюдалось при натирании замшей янтарных предметов. Янтарь по-гречески называется электрон. Поэтому стали говорить об электрических явлениях., о появлении в телах, при натирании, электричества, или электрического заряда.
Исследованиями таких ученых как, М.Ломоносов, А.Попов, Ш.Кулон, А.Вольта, А.Ампер, Г.Ом, Г.Кирхгоф и многих других, появились законы, объясняющие электрические явления. Появились первые электрические приборы, источники и приемники электрической энергии, применяемые в промышленности. Образовались новые направления, области применения электричества: электротехника, радиотехника, электроника, электросвязь. Электричество прочно вошло и в наш дом.
Все вещества делятся на три основные группы: проводники, полупроводники и диэлектрики.
Проводники.Очень часто электроны (особенно те, которые слабо связаны с ядром атома) могут покинуть свою орбиту, перейти в междуатомное пространство. Tакие электроны называются свободными. Вещества, в междуатомном пространстве которых всегда есть свободные электроны, относятся к проводникам первого рода. и ток в проводнике создается свободными электронами. К ним относятся все металлы. На практике это провода, жилы кабелей, контакты реле, нити эл. ламп и т.д.
Растворы кислот, солей и щелочей (электролиты), относятся к проводникам второго рода. В электролите непрерывно образуются положительные и отрицательные ионы. Электрический ток в электролите создается не свободными электронами, а ионами.
Из школьного курса по физике электрический ток это: направленное движение электронов в проводнике или направленное движение ионов в электролите. Электрический ток существует в проводниках, полупроводниках, так же в газах, вакууме и др.
Полупроводники. В настоящее время широчайшее применение нашли полупроводники. В основном это кристаллы кремния и германия. В обычных условиях свободных электронов в этих веществах очень мало и они плохо проводят электрический ток.
Но при нагревании или под действием света, электрических или магнитных полей, радиоактивного излучения и других факторов количество свободных электронов в полупроводнике возрастает и он начинает проводить электрический ток. Это, так называемая, электронная или дырочная проводимость — характерный признак полупроводников.
На практике это полупроводниковые диоды, транзисторы, микросхемы и многое другое.
Диэлектрики. В обычных условиях в диэлектрике нет ни свободных электронов ни ионов, а значит и ток через них не проходит. На практике это такие вещества, как резина, стекло, слюда, фарфор и множество других.
Диэлектрики широко применяются в электротехнике в качестве изоляторов (прокладки, оплетки проводов и кабелей, каркасы электрических узлов и др.). Если к диэлектрику приложить очень высокое напряжение, может произойти электрический пробой и он превратится в проводник — потеряет свои диэлектрические свойства.
С пробоями в изоляции проводов, конденсаторов, прогары в прокладках между эл. шинами, пробой диодов и транзисторов и др. все довольно часто сталкивались.



