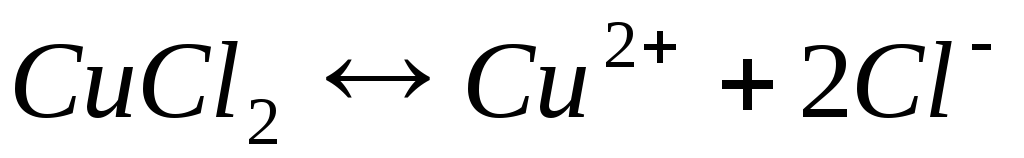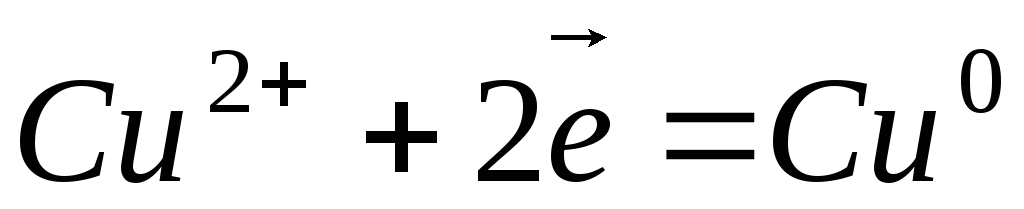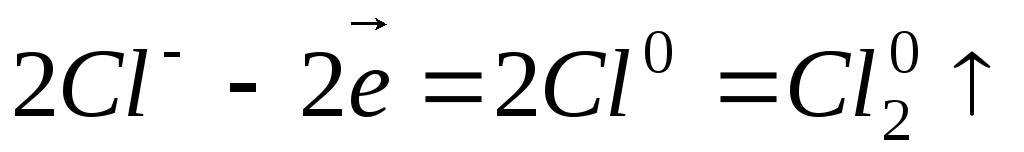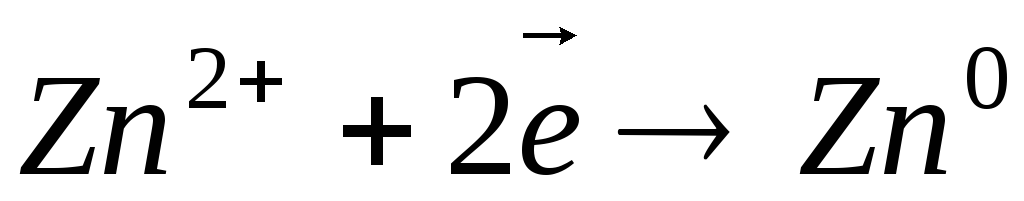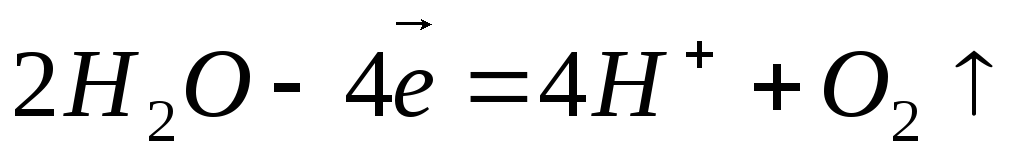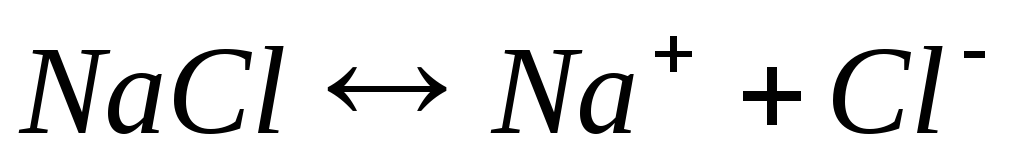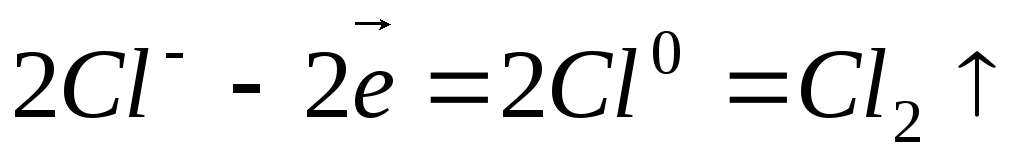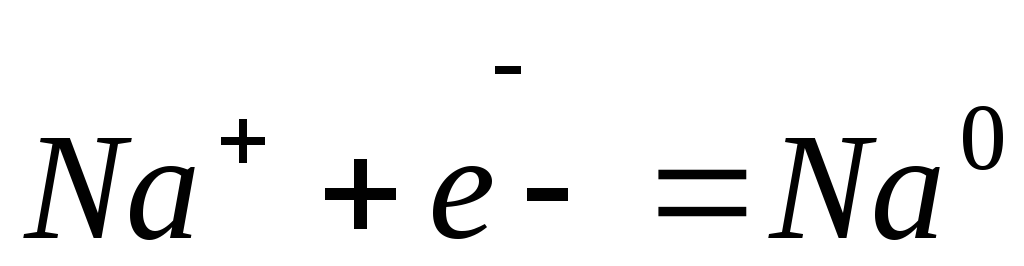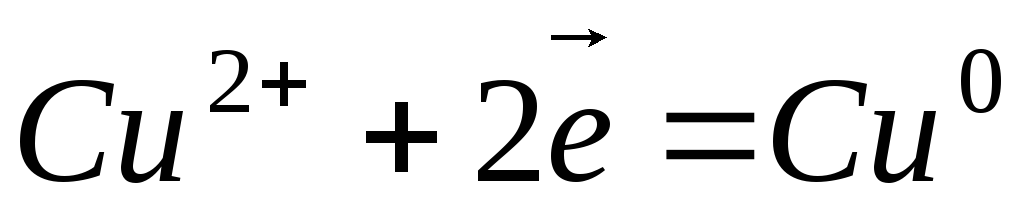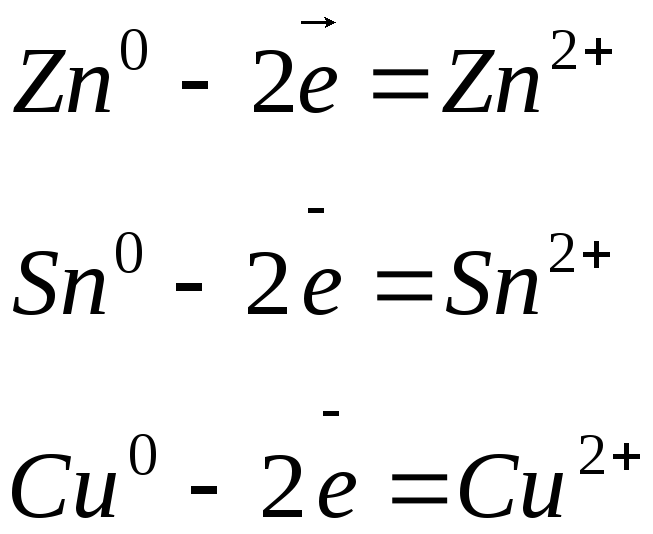Типовые примеры электролиза веществ
Пример 1.Электролиз расплава хлорида натрия на инертных электродах.
NaCl ⇄Na+ + Cl—.
Катод (-): Na+ + 1ē = Na.
Анод (+): 2Cl—— 2ē = Cl2↑.
Пример 2. Электролиз расплава гидроксида натрия на инертных электродах.
NaOH ⇄Na++ OH—.
Катод (-): Na++ 1 ē =Na.
Анод (+): 4OH—— 4 ē =O2↑ + 2H2O.
Пример 3.Электролиз раствора хлорида натрия на инертных электродах.
NaCl ⇄Na+ + Cl—.
Катод (-): 2H2O + 2ē = H2↑ + 2OH—.
Анод (+): 2Cl—— 2ē = Cl2↑.
В растворе остаются ионы натрия и гидрокид-ионы, т. е. при электролизе образуется гидроксид натрия.
Пример 4. Электролиз раствора сульфата натрия на инертных электродах.
Na2SO4 ⇄
2Na+ + SO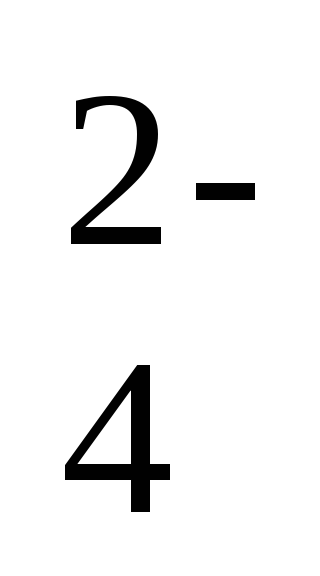 ..
..
Катод (-): 2H2O + 2ē = H2↑ + 2OH—.
Анод (+): 2H2O– 4ē =O2↑ + 4H+.
В этом случае электролизу подвергается вода.
Пример 5. Электролиз раствора сульфата меди на инертных электродах.
CuSO4 ⇄
Cu2+ + SO
Катод (-): Cu2+ + 2ē = Cu.
Анод (+): 2H2O– 4ē =O2↑ + 4H+.
Пример 6. Электролиз раствора сульфата меди с медными электродами.
CuSO4 ⇄
Cu2+ + SO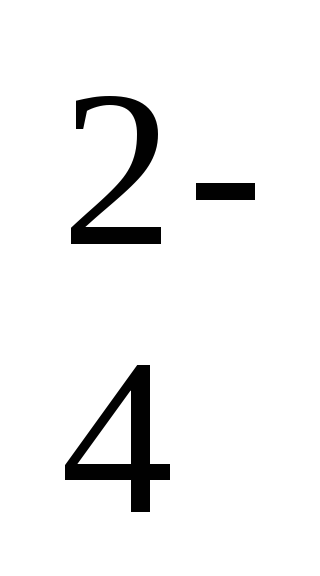 .
.
Катод (-): Cu2+ + 2ē = Cu.
Анод (+): Cu- 2ē =Cu2+.
Закон электролиза
Количество вещества, выделившееся на катоде и аноде, зависит от числа электронов, участвующих в окислительно-восстановительном процессе, т. е. от количества электричества, прошедшего через раствор или расплав электролита. Эта зависимость выражается законом Фарадея
массы веществ, выделившиеся на электродах, пропорциональны количеству прошедшего электричества через раствор или расплав электролита и химическому эквиваленту. При прохождении через раствор или расплав электролита 96500 Кл на электродах выделяется один моль эквивалентов вещества (постоянная Фарадея).
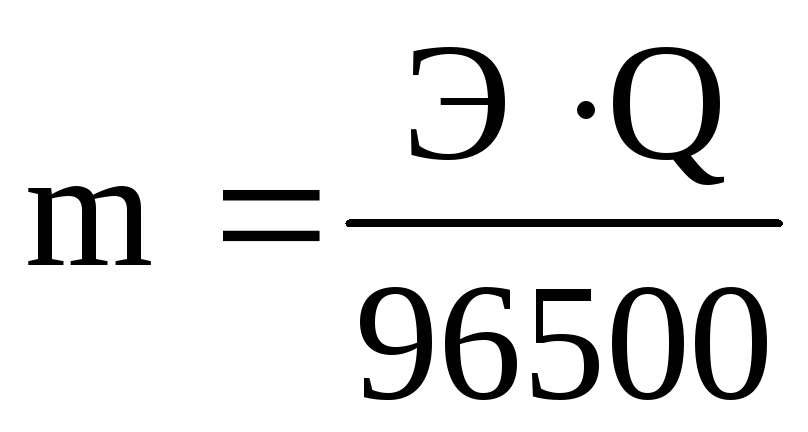 ,
,
где m – масса вещества, выделившегося на электроде, г;
Q– количество электричества, Кл;
Э – эквивалентная масса выделившегося вещества, г/моль-экв.
Так как Q=I·t,
где I– ток, А,t– время, с,
то уравнение закона Фарадея можно записать в следующем виде:
 .
.
Эквивалентная масса (Э) равна молярной массе вещества, деленной на количество принятых или отданных электронов.
Примеры решения типовых задач
Задача 1. Определить массу выделившейся меди при пропускании тока 10 А через раствор сульфата меди в течение 2 часов.
CuSO4⇄
Cu .
.
На катоде выделяется медь при восстановлении ионов Cu2+:
Cu2+ + 2 ē = Cu.
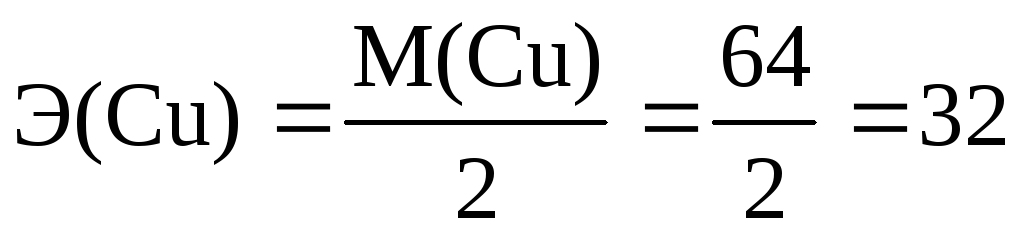 г/моль-экв,
г/моль-экв,
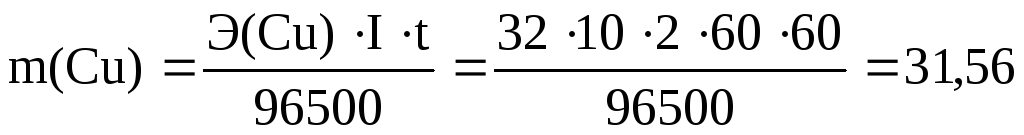 г.
г.
Задача 2. Сколько времени нужно пропускать ток силой 5 А, чтобы из раствора серной кислоты выделить 50 л водорода, измеренных при нормальных условиях?
H2SO4⇄ 2H+ +
SO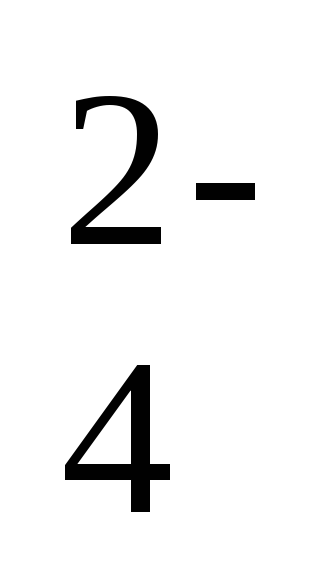
Количество моль-эквивалентов (ν )выделенного водорода ν = m:Э = V:Vэ.
Объемный эквивалент водорода VM:2 = 22,4:2 = 11,2 л/моль,
так как для образования одной молекулы водорода два иона водорода принимают два электрона: 2H+ + 2 ē = H2↑.
Из закона Фарадея следует
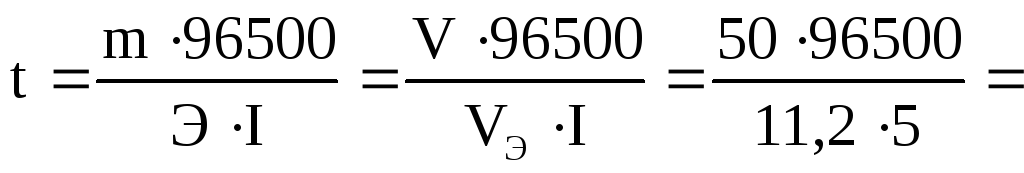 86161 с = 23,9 ч.
86161 с = 23,9 ч.
Содержание дисциплины «Общая химия»
Реакции ионного обмена. Произведение растворимости. Гидролиз. Амфотерность. Окислительно-восстановительные реакции. Степень окисления и валентность. Общие принципы составления уравнений окислительно-восстановительных реакций. Электрохимические процессы. Гальванические элементы и аккумуляторы. Стандартные электродные потенциалы. Ряд напряжений. Направление окислительно-восстановительных реакций и ЭДС. Электролиз. Закон Фарадея.
ЕГЭ. Электролиз расплавов. Примеры
Электролиз расплавов (скачать pdf)
Напомним, что на катоде происходит восстановление катионов, а на аноде – окисление анионов. В электролизе расплавов вода отсутствует, следовательно, любые (даже активные) металлы могут быть восстановлены на катоде. В случае кислородсодержащих кислотных остатков необходимо следовать следующему правилу: атомы кислорода окисляются до простого вещества и выделяется оксид неметалла.
1. Соли:
CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Расписываем процессы, происходящие на катоде и аноде. Так как воды нет, любой металл будет восстанавливаться на катоде:
К: Cu2+ + 2e → Cu0
A: 2Cl– – 2e → Cl2
Пишем суммарное уравнение:
CuCl2 → Cu + Cl2
Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO4
Расписываем процессы, происходящие на катоде и аноде. В данном случае ср находится в степени окисления +6, т.е. окислить ее уже нельзя, следовательно, окисляем кислород до простого вещества. Сера переходит в оксид с той же степенью окисления:
К: Na+ + 1e → Na0
A: 2SO42– – 4e → O20 + 2SO3
Анодный процесс по шагам:
1) сначала пишем окисление кислорода до простого вещества и SO3:
SO42– → O20 + SO3
2) Далее расставляем коэффициенты:
2SO42– → O2
3) Уравниваем электроны: в левой части заряд 4– (так как заряд сульфат-иона 2– и их два), в правой – заряд 0, так как ионов нет. Следовательно, из левой части мы должны отнять 4 электрона, тем самым делая заряд 0 в обеих частях уравнения:
2SO42– – 4e → O20 + 2SO3
Сравниваем катодный и анодный процессы: количество принимаемых и отдаваемых электронов должно быть одинаковым. Следовательно, все коэффициенты катодного процесса необходимо умножить на 4:
К: 4Na+ + 4e → 4Na0
A: 2SO42– – 4e → O20 + 2SO3
Теперь складываем левые и правые части катодного и анодного процессов:
2. Щелочи:
KOH
Расписываем диссоциацию на ионы:
KOH → K+ + OH–
Расписываем процессы, происходящие на катоде и аноде:
К: K+ +1e → K0
A: 4OH– – 4e → O20 + 2H2O
Анодный процесс по шагам:
1) Понимаем, что окисляться будет кислород до простого вещества (водород уже имеет степень окисления +1 и далее не может быть окислен). Также будет выделение воды – почему? Потому что больше ничего написать и не получится: 1) H
OH–  → O20 + H2O
2) Расставляем коэффициенты:
4OH–  → O20 + 2H2O
3) Уравниваем число электронов в левой и правой частях уравнения:
4OH– – 4e → O20 + 2H2O
Вычитаем 4e, так как в левой части присутствуют 4 отрицательных заряда, а в правой части ионов нет. В итоге получаем заряд 0 в обеих частях уравнения.
Далее уравниваем число принимаемых и отдаваемых электронов на катоде и аноде (все коэффициенты катодного уравнения умножаем на 4):
К: 4K+ + 4e → 4K0
A: 4OH– – 4e → O20 + 2H2O
Теперь складываем левые и правые части катодного и анодного процессов:
4KOH → 4K0 + O20 + 2H2O.
Рассмотрим несколько примеров электролиза
Электролиз соли меди с растворимым медным анодом Катодом является химически чистая электролитическая медь, а анодом — чер-
новая медь. В качестве электролита применяют водный раствор сульфата меди.
На аноде Сu = Сu 2+ +2е—
На катоде Сu 2+ +2е—=Сu
Этот метод применяется для рафинирования меди и других металлов.
Электролиз водного раствора сульфата натрия с нерастворимыми платиновыми электродами. Сульфат натрия в водном растворе диссоциирует на ионы 2Na+ и SO42-. При электролизе процесс на катоде может быть выражен следующим образом: 4Na+ + 4Н20+4е-=4Na+ 4ОН—+2Н2
или Н20+4е-=4ОН—+2Н2
а на аноде 2SO42- +2Н20-4е—=4Н+ + 2SО42-+O2
или 2Н20-4е—=4Н+ + O2
Таким образом, на катоде выделяется водород, а на аноде кислород; вблизи катода получается гидроокись натрия, а вблизи анода — серная кислота. Если католит (раствор у катода) и анолит (раствор у анода) смешать, то получится сульфат натрия и вода. Таким образом, электролиз водного раствора сульфата натрия сводится к разложению воды на водород и кислород.
Электролиз водного раствора йодида калия с платиновыми электродами. Иодид калия в водном растворе содержит -ионы калия и иодид-ионы.
На катоде 2К++2Н2О+2е-=2К++20Н—+Н2
или 2Н2О+ 2е- = 20Н- + Н2
а на аноде 2J- —2е- = J2
На катоде выделяется водород, а на аноде йод.
Электролиз водного раствора серной кислоты с платиновыми электродами. При электролизе раствора серной кислоты
на катоде 4Н++4e—=2Н2
На аноде 2SO42- +2Н20—4е-=4Н++2SO42- + О2
или 2Н2О—4е— = 4Н++О2
т. е. по существу происходит разложение воды на водород и кислород. В случае если электролитом является кислота с кислородсодержащим анионом или соль такой кислоты, то при электролизе на аноде выделяется кислород и увеличивается концентрация кислоты в анолите,
По активности к окислению на аноде отрицательные ионы могут быть расположены в следующий ряд:
элементарные ионы.. .сложные ионы
J-, Вг-, С1-, S2- ОН-, SO42-, N03—, С1О4— …
При электролизе водных растворов соединений, содержащих сложные ионы, вместо последних на аноде разряжается гидроксид-ион.
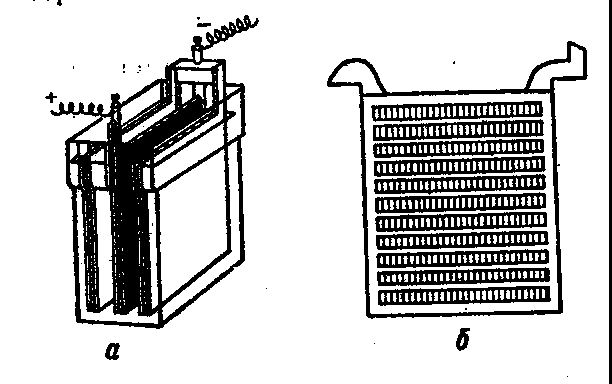
Рис. 7. Свинцовый аккумулятор: а — смонтированный аккумулятор, б — свинцовая пластина
11. Аккумуляторы
Аккумуляторы — это устройства, являющиеся вторичными химическими источниками электрической энергии. Они характеризуются обратимостью, т. е. после разрядки могут быть приведены в исходноесостояние пропусканием через них электрического тока от внешнего источника (зарядка аккумулятора). Аккумуляторы применяются для приведения в движение электрокар, шахтных электровозов, подводных лодок, для обслуживания самолетов, аэродромов и беспилотных управляемых объектов, для запуска двигателей автомобилей, самолётов и т. д. Свинцовый аккумулятор состоит из двух перфорированных (тонких решетчатых, сотообразных) свинцовых пластин, одна из которых (отрицательная) после зарядки заполнена губчатым металлическим свинцом, а другая (положительная) — двуокисью свинца (рис. 7). Обе пластины находятся в 25—30%-ном растворе серной кислоты. Вначале, перед зарядкой, в свинцовые пластины электродов вмазывается паста, содержащая, помимо органического связующего, окись свинца. В результате взаимодействия окиси свинца с серной кислотой на электродных пластинах образуется сульфат свинца
РbО + Н2S04 = РbSО4 + Н2О
Процесс зарядки аккумулятора может быть представлен следующими уравнениями реакций для катодной и анодной пластин:
на катоде РbSО4+2е—=Рb+SO42- с образованием губчатого свинца;
на аноде РbSО4 + 2Н2О – 2е— = Рb + 4Н+ + SО42
Суммарно химическую реакцию, протекающую при зарядке аккумулятора, можно выразить следующим уравнением:
2РbSО4 + 2Н2О = Рb + РbО2 + 2Н2SО4
Процесс разрядки.
На катоде Рb + SO42- =PbSO4+2e— (Е02)
или Pb = Pb2+ + 2e-
на аноде PbO2+2H2SO4 = Pb(SO4)2+2H2O
Рb(SO4)2 + 2e- = 2PbSO4 +2H2O (Е01)
или Pb4++2e—=Pb2+
или
Процессы, протекающие при разрядке и зарядке аккумулятора, суммарно могут быть представлены:
разрядка
Рb + РbО2 + 2Н2SО4 = 2Рb SO4 + 2Н2О
зарядка
Очевидно, что при зарядке аккумулятора концентрация серной : кислоты в нём увеличивается, а при разрядке уменьшается. Зарядку и разрядку можно повторять много раз; поэтому аккумуляторы могут находиться в эксплуатации продолжительное время.
ЭДС аккумулятора=Е01 — Е02 = 1,68-(-0,36) = 2,04 в
(значения стандартных потенциалов электродов взяты из табл. 45). В действительности значение ЭДС аккумулятора несколько отличается от 2,04 в, так как концентрации ионов Рb2+ и Рb4+ в растворе не отвечают стандартным условиям.
Помимо свинцового аккумулятора в практике находят применение никелево-кадмиевый, никелево-железный и серебряно-цинковый аккумуляторы.
Топливный элемент. Гальванические элементы и аккумуляторы являются химическими источниками электрической энергии. Особого типа химическим источником электрической энергии является так называемый топливный элемент. Принципиальная схема топливного элемента может быть дана в следующем виде:
С | электролит | О2 | неактивный электрод
Теоретически ЭДС этого элемента определяется теплотой горения угля по реакции С+О2=СО2 и должна составлять 1 ,05 в. В топливном элементе вся тепловая энергия должна превращаться в электрическую, т. е. топливный элемент должен иметь коэффициент полезного действия (к. п. д.), близкий к 100%. В настоящее время во многих странах мира разрабатываются электрохимические схемы и конструкции топливного элемента. Исследуется возможность применения в топливном элементе в качестве горючего не только угля, но и различных горючих газов (водород, окись углерода).
Примеры электролиза растворов электролитов с нерастворимыми анодами.
Электролиз раствора хлорида меди

Катодный процесс (-) | Анодный процесс (+) | |
|
|
Продукты, образующиеся при электролизе на электродах в результате электрохимических реакций, называются первичными продуктами электролиза.
Электролиз раствора сульфата цинка

Катодный процесс (-) | Анодный процесс (+) | |
|
| |
|
Продукты, образующиеся в растворе у электродов в результате вторичных реакций соединения, называются вторичными продуктами электролиза. В данном примере это образовавшаяся у анода серная кислота. Цинк и кислород, образовавшиеся на электродах, — первичные продукты электролиза.
Электролиз раствора хлорида натрия

Катодный процесс (-) | Анодный процесс (+) | |
|
|
В приведённом примере первичными продуктами электролиза являются газы – водород и хлор, вторичными — гидроксид натрия, образовавшийся у катода.
4.
Электролиз раствора сульфата натрия 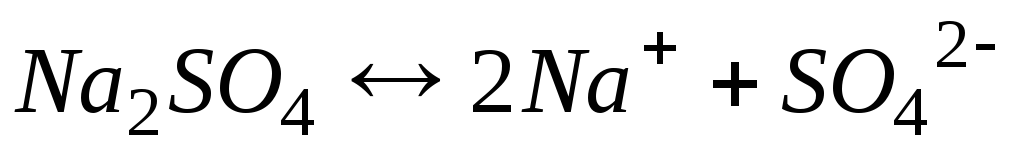
Катодный процесс (-) | Анодный процесс (+) | |
|
|
В данном случае, как и при электролизе кислородсодержащих кислот и щелочей, образуется 2 первичных (водород и кислород) и 2 вторичных (щелочь и кислота) продукта.
5.
Электролиз расплава хлорида натрия 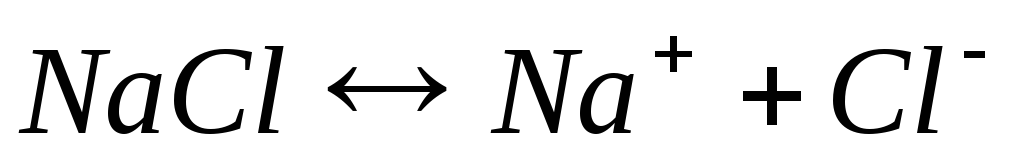
Катодный процесс (-) | Анодный процесс (+) | |
|
|
Примеры электролиза растворов электролитов с растворимыми анодами.
6. Рафинирование (очистка от примесей) анода, изготовленного из меди с примесями Zn, Sn, Ag.
Электролитом
в этом случае служит раствор соли меди,
анодом – медь, загрязненная примесями,
катодом – графит или пластинка из чистой
меди. Прилагаемое из внешнего источника
напряжение не превышает стандартный
электродный потенциал меди ( 0,4 В):
0,4 В):

Катодный процесс (-)
Анодный процесс (+)


Для растворения серебра величина используемого напряжения недостаточна, и поэтому оно в нейтральном состоянии остается на дне электролизера в виде рыхлого осадка (в шламе). Для осаждения примесей на медном катоде требуется большое перенапряжение, и поэтому они остаются в растворе.
Подобно рафинированию методом электролиза производится покрытие одного металла другим (гальваностегия), и наносятся металлические покрытия на неметаллические полупроводниковые подложки (гальванопластика).
Приведенные примеры находят широкое применение в промышленности.
Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Электролиз — это… Что такое Электролиз?
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[источник не указан 1318 дней], диоксида марганца[2], пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- (1)
- (2)
- (3)
- (4)
- , где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
где — постоянная Фарадея.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
где — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; — время, в течение которого проводился электролиз, с; — постоянная Фарадея, Кл·моль−1; — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K»катод»(-): Na+ + 1e = Na0
A»анод»(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
Точно так же
3) Неактивные металлы
Точно так же
Растворы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K»катод»(-): 2H2O + 2e = H2 + 2OH−
A»анод»(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2.Соль активного металла и кислородсодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → 2H2 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2H2O (электролиз) → 2H2 + O2
2) Менее активные металлы
1.Соль менее активного металла и бескислородной кислоты
ZnCl2 ↔ Zn2+ + 2Cl−
K»катод»(-): Zn2+ + 2e = Zn0
A»анод»(+): 2Cl− — 2e = 2Cl0
Вывод: ZnCl2 (электролиз) → Zn + Cl2
2.Соль менее активного металла и кислородсодержащей кислоты
ZnSO4 ↔ Zn2++SO42−
K(-): Zn2+ + 2e = Zn0
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2ZnSO4 + 2H2O(электролиз) → 2Zn + 2H2SO4 + O2
3. Гидроксид: невозможно (нерастворим)
3) Неактивные металлы
Точно так же
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
 | В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 11 мая 2011. |
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока, наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей;
1) При отсутствии ионизатора электролиз проводиться не будет даже при высоком напряжении.
2) Электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы.
3) Уравнения электролиза как в электролитах, так и в газах всегда остаются постоянными.