Электропроводность сред и её роль в различных отраслях промышленности
Что такое проводимость?
 Чаще всего под проводимостью понимается способность вещества передавать тепло, звук или электричество. В этом материале мы разберём электрическую проводимость (EC), которая представляет собой способность исследуемой среды проводить электрический ток. Небольшие положительно либо отрицательно заряженные частицы, называемые ионами, помогают переносить электрический заряд через вещество. Чем больше таких ионов, тем выше проводимость, соответственно, меньшее количество ионов приводит к снижению проводимости. А чем выше проводимость, тем выше способность среды проводить электричество. Это связано с большим количеством заряженных ионов, присутствующих в образце. Самой высокой электрической проводимостью обладают проводники – металлы и электролиты.
Чаще всего под проводимостью понимается способность вещества передавать тепло, звук или электричество. В этом материале мы разберём электрическую проводимость (EC), которая представляет собой способность исследуемой среды проводить электрический ток. Небольшие положительно либо отрицательно заряженные частицы, называемые ионами, помогают переносить электрический заряд через вещество. Чем больше таких ионов, тем выше проводимость, соответственно, меньшее количество ионов приводит к снижению проводимости. А чем выше проводимость, тем выше способность среды проводить электричество. Это связано с большим количеством заряженных ионов, присутствующих в образце. Самой высокой электрической проводимостью обладают проводники – металлы и электролиты.
Электропроводность сред, также называемая ЕС, основана на проводимости, которая, как мы выяснили, является способностью вещества передавать ток. Единицами измерения электропроводности является Siemens/cm (S/cm, mS/cm, μS/cm, dS/m). Например, сверхчистая вода имеет удельную проводимость 0.055 μS/см при температуре 25 °С. Величина электропроводности обратна величине электрического сопротивления, несмотря на то, что обе они являются характеристиками электропроводящей способности материалов.
Какие отрасли промышленности полагаются на измерения ЕС?
Теперь давайте взглянем на конкретные применения измерений ЕС в конкретных отраслях жизнедеятельности человека.
ЕС и сельское хозяйство
В сельскохозяйственной промышленности знание электропроводности почвы чрезвычайно важно для здоровья и роста сельскохозяйственных культур. Фермеры и производители, как правило, регулярно производят мониторинг содержания фосфатов, нитратов, кальция и калия почвы, поскольку эти питательные вещества необходимы для успешного роста растений. Тестирование электропроводности (ЕС) почвы может помочь производителям отслеживать количество всех питательных веществ, присутствующих в почве, и определять, требует ли она больше питательных веществ или же, наоборот, имеет место её перенасыщение. Таким образом, измерение EC почвы помогает экономить денежные средства в долгосрочной перспективе и обеспечивает здоровое растениеводство.
EC и обработка воды
Электрическая проводимость играет огромную роль в различных сферах, связанных с контролем качества воды. При очистке сточных вод ЕС измеряется для того, чтобы сопоставить параметры отходящих сточных вод со свойствами воды, в которую они поступают. Попадание в чистую воду стоков с чрезвычайно высокой или низкой солёностью может иметь пагубные последствия для здоровья водной флоры и фауны. Таким образом, сохранение измерений ЕС в приемлемых диапазонах является важным и полезным для поддержания здоровой и устойчивой экосистемы наших океанов и других природных водоёмов.
EC и гальванические ванны
Проводимость может также оказывать воздействие на гальванические ванны, с помощью которых проводятся процедуры нанесения на металлы слоёв защищающих веществ и/или придания им определённой окраски. Поэтому измерения ЕС являются обычным делом в таких отраслях, как аэрокосмическая промышленность, автомобилестроение, изготовление ювелирных изделий и т. д.
Измерения ЕС и общего содержания растворенных твердых веществ (TDS)
Между тем, электропроводимость можно измерять и с целью определения общего количества растворенных твердых веществ в средах (TDS) и их солёности, что также весьма востребовано в различных отраслях промышленности. Обычно измерение EC используется для оценки параметров TDS. Это подразумевает то, что природа твёрдых частиц является ионной и соотношение между растворенными ионами и проводимостью ЕС нам известно.
Для измерения TDS используются единицы мг/л (ppm) или г/л. Некоторые модели измерителей электропроводимости разрешают пользователю осуществлять введение коэффициента TDS для последующего преобразования, однако в большинстве приборов данный коэффициент устанавливается автоматически на значении 0.50. Для растворов с высоким содержанием ионов коэффициент TDS составляет 0.5, а для слабых образцов, таких как, например, удобрения, он равен 0.7. Следует заметить, что коэффициенты преобразования TDS для разных твёрдых тел являются различными.
Измерения электропроводимости и солёности
 Измерения EC также могут применяться для определения солёности морской воды. Существуют различные шкалы, предназначенные для измерений солёности в солёной воде в зависимости от возможностей вашего измерительного прибора. Три общих шкалы солености – это практическая шкала минерализации (от 0.00 до 42.00 единиц практической солености, определенных Организацией Объединенных Наций по вопросам образования и культуры (ЮНЕСКО) в 1978 году; процентная шкала (от 0.0 до 400.0 %), где 100 % — морская вода; и природная шкала морской воды (от 0.00 до 80.00 п.п.), определенная ЮНЕСКО в 1966 году. Каждый измеритель электропроводности обладает собственными алгоритмами для преобразования результатов измерений проводимости в желаемый масштаб в соответствии с этими шкалами.
Измерения EC также могут применяться для определения солёности морской воды. Существуют различные шкалы, предназначенные для измерений солёности в солёной воде в зависимости от возможностей вашего измерительного прибора. Три общих шкалы солености – это практическая шкала минерализации (от 0.00 до 42.00 единиц практической солености, определенных Организацией Объединенных Наций по вопросам образования и культуры (ЮНЕСКО) в 1978 году; процентная шкала (от 0.0 до 400.0 %), где 100 % — морская вода; и природная шкала морской воды (от 0.00 до 80.00 п.п.), определенная ЮНЕСКО в 1966 году. Каждый измеритель электропроводности обладает собственными алгоритмами для преобразования результатов измерений проводимости в желаемый масштаб в соответствии с этими шкалами.
Влияние температуры измеряемого вещества на показатели проводимости
Следует также иметь в виду, что температура измеряемого образца влиять на измерения ЕС. Ведь от температуры зависит активность ионов и концентрация вещества, а это, в свою очередь, влияет на проводимость. Чем выше температура раствора, тем ниже сопротивление (что соответствует более высокой проводимости). И, наоборот, чем ниже температура вещества, тем выше сопротивление (и тем ниже проводимость). Встроенные датчики температуры в приборах для измерения проводимости определяют температуру раствора в режиме реального времени. Встроенная автокомпенсация корректирует измеряемую проводимость до контрольной температуры с помощью фиксированного коэффициента β для линейной компенсации. Более продвинутые измерители проводимости позволяют регулировать β для компенсации различных сред и осуществляют регулировку эталонной температур в максимально широких температурных диапазонах.
Какие датчики используют для измерения проводимости?
Существует несколько типов зондов для измерения проводимости. Они подключаются к корпусу измерительного оборудования для сбора максимально точных показаний.
 Амперометрический датчик
Амперометрический датчик
Амперометрический датчик – это двухэлектродный зонд, измеряющий проводимость с применением амперометрического метода. Эти два электрода изолированы друг от друга, однако и тот и другой при этом контактируют с раствором, для измерения. Данный зонд функционирует с использованием переменного напряжения на определенной частоте между парой электродов, находящихся в растворе.
Двухэлектродные зонды не требуют большого объёма образца, чтобы полностью покрыть датчики, однако измерительный диапазон таких электродов ограничен. Также если вы тестируете образцы, обладающие переменной электропроводимостью, вам вероятнее всего придётся приобрести более одного двухэлектродного зонда и/или измерительного прибора.
Потенциометрический зонд
Данный измерительный датчик представляет собой четырёхкольцовый зонд, который использует для анализа сред потенциометрический подход. В «кольцо» входят два внешних «приводных» и два внутренних электрода. На внешние электроды подаётся переменный ток для индукции тока через раствор. В свою очередь, внутренняя пара электродов измеряет падение потенциала, вызванное наличием тока. Четырёхдиапазонные зонды могут покрывать более широкий измерительный диапазон (концентрацию ионов) и демонстрируют более высокую степень точности, в сравнении с амперометрическим методом исследования. Однако зонд такого типа потребует большего количества измеряемого вещества.
По материалам Brown, M. (октябрь, 2015). Гальваника: о чём должен знать каждый инженер
Физико-химические методы анализа Практическое применение электропроводности
Зная эквивалентную электропроводность раствора можно рассчитать степень () и константу диссоциации (K) растворенного в нем слабого электролита:
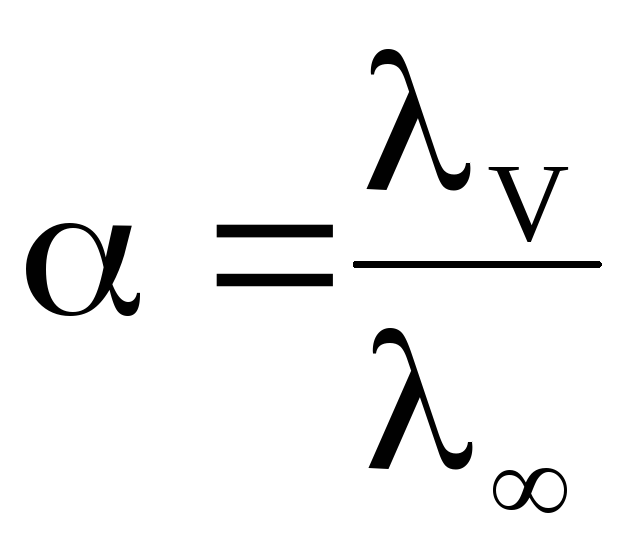
где λV – эквивалентная электропроводность при данном разведении V; λ∞ – предельная эквивалентная электропроводность.
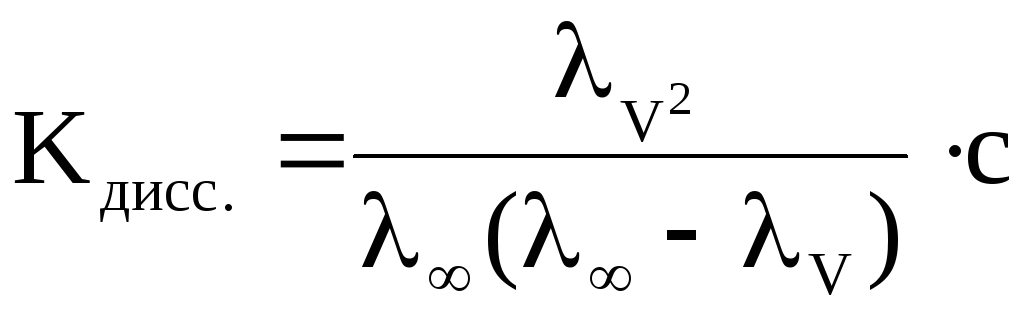
где с – молярная концентрация электролита в растворе, моль/дм3.
На измерении удельной электропроводности основан кондуктометрический метод анализа (кондуктометрия).В аналитической химии широкое применение имеет
Рассмотрим в качестве примера титрование сильной кислоты HClсильным основаниемNaOH:
HCl + NaOH = NaCl + H2O
H+ + OH– = H2O
При постепенном прибавлении раствора NaOHк кислоте ионыH+иOH–в растворе заменяются менее подвижными ионамиNa+
Абсцисса точки пересечения двух прямых соответствует конечной точке титрования, т.е. точке эквивалентности.

Рис. 92. Кривая
кондуктометрического титрования сильной
кислоты сильным основанием, (1/R
Методы анализа, основанные на измерении электропроводности, широко применяются для технологического контроля во многих производствах, определения влажности различных объектов, содержания солей в воде, в ряде биологических жидкостей или в почве. По электропроводности растворов можно количественно определять растворимость труднорастворимых соединений, изоэлектрическую точку аминокислот, пептидов и белков.
Потенциометрия
Потенциометриейназывают группу методов количественного анализа, основанных на использовании зависимости равновесного потенциала электрода, опущенного в раствор, от активности (концентрации) ионов этого раствора.
Теоретической основой потенциометрии является уравнение Нернста. Практически потенциометрия реализуется путем создания на основе исследуемой системы гальванического элемента.
В потенциометрии используют гальванические элементы, в которых потенциал одного из электродов зависит от концентрации исследуемого вещества. Этот электрод называют рабочим (индикаторным) или электродом измерения.Второй электрод в потенциометрии являетсяэлектродом сравнения.Этот электрод выбирают с таким расчетом, чтобы его потенциал оставался постоянным и не зависел от состояния исследуемого раствора.
Потенциометрические измерения являются надежными при изучении констант равновесия электродных реакций, коэффициентов активности ионов в растворе, констант нестойкости комплексных ионов, рН растворов.
Потенциометрические методы анализа имеют ряд преимуществ. Они особо чувствительны и не требуют для исследования больших объемов растворов. Существуют модификации потенциометрического определения, позволяющие проводить анализ в пробах, объем которых может не превышать десятых долей миллилитра, что важно для биологических исследований. Поскольку равновесное значение потенциала устанавливается быстро, то потенциометрические измерения не требуют значительных затрат времени. Их можно проводить в мутных и окрашенных растворах, вязких средах.
Различают прямую и косвенную потенциометрию или потенциометрическое титрование.
Прямая
потенциометрия (ионометрия)– это
потенциометрический метод, в котором
индикаторным электродом является
ионоселективный электрод. Ионометрия
– удобный, простой, экспрессный
современный метод анализа. Для его
реализации достаточно подобрать
соответствующий ионоселективный
электрод для определяемого иона. Особенно
широко ионометрия используется при
определении точной концентрации ионов
Н
Потенциометрическое титрованиеявляется разновидностью титриметрических методов анализа. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом, фиксируя точку эквивалентности на основании характера изменения э.д.с. измеряемой цепи в зависимости от объема добавляемого раствора. По полученным данным строят кривую потенциометрического титрования и на этой кривой определяют точку эквивалентности и объем израсходованного титранта в точке эквивалентности.
Потенциометрическое титрование может быть использовано для определения концентрации кислоты или основания в анализируемом растворе. В этом случае составляют гальваническую цепь, содержащую индикаторный стеклянный электрод и электрод сравнения с постоянным известным потенциалом (например, хлорсеребряный):
AgAgCl,HCl«смб»Н3О+KCl,AgClAg
a
 ax
axиндикаторный хлорсеребряный
стеклянный электрод электрод сравнения
где «смб» – стеклянная мембрана; а – известная активность ионов Н+ внутреннего раствора стеклянного электрода; ах – неизвестная активность ионов Н+ измеряемого раствора.
Э.д.с. такой гальванической цепи будет зависеть от концентрации ионов Н+
Титруемый раствор строго определенного объема помещают в электролитическую ячейку с электродами и при перемешивании из бюретки небольшими порциями добавляют титрант (например, раствор щелочи при определении концентрации кислоты в исследуемой системе). После каждого добавления очередной порции раствора щелочи с помощью потенциометра определяют рН раствора и затем по полученным данным строят кривую титрования в координатах рН раствора – V(титранта) (рис. 104).
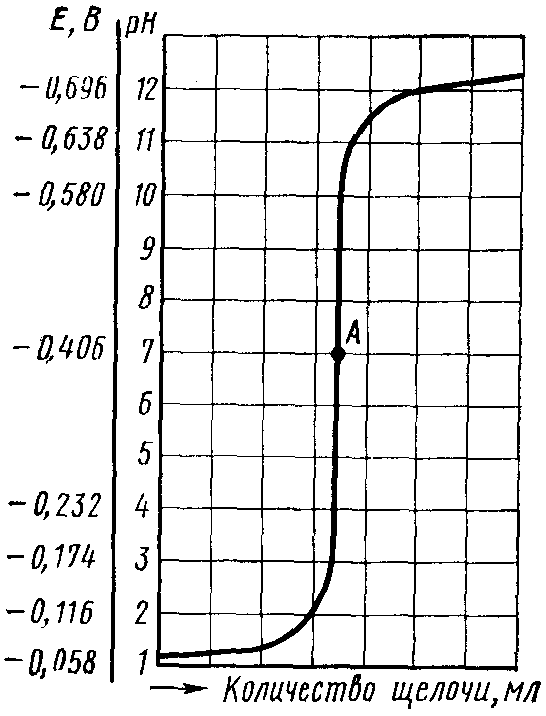
Рис. 104. Кривая потенциометрического титрования соляной кислоты гидроксидом натрия: А – точка эквивалентности
В случае титрования сильной кислоты щелочью точка эквивалентности будет лежать на середине скачка титрования (рН = 7).
В ряде случаев чувствительность потенциометрического метода превышает чувствительность обычного объемного метода, а также метода кондуктометрического титрования.
Практическое применение электрической проводимости.
Определение fэ сильных электролитов:
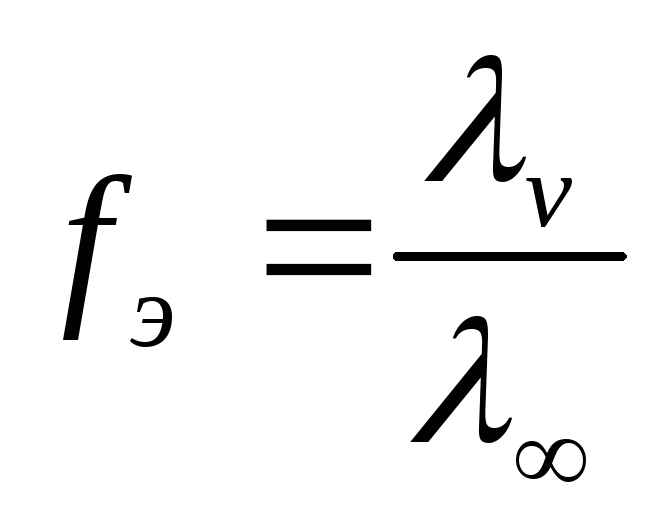
Определение константы и степени диссоциации слабых электролитов:

В не слишком разбавленных растворах величина у слабых кислот и оснований очень мала, и можно считать, что 1 -1. Тогда получаем:
K=2Cи=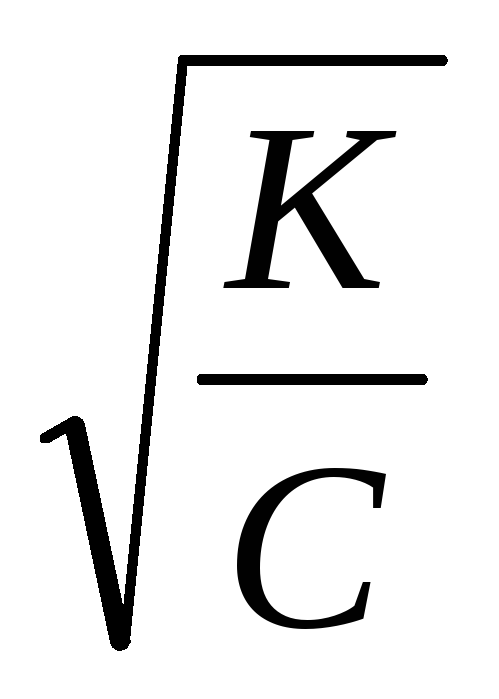
Это уравнение дает простой способ подсчета степени электролитической диссоциации слабого электролита в растворе данной концентрации, когда константа К известна.
3 .
Определение солесодержания в растворе
электролита:
.
Определение солесодержания в растворе
электролита:
1 000
= Сi
(k+ a)
000
= Сi
(k+ a)
Сi= 1000 /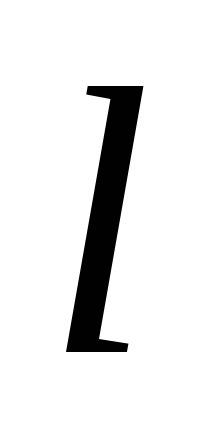 k+
k+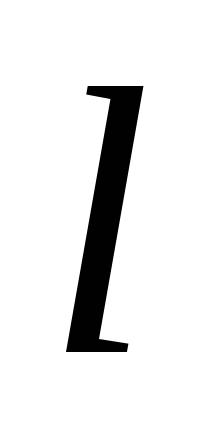 a
a
4. Определение растворимости труднорастворимых солей.
По закону действующих масс для бинарного электролита можно записать:
[K+] [A—] =K[KA] = ПР,
где ПР – произведение растворимости. ПР = constпри Т =const
Если соединение диссоциирует нацело, то
[ K+]
= [A—] =ПР
= С (моль/л)
K+]
= [A—] =ПР
= С (моль/л)
ПР и С определяют из данных насыщенного раствора электролита.
Пример: AgCl
С
 начала
измеряют дистиллированной воды (
=1,510-6См/м).
начала
измеряют дистиллированной воды (
=1,510-6См/м).
 насыщенного
раствора AgClравна
2,7510-6См/м.
насыщенного
раствора AgClравна
2,7510-6См/м.
С ледовательно:
ледовательно:
(AgCl) = 2,7510-6— 1,510-6= 1,2510-6См/м
Электролитические подвижности ионов Ag+иCl—равны соответственно 53,8 и 65,2, а молярная электрическая проводимость при бесконечном разбавлении:
=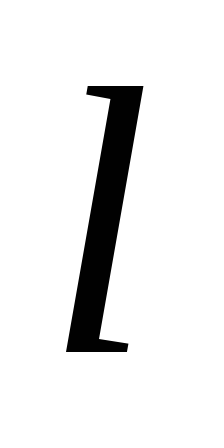 Ag+
Ag+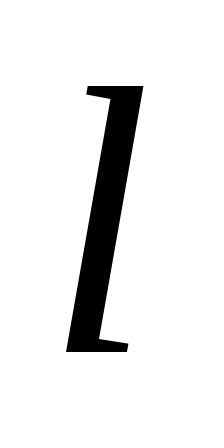 Cl= 53,5 + 65,2 = 119,0 См/м2
Cl= 53,5 + 65,2 = 119,0 См/м2
Т ак
как
ак
как
= V;
то определяем V, содержащий 1 мольAgCl:
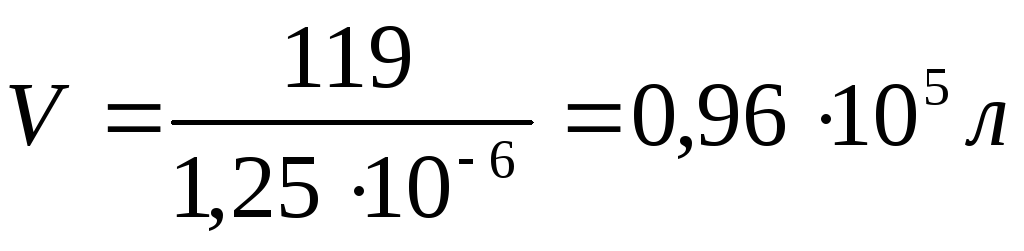
Число молей в 1 литре равно:
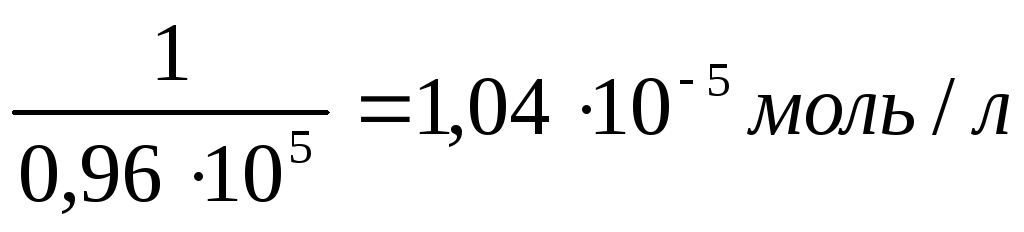
Биологическое значение.
Явления электрической проводимости в тканях растительных и животных организмов имеют большое физиологическое значение.
Электрическая проводимость разных тканей и биологических жидкостей неодинакова: наибольшей электрической проводимостью обладают спинномозговая жидкость, лимфа, желчь, кровь; хорошо проводят ток также мышцы, подкожная клетчатка, серое вещество головного мозга. Значительно ниже электрическая проводимость легких, сердца, печени. Очень низка она у жировой ткани, нервной, костной. Хуже всего проводит электрический ток кожа (роговой слой). Сухой эпидермис почти не обладает электропроводностью.
Жидкость межклеточных пространств гораздо лучше проводит ток, чем клетки, оболочки которых оказываются существенным препятствием при движении многих ионов. Измерение электрической проводимости широко применяется при изучении изменения проницаемости в живых клетках. Возрастание электрической проводимости клетки означает, что ионы проходят через клетку с большей легкостью. При малых изменениях электрической проводимости процесс обратим, но если изменение электрической проводимости слишком увеличивается в сторону возрастания или убывания, то процесс становится необратимым и наступает смерть организма. По величине электрической проводимости биологических жидкостей можно определить их сопротивление. Электрическое сопротивление нормальных водорослей почти в 10 раз больше сопротивления морской воды, тогда как мертвая ткань имеет сопротивление почти равное сопротивлению морской воды. Вообще Са++понижает проницаемость, аMg++,Na+,K+ее увеличивают.
Изучение электрической проводимости растворов называют кондуктометрией. Кондуктометрические методы анализа основаны на зависимости между электрической проводимостью растворов и концентрацией ионов в растворе.
Кондуктометрическое титрование – метод анализа, основанный на определении содержания вещества по излому кривой титрования. Кривую строят по измерениям удельной электрической проводимости анализируемого раствора, изменяющейся в результате химических реакций в процессе титрования.
Кондуктометрические методы по сравнению с другими методами анализа имеют некоторые преимущества. Они дают возможность:
— без больших затруднений проводить определения не только в прозрачных, но и в окрашенных и мутных растворах, а также в присутствии окислителей и восстановителей, ограничивающих применение органических индикаторов в других методах;
— осуществлять определения разнообразных неорганических и органических индивидуальных соединений;
— анализировать не только сравнительно концентрированные растворы, но и разбавленные до 10-4М;
— проводить исследования не только водных, но и не водных и смешанных водно-органических растворов;
— сравнительно легко осуществлять автоматизацию процессов титрования;
— широко использовать разнообразные типы реакций (нейтрализации, осаждения, комплексообразования, окисления-восстановления, замещения, конденсации, омыления и т.п.), сопровождающихся изменением электрической проводимости анализируемых растворов;
— во многих случаях избежать предварительного отделения примесей, обычно мешающих определению другими методами;
— просто и точно определять конечную точку титрования по пересечению двух прямых и соответственно вычислять точку эквивалентности;
— использовать переменный ток низкой частоты и постоянный ток;
— производить дифференцированное титрование смесей электролитов, что невозможно осуществить другими методами.
Кондуктометрические методы анализа применяются в промышленности для осуществления непрерывного химико-аналитического контроля производства, определения концентрации солевых растворов, содержание солей в минеральной, морской и речной воде, для контроля процесса очистки и качества воды, оценки загрязненности сточных вод, для определения следов воды в неводных растворителях, газах, твердых солях, целлюлозе, бумаге, зерне, для определения влажности зерна и почвы.
Кондуктометрические методы также применяются для анализа окружающей среды, качественного определения различных газов (СО2, СО, О2,NH3,SO2,H2Sи др.), содержание вредных примесей в воздухе, воде, пищевых продуктов, для контроля качество молока, вин, напитков, фруктовых соков.
Кондуктометрическое титрование используется для определения индивидуальных сильных, слабых и очень слабых неорганических и органических карбоновых кислот, амино-, галогено- и оксикислот, фенолов и их производных, фармацевтических препаратов, дигуанидина, гуминовых кислот, аминов, четвертичных аммониевых оснований и т.д.
Кондуктометрическое титрование применяется также для анализа многокомпонентных смесей, кислот, оснований, солей, образованных сильными кислотами (основаниями) и слабыми основаниями (кислотами), разнообразных катионов и анионов, окислителей и восстановителей, комплексующихся агентов, смесей минеральных, монокарбоновых и поликарбоновых кислот, смесей оснований и солей слабых кислот, смесей кислот и солей слабых оснований и т.д.
Электропроводность применение — Справочник химика 21
Большое практическое значение имеет кондуктометрическое титрование, т. е. определение концентрации электролита в растворе путем измерения электропроводности при титровании. Этот способ является особенно ценным в случае мутных или сильно окрашенных растворов, которые титровать с применением обычных индикаторов часто невозможно. [c.412]Общие свойства меди и ее сплавов. Медь, помимо широкого применения в технике по причине ее высокой электропроводности, используется в химическом машиностроении в качестве конструкционного материала для изготовления разнообразной химической аппаратуры и в особенности теплообменной аппаратуры (выпарные аппараты,теплообменники,конденсаторы, испарители, змеевики и т. п.). Объясняется это высокой теплопроводностью меди и ее сплавов, их благоприятными физико-механическими свойствами при достаточно высокой [c.245]
Ионитовые мембраны являются своеобразными избирательными проводниками электрического тока. В то время как катионитовые мембраны пропускают через себя преимущественно положительно заряженные частицы за счет последовательного многократного обмена их на подвижные катионы полимера, анионитовые в основном прозрачны для анионов (число переноса анионитов достигает 0,94— 0,96). Благодаря большому диффузионному сопротивлению этих мембран, препятствующему диффузии электролита в направлении, обратном движению электрического тока, и их высокой электропроводности, применение таких мембран вместо инертных диафрагм повышает экономичность процесса электролиза разбавленных растворов. [c.450]
Вообще армирование пластиков металлом применяется довольно редко и только для специальных целей, например для достижения электропроводности. Применение же металлов для армирования пластиков в целях повышения их прочности мало применимо, вследствие того, что довольно трудно выбрать конструкцию, в которой пластик и металл работали бы совместно и равнозначно. Обычно вследствие различных коэффициентов термического расширения, незначительной адгезии и других причин пластик и металл работают по-разному. Исключение составляют металлические сетки или листы с просверленными отверстиями, через которые проходит пластик. [c.465]
Наряду со стандартным методом имеются исследовательские методы оценки электропроводности, измеряемой с применением переменного тока или по длительности зарядки или разрядки измерительного конденсатора [116]. Основным достоинством метода измерения электропроводности с применением переменного тока является практически полное отсутствие влияния электроочистки. Однако возникают дополнительные трудности 1) отсутствие надежных измерителей малых величин переменного тока 2) появление реактивного тока, затрудняющего измерение активного тока. Этим методом с помощью мостов определяется тангенс угла диэлектрических потерь, который связан с электропроводностью (Хо) соотношением [c.131]
Попадание нагара на электроды и изоляторы свечей приводит к нарушению нормальной работы свечей зажигания. Особенно ярко это наблюдается в случае применения бензинов, содержащих металлоорганические антидетонаторы, так как здесь нагары имеют повышенную электропроводность. В частности, одним из наиболее существенных недостатков нового марганцевого антидетонатора является нарушение работы свечей зажигания. [c.268]
В некоторых нефтехимических синтезах, в частности при получении бутилкаучука, изопрена, термостойких пластических масс,, используют только разветвленные олефины С4—Се. Примеси нормальных олефинов, как правило, ухудшают свойства готового продукта. Например, химическая инертность, высокая термостабильность и низкая электропроводность бутилкаучука достигаются-лишь при отсутствии в мономере (изобутене) примесей н-бутенов. Применяемая в промышленности абсорбция изобутена из фракции олефинов С4 (их содержится 50—60%) серной кислотой не обеспечивает должной чистоты мономера — в нем остается небольшое количество бутена-1, а также меркаптана. Применение адсорбционных методов с использованием цеолитов (главным образом a ) позволило решить эту проблему, в частности выделить-99,9%-ный изобутен. . [c.199]
Было отмечено аномальное распределение локальной пористости в осадке, когда максимальная пористость находится на некотором расстоянии от фильтровальной перегородки. При этом пористость в различных слоях осадка определялась по электропроводности с применением игольчатых электродов, вводимых в осадок и в некоторой мере нарушающих его структуру. С использованием дисковых электродов, являющихся частью внутренней поверхности фильтра и не влияющих на структуру осадка, было установлено, что распределение пори- [c.181]
В основе первого направления лежит использование МГД-течений в электропроводных жидкостях. Соответствующие устройства подразделяют на кондукционные и индукционные. В кондукционных устройствах электропроводная жидкость (или суспензия) протекает по каналу, располагаемому между полюсами электромагнита. В боковых гранях канала размещены электроды, к которым подводится напряжение от внешнего источника. Возникающие электродинамические силы служат для перемешивания жидких сред. В индукционных устройствах используют переменное магнитное поле, создаваемое обмоткой статора, а жидкость внутри его служит подобием ротора асинхронного двигателя. В результате электромагнитной индукции создается ток и обеспечивается вращательное движение жидкости. Вследствие низкого к. п. д. и больших энергозатрат рассмотренные устройства пока не нашли широкого применения. [c.112]
Применение кондуктометрических определений. Опре деления электропроводности называются кондуктометрическими определениями. Эти определения находят различное применение. [c.411]
Прежде всего электропроводность раствора играет большую роль при промышленном применении электролиза, так как от лее в значительной степени зависит расход электроэнергии при электролизе. [c.411]
Для определения содержания солей в потоке находят применение приборы типа АСН. Действие приборов основано на том, что отбираемую на технологической линии пробу нефти определенного объема (150 мл/час) перемешивают с десятикратным объемом дистиллированной воды при 90-95 °С. При этом соли полностью вымываются из нефти. Затем эмульсия расслаивается и измерением электропроводности полученной воды (водной вытяжки) определяет содержание солей.
Электропроводность — жидкость — Большая Энциклопедия Нефти и Газа, статья, страница 1
Электропроводность — жидкость
Cтраница 1
Электропроводность жидкостей обусловлена ионами, образующимися при диссоциации молекул самой жидкости или ее примесей. [1]
Электропроводность жидкостей зависит не только от концентрации растворенного вещества, но и от наличия примесей ( солевой фон) и температуры. Солевой фон ц колебания температуры оказывают значительное влияние на результат измерения. [3]
Электропроводность жидкости существенным образом зависит от температуры. Поэтому в кондуктометрических приборах предусматривается автоматическая температурная коррекция показаний, либо исследуемый раствор в процессе измерений термо-статируется. [4]
Электропроводность жидкости оказывает решающее влияние на процесс электроочистки, так как этот метод непригоден для очистки электролитов и им можно пользоваться только для очистки диэлектрических жидкостей. Электропроводность жидкостей отражается также на процессе их фильтрования, так как от ее величины зависит электрокинетический потенциал фильтрующей перегородки, а его величина и знак влияют, в свою очередь, на скорость фильтрования. От электропроводности жидкости зависит также элек-трокинетический потенциал загрязняющих ее твердых частиц, влияющий на процесс их агрегирования, что отражается на скорости отстаивания. [5]
Электропроводность жидкости является вторым показателем наличия ионов. [6]
Электропроводность жидкостей можно увеличить путем введен гя в них антистатических присадок. [7]
Электропроводность жидкостей обусловлена ионами, образующимися при диссоциации молекул самой жидкости или ее примесей. [8]
Электропроводность жидкости зависит от ее вязкости. [9]
Повышение электропроводности жидкостей при нагревании объясняется увеличением коэффициента диссоциации а и, кроме того, увеличением подвижности ионов. [10]
Повышение электропроводности жидкостей при нагревании объясняется увеличением коэффициента диссоциации а и, кроме того, увеличением подвижности ионов. [11]
Механизм электропроводности жидкости по современным представлениям аналогичен характеру теплового движения частиц в жидкости: ион некоторое время колеблется около одного положения равновесия, а потом делает скачок к другому положению равновесия. Скорость движения иона обусловлена лишь продолжительностью колебания около одного положения равновесия, так как время, требуемое на самый перескок из одного положения равновесия в другое, незначительно. [12]
При увеличении электропроводности жидкости коррозия будет распространяться более равномерно, так как ток, проходящий по элементам с большой длиной лути, будет уменьшаться поляризацией пропорционально меньше, чем ток, идущий по коротким элементам. При увеличении электропроводности полная сила тока будет, конечно, возрастать; она, однако, не будет пропорциональна электропроводности и таким образом невозможно приписать С такое значение, которое было бы независимо от электропроводности жидкости. Следовательно, нельзя значение С, полученное экспериментально для раствора определенной концентрации, подставить в уравнение ( 20) для сравнения рассчитанных и полученных из олыта скоростей коррозии при других концентрациях. Следующее возражение против применения уравнения ( 20) относится к тому, что, даже в том случае, когда образцы вырезываются из одного и того же листа или куска металла и одинаково обрабатываются, величина С для всех этих образцов различна. [13]
Описывается механизм электропроводности жидкостей и зависимость электропроводимости от различных факторов. [14]
Ячейка 6 измеряет общую усредненную электропроводность жидкости. [15]
Страницы: 1 2 3 4
Электропроводность жидкостей (электролитов)
Электролитами называются вещества, молекулы которых состоят из ионов противоположных знаков, удерживаемых кулоновскими силами. К электролитам относятся кислоты, щелочи и соли. При растворении в воде значительная часть молекул электролитов распадается на ионы. Это явление называется электролитической диссоциацией.
При прохождении тока через электролиты плотность тока определяется плотностью тока положительных и отрицательных ионов
j = j+ + j— = q+n+v+ + q—n—v—
если предположить, что каждая молекула диссоциирует на два иона, то n+ = n— = αn, где α – коэффициент диссоциации, n – концентрация молекул электролита,
q+ = q— = q = Zе, Z – валентность ионов, е – элементарный заряд. Скорость ионов пропорциональна напряженности электрического поля v = bЕ, b – коэффициент пропорциональности, называется подвижностью иона (при Е = 1, v = b)
j = Zeαnb+E + Zeαnb—E = Zeαn(b+ + b—) E = σE,
σ = Zeαn(b+ + b—) – электропроводность электролита, зависит от концентрации свободных ионов, их заряда и подвижности.
При повышении температуры электропроводность электролитов увеличивается (сопротивление соответственно уменьшается). Это связано с двумя причинами:
при увеличении температуры увеличивается коэффициент диссоциации
при нагревании вязкость жидкостей уменьшается и поэтому подвижность ионов возрастает.
Законы электролиза
Подходя к электродам, опущенным в раствор электролита, ионы разряжаются и превращаются в нейтральные атомы или радикалы. Нейтрализовавшиеся атомы оседают на электродах. Если они химически активны, то у электродов протекают вторичные реакции. Например, при нейтрализации иона натрия атом натрия реагирует с водой и на катоде выделяется газообразный водород.
Выделение на электродах составных частей электролита при прохождении через него электрического тока называется электролизом.
Количественные законы электролиза были установлены Фарадеем в 1833-34 гг.
1 закон: количество вещества, выделяющегося на электроде, прямо пропорционально заряду, прошедшему через электролит
m = kq= kIt
k – электрохимический эквивалент вещества.
2 закон: электрохимический
эквивалент прямо пропорционален
химическому эквиваленту 
А – атомный вес элемента, z– валентность, А/z – химический эквивалент, с – коэффициент пропорциональности, 1/с = F – число Фарадея. F = еNА, NА – число Авогадро.
Объединенный
закон:  .
Отсюда следует физический смысл числа
Фарадея: F = q при m = A/z –число
Фарадея равно количеству электричества,
которое должно пройти через раствор,
для выделения одного грамм-эквивалента
(килограмм-эквивалента) данного вещества.
.
Отсюда следует физический смысл числа
Фарадея: F = q при m = A/z –число
Фарадея равно количеству электричества,
которое должно пройти через раствор,
для выделения одного грамм-эквивалента
(килограмм-эквивалента) данного вещества.
F = 96494 Кл/г·экв ≈ 9,65·107 Кл/кг·экв.
Электролиз используется для получения и очистки цветных металлов, для создания антикоррозийных покрытий и т.д.
Токи в газах. Аэроионы.
Молекулы газов нейтральны, поэтому газы являются хорошими изоляторами. Но если газ ионизовать, то он становится электропроводным. Ионизатором может быть пламя, свет, рентгеновское и радиоактивное излучение и т.д.
При ионизации газовых молекул под действием внешних источников из молекулы обычно вырывается один электрон и остается положительный ион. Вырванный электрон может присоединиться к другой молекуле и образовать отрицательный ион. Под действием внешнего электрического поля эти ионы и электроны начинают двигаться и возникает электрический ток.
Одновременно с ионизацией наблюдается и обратный процесс: при столкновении положительного иона и электрона они могут соединяться в нейтральные молекулы. Этот процесс называется рекомбинацией. При рекомбинации выделяется энергия, равная энергии, затраченной на ионизацию. Частично она излучается в виде света, поэтому излучение света при рекомбинации является одной из причин свечения многих форм газового разряда. Если ионизатор прекратит свое действие, то газ, вследствие рекомбинации, быстро становится изолятором.
В земных условиях воздух практически всегда содержит некоторое количество ионов благодаря природным ионизаторам: радиоактивным элементам в почве, космическому излучению.
При дроблении в воздухе вода распадается на заряженные капельки. Крупные капли имеют положительный заряд и быстро оседают и в воздухе остаются мельчайшие отрицательные капельки. Такое явление наблюдается у фонтанов, у водопадов.
Ионы и электроны, находящиеся в воздухе, могут присоединяться к нейтральным молекулам и взвешенным частицам и образовывать более сложные ионы. Эти ионы в атмосфере называются аэроионами. Они различаются не только знаком, но и массой, их условно делят на легкие (газовые) и тяжелые (пылинки, частицы дыма, влаги). Тяжелые ионы вредно действуют на организм. Легкие ,в основном отрицательные, оказывают благотворное влияние. Их используют для лечения — аэроионотерапия.
Различают естественную аэроионотерапию – пребывание больных в местах с повышенной ионизацией воздуха (горы, водопады и т.д.), и искусственную, проводимую с помощью ионизаторов.
Лекция 9
Электропроводность практическое применение — Справочник химика 21
Особое внимание при изложении раздела электропроводности растворов необходимо уделить практическому применению методов измерения электропроводности в различных областях народного хозяйства (опыт 23). Для этой цели весьма полезно описать и показать в работе приборы для определения влажности зерна, почвы, а также различные кондуктометры и солемеры, в основе работы которых лежит принцип электропроводности. Все эти методы нужно увязать с практикой сельского хозяйства. Система контроля за мелиоративным состоянием орошаемых земель, за влажностью почвы и зерна, определение кислотности силосной массы и других окрашенных жидкостей биологического происхождения — вот далеко не полный перечень тех вопросов, которые могут успешно решаться с применением методов электропроводности. [c.56]Наряду со стандартным методом имеются исследовательские методы оценки электропроводности, измеряемой с применением переменного тока или по длительности зарядки или разрядки измерительного конденсатора [116]. Основным достоинством метода измерения электропроводности с применением переменного тока является практически полное отсутствие влияния электроочистки. Однако возникают дополнительные трудности 1) отсутствие надежных измерителей малых величин переменного тока 2) появление реактивного тока, затрудняющего измерение активного тока. Этим методом с помощью мостов определяется тангенс угла диэлектрических потерь, который связан с электропроводностью (Хо) соотношением [c.131]
Неоднократно предлагали использовать металлические электроды для электролиза соляной кислоты [23] катоды из стали, никелированной стали или сплавов никеля [25—26], а также покрытые активным слоем мелкодисперсного серебра [24] предлагали использовать и металлические аноды с покрытиями из иридия или сплавов платины с иридием [27]. Однако о практическом применении металлических анодов в промышленном электролизе соляной кислоты сведения отсутствуют. Отсутствие металлов, достаточно стойких в среде горячей соляной кислоты, делает сомнительным целесообразность применения металлических электродов в этом процессе. Из электродных материалов только графит удовлетворяет основным требованиям, предъявляемым к электродным материалам. Он достаточно стоек при анодной и катодной поляризации в горячей концентрированной соляной кислоте, имеет сравнительно хорошую электропроводность и невысокую стоимость [22]. [c.286]
Определение чисел переноса важно для проверки теории межионного взаимодействия, а также в связи с практическим применением чисел переноса в изучении электропроводности и электродвижущих сил. [c.369]
Практическое применение величин электропроводности растворов. Кондуктометрическое титрование [c.275]
Практическое применение находят почти все металлы или в чистом виде, или в виде сплавов друг с другом. Их использование определяется свойствами самих металлов и сплавов. Наиболее широко применяют железо и алюминий, а также их сплавы (главы IX и X). Чистая медь имеет большую электропроводность, уступающую только серебру, и применяется для изготовления электрических проводов и радиотехнической аппаратуры. Сплавы меди с цинком называют томпаками (до 10% 2п) или латунями (10—40% 2п), а с другими металлами — бронзами. Алюминиевые бронзы (5—11% А1) обладают высокой коррозионной стойкостью и золотистым блеском служат для изготовления лент, пружин, шестерен и художественных изделий. Кремнистые бронзы (4—5% 51) обладают высокими механическими и антикоррозионными свойствами. Их применяют в химической промышленности для изготовления сеток, проводов, трубопроводов. [c.131]
Практическое применение электропроводности [c.395]
Описанное явление имеет важное практическое применение когда производится прядение волокон, особенно искусственных, возникают заряды статического электричества, которые запутывают волокна. При повышении электропроводности воздуха, электростатические заряды быстро стекают с волокон, не накапливаясь на них и не вызывая их спутывания. Таким нейтрализатором статических зарядов н служит радиоактивный препарат, ионизирующий окружающий его воздух и способствующий увеличению его электропроводности. [c.218]
Вещества, которые во всей УФ-области обладают небольшим коэффициентом экстинкции, часто необходимо вводить в высокой концентрации, для того, чтобы получить сигнал этого соединения в детекторе. Однако для такой пробы разделительная система часто бывает перегружена и интенсивность пиков так мала, что невозможно практическое применение такого разделения. Существенно чувствительнее такие вещества могут анализироваться при использовании других принципов детектирования (детектирование по электропроводности, потенциометрическое детектирование). Но поскольку до настоящего времени нет других детекторов для рутинных исследований в коммерческих приборах КЭ, непрямое Уф-детектирование в КЭ имеет особенное значение. [c.53]
Практическое применение измерений электропроводности [c.268]
Электропроводность металлов, имеющих наибольшее практическое применение, убывает в следующем ряду серебро> > медь> алюминий > цинк > железо> свинец. Т еплопроводность изменяется примерно в той же последовательности. При повышении температуры усиливаются колебания в кристалличе- [c.166]
Известны работы, посвященные электролизу солей рзэ в неводных средах [629, 1124, 1478, 1479]. При этом обнаружено, что из спиртовых сред, пиридина, этилендиамина элементы выделяются в металлическом состоянии на катоде. Такие осадки сильно загрязнены органическими продуктами восстановления, и выделение металла из-за малой электропроводности среды далеко неполное. Поэтому последние способы и не нашли практического применения. [c.147]
С повышением температуры электропроводность увеличивается. При данной температуре удельная электропроводность разбавленных растворов приблизительно пропорциональна концентрации электролита. Это позволяет пользоваться кондуктометрическими измерениями для аналитических определений. Практическое применение этого метода ограничено тем, что электропроводность зависит не только от концентрации определяемого вещества, но и от концентрации ионов всех веществ, присутствующих в исследуемом растворе. [c.328]
При практическом применении формул электропроводности гетерогенных систем следует иметь в виду, что они справедливы для постоянного тока и переменного тока низкой частоты. При высокочастотных полях следует учитывать также электрическую емкость частиц дисперсной фазы [232]. [c.113]




 Амперометрический датчик
Амперометрический датчик