Получение водорода электролизом воды.
Электролиз воды один из наиболее известных и хорошо исследованных методов получения водорода. Он обеспечивает получение чистого продукта (99,6-99,9%H2 ) в одну технологическую ступень. В производственных затратах на получение водорода стоимость электрической энергии составляет примерно 85%.
Электролиз воды один из наиболее известных и хорошо исследованных методов получения водорода [433]. Он обеспечивает получение чистого продукта (99,6—99,9 % Н2) в одну технологическую ступень. Экономика процесса в основном зависит от стоимости электроэнергии. В производственных затратах на получение водорода стоимость электрической энергии составляет примерно 85 % .
Этот метод получил применение в ряде стран, обладающих значительными ресурсами дешевой гидроэнергии. Наиболее крупные электрохимические комплексы находятся в Канаде, Индии, Египте, Норвегии, но созданы и работают тысячи более мелких установок во многих странах мира. Важен этот метод и потому, что он является наиболее универсальным в отношении использования первичных источников энергии. В связи с развитием атомной энергетики возможен новый расцвет электролиза воды на базе дешевой электроэнергии атомных электростанций. Ресурсы современной электроэнергетики недостаточны для получения водорода в качестве продукта для дальнейшего энергетического использования. Если электроэнергию получать за счет наиболее дешевой атомной энергии, то при КПД процесса получения электроэнергии, равном 40 % (в случае быстрых реакторов-размножителей) и КПД процесса получения водорода электролизом даже 80 %, полный КПД электролизного процесса составит 0,8-0,4 = 0,32, или 32 %. Далее, если предположить, что электроэнергия составляет 25 % полного производства энергии, а 40 % электроэнергии расходуется на электролиз, тогда вклад этого источника в общее энергообеспечение составит в лучшем случае 0,25Х X 0,4-0,32 = 0,032, или 3,2%. Следовательно, электролиз воды, как метод получения водорода для энергоснабжения может рассматриваться в строго ограниченных рамках. Однако как метод получения водорода для химической и металлургической индустрии его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
Электролиз с успехом может быть использован на гидростанциях или в тех случаях, когда тепловые и атомные электростанции имеют избыточные мощности, и получение водорода является средством для использования, хранения и накопления энергии. Для этой цели могут быть использованы мощные электролизеры производительностью до 1 млн. м
Электрохимический метод получения водорода из воды обладает следующими положительными качествами: 1) высокая чистота получаемого водорода – до 99,99% и выше; 2) простота технологического процесса, его непрерывность, возможность наиболее полной автоматизации, отсутствие движущихся частей в электролитической ячейке; 3) возможность получения ценнейших побочных продуктов – тяжелой воды и кислорода; 4) общедоступное и неисчерпаемое сырье – вода; 5) гибкость процесса и возможность получения водорода непосредственно под давлением; 6) физическое разделение водорода и кислорода в самом процессе электролиза.
Во всех процессах получения водорода разложением воды в качестве побочного продукта будут получаться значительные количества кислорода. Это даст новые стимулы его применения. Он найдет свое место не только как ускоритель технологических процессов, но и как незаменимый очиститель и оздоровитель водоемов, промышленных стоков. Эта сфера использования кислорода может быть распространена на атмосферу, почву, воду. Сжигание в кислороде растущих количеств бытовых отходов сможет решить проблему твердых отбросов больших городов.
Еще более ценным побочным продуктом электролиза воды является тяжелая вода – хороший замедлитель нейтронов в атомных реакторах. Кроме того, тяжелая вода используется в качестве сырья для получения дейтерия, который в свою очередь является сырьем для термоядерной энергетики.
Электролитическое разложение воды.
2 H2O = 2 H2 + O2
Получающийся при электролизе водород очень чист, если не считать примеси небольших количеств кислорода, который легко удалить пропусканием газа над подходящими катализаторами, например над слегка нагретым палладированным асбестом. Поэтому его используют как для гидрогенизации жиров, так и для других процессов каталитического гидрирования. Водород, получаемый этим методом довольно дорог.
Дата добавления: 2016-10-26; просмотров: 12924;
Похожие статьи:
Водородная вода своими руками. Получение водорода электролизом воды
Удорожание энергоносителей стимулирует поиск более эффективных и дешевых видов топлива, в том числе на бытовом уровне. Более всего умельцев – энтузиастов привлекает водород, чья теплотворная способность втрое превышает показатели метана (38.8 кВт против 13.8 с 1 кг вещества). Способ добычи в домашних условиях, казалось бы, известен – расщепление воды путем электролиза. В действительности проблема гораздо сложнее. Наша статья преследует 2 цели:
- разобрать вопрос, как сделать водородный генератор с минимальными затратами;
- рассмотреть возможность применения установки для отопления частного дома, заправки авто и в качестве сварочного аппарата.
Краткая теоретическая часть
Водород, он же hydrogen, – первый элемент таблицы Менделеева – представляет собой легчайшее газообразное вещество, обладающее высокой химической активностью. При окислении (то бишь, горении) выделяет огромное количество теплоты, образуя обычную воду. Охарактеризуем свойства элемента, оформив их в виде тезисов:
Для справки. Ученые, впервые разделившие молекулу воды на hydrogen и oxygen, назвали смесь гремучим газом из-за склонности к взрыву. Впоследствии она получила название газа Брауна (по фамилии изобретателя) и стала обозначаться гипотетической формулой ННО.

Из вышесказанного напрашивается следующий вывод: 2 атома водорода легко соединяются с 1 атомом кислорода, а вот расстаются весьма неохотно. Химическая реакция окисления протекает с прямым выделением тепловой энергии в соответствии с формулой:
2h4 + O2 → 2h4O + Q (энергия)
Здесь кроется важный момент, который пригодится нам в дальнейшем разборе полетов: hydrogen вступает в реакцию самопроизвольно от возгорания, а теплота выделяется напрямую. Чтобы разделить молекулу воды, энергию придется затратить:
2h4O → 2h4 + O2 — Q
Это формула электролитической реакции, характеризующая процесс расщепления воды путем подведения электричества. Как это реализовать на практике и сделать генератор водорода своими руками, рассмотрим далее.
Создание опытного образца
Чтобы вы поняли, с чем имеете дело, для начала предлагаем собрать простейший генератор по производству водорода с минимальными затратами. Конструкция самодельной установки изображена на схеме.

Из чего состоит примитивный электролизер:
- реактор – стеклянная либо пластиковая емкость с толстыми стенками;
- металлические электроды, погружаемые в реактор с водой и подключенные к источнику электропитания;
- второй резервуар играет роль водяного затвора;
- трубки для отвода газа HHO.
Важный момент. Электролитическая водородная установка работает только от постоянного тока. Поэтому в качестве источника питания применяйте сетевой адаптер, автомобильное зарядное устройство или аккумулятор. Электрогенератор переменного тока не подойдет.
Принцип работы электролизера следующий:
Чтобы своими руками сделать показанную на схеме конструкцию генератора, потребуется 2 стеклянных бутылки с широкими горлышками и крышками, медицинская капельница и 2 десятка саморезов. Полный набор материалов продемонстрирован на фото.

Из специальных инструментов потребуется клеевой пистолет для герметизации пластиковых крышек. Порядок изготовления простой:
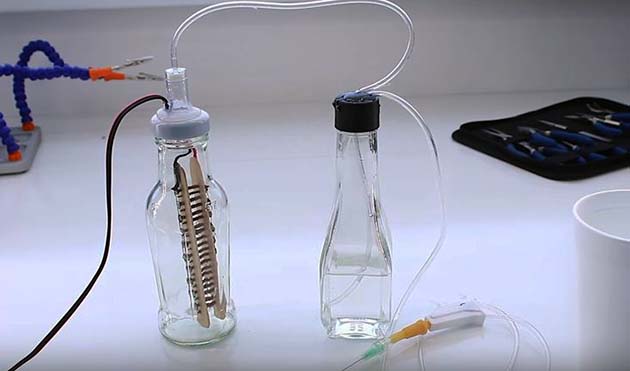
Для запуска генератора водорода налейте в реактор подсоленную воду и включите источник питания. Начало реакции ознаменуется появлением пузырьков газа в обеих емкостях. Отрегулируйте напряжение до оптимального значения и подожгите газ Брауна, выходящий из иглы капельницы.
Второй важный момент. Слишком высокое напряжение подавать нельзя — электролит, нагревшийся до 65 °С и более, начнет интенсивно испаряться. Из-за большого количества водяного пара разжечь горелку не удастся. Подробности сборки и запуска импровизированного водородного генератора смотрите на видео:
О водородной ячейке Мейера
Если вы сделали и испытали вышеописанную конструкцию, то по горению пламени на конце иглы наверняка заметили, что производительность установки чрезвычайно низкая. Чтобы получить больше гремучего газа, нужно изготовить более серьезное устройство, называемое ячейкой Стэнли Мейера в честь изобретателя.
Принцип действия ячейки тоже основан на электролизе, только анод и катод выполнены в виде трубок, вставляющихся одна в другую. Напряжение подается от генератора импульсов через две резонансные катушки, что позволяет снизить потребляемый ток и увеличить производительность водородного генератора. Электронная схема устройства представлена на рисунке:
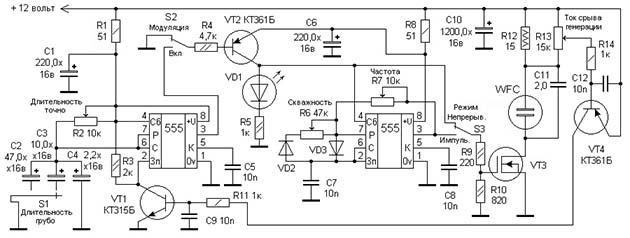
Примечание. Подробно о работе схемы рассказывается на ресурсе http://www.meanders.ru/meiers8.shtml.
Для изготовления ячейки Мейера потребуется:
- цилиндрический корпус из пластмассы или оргстекла, умельцы нередко используют водопроводный фильтр с крышкой и патрубками;
- трубки из нержавеющей стали диаметром 15 и 20 мм длиной 97 мм;
- провода, изоляторы.

Нержавеющие трубки крепятся к основанию из диэлектрика, к ним припаиваются провода, подключаемые к генератору. Ячейка состоит из 9 или 11 трубок, помещенных в пластиковый либо плексигласовый корпус, как показано на фото.

Соединение элементов производится по всем известной в интернете схеме, куда входит электронный блок, ячейка Мейера и гидрозатвор (техническое название – бабблер). В целях безопасности система снабжена датчиками критического давления и уровня воды. По отзывам домашних умельцев, подобная водородная установка потребляет ток порядка 1 ампера при напряжении 12 В и обладает достаточной производительностью, хотя точные цифры отсутствуют.
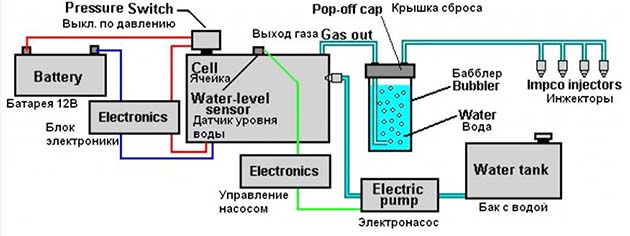 Принципиальная схема включения электролизера
Принципиальная схема включения электролизераРеактор из пластин
Высокопроизводительный генератор водорода, способный обеспечить работу газовой горелки, выполняется из нержавеющих пластин размером 15 х 10 см, количество – от 30 до 70 шт. В них просверливаются отверстия под стягивающие шпильки, а в углу выпиливается клемма для присоединения провода.

Кр
Водород, получение электролизом воды — Справочник химика 21
Наиболее простым в техническом исполнении и уже реализованным в промышленности способом получения водорода является электролиз воды, который имеет три модификации [c.130]Процесс получения водорода методом электролиза воды является пожаро- и взрывоопасным. Опасность аварий, взрывов и пожаров может возникнуть при нарушениях технологического режима, утечках электролитических газов — водорода и кислорода, их смешении в коллекторах и внутри аппаратов во взрывоопасных соотношениях при проникновении водорода в кислород и кислорода в водород. Входящие в состав производства помещения электролиза воды, очистки и осушки водорода, наружные установки водорода (мокрые газгольдеры), отделения компрессии, наполнения и склады баллонов водорода по степени пожаро- и взрывоопасности относятся к категории А. [c.61]
ПОЛУЧЕНИЕ ВОДОРОДА, КИСЛОРОДА ЭЛЕКТРОЛИЗОМ ВОДЫ. ПОЛУЧЕНИЕ ТЯЖЕЛОЙ ВОДЫ [I, 2] [c.8]
Опасности производства ТИБА обусловлены характерными свойствами применяемых и перерабатываемых продуктов, полупродуктов и готового продукта. Особую пожаро- и взрывоопасность представляет процесс получения водорода методом электролиза воды. Опасность аварии, взрывов и пожаров может возникнуть при нарушении технологического режима, утечках электролитических газов — водорода и кислорода, их смешении в коллекторах. и внутри аппаратов до взрывоопасных соотношений. [c.152]
На рис. 289 представлена схема установки для выделения дейтерия из водорода, полученного электролизом воды с колонной однократной ректификации. [c.413]
Производство водорода, необходимого для выработки аммиака, на базе других источников сырья по сравнению с природным и коксовым газом обходится дороже, например себестоимость водорода, вырабатываемого на базе газификации угля и кокса, примерно в 1,5 раза выше, чем водорода из коксового газа. Водород, полученный электролизом воды, по ориентировочным подсчетам на 25—30% дороже, чем получаемый из коксового газа. [c.54]
Устройства для получения водорода путем электролиза воды имеют большие размеры и доро-ги.-Электролизер этого типа представлен на рис. 111-3. Колонна для синтеза аммиака (рис. 111-4), содержащая катализатор, из-за высоких давлений, при которых проходит реакция, имеет толстую стенку, тяжела и дорога. [c.55]
Применение водорода в качестве моторного топлива для автомобильных двигателей в значительной мере определяется возможностью его получения в больших количествах при затратах на единицу энергии, сопоставимых с затратами, имеющими место при получении современных высокооктановых бензинов. В этом направлении в большинстве высокоразвитых стран ведутся интенсивные поиски высокоэффективных способов получения водорода. Ближайшей промышленной перспективой производства водорода будет его получение путем газификации углей. Объясняется это тем, что запасы углей достаточно велики и их использование путем газификации наиболее целесообразно как с экономической, так и с экологической точек зрения. Наиболее распространенным методом газификации углей является процесс Лурги — газификация под давлением в стационарном слое на парокислородном дутье. Перспективным также представляется способ получения водорода из воды в термохимических замкнутых циклах с использованием низкопотенциального тепла ядерных реакторов. Важное место в получении водорода отводится электролизу воды путем использования избыточной мощности электростанций в периоды их минимальной загрузки. Такое комбинирование электроэнергетики с системой производства и аккумулирования водорода позволит использовать электростанции в экономичном [c.6]
Затраты иа производство электролитического водорода в наибольшей степени зависят от стоимости электроэнергии. При получении ее на базе органического топлива в современных условиях себестоимость электролитического водорода примерно в два раза превышает себестоимость его получения газификацией угля и в четыре раза — паровой конверсией природного газа [142]. Поэтому главным фактором снижения стоимости водорода, получаемого электролизом воды, в перспективе может стать получение дешевой электроэнергии, вырабатываемой на АЭС, особенно в период провальных нагрузок. [c.131]
Физические свойства. Отсутствие у водорода цвета, запаха наблюдается учениками при получении- водорода однако в связи с содержанием в цинке примесей получаемый обычным способом водород имеет неприятный вкус и запах. Поэтому лучше брать водород, полученный электролизом воды или очищенный пропусканием через щелочной раствор перманганата калия. [c.93]
Этот метод обработки воды рекомендуется использовать на предприятиях химической промышленности, располагающих водородом или имеющих установки для получения водорода методом электролиза воды. С помощью десорбционного обескислороживания концентрация кислорода в воде может быть снижена до 0,0—0,1 мг/л [14]. [c.120]
Рассмотрим, например, получение водорода путем электролиза воды. Получаемый этим способом водород используется в основном для синтеза аммиака и гидрогенизации жиров — переработке жидких растительных и животных масел в маргарин. Подсчитано, что на 1 г аммиака расходуется свыше 2000 водорода. Отсюда понятны громадные мощности современных заводов по электролизу воды. Достаточно сказать, что только один завод компании Порск-Гидро в Норвегии потребляет около 25 млн квт-ч электрической энергии в сутки. [c.29]
М/4,2 ГДж перерабатываемой нефти). На рис. 11.9 представлено изменение себестоимости водорода, получаемого термохимическим разложением воды, в зависимости от стоимости используемого тепла атомного реактора для указанных вариаций удельных капитальных вложений в атомно-водородный комплекс. Как видно из рисунка, стоимость водорода, полученного электролизом и при таком варьировании капитальных вложений остается самой высокой. [c.598]
Новые возможности получения водорода методом электролиза воды 303 [c.4]
Кормовой белок таким способом получают из источника, полностью независимого от сельского хозяйства. Микробиологический синтез привлекает исследователей и потому, что он пригоден как метод получения белков для космонавтов при их длительном пребывании в космосе. Водород в этих условиях может быть получен электролизом воды. Кислород будет использован для дыхания космонавтов, а выдыхаемый диоксид у
Расчет установки для получения водорода электролизом воды
из «Методы расчетов по технологии связанного азота»
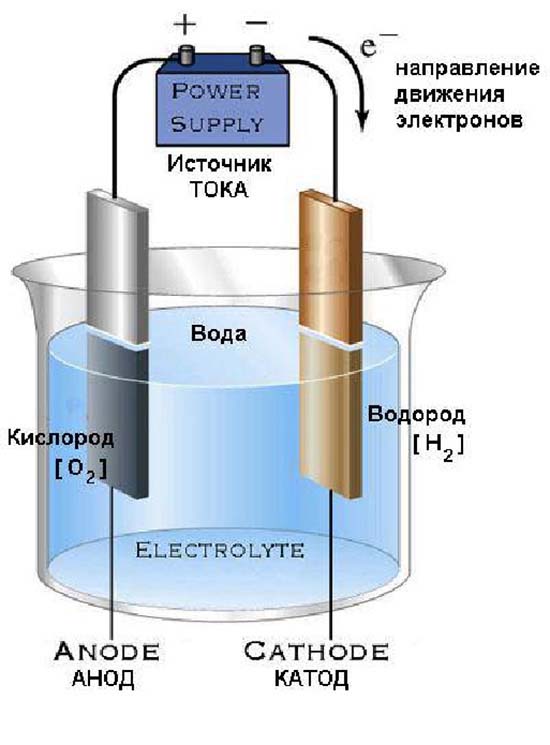
При пропускании через электролит постоянного электрического тока гидроксильные ионы, заряженные отрицательно (ОН -анионы), движутся к положительному полюсу, к аноду, а положительно заряженные водородные ионы (Н+-катионы) движутся к отрицательному полюсу, к катоду (рис. 6). [c.84]Для осуществления процесса электролиза воды необлодимо создать определенное напряжение (теоретический потенциал разложения электролита) и известное перенапряжение для преодоления сопротивления электролитической ванны. [c.85]
Теоретическое напряжение для электролиза воды будет равно электродвижущей силе обратимо работающего гальванического элемента с образованием воды, у которого анодом служит кислород, а катодом — водород. Возникающая при этом электродвижущая сила равна 1,23 вольта. [c.85]
Для расчета примем ванну с биполярными электродами, работающую при малой силе тока и большом напряжении. [c.87]
Электродами служат металлические пластины, которые чередуются с диафрагмами, зажатыми в рамах, имеющих форму Л . Все рамы зажимаются стягивающими болтами. Электрический ток подводится к крайним рамам. Вследствие деполяризации одна сторона электрода является анодом, а другая катодом. Электролизер заполняется электролитом. Кислород выделяется у анодной части электродной пластины, а водород — у противоположной, катодной части пластины. [c.87]
Общий вид электролизера приведен на рис. 7. [c.87]
Выделяющиеся из ячеек водород и кислород собираются соответственно в газосборниках, расположенных над электролизером в виде горизонтальных цилиндров. Подача дистиллированной воды производится через изоляционные фонари. Электролизер расположен на фарфоровых изоляторах. [c.87]
Исходя из данных об электропроводимости электролитов, приведенных на рис. 8 и 9, обычно применяют в качестве электролита едкий калий. Наименьшим сопротивлением и, следовательно, наибольшей электропроводимостью обладает 30-процентный раствор едкого калия. С повышением температуры электролита электропроводимость его увеличивается примерно на 2% на каждый градус. [c.88]
Температурный градиент электропроводимости для 25,21% КОН составляет 0,0209 и для 29,4% КОН —0,021. [c.88]
Исходя из этого, электролиз необходимо вести при повышенных температурах порядка 75—80°, но не выше, так как одновременно возрастает коррозия аппаратуры, электродов и диафрагм. Желательно, чтобы расстояние между электродными пластинами было минимальным, и выбор его диктуется конструктивными соображениями. В действующих электролизерах это расстояние составляет 20— 0 мм. Б качестве диафрагмы применяется асбестовое полотно с вплетенными в его нити никелевыми проволочками. Увеличение толщины и плотности диафрагмы дает возможность получать более чистый водород и кислород, но одновременно увеличивается сопротивление. [c.88]
Значения перенапряжения водорода или потенциала железного катода при различных плотностях тока в концентрированном растворе едкого калия приведены в таблице 24. [c.89]
Значения перенапряжения кислорода или потенциала стального никелированного анода при различных плотностях тока в нормальном растворе едкого калия приведены в таблице 25. [c.89]
Хомяков, В. П. Машовец, Л. Л. Кузьмин. Технология электрохимических производств. Госхимиздат, 1949. [c.90]
Ж- Биллитер. Промышленный электролиз водных растворов. Госхимиздат. 1959. [c.90]
Вернуться к основной статье



