Электролиз. Электролиз растворов. Электролиз расплавов
Электролиз — это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз — это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать — рассказано дальше) и, конечно, электролит. Электролит — это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие — в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно — анод. Электрод, заряженный отрицательно — катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
В домашних условиях, из тех веществ, что имеются практически у каждого, можно без труда получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щёлочь! Но будьте осторожны с хлором — этот газ ядовит!
Первый опыт проведём с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (можно взять кальцинированную соду), опустите туда электроды и включите источник питания. Как только ток пойдёт через раствор, сразу станут заметны пузырьки газа, которые образуются у электродов: у «+» будет выделяться кислород, у «-» водород.
Именно такое распределение газов происходит из-за того, что возле анода «+» происходит скопление отрицательных ионов OH—, и восстановление кислорода, а возле катода «-» скапливаются ионы щелочного металла, которые содержатся в кальцинированной соде (Na Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Li <K <Rb <Cs <Ba <Ca <Na <Mg <Al <Mn <Cr <Zn <Fe <Cd <Co <Ni <Sn <Pb <h3 <Cu <Ag <Hg <Pt <Au
В следующем опыте по электролизу будем получать чистую медь (Cu).
Для этого нам потребуется раствор медного купороса CuSO4, который содержит растворённую медь. Медь стоит в ряду напряжений металлов после водорода, поэтому она и будет выделятся на электроде.
Приготовьте раствор медного купороса, опустите в него электроды и включите источник питания. Как и в предыдущем опыте с раствором кальцинированной соды, на адоде «+» будет восстанавливаться кислород. В то же время катод «-» будет покрываться тёмно-красным слоем меди, которая восстанавливается из раствора до чистого металла.
Мы провели 2 опыта по электролизу растворов и можем подвести результат:
При пропускании тока через раствор на положительном электроде — аноде — восстанавливаются отрицательно заряженные ионы (в нашем случае — кислород). Отрицательно заряженные ионы ещё называют
Проведём ещё один опыт по электролизу. На этот раз мы будем пропускать ток через раствор поваренной соли (NaCl).
Но должен заранее предупредить, этот электролиз нужно проводить в хорошо проветриваемой комнате, так как выделяемый из раствора чистый газ — хлор (Cl2) очень токсичен. Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:
Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:
Электролиз раствора поваренной соли. Схема сбора газа
Итак, начнём. Приготовьте раствор поваренной соли (NaCl). К положительному полюсу источника питания подключите инертный электрод (например — графитовый стержень), к отрицательному — подойдёт любой материал, проводящий ток. Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода («+»). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте «нюхать»его в банке — можно сильно отравится! (Статья о хлоре).
На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H
Электролиз расплавов
При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ — хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл — натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы. Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Урок по химии «Электролиз»
Цель урока: сформировать у учащихся понятие процесса электролиза.
Задачи урока:
- Сформировать умение определять процессы,
происходящие на электродах, составлять
суммарное уравнение реакции электролиза.

- Развивать у школьников умение пользоваться опорными знаниями, составлять конспект урока.
- Углубить знание окислительно-восстановительных процессов, сформировать понимание практического значение электролиза в природе и жизни человека.
- Развивать мышление, умение делать логические выводы из наблюдений по опыту.
- Закрепить умения и навыки химического эксперимента, умение работать с таблицами, справочными материалами, дополнительной литературой, опорными схемами.
Оборудование: таблица растворимости,
индикаторная шкала, штатив с пробирками,
растворы фенолфталеина, сульфата меди (II),
хлорида натрия, хлорида алюминия, прибор для
определения электропроводимости растворов,
толстостенные химические стаканы, опорные схемы
урока, физическая карта России, плакаты
“Электролиз водных растворов”, “Применение
электролизов”.
Эпиграф: “Открытия в области электрохимии представляют собой одну из самых больших революций в химии и открывают эру новых открытий” (Джон Фредерик Даниэль, английский электрохимик).
Ход урока
1. Постановка проблемы.
Наш сегодняшний урок мне хотелось бы начать с античной легенды:
“Некий мастер, имя которого история не сохранила, принес римскому императору Тиберию, правившему в начале I века н.э., чашу из металла, напоминающего серебро, но только более легкого. Подарок стоил жизни изобретателю: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро императорской сокровищницы”. Согласно рассказу Плиния Старшего, этот металл, похожий на серебро, был получен из “глинистой земли ”.
Но история не знает безвозвратных потерь. В 1827
году немецкий ученый Фридрих Вёлер получает
несколько граммов, а через несколько лет уже
несколько килограммов нового легкого, прочного,
блестящего металла.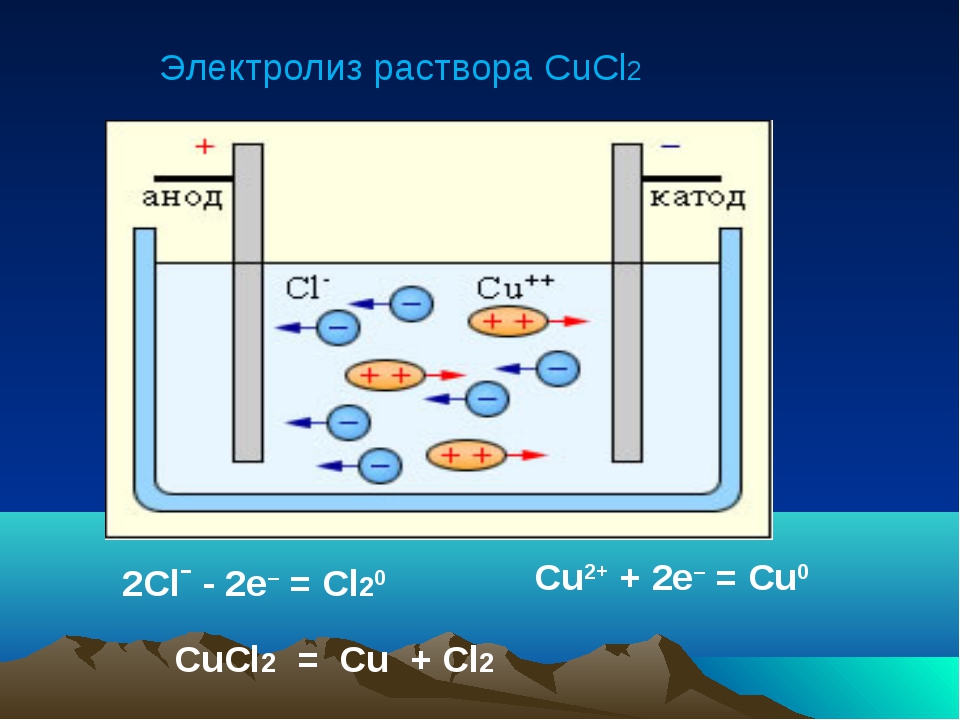 Но металл стоил также дорого,
как серебро. Французы изготовили из него кирасы
охранникам императора и игрушку наследнику Его
Величества. В этом ларце находиться изделие из
этого металла. Оно необходимо каждому из нас. Что
же находиться в ларце? (Ответивший на вопрос
ученик достает из ларца алюминиевую ложку.)
Но металл стоил также дорого,
как серебро. Французы изготовили из него кирасы
охранникам императора и игрушку наследнику Его
Величества. В этом ларце находиться изделие из
этого металла. Оно необходимо каждому из нас. Что
же находиться в ларце? (Ответивший на вопрос
ученик достает из ларца алюминиевую ложку.)
Кстати, в 1852 году это чайная ложечка весом 25 грамм стоила бы 30 долларов.
Послушаем сообщение о стоимости алюминия в 19 веке, о работах Фридриха Вёлера и Чарльза Холла.
Учащийся выступает с сообщением.
Найдем на географической карте России центры получения алюминия.
Учащиеся называют города Волгоград и Красноярск.
Почему же именно в этих городах расположены крупнейшие заводы по производству алюминия?
Учащиеся констатируют факт расположения
заводов по производству алюминия вблизи крупных
электростанций.
Таким образом, мы пришли к выводу, что для получения алюминия необходимы значительные затраты электроэнергии, и в записи уравнения реакции получения алюминия по способу Чарльза Холла не хватает знака “” — знака электролиза.
Сегодня мы вторгаемся в область электрохимии и рассмотрим явление электролиза. Запишем тему урока.
2. Основная часть.
Вопрос: “Что же называется электролизом ?”.
“Электро” – электрический ток, “лизис” – разложение.
Делается вывод, что электролиз – это процесс, в результате которого происходит разложение вещества под действием постоянного электрического тока.
Разложить можно практически любое вещество, поместив его в электролизер. Но в каком виде? Обычно в жидком, т.е. в виде раствора.
На плакате изображено, что в раствор
электролита опускаются электроды, соединенные с
источником постоянного электрического тока. Отрицательно заряженный электрод называется
катод и условно обозначается К (-). Положительно
заряженный электрод называется анод и
обозначается А (+). В межэлектродном пространстве
находится диссоциирующий на ионы электролит.
Катионы, заряженные положительно, перемещаются в
сторону катода, а анионы, заряженные
положительно, в сторону анода. На катоде будет
происходить электрохимическое восстановление
катионов или молекул воды, а на аноде
электрохимическое окисление анионов или молекул
воды.
Отрицательно заряженный электрод называется
катод и условно обозначается К (-). Положительно
заряженный электрод называется анод и
обозначается А (+). В межэлектродном пространстве
находится диссоциирующий на ионы электролит.
Катионы, заряженные положительно, перемещаются в
сторону катода, а анионы, заряженные
положительно, в сторону анода. На катоде будет
происходить электрохимическое восстановление
катионов или молекул воды, а на аноде
электрохимическое окисление анионов или молекул
воды.
Дается определение: электролиз – совокупность окислительно-восстановительных процессов, протекающих в электролитах при пропускании постоянного электрического тока.
Данный прибор имитирует работу электролизера. Он поможет нам выполнить тестовое задание, текс которого находиться у вас на столах :
Задача.
При электролизе раствора какой соли можно
одновременно получить 0,2 моль нерастворимого
основания и 13,44 л газообразных продуктов (н.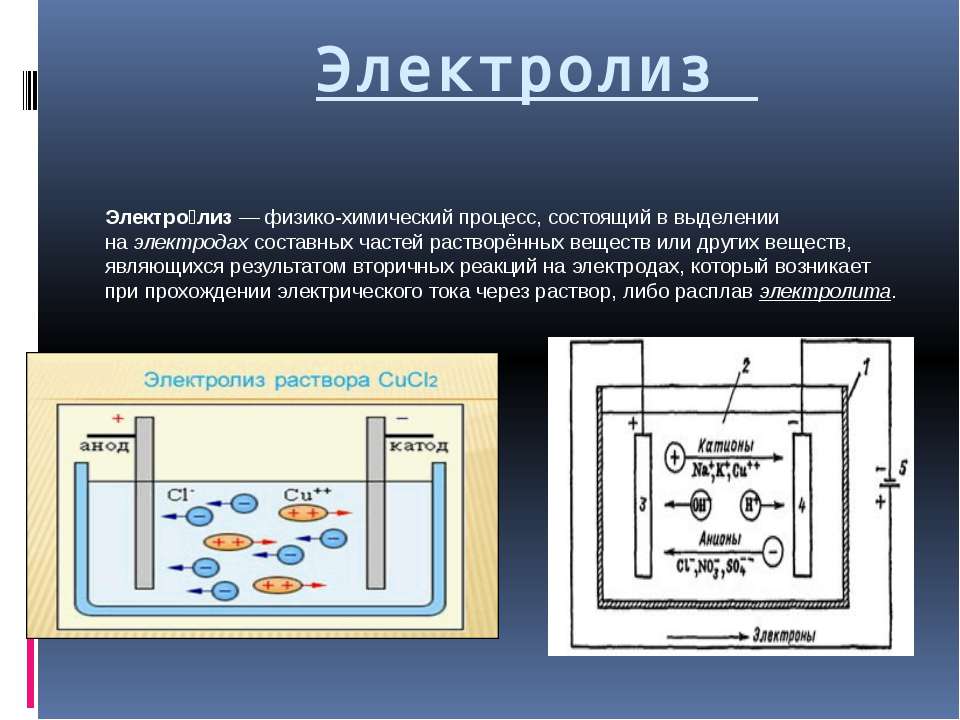 у.)?
Напишите уравнения процессов, происходящих на
электродах в ионной и молекулярной формах:
у.)?
Напишите уравнения процессов, происходящих на
электродах в ионной и молекулярной формах:
1) CuSO4;
2) NaCl;
3) AlCl3.
(ВолгГТУ, 2004 год.)
Определим соотношение количеств газообразных продуктов и нерастворимого основания, выполним предварительные расчеты:
v (осадка) = 0,2 моль
V (газов) = 13,44 л
v (газов): v (осадка) = ?
v (газов) =V(газов) : Vm = 13.44 : 22,4 = 0,6 моль
v (газов): v (осадка) = 0,6 : 0,2 = 6 : 2 = 3 : 1
Из текста задания ясно, что нам необходимо составить уравнения электролиза растворов, определить катодные и анодные процессы, выполнить необходимые расчеты. Кто первый хочет попробовать выполнить задание п. а)?
Напишем сначала процесс электролитической диссоциации, происходящий в данном растворе.
А) CuSO4 —>Cu2+ + SO42-
Катион меди (II) будет перемещаться в сторону
катода.
Но поскольку в околокатодном пространстве будут находиться также молекулы воды, то мы запишем это таким образом:
К(-) Cu2+
H2O
Пользуясь опорным конспектом [приложение № 1], определите катион меди (II) или молекулы воды будут восстанавливаться на поверхности катода?
Катион Cu2+ входит в 3 группу катионов и он будет восстанавливаться. Вода восстановлению в данном случае не подвергается:
К(-) Cu2+ + 2 е Cu0
H2O
Определим теперь процессы, происходящие на аноде.
Сульфат – анион будет перемещаться в сторону анода, в околоанодном пространстве будут так же находиться молекулы воды:
А (+) SO42-
H2O
На аноде будет происходить электрохимическое окисление молекул воды, так как анион SO42 является анионом кислотного остатка оксокислоты и окислению не подвергается (1 группа анионов):
А (+) SO42-
2H2O- 4 е —>О20 + 4Н+
Определим соотношение коэффициентов так же, как в обычном электронном балансе:
К(-) Cu2+ + 2 е —>Cu0 (2)
H2O
А (+) SO42-
2H2O- 4 е —>О20 + 4Н+ (1)
Составим электронно-ионное уравнение, с учетом коэффициентов:
2Cu2+ +2H2O —> 2Cu0 + О20 + 4Н+
Полное электронно-ионное уравнение напишем с учетом ионов, не участвовавших в окислительно-восстановительном процессе:
2Cu2+ +2H2O + 2 SO42 —> 2Cu0 + О20 + 4Н+ + 2 SO42
Теперь мы легко напишем суммарное уравнение электролиза, не забыв поставить знак электролиза:
2CuSO4 + 2 H2O —> O2 + 2Cu + 2H2SO4
Получился ли в результате реакции осадок?
Определите это с помощью таблице растворимости.
В результате реакции электролиза осадок не образовался.
Может быть выделился газ?
В околоанодном пространстве происходит выделение кислорода.
Проверим это опытным путем – проведем электролиз водного раствора сульфата меди (II). Что вы наблюдаете?
Поверхность одного из электродов покрывается пузырьками газа.
Перейдем к выполнению задания п. б).
NaCl —> Na+ + Cl –
K (-) Na+
2H2O— 2 e —> 2OH – + H2 (2) (1)
A (+)2Cl – — 2 e —> Cl20 (2) (1)
H2O
2H2O + 2Cl – —>2OH – + H2 + Cl2
2Na+ + 2H2O + 2Cl – —>2OH + H2 + Cl20
+ 2Na+
2 NaCl + 2H2O —> 2NaOH + H2 + Cl2
Получились ли теперь осадок и газообразные вещества?
Осадка нет, но в околокатодном пространстве
происходит выделение водорода, а в околоанодном
пространстве – хлора.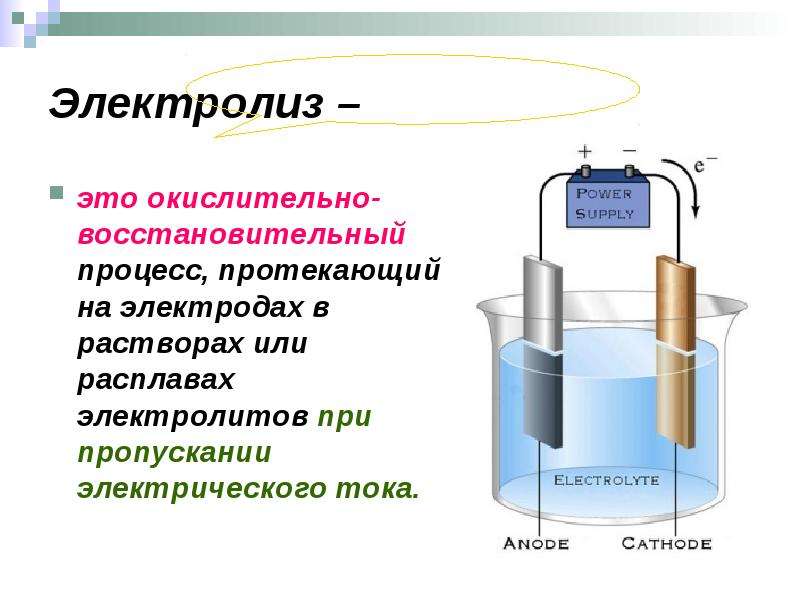
Проверим это опытным путем – проведем электролиз водного раствора хлорида натрия. Что вы наблюдаете?
Поверхность обоих электродов покрывается пузырьками газа, в присутствии фенолфталеина раствор окрашивается в малиновый цвет.
Выполним задание п. в).
AlCl3 —> Al3+ + 3Cl –
K (-) Al3+
2H2O + 2 e 2OH – + H20 (6) (3)
A(+)6Cl – — 6 e —> 3Cl20 (2) (1)
H2O
6H2O + 6Cl — —> 3H2 +6OH – + 3Cl2
6H2O + 6Cl —+2Al3+ —> 3H2 +6OH – +
3Cl2+2Al3+
2AlCl3 + 6H2O —>3H20 +3Cl2 + 2Al(OH)3
С помощью таблицы растворимости определяем,
что вещество Al(OH)3 не растворимо и выпадает
в осадок. В околоанодном пространстве выделяется
газообразный хлор, в околокатодном пространстве
– водород.
В околоанодном пространстве выделяется
газообразный хлор, в околокатодном пространстве
– водород.
Проверим это опытным путем – проведем электролиз водного раствора хлорида алюминия. Что вы наблюдаете?
Происходит помутнение раствора.
По уравнению реакции определяем соотношение количеств газообразных продуктов и осадка.
2AlCl3 + 6H2O —>3H20 +3Cl2 + 2Al(OH)3
6 моль газов 2 моль осадка
v (газов): v (осадка) = 6: 2 = 3 : 1
Это в точности совпадает с нашими расчетами. Значит правильный ответ в этом задании в)
3. Разрешение проблемы.
Мы выполнили с вами задание, но алюминий в
результате электролиза не получили. В качестве
сырья мы должны взять оксид алюминия, в воде не
растворимый. Но электролит в электролизере
должен быть жидким. Как быть?
Как быть?
Сделать расплав.
Обратимся к тексту учебника §18. Какой процесс протекает при электролизе расплава глинозема в криолите?
Al2O3 — 2Al3 + + 3O2 –
K (-) Al3+ + 3 e —> Al0 (4)
A(+) 2O2 – — 4 e —> O02 (3)
4Al3 + + 6O2 — —> 4Al0 + 3O20
2Al2O3 —>4Al + 3O2
Мы рассмотрели с вами химические основы современного промышленного способа получения алюминия.
4. Практическое значение электролиза.
Но только ли для этого необходим электролиз? О практическом значении электролиза послушаем сообщение.
Ученик делает сообщение и выполняет
демонстрационные опыты.
5. Подведение итогов, проверка результативности.
Проверим результативность нашей совместной работы, напишем графический диктант, текст которого вы видите на своих столах :
Графический диктант.
- Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием электрического тока.
- Катод – отрицательно заряженный электрод;
- На катоде происходит процесс электрохимического окисления;
- Анион SO42 – будет окисляться на аноде в водном растворе;
- Анион Cl – будет окисляться на аноде в водном растворе;
- Катион Na + будет восстанавливаться на катоде в водном растворе;
- Катион Cu2 + будет восстанавливаться на катоде в водном растворе;
- Алюминий получают электролизом расплава Al2O3 в криолите;
- При электролизе раствора NaCl можно получить
щелочь NaOH и газы H2 и Cl2.

Ученики заполняют бланк химического диктанта:
Фамилия, имя_______________________________________
1 2 3 4 5 6 7 8 9 10
ДА
НЕТ
Оценка:_______________
Учащимся предлагается поменяться с соседом заполненными бланками, выставить друг другу оценки по оценочной шкале: 5 – 6 правильных ответов – оценка “3”, 7 – 8 правильных ответов – оценка “4”, 9 – правильных ответов – оценка “5”. На доске открывается шаблон с правильными ответами:
Прошу поднять руку тех учеников, которые справились с графическим диктантам на “хорошо” и “отлично”.
6. Домашнее задание.
§18, упражнение № 29, 31, 37(письменно).
Трое учеников получают карточки с дополнительным индивидуальным заданием:
Карточка № 1.
Сколько килограмм алюминия можно получить при электролизе 1 тонны глинозема?
Карточка № 2.
При электролизе раствора какой соли можно одновременно получить 2 моль нерастворимого гидроксида и 44,8 л газообразных продуктов (н.у.)? напишите уравнения процессов, происходящих на электродах в ионной и молекулярной формах:
1) CuCl2;
2) Cu(NO3)2;
3) Mg(NO3)2
ВолгГТУ, 2004 год.
Карточка № 3.
В конце ХХ века появились новые данные о принципиальной возможности получения металлического алюминия в древности. Институт прикладной физики Китайского Академии наук сообщил о результатах исследования гробница полководца Чжоу-Чжу, похороненного в 297 году н.э.. спектральный анализ орнамента, украшающего саркофаг, показал, что он состоит из сплава: 85% алюминия, 10% меди, 5% магния. Анализ повторяли несколько раз. Результаты оказались те же. Как могли древние китайские мастера получить сплав алюминия?
Приложение.
Методика определения количества окисленного металла при электролизе на переменном токе
%PDF-1.6 % 1 0 obj > endobj 5 0 obj /Title >> endobj 2 0 obj > /Encoding > >> >> endobj 3 0 obj > endobj 4 0 obj > stream
Определение толщины диффузионного слоя при электролиз
Определение толщины диффузионного слоя а концентрации электролита у катода при электролизе [c.102]Как уже отмечалось, при достаточно большой величине потенциала электрода скорость электрохимической реакции делается столь высокой, что концентрация деполяризатора у поверхности электрода падает почти до нуля практически сразу же после начала электролиза. Распределение концентрации деполяризатора по расстоянию от поверхности электрода схематически представлено кривой в на рис. 4. Область раствора вблизи электрода, в которой наблюдается пониженная концентрация деполяризатора, называется диффузионным слоем. Толщина диффузионного слоя не имеет строго определенных границ, так как концентрация деполяризатора по мере удаления от поверхности электрода лишь асимптотически приближается к ее величине в объеме раствора. Тем не менее внешней границей диффузионного слоя условно можно считать расстояние от электрода, на котором концентрация деполяризатора достигает, например, 0,99 от ее величины е объеме раствора. [c.16]
Чтобы получить вольт-амперную характеристику, не искаженную влиянием времени электролиза, можно воспользоваться вращающимся дисковым электродом, на котором ток не зависит от времени, или же — при электролизе на неподвижных электродах— сопоставлять между собой значения тока при различных потенциалах д,пя одного и того же момента времени электролиза, т. е. для определенной толщины диффузионного слоя. Однако особенно удобен для этой цели ртутный капельный электрод, на котором кривые зависимости тока от потенциала, называемые поля-рограммами, могут быть сняты на большой серии последовательно образующихся капель, так как все явления обычно идеально воспроизводятся при переходе от одной капли к другой. [c.20]
По мере протекания электролиза граница пониженной концентрации деполяризатора (фронт диффузии) распространяется от электрода в глубь раствора, при этом толщина диффузионного слоя 6 =-у/л 01, как следует из ее определения, растет пропорционально квадратному корню из времени, протекшего от начала электролиза. На рис. 5 видно, что с увеличением времени возрастает наклон начальных участков кривых, т. е. снижается градиент концентрации у электродной поверхности. Это, как следует из уравнений (10) и (И), приводит в рассматриваемом случае (т. е. плоского электрода и полубесконечной линейной диффузии) к уменьшению диффузионного тока, который обратно пропорционален Yt. Действительно, при работе с неподвижными электродами, когда выполняются условия полубесконечной линейной диффузии, наблюдается предсказываемое теорией снижение тока во времени. [c.18]
Коваленко П. Н. Полярографический метод определения константы скорости электролиза и толщины диффузионного слоя при электроосаждении металлов. ЖПХ, 1950, [c.49]
Таким образом, К тем больше, чем больше коэффициент диффузии В деполяризатора, площадь поверхности 5 рабочего электрода и меньше объем V раствора деполяризатора в ячейке и толщина диффузионного слоя 6. Наибольшее влияние на К оказывает увеличение соотношения З/У, это обстоятельство учитывается при определении оптимальных параметров электролиза. Коэффициент В специфичен для каждого деполяризатора, но его вклад в скорости протекания электролиза можно увеличить, уменьшая вязкость раствора, нагреванием и заменой растворителя на менее вязкий (если это допустимо ). Температурный градиент изменения О от t равен приблизительно 2 % на 1 °С. Энергичное, равномерное перемешивание электролизи-руемого раствора также дает положительный эффект, так как заметно уменьшает толщину диффузионного слоя б. [c.13]
Определим исходные количественные соотношения для нахождения искомой связи между Е, С°ох и °Red- Из этих величин одна бывает задана (обычно Е). Для определения других величин нужны, по крайней мере, три уравнения. В качестве одного их них можно использовать уравнение замедленного разряда Батлера-Фольмера (4.63) или уравнение Нернста (4.11), которые для рассматриваемых условий целесообразно представить в несколько ином виде. Для этого примем во внимание тот факт, что при равновесных концентрациях С°ох и °Red у поверхности электрода фарадеевский ток отсутствует, а его появление обусловлено превращением на электроде одной формы электроактивного вещества в другую. Независимо от метода при электролизе объемные концентрации Ох и Red у поверхности электрода (граничные концентрации Сох и С Red) будут отклоняться ОТ СВОИХ равновесных значений в противоположные стороны, т.е. если процесс восстановления превалирует над окислением, то Сох убывает, приводя к увеличению Red, и, наоборот, при преобладании процесса окисления убывает Red, увеличивая Сох- При условии, что толщина диффузионного слоя много меньше радиуса поверхности электрода, получим [c.271]
определение и синонимы слова электролиз в словаре русский языка
ЭЛЕКТРОЛИЗ — определение и синонимы слова электролиз в словаре русский языкаEducalingo использует cookies для персонализации рекламы и получения статистики по использованию веб-трафика. Мы также передаем информацию об использовании сайта в нашу социальную сеть, партнерам по рекламе и аналитике.
ПРОИЗНОШЕНИЕ СЛОВА ЭЛЕКТРОЛИЗ
ЧТО ОЗНАЧАЕТ СЛОВО ЭЛЕКТРОЛИЗ
Электролиз
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита. Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный.Значение слова электролиз в словаре русский языка
ЭЛЕКТРОЛИЗ, -а, м. . Разложение вещества на составные части при прохождении через него электрического тока. || прилагательное электролиз ный, -ая, -ое и электролитический, -ая, -ое.
СЛОВА, РИФМУЮЩИЕСЯ СО СЛОВОМ ЭЛЕКТРОЛИЗ
Синонимы и антонимы слова электролиз в словаре русский языка
Перевод слова «электролиз» на 25 языков
ПЕРЕВОД СЛОВА ЭЛЕКТРОЛИЗ
Посмотрите перевод слова электролиз на 25 языков с помощью нашего многоязыкового переводчика c русский языка. Переводы слова электролиз с русский языка на другие языки, представленные в этом разделе, были выполнены с помощью автоматического перевода, в котором главным элементом перевода является слово «электролиз» на русский языке.Переводчик с русский языка на
китайский язык 电解1,325 миллионов дикторов
Переводчик с русский языка на
испанский язык electrólisis570 миллионов дикторов
Переводчик с русский языка на
английский язык electrolysis510 миллионов дикторов
Переводчик с русский языка на
хинди язык इलेक्ट्रोलीज़380 миллионов дикторов
Переводчик с русский языка на
арабский язык التحليل الكهربائي280 миллионов дикторов
Переводчик с русский языка на
португальский язык eletrólise270 миллионов дикторов
Переводчик с русский языка на
бенгальский язык তড়িদ্বিশ্লেষণ260 миллионов дикторов
Переводчик с русский языка на
французский язык électrolyse220 миллионов дикторов
Переводчик с русский языка на
малайский язык elektrolisis190 миллионов дикторов
Переводчик с русский языка на
немецкий язык Elektrolyse180 миллионов дикторов
Переводчик с русский языка на
японский язык 電気分解130 миллионов дикторов
Переводчик с русский языка на
корейский язык 전기 분해85 миллионов дикторов
Переводчик с русский языка на
яванский язык electrolysis85 миллионов дикторов
Переводчик с русский языка на
вьетнамский язык điện phân80 миллионов дикторов
Переводчик с русский языка на
тамильский язык மின்னாற்பகுப்பு75 миллионов дикторов
Переводчик с русский языка на
маратхи язык विद्युतविघटन75 миллионов дикторов
Переводчик с русский языка на
турецкий язык elektroliz70 миллионов дикторов
Переводчик с русский языка на
итальянский язык elettrolisi65 миллионов дикторов
Переводчик с русский языка на
польский язык elektroliza50 миллионов дикторов
Переводчик с русский языка на
украинский язык електроліз40 миллионов дикторов
Переводчик с русский языка на
румынский язык electroliză30 миллионов дикторов
Переводчик с русский языка на
греческий язык ηλεκτρόλυση15 миллионов дикторов
Переводчик с русский языка на
африкаанс язык elektrolise14 миллионов дикторов
Переводчик с русский языка на
шведский язык elektrolys10 миллионов дикторов
Переводчик с русский языка на
норвежский язык elektrolyse5 миллионов дикторов
Тенденции использования слова электролиз
ТЕНДЕНЦИИ ИСПОЛЬЗОВАНИЯ ТЕРМИНА «ЭЛЕКТРОЛИЗ»
На показанной выше карте показана частотность использования термина «электролиз» в разных странах.
Примеры использования в литературе на русский языке, цитаты и новости о слове электролиз
КНИГИ НА РУССКИЙ ЯЗЫКЕ, ИМЕЮЩЕЕ ОТНОШЕНИЕ К СЛОВУ
«ЭЛЕКТРОЛИЗ» Поиск случаев использования слова электролиз в следующих библиографических источниках. Книги, относящиеся к слову электролиз, и краткие выдержки из этих книг для получения представления о контексте использования этого слова в литературе на русский языке.1
Высокотемпературный электролиз газов:в конце глав
С.В Карпачев, 1988
2
Электролиз воды — Страница 86З.А. Ткачек. С повышением температуры процесса электролиза доля потерь тепла с газами и через стенки ячейки возрастает. При изменении плотности тока изменяются также напряжение и тепловой баланс ячейки. На рис.
З.А. Ткачек, 2013
3
Химия. Полный справочник для подготовки к ЕГЭРостислав Лидин. Раствор МаОН разъедает стекло (образуется Ма5103), корродирует поверхность алюминия (образуются Ма[А](ОН)4] и Н2). Получение МаОН в промышленности: а) электролиз раствора МаС] на инертном …
Ростислав Лидин, 2014
4
Журнал Русскаго физико-химическаго общества при … При электролиз-в бензольнаго комплекса подобныя побочныя явлешя наблюдаются гораздо чаще, ч-вмъ при электролиз* толу- ольнаго. У анода наблюдались слъ-дуюшдя явлешя: при электролиз* толуольнаго комплекса у
Русское физическое общество, 1908
5
Химия в вопросах и ответах. Учебное пособие — Страница 7979 o Zn» + 2e —- Zn 2Н2О — 4е — О, 1 + 4Н» 2Н2О + 2e —+ Н2″ + 2он Н» — NО, —+ Н NО, Zn» + 2ОН — Zn(ОН)2 Таким образом, при электролизе раствора Zn(NОз)» на катоде выделяется водород, а на аноде — кислород, т. е. идет …
Ерохин Ю.М., 2014
6
Современные методы обеззараживания водыПрименяютдва способа электрохимического обеззараживания: получение гипохлорита натрияэлектролизом споследующим введением егов обрабатываемую воду,и непосредственный электролиз обрабатываемойводы.
Елена Хохрякова, 2014
7
Шпаргалка. ХимияЭлектролиз — окислительновосстановительный процесс, проходящий на электродах поддействиемэлектрическоготокав растворахирасплавахэлектролитов. Накатоде(K)(отрицательно заряженном электроде) происходит …
Богомолова И.В., 2012
НОВОСТИ, В КОТОРЫХ ВСТРЕЧАЕТСЯ ТЕРМИН «ЭЛЕКТРОЛИЗ»
Здесь показано, как национальная и международная пресса использует термин электролиз в контексте приведенных ниже новостных статей.Что такое электроэпиляция?
В зависимости от этого может быть выбран определенный метод: термолиз, электролиз, бленд или флеш. Они схожи в одном – использовании … «Вслух.ru, Сен 15»
20:07 В Мурманской области будут получать никель с высшими …
Сейчас она состоит из нескольких стадий, при этом основные — выплавка никелевых анодов и последующий электролиз — в сумме занимают немало … «Телекомпания ТВ-21, Авг 15»
Как отделить драгоценные металлы из радиодеталей
Также отделить ценный материал можно с помощью электролиза. Прием драгоценностей, как и прием черного лома, проводится во многих пунктах. «Командир, Апр 15»
Разработан прибор для производства кислорода из …
Основная часть прибора — камера для электролиза, которая работает параллельно с герметизирующим механизмом, датчиком кислорода и клапаном … «GISMETEO.Новости, Дек 14»
От солнечной энергии к водородному топливу
Выделение водорода из воды методом электролиза (фото: EPFL / LPI / Alain Herzog). Пока специализированные ячейки – перспективная и дорогая … «Компьютерра-Онлайн, Дек 14»
способ получения дизеля из воздуха
Далее осуществляется электролиз воды, в результате чего получаются кислород и водород. Последний вступает в химическую реакцию с двуокисью … «motor.ru, Ноя 14»
Компания Audi научилось производить топливо из воздуха
Далее осуществляется электролиз воды, в результате чего получаются кислород и водород. Последний вступает в химическую реакцию с двуокисью … «bigmir)net, Ноя 14»
Найден способ получения водородного топлива при помощи …
В результате электролиза воды на водород и кислород воду расщепляет электрический ток, от железо-никелевой батареи ААА, протекающий между … «KM.RU, Авг 14»
Топливо из батарейки
Так, классический электролиз воды требует больше энергии, чем окисление метана и очистка синтез-газа от угарного газа. Когда ученые и технологи … «Русская планета, Авг 14»
20:02 Производственные мощности Кольской ГМК посетил …
На мончегорской промплощадке Игорь Рахимов особое внимание уделил объектам капитального строительства в цехе электролиза никеля. С момента … «Телекомпания ТВ-21, Апр 14»
ССЫЛКИ
« EDUCALINGO. Электролиз [онлайн]. Доступно на <https://educalingo.com/ru/dic-ru/elektroliz>. Дек 2021 ».
Электролиз растворов
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ЭЛЕКТРОЛИЗ. Фарадей. Электромагнитная индукция [Наука высокого напряжения]
ЭЛЕКТРОЛИЗ
Благодаря батарейке Вольты химики открыли, что электрический ток протекает вдоль контура по кабелю, идущему от одного полюса батарейки к другому. При этом если кабели на концах контура присоединить к металлическим электродам, погруженным в жидкость, ток пройдет по ней и начнется химический процесс расщепления.
Возьмем в качестве примера такой жидкости воду (H2O). В результате ее расщепления у одного из электродов появится водород, а около другого — кислород. Если над электродами расположить сосуды соответствующего вида, можно будет собрать данные газы по отдельности.
Через три десятилетия после первого опыта по расщеплению воды электричеством Фарадей использовал термин «электролиз». Исследования этого явления сделали очевидной возможность обратной реализации знаменитого эксперимента Генри Кавендиша (1731–1810), осуществленного в 1784 году: он получал воду, пропуская искру через сосуд с водородом и кислородом.
Первая «электролизация» воды была осуществлена английским химиком Уильямом Николсоном (1753–1815) через некоторое время после изобретения батарейки Вольты, 20 марта 1800 года. С помощью своего коллеги Энтони Карлайла(1768–1840) Николсон создал первую в Англии копию батарейки. Для улучшения электрического соединения он погрузил электроды от батарейки в сосуд с водой, и у каждого из электродов были собраны водород и кислород. Опыты по собиранию газов у электродов стали широко распространенными. Первым, кто увидел, что объем полученного в ходе электролиза водорода вдвое превышает объем кислорода, стал Гемфри Дэви. Пропорциональное распределение — две части водорода на одну часть кислорода — заставляло думать, что в воде больше атомов водорода, чем кислорода, и что каждая частица воды состоит из трех атомов, а не двух, как предлагал Джон Дальтон (1766–1844):
«Почему не допустить, что вода принимает одинаковый объем каждого из газов? Я долго размышлял над этим вопросом и, хотя меня полностью не удовлетворяет ответ, почти убежден, что данное обстоятельство зависит от веса и количества последних частиц, составляющих разные газы».
То есть химическая комбинация состоит из взаимодействующих атомов определенного и характерного веса. Данное заключение об атомном составе было, в конце концов, сформулировано Жозефом Луи Гей-Люссаком (1778–1850).
* * *
Электрический разряд как фактор химических реакций
До того как Фарадей начал свои исследования, считалось, что бывают разные виды электричества, в зависимости от источника. В начале XIX века думали, что существуют два вида электричества, изначально названных «стеклянное» и «смоляное», то есть положительное и отрицательное соответственно. Эта концепция, введенная Шарлем Франсуа де Систерне Дюфе, позволяла разделять все тела с точки зрения электричества: те, которые при натирании ведут себя как стекло, то есть электрически положительные, и те, которые при натирании ведут себя как смола, — электрически отрицательные (положительные и отрицательные — термины, введенные Бенджамином Франклином). Химические реакции можно было объяснять с позиции электрического притяжения и отталкивания. Таким образом, полюса контура притягивали на расстоянии компоненты молекулы, в конце концов разрушая ее.
Необходимость электрического разряда
Майкл Фарадей экспериментально доказал, что самой по себе близости двух электрических полюсов недостаточно для химической реакции: нужен электрический разряд. Эксперимент состоял в том, чтобы поместить бумагу, смоченную раствором йодистого калия, между двумя заряженными электродами. При высвобождении йода бумага окрашивалась в характерный фиолетовый цвет, и таким образом становилось очевидно, что произошла химическая реакция. Тогда ученый смог наблюдать, что близости электродов недостаточно.
Чтобы йод высвободился, а бумага окрасилась, нужен был электрический разряд. Для интерпретации данного явления Фарадей предложил, чтобы электрический ток вызывал помехи в химическом растворе, — это приводило к высвобождению йода.
Фарадей. мастер новых терминов
С помощью советов Уильяма Уэвелла (1794–1866), специалиста по классическим языкам и исследователя Тринити-колледжа Кембриджского университета, Фарадей придумал множество неологизмов для обозначения явлений и понятий в своих теориях и изобретениях. Для того чтобы новый термин был как можно более точным, Фарадей описывал Уэвеллу понятие или ситуацию со своим характерным умением использовать прозу там, где другие прибегали к математическим уравнениям, а Уэвелл, который, как считается, ввел термин «ученый» (заменяющий слово «натурфилософ»), предлагал свой вариант неологизма.
Электрохимия
Особенно интересны термины, введенные для понятий, связанных с электрохимией. Если в своих предыдущих исследованиях Фарадей был пионером и ему требовались абсолютно новые термины, то в области электрохимии уже существовал некоторый понятийный аппарат. Однако Фарадей считал, что старые термины не соответствуют тому, что обозначают: он был уверен в неотложной необходимости ввести новые термины для описания знакомых понятий, чтобы не ограничивать процесс осмысления старыми рамками. Например, для терминов «анод» и «катод» Фарадей представил Уэвеллу образ тока, перемещающегося в направлении восток — запад. Этот образ тесно связывался с земным магнетизмом и линиями широты.
Уэвелл предложил два варианта: эйсод (путь входа) и эксод (путь исхода), или анод (путь с востока) и катод (путь на запад). Фарадей в конце концов
выбрал второй вариант, так как он лучше описывал то, что ему хотелось выразить. Также совместно они придумали термин «электролиз», то есть разложение молекул электрическим током. Им принадлежит термин «ион» (идущий) — заряженная частица, движущаяся в растворе. В свою очередь, ионы, движущиеся к аноду, стали анионами, а те, что перемещаются в направлении катода, — катионами. Уэвелл придумал и много других терминов, связанных с наукой. Одно из таких обозначений не имеет эквивалента в русском языке — это все чаще произносимый в последнее время термин consilience, его ввел в моду Эдвард О. Уилсон в книге, озаглавленной «Consilience. Единица знания», и он означает определенный подход к обобщенному изучению науки и гуманитарных дисциплин, выведение общего из разных классов знания.
Уильям Уэвелл.
* * *
Но именно Майкл Фарадей назвал электродами две металлические пластины, погруженные в жидкость для электролиза. Отрицательный электрод получил наименование «катод», а положительный — «анод». Атомы, как правило, нейтральны, у них нет положительного или отрицательного заряда, но прохождение тока через жидкость делало атомы заряженными и заставляло их перемещаться. Фарадей назвал заряженные атомы ионами. Сегодня нам известно, что ион является заряженным атомом, потому что он получил или потерял электроны, но Фарадей в ту эпоху не мог знать об электронах, хотя, несомненно, у него были определенные догадки на этот счет.
Электрохимические эксперименты в этой области показали, что существует два основных класса химических элементов: те, что, распадаясь при электролизе, перемещаются к положительному полюсу электрической цепи (электроотрицательные элементы), и те, которые перемещаются к отрицательному полюсу (электроположительные элементы).
Были сделаны попытки встроить в эту зарождающуюся органическую химию теорию, разработанную Гемфри Дэви и шведским химиком Берцелиусом (1779–1848), согласно которой электрическое взаимодействие между электроположительными и электроотрицательными элементами должно было полностью или частично нейтрализовываться, а с помощью остаточного заряда могли формироваться новые, более сложные соединения с более хрупкими связями.
Тогда были открыты свободные радикалы — группы атомов, которые в химических реакциях ведут себя как отдельная единица и способны соединяться, что парадоксально, как с электроположительными, так и с электроотрицательными элементами. Таким образом, свободные радикалы ставили под сомнение предсказания дуалистской теории и представляли органическую химию как намного более сложную дисциплину, чем казалось на первый взгляд.
* * *
Электролиз воды
Электролиз воды — это разложение воды (H2O) на газы — кислород (O2) и водород (H2) — с помощью пропускания электрического тока через воду. Этот процесс позволяет подтвердить соотношение, в котором находятся эти два газа: 2 объема водорода на 1 объем кислорода. Отрицательно заряженный катод собирает катионы водорода для формирования газа водорода. Положительно заряженный анод направляет электроны к аноду для замыкания цепи. Чистая вода не проводит электричество. Для осуществления реакции в воду добавляется несколько капель серной кислоты (Н2SO4), электроды должны быть из платины, используется постоянный ток. в результате мы получаем вдвое больший объем H2 (на катоде) по сравнению с O2 (на аноде). Более детально рассматривая процесс, мы можем наблюдать, что при погружении двух электродов в кювету с водным раствором (вода и несколько капель серной кислоты) в растворе будут находиться ионы водорода (Н+) и сульфата (SO4—). Если затем подключить генератор электрического тока, некоторые молекулы воды будут распадаться на H+ и ОН—. В результате ион OH— будет образовывать воду и молекулы газа кислорода, осаждающиеся на аноде в виде пузырьков.
При этом ион SO4— вернется в раствор и останется в состоянии иона. В то же время ионы H+ от кислоты и воды уступят свои заряды и образуют молекулы водорода, осаждающиеся в виде пузырьков на катоде.
* * *
Открытие свободных радикалов привело к необходимости выявить число возможных комбинаций, которые могли создавать каждый радикал и каждый элемент. Позже это число назовут валентностью. Таким образом, давалась численная оценка способности одного или нескольких атомов элемента заменять один или несколько атомов другого элемента в сложной органической структуре.
Результаты экспериментов, проведенных Фарадеем в области электрохимии, можно обобщить в двух предложениях, которые получили название «законы электролиза Фарадея».
— Масса химических веществ, осажденных на электроде, прямо пропорциональна количеству пропущенного тока на требующееся для процесса время.
— Для данного количества электричества масса освобожденных химических элементов прямо пропорциональна их химическим эквивалентам.
Химическим эквивалентом, или эквивалентной массой, называется масса элемента, взаимодействующая с примерно 1 граммом водорода. Необходимое количество электричества для осаждения химического эквивалента любого постоянного элемента является константой, названной постоянной Фарадея, равной 96500 Кл, что эквивалентно 1 фараду (Ф). Таким образом, математическая формула, объединяющая оба закона, выглядит так:
где т — масса в граммах осажденного на электроде элемента, I — сила тока, t — время прохождения тока через раствор, Eq — химический эквивалент элемента.
Современная электрохимия появилась благодаря законам электролиза, сформулированным Фарадеем. В связи с этим в его честь фарадом (Ф) называется единица, используемая в электрохимических системах для расчета массы элементов, которые осаждаются на электроде, то есть количество электричества, необходимое для осаждения химического эквивалента элемента: 23 грамма натрия, 108 граммов серебра или 32 грамма меди.
термоэлектричества | физика | Британника
термоэлектричество , также называемое эффектом Пельтье-Зеебека , прямое преобразование тепла в электричество или электричества в тепло с помощью двух взаимосвязанных механизмов, эффекта Зеебека и эффекта Пельтье.
Когда два металла находятся в электрическом контакте, электроны перетекают из одного, в котором электроны менее связаны, в другой. Связывание измеряется расположением так называемого уровня Ферми электронов в металле; чем выше уровень, тем ниже привязка.Уровень Ферми представляет собой разграничение энергии в зоне проводимости металла между уровнями энергии, занятыми электронами, и уровнями, которые не заняты. Энергия электрона на уровне Ферми составляет — Вт относительно свободного электрона вне металла. Поток электронов между двумя контактирующими проводниками продолжается до тех пор, пока изменение электростатического потенциала не приведет к одинаковому значению уровней Ферми двух металлов ( W 1 и W 2 ).Этот электростатический потенциал называется контактным потенциалом ϕ 12 и определяется выражением e ϕ 12 = W 1 — W 2 , где e составляет 1,6 × 10 −19 . кулон.
Подробнее по этой теме
электричество: термоэлектричество
Когда два металла находятся в электрическом контакте, электроны выходят из одного, в котором электроны менее связаны, в другой….
Если замкнутая цепь сделана из двух разных металлов, в цепи не будет чистой электродвижущей силы, потому что два контактных потенциала противостоят друг другу и ток не будет течь. Будет ток, если температура одного из переходов будет повышена по сравнению с температурой второго. В цепи генерируется чистая электродвижущая сила, поскольку маловероятно, что два металла будут иметь уровни Ферми с одинаковой температурной зависимостью. Для поддержания разницы температур тепло должно поступать в горячий спай и уходить из холодного спая; это согласуется с тем фактом, что ток можно использовать для выполнения механической работы.Генерация тепловой электродвижущей силы на стыке называется эффектом Зеебека (в честь немецкого физика эстонского происхождения Томаса Иоганна Зеебека). Электродвижущая сила приблизительно линейна с разницей температур между двумя соединениями разнородных металлов, которые называются термопарами. Для термопары из железа и константана (сплав 60 процентов меди и 40 процентов никеля) электродвижущая сила составляет около пяти милливольт, когда холодный спай находится при 0 ° C, а горячий спай — при 100 ° C.Одно из основных приложений эффекта Зеебека — измерение температуры. Химические свойства среды, температура которой измеряется, и требуемая чувствительность определяют выбор компонентов термопары.
Поглощение или выделение тепла в соединении, в котором есть электрический ток, называется эффектом Пельтье (в честь французского физика Жана-Шарля Пельтье). Эффекты Зеебека и Пельтье также возникают на стыке металла и полупроводника и на стыке двух полупроводников.Развитие полупроводниковых термопар (например, состоящих из теллурида висмута типа n и типа p ) сделало использование эффекта Пельтье практичным для охлаждения. Комплекты таких термопар соединены последовательно электрически и параллельно термически. Когда электрический ток течет, между двумя переходами возникает разница температур, которая зависит от тока. Если температура более горячего спая поддерживается низкой за счет отвода тепла, второй спай может быть на десятки градусов холоднее и работать как холодильник.Холодильники Пельтье используются для охлаждения небольших тел; они компактны, не имеют движущихся механических частей и могут регулироваться для поддержания точной и стабильной температуры. Они используются во многих приложениях, например, для поддержания постоянной температуры образца, когда он находится на столике микроскопа.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Эта статья была недавно отредактирована и обновлена Уильямом Л. Хошем.Узнайте больше в этих связанных статьях Britannica:
Электролиз — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Электролитическая ячейка против гальванической ячейки
- Участники и атрибуты
Использование электрического тока для стимуляции неспонтанной реакции.Электролиз можно использовать для разделения вещества на его исходные компоненты / элементы, и именно с помощью этого процесса был обнаружен ряд элементов, которые до сих пор производятся в современной промышленности. В электролизе — электрический ток, который он пропускает через электролит в раствор, чтобы стимулировать поток ионов, необходимый для протекания иначе несамопроизвольной реакции. Процессы, включающие электролиз, включают: электрорафинирование , электросинтез и хлорно-щелочной процесс .
Электролитическая ячейка и гальваническая ячейка
Пример: когда мы электролизуем воду, пропуская через нее электрический ток, мы можем разделить ее на водород и кислород.
\ [2 H_2O (l) \ rightarrow 2H_2 (g) + O_2 (g) \]
Дополнительная информация: Электролиз воды
Электролитическая ячейка — это, по сути, гальваническая ячейка несамопроизвольной реакции (фактически, если мы изменили поток электричества в гальванической ячейке, превысив требуемое напряжение, мы создали бы электролитическую ячейку).Электролитические ячейки состоят из двух электродов (один действует как катод, а второй — как анод) и электролита. В отличие от гальванического элемента, реакции с использованием электролитических элементов должны быть электрически индуцированы, а его анод и катод меняются местами (анод слева, катод справа).
| Вольтаический | Электролитический |
| Окисление: X → X + + e — (отрицательный анод) | Y → Y + + e — (положительный анод ) |
| Редукция: Y + + e — → Y (положительный катод) | X + + e — → X (отрицательный катод) |
| Всего: X + Y + → X + + Y (G <0) | X + + Y → X + Y + (G> 0) |
| Эта реакция спонтанная и высвободит энергию | Это реакция не является спонтанной и будет поглощать энергию |
Авторы и авторства
Что такое электролиз? — Определение, процесс и факты — Видео и стенограмма урока
Как работает электролиз?
Мы можем понять процесс электролиза, посмотрев на пример, связанный с очисткой металлической меди.Для этого процесса потребуется анод , , положительно заряженный электрод и катод , , отрицательно заряженный электрод. В этом случае примесная металлическая медь является анодом, а чистая металлическая медь — катодом. Цель состоит в том, чтобы использовать электролиз для переработки грязного старого куска медной трубы или грязной меди в красивую, очищенную медную трубу.
Электролит или раствор сульфата меди или раствор обеспечивает наличие жидкой среды, способствующей перемещению ионов внутри элемента (а).Когда ионы меди покидают загрязненную медную трубку с помощью источника энергии, они мигрируют от анода (b) к катоду (c). Достигнув катода, они собирают электроны, необходимые для образования нейтральной или нулевой металлической меди. Эти нейтральные атомы металлической меди собираются на катоде из чистой меди (d). Остаточные примеси с анода или те, которые не попадают на катод для очистки, собираются на дне электролизера.
Ключевые факты
Как видите, процесс электролиза включает перенос ионов через жидкий раствор или электролит.Давайте рассмотрим некоторые ключевые факты, связанные с электролизом, используя наш пример очистки меди для справки. Обратите внимание, что эти факты применимы ко всем процессам электролиза.
Факт №1: Положительно заряженные ионы мигрируют к отрицательно заряженному катоду; отрицательно заряженные ионы мигрируют к положительно заряженному аноду. Другими словами, ионы меди из загрязненной медной трубы не покинут этот анод, если они не будут притягиваться к катоду.
Факт № 2: Электролитические ячейки — это несамопроизвольные реакции, в которых для протекания реакции необходимо подавать энергию.В нашем примере с медью аккумулятор обеспечивает электрическую работу, необходимую для миграции ионов меди от анода к катоду.
Факт № 3: Должен присутствовать электролит для облегчения движения электрического тока внутри и вне электролитической ячейки. Для очистки меди электролит из сульфата меди растворяли в жидком растворе и использовали в процессе электролиза. Он обеспечивает среду, через которую проходят ионы меди.
Краткое содержание урока
Электролиз — это процесс использования электрического тока для запуска несамопроизвольной реакции .Цели использования этого процесса включают выделение элементов из природных источников, очистку металлов и разложение соединений. Поскольку электролиз не является самопроизвольным процессом, для его запуска требуется подача энергии.
Весь процесс электролиза осуществляется в электролитической ячейке . В этой ячейке ионы будут мигрировать к или от анода или катода . Эта миграция происходит в жидкой среде, содержащей электролиты.Отрицательно заряженные ионы мигрируют к положительно заряженному аноду. Положительно заряженные ионы мигрируют к отрицательно заряженному катоду.
Результаты обучения
Этот урок по электролизу должен научить вас:
- Определить электролиз
- Объясните, что такое электролизер
- Кратко объясните, как работает электролиз
Электролиз: определение, типы и применение — видео и стенограмма урока
Электролитические ячейки
Специально разработанные устройства, называемые электролитическими ячейками , используются для проведения электролиза.Электролитическая ячейка содержит два электрода и раствор с растворенными ионами, называемый электролитами . Также вам понадобится источник электрической энергии, например, аккумулятор.
Электролиз не происходит спонтанно и всегда требует электричества. Когда электроды подключены к батарее (или другому источнику электроэнергии), один становится положительно заряженным, а другой — отрицательно заряженным. Эти заряженные электроды могут затем вступать в реакцию с ионами электролита.
Тип химической реакции, происходящей в электролитической ячейке, называется окислительно-восстановительной реакцией. Отрицательно заряженный электрод, известный как катод , уменьшает положительные ионы, добавляя к ним электроны, создавая нейтральные атомы. В то же время положительно заряженный электрод, известный как анод , окисляет отрицательные ионы, производя больше свободных электронов.Эти две полуреакции генерируют новые химические вещества, а также замыкают цепь с аккумулятором, чтобы ток продолжал течь через элемент.
- Окисление, половина реакции: X- → X + e-
- Восстановление половины реакции: Y + + e- → Y
Электролиз воды
Чтобы понять процесс электролиза, давайте сначала рассмотрим один из самых распространенных и простых электролитических процессов — электролиз воды. В этом процессе молекулы воды (h3 O) расщепляются с образованием как водорода (h3), так и кислорода (O2).
Для проведения электролиза воды вам понадобится электролитическая ячейка с двумя электродами внутри раствора воды с электролитами в ней. Хотя молекулы воды будут диссоциировать на ионы водорода (H +) и гидроксида (OH-), чистая вода не очень хорошо проводит электричество, поэтому вам нужно будет добавить несколько дополнительных ионов, чтобы электролиз стал возможным.
После подключения электродов к батарее ионы H + будут восстанавливаться на катоде с образованием газообразного водорода, а молекулы воды будут окисляться на аноде.Результатом этой окислительно-восстановительной реакции является производство как кислорода, так и водорода.
- Реакция восстановления: 2H + + 2e- → h3
- Реакция окисления: 2 h3 O → O2 + 4 H + + 4 e-
- Общий результат реакции: 2 h3 O → 2 h3 + O2
Зачем вам проводить электролиз воды? Водород используется во многих промышленных приложениях, включая производство водородных топливных элементов, и это относительно простой способ его получения.Это также хороший способ получения кислорода, особенно в ситуациях, когда транспортировка большого количества газообразного кислорода не так уж и возможна, как на Международной космической станции. Кислород, которым дышат космонавты на космической станции, создается путем электролиза воды!
Электролиз также широко используется для извлечения чистых металлов из металлических соединений. Например, металлический натрий можно получить из хлорида натрия (более известного как поваренная соль) с помощью электролиза. Чтобы извлечь металлический натрий, вы должны сначала расплавить хлорид натрия, а затем поместить два электрода в расплавленную соль.Его нужно расплавить, чтобы ионы могли свободно перемещаться. Ионы натрия (Na +) притягиваются к отрицательно заряженному катоду, где они объединяются с электронами с образованием металлического натрия, который осаждается на электроде. На аноде ионы хлора (Cl-) окисляются с образованием свободных электронов и газообразного хлора (Cl2).
Итак, мы имеем следующее:
2NaCl → 2Na + Cl2
Подобный процесс можно использовать для извлечения многих различных типов металлов из природных соединений.
Гальваника
Электролиз также можно использовать для покрытия металлических предметов тонким слоем другого металла. Этот процесс называется гальваника . Чтобы гальванизировать один металл с другим, вам понадобятся два металлических электрода. Металл анода будет окисляться, что приведет к его растворению в растворе на ионы металла. Затем эти ионы осаждаются на катодном металле тонким однородным слоем.
Гальваника используется при производстве пенни, которые в основном состоят из цинка с тонким слоем гальваники сверху.Он также обычно используется для покрытия частей автомобилей и приборов хромом для повышения их коррозионной стойкости, а также для покрытия недорогих ювелирных изделий золотом или серебром.
Резюме урока
Хорошо, теперь, когда мы завершаем этот урок, давайте уделим пару минут, чтобы просмотреть важную информацию, которую мы узнали.
Как мы видели здесь, электролиз — это процесс использования электричества для разделения химических соединений, вызывающий протекание химической реакции окисления-восстановления.Для проведения электролиза вам понадобится электролитическая ячейка с двумя электродами, известная как катод , или отрицательно заряженный электрод и анод , или положительно заряженный электрод, электролитический раствор растворенных ионов (называемый электролитами ). проводить электричество между ними и источником электрической энергии, например, батареей. Вам также необходимо расплавить хлорид натрия перед проведением электролиза, чтобы ионы натрия и хлора могли перемещаться и проводить электричество между электродами.
Электролиз можно использовать для производства водорода и кислорода из воды (именно так они производят кислород на Международной космической станции!), Для извлечения чистых металлов из металлических соединений и для гальваники одного металла с другим, что является процесс, при котором электролиз также может использоваться для покрытия металлических предметов тонким слоем другого металла. Мы узнали, что гальваника используется во многих различных областях, от покрытия деталей автомобилей хромом до покрытия пенсов медью.
Изобилие электролиза в нашей жизни невозможно переоценить.
Электролиз: определение и лечение
Обзор
Что такое электролиз?
Электролиз — это процедура для удаления волос. Квалифицированный электролог вводит тонкую проволоку в волосяной фолликул под поверхностью кожи. Электрический ток движется по проволоке к основанию фолликула, разрушая корень волоса. Повреждение фолликула препятствует росту волос и вызывает их выпадение.
Электролиз существует уже более 100 лет. Он был впервые изобретен для удаления раздражающих вросших волосков ресниц. Электролиз — единственный одобренный FDA метод удаления волос навсегда.
Кому нужен электролиз?
Рост волос нормальный и часто желаемый. Но иногда людям нужен электролиз, потому что они:
- Недовольны тем, где растут волосы (например, между бровями, на верхней губе или на груди).
- У гирсутизма, то есть чрезмерного роста волос.
- Смена пола.
Какие части тела можно лечить электролизом?
Электролизом можно обработать большинство участков тела, в том числе:
- Назад.
- Линия бикини, бедер и голеней.
- Грудь и живот.
- Лицо, включая губу, подбородок и брови.
- Пальцы рук и ног.
- Подмышки.
Что вызывает нежелательный рост волос?
Причины лишнего роста волос включают:
- Проблемы наследственности (генетика может повлиять на наличие у вас большого количества волос на теле).
- Уровни гормонов, например высокий уровень андрогенов (мужских гормонов).
- Некоторые лекарства, например некоторые стероиды.
- Определенные заболевания, например синдром поликистозных яичников.
Детали процедуры
Какое устройство используется при электролизе?
Медицинские устройства для электролиза называются эпиляторами. Они разрушают центр роста волос с помощью электрического тока.
Что происходит во время электролиза?
Электрологи используют тонкую иглу, которая зачастую даже тоньше волоса.Вставляют иглу в отверстие волосяного фолликула. Небольшой электрический ток разрушает клетки роста волос. Кожа в месте введения иглы может временно нагреваться или ощущаться как защемление.
Сколько процедур электролиза мне понадобится?
Вам потребуется несколько приемов. Количество сеансов, необходимых для достижения стойкого удаления волос, варьируется от человека к человеку. Обычно вам нужно записываться на прием каждую неделю или раз в две недели. Назначения могут длиться до полутора лет.
Продолжительность процедуры зависит от нескольких факторов, включая площадь тела и тип растущих на ней волос. Если вы обрабатываете большую область или область с жесткими волосами, вам потребуется больше процедур.
Почему мне нужно так много процедур электролиза?
Волосы имеют разные циклы роста. Ваш волосяной фолликул производит волосы и выбрасывает их путем выпадения. Этот цикл производства волос — это процесс роста, отдыха и замены. Отдельные волосы находятся в разных фазах этого цикла.Более чем одно средство улавливает волосы в нужный момент цикла и уничтожает их.
Как долго длится лечение электролизом?
Электролиз длится от 15 минут до одного часа.
Что мне нужно знать после процедуры?
В первые 24 часа после лечения старайтесь избегать действий, которые могут вызвать раздражение волосяных фолликулов, в том числе:
- Все, что вызывает потоотделение.
- Дубление.
- Пребывание на солнце.
- Нанесение макияжа.
Риски / преимущества
В чем преимущество электролиза?
Многие люди испытывают стойкое удаление волос после завершения процедуры электролиза. Также электролиз работает с самым широким диапазоном типов кожи и волос. Подходит для чувствительных участков тела, таких как лицо или линия бикини. Главный недостаток электролиза — время, необходимое для удаления волос навсегда.
Есть ли риски или осложнения при электролизе?
Электролиз очень безопасен. Существует очень небольшой риск инфицирования (от нестерильной иглы) или образования рубцов, если электролиз не будет проведен правильно. Эти риски очень низки, если вы выберете сертифицированный профессиональный кабинет электролиза.
Во время или сразу после лечения у вас может наблюдаться легкое покраснение кожи. Это очень недолго. Люди с более темной кожей могут иметь временные темные пятна на коже.Пятна со временем тускнеют, поэтому не используйте для них отбеливающий крем.
Оставит ли электролиз шрам?
Рубцы после процедур электролиза возникают редко.
Больно ли электролиз?
Электролиз обычно не вызывает сильного дискомфорта. Вы можете почувствовать легкое покалывание. При необходимости поговорите со своим электрологом о местном обезболивающем (обезболивающем креме).
Восстановление и Outlook
Каково время восстановления после электролиза?
Вы можете вернуться к своей обычной деятельности сразу после лечения.
Электролиз постоянный?
Да, электролиз безопасно и навсегда удаляет волосы любого оттенка кожи. Это единственное средство для перманентного удаления волос, одобренное FDA. Поскольку электролиз навсегда разрушает ростовые клетки в волосяных фолликулах, волосы не будут расти снова.
Когда звонить доктору
Что следует спросить у электролога перед процедурой?
При встрече с электрологом спрашивайте:
- Как будет выглядеть процедура?
- Как долго длится каждый сеанс?
- Как вы думаете, сколько посещений мне понадобится?
- Сколько будет стоить это лечение?
- Покроет ли страхование лечение электролизом?
- Как давно вы занимаетесь электролизом?
- Сколько человек вы лечили?
дополнительные детали
На что обращать внимание при выборе электролога?
Электрологи — это обученные профессионалы, которые могут безопасно выполнять процедуры электролиза.Выбирая электролога, спросите о:
- Квалификация: Многие штаты требуют лицензирования или сертификации для электрологов. Убедитесь, что сертификат поставщика обновлен и доступен для просмотра. Если ваш штат не регулирует электрологию, спросите, посещал ли поставщик аккредитованную школу электрологии.
- Рекомендации: Спросите друзей или членов семьи за рекомендациями из личного опыта. Или обратитесь за рекомендацией к своему врачу.
- Консультация: Многие практики предлагают бесплатную консультацию по электролизу. Задайте любые вопросы, которые у вас возникнут при первом посещении, чтобы вы чувствовали себя комфортно с вашим выбором.
- Чистота и гигиена: На консультации спросите о процедурах очистки и стерилизации. Посмотрите, выглядит ли практика чистой и используют ли рабочие одноразовое оборудование. Убедитесь, что вам комфортно с электрологом.
Чем отличается электролиз от временных методов удаления волос?
Многие люди используют химические депиляторы, такие как жидкости или кремы, для удаления волос на ногах.Химические вещества в этих продуктах могут вызывать раздражение кожи. Химическая эпиляция может быть беспорядочной и занять много времени. Вощение, еще один метод удаления волос, может быть болезненным и дорогостоящим. Домашние наборы для депиляции могут быть грязными и сложными в использовании.
Могу ли я использовать устройство для электролиза в домашних условиях?
На рынке существуют устройства для электрического электролиза, доступные для домашнего использования. Но лучше всего обратиться к квалифицированному электрологу для проведения электролиза. Они используют высококачественное стерильное оборудование и могут индивидуализировать лечение в соответствии с вашими потребностями.
Людям, которые хотят удалить волосы на теле, навсегда избавится от электролиза. Квалифицированный электролог проводит процедуру, которая в целом безболезненна. После нескольких сеансов лечения у вас, скорее всего, не останется волос. Поговорите со своим врачом, чтобы узнать, подходит ли вам электролиз.
электролиз — определение и значение
В результате, электролиз для многих является делом всей жизни, которое часто не оправдывает ожиданий клиентов.
Рубашка среднего размера | Коллекционные предметы из фантастики, фэнтези и ужасов
Единственный способ отремонтировать систему с электролизером — это удалить все без исключения соединения с электрической системой (что может быть сложной задачей в медицинском здании) и заменить всю систему трубопроводов в здании.
как работает «заземляющий» полюс в земле?
Единственный способ отремонтировать систему с электролизером — это удалить все без исключения соединения с электрической системой (что может быть сложной задачей в медицинском здании) и заменить всю систему трубопроводов в здании.
как работает «заземляющий» полюс в земле?
Единственный способ отремонтировать систему с электролизером — это удалить все без исключения соединения с электрической системой (что может быть сложной задачей в медицинском здании) и заменить всю систему трубопроводов в здании.
как работает «заземляющий» полюс в земле?
Единственный способ отремонтировать систему с электролизером — это удалить все без исключения соединения с электрической системой (что может быть сложной задачей в медицинском здании) и заменить всю систему трубопроводов в здании.
как работает «заземляющий» полюс в земле?
Единственный способ отремонтировать систему с электролизером — это удалить все без исключения соединения с электрической системой (что может быть сложной задачей в медицинском здании) и заменить всю систему трубопроводов в здании.
как работает «заземляющий» полюс в земле?
Единственный способ отремонтировать систему с электролизером — это удалить все без исключения соединения с электрической системой (что может быть сложной задачей в медицинском здании) и заменить всю систему трубопроводов в здании.
как работает «заземляющий» полюс в земле?
Они также говорят, что участвует в электролизе («пузырьки газа образуются вокруг электродов, что указывает на протекание электролитической реакции»).
Ловкий детокс
Они также говорят, что участвует в электролизе («пузырьки газа образуются вокруг электродов, что указывает на протекание электролитической реакции»).
Архив 2004-05-01
Ионы должны были быть носителями электрического тока, например в электролиз , но и химической активности.
Сванте Аррениус — Биография
Электролиз | Encyclopedia.com
Электролиз воды
Производство натрия и хлора
Производство магния
Производство гидроксида натрия, хлора и водорода
Производство алюминия
Рафинирование меди
Гальваника
Ресурсы
Электролиз процесс, вызывающий химическую реакцию при прохождении электрического тока через вещество или смесь веществ, чаще всего в жидкой форме.Электролиз часто приводит к разложению соединения на элементы. Для проведения электролиза два электрода, положительный электрод (анод) и отрицательный электрод (катод) погружаются в материал, подлежащий электролизу, и подключаются к источнику постоянного (постоянного) электрического тока.
Аппарат, в котором проводится электролиз, называется электролитической ячейкой . Корни -lys и -lyt происходят от греческих lysis и lytos , что означает «разрезать или разлагать»; электролиз в электролитической ячейке — это процесс, при котором вещество может разлагаться.
Электролизуемое вещество должно быть электролитом, жидкостью, содержащей положительные и отрицательные ионы и, следовательно, способной проводить электричество. Есть два вида электролитов. Один вид — это раствор ионного соединения любого соединения, которое производит ионы при растворении в воде, например неорганической кислоты, основания или соли. Другой вид представляет собой сжиженное ионное соединение, такое как расплавленная соль.
В любом виде электролита жидкость проводит электричество, потому что ее положительные и отрицательные ионы могут свободно перемещаться к электродам с противоположным зарядом — положительные ионы к катоду и отрицательные ионы к аноду.Эта передача положительного заряда в одном направлении и отрицательного заряда в противоположном направлении составляет электрический ток, потому что электрический ток, в конце концов, всего лишь поток заряда, и не имеет значения, являются ли носители заряда ионами или электронами. В ионном твердом веществе, таком как хлорид натрия, например, обычно фиксированные ионы становятся свободными для движения, как только твердое вещество растворяется в воде или как только оно плавится.
Во время электролиза ионы движутся к электродам с противоположным зарядом.Когда они достигают своих электродов, они подвергаются химическим окислительно-восстановительным реакциям. На катоде, который накачивает электроны в электролит, происходит химическое восстановление — захват электронов положительными ионами. На аноде, удаляющем электроны из электролита, происходит химическое окисление — потеря электронов отрицательными ионами.
В электролизе существует прямая зависимость между количеством электричества, протекающего через элемент, и количеством протекающей химической реакции.Чем больше электронов перекачивается через электролит аккумулятором, тем больше ионов будет вынуждено отдать или принять электроны, тем самым окисляясь или восстанавливаясь. Чтобы произвести химическую реакцию на один моль, через клетку должен пройти один моль электронов. Моль электронов, то есть 6,02 ← × 10 23 электронов, называется фарадеем . Устройство названо в честь Майкла Фарадея (1791–1867), английского химика и физика, открывшего взаимосвязь между электричеством и химическими изменениями.Ему также приписывают первое использование слов анод , катод , электрод , электролит и электролиз .
Могут быть разработаны различные типы электролитических ячеек для решения конкретных химических задач.
Возможно, самым известным примером электролиза является электролитическое разложение воды с образованием водорода и кислорода:
Поскольку вода является таким стабильным соединением, ученые могут осуществить эту реакцию, только закачивая в нее энергию — в данном случае форма электрического тока.Чистая вода, которая не очень хорошо проводит электричество, должна, во-первых, превратиться в электролит путем растворения в ней кислоты, основания или соли. Затем анод и катод, обычно сделанные из графита или какого-либо нереагирующего металла, такого как платина, могут быть вставлены и подключены к батарее или другому источнику постоянного тока.
На катоде, где электроны закачиваются в воду аккумулятором, они захватываются молекулами воды с образованием газообразного водорода:
На аноде электроны удаляются из молекул воды:
Чистый результат эти две электродные реакции, сложенные вместе, составляют
(обратите внимание, что когда эти два уравнения складываются вместе, четыре иона H + и четыре иона OH — с правой стороны объединяются с образованием четырех ионов H 2 O молекулы, которые затем нейтрализуют четыре из молекул H 2 O в левой части.Таким образом, каждые две молекулы воды разложились на две молекулы водорода и одну молекулу кислорода.
Кислота, основание или соль, превратившие воду в электролит, были выбраны таким образом, чтобы ее конкретные ионы не могли окисляться или восстанавливаться (по крайней мере, при напряжении батареи), поэтому они не вступают в химическую реакцию и служат только для проведения течение через воду. Обычно используется серная кислота, H 2 SO 4 .
Путем электролиза поваренная соль, хлорид натрия, NaCl, может быть разложена на элементы, натрий и хлор.Это важный метод производства натрия. Он также используется для производства других щелочных металлов и щелочноземельных металлов из их солей.
Чтобы получить натрий электролизом, ученые сначала расплавят немного хлорида натрия, нагревая его выше точки плавления 1,474 ° F (801 ° C). Затем в расплавленную соль вставят два инертных (не реагирующих) электрода. Хлорид натрия должен быть расплавлен, чтобы ионы Na + и Cl — могли свободно перемещаться между электродами; в твердом хлориде натрия ионы замораживаются.Наконец, ученые пропустят постоянный электрический ток (DC) через расплавленную соль.
Отрицательный электрод (катод) будет притягивать ионы Na + , а положительный электрод (анод) будет притягивать ионы Cl — , после чего происходят следующие химические реакции.
На катоде, куда закачиваются электроны, они захватываются положительными ионами натрия:
На аноде, где выкачиваются электроны, они отрываются от ионов хлора:
(Хлор атомы немедленно объединяются в двухатомные молекулы, Cl 2 .В результате электричество расщепляет поваренную соль на элементы.
Другое важное применение электролиза — производство магния из морской воды. Морская вода является основным источником этого металла, поскольку она содержит больше ионов магния, чем любого другого металла, кроме натрия. Во-первых, хлорид магния, MgCl 2 , получают путем осаждения гидроксида магния из морской воды и растворения его в соляной кислоте. Затем хлорид магния плавят и подвергают электролизу.Подобно получению натрия из расплавленного хлорида натрия, описанному выше, расплавленный магний осаждается на катоде, а газообразный хлор выделяется на аноде. Общая реакция: MgCl 2 → Mg + Cl 2 .
Гидроксид натрия, NaOH, также известный как щелочь и каустическая сода, является одним из наиболее важных промышленных химикатов. По состоянию на 2004 год только в Соединенных Штатах его ежегодно производили более 25 миллиардов фунтов (11 миллиардов килограммов). Мировое производство в том же году превысило 100 миллиардов фунтов (44 миллиарда килограммов).Основным методом его получения является электролиз рассола или соленой воды, раствора поваренной соли, хлорида натрия в воде. Хлор и водород образуются как ценные побочные продукты.
Когда электрический ток проходит через соленую воду, отрицательные ионы хлора, Cl — , мигрируют к положительному аноду и теряют свои электроны, превращаясь в газообразный хлор.
(Затем атомы хлора объединяются в пары, образуя молекулы Cl 2 .) Между тем ионы натрия Na + притягиваются к отрицательному катоду.Однако они не собирают электроны, чтобы стать атомами металлического натрия, как это происходит в расплавленной соли. Это связано с тем, что в водном растворе сами молекулы воды улавливают электроны легче, чем ионы натрия. Таким образом, на катоде происходит
. Ионы гидроксида вместе с ионами натрия, которые уже находятся в растворе, составляют гидроксид натрия, который может быть восстановлен путем испарения.
Этот так называемый процесс хлорно-щелочной является основой отрасли, которая существует уже более ста лет.С помощью электричества он превращает дешевую соль в ценный хлор, водород и гидроксид натрия. Среди прочего, хлор используется для очистки воды, водород используется для гидрогенизации масел, а щелок используется для производства мыла, промышленных стоков и очистителей для духовок, а также бумаги.
Производство алюминия методом Холла было одним из первых применений электролиза в больших масштабах и до сих пор остается основным методом получения этого очень полезного металла. Чарльз М.Холл, 21-летний студент Оберлин-колледжа в Огайо, который искал способ восстановить оксид алюминия до металла, открыл этот процесс в 1886 году. Алюминий был редкой и дорогой роскошью в то время, потому что металл очень реакционноспособен, и поэтому его трудно восстановить химическими средствами. С другой стороны, электролиз расплавленной соли или оксида алюминия затруднен, потому что соли трудно получить в безводной (сухой) форме, а оксид Al 2 O 3 не плавится до температуры 3762 ° F. (2,072 ° С).
Холл обнаружил, что Al 2 O 3 в форме минерального боксита растворяется в другом минерале алюминия, называемом криолитом, Na 3 AlF 6 , и что полученная смесь может быть легко расплавлена. Когда через эту расплавленную смесь проходит электрический ток, ионы алюминия мигрируют к катоду, где они восстанавливаются до металла:
На аноде ионы оксида окисляются до газообразного кислорода:
Расплавленный металлический алюминий опускается на дно. ячейки и может быть снята.
Обратите внимание, что три моля электронов (три фарада электричества) необходимы для производства каждого моля алюминия, потому что на каждом ионе алюминия есть три положительных заряда, которые должны нейтрализоваться электронами. Следовательно, производство алюминия по процессу Холла требует огромного количества электроэнергии. Переработка банок для напитков и других алюминиевых предметов стала важной мерой энергосбережения.
В отличие от алюминия, металлическую медь довольно легко получить химическим способом из руд.Но с помощью электролиза его можно очистить и сделать очень чистым — до 99,999%. Чистая медь важна для изготовления электрического провода, потому что электропроводность меди снижается из-за примесей. К этим примесям относятся такие ценные металлы, как серебро, золото и платина; когда они удаляются электролизом и восстанавливаются, они имеют большое значение для оплаты счетов за электроэнергию.
При электролитическом рафинировании меди нечистая медь образуется из анода в ванне электролита из сульфата меди, CuSO 4 и серной кислоты H 2 SO 4 .Катод представляет собой лист чистой меди. По мере прохождения тока через раствор положительные ионы меди Cu 2+ в растворе притягиваются к отрицательному катоду, где они захватывают электроны и осаждаются как нейтральные атомы меди, тем самым создавая все больше и больше чистой меди на катод. Между тем, атомы меди в положительном аноде отдают электроны и растворяются в растворе электролита в виде ионов меди. Однако примеси в аноде не переходят в раствор, потому что атомы серебра, золота и платины не так легко окисляются (превращаются в положительные ионы), как окисляется медь.Таким образом, серебро, золото и платина просто падают с анода на дно резервуара, где их можно соскрести.
Еще одно важное применение электролитических ячеек — это гальваника серебра, золота, хрома и никеля. Гальваника позволяет получить тонкое покрытие из этих дорогих металлов на поверхностях более дешевых металлов, чтобы придать им внешний вид и химическую стойкость, как у дорогих.
При серебряном покрытии покрываемый объект (например, ложка) изготавливается из катода электролитической ячейки.Анод представляет собой стержень из металлического серебра, а электролит (жидкость между электродами) представляет собой раствор цианида серебра AgCN в воде. Когда через элемент пропускают постоянный ток, положительные ионы серебра (Ag + ) из цианида серебра мигрируют к отрицательному аноду (ложке), где они нейтрализуются электронами и прилипают к ложке как металлическое серебро:
Между тем серебряный анодный стержень отдает электроны, превращаясь в ионы серебра:
Таким образом, анодный стержень постепенно растворяется, пополняя запасы ионов серебра в растворе.В результате металлическое серебро переместилось с анода на катод, в данном случае — на ложку. Этот процесс продолжается до тех пор, пока на ложке не будет достигнута желаемая толщина покрытия — обычно всего несколько тысячных дюйма — или пока серебряный слиток полностью не растворится.
При гальванике с серебром цианид серебра используется в электролите, а не другие соединения серебра, такие как нитрат серебра, AgNO 3 , потому что ион цианида, CN — , реагирует с ионом серебра, Ag + , с образованием комплексного иона Ag (CN) 2 — .Это ограничивает поступление свободных ионов Ag + в раствор, поэтому они могут осаждаться на катоде только постепенно. Это обеспечивает более блестящее и прочное серебряное покрытие. Золотое покрытие
КЛЮЧЕВЫЕ ТЕРМИНЫ
Комплексный ион — Большой ион, состоящий из более мелких ионов, объединенных друг с другом или с другими атомами или молекулами
Фарадея — Единица электрического заряда, равная количеству заряд переносится одним мольом электронов. Один фарадей равен 96 485 кулонам.
Окисление — Процесс, при котором степень окисления атома увеличивается за счет потери одного или нескольких электронов.
Восстановление — Процесс, при котором степень окисления атома снижается за счет получения одного или нескольких электронов.
выполняется примерно так же, с использованием золотого анода и электролита, содержащего цианид золота, AuCN.
КНИГИ
Чанг, Раймонд. Химия . Бостон, Массачусетс: McGraw-Hill, 2002.