Полярные и неполярные молекулы
Полярные и неполярные молекулы в органической химии
Полярные и неполярные молекулы. Во всякой молекуле имеются как положительно заряженные частицы — ядра атомов, так и отрицательно заряженные — электроны. Для каждого рода частиц (или, вернее, зарядов) можно найти такую точку, которая будет являться как бы их «электрическим центром тяжести». Эти точки называются полюсами молекулы. Если в молекуле электрические центры тяжести положительных и отрицательных зарядов совпадут, то молекула будет неполярной. Таковы, например, молекулы Н2, N2, образованные одинаковыми атомами, у которых общие пары электронов в равной мере принадлежат обоим атомам, а также многие симметрично построенные молекулы с атомной связью, например метан СН4, четыреххлористый углерод ССl4. Но если молекула построена несимметрично, например состоит из двух разнородных атомов, то, как мы уже говорили, общая пара электронов может быть в большей или меньшей степени смещена в сторону одного из атомов.
Полярные молекулы являются диполями. Этим термином обозначают вообще всякую электронейтральную систему, т. е. систему, состоящую из положительных и отрицательных зарядов, распределенных таким образом, что их электрические центры тяжести не совпадают.
Полярность молекул
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2).
При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3 (молекулы метанаCH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
Bδ+ →Fδ−
Cδ− ←Hδ+
Nδ− ←Hδ+
(здесь δ — частичный электрический заряд на атомах).
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.
Неполярные вещества — Справочник химика 21
Связь 1/д или с константой Генри и с теплотой адсорбции или растворения позволяет сделать целесообразный выбор неподвижной фазы для газо-хроматографического разделения различных по свойствам веществ. Для разделения легких газов, очевидно, надо резко увеличить значение величины К, а следовательно, и Q. Этого нельзя добиться при газо-жидкостной хроматографии, потому что теплоты растворения газов малы. Поэтому для разделения легких газов и паров низкокипящих жидкостей применяют газо-адсорбционную хроматографию, используя молекулярные сита (цеолиты), пористые стекла, силикагели, алюмогели, неполярные активные угли (в зависимости от природы раз деляемых газов и паров). Для разделения паров жидкостей, кипящих при температурах от комнатной до 200 °С, хорошие результаты дает газо-жидкостная хроматография, причем неподвижная жидкость выбирается в соответствии с природой разделяемых компонентов для разделения неполярных веществ применяют неполярные жидкости (различные парафиновые и силиконовые масла) для разделения полярных веществ применяют полярные жидкости, такие, как полиэтиленгликоль, различные сложные эфиры и т.
Это правило не выполняется в отношении многих веществ (см. табл. IV, 4), например для ассоциированных жидкостей (вода, аммиак, спирты). Правило Траутона приближенно выполняется для углеводородов и их производных, эфиров и других классов неполярных веществ. [c.142]
На некотором малом расстоянии от поверхности полимера, где на раствор влияет силовое поле мембраны, слой, находящийся в термодинамически менее выгодном состоянии, стремится к достижению устойчивого состояния, т.
Уравнение[c.147]
Неполярные вещества Вещества, молекулы которых не имеют дипольного момента [c.546]
Наблюдаемое (см. рис. 1У-34) для растворов неполярных веществ различие в характере изменения проницаемости объясняется следующим образом. При различной подвижности моЛекул компонентов смеси малоподвижные молекулы неполярного вещества частично блокируют вход в поры, а в порах сужают сечение потока жидкости. Поэтому в данном случае связанный слой проявляет свойства неньютоновских жидкостей [229], вязкость которых зависит от создаваемого напряжения сдвига, и течение этого слоя через поры начинается только при достижении определенного сдвигового напряжения — выше предельного. Поэтому зависимость проницаемости водных растворов полярных веществ от давления не должна экстраполироваться в начало координат, что и подтверждается экспериментальными данными (см. рис. 1У-13).
Поэтому в данном случае связанный слой проявляет свойства неньютоновских жидкостей [229], вязкость которых зависит от создаваемого напряжения сдвига, и течение этого слоя через поры начинается только при достижении определенного сдвигового напряжения — выше предельного. Поэтому зависимость проницаемости водных растворов полярных веществ от давления не должна экстраполироваться в начало координат, что и подтверждается экспериментальными данными (см. рис. 1У-13).
Известно, например, что неполярные вещества лучше взаимно растворимы (так же, как полярные), чем неполярное вещество в полярном растворителе или обратно. Так, соли, мочевина, низшие спирты хорошо растворимы в воде и плохо в углеводородах. Очевидно, наличие диполей у однородных и разнородных полярных молекул вызывает взаимное их притяжение и увеличивает растворимость, тогда как неполярные молекулы выталкиваются из полярного растворителя вследствие дипольной ассоциации его молекул.
Дисперсионное взаимодействие.
 Если оба вещества неполярны, то взаимодействие их молекул определяется дисперсионными силами, открытыми Лондоном. Дисперсионные силы притяжения вызываются взаимными короткими, периодически возникающими диполями. Молекулы неполярных веществ обладают флуктуирующими диполями. Это такие колебания (флуктуации), которые вызывают мгновенные отклонения распределения электронной плотности от среднего распределения. Положение электрона относительно ядра можно рассматривать как кратковременный вращающийся диполь, заставляющий молекулу другого вещества в данное мгновение ориентироваться относительно этой молекулы (рис. 2).
Если оба вещества неполярны, то взаимодействие их молекул определяется дисперсионными силами, открытыми Лондоном. Дисперсионные силы притяжения вызываются взаимными короткими, периодически возникающими диполями. Молекулы неполярных веществ обладают флуктуирующими диполями. Это такие колебания (флуктуации), которые вызывают мгновенные отклонения распределения электронной плотности от среднего распределения. Положение электрона относительно ядра можно рассматривать как кратковременный вращающийся диполь, заставляющий молекулу другого вещества в данное мгновение ориентироваться относительно этой молекулы (рис. 2). Однако сложность и разнообразие закономерностей, охватывающих свойства растворов различных веществ, делают теорию растворов труднейшей проблемой молекулярной физики и учения о химических связях. Общей количественной теории растворов пока не существует, имеются лишь с успехом разрабатываемые частные теории растворов неполярных веществ с молекулами, симметрия силового поля которых близка к шаровой, или разбавленных растворов электролитов.
Лишь для неполярных веществ (главным образом—органических), растворы которых обнаруживают небольшие положительные отклонения от закона Рауля—Генри, удается построить полуколичественную статистическую теорию растворимости, согласно которой основным фактором, определяющим растворимость твердого тела в различных жидких растворителях, является разность квадратных корней внутренних давлений жидких компонентов. С ростом этой разности растворимость уменьшается (см. стр. 252). [c.232]
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (во,да, спирты, жидкий аммиак), а неполярные вещества — в неполярных растворителях (бензол, сероуглерод). [c.218]
Пропускание через воду газообразного хлора С1 . Хотя хлор как неполярное вещество плохо растворим в воде, он реагирует с водой с образованием водорастворимых хлорсодержащих соединений. [c.90]
[c.90]
Подождите 1 мин. Видно образование двух жидких фаз. Поскольку жир — неполярное вещество, он стремится перейти в неполярный слой. Видны ли в этом слое капельки жира [c.264]
Ранее в гл. I, разд. В.И и В. 12, мы исследовали принцип подобное растворяется в подобном и выяснили, что, вообще говоря, в воде растворяются полярные и ионные соединения, а неполярные вещества растворяются в неполярных растворителях. Сравнительное по силе взаимодействие — вот ключ к растворимости. И как вы видели — некоторые большие молекулы могут растворяться и в полярных, и в неполярных растворителях. [c.465]
Низкомолекулярные растворители — парафиновые углеводороды, так же как в основном и компоненты гудрона, являются неполярными веществами. Растворимость в этом случае обус- [c.40]
Образованные в результате такого гидрофобного взаимодействия соединения в дальнейшем связываются с гидрофобными частями полимера и образуют еще более малоподвижные молекулярные комплексы, которые могут укрупняться, образуя связь с уже имеющимися на поверхности мембраны молекулами неполярного вещества или их группами. Важным следствием такого гидрофобного взаимодействия является повышение числа свободных подвижных молекул воды в связанном слое, получаемых вследствие вытеснения некоторых молекул воды из моди- [c.221]
Важным следствием такого гидрофобного взаимодействия является повышение числа свободных подвижных молекул воды в связанном слое, получаемых вследствие вытеснения некоторых молекул воды из моди- [c.221]
В производстве нефтяных масел наиболее широко применяют полярные растворители. Компоненты масляных фракций в основном являются неполярными веществами, поэтому растворение их в растворителях этой группы происходит в результате поляризации неполярных молекул под влиянием электрического поля молекул растворителя с высоким дипольным моментом. Растворимость углеводородов нефтяных фракций в полярных растворителях зависит от кратности растворителя и температуры. [c.48]
В водных растворах неполярных веществ молекулы воды с мембраной связываются ориентационными силами, а молекулы неполярных веществ — дисперсионными. Это обусловливает их различную подвижность. Поэтому для такой системы с увеличением давления содержание воды в фильтрате должно увеличиваться быстрее, чем растворенного [c. 218]
218]
С ростом температуры увеличивается скорость движения молекул в связанном слое и повышается вероятность столкновения молекул неполярного вещества между собой. При этом объем термодинамически менее устойчивого окружения этих молекул уменьшается, а, значит. [c.220]
При сближении молекул неполярных веществ движение флуктуирующих диполей становится согласованным, обусловливая их притяжение и согласованную ориентацию. Это приводит к появлению постоянно возобновляющихся сил притяжения, что обусловливает взаимную ориентацию неполярных молекул. В итоге природа дисперсионного взаимодействия тоже дипольная и, следовательно, сила этого взаимодействия обратно пропорциональна г . [c.44]
С.>ш ку, ио растворимую в углеводородах, а также галоидалкилах. эфира с п других неполярных веществах, готовят растворением 4 г картофельного крахмала и 2 г сахара в глицерине при 140 С.
 [c.150]
[c.150]Чем больше дипольный момент полярной молекулы, тем больше Сила ее электрического поля, тем сильнее нод действием этой силы происходит деформация электронного облака молекулы неполярного вещества и, следовательно, больше индуцированный диполь. Сила индукционного взаимодействия обратно пропорциональна г , поэтому это взаимодействие тоже короткодействующее. Деформация электронных облаков неполярных молекул связана с их внутренним сопротивлением изменению структуры и поэтому практически не зависит от температуры. [c.44]
Из отдельных закономерностей отметим, что в молекулярных кристаллах неполярных веществ точка плавления в общем повышается с увеличением размера молекулы, хотя и не всегда плавно. С увеличением полярности молекул, а в особенности с образованием водородной связи в кристаллах, точка плавления повышается. Ионные кристаллы, состоящие из двухзарядных ионов, обладают более высокой точкой плавления, чем кристаллы, состоящие из однозарядных 5о 450 -вв 50 ионов. 0 , [c.151]
0 , [c.151]
Для выбора разделяющих агентов на основании представлений о связи между полярностью молекул и характером отклонений от идеального поведения в образуемых ими системах, последние было предложено [20] разделять на следующие группы 1) высокополярные, 2) неполярные, 3) один компонент полярный, другой неполярный и 4) оба компонента с умеренной полярностью. К первой группе относятся, например, системы ацетон—метиловый спирт, вода—уксусная кислота и вода—этиловый спирт. Для первой из этих систем подходящими разделяющими агентами являются, например, дихлорметан [51] — неполярное вещество и вода [52], имеющая резко выраженную полярность. Разделение смесей уксусной кислоты и воды облегчается при проведении ректификации в присутствии таких полярных веществ, как эфиры уксусной кислоты или неполярных углеводородов и их хлорпроизводных [53]. Разделяющими агентами для системы вода—этиловый спирт являются неполярное вещество — бензол [54], — а также полярные вещества — высшие жирные спирты, например амиловый [55] или фенол [56].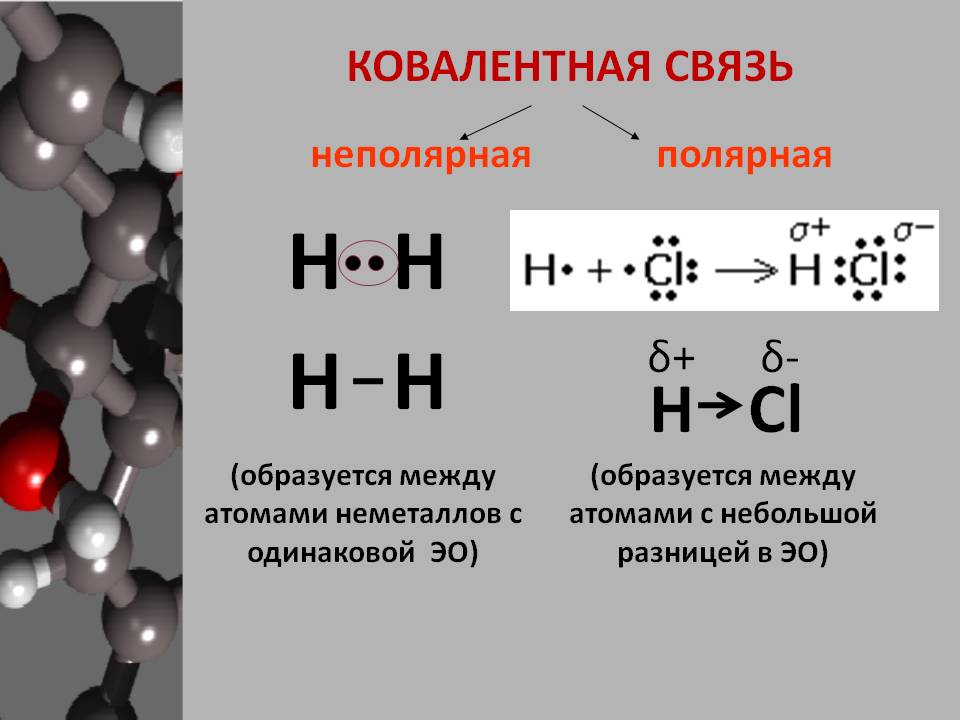 [c.62]
[c.62]
Если один компонент заданной смеси полярный, а другой неполярный, то в качестве разделяющего агента могут быть использованы как полярные, так и неполярные вещества. Так, для разделения смеси метиловый спирт — бензол применимы в качестве разделяющих агентов ксилол (неполярное вещество) [c.62]
Описание фазового равновесия является одной из важнейших задач при расчете процессов разделения. Знание условий равновесия позволяет не только принципиально решить вопрос о возможности разделения многокомпонентной смеси методами ректификации, абсорбции, экстракции, но и выбрать схему разделения. Наиболее обший метод расчета равновесия основан на применении некоторого уравнения (уравнения состояния) ко всем фазам системы пар — жидкость. Однако использование уравнений состояния возможно лишь в случае простых систем, которые образованы веществами с аналогичными свойствами, например неполярными веществами, составляющими природный газ. [c. 40]
40]
На основе описанных явлений сформулированы обобщения качественного характера, определяющие растворимость. Вещества с различной полярностью плохо растворяются друг в друге полярные вещества часто плохо растворяются в неполярных растворителях, как и неполярные вещества в полярных растворителях. Равнополярные вещества хорошо растворяются друг в друге. Так например, неполярные углеводороды СЗо и СС14 плохо растворяются в воде и спиртах—полярных соединениях. Полярные же вещества, например электролиты, хорошо растворяются в воде и спиртах и [c.12]
При перегонке смесей близкокипящих компонентов обычно следует считаться с возможностью образования азеотропа. Азеотропия проявляется не только при наличии специфического взаимодействия между молекулами, но также наблюдается у смесей неполярных веществ, например бензол—циклогексан или бен- [c.300]
Индукционное взаимодействие. В случае растворения двух,веществ, одно из которых полярно, а другое неполярно, имеет место взаимодействие индуцированных диполей в неполярных молекулах и постоянных диполей молекул растворителя. Под действием электростатического поля полярных молекул происходит изменение электронной структуры молекул неполярного вещества. При этом центр тяжести отрицательно заряженных частиц смещается по отношению к ядру на расстояние I, что проводит к возникновению индуцированного двпольного момента tи в молекулах неполярного вещества (рис. 1). Затем происходит ориентация полярных молекул и молекул, в которых индуцирован диполыный момент. Чем больше этот момент, тем сильнее взаимодействие молекул. Индукционные силы взаимодействия зависят от силы электростатического поля полярной молекулы, т. е. от значения [c.43]
Под действием электростатического поля полярных молекул происходит изменение электронной структуры молекул неполярного вещества. При этом центр тяжести отрицательно заряженных частиц смещается по отношению к ядру на расстояние I, что проводит к возникновению индуцированного двпольного момента tи в молекулах неполярного вещества (рис. 1). Затем происходит ориентация полярных молекул и молекул, в которых индуцирован диполыный момент. Чем больше этот момент, тем сильнее взаимодействие молекул. Индукционные силы взаимодействия зависят от силы электростатического поля полярной молекулы, т. е. от значения [c.43]
Уравнение Трутона (для неполярных веществ) [c.156]
Для неполярных веществ с повышением температуры значение 8 уменьшается (для масла приблизительно на 0,1 при повышении температуры с 20 до 100° С) за счет уменьшения числа молекул в 1 сж. [c.530]
Поведение молекул характеризуется в электростатическом поле величиной 8, а в переменном поле, в частности в поле световой волны, — показателем преломления п. Для неполярных веществ, какими могут считаться трансформаторные масла, 8 = С повышением концентрации ароматических углеводородов в масле величина г увеличивается (табл. 10. 7) [3]. [c.531]
Для неполярных веществ, какими могут считаться трансформаторные масла, 8 = С повышением концентрации ароматических углеводородов в масле величина г увеличивается (табл. 10. 7) [3]. [c.531]
В технике водоснабжения и канализации на НПЗ и НХЗ нефтепродуктами называются все малополярные или неполярные вещества, растворимые в гексане. [c.191]
Этот способ позволяет осуществить реакцию практически в двухфазной системе раствор изобутилена в воде (при наличии универсального растворителя для полярных и неполярных веществ — этилцеллозольва и неиногенного эмульгатора) и твердый катализатор. Проведение гидратации в такой системе позволило повысить конверсию изобутилена за один проход до 90—95%. Результаты по гидратации изобутилена пиролизной фракции (очищенной от бутадиена), содержащей около 38% изобутилена, на лабораторной установке с катионитом КУ-2 (объем реактора 0,29 л) приведены ниже [c.728]
Резкая разница в подвижности молекул воды и гидрофобных комплексов обусловливает положительную селективность разделения водных растворов неполярных веществ (рис.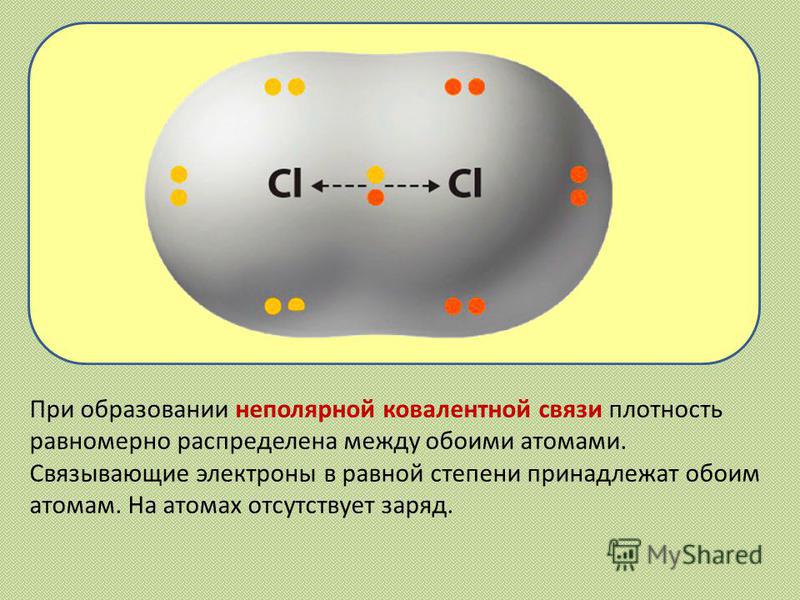 IV-12, кривая 1). Причем с повышением температуры селективность должна возрастать, так как увеличивая подвижность молекул воды, температура не влияет на дисперси- [c.185]
IV-12, кривая 1). Причем с повышением температуры селективность должна возрастать, так как увеличивая подвижность молекул воды, температура не влияет на дисперси- [c.185]
В участках раствора, содержащих молекулы неполярного вещества, межмолекулярные силы компенсируются не полностью, и энергия Гиббса в таких участках раствора в среднем выше, чем в местах, не содержащих этих молекул. Из-за такой неполной насыщенности межмоле-куляриых сил некоторый слой жидкости около неполярных молекул находится в термодинамически менее выгодном состоянии, образуя так называемую модифицированную сферу. [c.220]
В основу процесса адсорбционной очистки масляного сырья на полярных адсорбентах положена разная адсорбируемость компонентов этой сложной смеси, которая зависит от химического состава этой Смеси и структуры молекул веществ, входящих в ее состав. При адсорбции на полярных адсорбентах полярные силы преобладают над диоперсионными, поэтому адсорбируемость компонентов на адсорбентах такого типа там выше, чем больше дипольный момент их молекул. Адсорбция неполярных веществ, к которым относятся углеводороды, определяется образованием в молекулах углеводородов индуцированного дийоля. В процессе адсорбции в результате сил притяжения на поверхности адсор- [c.258]
Адсорбция неполярных веществ, к которым относятся углеводороды, определяется образованием в молекулах углеводородов индуцированного дийоля. В процессе адсорбции в результате сил притяжения на поверхности адсор- [c.258]
Уравнения состояния либо основаны на теоретических предпосылках, либо эмпирические. Примером последних является уравнение Бенедикта—Вебба—Рубина [19]. Оно широко применяется при расчете производств газовой и нефтеперерабатывающей промышленности, но достаточно трудоемко из-за того, что необходимо большое количество экспериментальных данных для определения параметров. Другим недостатком его является пригодность лишь к системам неполярных веществ с аналогичными свойствами (например, к природному газу). [c.98]
Для неполярных веществ ситуация совершенно иная. Согласно оаботам [37—41], у этих веществ силы связи уменьшаются с расстоянием существенно быстрее. Поэтому при вычислении отдельных энергий 1, 2, 3, 4 достаточно рассматривать лишь ближайших соседей данной частицы. Для неполярных веществ справедливы неравенства [c.265]
Для неполярных веществ справедливы неравенства [c.265]
Для систем, оба компонента которых имеют умеренную полярность, подходящими разделяющими агентами могут оказаться как сильно полярные, так и неполярные вещества. При выборе разделяющих агентов для систем этого типа Шейбл [23] рекомендует применять высококипящие гомологи менее летучего компонента. Интересно также предложение Дикса и Карлсона [c.64]
Растворимость твердых веществ в жидкостях а вависимости от природы растворяемого вещества и растворителя может изменяться в очень широких пределах. Щ)вД( казвть растворимость какого-либо вещества по аналогии с растворимостью других веществ пока невозможно. Известно лишь, что неполярные вещества лучше расворяются в неполярных растворителях, как и полярные в полярных, чем неполярное вещество в полярном растворителе, или наоборот. [c.29]
Поскольку надежного обобщенного уравнення для учета влняння давления на теплопроводность ие существует, уравненне, предложенное в [107] и в болыней степени обобщающее данные для неполярных веществ, используется также и для полярных, где оно может проводить к большим погрешностям.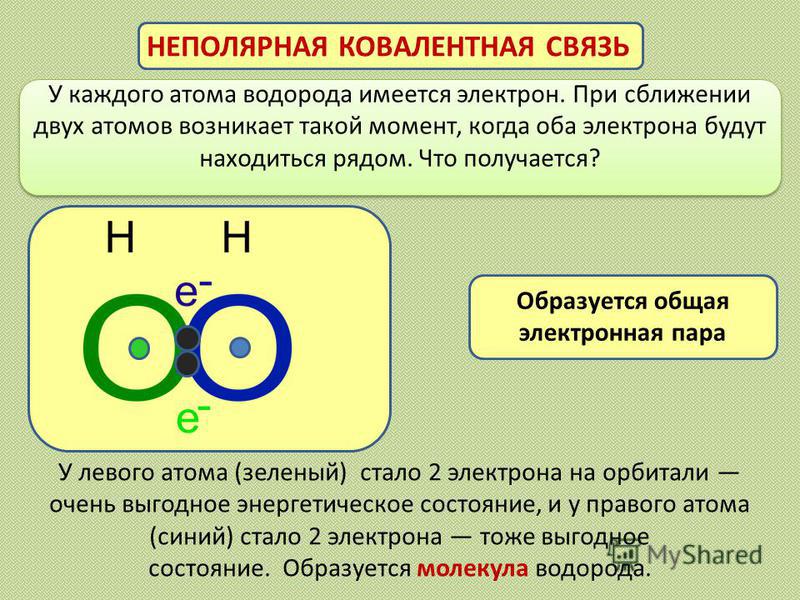 [c.215]
[c.215]
Некоторые растворители обладают широким диапазоном применения, например слояшые эфиры могут применяться для разделения полярных и неполярных веществ. [c.843]
Вещества полярные — Энциклопедия по машиностроению XXL
Использование в качестве заполнителей материалов на основе окиси кальция магния и др. приводит к изменению заряда двойного электрического слоя мицелл золя и, следовательно, к его быстрой коагуляции. Для устранения указанного явления раствор золя необходимо стабилизировать, что достигается введением в него окислов щелочных металлов, а также веществ, полярных по своему характеру и содержащих аминогруппу, например диэтил-амина [4]. [c.250]Процесс отверждения на третьей стадии связан с испарением остаточного растворителя. Эта стадия является наиболее продолжительной по сравнению с первыми двумя стадиями, так как остаточный растворитель в пленке достаточно прочно связан с пленкообразующим веществом.
 Чем сложнее химическое строение пленкообразующих веществ (полярность, разветвленность,
[c.52]
Чем сложнее химическое строение пленкообразующих веществ (полярность, разветвленность,
[c.52]Из четырех низкомолекулярных веществ, приведенных на схеме За, этан является неполярным веществом, а этиловый спирт, уксусная кислота и щавелевая кислота представляют собой вещества полярные. Этан — простейший углеводород, который растворяется в других углеводородах, но он не растворим в воде. Этиловый спирт совмещается со многими углеводородами и с водой. Уксусная и щавелевая кислоты практически не растворимы в углеводородах, но растворимы в воде. Углеводороды представляют собой неполярные вещества, а вода обладает высокой полярностью. [c.24]
Из более общих корреляций, применимых как к насыщенным, так и к сжатым жидкостям, можно использовать корреляции Йена—Вудса [уравнение (3.15.8)] или Чью и др. [уравнение (3.15.18)]. Последняя не рекомендуется при приведенных температурах выше Тг 0,99. Оба уравнения хорошо проверены для чистых веществ, полярных и неполярных. Специально для полярных веществ никаких методов разработано не было, но оба упомянутых метода дают приемлемые результаты. Для более точных определений следует обращаться к корреляциям, разработанным специально для полярных жидкостей [ 41, 51, 118].,
[c.73]
Специально для полярных веществ никаких методов разработано не было, но оба упомянутых метода дают приемлемые результаты. Для более точных определений следует обращаться к корреляциям, разработанным специально для полярных жидкостей [ 41, 51, 118].,
[c.73]
К органическим замедлителям коррозии относятся органические коллоиды (агар-агар, желатина, декстрин, животный клей и др.), органические вещества, содержащие в молекуле полярные 1 руппы (амины и их соли), альдегиды, гетероциклические соединения и многие другие органические соединения. [c.314]
Диэлектрические свойства пластмасс зависят от наполнителей, связующих веществ и их полярности. У пластиков различают неполярные (нейтральные) и полярные диэлектрики. [c.345]
Теория эффекта Керра была предложена для неполярных веществ (газов, жидкостей) Ланжевеном (1910 г.), для полярных веществ — Борном (1916 г.). [c.290]
Поверхностно-активные вещества (ПАВ) — вещества, способные накапливаться на поверхности соприкосновения двух тел (сред, фаз), понижая ее свободную энергию (поверхностное натяжение). Важнейшие ПАВ — водорастворимые органические соединения, молекулы которых состоят из двух частей полярной (гидрофильной) и неполярной (гидрофобной). ПАВ применяют в промышленности (например, при флотации), они входят в состав моющих средств, лаков и красок, пищевых продуктов.
[c.152]
Важнейшие ПАВ — водорастворимые органические соединения, молекулы которых состоят из двух частей полярной (гидрофильной) и неполярной (гидрофобной). ПАВ применяют в промышленности (например, при флотации), они входят в состав моющих средств, лаков и красок, пищевых продуктов.
[c.152]
Электрическая поляризация вещества, состоящего из полярных молекул, отличается от электрической поляризации вещества, состоящего из неполярных молекул. Молекулы, имеющие постоянные дипольные моменты, поляризуются полем не только вследствие индукции, т. е. появления наведенного дипольного момента, определяемого поляризуемостью, но и вследствие ориентации молекул полем. При отсутствии поля молекулы в результате теплового движения расположены хаотично (рис. 16.2, а) и поэтому векторная сумма всех моментов диполей в среднем близка к нулю. При наложении внешнего электрического поля на каждый диполь действуют силы, стремящиеся ориентировать его параллельно электрическому полю (рис.
 16.2,6). В этом случае сумма всех дипольных моментов молекул уже не равна нулю и диэлектрик приобретает электрический момент. Такой тип поляризации называют ориентационной, или дипольной, поляризацией.
[c.7]
16.2,6). В этом случае сумма всех дипольных моментов молекул уже не равна нулю и диэлектрик приобретает электрический момент. Такой тип поляризации называют ориентационной, или дипольной, поляризацией.
[c.7]Таким образом, общая поляризация полярных веществ складывается из индукционной Р,- и ориентационной Ро поляризаций Р = Рг + Ро- [c.7]
Поведение полярных молекул в поле световой волны не отличается от поведения неполярных молекул. Поскольку напряженность электрического поля световой волны меняется очень быстро (в видимой области с частотой порядка (4- -8) 10 Гц), а частоты вращательных движений молекул (вызванных тепловым движением) имеют порядок 10 —10 Гц, то за время светового колебания молекула не успевает повернуться, т. е. диполь не успевает сориентироваться в поле световой волны. Поэтому выражение молекулярной рефракции полярных молекул остается таким же (см. формулу (16.12)), что и для неполярных веществ. [c.8]
Особенно сильно и своеобразно процессы молекулярной ассоциации проявляются в растворах различных красителей — веществ, имеющих интенсивную полосу поглощения в видимой части спектра и обладающих красящими свойствами. Наиболее благоприятной средой для образования ассоциатов красителей является вода. В чистых же полярных органических растворителях (спиртах, ацетоне, пиридине и др.) ассоциация молекул красителей либо
[c.208]
Наиболее благоприятной средой для образования ассоциатов красителей является вода. В чистых же полярных органических растворителях (спиртах, ацетоне, пиридине и др.) ассоциация молекул красителей либо
[c.208]
Диэлектрики можно подразделить на два класса полярные, т.е. содержащие постоянные диполи, способные к переориентации, и неполярные, не содержащие ориентирующихся диполей. Это разделение очень важно при рассмотрении не только электрических, но и общих физико-химических свойств вещества. [c.89]
В большинстве случаев постоянный электрический момент молекул полярных веществ Кл-м (так как q порядка Ю» Кл, I порядка [c.89]
Независимо от электрических свойств о полярности вещества можно судить по строению его молекул. Однако при экспериментальном определении постоянного электрического момента молекулы р по электрическим свойствам вещества можно делать важные заключения о структуре молекул. Очевидно, что молекулы, имеющие симметричное строение и центр симметрии, неполярны, так как в этом случае центры тяжести как положительных, так и отрицательных зарядов совпадают с центром симметрии молекулы и как /, так и р равны нулю несимметричные молекулы полярны. [c.89]
[c.89]
При оценке полярности вещества по строению его молекул необходимо учитывать не условное написание химической формулы, а фактическое расположение зарядов в пространстве. Например, формулы угольного ангидрида СО2 и воды Н2О выглядят сходно, но в действительности молекула СО2 имеет центр симметрии (рис.4.2,б) и угольный ангидрид неполярен, а молекула воды несимметрична (рис.4.2,в) и вода — типичное полярное вещество ср =6,М0 Кл-м. [c.90]
Наибольшее значение в электрической изоляции имеют синтетические смолы полимеризационные и конденсационные. Общим недостатком конденсационных смол является то, что при их отвержении происходит выделение воды или других низкомолекулярных веществ, остатки которых могут ухудшить электроизоляционные свойства смолы. Кроме того, молекулы конденсационных смол, как правило, содержат полярные группы, что повышает их тангенс угла диэлектрических потерь и гигроскопичность полимеризационные же смолы могут быть и неполярными (например, полимеры углеводородного состава, политетрафторэтилен). [c.132]
[c.132]
К диэлектрикам с дипольной релаксационной поляризацией относятся такие полярные жидкости, как вода, нитробензол, спирт, ацетон, соляная кислота, глицерин и др. Твердые вещества с этим же видом поляризации — целлюлоза и другие материалы на основе древесины, бакелит, синтетические смолы, шелк, органическое стекло, эбонит, канифоль и канифольные компаунды. [c.147]
Насыщенный адсорбционный монослой образуется из плотно расположенных полярных молекул, ориентированных параллельно друг другу и перпендикулярно поверхности тела. Адсорбированные молекулы взаимодействуют не только с поверхностью, но и между собой. Взаимодействие между молекулами в тангенциальном направлении к поверхности называют продольной когезией. Конец молекулы, присоединяющийся к металлу, подобен маленькому магниту, его называют полярным или активным. Остальная часть молекулы составляет так называемый хвост. У всех органических кислот и их мыл активной является карбоксильная группа СООН, у спиртов-гидроксил ОН, у других веществ — группа NH- O- I и др. [32].
[c.55]
У всех органических кислот и их мыл активной является карбоксильная группа СООН, у спиртов-гидроксил ОН, у других веществ — группа NH- O- I и др. [32].
[c.55]
Электропроводность жидких диэлектриков. В неполярных жидких диэлектриках диссоциация молекул на ионы незначительна, поэтому число носителей заряда в единице объема невелико и проводимость мала. Источником ионов в неполярной жидкости могут быть примеси — влага, различные полярные жидкости, частицы твердых веществ, молекулы которых диссоциируют на ионы. В таких случаях проводимость жидкости называют примесной. Молекулы полярных жидкостей диссоциируют на ионы в большей степени, поэтому их проводимость большая. Если в полярной жидкости содержится даже небольшое количество полярной примеси, то ее молекулы практически все диссоциируют, возрастает и количество диссоциировавших молекул жидкости и проводимость сильно увеличивается. [c.140]
Пентапласт является хлорированным простым полиэфиром, относится к медленно кристаллизующимся полимерам. Пентапласт более устойчив к нагреву по сравнению с поливинилхлоридом (отщепления хлористого водорода под действием температуры не происходит). Прочность пентапласта близка к прочности винипласта, но он выдерживает температуру 180 °С и хорошо формуется, нехладотекуч, стоек к истиранию. Пентапласт, являясь веществом полярным, обладает удовлетворительными электроизоляционными свойствами. Кроме того, он водостоек. По химической стойкости занимает промежуточное положение между фторопластом и винипластом. Из пентапласта изготовляют трубы, клапаны, детали насосов и точных приборов, емкости, пленки и защитные покрытия на металлах.
[c.458]
Пентапласт более устойчив к нагреву по сравнению с поливинилхлоридом (отщепления хлористого водорода под действием температуры не происходит). Прочность пентапласта близка к прочности винипласта, но он выдерживает температуру 180 °С и хорошо формуется, нехладотекуч, стоек к истиранию. Пентапласт, являясь веществом полярным, обладает удовлетворительными электроизоляционными свойствами. Кроме того, он водостоек. По химической стойкости занимает промежуточное положение между фторопластом и винипластом. Из пентапласта изготовляют трубы, клапаны, детали насосов и точных приборов, емкости, пленки и защитные покрытия на металлах.
[c.458]
Прочность пентона близка к прочности винипласта, но он выдерживает температуру 180° С и хорошо формуется, нехладотекуч, стоек к истиранию. Являясь веществом полярным, обладает удовлетворительными электроизоляционными свойствами. Кроме того, он водостоек. По химической стойкости занимает промежуточное положение между фторопластом и винипластом. Из пентона изготовляют трубы, клапаны, детали насосов, гибкие шланги, емкости, детали точных приборов и механизмов, пленки для упаковки и защитные покрытия на металлах.
[c.418]
Из пентона изготовляют трубы, клапаны, детали насосов, гибкие шланги, емкости, детали точных приборов и механизмов, пленки для упаковки и защитные покрытия на металлах.
[c.418]
Если полярность маслорастворимых ПАВ невелика, то электролит даже при поляризации вблизи нулевой точки металла десорбирует их с электродов и ОПИ ингибиторов равна нулю. Бели вещества полярны, то в зависимости от их электронодонорно-акцепторных свойств процесс их хемосорбции усиливается соответственно на анодных или катодных участках металла. При исследовании этим методом пластичных смазок и ингибированных тонкопленочных покрытий, образующих на металле цленки с большим сопротивлением, влияние двойного электрического слоя электролита становится весьма малым, и для проявления полярных свойств [c.38]
Как это показано классич. исследованиями Гарди, Лангмюира и Гаркинса, адсорбция всегда связана с ориентацией адсорбирующихся молекул в пограничном слое. Поэтому типично поверхностно-активными являются вещества с полярными молекулами резко выраженной асси-метрич. структуры типа ф-Ъ, где а—полярная группа (ОН, NHa, СООН, SSH и др.), а Ъ—неполярная часть молекулы (напр, углеводородная цепь)—СНа—СНа—СНо—…СНд. Такие ассиметричные молекулы ориентируются в пограничном слое, а следовательно и адсорбируются тем сильнее, чем больше разность полярностей обеих соприкасающихся фаз, причем адсорбция сопровождается уравниванием этой разности полярностей в пограничном слое, происходя поэтому обычно только тогда, когда полярность адсорбирующегося вещества лежит между полярностями обеих фаз системы. Этим правил ом уравнивания полярностей объясняется то обстоятельство, что из водных растворов на поверхности раствор— воздух или раствор—пар адсорбируются поверхностно-активные растворенные вещества, полярность к-рых в чистом состоянии меньше полярности воды. Из газовых же сред на твердых адсорбентах адсорбируются, наоборот, наиболее полярные компоненты газовой смеси,т. к. твердые тела всегда полярнее окружающей их газовой среды.
[c.199]
структуры типа ф-Ъ, где а—полярная группа (ОН, NHa, СООН, SSH и др.), а Ъ—неполярная часть молекулы (напр, углеводородная цепь)—СНа—СНа—СНо—…СНд. Такие ассиметричные молекулы ориентируются в пограничном слое, а следовательно и адсорбируются тем сильнее, чем больше разность полярностей обеих соприкасающихся фаз, причем адсорбция сопровождается уравниванием этой разности полярностей в пограничном слое, происходя поэтому обычно только тогда, когда полярность адсорбирующегося вещества лежит между полярностями обеих фаз системы. Этим правил ом уравнивания полярностей объясняется то обстоятельство, что из водных растворов на поверхности раствор— воздух или раствор—пар адсорбируются поверхностно-активные растворенные вещества, полярность к-рых в чистом состоянии меньше полярности воды. Из газовых же сред на твердых адсорбентах адсорбируются, наоборот, наиболее полярные компоненты газовой смеси,т. к. твердые тела всегда полярнее окружающей их газовой среды.
[c.199]
Поверхностно-активные вещестэа. Вещества, которые снижают поверхностное натяжение на границе раздела двух фаз, называются поверхностно-активными. По отношению к воде поверхностно-активными веществами являются вещества, молекулы которых содержат группы ОН, СООН, СО, Nh3, N02 (т. е. из органических веществ спирты, кислоты, альдегиды, кетоны, амины, нитросоединения). Обычно молекулы этих веществ полярны, т. е. обладают собственным дипольным моментом.
[c.345]
Вещества, которые снижают поверхностное натяжение на границе раздела двух фаз, называются поверхностно-активными. По отношению к воде поверхностно-активными веществами являются вещества, молекулы которых содержат группы ОН, СООН, СО, Nh3, N02 (т. е. из органических веществ спирты, кислоты, альдегиды, кетоны, амины, нитросоединения). Обычно молекулы этих веществ полярны, т. е. обладают собственным дипольным моментом.
[c.345]
Что же касается жидкостей неполярных, таких, как смеси углеводородов, представляющих собой различные сорта жидкого топлива и смазочных масел, а также некоторых галоидопроизводных углеводородов, то имея в виду их большое удельное электрическое сопротивление, полагали, что коррозия в них может носить только химический характер. Однако Л. Г. Гиндиным было показано, что коррозия может иметь электрохимический характер и в средах с очень низкой диэлектрической проницаемостью. Объясняется это тем что продукты коррозии представляют собой вещества полярные и проводящие электрический ток значительно лучше исходного диэлектрика. Некоторые органические вещества приобретают агрессивные свойства в процессе их хранения. Так, например, жидкое топливо и его продукты при хранении окисляются кислородом воздуха и становятся коррозионно опасными. С целью торможения окисления в жидкое топливо вводят антиоксиданты Коррозия металлов в углеводородных растворах хлористого алюминия вызывается образованием хлороводорода. Путем введения, например, аминов в хлористый метил можно предотвратить коррозию алюминия.
[c.312]
Некоторые органические вещества приобретают агрессивные свойства в процессе их хранения. Так, например, жидкое топливо и его продукты при хранении окисляются кислородом воздуха и становятся коррозионно опасными. С целью торможения окисления в жидкое топливо вводят антиоксиданты Коррозия металлов в углеводородных растворах хлористого алюминия вызывается образованием хлороводорода. Путем введения, например, аминов в хлористый метил можно предотвратить коррозию алюминия.
[c.312]
Рис. 10.3 построен для Диапазона температур 40—140 С. Эмпирическая зависимость Стила и Тодоса дает промежуточные результаты. То же относится и к методу Бромли. Хотя этого нельзя установить по рис. 10.3, безразмерная группа ХМ1у С почти не зависит от температуры, изменяясь от 1,40 при 40 °С до 1,49 при 150 °С такая нечувствительность ХМ1х С к температуре является, в узких температурных диапазонах, типичной для большинства веществ — полярных и неполярных [196].
 Однако Грилли [55] указал на наличие исключений (особенно, водород) и исследовал влияние температуры на %М1 х С в более широком диапазоне температур (см. также рис. 10.2).
[c.417]
Однако Грилли [55] указал на наличие исключений (особенно, водород) и исследовал влияние температуры на %М1 х С в более широком диапазоне температур (см. также рис. 10.2).
[c.417]В состоянии плазмы находится подавляющая часть вещества Вселенной — звезды, звездные атмосферы, галактические туманности и межзвездная среда. Плазма существует в кос.мосе в виде солнечного ветра, заполняет магнитосферу (образуя радиационные пояса Земли) н ионосферу. Процессами в околоземной плазме обусловлены магнитные бури и полярные сияния. Отражение радиоволн от ионосферной плазмы обеспечивает возможность дальней радиосвязи на Земле. [c.290]
Для того чтобы вещество могло выполнять функцию ингибитора травления, оно должно иметь в общем случае одну или несколько полярных групп, посредством которых молекула могла бы присоединяться к поверхности металла. Обычно они представляют собой органические соединения, содержащие азот, амины, серу или группу ОН. Важное значение для эффективности ингибитора имеют размер, ориентация, форма молекулы и распределение электрического заряда в ней.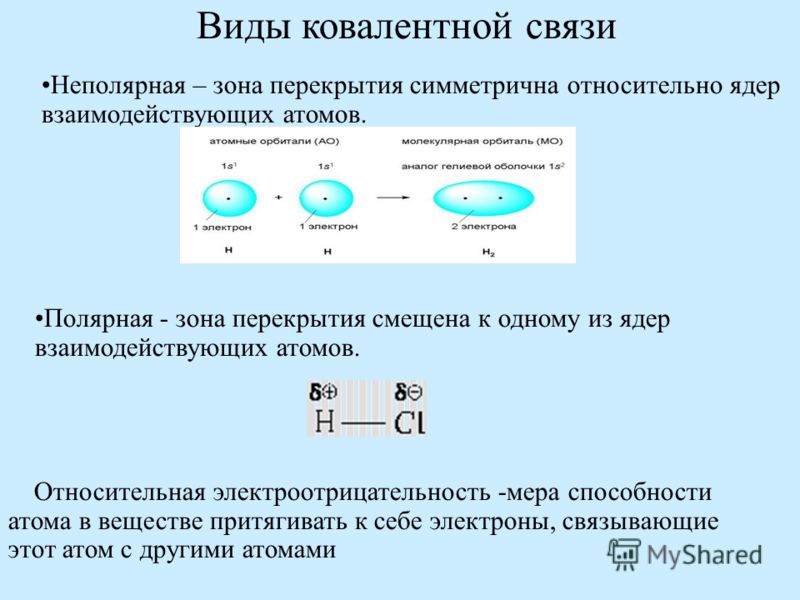 Например, обнаружено, что коррозия железа в 1т растворе соляной кислоты замедляется производными тиогликолевой кислоты и З-меркаптонронионовой кислоты в степени, которая закономерно зависит от длины цепи соединений [32]. Возможность адсорбции соединения на поверхности данного металла и относительная сила связи адсорбции часто зависят от такого фактора, как заряд поверхности металла [33]. Катодная поляризация в присутствии ингибиторов, которые лучше адсорбируются при потенциалах более от-
[c.269]
Например, обнаружено, что коррозия железа в 1т растворе соляной кислоты замедляется производными тиогликолевой кислоты и З-меркаптонронионовой кислоты в степени, которая закономерно зависит от длины цепи соединений [32]. Возможность адсорбции соединения на поверхности данного металла и относительная сила связи адсорбции часто зависят от такого фактора, как заряд поверхности металла [33]. Катодная поляризация в присутствии ингибиторов, которые лучше адсорбируются при потенциалах более от-
[c.269]
В качестве дисперсионной среды применяют органические диэлектрические жидкости, в которые добавляют поверхностно-активные вещества и иногда связующие. Дисперсионная среда должна обладать определенной полярностью и минимальной электропроводностью для предупреждения разложения среды п газовыделе-ния на электродах. В зависимости от последнего фактора среды подразделяются на неполярные, слабополярные (эфиры) и сильнополярные (спирты, нитропарафины, вода).
[c. 99]
99]
Часто p—v—Т -свойства газов и жидкостей характе. ризуют безразмерной величиной Z = pvlRT, которая называется фактором сжимаемости. На рис. 4.1 показаны p—i —7 -соотношения в жидкостях и газах в виде семейства кривых Z = Z(T р,), где Tr=TjT р, = р1рс Тс и Рс — приведенные температура н давление Гс п Рс— критические температура и давление. В широкой области давлений и температур значения Z, приведенные на рис. 4.1, отличаются от экспериментальных не более чем на 4—6 % для большинства веществ (кроме сильно полярных) [5]. [c.87]
ТпянсЛопматорное, а также другие нефтяные ( минеральные ) электроизоляционные масла получают из нефти посредством ее ступенчатой перегонки с выделением на каждой ступени определенной (по температуре кипения) фракции и последующей тщательной очистки от химически нестойких примесей в результате обработки серной кислотой, затем щелочью, промывки водой и сушки. Часто электроизоляционные масла дополнительно обрабатываются адсорбентами, т. е. веществами (особые типы глин или же получаемые искусственным путем материалы), которые обладают сильно развитой поверхностью и при соприкосновении с маслом поглощают воду и различные полярные примеси. Такая обработка производится или перемешиванием нагретого масла с измельченным адсорбентом с последующим отстаиванием, или же фильтрованием масла сквозь слой адсорбента (перколяция) Применяются и другие способы очистки. масла.
[c.129]
е. веществами (особые типы глин или же получаемые искусственным путем материалы), которые обладают сильно развитой поверхностью и при соприкосновении с маслом поглощают воду и различные полярные примеси. Такая обработка производится или перемешиванием нагретого масла с измельченным адсорбентом с последующим отстаиванием, или же фильтрованием масла сквозь слой адсорбента (перколяция) Применяются и другие способы очистки. масла.
[c.129]
Поверхностно-активные вещества, например органические кислоты, их металлические мыла, спирты и смолы, обладают наибольшей способностью к адсорбции. Молекулы этих вс1цеств при адсорбции ориентируются перпендикулярно поверхности вследствие несовпадения центров тяжести положительных и отрицательных зарядов в их молекулах даже в изолированном состоянии. Такие молекулы называют полярными, они притягиваются и удерживаются поверхностью тела. [c.54]
Известно, что металл с кристаллической структурой представляет собой систему положительных ионов (ядра, окруженные электронами внутренних орбиталей), 1югруженную в отрицательный электронный газ обобществленных внешних электронов.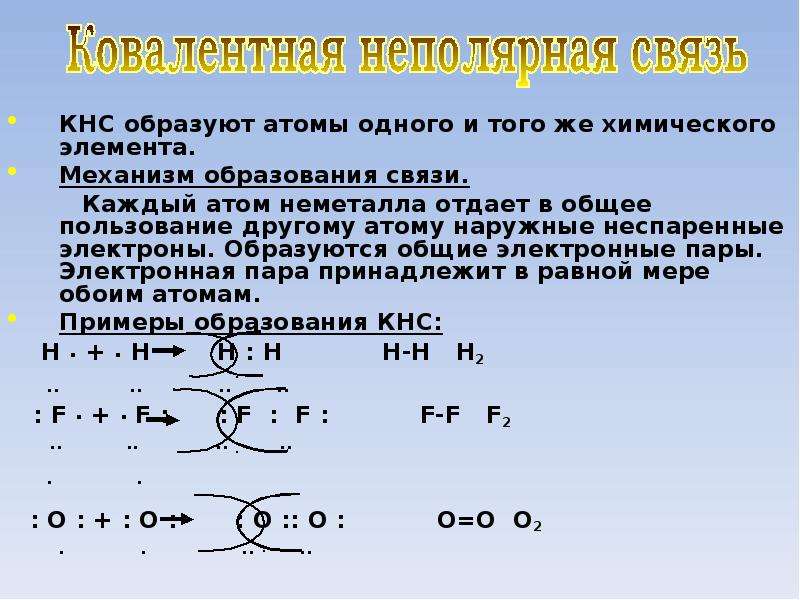 Электроны, обладающие достаточным запасом кинетической энергии, вырываются из металла и образуют над его поверхностью отрицательно заряженное облако. Электроны, находящиеся внутри металла и вблизи его поверхности, отталкиваются от этого облака, смещаясь внутрь металла. В результате уменьшается поверхностная плотность электронов и индуцируется положительный заряд, равный по абсолютной величине отрицательному заряду электронного облака. Сила взаимодействия между зарядами — сила электрического изображения — имеет значительную дальность действия, до 10 мкм от поверхности. Следовательно, энергетический потенциал поверхности характеризуется потенциалом внепп1сго пространства на расстоянии примерно 10 мкм от поверхности. Облако электронов совместно с наружным слоем положительных ионов образует двойной электрической слой. Таким образом, наличие электрического потенциала поверхности твердого тела и полярных молекул поверхностно-активных веществ предопределяет уровень их энергетического взаимодействия при адсорбции и строение адсорби -)ованной пленки.
Электроны, обладающие достаточным запасом кинетической энергии, вырываются из металла и образуют над его поверхностью отрицательно заряженное облако. Электроны, находящиеся внутри металла и вблизи его поверхности, отталкиваются от этого облака, смещаясь внутрь металла. В результате уменьшается поверхностная плотность электронов и индуцируется положительный заряд, равный по абсолютной величине отрицательному заряду электронного облака. Сила взаимодействия между зарядами — сила электрического изображения — имеет значительную дальность действия, до 10 мкм от поверхности. Следовательно, энергетический потенциал поверхности характеризуется потенциалом внепп1сго пространства на расстоянии примерно 10 мкм от поверхности. Облако электронов совместно с наружным слоем положительных ионов образует двойной электрической слой. Таким образом, наличие электрического потенциала поверхности твердого тела и полярных молекул поверхностно-активных веществ предопределяет уровень их энергетического взаимодействия при адсорбции и строение адсорби -)ованной пленки. [c.54]
[c.54]
Контакт воды с металлической поверхностью приводит к коррозии металлов, протекающей по электрохимическому механизму. Величина водонефтяного соотношения, характерного для конкретного месторождения, при котором система нефть — вода становится неустойчивой, может быть использована в качестве параметра для прогнозирования скорости коррозионного разрушения оборудования. Углеводороды практически не вызывают коррозию металлов. Однако неполярная фаза в системе нефть — вода оказывает значительное влияние на коррозионную активность водонефтяной системы в целом, повышая или понижая ее. Повышение защитного действия углеводородной составляющей в эмульсионной системе вода — нефть связано в основном с ингибирующими свойствами ПАВ, входящими в природную нефть. Наиболее активные ПАВ — нафтеновые н алифатические кислоты и асфальтосмолистые вещества. Содержание ПАВ в нефтях различных месторождений колеблется в широких пределах. Молекулы нафтеновых и алифатических кислот состоят из неполярной части — углеводородного радикала и полярной части карбоксильной группы, что обусловливает их способность адсорбироваться на границе раздела фаз. Соли нафтеновых кислог более полярны, чем сами кислоты, и более поверхностно-активны. Величина поверхностного натяжения на границе раздела вода — очищенная фракция нефти (например, вазелиновое масло или очищенный керосин) составляет 50—55 мН/м, в то время как поверхностное натяжение на границе раздела вода — сырая нефть не превышает 20—25 мН/м. Это свидетельствует об адсорбции поверхностно-активных компонентов нефти на границе раздела сырая нефть—вода. В щелочной пластовой воде происходит реакция взаимодействия нафтеновой кислоты с ионом щелочного металла. Образующееся соединение более поверхностно-активно, чем нафтеновые кислоты.
[c.122]
Соли нафтеновых кислог более полярны, чем сами кислоты, и более поверхностно-активны. Величина поверхностного натяжения на границе раздела вода — очищенная фракция нефти (например, вазелиновое масло или очищенный керосин) составляет 50—55 мН/м, в то время как поверхностное натяжение на границе раздела вода — сырая нефть не превышает 20—25 мН/м. Это свидетельствует об адсорбции поверхностно-активных компонентов нефти на границе раздела сырая нефть—вода. В щелочной пластовой воде происходит реакция взаимодействия нафтеновой кислоты с ионом щелочного металла. Образующееся соединение более поверхностно-активно, чем нафтеновые кислоты.
[c.122]
Гигроскопичность диэлектриков зависит от их структуры и состава. Неполярные органические диэлектрики, например парафин, полиэтилен, полипропилен, обладают очень малой гигроскопичностью, почти не поглощают влаги из возду а и даже при длительном пребывании во влажной среде сохраняют хорошие диэлектрические свойства.
 Полярные диэлектрики обладают обычно большей гигроскопичностью, причем закрепление полярных молекул воды около полярных групп молекул диэлектрика замедляет поглощение влаги и равновесное состояние (предельное влагопоглоще-ние) наступает в них за большее время, чем у неполярных. Некоторые вещества, поглощая влагу, образуют с ней твердый коллоидный раствор — набухают. У таких диэлектриков (например, целлюлозные материалы) влагопоглощение может быть очень большим и вызывать сильное ухудшение электрических параметров. Наличие в диэлектриках водорастворимых составных частей и солей повышает их гигроскопичность. Многие неорганические диэлектрики, обладающие плотной структурой, например стекло, непористая керамика, практически не обнаруживают объемного поглощения воды. Проникновение влаги в диэлектрик может происходить через имеющиеся в нем поры. По своему характеру пористость может быть открытой в виде каверн на поверхности закрытой — в виде внутренних воздушных пустот, не сообщающихся с окружающей средой сквозной — в виде каналов, пронизывающих диэлектрик насквозь.
Полярные диэлектрики обладают обычно большей гигроскопичностью, причем закрепление полярных молекул воды около полярных групп молекул диэлектрика замедляет поглощение влаги и равновесное состояние (предельное влагопоглоще-ние) наступает в них за большее время, чем у неполярных. Некоторые вещества, поглощая влагу, образуют с ней твердый коллоидный раствор — набухают. У таких диэлектриков (например, целлюлозные материалы) влагопоглощение может быть очень большим и вызывать сильное ухудшение электрических параметров. Наличие в диэлектриках водорастворимых составных частей и солей повышает их гигроскопичность. Многие неорганические диэлектрики, обладающие плотной структурой, например стекло, непористая керамика, практически не обнаруживают объемного поглощения воды. Проникновение влаги в диэлектрик может происходить через имеющиеся в нем поры. По своему характеру пористость может быть открытой в виде каверн на поверхности закрытой — в виде внутренних воздушных пустот, не сообщающихся с окружающей средой сквозной — в виде каналов, пронизывающих диэлектрик насквозь. Наибольшее влияние на электрические параметры оказывает влага, попадающая в сквозные поры. Конденсируясь на их стенках, вода образует сплошные пленки повышенной проводимости. Имеют значение и размеры пор, которые могут быть разными от макроскопических до суб-микроскопических размером (5—10)-10 см.
[c.110]
Наибольшее влияние на электрические параметры оказывает влага, попадающая в сквозные поры. Конденсируясь на их стенках, вода образует сплошные пленки повышенной проводимости. Имеют значение и размеры пор, которые могут быть разными от макроскопических до суб-микроскопических размером (5—10)-10 см.
[c.110]До отверждения эпоксиды являются олигомерами в виде или вязких жидкостей, или твердых веществ с низкой температурой плавления (в зависимости от способа получения). Эти олигомеры при наличии в молекулах двух и более эпоксидных групп в смеси с некоторыми соединениями—отвер-дителями отверждаются, переходят в твердое неплавкое и нерастворимое состояние. Эпоксиды — полярные диэлектрики. Существует несколько разновидностей эпоксидных олигомеров. Рассмотрим важнейшие из них. Диановые смолы получают путем взаимодействия эпихлоргидрина и дифени- [c.140]
Ковалентные неполярные и полярные связи — урок. Химия, 8–9 класс.
Общие электронные пары, образующиеся в простых веществах h3,O2,Cl2,F2,N2, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной.
Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
Рассмотрим образование ковалентных связей в сложных веществах.
1. Образование молекулы хлороводорода.
У атома водорода на внешнем уровне — один электрон. У хлора на внешнем уровне — семь электронов, один из которых неспаренный.
Образуется одна общая электронная пара, которая смещена к атому хлора. В результате
появляются частичные заряды: на атоме хлора — отрицательный, а на атоме водорода — положительный.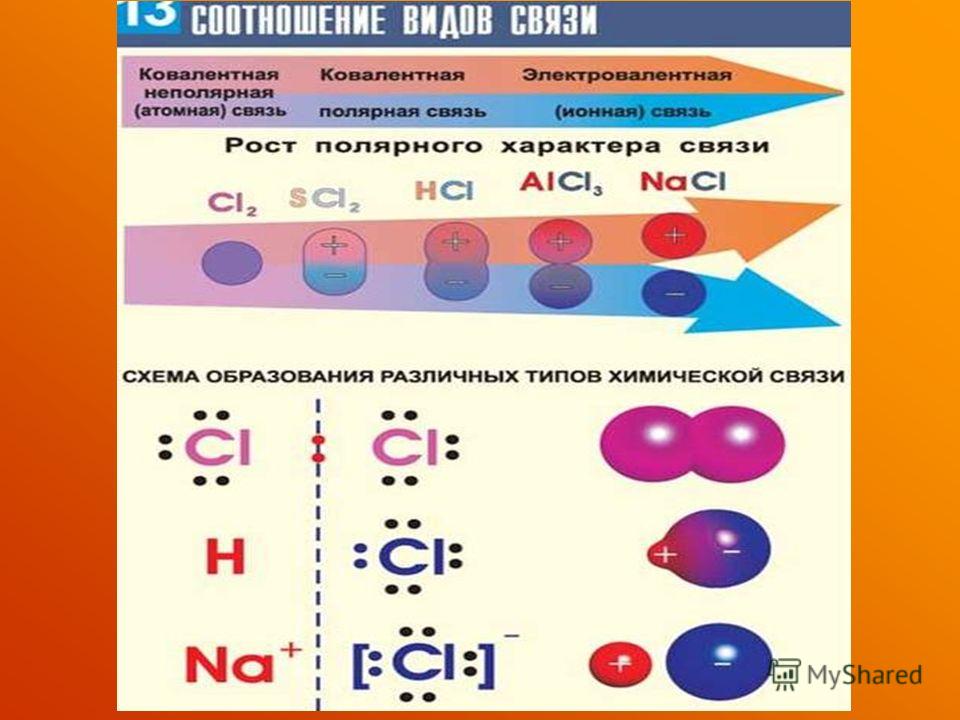 Сдвиг электронной плотности принято обозначать греческой буквой дельта δ:
Сдвиг электронной плотности принято обозначать греческой буквой дельта δ:
Рис. \(1\). Образование молекулы хлороводорода
Структурная формула хлороводорода H−Cl
Подобным образом соединяются атомы в молекулах других галогеноводородов:
H−F,H−Br,H−I.
2. Образование молекулы воды.
На внешнем уровне атома кислорода — шесть электронов, два из которых неспаренные.
Атом кислорода образует две общие электронные пары с двумя атомами водорода.
Электронная плотность этих общих пар сдвинута к более электроотрицательному кислороду. Атом кислорода имеет отрицательный заряд, а атомы водорода — положительный.
Рис. \(2\). Образование молекулы воды
Сходное строение имеет молекула сероводорода. Структурные формулы воды и сероводорода:
H−OH−S||HH
3. Образование молекулы аммиака.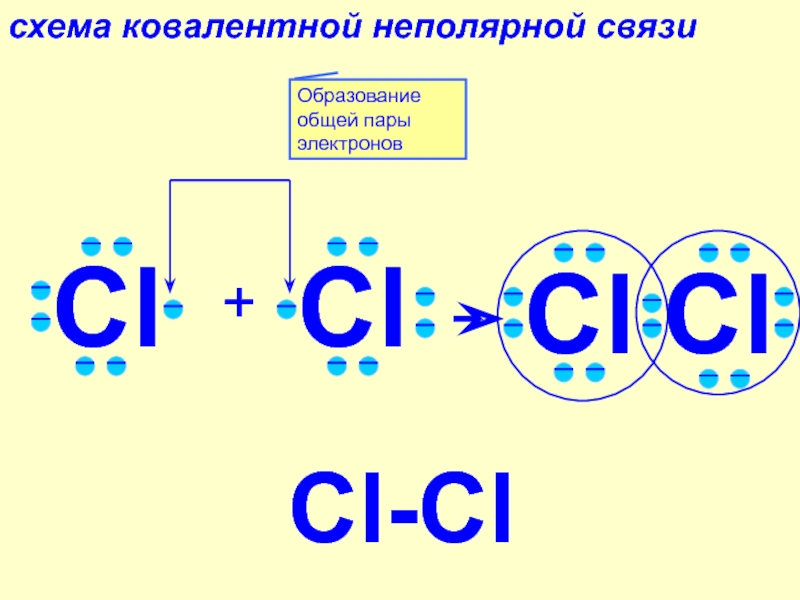
У атома азота — пять внешних электронов, три из которых неспаренные.
Атом азота присоединяет к себе три атома водорода.
Азот — более электроотрицательный элемент, поэтому на его атоме будет отрицательный заряд, а на атомах водорода — положительные заряды.
Рис. \(3\). Образование молекулы аммиака
Структурная формула аммиака:
H−N−H|H
Для того чтобы определить знаки частичных зарядов на атомах в веществе, надо сравнить ЭО неметаллов.
Пример:
определим частичные заряды атомов в соединении CCl4.
Вспомним положение углерода и хлора в ряду ЭО:
По положению элементов в этом ряду видно, что более электроотрицательный элемент в этой паре — хлор. Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
C+δCl4−δ.
Полярную ковалентную связь часто изображают стрелкой: H→Cl. Стрелка показывает направление смещения общей электронной плотности.
Источники:
Рис. 1. Образование молекулы хлороводорода © ЯКласс
Рис. 2. Образование молекулы воды © ЯКласс
Рис. 3. Образование молекулы аммиака © ЯКласс
What are Lipids? | Protocol (Translated to Russian)
3.7: Что такое липиды?
Обзор
Липиды являются группой структурно и функционально разнообразных органических соединений, которые нерастворимы в воде. Некоторые классы липидов, таких как жиры, фосфолипиды и стероиды имеют решающее значение для всех живых организмов. Они функционируют как структурные компоненты клеточных мембран, энергетических резервуаров и сигнальных молекул.
Липиды являются разнообразной группой гидрофобных молекул
Липиды являются структурно и функционально разнообразной группой углеводородов. Углеводороды являются химическими соединениями, которые состоят из атомов углерода и водорода. Углерод-углеродные и углерод-водородные связи являются неполярными, а это означает, что электроны между атомами делятся поровну. Индивидуальные неполярные связи придают углеводородному составу общую неполярную характеристику. Кроме того, неполярные соединения, гидрофобные, или «боящиеся воды». Это означает, что они не образуют водородные связи с молекулами воды, что делает их почти нерастворимыми в воде.
Углеводороды являются химическими соединениями, которые состоят из атомов углерода и водорода. Углерод-углеродные и углерод-водородные связи являются неполярными, а это означает, что электроны между атомами делятся поровну. Индивидуальные неполярные связи придают углеводородному составу общую неполярную характеристику. Кроме того, неполярные соединения, гидрофобные, или «боящиеся воды». Это означает, что они не образуют водородные связи с молекулами воды, что делает их почти нерастворимыми в воде.
В зависимости от химического состава липиды можно разделить на разные классы. Биологически важными классами липидов являются жиры, фосфолипиды и стероиды.
жир — молекула с содержанием жирных кислот и глицерола
Углеводородная основа жира состоит из трех атомов углерода. Каждый углерод несет в себе группу гидроксила (-OH), что делает его глицеролом. Чтобы сформировать жир, каждая из групп гидроксила глицерола связана с жирной кислотой. На одном конце жирная кислота – это длинная углеводородная цепь с карбоксиловой группой (-COOH). Карбоксиловая группа жирных кислот и гидроксиловая группа глицерола образуют стабильную связь с высвобождением молекулы воды. Полученная молекула называется эстером (-COOR). жир является эстер глицерол и три жирные кислоты; поэтому его также называют триглицеридов. Три составные жирные кислоты могут быть идентичными или разными и, как правило, иметь 12-18 атомов углерода в длину.
На одном конце жирная кислота – это длинная углеводородная цепь с карбоксиловой группой (-COOH). Карбоксиловая группа жирных кислот и гидроксиловая группа глицерола образуют стабильную связь с высвобождением молекулы воды. Полученная молекула называется эстером (-COOR). жир является эстер глицерол и три жирные кислоты; поэтому его также называют триглицеридов. Три составные жирные кислоты могут быть идентичными или разными и, как правило, иметь 12-18 атомов углерода в длину.
Насыщенные жиры против ненасыщенных жиров
жиры либо насыщены, либо ненасыщены в зависимости от наличия или отсутствия двойных связей в углеводородных цепях их жирных кислот. Если цепочка жирных кислот не имеет двойных связей между атомами углерода, отдельные атомы углерода связывают максимальное количество водорода. Такая жирная кислота полностью насыщена водородом и называется насыщенной жирной кислотой. С другой стороны, если жирная кислота содержит один или несколько двойных карбированных атомов углерода, жирная кислота называется ненасыщенной жирной кислотой.
жиры, содержащие все насыщенные жирные кислоты, называются насыщенными жирами. В основном насыщены жиры, полученные из животных источников, например, сливочное масло, молоко, сыр и сало. жиры из рыб или растительных источников часто ненасыщенные, как оливковое масло, арахисовое масло, и масло печени трески. Отсутствие двойных связей в углеводородных цепях насыщенных жирных кислот делает их гибкими. Гибкие цепи жирных кислот могут плотно упаковываться друг с другом; следовательно, насыщенные жиры в основном твердые при комнатной температуре.
Большинство естественных ненасыщенных жирных кислот находятся вконформацииcis , что означает, что атомы водорода, прилегающие к двойной связи между углеродом и кислородом, находятся на одной стороне. Наличие cis-двойныхсвязей вызывает изгиб в углеводородной цепи, что делает длинную углеводородную цепь менее гибкой и трудной для упаковки. Как следствие, большинство ненасыщенных жирных кислот являются жидкими при комнатной температуре.
Во многих организмах жиры являются долгосрочным резервуаром энергии. Если возникает необходимость, организм расщепляет жиры для производства энергии. У животных жир обеспечивает амортизацию вокруг жизненно важных органов, а подкожный слой жира изолирует организм от внешних температур.
Фосфолипиды являются неотъемлемой частью клеточных мембран
Фосфолипиды имеют решающее значение для клетки, поскольку они являются основными компонентами клеточных мембран. Фосфолипиды структурно похожи на жиры, но содержат только две жирные кислоты, связанные с глицеролом вместо трех. Остатки жирных кислот могут быть насыщенными или ненасыщенными. При фосфолипидах третья гидроксиловая группа глицерола связана с отрицательно заряженной фосфатной группой.
Дополнительная функциональная группа, присоединенная к фосфатной группе, может привести к различным химическим свойствам фосфатов. Наиболее распространенными добавками являются небольшие полярные группы, такие как холин или серин.
Фосфолипиды — амфипатические молекулы, а это означает, что они имеют части, которые являются гидрофобными идругие, которые являются гидрофильными , или взаимодействуют с водой. Когда фосфолипиды добавляются в воду, они спонтанно образуют би-слой, тонкую пленку в две молекулы фосфолипида толщиной. Эта самоорганизации происходит потому, что полярные группы притягиваются к воде, в то время как гидрофобные жирные кислоты запакованы в центре слоя, чтобы избежать контакта с водой. Такой фосфолипидный би-слой образует клеточную мембрану во всех живых организмах. Он разобщает жидкости на внутренней и внешней стороне клетки. Встроенными в би-слой являются белки и стероиды, другой класс липидов. Дополнительные фосфолипидные би-слои могут еще больше разобщить внутреннюю часть эукариотической клетки, например, лизосому и эндоплазмический ретикулум.
Стероиды состоят из четырех конденсированных углеродных колец
Стероиды являются еще одним биологически важным классом липидов. Стероиды состоят из четырех углеродных колец, которые соединяются друг с другом. Стероиды различаются друг от друга на основе химических групп, прикрепленных к углеродным кольцам. Хотя стероиды структурно различны, они гидрофобные и нерастворимые в воде. Стероиды снижают текучесть клеточной мембраны. Они также функционируют как сигнальные молекулы внутри клетки. Холестерин является наиболее распространенным стероидом и синтезируется печенью. Он присутствует в клеточной мембране и является предшественником половых гормонов у животных.
Стероиды состоят из четырех углеродных колец, которые соединяются друг с другом. Стероиды различаются друг от друга на основе химических групп, прикрепленных к углеродным кольцам. Хотя стероиды структурно различны, они гидрофобные и нерастворимые в воде. Стероиды снижают текучесть клеточной мембраны. Они также функционируют как сигнальные молекулы внутри клетки. Холестерин является наиболее распространенным стероидом и синтезируется печенью. Он присутствует в клеточной мембране и является предшественником половых гормонов у животных.
Литература для дополнительного чтения
Muro, Eleonora, G. Ekin Atilla-Gokcumen, and Ulrike S. Eggert. “Lipids in Cell Biology: How Can We Understand Them Better?” Molecular Biology of the Cell 25, no. 12 (June 15, 2014): 1819–23. [Source]
Simons, Kai. 2016. «Cell membranes: A subjective perspective.» Biochimica et Biophysica Acta (BBA) — Biomembranes 1858 (10):2569-2572. [Source]
[Source]
Lordan, Ronan, Alexandros Tsoupras, and Ioannis Zabetakis. “Phospholipids of Animal and Marine Origin: Structure, Function, and Anti-Inflammatory Properties.” Molecules 22, no. 11 (November 2017): 1964. [Source]
Бутоксиэтанол поможет разработать новые средства для борьбы с разливами нефти
Разливы нефти и продуктов ее переработки крайне опасны для морских обитателей: они приводят к гибели рыб, птиц и водных млекопитающих. Удалить нефтяные пленки можно с помощью особых веществ, растворяющих маслоподобные соединения. Российские ученые с американскими коллегами описали поведение перспективного для этих целей вещества — бутоксиэтанола — при взаимодействии с водой и толуолом, а также сравнили его с «идеальным» аналогом — третичным бутанолом. Оказалось, что бутоксиэтанол эффективнее растворяет масло в воде и при этом еще менее летуч. Результаты исследования, поддержанного грантом Президентской программы Российского научного фонда (РНФ), опубликованы в журналах Journal of Molecular Liquids и Data in Brief.
Большинство жидкостей, с которыми человек встречается в быту, можно условно разделить на две категории: вода и подобные ей полярные соединения, молекулы которых связаны сеткой водородных связей, и «масло» — неполярные, в которых молекулы взаимодействуют друг с другом за счет более слабых сил Ван-дер-Ваальса.
Если попытаться смешать воду и масло, то будет наблюдаться расслоение, как, например, в тарелке супа с каплями жира или на поверхности воды с пятном нефти. Однако расслоение можно предотвратить, если добавить амфифильные соединения. Их молекулы имеют две части — полярную, которая взаимодействует с водой, и неполярную, контактирующую с маслом. Если неполярная часть относительно большая, вещество будет создавать вокруг масла замкнутые шарообразные частицы, и таким образом «прятать» его от воды. По такому принципу работают все поверхностно-активные вещества, например входящие в состав моющих средств. Если неполярная часть амфифильной молекулы сравнительно небольшая, то такое соединение, называемое гидротропом, растворит неполярное вещество в воде.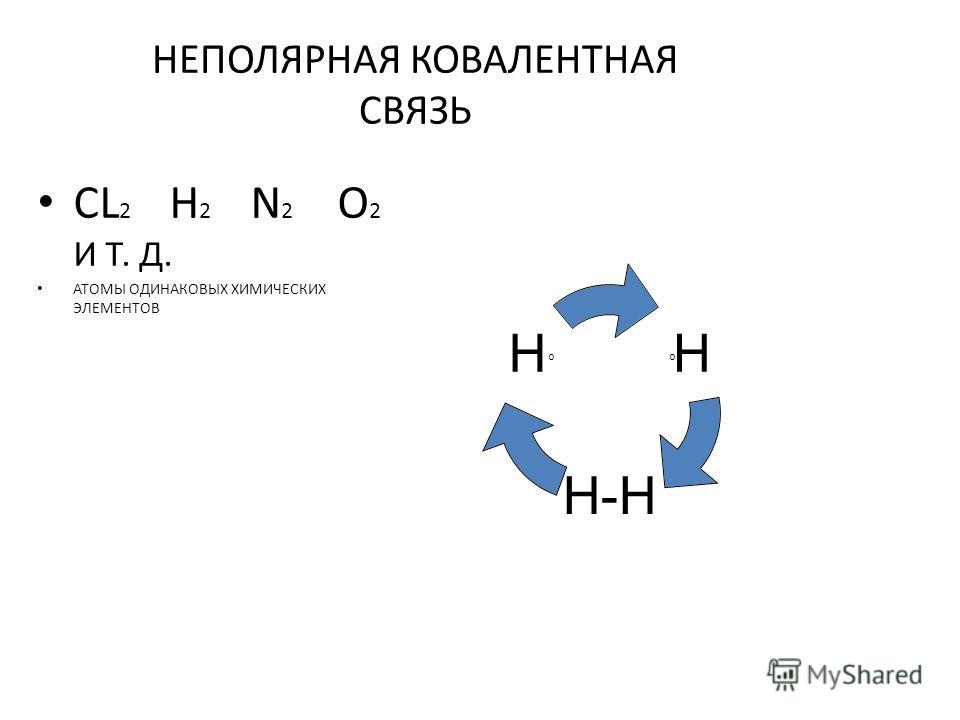 Чтобы удалить нефтяные разливы, необходимо, чтобы масляная пленка распалась на отдельные капли и частично растворилась в воде. Поэтому для такой цели используют средства на основе поверхностно-активных веществ, в том числе и гидротропов.
Чтобы удалить нефтяные разливы, необходимо, чтобы масляная пленка распалась на отдельные капли и частично растворилась в воде. Поэтому для такой цели используют средства на основе поверхностно-активных веществ, в том числе и гидротропов.
Самый известный гидротроп — третичный бутиловый спирт, или трет-бутанол. Он считается «идеальным» среди подобных соединений благодаря тому, что при добавлении в смесь воды и модельного масла (октана), его молекулы оказываются на границе двух жидкостей, занимая равные объемы в каждой из них. Поэтому поведение других гидротропов удобно сравнивать именно с трет-бутанолом.
Ученые из Губкинского университета (Москва) с коллегами из Мэрилендского университета (США) исследовали поведение бутоксиэтанола в системах с водой и толуолом. Это соединение, в отличие от трет-бутанола, более гидрофобно — на границе раздела воды и масла оно занимает больший объем со стороны неполярной среды.
Сначала исследователи, добавляя бутоксиэтанол к смесям воды и толуола («масло») в разных соотношениях, определили, при каких концентрациях бутоксиэтанола пропадает расслоение между водой и маслом. Если сравнивать значения этих концентраций с более ранними экспериментами для трет-бутанола, то можно заключить, что бутоксиэтанола нужно меньше, а потому он более эффективно растворяет толуол в смеси с водой.
Если сравнивать значения этих концентраций с более ранними экспериментами для трет-бутанола, то можно заключить, что бутоксиэтанола нужно меньше, а потому он более эффективно растворяет толуол в смеси с водой.
Затем ученые измерили вязкость равновесных жидких фаз. При отсутствии бутоксиэтанола или при его низком содержании вязкость водной фазы существенно превышала вязкость масляной. По мере добавления бутоксиэтанола вязкость органического компонента возрастала значительно быстрее, чем у водного, что авторы интерпретировали как эффект, связанный с тем, что в масляной фазе начинают формироваться водородные связи между молекулами бутоксиэтанола и воды.
«Бутоксиэтанол будет хорошим реагентом для разработки новых средств для удаления нефтяных разливов. Он менее летуч, чем бутанол, а также лучше снижает натяжение жидкостей на границе «вода-масло», благодаря чему помогает им смешиваться. Но оба эти соединения имеют общий недостаток — они токсичны. Снизить токсичность можно, поместив реагенты на пористый носитель. Эту технологию мы недавно запатентовали. В дальнейшем планируем исследовать другие «неидеальные» гидротропы, например, изопропиловый спирт», — рассказывает руководитель проекта по гранту РНФ Андрей Новиков, кандидат химических наук, доцент кафедры физической и коллоидной химии Губкинского университета.
Эту технологию мы недавно запатентовали. В дальнейшем планируем исследовать другие «неидеальные» гидротропы, например, изопропиловый спирт», — рассказывает руководитель проекта по гранту РНФ Андрей Новиков, кандидат химических наук, доцент кафедры физической и коллоидной химии Губкинского университета.
Что такое неполярная связь?
Неполярная связь — это ковалентная связь между атомами, в которой электроны распределяются поровну между атомами. Равное распределение электронов приводит к образованию неполярной молекулы, которая не имеет электрического дипольного момента, или к разделению электрического заряда. Два одинаковых атома образуют неполярную связь, потому что они имеют одинаковую электроотрицательность.
Типичный пример неполярной связи можно найти в двухатомном кислороде. Каждый атом кислорода имеет шесть электронов в своей внешней оболочке, и для достижения стабильной конфигурации из восьми электронов благородного газа требуется еще два электрона. В молекуле кислорода атомы разделяют набор из четырех электронов одинаково в двойных связях, удовлетворяя потребность каждого атома в дополнительных двух электронах. Каждая из этих связей будет считаться неполярной связью.
В молекуле кислорода атомы разделяют набор из четырех электронов одинаково в двойных связях, удовлетворяя потребность каждого атома в дополнительных двух электронах. Каждая из этих связей будет считаться неполярной связью.
Неполярные ковалентные связи обычно обнаруживаются в двухатомных молекулах, где два одинаковых атома связаны друг с другом. К ним относятся йод, водород и азот. Общую полярность молекулы не следует путать с полярностью ее связей. Молекула может быть неполярной в целом, даже если ее атомы не связаны неполярной связью. Это происходит, когда полярные ковалентные связи отменяют заряд друг друга из-за молекулярной структуры.
В метане углерод связан с водородом в слегка полярных связях, связанных с неравномерным распределением электронов. Тетраэдрическая структура молекулы заставляет эти заряды подавляться, что приводит к неполярной молекуле. Даже если атомы не связаны неполярными связями, молекула ведет себя неполярным образом.
Это общее неполярное взаимодействие между атомами водорода и углерода делает органические соединения гидрофобными, что означает, что они не могут взаимодействовать с водой с образованием водородных связей.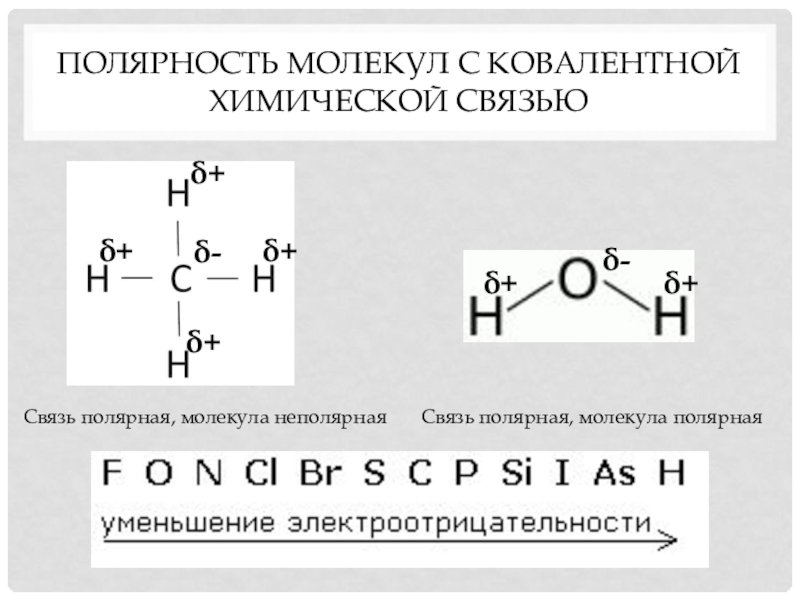 При взаимодействии с полярными молекулами вода образует водородные связи между своими положительно заряженными атомами водорода и электроотрицательным атомом из другой молекулы. Неполярные соединения не могут осуществлять это взаимодействие, потому что они не имеют разделения заряда по своей структуре и, следовательно, не имеют места для привлечения заряда.
При взаимодействии с полярными молекулами вода образует водородные связи между своими положительно заряженными атомами водорода и электроотрицательным атомом из другой молекулы. Неполярные соединения не могут осуществлять это взаимодействие, потому что они не имеют разделения заряда по своей структуре и, следовательно, не имеют места для привлечения заряда.
Гидрофобное поведение можно наблюдать в продуктах домашнего обихода, таких как растительное масло, которое заметно отделяется от воды. Неполярность гидрофобных веществ также является важным фактором в функционировании живых организмов. Липиды, которые встречаются в клеточных структурах, препятствуют смешиванию воды с внутренними структурами и отдельными жидкостями. Как и в случае с другими органическими соединениями, эти молекулы состоят из связей, которые почти, но не совсем, неполярны: их структура связей приводит к потере полярности.
Углекислый газ является еще одним примером неполярной молекулы с полярными связями.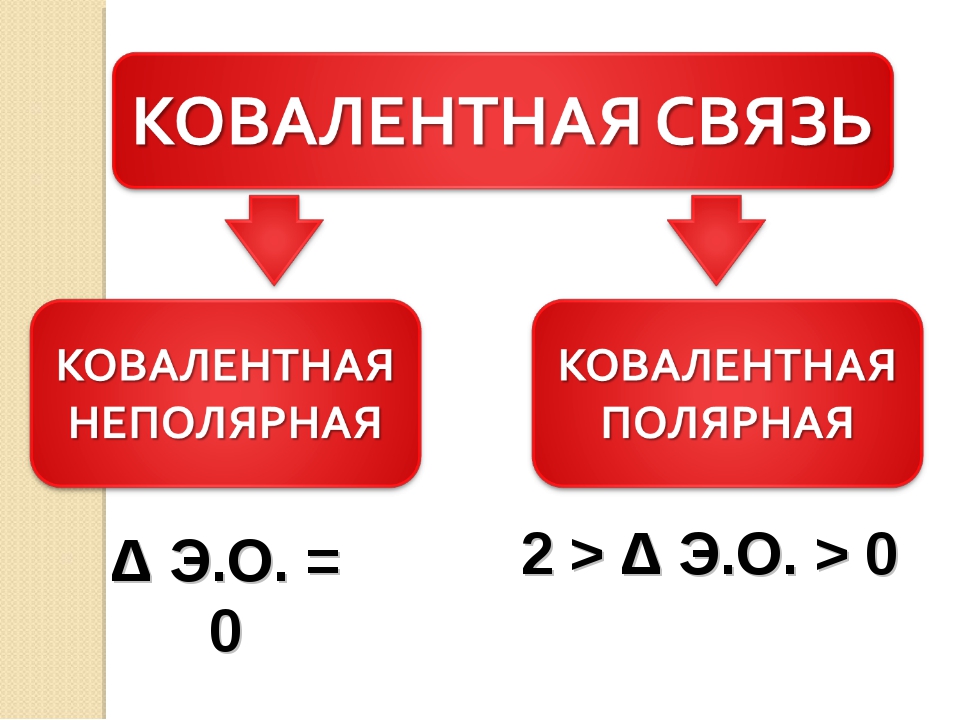 Структура этой молекулы линейная, с двумя атомами кислорода, двойно связанными с центральным атомом углерода. Эти связи являются полярными ковалентными, но поскольку они точно симметричны, их заряды аннулируются, создавая неполярную молекулу.
Структура этой молекулы линейная, с двумя атомами кислорода, двойно связанными с центральным атомом углерода. Эти связи являются полярными ковалентными, но поскольку они точно симметричны, их заряды аннулируются, создавая неполярную молекулу.
ДРУГИЕ ЯЗЫКИ
полярное и неполярное
полярное и неполярное В зависимости от относительной электроотрицательности двух атомов, разделяющих электроны, может происходить частичный перенос электронной плотности от одного атома к другому. Когда электроотрицательности не равны, электроны не распределяются поровну и возникают частичные ионные заряды.Чем больше разница электроотрицательностей, тем более ионная связь. Частично ионные связи называются полярными ковалентными связями .
Неполярные ковалентные связи с равным распределением электронов связи возникают, когда электроотрицательности двух атомов равны.
Полярные и неполярные ковалентные связи- Связь между двумя атомами неметалла, имеющими одинаковые электроотрицательность и, следовательно, имеют равное распределение связывающего электрона пара
- Пример: в H-H каждый атом H имеет электроотрицательность.
 значение 2.1, поэтому ковалентная связь между ними считается неполярной
значение 2.1, поэтому ковалентная связь между ними считается неполярной
Полярная ковалентная связь
- Связь между двумя атомами неметалла, имеющими разные электроотрицательности и, следовательно, неравномерное распределение связывающего электрона пара
- Пример: в H-Cl электроотрицательность Cl атома 3,0, а атома H 2,1
- В результате получается связь, в которой электронная пара смещается. к более электроотрицательному атому.Тогда этот атом получает частично отрицательный заряд, в то время как менее электроотрицательный атом имеет частично положительный заряд. разделение заряда или диполь связи можно проиллюстрировать с помощью стрелка, острие которой направлено в сторону более электроотрицательного атома.
Греческая буква , дельта означает «частично».
- Внутри молекулы каждая полярная связь имеет диполь связи
- Полярная молекула всегда содержит полярные связи, но
некоторые молекулы с полярными связями неполярны.

Полярный Молекула
- Молекула, в которой присутствующие диполи связей не компенсируют друг друга и, таким образом, получают молекулярный диполь . (см. ниже) . Отмена зависит от формы молекулы или стереохимии. и ориентация полярных связей.
Молекулярный диполь
- Результат диполей связи в молекуле.
- Связанные диполи могут или не могут аннулировать, тем самым производя либо неполярные молекулы, если они сокращаются, либо полярные, если они не отменить
- Примеры:
- CO 2 представляет собой линейную молекулу с 2 равные и противоположно направленные диполи связи, поэтому связь полярности отменяются, и молекула неполярна.
- HCN представляет собой линейную молекулу с двумя диполями связей, расположенными в одном направлении. и не равны, поэтому полярности связей не сокращаются, и молекула полярный
- Больше примеров можно найти в Таблице: Стереохимия.
 некоторых общих молекул
некоторых общих молекул
- Для фигурных диаграмм:
- Сплошные линии представляют облигации, которые находятся в той же . самолет как у страницы
- Пунктирными линиями обозначены облигации, направленные на и . самолет страницы
- Клин указывает облигации, которые направляются на наружу. самолет страницы
- При определении формы молекул электронные пары кратного облигации считаются группой, поскольку все образованные облигации имеют одинаковое направление
НАЗАД НА ГЛАВНУЮ СТРАНИЦУ
4.4. Полярные и неполярные ковалентные связи
Электроотрицательность и полярность связи
Хотя мы определили ковалентную связь как совместное использование электронов, электроны в ковалентной связи не всегда одинаково распределяются между двумя связанными атомами. Если связь не соединяет два атома одного и того же элемента, всегда будет один атом, который притягивает электроны в связи сильнее, чем другой атом, как показано на рисунке \ (\ PageIndex {1} \). Когда возникает такой дисбаланс, возникает накопление некоторого отрицательного заряда (называемого частичным отрицательным зарядом и обозначенного δ−) на одной стороне связи и некоторого положительного заряда (обозначенного δ +) на другой стороне связи.Ковалентная связь с неравномерным распределением электронов, как показано в части (b) на рисунке \ (\ PageIndex {1} \), называется полярной ковалентной связью. Ковалентная связь с равным распределением электронов (часть (а) на рисунке \ (\ PageIndex {1} \)) называется неполярной ковалентной связью.
Когда возникает такой дисбаланс, возникает накопление некоторого отрицательного заряда (называемого частичным отрицательным зарядом и обозначенного δ−) на одной стороне связи и некоторого положительного заряда (обозначенного δ +) на другой стороне связи.Ковалентная связь с неравномерным распределением электронов, как показано в части (b) на рисунке \ (\ PageIndex {1} \), называется полярной ковалентной связью. Ковалентная связь с равным распределением электронов (часть (а) на рисунке \ (\ PageIndex {1} \)) называется неполярной ковалентной связью.
Рисунок \ (\ PageIndex {1} \) Полярные и неполярные ковалентные связи. (а) Электроны в ковалентной связи в равной степени разделяются обоими атомами водорода. Это неполярная ковалентная связь. (б) Атом фтора притягивает электроны в связи больше, чем атом водорода, что приводит к дисбалансу в распределении электронов.Это полярная ковалентная связь.
Любая ковалентная связь между атомами разных элементов является полярной связью, но степень полярности сильно различается. Некоторые связи между различными элементами только минимально полярны, в то время как другие сильно полярны. Ионные связи можно считать предельной полярностью, при которой электроны переносятся, а не разделяются. Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность, которая является относительной мерой того, насколько сильно атом притягивает электроны, образуя ковалентную связь.Существуют различные числовые шкалы для оценки электроотрицательности. На рисунке \ (\ PageIndex {2} \) показана одна из самых популярных — шкала Полинга. О полярности ковалентной связи можно судить, определив разницу в электроотрицательностях двух атомов, образующих связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс распределения электронов в связи. Хотя нет никаких жестких правил, общее правило состоит в том, что разница в электроотрицательностях меньше примерно 0.4 связь считается неполярной; если разница больше 0,4, связь считается полярной.
Некоторые связи между различными элементами только минимально полярны, в то время как другие сильно полярны. Ионные связи можно считать предельной полярностью, при которой электроны переносятся, а не разделяются. Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность, которая является относительной мерой того, насколько сильно атом притягивает электроны, образуя ковалентную связь.Существуют различные числовые шкалы для оценки электроотрицательности. На рисунке \ (\ PageIndex {2} \) показана одна из самых популярных — шкала Полинга. О полярности ковалентной связи можно судить, определив разницу в электроотрицательностях двух атомов, образующих связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс распределения электронов в связи. Хотя нет никаких жестких правил, общее правило состоит в том, что разница в электроотрицательностях меньше примерно 0.4 связь считается неполярной; если разница больше 0,4, связь считается полярной. Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Разница электроотрицательностей, равная нулю, конечно же, указывает на неполярную ковалентную связь.
Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Разница электроотрицательностей, равная нулю, конечно же, указывает на неполярную ковалентную связь.
Рисунок \ (\ PageIndex {2} \) Электроотрицательность различных элементов. Популярная шкала электроотрицательностей имеет значение для атомов фтора, равное 4.0, максимальное значение.
Пример \ (\ PageIndex {1} \)
Опишите разницу в электроотрицательности между каждой парой атомов и результирующую полярность (или тип связи).
- C и H
- H и H
- Na и Cl
- O и H
Раствор
- Углерод имеет электроотрицательность 2,5, а водород — 2,1. Разница составляет 0,4, что довольно мало. Поэтому связь C – H считается неполярной.
- Оба атома водорода имеют одинаковое значение электроотрицательности — 2,1. Разница равна нулю, значит связь неполярная.
- Электроотрицательность натрия составляет 0,9, а хлора — 3,0. Разница составляет 2,1, что довольно велико, поэтому натрий и хлор образуют ионное соединение.
- При 2,1 для водорода и 3,5 для кислорода разница электроотрицательностей составляет 1,4. Мы ожидаем очень полярной связи, но не настолько полярной, чтобы связь O – H считалась ионной.
Упражнение
Опишите разницу в электроотрицательности между каждой парой атомов и результирующую полярность (или тип связи).
- C и O
- N и H
- N и N
- C и F
Когда связи молекулы полярны, молекула в целом может демонстрировать неравномерное распределение заряда в зависимости от того, как ориентированы отдельные связи. Например, ориентация двух связей O – H в молекуле воды (рис. \ (\ PageIndex {3} \)) изогнута: один конец молекулы имеет частично положительный заряд, а другой конец — частично отрицательный. плата. Короче говоря, сама молекула полярна.Полярность воды оказывает огромное влияние на ее физические и химические свойства. (Например, температура кипения воды [100 ° C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C = O в диоксиде углерода являются полярные, они лежат прямо напротив друг друга и, таким образом, нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа.(Например, углекислый газ превращается в газ при -77 ° C, что почти на 200 ° ниже, чем температура, при которой закипает вода.)
Рисунок \ (\ PageIndex {3} \) Физические свойства и полярность. На физические свойства воды и углекислого газа влияет их полярность.
Упражнения по обзору концепций
На что указывает электроотрицательность атома?
Какой тип связи образуется между двумя атомами, если разница в электроотрицательности мала? Середина? Большой?
ответов
Электроотрицательность — это качественная мера того, насколько атом притягивает электроны ковалентной связью.
Основные выводы
- Ковалентные связи между разными атомами имеют разную длину связи.
- Ковалентные связи могут быть полярными или неполярными, в зависимости от разницы электроотрицательностей между задействованными атомами.
Авторы и авторство
Типы ковалентных связей: полярные и неполярные
Электроны по-разному разделяются на ионные и ковалентные связи. Ковалентные связи могут быть неполярными или полярными и реагировать на электростатические заряды.
Ионные связи , как и в поваренной соли (NaCl), возникают из-за электростатических сил притяжения между положительно заряженными (Na +) и отрицательно заряженными (Cl-) ионами. Во втором блоке мы сравнили атомы со щенками и электроны с костями, аналогично тому, как работает связь. При ионной связи каждый щенок начинается с электронной кости, но один щенок действует как вор и крадет кость другого щенка (см. Рис. 3-1a). Теперь у одного щенка две электронные кости, а у одного — нет. Поскольку электронные кости в нашей аналогии имеют отрицательный заряд, щенок-вор получает отрицательный заряд из-за дополнительной кости.Щенок, потерявший электронную кость, заряжается положительно. Поскольку у щенка, потерявшего кость, заряд противоположен щенку-вору, щенки удерживаются вместе за счет электростатических сил, как ионы натрия и хлора!
В ковалентных связях , как и в случае газообразного хлора (Cl2), оба атома разделяют и прочно удерживают электроны друг друга. В нашей аналогии каждый щенок снова начинается с электронной кости. Однако вместо того, чтобы один щенок украл кость у другого, оба щенка держатся за обе кости (см. Рис.3-1b).
Некоторые ковалентно связанные молекулы, такие как газообразный хлор (Cl2), в равной степени разделяют свои электроны (как два одинаково сильных щенка, каждый из которых держит обе кости). Другие ковалентно связанные молекулы, такие как газообразный фтористый водород (HF), не разделяют электроны поровну. Атом фтора действует как немного более сильный щенок, который немного сильнее притягивает общие электроны (см. Рис. 3-1c). Несмотря на то, что электроны во фтористом водороде являются общими, фторсодержащая сторона молекулы воды сильнее притягивает отрицательно заряженные общие электроны и становится отрицательно заряженной.Атом водорода имеет небольшой положительный заряд, потому что он не может так крепко держаться за отрицательные электронные кости. Ковалентные молекулы с таким типом неравномерного распределения заряда полярны . Молекулы с полярными ковалентными связями имеют положительную и отрицательную стороны.
Рис. 3-1: Связывание с использованием аналогии со щенком. В этой аналогии каждый щенок представляет собой атом, а каждая кость представляет собой электрон.
Вода — полярная ковалентная молекула
Вода (h3O), как и фтористый водород (HF), представляет собой полярную ковалентную молекулу.Если вы посмотрите на диаграмму воды (см. Рис. 3-2), вы увидите, что два атома водорода неравномерно распределены вокруг атома кислорода. Неравномерное распределение электронов между атомами и несимметричная форма молекулы означает, что молекула воды имеет два полюса — положительный заряд на водородном полюсе (сбоку) и отрицательный заряд на кислородном полюсе (сбоку). Мы говорим, что молекула воды электрически полярна.
Рис. 3-2: Различные способы представления полярного распределения электронов в молекуле воды.Каждая диаграмма показывает несимметричную форму молекулы воды. На (a) и (b) полярные ковалентные связи показаны линиями. В части (c) полярные ковалентные связи показаны в виде электронных точек, общих для атомов кислорода и водорода. В части (d) диаграмма показывает относительный размер атомов, а связи представлены касанием атомов.
Деятельность
Полярная ковалентная связь водорода и кислорода в воде приводит к интересному поведению, su
Ориентация молекулы
Вода притягивается положительными и отрицательными электростатическими силами, потому что жидкие полярные молекулы ковалентной воды могут перемещаться, чтобы они могли ориентироваться в присутствии электростатической силы.(см. рис. 3-4).Эти силы можно увидеть на следующем видео:
Хотя мы не можем видеть отдельные молекулы, мы можем сделать вывод из наших наблюдений, что в присутствии отрицательного заряда молекулы воды поворачиваются так, что их положительные полюса водорода обращены к отрицательно заряженному объекту. То же самое было бы верно в присутствии положительно заряженного объекта; молекулы воды поворачиваются так, что отрицательные полюса кислорода обращены к положительному объекту.См. Рис. 3-5 для интерпретации художника.Симметрия и асимметрия
Помните, что в полярной молекуле притяжение одного атома сильнее, чем другого. Полярные ковалентные молекулы существуют всякий раз, когда существует асимметрия или неравномерное распределение электронов в молекуле. Один или несколько из этих асимметричных атомов притягивают электроны сильнее, чем другие атомы. Например, у полярного соединения метилового спирта отрицательный полюс состоит из углерода и водорода, а положительный — из кислорода и водорода (см.рис.3-6).
Однако, когда молекулы симметричны , атомы одинаково притягивают электроны и распределение заряда однородно. Симметричные молекулы неполярны. Поскольку неполярные молекулы равномерно разделяют свои заряды, они не реагируют на электростатические заряды, как вода. Ковалентные молекулы, состоящие только из одного типа атомов, такие как газообразный водород (h3), неполярны, потому что атомы водорода делят свои электроны поровну. Молекулы, состоящие из более чем одного типа ковалентно связанных неметаллических атомов, такие как газообразный диоксид углерода (CO2), остаются неполярными, если они симметричны или если их атомы имеют относительно одинаковое притяжение.Даже большие соединения, такие как гексан бензин (С6х24), симметричны и неполярны. Похоже, что электростатические заряды не оказывают большого влияния на неполярные соединения. См. Рис. 3-6 для примеров полярных и неполярных молекул.Полярная ковалентная связь — обзор
9.35.5.2.4 Ковалентные твердые вещества
В хорошем первом приближении и с правдоподобными результатами соединения, образующие полярные ковалентные связи, часто можно успешно описать с помощью ионных эмпирических потенциалов.Это особенно верно до тех пор, пока локальные координационные полиэдры анионов, которые окружают отдельные катионы, высокосимметричны, а общее распределение заряда в твердом теле приблизительно изотропно. В таком случае ковалентные и ионные модели во многих случаях создают один и тот же набор кандидатов в низкоэнергетические структуры, только с некоторыми разными ранжированием энергии в более высоких минимумах и, возможно, разными энергетическими барьерами между минимумами. Однако это не относится к системам, в которых важные локальные минимумы демонстрируют различные виды анизотропных связей, например, sp 2 — и sp 3 -гибридизированные атомы углерода, и затем необходимо выполнить глобальную оптимизацию ab initio энергетический ландшафт.
Например, в нитриде бора присутствует несколько видов, в основном ковалентных, вкладов в общую энергию, и глобальный поиск должен выполняться на уровне ab initio. Система BN особенно интересна как тестовая система, потому что экспериментально наблюдаемые модификации включают как слоистые структуры (гексагональный BN), так и трехмерные сети (типа вюрцита и сфалерита). При глобальной оптимизации, использующей как функционалы Хартри – Фока, так и функционалы плотности, 247 действительно были обнаружены все экспериментально наблюдаемые типы структур.Кроме того, было предсказано несколько новых модификаций, таких как слоистые структуры, но с порядком наложения, отличным от экспериментально наблюдаемой структуры h-BN. Сила общего ландшафтного подхода была впечатляюще продемонстрирована открытием двух замечательных новых каркасных структур с низкими энергиями, демонстрирующих структуру β-BeO и частичную структуру Al в SrAl 2 , соответственно.
В другом недавнем исследовании использовалось сочетание интеллектуального анализа данных, генерации сети и локальной оптимизации с ab initio расчетами энергии (DFT) для предсказания кристаллических структур нитридов и фосфидов группы 14. 384 Важным шагом было создание новых кандидатов путем разумной замены атомов разных типов в известных базовых сетях, что привело к появлению множества интересных структур. Эта процедура в некоторой степени похожа на один из подходов, используемых для поиска кандидатов в кристаллы в системе Si 3 B 3 N 7 . 55
| ПРИМЕР — Прогнозирование молекулярной полярности: Решить являются ли молекулы, представленные следующими формулами, полярными или неполярный.(Вам может потребоваться нарисовать структуры Льюиса и геометрические эскизы, чтобы сделать итак.)
Решение : а. Структура Льюиса для CO 2 —
г. Структура Льюиса для OF 2 — .
г. Молекулярная геометрия CCl 4 составляет четырехгранный. Хотя связи C-Cl полярны, их симметричное расположение делает молекулу неполярной. г. В Структура Льюиса для CH 2 Cl 2 составляет
e. В Структура Льюиса и геометрический эскиз для HCN такие же:
|
Разница между полярностью и неполярностью
Полярность и неполярность молекул зависят от электроотрицательности.Теория электроотрицательности лежит во всей неорганической химии. Чем более электроотрицателен атом, тем больше он ищет электронов. Если один атом более электроотрицателен, чем другие, он может образовывать ионную связь или полярную ковалентную связь. Образование ионной связи происходит, когда основной электроотрицательный атом полностью забирает электрон у другой молекулы. Если атом просто притягивает электроны к себе и образует полярную ковалентную связь. Таким образом, несопоставимое разделение электронов приводит к тому, что связь имеет частичный положительный и отрицательный конец.
Идентификация полярных и неполярных связей:
Как упоминалось ранее, возможны два типа связей: либо полностью полярные, либо неполярные. Когда нет различия между электроотрицательностями молекул, связь будет неполярной ковалентной связью. С другой стороны, когда более электроотрицательный атом оттягивает электрон от другого атома, образуются полярные ионные связи.
Но что происходит между этими двумя конечностями?
Идентификация облигации представлена в табличном формате ниже с точки зрения электроотрицательности:
Тип связи | Разница в электроотрицательности |
Чистая ковалентная .4 | |
Полярный ковалент | Между 0,4 и 1,8 |
Ионный | > 1,8 |
Разница в электроотрицательности является основной причиной из-за разницы между полярностями. и неполярные связи.
Polar Vs. Неполярный:
Соединение может иметь полярные ковалентные связи, но не может быть полярным соединением. Причина в том, что из-за наличия чистого диполя в полярном соединении они расположены асимметрично.Возьмем, к примеру, воду; это полярное соединение. Они обладают как частичным положительным зарядом, так и не могут компенсироваться.
Принимая во внимание, что неполярные соединения могут либо разделять целые электроны, либо обладать симметричными полярными связями, которые могут нейтрализовать какой-то чистый диполь. Возьмем, к примеру, трифторид бора (BF3), где полярные связи расположены в одной плоскости и в конечном итоге нейтрализуют друг друга. Табличный формат приведен ниже при различении обоих соединений:
Полярный | Неполярный |
Полярные соединения расположены асимметрично. | Они обладают симметричными полярными связями. |
Молекула была бы полярной, если бы у нее был нулевой дипольный момент. Пример: вода | Неполярные молекулы имеют значительное значение дипольного момента. Пример: CCl4 |
Полярные молекулы обладают равным распределением электронной плотности. | Неравномерное распределение электронной плотности приводит к неполярной молекуле. |
Разница между полярными и неполярными соединениями:
Чтобы понять разницу между полярными и неполярными соединениями, необходимо сосредоточиться на структуре Льюиса.Неполярные соединения будут симметричными, что означает наличие идентичных атомов вокруг центрального атома, который связывается с элементом без каких-либо неподеленных пар электронов. Принимая во внимание молекулу CCl4, она полностью неполярна из-за ее тетраэдрической структуры.
По сравнению с неполярными соединениями полярные соединения асимметричны по своей природе, поскольку они содержат неподеленные пары электронов на центральном атоме, а присоединенные атомы обладают разной электроотрицательностью.Например, фтористый водород (HF) — это двухатомная молекула, одна сторона которой слегка положительна, а другая — слегка отрицательна. Это различие в электроотрицательности делает его полярным соединением. Связь представляет собой полярную ковалентную связь.
Высокая электроотрицательность атома фтора увлекает за собой все положительные заряды атома H. Вот почему на атоме H генерируется частичный положительный заряд, а на атоме F. Вся молекула считается дипольной молекулой из-за неравномерного распределения электронной плотности.
Еще одна важная вещь, которую следует учитывать при определении полярных и неполярных молекул, — это геометрия молекул. На приведенном ниже рисунке показано сравнение воды и оксида углерода. Из-за линейной структуры молекулы CO2 более высокие электроотрицательные атомы кислорода увлекают заряды от атома углерода и, таким образом, два изолированных диполя, направленных наружу от атома углерода к атому кислорода. Так что диполи уравновешивают друг друга, и молекулярная полярность СО2 становится нулевой.CO2 — неполярная молекула.
В то время как вода имеет изогнутую структуру и из-за более высокой электроотрицательности кислорода она вытягивает заряды, поэтому прямая связь будет идти от Н к О. Благодаря этой структуре диполи не могут компенсировать друг друга, и соединение полярно. .
Представляет геометрию молекулы, которая влияет на полярность. CO2 обладает нулевым дипольным моментом из-за линейной структуры и становится неполярной молекулой. Напротив, вода является полярным соединением из-за ее изогнутой структуры, и дипольный момент не может достигать нуля
Разница между полярными и неполярными растворителями:
Основная разница между полярными и неполярными растворителями заключается в том, что полярный растворитель растворяется в полярном растворителе. соединение, тогда как неполярный растворитель растворяется в неполярных соединениях.Более того, полярные растворители обладают молекулами с полярными связями, а неполярные растворители обладают молекулами с аналогичными значениями электроотрицательности.
Что такое полярные растворители?
Обычно полярные молекулы и полярные растворители обладают большими значениями дипольного момента. Полярные растворители — это жидкости, которые могут растворять различные полярные соединения. Это связано с тем, что положительно заряженная молекула соединения легко притягивается отрицательно заряженной молекулой растворителя, что приводит к разжижению полярных соединений до полярных растворителей.Ранее было показано, что полярность растворителя возникает из-за несоответствия электроотрицательности молекул.
Что такое неполярные растворители?
Неполярные растворители — это жидкости, не имеющие дипольного момента. Эти неполярные растворители не обладают частичными положительными или отрицательными зарядами. Вот почему неполярные растворители не могут растворять полярные соединения, поскольку отсутствуют противоположные заряды, притягивающие полярные.
ROCO-резонанс: все
Практически любая волновая функция может быть улучшена при хоть немного, объединив его с другими функциями.Итак, в этом В смысле каждая молекула представляет собой резонансный гибрид. Но это несерьезно.
На самом деле я спрашиваю: «большинство (или все) молекулы резонансных гибридов в каком-то значительном пути? » Можем ли мы думать о молекуле, даже с небольшим успехом, без используя резонанс, или резонанс — универсальное явление?
Не раскрывая ответа, скажу лишь, что резонанс гораздо более распространен, чем большинство химиков понимают.Чтобы убедить вас в этом, я опишу два широко распространенных электронных паттерна, которые, кажется, связаны с резонансом: полярные ковалентные связи и неполярные ковалентные связи.
Предупреждение — современные химики не упоминают к локализованным связям как резонансным гибридам. Однако Полинг описал их как резонансные гибриды, и это может помочь вам понять связи лучше, если вы подумаете о них (хотя бы вкратце) так, как он.
Полярные ковалентные связи
Связь AB, представленная формами IV и V, является частичной двойная связь. Разделение зарядов в V показывает, что связь имеет полярный характер. Такая связь появляется во многих группах — C = O, CN (двойная и тройная) и N = O — и химики-органики единодушны в том, что эти группы являются резонансными гибриды.
Облигация AB, представленная формами II и III, выглядит похоже на такую же суперпозицию, но является ли эта группа резонансным гибридом?
Когда-то резонанс II / III назывался no-bond резонанс (поскольку у III отсутствует связь), а AB рассматривался как резонансный гибрид.Однако химики как-то потеряли интерес / осознание этого описание и перестали говорить об этом и обучении этому. Теперь вместо того, чтобы называть AB резонансом гибрид, они говорят, что связь AB — это локализованная ковалентная связь с полярным характером.
Химики могут отрицать существование резонанса без связи, если они хотят, но их так называемая «локализованная полярная ковалентная связь» идентична резонансу без связи. Чтобы доказать это, я построю суперпозицию II и III.Как обычно, я начинаю с написания волновой функции для каждой формы резонанса:
WF (II) = BO (AB) = AO (A) + АО (Б)
WF (III) = AO (B)
Затем я совмещаю эти формы:
WFsuper = WF (II) + n WF (III)
= AO (A) + AO (B) + n AO (B)
= АО (А) + (1 + n ) АО (В)
Последняя строка показывает, что суперпозиция II / III (резонанс без связи) эквивалентен орбитали полярной связи, в которой доминирует атом B, i.е., резонанс II / III дает локализованная (?) полярная ковалентная связь.
На рисунке «локализованная полярная ковалентная связь» есть одна преимущество: это избавляет нас от рисования резонансных форм для каждой полярной Ковалентная связь. Однако «локализованная» картинка также имеет два существенных недостатка. Он скрывает факторы, которые приводят к полярному соединению: небольшой энергетический зазор между формами II и III и сильное взаимодействие между эти формы.И это побуждает нас давать разные ярлыки похожим паттерны (IV / V против II / III).
Неполярное ковалентное связывание
Ковалентная связь в h3 неполярный, и Полинг предложил рассматривать его как суперпозиция резонансных форм IX и X:
(Позвольте мне пояснить значение этих рисунков.IX показывает «синий» электрон около левого ядра H и «красный» электрон около правого ядра H. Электроны поменялись местами в X. Формы IX и X «локализуют» по одному электрону около каждого атомного ядра. Электронное «деление» (делокализация) не происходит, пока мы не наложим IX и X.)
В подтверждение своего аргумента Полинг рассчитал энергию резонансной формы IX для нескольких расстояний HH. E (IX) совсем не ведет себя как энергия h3.С другой стороны, Esuper ведет себя реально.
Кажется правдоподобным, что суперпозиция IX и X может быть лучшей волновой функцией, чем IX или только X. IX и X имеют одинаковую энергию, что является одним из наших условий для эффективного суперпозиция. И IX и X сильно взаимодействуют, когда расстояние HH вкратце, наше второе условие эффективной суперпозиции.
Если мы сосредоточимся на «синем» электроне, то найдем:
WF (IX) = AO (Hleft)
WF (X) = AO (Hright)
WFsuper = AO (слева) + AO (справа) = BO (HH)
Делокализация, создаваемая резонансом между IX и X, эквивалентна делокализации, создаваемой связующей орбиталью.Без делокализации (резонанса) нет никакой связи.
Сводка
Ковалентные связи, как полярные, так и неполярные, следует рассматривать как суперпозицию более простых волновых функций. Суперпозиции могут быть построены с использованием различной терминологии. Если совместить резонанс форм, получаем резонансный гибрид. С другой стороны, если мы объединим атомные орбитали, мы получим связующие орбитали. На этих изображениях может использоваться разная терминология, но они приводят к одним и тем же волновым функциям, и оба подтверждают фундаментальные роль суперпозиции в химической связи.
.



 значение 2.1, поэтому ковалентная связь между ними считается неполярной
значение 2.1, поэтому ковалентная связь между ними считается неполярной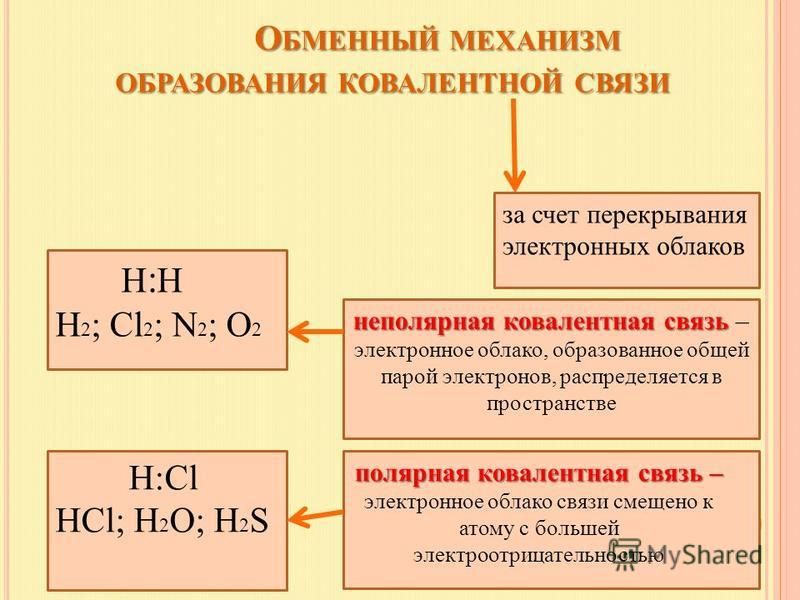
 некоторых общих молекул
некоторых общих молекул