Пикраты — Википедия
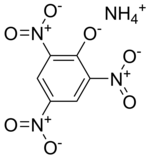 Пикрат аммония
Пикрат аммонияПикраты — группа химических соединений — солей пикриновой кислоты (2,4,6-тринитрофенола C6H2(NO2)3OH). Традиционно в эту группу включают также соединения пикриновой кислоты с некоторыми органическими веществами, которые, как правило, не являются солями. Пикриновая кислота образует пикраты практически со всеми металлами, за исключением олова. Пикраты чаще всего используют как инициирующие взрывчатые вещества или компоненты составов, повышающие их чувствительность.
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил Глаубер, воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог. Считается, что первые печатные сообщения о пикратах опубликованы в 1795 году, однако длительное время их состав и свойства не были точно определены. Первое применение смеси пикрата калия, нитрата калия и угля как взрывчатого вещества было предложено Десиньолем (Designolle) в 1869. В этом же году Фонтэйн (Fountaine) предложил смесь пикрата калия и хлората калия, а Абель (Abel) предложил смесь пикрата аммония и нитрата калия. Первые систематические исследования пикратов металлов были проведены в 1901 Дюпре (Dupre), продолжены Уиллом (Will) в 1906, Силберрадом (Silberrad) и Филлипсом (Phillips) в 1908, Кастом (Kast) в 1911.
Общее свойство всех пикратов — образовывать кристаллогидраты с различным количеством молекул воды. Чувствительность в значительной степени зависит от количества остаточной воды, чем её больше, тем менее чувствительны материалы.
В ряду пикратов с различными катионами чувствительность уменьшается в ряду:
Pb>Fe>Co>Ni>Ba>Cu>Mn>Zn>Ca, Na, NH
Пикраты могут быть получены действием на пикриновую кислоту гидроксидов или карбонатов соответствующих металлов, а также другими методами.
Пикрат алюминия[править | править код]
Химическая формула [C6H2(NO2)3O]3Al, молекулярная масса 711,31 а. е. м. Содержание азота 17,73 %. Плавится выше 100 °C, при дальнейшем нагревании взрывается. Может быть получен продолжительным нагреванием из его гидратов (например, ди-, тетра-, дека- или гексадекагидрата) при температуре ниже 100 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 40,6 см (для тротила — 35,6 см).
Дигидрат пикрата алюминия [C6H2(NO2)3O]3Al*2H2O получается из декагидрата при нагревании до +80 °C. По чувствительности он сравним с безводной солью, а декагидрат имеет низкую чувствительность. Дигидрат пикрата алюминия взрывается при температуре около 360 °C.
Основной пикрат алюминия [C6H2(NO2)3O]2AlOH·7H2O, молекулярная масса 530,35 а. е. м. Красноватые или палево-желтые игольчатые кристаллы, при нагреве до +80 °C переходят в тетрагидрат жёлтого цвета, который при дальнейшем нагревании взрывается.
Пикрат аммония[править | править код]
Другие названия: тринитрофенолят аммония, взрывчатое вещество Д и даннит (en:dunnite) (в военном применении в США).
Химическая формула C6H2(NO2)3ONH4, молекулярная масса 246,14. Содержание азота 22,77 %. Кислородный баланс с окислением до CO2: −52 %. Две формы: стабильная жёлтая и метастабильная красная.
Получают реакцией нейтрализации в водном растворе пикриновой кислоты аммиаком в виде газа или водного раствора.
Пикрат аммония — одно из первых бризантных взрывчатых веществ, которые начали применяться в XIX веке для снаряжения боеприпасов, название даннит получил от фамилии майора армии США Данна, предложившего использовать его в снарядах. Под наименованием Explosive D (взрывчатое вещество Д) широко использовался и используется в США. Входит в состав нескольких взрывчатых смесей (например, пикратола).
По взрывчатым характеристикам незначительно уступает тротилу, чувствительность меньше, чем у тротила.
Пикрат бария[править | править код]
Химическая формула [C6H2(NO2)3O]2Ba, молекулярная масса 594,64 а. е. м. Содержание азота 14,14 %. Жёлтый кристаллический порошок, взрывается при 333—337 °C с умеренной мощностью. Может быть получен нагреванием пентагидрата [C6H2(NO2)3O]Ba·5H2O . Пентагидрат — жёлтые призматические игольчатые кристаллы, получаются из концентрированного водного раствора. Безводная соль взрывается при 403 °C, но малочувствительна к удару и трению.
Пикрат кадмия[править | править код]
Химическая формула [C6H2(NO2)3O]2Cd, молекулярная масса 569,70 а. е. м. Содержание азота 14,76 %. Жёлтый кристаллический порошок. Взрывается при 336—341 °C. Получается нагревом кристаллогидратов при 80-150 °C. (пента-, гепта- или октогидрата). Чувствительность к удару безводной соли по методу Арсенала Пикатинни с грузом 2 кг составляет 30,5 см (тротил — 35,6 см). Чувствительность октагидрата 88,9 см, он менее чувствителен, чем дымный порох.
Пикрат кальция[править | править код]
Химическая формула [C6H2
Пикрат церия[править | править код]
Химическая формула [C6H2(NO2)3O]2Ce, молекулярная масса 824,45 а. е. м. Содержание азота 15,29 %. Коричневый кристаллический порошок. Взрывается при 306—313 °C. Получается нагревом кристаллогидратов (три-, или ундекагидрата).
Пикрат цезия[править | править код]
Химическая формула C6H2(NO2)3OCs, молекулярная масса 361,01 а. е. м. Содержание азота 11,64 %. Жёлтые иглообразные кристаллы. Взрывается при 277—287 °C. Использовался в США для возбуждения взрыва в зарядах гексогена в магнитогидродинамических генераторах (МГД-генераторах).
Пикрат хрома[править | править код]
Химическая формула [C6H2(NO2)3O]5Cr·27H20, молекулярная масса 1695,09 а. е. м. Содержание азота 12,04 %. Зелёный кристаллический порошок. Получается взаимодействием эквивалентных количеств пикрата бария и фиолетовой модификации сульфата хрома (зелёная модификация не полностью реагирует с пикратом бария). Безводная соль получается дегидратацией при 150 °C. Тридекагидрат и моногидрат взрываются при 330 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для тридекагидрата 91,4 см, для моногидрата 20,3 см (для тротила — 35,6 см).
Пикрат кобальта[править | править код]
Химическая формула [C6H2(NO2)3O]2Co, молекулярная масса 371,03 а. е. м. Содержание азота 22,66 %. Коричневый кристаллический порошок. Взрывается при 320—325 °C. Получается нагревом кристаллогидратов при 150 °C.
Пикрат меди[править | править код]
Химическая формула [C6H2(NO2)3O]2Cu, молекулярная масса 520,85 а. е. м. Содержание азота 16,14 %. Жёлто-зелёный кристаллический порошок, очень гигроскопичный. Взрывается при 282—287 °C, по другим данным при 373 °C. Получается нагревом кристаллогидратов при 80-150 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 30,5 (для тротила — 35,6 см). Тригидрат взрывается при 300 °C, его чувствительность к удару 48,3 см.
Пикрат железа (III)[править | править код]
Химическая формула [C6H2(NO2)3O]3Fe·11H2O, молекулярная масса 938,4 а. е. м. Содержание азота 13,44 %. Красно-жёлтый игольчатый кристаллический порошок. Получен Кастом в 1911 обработкой горячего насыщенного раствора сульфата железа пикратом бария. Имеет несколько кристаллогидратов, которые взрываются при 295 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — от 15,2 см для материала, высушенного при 150 °C, до 91,4 см для материала, высушенного при +25 °C.
Пикрат железа II[править | править код]
Химическая формула[C6H2(NO2)3O]2Fe, молекулярная масса 513,15 а. е. м. Содержание азота 16,38 %. Тёмно-зелёный кристаллический порошок. Взрывается при 315—320 °C. Получается сушкой октагидрата в вакуумном эксикаторе над серной кислотой. Октагидрат был получен обработкой горячего насыщенного раствора сульфата железа (II) пикратом бария. Жёлтые гексагональные призмы октагидрата при хранении приобретают коричневый цвет. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 91,4 см.
Пикрат свинца[править | править код]
Химическая формула [C6H2(NO2)3O]2
Моногидрат пикрата свинца был запатентован во Франции в 1872 году для применения в капсюлях и детонаторах. Использовался в Германии для производства зажигательных смесей.
Пикрат лития[править | править код]
Химическая формула C
Пикрат магния[править | править код]
Химическая формула [C6H2(NO2)3O]2Mg, молекулярная масса 481,60 а. е. м. Содержание азота 17,45 %. Взрывается при 367—372 °C. Получается сушкой гидратов при 150 °C.
Пикрат марганца[править | править код]
Химическая формула [C6H2(NO2)3O]2Mn, молекулярная масса 512,23 а. е. м. Содержание азота 16,41 %. Жёлтый кристаллический порошок. Взрывается при 325—330 °C. Получается сушкой гидратов при 150 °C.
Пикрат никеля[править | править код]
Химическая формула [C6H2(NO2)3O]2Ni, молекулярная масса 516,01 а. е. м. Содержание азота 16,29 %. Зелёный кристаллический порошок. Взрывается при 335—340 °C, гексагидрат взрывается при 390 °C. Получается сушкой гидратов. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для безводной соли — 10,1 см.
Пикраты платины[править | править код]
Платина образует комплексные соединения, содержащие ион пикриновой кислоты:
- [Pt(CH3SCH3)4]·[C6H2(NO2)3O]2, содержание азота 9,32 %, жёлтые кристаллы, взрывается при нагреве.
- [Pt(C2H5SCH2CH2SC2H5)2]·[C6H2(NO2)3O]2, содержание азота 8,8 %, жёлтые кристаллы, взрывается при нагреве.
Пикрат калия[править | править код]
Химическая формула C6H2(NO2)3OK, молекулярная масса 267,20 а. е. м. Содержание азота 15,73 %. Красновато-жёлтые или зелёные ромбические кристаллы. Взрывается при 310—316 °C. Предположительно, впервые был получен Глаубером в XVII веке растворением древесины в азотной кислоте и нейтрализацией поташом K2CO3. Получается в реакции нейтрализации горячего водного раствора карбоната калия горячим раствором пикриновой кислоты и отделением кристаллов при охлаждении раствора. Растворимость в воде при +15 °C 0,5 г/100 г воды, при 100 °C 25 г/100 г воды. Растворимость в этиловом спирте 0,2 г/ 100 г. Теплота взрывчатого разложения при постоянном объёме 621,8 ккал/моль. Взрывается при 370 °C.
Чувствительность к удару 2 дюйма. Стабильность близка к пикрату аммония (Explosive D), но бризантность меньше. При контакте с огнём детонирует. При любых условиях взрывания выделяется чёрный дым неокисленного углерода. Смеси с окислителями (например, нитратом калия) могут гореть без детонации, но чувствительны к удару и опасны в обращении.
В 1869 году Десиньолем разработан взрывчатый состав (смесь пикрата калия, нитрата калия и древесного угля) (порох Десиньоля), а также порох Фонтэйна (Fountain) (смесь пикрата калия и хлората калия). Пикрат калия использовался в пиротехнических составах для сигнальных свистков (использующих характерный звук, возникающий при горении некоторых пикратов). Использовался в составе баллиститных твёрдых ракетных топлив, в различных инициирующих составах (например, в смесях пикрата калия, пикрата свинца и хлората калия).
Смесь мелкодисперсных пикрата калия с нитратом калия в соотношении 60:40 по массе, плотно упакованная в бумажные или бамбуковые трубочки диаметром от ¼ до ¾ дюйма, горит с громким свистящим звуком. Во время Второй мировой войны немецкая армия применяла такие свистки в качестве дополнительных устройств к бомбам для усиления психологического воздействия. Свистки применялись как сигнальное средство при газовой атаке. Указанная смесь имеет высокую чувствительность и опасна в обращении, поэтому была заменена смесью галловой кислоты и хлората калия.
Пикрат рубидия[править | править код]
Химическая формула C6H2(NO2)3ORb, молекулярная масса 313,58 а. е. м. Содержание азота 13,40 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 300—315 °C. Взрывается при ударе.
Пикрат серебра[править | править код]
Серебро образует комплексные аммиачные соли [Ag(NH3)2]·[C6H2(NO2)3O]2, молекулярная масса 682,23. Содержание азота 28,75 %. Жёлтые кристаллы, взрываются при нагреве.
Пикрат натрия[править | править код]
Химическая формула C6H2(NO2)3ONa, молекулярная масса 251,10 а. е. м. Содержание азота 16,74 %. Желтоватый игольчатый кристаллический порошок. Взрывается при 310—315 °C. Получается сушкой моногидрата при 150 °C. Моногидрат был получен нейтрализацией водного раствора пикриновой кислоты карбонатом натрия. Моногидрат взрывается при 360 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для моногидрата 43,2 см, для безводной соли 38,1 см (для тротила 35,6 см).
Пикрат натрия горит при контакте с пламенем и придаёт эти свойства смесям с другими материалами. Использовался во взрывчатых и пиротехнических составах, в том числе вместо пикрата калия.
Двойные пикраты (например, получаемые совместно пикрат натрия и пикрат свинца) показывают меньшую чувствительность к удару, чем эти соли по отдельности.
Пикрат таллия[править | править код]
Химическая формулаC6H2(NO2)3OTl, молекулярная масса 432,48 а. е. м. Содержание азота 9,72 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 273—275 °C. Получается обработкой раствора пикриновой кислоты карбонатом таллия. Взрывается при нагреве и ударе.
Пикрат тория[править | править код]
Химическая формула [C6H2(NO2)3O]4Th, молекулярная масса 1324,68 а. е. м. Содержание азота 12,69 %. Жёлтый игольчатый кристаллический порошок. Температура плавления +52— +53 °C. Взрывается при контакте с пламенем.
Пикрат цинка[править | править код]
Химическая формула [C6H2(NO2)3O]2Zn, молекулярная масса 522,67 а. е. м. Содержание азота 16,08 %. Жёлто-коричневый кристаллический порошок. Взрывается при 350—355 °C. Получается сушкой гидратов при 150 °C. Чувствительность к удару 60 см для груза 2 кг, что близко к пикриновой кислоте.
Пикрат циркония[править | править код]
Химическая формула [C6H2(NO2)3O]4Zr, молекулярная масса 1032,66 а. е. м. Содержание азота 16,75 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 317—322 °C. Может быть получен действием карбоната циркония на раствор пикриновой кислоты.
Пикриновая кислота образует соединения, подобные пикратам, со многими органическими веществами: углеводородами, нитросоединениями, аминами, фенолами и др. Как правило, их можно получить кипячением спиртовых растворов с последующим охлаждением и выпадением кристаллов пикратов. Отдельные примеры таких соединений:
- пикрат аценафтена (acenaphthen) C12H10+C6H2(NO2)3OH. Оранжево-красные призматические кристаллы, температура плавления 161—162 °C, взрывается при 412 °C.
- пикрат аллиламина (allylamine) C3H7N+C6H2(NO2)3OH. Лимонно-жёлтые игольчатые кристаллы, температура плавления 140—141 °C, взрывается при 270 °C.
- пикрат анилина C6H5NH2+C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления с разложением 165 °C, взрывается при 398 °C.
- пикрат атропина, температура плавления 173—175 °C, взрывается при 460 °C.
- пикрат азидогуанидина N3CNHNH2+C6H2(NO2)3OH. Взрывается при нагреве, к удару нечувствителен.
- пикрат цинхонидина (cinchonidine) 2C19H22ON2+3C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления 194—195 °C, взрывается при 260—268 °C.
- пикрат гуанидина CH5N3+C6H2(NO2)3OH. Жёлтые кристаллы, взрывается при 498 °C.
- пикрат гексаметилентетрамина C6H12N4+C6H2(NO2)3OH. Жёлтые игольчатые, взрывается при 360 °C.
- пикрат гидразина N2H4+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 201 °C, взрывается при 385 °C.
- пикрат индена C9H8+C6H2(NO2)3OH. Золотисто-жёлтые кристаллы, температура плавления 98 °C, высокая чувствительность в сухом состоянии, на воздухе медленно разлагается.
- пикрат нафталина C10H8+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 149—151 °C, взрывается при 484 °C. Образует с пикриновой кислотой эвтектическую смесь.
- пикрат альфа-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-жёлтые игольчатые кристаллы, температура плавления 189—190 °C, взрывается при 458 °C.
- пикрат бета-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-красные игольчатые кристаллы, температура плавления 155—157 °C, взрывается при 469 °C.
- пикрат фенантрена C14H10+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 143—145 °C, взрывается при 478 °C.
- пикрат пиридина C5H5N+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 165—166 °C, взрывается при 432 °C.
- Пикрат карбамида (мочевины) CH4ON2+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 142 °C с разложением, взрывается при 489 °C.
- Fedoroff, Basil T. et al Enciclopedia of Explosives and Related Items, vol.1—7. — Dover, New Jersey: Picatinny Arsenal. — 1960—1975. — P274-P285.
Военное дело — Пикраты
Пикраты — группа химических соединений — солей пикриновой кислоты (2,4,6-тринитрофенола C6h3(NO2)3OH). Традиционно в эту группу включают также соединения пикриновой кислоты с некоторыми органическими веществами, которые, как правило, не являются солями. Пикриновая кислота образует пикраты практически со всеми металлами, за исключением олова. Пикраты чаще всего используют как инициирующие взрывчатые вещества или компоненты составов, повышающие их чувствительность.
История
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил Глаубер в 1742 году, воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог. Считается, что первые печатные сообщения о пикратах опубликованы в 1795 году, однако длительное время их состав и свойства не были точно определены. Первое применение смеси пикрата калия, нитрата калия и угля как взрывчатого вещества было предложено Десиньолем (Designolle) в 1869. В этом же году Фонтэйн (Fountaine) предложил смесь пикрата калия и хлората калия, а Абель (Abel) предложил смесь пикрата аммония и нитрата калия. Первые систематические исследования пикратов металлов были проведены в 1901 Дюпре (Dupre), продолжены Уиллом (Will) в 1906, Силберрадом (Silberrad) и Филлипсом (Phillips) в 1908, Кастом (Kast) в 1911.
Глаубер, Иоганн Рудольф
Взрывчатые свойства
Общее свойство всех пикратов — образовывать кристаллогидраты с различным количеством молекул воды. Чувствительность в значительной степени зависит от количества остаточной воды, чем её больше, тем менее чувствительны материалы.
В ряду пикратов с различными катионами чувствительность уменьшается в ряду: Pb>Fe>Co>Ni>Ba>Cu>Mn>Zn>Ca, Na, Nh5
Получение
Пикраты могут быть получены действием на пикриновую кислоту гидроксидов или карбонатов соответствующих металлов, а также другими методами.
Отдельные неорганические пикраты
Пикрат алюминия
Химическая формула [C6h3(NO2)3O]3Al, молекулярная масса 711,31 а. е. м. Содержание азота 17,73 %. Плавится выше 100 °C, при дальнейшем нагревании взрывается. Может быть получен продолжительным нагреванием из его гидратов (например, ди-, тетра-, дека- или гексадекагидрата) при температуре ниже 100 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 16 дюймов (для тротила — 14 дюймов).
Дигидрат пикрата алюминия [C6h3(NO2)3O]3Al*2h3O получается из декагидрата при нагревании до 80 °C. По чувствительности он сравним с безводной солью, а декагидрат имеет низкую чувствительность. Дигидрат пикрата алюминия взрывается при температуре около 360 °C.
Основной пикрат алюминия [C6h3(NO2)3O]2AlOH·7h3O, молекулярная масса 530,35 а. е. м. Краснованые или палево-желтые игольчатые кристаллы, при нагреве до 80 °C переходят в тетрагидрат жёлтого цвета, который при дальнейшем нагревании взрывается.
Пикрат аммония
Другие названия: тринитрофенолят аммония, взрывчатое вещество Д и даннит (en:dunnite) (в военном применении в США). Химическая формула C6h3(NO2)3ONh5, молекулярная масса 246,14. Содержание азота 22,77 %. Кислородный баланс с окислением до CO2: −52 %. Две формы: стабильная жёлтая и метастабильная красная. Получают реакцией нейтрализации в водном растворе пикриновой кислоты аммиаком в виде газа или водного раствора. Пикрат аммония — одно из первых бризантных взрывчатых веществ, которые начали применяться в XIX веке для снаряжения боеприпасов, название даннит получил от фамилии майора армии США Данна, предложившего использовать его в снарядах. Под наименованием Explosive D (взрывчатое вещество Д) широко использовался и используется в США. Входит в состав нескольких взрывчатых смесей (например, пикратола). По взрывчатым характеристикам близок к тротилу, а чувствительность меньше, чем у тротила.
Пикрат бария
Химическая формула [C6h3(NO2)3O]2Ba, молекулярная масса 594,64 а. е. м. Содержание азота 14,14 %. Жёлтый кристаллический порошок, взрывается при 333—337 °C с умеренной мощностью. Может быть получен нагреванием пентагидрата [C6h3(NO2)3O]Ba·5h3O . Пентагидрат — жёлтые призматические игольчатые кристаллы, получаются из концентрированного водного раствора. Безводная соль взрывается при 403 °C, но малочувствительна к удару и трению.
Пикрат кадмия
Химическая формула [C6h3(NO2)3O]2Cd, молекулярная масса 569,70 а. е. м. Содержание азота 14,76 %. Жёлтый кристаллический порошок. Взрывается при 336—341 °C. Получается нагревом кристаллогидратов при 80-150 °C. (пента-, гепта- или октогидрата). Чувствительность к удару безводной соли по методу Арсенала Пикатинни с грузом 2 кг составляет 12 дюймов (тротил — 14 дюймов). Чувствительность октагидрата 35 дюймов, он менее чувствителен, чем дымный порох.
Пикрат кальция
Химическая формула [C6h3(NO2)3O]2Ca, молекулярная масса 497,38 а. е. м. Содержание азота 16,90 %. Жёлтый кристаллический порошок. Взрывается при 323—328 °C. Получается нагревом декагидрата при 80 °C.
Пикрат церия
Химическая формула [C6h3(NO2)3O]2Ce, молекулярная масса 824,45 а. е. м. Содержание азота 15,29 %. Коричневый кристаллический порошок. Взрывается при 306—313 °C. Получается нагревом кристаллогидратов (три-, или ундекагидрата).
Пикрат цезия
Химическая формула C6h3(NO2)3OCs, молекулярная масса 361,01 а. е. м. Содержание азота 11,64 %. Жёлтые иглообразные кристаллы. Взрывается при 277—287 °C. Использовался в США для возбуждения взрыва в зарядах гексогена в магнитогидродинамических генераторах (МГД-генераторах).
Пикрат хрома
Химическая формула [C6h3(NO2)3O]5Cr·27h30, молекулярная масса 1695,09 а. е. м. Содержание азота 12,04 %. Зелёный кристаллический порошок. Получается взаимодействием эквивалентных количеств пикрата бария и фиолетовой модификации сульфата хрома (зелёная модификация не полностью реагирует с пикратом бария). Безводная соль получается дегидратацией при 150 °C. Тридекагидрат и моногидрат взрываются при 330 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для тридекагидрата 36 дюймов, для моногидрата 8 дюймов (для тротила — 14 дюймов).
Пикрат кобальта
Химическая формула [C6h3(NO2)3O]2Co, молекулярная масса 371,03 а. е. м. Содержание азота 22,66 %. Коричневый кристаллический порошок. Взрывается при 320—325 °C. Получается нагревом кристаллогидратов при 150 °C.
Пикрат меди
Химическая формула [C6h3(NO2)3O]2Cu, молекулярная масса 520,85 а. е. м. Содержание азота 16,14 %. Жёлто-зелёный кристаллический порошок, очень гигроскопичный. Взрывается при 282—287 °C, по другим данным при 373 °C. Получается нагревом кристаллогидратов при 80-150 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 12 дюймов (для тротила — 14 дюймов). Тригидрат взрывается при 300 °C, его чувствительность к удару 19 дюймов.
Пикрат железа (III)
Химическая формула [C6h3(NO2)3O]3Fe·11h3O, молекулярная масса 938,4 а. е. м. Содержание азота 13,44 %. Красно-жёлтый игольчатый кристаллический порошок. Получен Кастом в 1911 обработкой горячего насыщенного раствора сульфата железа пикратом бария. Имеет несколько кристаллогидратов, которые взрываются при 295 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — от 6 дюймов для материала, высушенного при 150 °C, до 36 дюймов для материала, высушенного при 25 °C.
Пикрат железа II
Химическая формула[C6h3(NO2)3O]2Fe, молекулярная масса 513,15 а. е. м. Содержание азота 16,38 %. Тёмно-зелёный кристаллический порошок. Взрывается при 315—320 °C. Получается сушкой октагидрата в вакуумном эксикаторе над серной кислотой. Октагидрат был получен обработкой горячего насыщенного раствора сульфата железа (II) пикратом бария. Жёлтые гексагональные призмы октагидрата при хранении приобретают коричневый цвет. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 36 дюймов.
Пикрат свинца
Химическая формула [C6h3(NO2)3O]2Pb, молекулярная масса 663,41 а. е. м. Содержание азота 12,67 %. Жёлтый кристаллический порошок. Взрывается при 270—281 °C. Получается сушкой моногидрата или тетрагидрата при 150 °C. Тетрагидрат был получен обработкой раствора пикриновой кислоты карбонатом свинца. Чувствительность к удару безводной соли при испытании с грузом 500 г — 4 см (для гремучей ртути — 24 см). Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 2 дюйма. Чувствительность к трению также высока.
Моногидрат пикрата свинца был запатентован во Франции в 1872 для применения в капсюлях и детонаторах. Использовался в Германии для производства зажигательных смесей.
Пикрат лития
Химическая формула C6h3(NO2)3OLi, молекулярная масса 235,05 а. е. м. Содержание азота 17,88 %. Жёлтый кристаллический порошок. Очень гигроскопичен, с образованием моногидрата. Взрывается при 318—323 °C. Получается сушкой гидратов. Плотность 1,724 — 1,740 г/см3.
Пикрат магния
Химическая формула [C6h3(NO2)3O]2Mg, молекулярная масса 481,60 а. е. м. Содержание азота 17,45 %. Взрывается при 367—372 °C. Получается сушкой гидратов при 150 °C.
Пикрат марганца
Химическая формула [C6h3(NO2)3O]2Mn, молекулярная масса 512,23 а. е. м. Содержание азота 16,41 %. Жёлтый кристаллический порошок. Взрывается при 325—330 °C. Получается сушкой гидратов при 150 °C.
Пикрат никеля
Химическая формула [C6h3(NO2)3O]2Ni, молекулярная масса 516,01 а. е. м. Содержание азота 16,29 %. Зелёный кристаллический порошок. Взрывается при 335—340 °C, гексагидрат взрывается при 390 °C. Получается сушкой гидратов. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для безводной соли — 4 дюйма.
Пикраты платины
Платина образует комплексные соединения, содержащие ион пикриновой кислоты:
[Pt(Ch4SCh4)4]·[C6h3(NO2)3O]2, содержание азота 9,32 %, жёлтые кристаллы, взрывается при нагреве.
[Pt(C2H5SCh3Ch3SC2H5)2]·[C6h3(NO2)3O]2, содержание азота 8,8 %, жёлтые кристаллы, взрывается при нагреве.
Пикрат калия
Химическая формула C6h3(NO2)3OK, молекулярная масса 267,20 а. е. м. Содержание азота 15,73 %. Красновато-жёлтые или зелёные ромбические кристаллы. Взрывается при 310—316 °C. Предположительно, впервые был получен Глаубером в XVII веке растворением древесины в азотной кислоте и нейтрализацией поташом K2CO3. Получается в реакции нейтрализации горячего водного раствора карбоната калия горячим раствором пикриновой кислоты и отделением кристаллов при охлаждении раствора. Растворимость в воде при 15 °C 0,5 г/100 г воды, при 100 °C 25 г/100 г воды. Растворимость в этиловом спирте 0,2 г/ 100 г. Теплота взрывчатого разложения при постоянном объёме 621,8 ккал/моль. Взрывается при 370 °C.
Чувствительность к удару 2 дюйма. Стабильность близка к пикрату аммония (Explosive D), но бризантность меньше. При контакте с огнём детонирует. При любых условиях взрывания выделяется чёрный дым неокисленного углерода. Смеси с окислителями (например, нитратом калия) могут гореть без детонации, но чувствительны к удару и опасны в обращении.
В 1869 Десиньолем разработан взрывчатый состав (смесь пикрата калия, нитрата калия и древесного угля) (порох Десиньоля), а также порох Фонтэйна (Fountain) (смесь пикрата калия и хлората калия). Пикрат калия использовался в пиротехнических составах для сигнальных свистков (использующих характерный звук, возникающий при горении некоторых пикратов). Использовался в составе баллиститных твёрдых ракетных топлив, в различных инициирующих составах (например, в смесях пикрата калия, пикрата свинца и хлората калия).
Смесь мелкодисперсных пикрата калия с нитратом калия в соотношении 60:40 по массе, плотно упакованная в бумажные или бамбуковые трубочки диаметром от ¼ до ¾ дюйма, горит с громким свистящим звуком. Во время Второй мировой войны германская армия применяла такие свистки в качестве дополнительных устройств к бомбам для усиления психологического воздействия. Свистки применялись как сигнальной средство при газовой атаке. Указанная смесь имеет высокую чувствительность и опасна в обращении, поэтому была заменена смесью галловой кислоты и хлората калия.
Пикрат рубидия
Химическая формула C6h3(NO2)3ORb, молекулярная масса 313,58 а. е. м. Содержание азота 13,40 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 300—315 °C. Взрывается при ударе.
Пикрат серебра
Серебро образует комплексные аммиачные соли [Ag(Nh4)2]·[C6h3(NO2)3O]2, молекулярная масса 682,23. Содержание азота 28,75 %. Жёлтые кристаллы, взрываются при нагреве.
Пикрат натрия
Химическая формула C6h3(NO2)3ONa, молекулярная масса 251,10 а. е. м. Содержание азота 16,74 %. Желтоватый игольчатый кристаллический порошок. Взрывается при 310—315 °C. Получается сушкой моногидрата при 150 °C.Моногидрат был получен нейтрализацией водного раствора пикриновой кислоты карбонатом натрия. Моногидрат взрывается при 360 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для моногидрата 17 дюймов, для безводной соли 15 дюймов (для тротила 14 дюймов). Пикрат натрия горит при контакте с пламенем и придаёт эти свойства смесям с другими материалами. Использовался во взрывчатых и пиротехнических составах, в том числе вместо пикрата калия. Двойные пикраты (например, получаемые совместно пикрат натрия и пикрат свинца) показывают меньшую чувствительность к удару, чем эти соли по отдельности.
Пикрат таллия
Химическая формулаC6h3(NO2)3OTl, молекулярная масса 432,48 а. е. м. Содержание азота 9,72 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 273—275 °C. Получается обработкой раствора пикриновой кислоты карбонатом таллия. Взрывается при нагреве и ударе.
Пикрат тория
Химическая формула [C6h3(NO2)3O]4Th, молекулярная масса 1324,68 а. е. м. Содержание азота 12,69 %. Жёлтый игольчатый кристаллический порошок. Температура плавления 52-53 °C. Взрывается при контакте с пламенем.
Пикрат цинка
Химическая формула [C6h3(NO2)3O]2Zn, молекулярная масса 522,67 а. е. м. Содержание азота 16,08 %. Жёлто-коричневый кристаллический порошок. Взрывается при 350—355 °C. Получается сушкой гидратов при 150 °C. Чувствительность к удару 60 см для груза 2 кг, что близко к пикриновой кислоте.
Пикрат циркония
Химическая формула [C6h3(NO2)3O]4Zr, молекулярная масса 10032,66 а. е. м. Содержание азота 16,75 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 317—322 °C. Может быть получен действием карбоната циркония на раствор пикриновой кислоты.
Органические пикраты
Пикриновая кислота образует соединения, подобные пикратам, со многими органическими веществами: углеводородами, нитросоединениями, аминами, фенолами и др. Как правило, их можно получить кипячением спиртовых растворов с последующим охлаждением и выпадением кристаллов пикратов. Отдельные примеры таких соединений:
пикрат аценафтена (acenaphthen) C12h20+C6h3(NO2)3OH. Оранжево-красные призматические кристаллы, температура плавления 161—162 °C, взрывается при 412 °C.
пикрат аллиламина (allylamine) C3H7N+C6h3(NO2)3OH. Лимонно-жёлтые игольчатые кристаллы, температура плавления 140—141 °C, взрывается при 270 °C.
пикрат анилина C6H5Nh3+C6h3(NO2)3OH. Жёлтые кристаллы, температура плавления с разложением 165 °C, взрывается при 398 °C.
пикрат атропина, температура плавления 173—175 °C, взрывается при 460 °C.
пикрат азидогуанидина N3CNHNh3+C6h3(NO2)3OH. Взрывается при нагреве, к удару нечувствителен.
пикрат цинхонидина (cinchonidine) 2C19h32ON2+3C6h3(NO2)3OH. Жёлтые кристаллы, температура плавления 194—195 °C, взрывается при 260—268 °C.
пикрат гуанидина CH5N3+C6h3(NO2)3OH. Жёлтые кристаллы, взрывается при 498 °C.
пикрат гексаметилентетрамина C6h22N4+C6h3(NO2)3OH. Жёлтые игольчатые, взрывается при 360 °C.
пикрат гидразина N2h5+C6h3(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 201 °C, взрывается при 385 °C.
пикрат индена C9H8+C6h3(NO2)3OH. Золотисто-жёлтые кристаллы, температура плавления 98 °C, высокая чувствительность в сухом состоянии, на воздухе медленно разлагается.
пикрат нафталина C10H8+C6h3(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 149—151 °C, взрывается при 484 °C. Образует с пикриновой кислотой эвтектическую смесь.
пикрат альфа-нафтола C10H7OH+C6h3(NO2)3OH. Оранжево-жёлтые игольчатые кристаллы, температура плавления 189—190 °C, взрывается при 458 °C.
пикрат бета-нафтола C10H7OH+C6h3(NO2)3OH. Оранжево-красные игольчатые кристаллы, температура плавления 155—157 °C, взрывается при 469 °C.
пикрат фенантрена C14h20+C6h3(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 143—145 °C, взрывается при 478 °C.
пикрат пиридина C5H5N+C6h3(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 165—166 °C, взрывается при 432 °C.
Пикрат карбамида (мочевины) Ch5ONO2+C6h3(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 142 °C с разложением, взрывается при 489 °C.
Пикраты — Взрывчатые свойства
Химия — Пикраты — Взрывчатые свойства
28 февраля 2011Оглавление:
1. Пикраты
2. Взрывчатые свойства
3. Органические пикраты
Обще свойство всех пикратов образовывать кристаллогидраты с различным количеством молекул воды. Чувствительность в значительной степени зависит от количества остаточной воды, чем её больше, тем менее чувствительны материалы.
В ряду пикратов с различными катионами чувствительность уменьшается в ряду: Pb>Fe>Co>Ni>Ba>Cu>Mn>Zn>Ca, Na, NH4
Получение
Пикраты могут быть получены действием на пикриновую кислоту гидроокисей или карбонатов соответствующих металлов, а также другими методами.
Отдельные неорганические пикраты
Пикрат алюминия
Химическая формула3Al, молекулярная масса 711,31 а. е. м. Содержание азота 17,73 %. Плавится выше 100 °C, при дальнейшем нагревании взрывается. Может быть получен продолжительным нагреванием из его гидратов при температуре ниже 100 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг 16 дюймов.
Дигидрат пикрата алюминия3Al*2H2O получается из декагидрата при нагревании до 80 °C. По чувствительности он сравним с безводной солью, а декагидрат имеет низкую чувствительность. Дигидрат пикрата алюминия взрывается при температуре около 360 °C.
Основной пикрат алюминия2AlOH·7H2O, молекулярная масса 530,35 а. е. м. Краснованые или палево-желтые игольчатые кристаллы, при нагреве до 80 °C переходят в тетрагидрат жёлтого цвета, который при дальнейшем нагревании взрывается.
Пикрат аммония
Другие названия: тринитрофенолят аммония, взрывчатое вещество Д и даннит. Химическая формула C6H23ONH4, молекулярная масса 246,14. Содержание азота 22,77 %. Кислородный баланс с окислением до CO2: −52 %. Две формы: стабильная жёлтая и метастабильная красная. Получают реакцией нейтрализации в водном растворе пикриновой кислоты аммиаком в виде газа или водного раствора. Пикрат аммония одно из первых бризантных взрывчатых веществ, которые начали применяться в XIX веке для снаряжения боеприпасов, название даннит получил от фамилии майора армии США Данна, предложившего использовать его в снарядах. Под наименованием Explosive D широко использовался и используется в США. Входит в состав нескольких взрывчатых смесей. По взрывчатым характеристикам близок к тротилу, а чувствительность меньше, чем у тротила.
Пикрат бария
Химическая формула2Ba, молекулярная масса 594,64 а. е. м. Содержание азота 14,14 %. Жёлтый кристаллический порошок, взрывается при 333—337 °C с умеренной мощностью. Может быть получен нагреванием пентагидратаBa·5H2O . Пентагидрат жёлтые призматические игольчатые кристаллы, получаются из концентрированного водного раствора. Безводная соль взрывается при 403 °C, но малочувствительна к удару и трению.
Пикрат кадмия
Химическая формула2Cd, молекулярная масса 569,70 а. е. м. Содержание азота 14,76 %. Жёлтый кристаллический порошок. Взрывается при 336—341 °C. Получается нагревом кристаллогидратов при 80-150 °C.. Чувствительность к удару безводной соли по методу Арсенала Пикатинни с грузом 2 кг составляет 12 дюймов. Чувствительность октагидрата 35 дюймов, он менее чувствителен, чем дымный порох.
Пикрат кальция
Химическая формула2Ca, молекулярная масса 497,38 а. е. м. Содержание азота 16,90 %. Жёлтый кристаллический порошок. Взрывается при 323—328 °C. Получается нагревом декагидрата при 80 °C.
Пикрат церия
Химическая формула2Ce, молекулярная масса 824,45 а. е. м. Содержание азота 15,29 %. Коричневый кристаллический порошок. Взрывается при 306—313 °C. Получается нагревом кристаллогидратов.
Пикрат цезия
Химическая формулаC6H23OCs, молекулярная масса 361,01 а. е. м. Содержание азота 11,64 %. Жёлтые иглообразные кристаллы. Взрывается при 277—287 °C. Использовался в США для возбуждения взрыва в зарядах гексогена в магнитогидродинамических генераторах.
Пикрат хрома
Химическая формула5Cr·27H20, молекулярная масса 1695,09 а. е. м. Содержание азота 12,04 %. Зелёный кристаллический порошок. Получается взаимодействием эквивалентных количеств пикрата бария и фиолетовой модификации сульфата хрома. Безводная соль получается дегидратацией при 150 °C. Тридекагидрат и моногидрат взрываются при 330 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для тридекагидрата 36 дюймов, для моногидрата 8 дюймов.
Пикрат кобальта
Химическая формула2Co, молекулярная масса 371,03 а. е. м. Содержание азота 22,66 %. Коричневый кристаллический порошок. Взрывается при 320—325 °C. Получается нагревом кристаллогидратов при 150 °C.
Пикрат меди
Химическая формула2Cu, молекулярная масса 520,85 а. е. м. Содержание азота 16,14 %. Жёлто-зелёный кристаллический порошок, очень гигроскопичный. Взрывается при 282—287 °C, по другим данным при 373 °C. Получается нагревом кристаллогидратов при 80-150 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг 12 дюймов. Тригидрат взрывается при 300 °C, его чувствительность к удару 19 дюймов.
Пикрат железа
Химическая формула3Fe·11H2O, молекулярная масса 938,4 а. е. м. Содержание азота 13,44 %. Красно-жёлтый игольчатый кристаллический порошок. Получен Кастом в 1911 обработкой горячего насыщенного раствора сульфата железа пикратом бария. Имеет несколько кристаллогидратов, которые взрываются при 295 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг от 6 дюймов для материала, высушенного при 150 °C, до 36 дюймов для материала, высушенного при 25 °C.
Пикрат железа II
Химическая формула2Fe, молекулярная масса 513,15 а. е. м. Содержание азота 16,38 %. Тёмно-зелёный кристаллический порошок. Взрывается при 315—320 °C. Получается сушкой октагидрата в вакуумном эксикаторе над серной кислотой. Октагидрат был получен обработкой горячего насыщенного раствора сульфата железа пикратом бария. Жёлтые гексагональные призмы октагидрата при хранении приобретают коричневый цвет. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг 36 дюймов.
Пикрат свинца
Химическая формула2Pb, молекулярная масса 663,41 а. е. м. Содержание азота 12,67 %. Жёлтый кристаллический порошок. Взрывается при 270—281 °C. Получается сушкой моногидрата или тетрагидрата при 150 °C. Тетрагидрат был получен обработкой раствора пикриновой кислоты карбонатом свинца. Чувствительность к удару безводной соли при испытании с грузом 500 г 4 см. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг 2 дюйма. Чувствительность к трению также высока.
Моногидрат пикрата свинца был запатентован во Франции в 1872 для применения в капсюлях и детонаторах. Использовался в Германии для производства зажигательных смесей.
Пикрат лития
Химическая формулаC6H23OLi, молекулярная масса 235,05 а. е. м. Содержание азота 17,88 %. Жёлтый кристаллический порошок. Очень гигроскопичен, с образованием моногидрата. Взрывается при 318—323 °C. Получается сушкой гидратов. Плотность 1,724 1,740 г/см3.
Пикрат магния
Химическая формула2Mg, молекулярная масса 481,60 а. е. м. Содержание азота 17,45 %. Взрывается при 367—372 °C. Получается сушкой гидратов при 150 °C.
Пикрат марганца
Химическая формула2Mn, молекулярная масса 512,23 а. е. м. Содержание азота 16,41 %. Жёлтый кристаллический порошок. Взрывается при 325—330 °C. Получается сушкой гидратов при 150 °C.
Пикрат никеля
Химическая формула2Ni, молекулярная масса 516,01 а. е. м. Содержание азота 16,29 %. Зелёный кристаллический порошок. Взрывается при 335—340 °C, гексагидрат взрывается при 390 °C. Получается сушкой гидратов. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для безводной соли 4 дюйма.
Пикраты платины
Платина образует комплексные соединения, содержащие ион пикриновой кислоты:
- ·2, содержание азота 9,32 %, жёлтые кристаллы, взрывается при нагреве.
- ·2, содержание азота 8,8 %, жёлтые кристаллы, взрывается при нагреве.
Пикрат калия
Химическая формулаC6H23OK, молекулярная масса 267,20 а. е. м. Содержание азота 15,73 %. Красновато-жёлтые или зелёные ромбические кристаллы. Взрывается при 310—316 °C. Предположительно, впервые был получен Глаубером в XVII веке растворением древесины в азотной кислоте и нейтрализацией поташом K2CO3. Получается в реакции нейтрализации горячего водного раствора карбоната калия горячим раствором пикриновой кислоты и отделением кристаллов при охлаждении раствора. Растворимость в воде при 15 °C 0,5 г/100 г воды, при 100 °C 25 г/100 г воды. Растворимость в этиловом спирте 0,2 г/ 100 г. Теплота взрывчатого разложения при постоянном объёме 621,8 ккал/моль. Взрывается при 370 °C.
Чувствительность к удару 2 дюйма. Стабильность близка к пикрату аммония, но бризантность меньше. При контакте с огнём детонирует. При любых условиях взрывания выделяется чёрный дым неокисленного углерода. Смеси с окислителями могут гореть без детонации, но чувствительны к удару и опасны в обращении.
В 1869 Десиньолем разработан взрывчатый состав, а также порох Фонтэйна. Пикрат калия использовался в пиротехнических составах для сигнальных свистков. Использовался в составе баллиститных твёрдых ракетных топлив, в различных инициирующих составах.
Смесь мелкодисперсных пикрата калия с нитратом калия в соотношении 60:40 по массе, плотно упакованная в бумажные или бамбуковые трубочки диаметром от ¼ до ¾ дюйма, горит с громким свистящим звуком. Во время Второй мировой войны германская армия применяла такие свистки в качестве дополнительных устройств к бомбам для усиления психологического воздействия. Свистки применялись как сигнальной средство при газовой атаке. Указанная смесь имеет высокую чувствительность и опасна в обращении, поэтому была заменена смесью галловой кислоты и хлората калия.
Пикрат рубидия
Химическая формулаC6H23ORb, молекулярная масса 313,58 а. е. м. Содержание азота 13,40 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 300—315 °C. Взрывается при ударе.
Пикрат серебра
Серебро образует комплексные аммиачные соли·2, молекулярная масса 682,23. Содержание азота 28,75 %. Жёлтые кристаллы, взрываются при нагреве.
Пикрат натрия
Химическая формулаC6H23ONa, молекулярная масса 251,10 а. е. м. Содержание азота 16,74 %. Желтоватый игольчатый кристаллический порошок. Взрывается при 310—315 °C. Получается сушкой моногидрата при 150 °C.Моногидрат был получен нейтрализацией водного раствора пикриновой кислоты карбонатом натрия. Моногидрат взрывается при 360 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для моногидрата 17 дюймов, для безводной соли 15 дюймов. Пикрат натрия горит при контакте с пламенем и придаёт эти свойства смесям с другими материалами. Использовался во взрывчатых и пиротехнических составах, в том числе вместо пикрата калия. Двойные пикраты показывают меньшую чувствительность к удару, чем эти соли по отдельности.
Пикрат таллия
Химическая формулаC6H23OTl, молекулярная масса 432,48 а. е. м. Содержание азота 9,72 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 273—275 °C. Получается обработкой раствора пикриновой кислоты карбонатом таллия. Взрывается при нагреве и ударе.
Пикрат тория
Химическая формула4Th, молекулярная масса 1324,68 а. е. м. Содержание азота 12,69 %. Жёлтый игольчатый кристаллический порошок. Температура плавления 52-53 °C. Взрывается при контакте с пламенем.
Пикрат цинка
Химическая формула2Zn, молекулярная масса 522,67 а. е. м. Содержание азота 16,08 %. Жёлто-коричневый кристаллический порошок. Взрывается при 350—355 °C. Получается сушкой гидратов при 150 °C. Чувствительность к удару 60 см для груза 2 кг, что близко к пикриновой кислоте.
Пикрат циркония
Химическая формула4Zr, молекулярная масса 10032,66 а. е. м. Содержание азота 16,75 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 317—322 °C. Может быть получен действием карбоната циркония на раствор пикриновой кислоты.
Просмотров: 5334
Натрий пикрат — Справочник химика 21
Натрия пикрата раствор. 1,8 г пикриновой кислоты растворяют в 180 мл воды и прибавляют 20 мл раствора натра едкого. Применяют свежеприготовленный раствор. [c.121]Натрия пикрата нейтральный раствор. 1 г пикриновой кислоты помещают в мерную колбу вместимостью 100 мл, прибавляют 25 мл воды, 4,36 мл раствора натра едкого (1 моль/л) (точно эквивалентное количество) и доводят объем раствора водой до метки. 5 мл полученного раствора титруют раствором натра едкого (0,1 моль/л) или раствором хлористоводородной кислоты (0,1 моль/л) (индикатор — фенолфталеин). [c.121]
В случае получения щелочного или кислого раствора натрия пикрата к нему прибавляют по расчету раствор натра едкого (0,1 моль/л) или хлористоводородной кислоты. [c.121]
Калнй хлоруксуснокислый Натрий пикрат 1 Тетраметиламмоний [c.687]
Водород бромистый Водород хлористый Натрий пикрат [c.687]
Натрия пикрата раствор. 1,8 г пикриновой кислоты растворяют в 180 мл воды и прибавляют 20 мл раствора едкого натра. [c.895]
Рубид ий и цезий как аналоги К дают осадки с теми же реактивами, которые применяются для его открытия, — хлоропла-тинато м натрия, перхлоратом натрия, нитрокобальтиатом натрия, пикратом натрия и др. [c.492]
Натрия пикрат Na .H.NaO, Вода Н.о Натрий бромистый NaBr 364 [c.1970]
Для количественного определения содержания никотина в табаке предложено много разнообразных методов, отличающихся между собой как условиями выделения никотина из табака, так и методами определения никотина. Последний или титруют непосредственно, или осаждают пикриновой кислотой и титруют раствором едкого натра пикрат, или осаждают наконец в виде кремневольфрамата состава 2С1(,Н 4Ы2-2Н 0-12ШОз-5102Н-6Н20, осадок которого озоляют и взвешивают остаток ШОз-ЗЮз количество никотина вычисляется путем умножения веса остатка на 0,1139. [c.423]
Пикраты — Википедия
Пикрат аммонияПикраты — группа химических соединений — солей пикриновой кислоты (2,4,6-тринитрофенола C6H2(NO2)3OH). Традиционно в эту группу включают также соединения пикриновой кислоты с некоторыми органическими веществами, которые, как правило, не являются солями. Пикриновая кислота образует пикраты практически со всеми металлами, за исключением олова. Пикраты чаще всего используют как инициирующие взрывчатые вещества или компоненты составов, повышающие их чувствительность.
История
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил Глаубер, воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог. Считается, что первые печатные сообщения о пикратах опубликованы в 1795 году, однако длительное время их состав и свойства не были точно определены. Первое применение смеси пикрата калия, нитрата калия и угля как взрывчатого вещества было предложено Десиньолем (Designolle) в 1869. В этом же году Фонтэйн (Fountaine) предложил смесь пикрата калия и хлората калия, а Абель (Abel) предложил смесь пикрата аммония и нитрата калия. Первые систематические исследования пикратов металлов были проведены в 1901 Дюпре (Dupre), продолжены Уиллом (Will) в 1906, Силберрадом (Silberrad) и Филлипсом (Phillips) в 1908, Кастом (Kast) в 1911.
Взрывчатые свойства
Общее свойство всех пикратов — образовывать кристаллогидраты с различным количеством молекул воды. Чувствительность в значительной степени зависит от количества остаточной воды, чем её больше, тем менее чувствительны материалы.
В ряду пикратов с различными катионами чувствительность уменьшается в ряду: Pb>Fe>Co>Ni>Ba>Cu>Mn>Zn>Ca, Na, NH4
Получение
Пикраты могут быть получены действием на пикриновую кислоту гидроксидов или карбонатов соответствующих металлов, а также другими методами.
Отдельные неорганические пикраты
Пикрат алюминия
Химическая формула [C6H2(NO2)3O]3Al, молекулярная масса 711,31 а. е. м. Содержание азота 17,73 %. Плавится выше 100 °C, при дальнейшем нагревании взрывается. Может быть получен продолжительным нагреванием из его гидратов (например, ди-, тетра-, дека- или гексадекагидрата) при температуре ниже 100 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 40,6 см (для тротила — 35,6 см).
Дигидрат пикрата алюминия [C6H2(NO2)3O]3Al*2H2O получается из декагидрата при нагревании до +80 °C. По чувствительности он сравним с безводной солью, а декагидрат имеет низкую чувствительность. Дигидрат пикрата алюминия взрывается при температуре около 360 °C.
Основной пикрат алюминия [C6H2(NO2)3O]2AlOH·7H2O, молекулярная масса 530,35 а. е. м. Красноватые или палево-желтые игольчатые кристаллы, при нагреве до +80 °C переходят в тетрагидрат жёлтого цвета, который при дальнейшем нагревании взрывается.
Пикрат аммония
Другие названия: тринитрофенолят аммония, взрывчатое вещество Д и даннит (en:dunnite) (в военном применении в США).
Химическая формула C6H2(NO2)3ONH4, молекулярная масса 246,14. Содержание азота 22,77 %. Кислородный баланс с окислением до CO2: −52 %. Две формы: стабильная жёлтая и метастабильная красная.
Получают реакцией нейтрализации в водном растворе пикриновой кислоты аммиаком в виде газа или водного раствора.
Пикрат аммония — одно из первых бризантных взрывчатых веществ, которые начали применяться в XIX веке для снаряжения боеприпасов, название даннит получил от фамилии майора армии США Данна, предложившего использовать его в снарядах. Под наименованием Explosive D (взрывчатое вещество Д) широко использовался и используется в США. Входит в состав нескольких взрывчатых смесей (например, пикратола).
По взрывчатым характеристикам незначительно уступает тротилу, чувствительность меньше, чем у тротила.
Пикрат бария
Химическая формула [C6H2(NO2)3O]2Ba, молекулярная масса 594,64 а. е. м. Содержание азота 14,14 %. Жёлтый кристаллический порошок, взрывается при 333—337 °C с умеренной мощностью. Может быть получен нагреванием пентагидрата [C6H2(NO2)3O]Ba·5H2O . Пентагидрат — жёлтые призматические игольчатые кристаллы, получаются из концентрированного водного раствора. Безводная соль взрывается при 403 °C, но малочувствительна к удару и трению.
Пикрат кадмия
Химическая формула [C6H2(NO2)3O]2Cd, молекулярная масса 569,70 а. е. м. Содержание азота 14,76 %. Жёлтый кристаллический порошок. Взрывается при 336—341 °C. Получается нагревом кристаллогидратов при 80-150 °C. (пента-, гепта- или октогидрата). Чувствительность к удару безводной соли по методу Арсенала Пикатинни с грузом 2 кг составляет 30,5 см (тротил — 35,6 см). Чувствительность октагидрата 88,9 см, он менее чувствителен, чем дымный порох.
Пикрат кальция
Химическая формула [C6H2(NO2)3O]2Ca, молекулярная масса 497,38 а. е. м. Содержание азота 16,90 %. Жёлтый кристаллический порошок. Взрывается при 323—328 °C. Получается нагревом декагидрата при +80 °C.
Пикрат церия
Химическая формула [C6H2(NO2)3O]2Ce, молекулярная масса 824,45 а. е. м. Содержание азота 15,29 %. Коричневый кристаллический порошок. Взрывается при 306—313 °C. Получается нагревом кристаллогидратов (три-, или ундекагидрата).
Пикрат цезия
Химическая формула C6H2(NO2)3OCs, молекулярная масса 361,01 а. е. м. Содержание азота 11,64 %. Жёлтые иглообразные кристаллы. Взрывается при 277—287 °C. Использовался в США для возбуждения взрыва в зарядах гексогена в магнитогидродинамических генераторах (МГД-генераторах).
Пикрат хрома
Химическая формула [C6H2(NO2)3O]5Cr·27H20, молекулярная масса 1695,09 а. е. м. Содержание азота 12,04 %. Зелёный кристаллический порошок. Получается взаимодействием эквивалентных количеств пикрата бария и фиолетовой модификации сульфата хрома (зелёная модификация не полностью реагирует с пикратом бария). Безводная соль получается дегидратацией при 150 °C. Тридекагидрат и моногидрат взрываются при 330 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для тридекагидрата 91,4 см, для моногидрата 20,3 см (для тротила — 35,6 см).
Пикрат кобальта
Химическая формула [C6H2(NO2)3O]2Co, молекулярная масса 371,03 а. е. м. Содержание азота 22,66 %. Коричневый кристаллический порошок. Взрывается при 320—325 °C. Получается нагревом кристаллогидратов при 150 °C.
Пикрат меди
Химическая формула [C6H2(NO2)3O]2Cu, молекулярная масса 520,85 а. е. м. Содержание азота 16,14 %. Жёлто-зелёный кристаллический порошок, очень гигроскопичный. Взрывается при 282—287 °C, по другим данным при 373 °C. Получается нагревом кристаллогидратов при 80-150 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 30,5 (для тротила — 35,6 см). Тригидрат взрывается при 300 °C, его чувствительность к удару 48,3 см.
Пикрат железа (III)
Химическая формула [C6H2(NO2)3O]3Fe·11H2O, молекулярная масса 938,4 а. е. м. Содержание азота 13,44 %. Красно-жёлтый игольчатый кристаллический порошок. Получен Кастом в 1911 обработкой горячего насыщенного раствора сульфата железа пикратом бария. Имеет несколько кристаллогидратов, которые взрываются при 295 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — от 15,2 см для материала, высушенного при 150 °C, до 91,4 см для материала, высушенного при +25 °C.
Пикрат железа II
Химическая формула[C6H2(NO2)3O]2Fe, молекулярная масса 513,15 а. е. м. Содержание азота 16,38 %. Тёмно-зелёный кристаллический порошок. Взрывается при 315—320 °C. Получается сушкой октагидрата в вакуумном эксикаторе над серной кислотой. Октагидрат был получен обработкой горячего насыщенного раствора сульфата железа (II) пикратом бария. Жёлтые гексагональные призмы октагидрата при хранении приобретают коричневый цвет. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 91,4 см.
Пикрат свинца
Химическая формула [C6H2(NO2)3O]2Pb, молекулярная масса 663,41 а. е. м. Содержание азота 12,67 %. Жёлтый кристаллический порошок. Взрывается при 270—281 °C. Получается сушкой моногидрата или тетрагидрата при 150 °C. Тетрагидрат был получен обработкой раствора пикриновой кислоты карбонатом свинца. Чувствительность к удару безводной соли при испытании с грузом 500 г — 4 см (для гремучей ртути — 24 см). Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 5 см. Чувствительность к трению также высока.
Моногидрат пикрата свинца был запатентован во Франции в 1872 году для применения в капсюлях и детонаторах. Использовался в Германии для производства зажигательных смесей.
Пикрат лития
Химическая формула C6H2(NO2)3OLi, молекулярная масса 235,05 а. е. м. Содержание азота 17,88 %. Жёлтый кристаллический порошок. Очень гигроскопичен, с образованием моногидрата. Взрывается при 318—323 °C. Получается сушкой гидратов. Плотность 1,724 — 1,740 г/см3.
Пикрат магния
Химическая формула [C6H2(NO2)3O]2Mg, молекулярная масса 481,60 а. е. м. Содержание азота 17,45 %. Взрывается при 367—372 °C. Получается сушкой гидратов при 150 °C.
Пикрат марганца
Химическая формула [C6H2(NO2)3O]2Mn, молекулярная масса 512,23 а. е. м. Содержание азота 16,41 %. Жёлтый кристаллический порошок. Взрывается при 325—330 °C. Получается сушкой гидратов при 150 °C.
Пикрат никеля
Химическая формула [C6H2(NO2)3O]2Ni, молекулярная масса 516,01 а. е. м. Содержание азота 16,29 %. Зелёный кристаллический порошок. Взрывается при 335—340 °C, гексагидрат взрывается при 390 °C. Получается сушкой гидратов. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для безводной соли — 10,1 см.
Пикраты платины
Платина образует комплексные соединения, содержащие ион пикриновой кислоты:
- [Pt(CH3SCH3)4]·[C6H2(NO2)3O]2, содержание азота 9,32 %, жёлтые кристаллы, взрывается при нагреве.
- [Pt(C2H5SCH2CH2SC2H5)2]·[C6H2(NO2)3O]2, содержание азота 8,8 %, жёлтые кристаллы, взрывается при нагреве.
Пикрат калия
Химическая формула C6H2(NO2)3OK, молекулярная масса 267,20 а. е. м. Содержание азота 15,73 %. Красновато-жёлтые или зелёные ромбические кристаллы. Взрывается при 310—316 °C. Предположительно, впервые был получен Глаубером в XVII веке растворением древесины в азотной кислоте и нейтрализацией поташом K2CO3. Получается в реакции нейтрализации горячего водного раствора карбоната калия горячим раствором пикриновой кислоты и отделением кристаллов при охлаждении раствора. Растворимость в воде при +15 °C 0,5 г/100 г воды, при 100 °C 25 г/100 г воды. Растворимость в этиловом спирте 0,2 г/ 100 г. Теплота взрывчатого разложения при постоянном объёме 621,8 ккал/моль. Взрывается при 370 °C.
Чувствительность к удару 2 дюйма. Стабильность близка к пикрату аммония (Explosive D), но бризантность меньше. При контакте с огнём детонирует. При любых условиях взрывания выделяется чёрный дым неокисленного углерода. Смеси с окислителями (например, нитратом калия) могут гореть без детонации, но чувствительны к удару и опасны в обращении.
В 1869 году Десиньолем разработан взрывчатый состав (смесь пикрата калия, нитрата калия и древесного угля) (порох Десиньоля), а также порох Фонтэйна (Fountain) (смесь пикрата калия и хлората калия). Пикрат калия использовался в пиротехнических составах для сигнальных свистков (использующих характерный звук, возникающий при горении некоторых пикратов). Использовался в составе баллиститных твёрдых ракетных топлив, в различных инициирующих составах (например, в смесях пикрата калия, пикрата свинца и хлората калия).
Смесь мелкодисперсных пикрата калия с нитратом калия в соотношении 60:40 по массе, плотно упакованная в бумажные или бамбуковые трубочки диаметром от ¼ до ¾ дюйма, горит с громким свистящим звуком. Во время Второй мировой войны немецкая армия применяла такие свистки в качестве дополнительных устройств к бомбам для усиления психологического воздействия. Свистки применялись как сигнальное средство при газовой атаке. Указанная смесь имеет высокую чувствительность и опасна в обращении, поэтому была заменена смесью галловой кислоты и хлората калия.
Пикрат рубидия
Химическая формула C6H2(NO2)3ORb, молекулярная масса 313,58 а. е. м. Содержание азота 13,40 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 300—315 °C. Взрывается при ударе.
Пикрат серебра
Серебро образует комплексные аммиачные соли [Ag(NH3)2]·[C6H2(NO2)3O]2, молекулярная масса 682,23. Содержание азота 28,75 %. Жёлтые кристаллы, взрываются при нагреве.
Пикрат натрия
Химическая формула C6H2(NO2)3ONa, молекулярная масса 251,10 а. е. м. Содержание азота 16,74 %. Желтоватый игольчатый кристаллический порошок. Взрывается при 310—315 °C. Получается сушкой моногидрата при 150 °C. Моногидрат был получен нейтрализацией водного раствора пикриновой кислоты карбонатом натрия. Моногидрат взрывается при 360 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для моногидрата 43,2 см, для безводной соли 38,1 см (для тротила 35,6 см).
Пикрат натрия горит при контакте с пламенем и придаёт эти свойства смесям с другими материалами. Использовался во взрывчатых и пиротехнических составах, в том числе вместо пикрата калия.
Двойные пикраты (например, получаемые совместно пикрат натрия и пикрат свинца) показывают меньшую чувствительность к удару, чем эти соли по отдельности.
Пикрат таллия
Химическая формулаC6H2(NO2)3OTl, молекулярная масса 432,48 а. е. м. Содержание азота 9,72 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 273—275 °C. Получается обработкой раствора пикриновой кислоты карбонатом таллия. Взрывается при нагреве и ударе.
Пикрат тория
Химическая формула [C6H2(NO2)3O]4Th, молекулярная масса 1324,68 а. е. м. Содержание азота 12,69 %. Жёлтый игольчатый кристаллический порошок. Температура плавления +52— +53 °C. Взрывается при контакте с пламенем.
Пикрат цинка
Химическая формула [C6H2(NO2)3O]2Zn, молекулярная масса 522,67 а. е. м. Содержание азота 16,08 %. Жёлто-коричневый кристаллический порошок. Взрывается при 350—355 °C. Получается сушкой гидратов при 150 °C. Чувствительность к удару 60 см для груза 2 кг, что близко к пикриновой кислоте.
Пикрат циркония
Химическая формула [C6H2(NO2)3O]4Zr, молекулярная масса 1032,66 а. е. м. Содержание азота 16,75 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 317—322 °C. Может быть получен действием карбоната циркония на раствор пикриновой кислоты.
Органические пикраты
Пикриновая кислота образует соединения, подобные пикратам, со многими органическими веществами: углеводородами, нитросоединениями, аминами, фенолами и др. Как правило, их можно получить кипячением спиртовых растворов с последующим охлаждением и выпадением кристаллов пикратов. Отдельные примеры таких соединений:
- пикрат аценафтена (acenaphthen) C12H10+C6H2(NO2)3OH. Оранжево-красные призматические кристаллы, температура плавления 161—162 °C, взрывается при 412 °C.
- пикрат аллиламина (allylamine) C3H7N+C6H2(NO2)3OH. Лимонно-жёлтые игольчатые кристаллы, температура плавления 140—141 °C, взрывается при 270 °C.
- пикрат анилина C6H5NH2+C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления с разложением 165 °C, взрывается при 398 °C.
- пикрат атропина, температура плавления 173—175 °C, взрывается при 460 °C.
- пикрат азидогуанидина N3CNHNH2+C6H2(NO2)3OH. Взрывается при нагреве, к удару нечувствителен.
- пикрат цинхонидина (cinchonidine) 2C19H22ON2+3C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления 194—195 °C, взрывается при 260—268 °C.
- пикрат гуанидина CH5N3+C6H2(NO2)3OH. Жёлтые кристаллы, взрывается при 498 °C.
- пикрат гексаметилентетрамина C6H12N4+C6H2(NO2)3OH. Жёлтые игольчатые, взрывается при 360 °C.
- пикрат гидразина N2H4+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 201 °C, взрывается при 385 °C.
- пикрат индена C9H8+C6H2(NO2)3OH. Золотисто-жёлтые кристаллы, температура плавления 98 °C, высокая чувствительность в сухом состоянии, на воздухе медленно разлагается.
- пикрат нафталина C10H8+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 149—151 °C, взрывается при 484 °C. Образует с пикриновой кислотой эвтектическую смесь.
- пикрат альфа-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-жёлтые игольчатые кристаллы, температура плавления 189—190 °C, взрывается при 458 °C.
- пикрат бета-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-красные игольчатые кристаллы, температура плавления 155—157 °C, взрывается при 469 °C.
- пикрат фенантрена C14H10+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 143—145 °C, взрывается при 478 °C.
- пикрат пиридина C5H5N+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 165—166 °C, взрывается при 432 °C.
- Пикрат карбамида (мочевины) CH4ON2+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 142 °C с разложением, взрывается при 489 °C.
См. также
Литература
- Fedoroff, Basil T. et al Enciclopedia of Explosives and Related Items, vol.1—7. — Dover, New Jersey: Picatinny Arsenal. — 1960—1975. — P274-P285.
Пикраты — это… Что такое Пикраты?
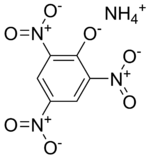 Пикрат аммония
Пикрат аммонияПикраты — группа химических соединений — солей пикриновой кислоты (2,4,6-тринитрофенола C6H2(NO2)3OH). Традиционно в эту группу включают также соединения пикриновой кислоты с некоторыми органическими веществами, которые, как правило, не являются солями. Пикриновая кислота образует пикраты практически со всеми металлами, за исключением олова. Пикраты чаще всего используют как инициирующие взрывчатые вещества или компоненты составов, повышающие их чувствительность.
История
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил Глаубер в 1742 году, воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог. Считается, что первые печатные сообщения о пикратах опубликованы в 1795 году, однако длительное время их состав и свойства не были точно определены. Первое применение смеси пикрата калия, нитрата калия и угля как взрывчатого вещества было предложено Десиньолем (Designolle) в 1869. В этом же году Фонтэйн (Fountaine) предложил смесь пикрата калия и хлората калия, а Абель (Abel) предложил смесь пикрата аммония и нитрата калия. Первые систематические исследования пикратов металлов были проведены в 1901 Дюпре (Dupre), продолжены Уиллом (Will) в 1906, Силберрадом (Silberrad) и Филлипсом (Phillips) в 1908, Кастом (Kast) в 1911.
Взрывчатые свойства
Общее свойство всех пикратов — образовывать кристаллогидраты с различным количеством молекул воды. Чувствительность в значительной степени зависит от количества остаточной воды, чем её больше, тем менее чувствительны материалы.
В ряду пикратов с различными катионами чувствительность уменьшается в ряду: Pb>Fe>Co>Ni>Ba>Cu>Mn>Zn>Ca, Na, NH4
Получение
Пикраты могут быть получены действием на пикриновую кислоту гидроокисей или карбонатов соответствующих металлов, а также другими методами.
Отдельные неорганические пикраты
Пикрат алюминия
Химическая формула [C6H2(NO2)3O]3Al, молекулярная масса 711,31 а. е. м. Содержание азота 17,73 %. Плавится выше 100 °C, при дальнейшем нагревании взрывается. Может быть получен продолжительным нагреванием из его гидратов (например, ди-, тетра-, дека- или гексадекагидрата) при температуре ниже 100 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 16 дюймов (для тротила — 14 дюймов).
Дигидрат пикрата алюминия [C6H2(NO2)3O]3Al*2H2O получается из декагидрата при нагревании до 80 °C. По чувствительности он сравним с безводной солью, а декагидрат имеет низкую чувствительность. Дигидрат пикрата алюминия взрывается при температуре около 360 °C.
Основной пикрат алюминия [C6H2(NO2)3O]2AlOH·7H2O, молекулярная масса 530,35 а. е. м. Краснованые или палево-желтые игольчатые кристаллы, при нагреве до 80 °C переходят в тетрагидрат жёлтого цвета, который при дальнейшем нагревании взрывается.
Пикрат аммония
Другие названия: тринитрофенолят аммония, взрывчатое вещество Д и даннит (en:dunnite) (в военном применении в США). Химическая формула C6H2(NO2)3ONH4, молекулярная масса 246,14. Содержание азота 22,77 %. Кислородный баланс с окислением до CO2: −52 %. Две формы: стабильная жёлтая и метастабильная красная. Получают реакцией нейтрализации в водном растворе пикриновой кислоты аммиаком в виде газа или водного раствора. Пикрат аммония — одно из первых бризантных взрывчатых веществ, которые начали применяться в XIX веке для снаряжения боеприпасов, название даннит получил от фамилии майора армии США Данна, предложившего использовать его в снарядах. Под наименованием Explosive D (взрывчатое вещество Д) широко использовался и используется в США. Входит в состав нескольких взрывчатых смесей (например, пикратола). По взрывчатым характеристикам близок к тротилу, а чувствительность меньше, чем у тротила.
Пикрат бария
Химическая формула [C6H2(NO2)3O]2Ba, молекулярная масса 594,64 а. е. м. Содержание азота 14,14 %. Жёлтый кристаллический порошок, взрывается при 333—337 °C с умеренной мощностью. Может быть получен нагреванием пентагидрата [C6H2(NO2)3O]Ba·5H2O . Пентагидрат — жёлтые призматические игольчатые кристаллы, получаются из концентрированного водного раствора. Безводная соль взрывается при 403 °C, но малочувствительна к удару и трению.
Пикрат кадмия
Химическая формула [C6H2(NO2)3O]2Cd, молекулярная масса 569,70 а. е. м. Содержание азота 14,76 %. Жёлтый кристаллический порошок. Взрывается при 336—341 °C. Получается нагревом кристаллогидратов при 80-150 °C. (пента-, гепта- или октогидрата). Чувствительность к удару безводной соли по методу Арсенала Пикатинни с грузом 2 кг составляет 12 дюймов (тротил — 14 дюймов). Чувствительность октагидрата 35 дюймов, он менее чувствителен, чем дымный порох.
Пикрат кальция
Химическая формула [C6H2(NO2)3O]2Ca, молекулярная масса 497,38 а. е. м. Содержание азота 16,90 %. Жёлтый кристаллический порошок. Взрывается при 323—328 °C. Получается нагревом декагидрата при 80 °C.
Пикрат церия
Химическая формула [C6H2(NO2)3O]2Ce, молекулярная масса 824,45 а. е. м. Содержание азота 15,29 %. Коричневый кристаллический порошок. Взрывается при 306—313 °C. Получается нагревом кристаллогидратов (три-, или ундекагидрата).
Пикрат цезия
Химическая формула C6H2(NO2)3OCs, молекулярная масса 361,01 а. е. м. Содержание азота 11,64 %. Жёлтые иглообразные кристаллы. Взрывается при 277—287 °C. Использовался в США для возбуждения взрыва в зарядах гексогена в магнитогидродинамических генераторах (МГД-генераторах).
Пикрат хрома
Химическая формула [C6H2(NO2)3O]5Cr·27H20, молекулярная масса 1695,09 а. е. м. Содержание азота 12,04 %. Зелёный кристаллический порошок. Получается взаимодействием эквивалентных количеств пикрата бария и фиолетовой модификации сульфата хрома (зелёная модификация не полностью реагирует с пикратом бария). Безводная соль получается дегидратацией при 150 °C. Тридекагидрат и моногидрат взрываются при 330 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для тридекагидрата 36 дюймов, для моногидрата 8 дюймов (для тротила — 14 дюймов).
Пикрат кобальта
Химическая формула [C6H2(NO2)3O]2Co, молекулярная масса 371,03 а. е. м. Содержание азота 22,66 %. Коричневый кристаллический порошок. Взрывается при 320—325 °C. Получается нагревом кристаллогидратов при 150 °C.
Пикрат меди
Химическая формула [C6H2(NO2)3O]2Cu, молекулярная масса 520,85 а. е. м. Содержание азота 16,14 %. Жёлто-зелёный кристаллический порошок, очень гигроскопичный. Взрывается при 282—287 °C, по другим данным при 373 °C. Получается нагревом кристаллогидратов при 80-150 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 12 дюймов (для тротила — 14 дюймов). Тригидрат взрывается при 300 °C, его чувствительность к удару 19 дюймов.
Пикрат железа (III)
Химическая формула [C6H2(NO2)3O]3Fe·11H2O, молекулярная масса 938,4 а. е. м. Содержание азота 13,44 %. Красно-жёлтый игольчатый кристаллический порошок. Получен Кастом в 1911 обработкой горячего насыщенного раствора сульфата железа пикратом бария. Имеет несколько кристаллогидратов, которые взрываются при 295 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — от 6 дюймов для материала, высушенного при 150 °C, до 36 дюймов для материала, высушенного при 25 °C.
Пикрат железа II
Химическая формула[C6H2(NO2)3O]2Fe, молекулярная масса 513,15 а. е. м. Содержание азота 16,38 %. Тёмно-зелёный кристаллический порошок. Взрывается при 315—320 °C. Получается сушкой октагидрата в вакуумном эксикаторе над серной кислотой. Октагидрат был получен обработкой горячего насыщенного раствора сульфата железа (II) пикратом бария. Жёлтые гексагональные призмы октагидрата при хранении приобретают коричневый цвет. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 36 дюймов.
Пикрат свинца
Химическая формула [C6H2(NO2)3O]2Pb, молекулярная масса 663,41 а. е. м. Содержание азота 12,67 %. Жёлтый кристаллический порошок. Взрывается при 270—281 °C. Получается сушкой моногидрата или тетрагидрата при 150 °C. Тетрагидрат был получен обработкой раствора пикриновой кислоты карбонатом свинца. Чувствительность к удару безводной соли при испытании с грузом 500 г — 4 см (для гремучей ртути — 24 см). Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 2 дюйма. Чувствительность к трению также высока.
Моногидрат пикрата свинца был запатентован во Франции в 1872 для применения в капсюлях и детонаторах. Использовался в Германии для производства зажигательных смесей.
Пикрат лития
Химическая формула C6H2(NO2)3OLi, молекулярная масса 235,05 а. е. м. Содержание азота 17,88 %. Жёлтый кристаллический порошок. Очень гигроскопичен, с образованием моногидрата. Взрывается при 318—323 °C. Получается сушкой гидратов. Плотность 1,724 — 1,740 г/см3.
Пикрат магния
Химическая формула [C6H2(NO2)3O]2Mg, молекулярная масса 481,60 а. е. м. Содержание азота 17,45 %. Взрывается при 367—372 °C. Получается сушкой гидратов при 150 °C.
Пикрат марганца
Химическая формула [C6H2(NO2)3O]2Mn, молекулярная масса 512,23 а. е. м. Содержание азота 16,41 %. Жёлтый кристаллический порошок. Взрывается при 325—330 °C. Получается сушкой гидратов при 150 °C.
Пикрат никеля
Химическая формула [C6H2(NO2)3O]2Ni, молекулярная масса 516,01 а. е. м. Содержание азота 16,29 %. Зелёный кристаллический порошок. Взрывается при 335—340 °C, гексагидрат взрывается при 390 °C. Получается сушкой гидратов. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для безводной соли — 4 дюйма.
Пикраты платины
Платина образует комплексные соединения, содержащие ион пикриновой кислоты:
- [Pt(CH3SCH3)4]·[C6H2(NO2)3O]2, содержание азота 9,32 %, жёлтые кристаллы, взрывается при нагреве.
- [Pt(C2H5SCH2CH2SC2H5)2]·[C6H2(NO2)3O]2, содержание азота 8,8 %, жёлтые кристаллы, взрывается при нагреве.
Пикрат калия
Химическая формула C6H2(NO2)3OK, молекулярная масса 267,20 а. е. м. Содержание азота 15,73 %. Красновато-жёлтые или зелёные ромбические кристаллы. Взрывается при 310—316 °C. Предположительно, впервые был получен Глаубером в XVII веке растворением древесины в азотной кислоте и нейтрализацией поташом K2CO3. Получается в реакции нейтрализации горячего водного раствора карбоната калия горячим раствором пикриновой кислоты и отделением кристаллов при охлаждении раствора. Растворимость в воде при 15 °C 0,5 г/100 г воды, при 100 °C 25 г/100 г воды. Растворимость в этиловом спирте 0,2 г/ 100 г. Теплота взрывчатого разложения при постоянном объёме 621,8 ккал/моль. Взрывается при 370 °C.
Чувствительность к удару 2 дюйма. Стабильность близка к пикрату аммония (Explosive D), но бризантность меньше. При контакте с огнём детонирует. При любых условиях взрывания выделяется чёрный дым неокисленного углерода. Смеси с окислителями (например, нитратом калия) могут гореть без детонации, но чувствительны к удару и опасны в обращении.
В 1869 Десиньолем разработан взрывчатый состав (смесь пикрата калия, нитрата калия и древесного угля) (порох Десиньоля), а также порох Фонтэйна (Fountain) (смесь пикрата калия и хлората калия). Пикрат калия использовался в пиротехнических составах для сигнальных свистков (использующих характерный звук, возникающий при горении некоторых пикратов). Использовался в составе баллиститных твёрдых ракетных топлив, в различных инициирующих составах (например, в смесях пикрата калия, пикрата свинца и хлората калия).
Смесь мелкодисперсных пикрата калия с нитратом калия в соотношении 60:40 по массе, плотно упакованная в бумажные или бамбуковые трубочки диаметром от ¼ до ¾ дюйма, горит с громким свистящим звуком. Во время Второй мировой войны германская армия применяла такие свистки в качестве дополнительных устройств к бомбам для усиления психологического воздействия. Свистки применялись как сигнальной средство при газовой атаке. Указанная смесь имеет высокую чувствительность и опасна в обращении, поэтому была заменена смесью галловой кислоты и хлората калия.
Пикрат рубидия
Химическая формула C6H2(NO2)3ORb, молекулярная масса 313,58 а. е. м. Содержание азота 13,40 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 300—315 °C. Взрывается при ударе.
Пикрат серебра
Серебро образует комплексные аммиачные соли [Ag(NH3)2]·[C6H2(NO2)3O]2, молекулярная масса 682,23. Содержание азота 28,75 %. Жёлтые кристаллы, взрываются при нагреве.
Пикрат натрия
Химическая формула C6H2(NO2)3ONa, молекулярная масса 251,10 а. е. м. Содержание азота 16,74 %. Желтоватый игольчатый кристаллический порошок. Взрывается при 310—315 °C. Получается сушкой моногидрата при 150 °C.Моногидрат был получен нейтрализацией водного раствора пикриновой кислоты карбонатом натрия. Моногидрат взрывается при 360 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для моногидрата 17 дюймов, для безводной соли 15 дюймов (для тротила 14 дюймов). Пикрат натрия горит при контакте с пламенем и придаёт эти свойства смесям с другими материалами. Использовался во взрывчатых и пиротехнических составах, в том числе вместо пикрата калия. Двойные пикраты (например, получаемые совместно пикрат натрия и пикрат свинца) показывают меньшую чувствительность к удару, чем эти соли по отдельности.
Пикрат таллия
Химическая формулаC6H2(NO2)3OTl, молекулярная масса 432,48 а. е. м. Содержание азота 9,72 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 273—275 °C. Получается обработкой раствора пикриновой кислоты карбонатом таллия. Взрывается при нагреве и ударе.
Пикрат тория
Химическая формула [C6H2(NO2)3O]4Th, молекулярная масса 1324,68 а. е. м. Содержание азота 12,69 %. Жёлтый игольчатый кристаллический порошок. Температура плавления 52-53 °C. Взрывается при контакте с пламенем.
Пикрат цинка
Химическая формула [C6H2(NO2)3O]2Zn, молекулярная масса 522,67 а. е. м. Содержание азота 16,08 %. Жёлто-коричневый кристаллический порошок. Взрывается при 350—355 °C. Получается сушкой гидратов при 150 °C. Чувствительность к удару 60 см для груза 2 кг, что близко к пикриновой кислоте.
Пикрат циркония
Химическая формула [C6H2(NO2)3O]4Zr, молекулярная масса 10032,66 а. е. м. Содержание азота 16,75 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 317—322 °C. Может быть получен действием карбоната циркония на раствор пикриновой кислоты.
Органические пикраты
Пикриновая кислота образует соединения, подобные пикратам, со многими органическими веществами: углеводородами, нитросоединениями, аминами, фенолами и др.) Как правило, их можно получить кипячением спиртовых растворов с последующим охлаждением и выпадением кристаллов пикратов. Отдельные примеры таких соединений:
- пикрат аценафтена (acenaphthen) C12H10+C6H2(NO2)3OH. Оранжево-красные призматические кристаллы, температура плавления 161—162 °C, взрывается при 412 °C.
- пикрат аллиламина (allylamine) C3H7N+C6H2(NO2)3OH. Лимонно-жёлтые игольчатые кристаллы, температура плавления 140—141 °C, взрывается при 270 °C.
- пикрат анилина C6H5NH2+C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления с разложением 165 °C, взрывается при 398 °C.
- пикрат атропина, температура плавления 173—175 °C, взрывается при 460 °C.
- пикрат азидогуанидина N3CNHNH2+C6H2(NO2)3OH. Взрывается при нагреве, к удару нечувствителен.
- пикрат цинхонидина (cinchonidine) 2C19H22ON2+3C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления 194—195 °C, взрывается при 260—268 °C.
- пикрат гуанидина CH5N3+C6H2(NO2)3OH. Жёлтые кристаллы, взрывается при 498 °C.
- пикрат гексаметилентетрамина C6H12N4+C6H2(NO2)3OH. Жёлтые игольчатые, взрывается при 360 °C.
- пикрат гидразина N2H4+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 201 °C, взрывается при 385 °C.
- пикрат индена C9H8+C6H2(NO2)3OH. Золотисто-жёлтые кристаллы, температура плавления 98 °C, высокая чувсвтвительность в сухом состоянии, на воздухе медленно ралагается.
- пикрат нафталина C10H8+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 149—151 °C, взрывается при 484 °C. Образует с пикриновой кислотой эвтектическую смесь.
- пикрат альфа-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-жёлтые игольчатые кристаллы, температура плавления 189—190 °C, взрывается при 458 °C.
- пикрат бета-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-красные игольчатые кристаллы, температура плавления 155—157 °C, взрывается при 469 °C.
- пикрат фенантрена C14H10+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 143—145 °C, взрывается при 478 °C.
- пикрат пиридина C5H5N+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 165—166 °C, взрывается при 432 °C.
- Пикрат карбамида (мочевины) CH4ONO2+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 142 °C с разложением, взрывается при 489 °C.
См. также
Литература
- Fedoroff, Basil T. et al Enciclopedia of Explosives and Related Items, vol.1—7. — Dover, New Jersey: Picatinny Arsenal. — 1960—1975. — P274-P285.
Ссылки
Пикраты — Википедия
 Пикрат аммония
Пикрат аммонияПикраты — группа химических соединений — солей пикриновой кислоты (2,4,6-тринитрофенола C6H2(NO2)3OH). Традиционно в эту группу включают также соединения пикриновой кислоты с некоторыми органическими веществами, которые, как правило, не являются солями. Пикриновая кислота образует пикраты практически со всеми металлами, за исключением олова. Пикраты чаще всего используют как инициирующие взрывчатые вещества или компоненты составов, повышающие их чувствительность.
История
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил Глаубер, воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог. Считается, что первые печатные сообщения о пикратах опубликованы в 1795 году, однако длительное время их состав и свойства не были точно определены. Первое применение смеси пикрата калия, нитрата калия и угля как взрывчатого вещества было предложено Десиньолем (Designolle) в 1869. В этом же году Фонтэйн (Fountaine) предложил смесь пикрата калия и хлората калия, а Абель (Abel) предложил смесь пикрата аммония и нитрата калия. Первые систематические исследования пикратов металлов были проведены в 1901 Дюпре (Dupre), продолжены Уиллом (Will) в 1906, Силберрадом (Silberrad) и Филлипсом (Phillips) в 1908, Кастом (Kast) в 1911.
Взрывчатые свойства
Общее свойство всех пикратов — образовывать кристаллогидраты с различным количеством молекул воды. Чувствительность в значительной степени зависит от количества остаточной воды, чем её больше, тем менее чувствительны материалы.
В ряду пикратов с различными катионами чувствительность уменьшается в ряду: Pb>Fe>Co>Ni>Ba>Cu>Mn>Zn>Ca, Na, NH4
Получение
Пикраты могут быть получены действием на пикриновую кислоту гидроксидов или карбонатов соответствующих металлов, а также другими методами.
Отдельные неорганические пикраты
Пикрат алюминия
Химическая формула [C6H2(NO2)3O]3Al, молекулярная масса 711,31 а. е. м. Содержание азота 17,73 %. Плавится выше 100 °C, при дальнейшем нагревании взрывается. Может быть получен продолжительным нагреванием из его гидратов (например, ди-, тетра-, дека- или гексадекагидрата) при температуре ниже 100 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 40,6 см (для тротила — 35,6 см).
Дигидрат пикрата алюминия [C6H2(NO2)3O]3Al*2H2O получается из декагидрата при нагревании до +80 °C. По чувствительности он сравним с безводной солью, а декагидрат имеет низкую чувствительность. Дигидрат пикрата алюминия взрывается при температуре около 360 °C.
Основной пикрат алюминия [C6H2(NO2)3O]2AlOH·7H2O, молекулярная масса 530,35 а. е. м. Красноватые или палево-желтые игольчатые кристаллы, при нагреве до +80 °C переходят в тетрагидрат жёлтого цвета, который при дальнейшем нагревании взрывается.
Пикрат аммония
Другие названия: тринитрофенолят аммония, взрывчатое вещество Д и даннит (en:dunnite) (в военном применении в США).
Химическая формула C6H2(NO2)3ONH4, молекулярная масса 246,14. Содержание азота 22,77 %. Кислородный баланс с окислением до CO2: −52 %. Две формы: стабильная жёлтая и метастабильная красная.
Получают реакцией нейтрализации в водном растворе пикриновой кислоты аммиаком в виде газа или водного раствора.
Пикрат аммония — одно из первых бризантных взрывчатых веществ, которые начали применяться в XIX веке для снаряжения боеприпасов, название даннит получил от фамилии майора армии США Данна, предложившего использовать его в снарядах. Под наименованием Explosive D (взрывчатое вещество Д) широко использовался и используется в США. Входит в состав нескольких взрывчатых смесей (например, пикратола).
По взрывчатым характеристикам незначительно уступает тротилу, чувствительность меньше, чем у тротила.
Пикрат бария
Химическая формула [C6H2(NO2)3O]2Ba, молекулярная масса 594,64 а. е. м. Содержание азота 14,14 %. Жёлтый кристаллический порошок, взрывается при 333—337 °C с умеренной мощностью. Может быть получен нагреванием пентагидрата [C6H2(NO2)3O]Ba·5H2O . Пентагидрат — жёлтые призматические игольчатые кристаллы, получаются из концентрированного водного раствора. Безводная соль взрывается при 403 °C, но малочувствительна к удару и трению.
Пикрат кадмия
Химическая формула [C6H2(NO2)3O]2Cd, молекулярная масса 569,70 а. е. м. Содержание азота 14,76 %. Жёлтый кристаллический порошок. Взрывается при 336—341 °C. Получается нагревом кристаллогидратов при 80-150 °C. (пента-, гепта- или октогидрата). Чувствительность к удару безводной соли по методу Арсенала Пикатинни с грузом 2 кг составляет 30,5 см (тротил — 35,6 см). Чувствительность октагидрата 88,9 см, он менее чувствителен, чем дымный порох.
Пикрат кальция
Химическая формула [C6H2(NO2)3O]2Ca, молекулярная масса 497,38 а. е. м. Содержание азота 16,90 %. Жёлтый кристаллический порошок. Взрывается при 323—328 °C. Получается нагревом декагидрата при +80 °C.
Пикрат церия
Химическая формула [C6H2(NO2)3O]2Ce, молекулярная масса 824,45 а. е. м. Содержание азота 15,29 %. Коричневый кристаллический порошок. Взрывается при 306—313 °C. Получается нагревом кристаллогидратов (три-, или ундекагидрата).
Пикрат цезия
Химическая формула C6H2(NO2)3OCs, молекулярная масса 361,01 а. е. м. Содержание азота 11,64 %. Жёлтые иглообразные кристаллы. Взрывается при 277—287 °C. Использовался в США для возбуждения взрыва в зарядах гексогена в магнитогидродинамических генераторах (МГД-генераторах).
Пикрат хрома
Химическая формула [C6H2(NO2)3O]5Cr·27H20, молекулярная масса 1695,09 а. е. м. Содержание азота 12,04 %. Зелёный кристаллический порошок. Получается взаимодействием эквивалентных количеств пикрата бария и фиолетовой модификации сульфата хрома (зелёная модификация не полностью реагирует с пикратом бария). Безводная соль получается дегидратацией при 150 °C. Тридекагидрат и моногидрат взрываются при 330 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для тридекагидрата 91,4 см, для моногидрата 20,3 см (для тротила — 35,6 см).
Пикрат кобальта
Химическая формула [C6H2(NO2)3O]2Co, молекулярная масса 371,03 а. е. м. Содержание азота 22,66 %. Коричневый кристаллический порошок. Взрывается при 320—325 °C. Получается нагревом кристаллогидратов при 150 °C.
Пикрат меди
Химическая формула [C6H2(NO2)3O]2Cu, молекулярная масса 520,85 а. е. м. Содержание азота 16,14 %. Жёлто-зелёный кристаллический порошок, очень гигроскопичный. Взрывается при 282—287 °C, по другим данным при 373 °C. Получается нагревом кристаллогидратов при 80-150 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 30,5 (для тротила — 35,6 см). Тригидрат взрывается при 300 °C, его чувствительность к удару 48,3 см.
Пикрат железа (III)
Химическая формула [C6H2(NO2)3O]3Fe·11H2O, молекулярная масса 938,4 а. е. м. Содержание азота 13,44 %. Красно-жёлтый игольчатый кристаллический порошок. Получен Кастом в 1911 обработкой горячего насыщенного раствора сульфата железа пикратом бария. Имеет несколько кристаллогидратов, которые взрываются при 295 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — от 15,2 см для материала, высушенного при 150 °C, до 91,4 см для материала, высушенного при +25 °C.
Пикрат железа II
Химическая формула[C6H2(NO2)3O]2Fe, молекулярная масса 513,15 а. е. м. Содержание азота 16,38 %. Тёмно-зелёный кристаллический порошок. Взрывается при 315—320 °C. Получается сушкой октагидрата в вакуумном эксикаторе над серной кислотой. Октагидрат был получен обработкой горячего насыщенного раствора сульфата железа (II) пикратом бария. Жёлтые гексагональные призмы октагидрата при хранении приобретают коричневый цвет. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 91,4 см.
Пикрат свинца
Химическая формула [C6H2(NO2)3O]2Pb, молекулярная масса 663,41 а. е. м. Содержание азота 12,67 %. Жёлтый кристаллический порошок. Взрывается при 270—281 °C. Получается сушкой моногидрата или тетрагидрата при 150 °C. Тетрагидрат был получен обработкой раствора пикриновой кислоты карбонатом свинца. Чувствительность к удару безводной соли при испытании с грузом 500 г — 4 см (для гремучей ртути — 24 см). Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 5 см. Чувствительность к трению также высока.
Моногидрат пикрата свинца был запатентован во Франции в 1872 году для применения в капсюлях и детонаторах. Использовался в Германии для производства зажигательных смесей.
Пикрат лития
Химическая формула C6H2(NO2)3OLi, молекулярная масса 235,05 а. е. м. Содержание азота 17,88 %. Жёлтый кристаллический порошок. Очень гигроскопичен, с образованием моногидрата. Взрывается при 318—323 °C. Получается сушкой гидратов. Плотность 1,724 — 1,740 г/см3.
Пикрат магния
Химическая формула [C6H2(NO2)3O]2Mg, молекулярная масса 481,60 а. е. м. Содержание азота 17,45 %. Взрывается при 367—372 °C. Получается сушкой гидратов при 150 °C.
Пикрат марганца
Химическая формула [C6H2(NO2)3O]2Mn, молекулярная масса 512,23 а. е. м. Содержание азота 16,41 %. Жёлтый кристаллический порошок. Взрывается при 325—330 °C. Получается сушкой гидратов при 150 °C.
Пикрат никеля
Химическая формула [C6H2(NO2)3O]2Ni, молекулярная масса 516,01 а. е. м. Содержание азота 16,29 %. Зелёный кристаллический порошок. Взрывается при 335—340 °C, гексагидрат взрывается при 390 °C. Получается сушкой гидратов. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для безводной соли — 10,1 см.
Пикраты платины
Платина образует комплексные соединения, содержащие ион пикриновой кислоты:
- [Pt(CH3SCH3)4]·[C6H2(NO2)3O]2, содержание азота 9,32 %, жёлтые кристаллы, взрывается при нагреве.
- [Pt(C2H5SCH2CH2SC2H5)2]·[C6H2(NO2)3O]2, содержание азота 8,8 %, жёлтые кристаллы, взрывается при нагреве.
Пикрат калия
Химическая формула C6H2(NO2)3OK, молекулярная масса 267,20 а. е. м. Содержание азота 15,73 %. Красновато-жёлтые или зелёные ромбические кристаллы. Взрывается при 310—316 °C. Предположительно, впервые был получен Глаубером в XVII веке растворением древесины в азотной кислоте и нейтрализацией поташом K2CO3. Получается в реакции нейтрализации горячего водного раствора карбоната калия горячим раствором пикриновой кислоты и отделением кристаллов при охлаждении раствора. Растворимость в воде при +15 °C 0,5 г/100 г воды, при 100 °C 25 г/100 г воды. Растворимость в этиловом спирте 0,2 г/ 100 г. Теплота взрывчатого разложения при постоянном объёме 621,8 ккал/моль. Взрывается при 370 °C.
Чувствительность к удару 2 дюйма. Стабильность близка к пикрату аммония (Explosive D), но бризантность меньше. При контакте с огнём детонирует. При любых условиях взрывания выделяется чёрный дым неокисленного углерода. Смеси с окислителями (например, нитратом калия) могут гореть без детонации, но чувствительны к удару и опасны в обращении.
В 1869 году Десиньолем разработан взрывчатый состав (смесь пикрата калия, нитрата калия и древесного угля) (порох Десиньоля), а также порох Фонтэйна (Fountain) (смесь пикрата калия и хлората калия). Пикрат калия использовался в пиротехнических составах для сигнальных свистков (использующих характерный звук, возникающий при горении некоторых пикратов). Использовался в составе баллиститных твёрдых ракетных топлив, в различных инициирующих составах (например, в смесях пикрата калия, пикрата свинца и хлората калия).
Смесь мелкодисперсных пикрата калия с нитратом калия в соотношении 60:40 по массе, плотно упакованная в бумажные или бамбуковые трубочки диаметром от ¼ до ¾ дюйма, горит с громким свистящим звуком. Во время Второй мировой войны немецкая армия применяла такие свистки в качестве дополнительных устройств к бомбам для усиления психологического воздействия. Свистки применялись как сигнальное средство при газовой атаке. Указанная смесь имеет высокую чувствительность и опасна в обращении, поэтому была заменена смесью галловой кислоты и хлората калия.
Пикрат рубидия
Химическая формула C6H2(NO2)3ORb, молекулярная масса 313,58 а. е. м. Содержание азота 13,40 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 300—315 °C. Взрывается при ударе.
Пикрат серебра
Серебро образует комплексные аммиачные соли [Ag(NH3)2]·[C6H2(NO2)3O]2, молекулярная масса 682,23. Содержание азота 28,75 %. Жёлтые кристаллы, взрываются при нагреве.
Пикрат натрия
Химическая формула C6H2(NO2)3ONa, молекулярная масса 251,10 а. е. м. Содержание азота 16,74 %. Желтоватый игольчатый кристаллический порошок. Взрывается при 310—315 °C. Получается сушкой моногидрата при 150 °C. Моногидрат был получен нейтрализацией водного раствора пикриновой кислоты карбонатом натрия. Моногидрат взрывается при 360 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для моногидрата 43,2 см, для безводной соли 38,1 см (для тротила 35,6 см).
Пикрат натрия горит при контакте с пламенем и придаёт эти свойства смесям с другими материалами. Использовался во взрывчатых и пиротехнических составах, в том числе вместо пикрата калия.
Двойные пикраты (например, получаемые совместно пикрат натрия и пикрат свинца) показывают меньшую чувствительность к удару, чем эти соли по отдельности.
Пикрат таллия
Химическая формулаC6H2(NO2)3OTl, молекулярная масса 432,48 а. е. м. Содержание азота 9,72 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 273—275 °C. Получается обработкой раствора пикриновой кислоты карбонатом таллия. Взрывается при нагреве и ударе.
Пикрат тория
Химическая формула [C6H2(NO2)3O]4Th, молекулярная масса 1324,68 а. е. м. Содержание азота 12,69 %. Жёлтый игольчатый кристаллический порошок. Температура плавления +52— +53 °C. Взрывается при контакте с пламенем.
Пикрат цинка
Химическая формула [C6H2(NO2)3O]2Zn, молекулярная масса 522,67 а. е. м. Содержание азота 16,08 %. Жёлто-коричневый кристаллический порошок. Взрывается при 350—355 °C. Получается сушкой гидратов при 150 °C. Чувствительность к удару 60 см для груза 2 кг, что близко к пикриновой кислоте.
Пикрат циркония
Химическая формула [C6H2(NO2)3O]4Zr, молекулярная масса 1032,66 а. е. м. Содержание азота 16,75 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 317—322 °C. Может быть получен действием карбоната циркония на раствор пикриновой кислоты.
Органические пикраты
Пикриновая кислота образует соединения, подобные пикратам, со многими органическими веществами: углеводородами, нитросоединениями, аминами, фенолами и др. Как правило, их можно получить кипячением спиртовых растворов с последующим охлаждением и выпадением кристаллов пикратов. Отдельные примеры таких соединений:
- пикрат аценафтена (acenaphthen) C12H10+C6H2(NO2)3OH. Оранжево-красные призматические кристаллы, температура плавления 161—162 °C, взрывается при 412 °C.
- пикрат аллиламина (allylamine) C3H7N+C6H2(NO2)3OH. Лимонно-жёлтые игольчатые кристаллы, температура плавления 140—141 °C, взрывается при 270 °C.
- пикрат анилина C6H5NH2+C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления с разложением 165 °C, взрывается при 398 °C.
- пикрат атропина, температура плавления 173—175 °C, взрывается при 460 °C.
- пикрат азидогуанидина N3CNHNH2+C6H2(NO2)3OH. Взрывается при нагреве, к удару нечувствителен.
- пикрат цинхонидина (cinchonidine) 2C19H22ON2+3C6H2(NO2)3OH. Жёлтые кристаллы, температура плавления 194—195 °C, взрывается при 260—268 °C.
- пикрат гуанидина CH5N3+C6H2(NO2)3OH. Жёлтые кристаллы, взрывается при 498 °C.
- пикрат гексаметилентетрамина C6H12N4+C6H2(NO2)3OH. Жёлтые игольчатые, взрывается при 360 °C.
- пикрат гидразина N2H4+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 201 °C, взрывается при 385 °C.
- пикрат индена C9H8+C6H2(NO2)3OH. Золотисто-жёлтые кристаллы, температура плавления 98 °C, высокая чувствительность в сухом состоянии, на воздухе медленно разлагается.
- пикрат нафталина C10H8+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 149—151 °C, взрывается при 484 °C. Образует с пикриновой кислотой эвтектическую смесь.
- пикрат альфа-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-жёлтые игольчатые кристаллы, температура плавления 189—190 °C, взрывается при 458 °C.
- пикрат бета-нафтола C10H7OH+C6H2(NO2)3OH. Оранжево-красные игольчатые кристаллы, температура плавления 155—157 °C, взрывается при 469 °C.
- пикрат фенантрена C14H10+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 143—145 °C, взрывается при 478 °C.
- пикрат пиридина C5H5N+C6H2(NO2)3OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 165—166 °C, взрывается при 432 °C.
- Пикрат карбамида (мочевины) CH4ON2+C6H2(NO2)3OH. Жёлтые игольчатые кристаллы, температура плавления 142 °C с разложением, взрывается при 489 °C.
См. также
Литература
- Fedoroff, Basil T. et al Enciclopedia of Explosives and Related Items, vol.1—7. — Dover, New Jersey: Picatinny Arsenal. — 1960—1975. — P274-P285.



