Электролиз
Цель работы: опытным путем изучить электролиз растворов солей.
Теоретическая часть.
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах, при прохождении электрического тока через раствор или расплав электролита. Это не самопроизвольный процесс, для осуществления химической реакции требуется электрическая энергия. Сущность электролиза заключается в том, что на катоде происходит процесс восстановления, а на аноде — процесс окисления. Процессы, протекающие на электродах, зависят как от электролита, так и от вещества, из которого сделан анод.
Различают два вида анодов: растворимые и нерастворимые.
Нерастворимый, или инертный, анод не изменяется в процессе электролиза, играет роль передатчика электронов (графит, уголь, платина и др.).
Растворимый или активный анод в процессе электролиза окисляется (медь, железо, кобальт и др.): Мео-nē=Мen+
На электродах легче всего протекают процессы, требующие минимальной затраты энергии.
На катоде быстрее восстанавливаются ионы, молекулы, атомы, имеющие наибольшее значение электродного потенциала.
Практическая последовательность восстановления на катоде при электролизе водных растворов:
1) ионы
металлов от конца ряда напряжений до
цинка: Аи3+………Zn2+ по уравнению:
 Металл при этом выделяется в свободном
виде.
Металл при этом выделяется в свободном
виде.2) молекулы воды: 2Н2О + 2ē = Н2↑ + 2ОН—
Если в растворе одновременно находятся катионы нескольких металлов, то при разных концентрациях их в первую очередь на катоде разряжаются ионы того металла, у которого больше величина электродного потенциала.
Например,
если в растворе одновременно присутствуют
в равных концентрациях различные катионы
(Zn2+,
Au3+,
Cu2+,
Fe2+),
то, в соответствии с величинами их
электродных потенциалов, катионы будут
восстанавливаться в следующей
последовательности: Au
На аноде легче всего окисляются ионы, молекулы, атомы, имеющие наименьшее значение электродного потенциала.
Практическая последовательность окисления на аноде при электролизе водных растворов:
а) анод — инертный :
1) анионы бескислородных кислот: Se2-, S2-, I—, Вг—, Сl— (кроме F—) до соответствующих соединений в свободном виде Se, S, I2, Br2, Cl2↑;
2)
молекулы воды; 2Н2О
— 4ē
= О2↑
+ 4Н
б) анод — активный:
окисляется сам анод: Мео-nē=Мen+
Схема электролиза некоторых солей.
Электролиз расплава хлорида магния с инертным анодом.
Расплав содержит ионы магния Mg2+ и хлорид-ионы CI—, при пропускании тока ионы магния перемещаются к катоду, а хлорид-ионы — к аноду. Принимая от катода по два электрона, ионы магния превращаются в нейтральные атомы, выделяющиеся из расплава. Катод постепенно покрывается магнием.
Хлорид-ионы, достигая анода, отдают ему электроны и превращаются в атомы хлора. У анода выделяется хлор.
Схематически процесс электролиза расплава хлорида магния можно изобразить: MgCI2 = Mg2+ + 2Cl—
(-) Катод: Mg2+ + 2ē = Mg°
(+) Анод:2Сl—-2ē = С12↑
Суммарная реакция: MgCI2 = Mg + CI2↑
2. Электролиз раствора нитрата калия с инертным анодом.
Раствор содержит ионы калия К+, нитрат-ионы NO3—, молекулы воды. В соответствии с последовательностью разрядки на аноде и катоде будут протекать следующие процессы:
K+ (+) Катод: 2Н2О + 2ē = H2↑+ 2ОН—
NO3—
В прикатодном пространстве будет образовываться щелочь KOH, а в прианодном – кислота HNO3.
Суммарная реакция в молекулярно-ионном виде:
6Н2О = 2Н2↑ + О2↑+ 4ОН — + 4Н+
В молекулярном виде:
4KNO3 + 6Н2О = 2Н2↑ + О2↑ + 4КOН + 4HNO3
3. Электролиз раствора сульфата никеля с никелевым анодом.
В соответствии с последовательностью разрядки на аноде и катоде будут протекать следующие процессы:
(-) Анод: Ni0 — 2ē = Ni2+
(+) Катод: Ni2+ + 2ē = Ni0
Весь процесс сводится к выделению никеля на катоде и постепенному растворению никелевого анода. Количество сульфата никеля в растворе остается неизменным.
Практическая часть
Электролиз водных растворов проводится в приборе, представленном на рисунке 10.1. В качестве инертных электродов используются графитовые стержни карандашей.
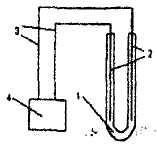
Рис. 9.1. Прибор для проведения электролиза
1 —U — образный сосуд с раствором электролита,
2 — электроды,
3 — токопроводящие проволоки.
4 — ИСТОЧНИКпостоянного ТОКа
Опыт №1. Электролиз с нерастворимыми электродами.
Электролизер (U — образную трубку) наполните, не доходя до краев ~ 1см, раствором соли, указанном в задании. Опустите в оба колена трубки электроды, включите прибор, отметьте все видимые изменения. Напишите уравнения катодного и анодного процессов, суммарное уравнение в ионно-молекулярном и молекулярном виде.
Идентификация продуктов, образующихся при электролизе солей
на аноде:
1. Хлор – газ — определяется по резкому запаху, при появлении первых признаков которого прибор следует выключить.
2. Йод определяется по появлению коричневой окраски, характерному запаху, с помощью йодкрахмальной индикаторной бумаги.
З. Кислород — газ без запаха.
на катоде:
Водород — газ без запаха.
Если на катоде не выделяется водород, то осаждается металл в виде красноватого налета (медь), блестящих игольчатых кристаллов (цинк, свинец) и т.д.
Опыт №2. Электролиз с активным анодом.
Опыт выполняется аналогично опыту №1. Один графитовый электрод заменяется металлическим (железо, алюминий, цинк, медь), который подключается к положительному полюсу внешнего источника. Раствор соли для электролиза взять из опыта №1 по указанию преподавателя.
Указания по технике безопасности
1. Настоящая работа имеет повышенную опасность, так как в ней применяется электрический ток.
2. Присоединять прибор к источнику тока только после того, когда электроды вставлены в раствор.
3. Не прикасайтесь к открытым токоведущим частям.
Лабораторная работа № 10
Электролиз расплавов | Дистанционные уроки
05-Апр-2013 | комментариев 14 | Лолита Окольнова
Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
КАТод — КАТионы (ионы у кат
АНод — АНионы (ионы у анода)
На катоде идет восстановление: Me n+ + ne— = Me0, т.е. на катоде выделяется металл.
На аноде окисляется кислород: O-2 -2e— = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
Me n+ +ne— = Me0
На аноде будет окисляться кислород в составе гидроксид-группы:
4OH− −4e =2H2O + O2
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде окисляется бескислородный анион: A n- — ne— = A0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде будет окисляться элемент аниона: SO3 2- — 2e— = SO3
Например, электролиз расплава сульфита натрия:
Na2SO3 = 2Na + SO3
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
2CO3-2 — 4e—= 2CO2 + O2
Например, электролиз расплава карбоната натрия:
2Na2CO3 = 4Na + 2CO2+ O2
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Еще на эту тему:
Обсуждение: «Электролиз расплавов»
(Правила комментирования)Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий на электродах через расплав или раствор электролита.
Не путать с окислительно-восстановительными реакциями, где восстановителем или окислителем является то или иное вещество. В данном типе ОВ процессов восстановителем и окислителем являются электроды:
Катод – электрод , на котором происходит восстановление катионов (катод отдаёт электроны, катион принимает).
Анод – электрод , на котором происходит окисление анионов (анод принимает электроны, анион отдаёт электроны).
Анод бывает инертным (не влияет на протекание реакции), а бывает растворимый (переходит в среду реакции).
Как говорилось выше, электролиз может проходить как в растворах, так и в расплавах. Если в расплаве зачастую в электролизе участвует одно вещество, то в растворе их может быть несколько (если в воде растворяли несколько веществ), включая воду.
Разберём уравнения электролиза на примере NaCl (расплав, раствор):
Алгоритм:
1. Пишем уравнение электролитической диссоциации
2. Обозначаем, какие вещества будут участвовать в восстановлении или окислении на электродах.
3. Описываем процесс восстановления и окисления.
4. Пишем суммарное уравнение
Теперь разберём на примере NaCl:
1.NaCl(расплав)⇆Na++Cl—
2. ЗАПОМНИТЬ!!! К катоду притягиваются катионы, а к аноду притягиваются анионы.
В нашем случае в электролизе участвует всего одно вещество – расплав NaCl, поэтому конкуренции на электродах не будет.
3.Катод (-): Na++1e→Na
Анод (+): 2Cl—-2e→Cl2↑
4. NaCl(расплав) → Na+Cl2↑
Далее речь пойдёт о электролизе растворов. Чтобы говорить о нём, нужно знать электролиз воды:
2H2O→2H2↑+O2↑
Катод (-): 2H++2e→H2↑
Анод (+): 2O-2-4e→O2↑
Заметим, что если проходит электролиз раствора, то участвовать в процессах будет растворённое вещество ивода!!! В водных растворах имеется как минимум (!!!) два вещества – вода и растворённое вещество.
Чтобы понять , какой из металлов выиграет в конкуренции за восстановление на катоде, следует обратиться к электрохимическому ряду напряжений металлов.
|
Катионы активных металлов |
Катионы металлов средней активности |
Катионы неактивных металлов |
|
Все металлы от Liи до Al(включительно) |
Все металлы от Mnи до Pb (включительно) |
Все металлы, стоящие после (H) в ЭХРП металлов |
|
Невозможно получить при электролизе растворов. На катоде подвергается электролизу вода с выделением водорода. |
При электролизе растворов данные металлы выделяются на катоде. |
Электролиз проходит легко, металлы выделяются на катоде. |
Конкуренция существует и при окислении на аноде, рассмотрим в таблице.
|
Анионы кислородсодержащих кислот, а так же фторид-ион |
Ионы бескислородных кислот (кроме фтороводородной) |
|
Не подвергаются окислению на аноде в водных растворах. Электролизу подвергается вода с выделением кислорода. |
Легко окисляются до свободных неметаллов. |
Разберём на практике несколько примеров:
1. Пишем уравнение диссоциации хлорида цинка :ZnCl2⇌Zn2++2Cl—
2. Катод (будут конкурировать ионы Zn2+ иH2O):
Zn2++2e→Zn↓
Анод (будут конкурировать ионы Cl—и H2O):
2Cl—-2e→Cl2↑
3. Суммарное уравнение:
ZnCl2+H2O→ Zn↓+Cl2↑
Из данного примера видим, что тут вода не участвовала в электролизе.
Ещё пример.
1. Раствор сульфата меди (II)
CuSO4⇌Cu2++SO42-
2. Катод (Ионы Cu2+выигрывают конкуренцию у H2O):
Cu2++2e→Cu↓
Анод (будут конкурировать ионыSO42- и H2O):
2H2O+4e→O2↑+4H+
В растворе остались ещё H+ ионы, которые пойдут на образование молекулH2SO4.
3. Суммарное уравнение: 2CuSO4+2H2O→2Cu↓+O2↑+2H2 SO4
1.Раствор нитрата меди (II)
Cu(NO3 )2⇄Cu2++2NO3—
2. Катод (ионы Cu2+выигрывают конкуренцию у H2O)
Cu2++2e→Cu↓
Анод (H2Oвыигрывает конкуренцию у NO3—)
2H2O-4e→O2↑+4H+
3. Суммарное уравнение:
2Cu(NO3 )2+2H2O→2Cu↓+O2↑+4HNO3
1. Раствор хлорида калия
KCl⇄K++Cl—
2. Катод (H2Oвыигрывает конкуренцию у ионов K+)
2H2O+2e→H2↑+2OH—
Анод (ионы Cl—выигрывают конкуренцию у H2O)
2Cl—-2e→Cl2↑
3. Суммарное уравнение:
Оставшиеся ионы K+и OH—образуют KOH
2KCl+2H2O→ H2↑+Cl2↑+2KOH
Решим несколько задач, где встречается электролиз:
1. При электролизе 1л раствора хлорида меди (II) на катоде выделилась медь массой 12,7г. Вычислите объем газа (н.у.), выделившегося на аноде, если плотность раствора близка к 1 г/мл
Ответ: 4,44 л.
2.При электролизе водного раствора нитрата серебра (I) на аноде выделилось 13,44л кислорода (н.у.). Определите массу выделившегося на катоде серебра, если выход серебра составил 90% от теоретически возможного, а выход кислорода — количественный.
Ответ: 233,3г.
3.При электролизе водного раствора хлорида цинка на катоде выделился цинк массой 68,25г, а на аноде — хлор объемом 28,22л (н.у.). Определите выход цинка, если выход хлора составил 90% от теоретически возможного.
Ответ: 75%.
Автор статьи: Симкин Егор Андреевич
Редактор: Харламова Галина Николаевна
Лекция на тему: «Электролиз»
Лекция тема: «Электролиз»
Изучив тему, следует:
знать сущность процесса электролиза и основные способы его применения
иметь представление об отличии электролиза расплава от электролиза раствора
уметь записывать процессы электролиза, происходящие на катоде и аноде в расплаве;
записывать процессы электролиза, происходящие на катоде и аноде в растворе;
составлять уравнения реакции электролиза
Сущность электролиза
С процессом электролиза познакомимся на примере раствора хлорида меди (II) CuCI2
Эта соль в растворе продиссоциирует CuCI2 → Cu 2+ + 2CI—
на катион меди Cu 2+ и анион кислотного остатка 2CI—
При пропускании постоянного электрического тока через раствор, катионы меди Cu 2+ движутся к катоду « — » (катод), а анионы хлора 2CI— к аноду « + » (анод)
катионы меди движутся к катоду: Cu 2+ → « — » (катод)
анионы хлора движутся к аноду: 2CI— → « + » (анод)
(-) Катод — отрицательный электрод с избытком электронов на его поверхности,
ионы меди Cu 2+ присоединяют электроны с катода: Cu 2+ + 2ē → Cu0
(+) Анод — положительный заряженный электрод. У анода недостаток электронов,
поэтому анод втягивает в себя электроны от отрицательно заряженных ионов хлора:
2CI— — 2ē → CI20
Следовательно, электролиз – это окислительно — восстановительный процесс
Электролиз — это окислительно-восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускать постоянный электрический ток
Отличие электролиза расплава от электролиза раствора
Электролиз расплавов
При расплавлении соли или щелочи, как и при растворении, распадаются на ионы
Схема электролиза расплавленного хлорида натрия: NaCI →Na+ + CI—
На катоде (-): Na+ + 1ē → Na0 2
Восстанавливаются ионы натрия в нейтральные атомы, то есть образуется металлический натрий.
На аноде (+): 2CI— — 2ē → CI20 1
Окисляются хлорид — ионы в нейтральную молекулу хлора.
Уравнение реакции процесса электролиза хлорида натрия NaCI:
электролиз
2NaCI → 2 Na0 + CI20↑
Схема электролиза расплавленного гидроксида натрия: NaOH → Na+ + OH—
Процесс восстановления на катоде (-): Na+ + 1ē → Na0 4 окислитель
Восстанавливаются ионы натрия в нейтральные атомы, то есть образуется металлический натрий.
Процесс окисления на аноде (+): OH— — 1ē → OH0 4OH0 → 2H2O + O2 ↑ 1 восстановитель
Окисляются гидроксид — ионы в нейтральные группа.
Эти группы неустойчивы, разлагаются с образованием воды и кислорода.
Уравнение реакции процесса электролиза гидроксида натрия NaОН:
электролиз
4NaOH → 4Na0 + 2H2O + O2 ↑
Электролиз водных растворов
При электролизе водных растворов в реакции могут участвовать ионы водорода и гидроксид — ионы, которые образуются в результате диссоциации воды: H2O ↔ Н+ + ОН—
В результате этого у катода накапливаются катионы электролита и ионы Н+,
а у анода — анионы электролита и ионы ОН—.
Какие же ионы будут восстанавливаться на катоде и окисляться на аноде?
Процессы, происходящие на катоде:
Катионы металлов, имеющих малый стандартный электродный потенциал
(Li+ K+ Ca2+ Na+ Mg2+ AI3+включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды. На катоде выделяется водород из воды
2. Катионы, стоящие в ряду стандартных электродных потенциалов от марганца до водорода
(Mn2+ Zn2 Cr3+ Fe2+ Ni2+ Sn2+ Pb2+ H+), при электролизе растворов восстанавливаются одновременно с молекулами воды
3. Катионы металлов, стоящие в ряду стандартных электродных потенциалов после водорода
(Cu2+ Hg2+ Ag+), практически полностью восстанавливаются на катоде
Процессы, происходящие на аноде:
Характер реакций, протекающих на аноде, зависит как от присутствия воды, так и от вещества, из которого сделан анод. Аноды подразделяются на нерастворимые в воде (изготавливаются из угля, графита, платины, иридия) и растворимые в воде (из меди, серебра, цинка, никеля и других металлов).
На нерастворимом аноде в процессе электролиза следует руководствоваться
рядом разряженности на аноде
1. Анионы бескислородых кислот и их солей (F— CI— Br— I— S2- CN— и т.п.) удерживают электроны слабее иона ОН— воды, поэтому при электролизе водных растворов солей бескислородных кислот окисляются анионы бескислородных кислот.
2. Анионы кислородсодержащих кислот (NO3— SO32- SO42- CO32- PO43-) удерживают свои электроны более прочно, чем ионы ОН—, поэтому при электролизе водных растворов солей кислородсодержащих кислот окисляется молекула воды, а анионы соли остаются без изменения.
Первая группа металлов до алюминия
Пример:
а) Электролиз раствора нитрата кальция
Ca(NO3)2 — соль с кислородcодержащим кислотным остатком
— электролит диссоциирует на Ca(NO3)2 ↔ Ca2+ + 2NO3—
вода диссоциирует на H2O ↔ Н+ + ОН—
Катионы кальция Ca2+ расположены в ряду стандартных электродных потенциалов до алюминия, следовательно, на катоде разряжаются ионы водорода Н+ воды,
а на аноде разряжаются ионы ОН— , так как ионы NO3— удерживают свои электроны более прочно, чем ионы ОН— воды
В растворе находятся положительные ионы: Ca2+ и Н+ отрицательные ионы: NO3— и ОН—
Процесс восстановления на катоде «-» 2H2O + 2ē → H20↑ + 2ОН— 4 ǀ 2 окислитель
—————————————————————————————————————————-
В катодном пространстве накапливаются: Са2+ + 2ОН— → Са(ОН)2
Процесс окисления на аноде «+» 2H2O — 4ē → O2 ↑ + 4Н+ 2 ǀ 1 восстановитель
——————————————————————————————————————————
В анодном пространстве накапливаются: Н+ + NO3— ↔ НNO3
Уравнение электролиза:
выписываются все продукты реакции с катода, анода и из катодного и анодного пространства
электролиз
Ca(NO3)2 + 3H2O → H20↑ + Са(ОН)2 + O2 ↑ + 2НNO3
Пример:
б) Электролиз раствора иодида кальция CaI2 — соль с бескислородным кислотным остатком
CaI2 — электролит диссоциирует на CaI2 ↔ Ca2+ + 2 I—
вода диссоциирует H2O ↔ Н+ + ОН—
Катионы кальция Ca2+ расположены в ряду стандартных электродных потенциалов до алюминия, следовательно, на катоде разряжаются ионы водорода Н+ воды, а на аноде — ионы йода I— так как они слабее удерживают свои электроны, чем ионы ОН— воды
Процесс восстановления на катоде «-» 2H2O + 2ē → H20↑ + 2ОН— 2 ǀ 1 окислитель
—————————————————————————————————————————-
В катодном пространстве накапливаются: Са2+ + 2ОН— → Са(ОН)2
Процесс окисления на аноде «+» 2I— — 2ē → I2 ↓ 2 ǀ 1 восстановитель
В анодном пространстве накопления молекул нет, так как кислотный остаток бескислородный и только он окисляется на аноде
Уравнение электролиза:
выписываются все продукты реакции с катода, анода и из катодного и анодного пространства
электролиз
CaI2 + 2H2O → H20↑ + Са(ОН)2 + I2 ↓
Вторая группа металлов от алюминия до водорода:
Пример:
а) Электролиз раствора сульфата никеля NiSO4
NiSO4 соль с кислородcодержащим кислотным остатком
— электролит диссоциирует на NiSO4 ↔ Ni2+ + SO42-
Вода диссоциирует H2O ↔ Н+ + ОН—
Катионы никеля — Ni2+ расположены в ряду стандартных электродных потенциалов от марганца до водорода, следовательно, они восстанавливаются одновременно с ионами водорода Н+ воды, а на аноде разряжаются ионы ОН— воды, так как ионы SO42- удерживают свои электроны более прочно, чем ионы ОН— воды
В растворе находятся положительные ионы: Ni2+ и Н+ отрицательные ионы: SO42- и ОН—
Процесс восстановления на катоде «-» 2H2O + 2ē → H20↑ + 2ОН—
идут параллельно оба процесса восстановления Ni2+ + 2ē → Ni0 ; 4 ǀ 1
—————————————————————————————————
В катодном пространстве накапливаются: Ni2+ + 2ОН— → Ni(ОН)2
Процесс окисления на аноде «+» 2H2O — 4ē → O2 ↑ + 4Н+ 4 ǀ 1
—————————————————————————————————
В анодном пространстве накапливаются: 2Н+ + SO42- ↔ Н2SO4
Уравнение электролиза:
выписываются все продукты реакции с катода, анода и из катодного и анодного пространства
электролиз
2NiSO4 + 4H2O → Ni0 + Ni(ОН)2 + O2 ↑ + H20 ↑ + Н2SO4
В растворе идет диссоциация нейтральных молекул до тех пор, пока все нейтральные молекулы не распадутся на ионы: Ni(ОН)2 + 2Н2SO4 → NiSO4 + 2H2O
Пример:
б) Электролиз раствора хлорида никеля (II) NiCI2
NiCI2 — электролит диссоциирует на NiCI2 ↔ Ni2+ + 2CI—
Вода диссоциирует H2O ↔ Н+ + ОН—
Катионы никеля — Ni2+ расположены в ряду стандартных электродных потенциалов от марганца до водорода, следовательно, они восстанавливаются одновременно с ионами водорода Н+ воды, а на аноде — ионы хлора CI— так как они слабее удерживают свои электроны, чем ионы ОН— воды: В растворе находятся положительные ионы: Ni2+ и Н+ отрицательные ионы: CI— и ОН—
Процесс восстановления на катоде «-» 2H2O + 2ē → H20↑ + 2ОН—
идут параллельно оба процесса восстановления Ni2+ + 2ē → Ni0 4 ǀ 2
————————————————————————————————————————-
В растворе у катода: Ni2+ + 2ОН— → Ni(ОН)2
Процесс окисления на аноде «+» 2CI— — 2ē → CI2 ↑ 2 ǀ 1
В катодном пространстве накапливаются Ni (ОН)2
Таким образом, при электролизе раствора NiCI2 получаем продукты реакции:
электролиз
2NiCI2 + 4H2O → Ni0 + Ni(ОН)2 + 2CI2 ↑ + H20↑
Третья группа металлов от водорода:
Пример:
Электролиз раствора нитрата ртути (II) Hg(NO3)2
Hg (NO3)2 ↔ Hg2+ + 2 NO3— H2O ↔ Н+ + ОН—
Катионы ртути Hg2+ расположены в ряду стандартных электродных потенциалов после водорода, следовательно, они полностью восстанавливаются на катоде, а на аноде разряжаются ионы ОН— воды.
катод «-» Hg2+ + 2ē → Hg0
анод «+» 2H2O — 4ē → O2 ↑ + 4Н+; Н+ + NO3— ↔ НNO3
электролиз
Hg (NO3)2 + 2H2O → Hg0 + O2 ↑ + 2НNO3
Все рассмотренные случаи электролиза относятся к нерастворимому аноду, который изготавливается из угля, графита, платины, иридия.
Если анод будет растворим (Cu Ag Zn Cd Hg Ni и др.) при электролизе водного раствора окисляется анод. Например: при электролизе водный раствор CuCI2 анод будет медным, то хлорид — ионы не окисляются (растворяется анод):
CuCI2 ↔ Cu2+ + 2CI— H2O ↔ Н+ + ОН—
катод «-» Cu2+ + 2ē → Cu0
анод «+» Cu0 — 2ē → Cu2+
Здесь происходит переход меди с анода на катод. Количество хлорида меди в растворе остается неизменным.
Электролиз с растворимым анодом широко применяется для получения металлов высокой чистоты.
Применение электролиза
Электролиз применяется при получении активных металлов (K Na Ca Mg AI), некоторых активных неметаллов (CI2 F2), а также сложных веществ (NaOH KOH KCIO3). Электролизом пользуются для покрытия металлических предметов никелем, хромом, цинком, оловом, золотом и т.д.
Продукты электролиза водных растворов электролитов
Щелочи, кислородсодержащие кислоты, соли кислородсодержащих кислот и активных металлов(K Na Ca)
H20↑ и O2 ↑ так как разлагается только вода
Бескислородные кислоты и их соли бескислородных кислот и активных металлов
(K Na Ca)
H20↑ S галогены и др.
Соли бескислородных кислот и малоактивных металлов (Cu Hg Ag Pt Au), а также металлов со средней активностью (Co Ni Cr Sn)
Металлы и галогены, а при большей концентрации ионов Н+ может выделяться H20↑
Соли кислородсодержащих кислот и малоактивных металлов (Cu Hg Ag Pt Au), а также металлов со средней активностью
(Co Ni Cr Sn)
Металл и O2 ↑, а при большей концентрации
ионов Н+ может выделяться H20↑
1. Защита металлических изделий от коррозии электролизом получила название гальваностегией. Защищая от коррозии, гальванические покрытия придают предметам красивый декоративный вид.
2. Другая отрасль электрохимии названа гальванопластикой — это получение точных металлических копий с различных предметов. Эта отрасль открыта русским ученым Б.С. Якоби (1838).
3. Получение химически активных металлов: щелочных, щелочноземельных, алюминия, лантаноидов и др., а также для очистки некоторых металлов от примесей.
Самостоятельная работа №1
Вопросы:
1) В чем отличие электролиза расплава от электролиза раствора?
2) Почему в первую очередь на аноде разряжаются бескислородные ионы кислот, а не кислородсодержащие?
3) Какие металлы в первую очередь разряжаются на катоде, стоящие в ряду напряжения металлов, до водорода или после?
4) Какие катионы металлов никогда не разряжаются в растворе?
5) Где применяется электролиз?
Выполните задания:
1) Составьте схемы электролиза водных растворов:
а) сульфата меди (II) б) хлорида магния в) нитрата калия г) серной кислоты д) гидроксида натрия
2) Составьте схемы расплавов: а) гидроксида калия б) хлорида натрия
Самостоятельная работа №2 (расчетные задачи)
1. При электролизе раствора хлорида меди (II) масса катода увеличилась на 8 г.
Какой газ выделился, рассчитайте его массу и объём (н.у.)?
2. При электролизе водного раствора нитрата серебра (I) выделилось 5, 6 л газа.
Сколько граммов металла отложилось на катоде?
3. При электролизе водного раствора хлорида калия образовалось 112 кг гидроксида калия.
Какие газы выделились и каков их объём (н.у.)?
4* Определите объём хлора (н.у.), который выделится на аноде при полном электролизе 200 г 10% раствора хлорида калия.
5* При электролизе раствора нитрата свинца (II) на аноде выделилось 11, 2 л газа.
Сколько свинца получилось за это время, если его выход составляет 80%?
Электролиз расплавов и растворов » HimEge.ru
Электролиз – это окислительно — восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Электролиз – дословно: «лизис» – разложение, «электро» – электрическим током.
1) Катод К(-), к нему перемещаются катионы, катод отдаёт электроны катионам, катионы разряжаются, идёт процесс восстановления.
2) Анод А(+), к нему перемещаются анионы, анионы отдают электроны аноду и разряжаются, идёт процесс окисления.
3) Электролиз растворов отличается от электролиза расплавов тем, что процессы протекают сложнее из-за непосредственного участия воды.
Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
При проведении электролиза растворов с использованием инертного (не расходуемого) анода (например, графита или платины), на электродах могут протекать конкурирующие процессы:
на аноде — окисление анионов и гидроксид-ионов,
на катоде — восстановление катионов и ионов водорода.
При выборе наиболее вероятного процесса на аноде и катоде исходят из положения, что протекает та реакция, которая требует наименьшей затраты энергии. На катоде преимущественно происходит восстановление тех катионов, которые обладают наибольшей окислительной активностью. На аноде в первую очередь будут окисляться анионы, обладающие наибольшей восстановительной активностью.
Электролиз — Знаешь как
Электролизом называется химический процесс, происходящий при пропускании электрического тока через раствор электролита или через расплавленный электролит. При прохождении электрического тона через раствор электролита находящиеся в растворе положительные ионы направляются к катоду, а отрицательные — к аноду и здесь разряжаются. Образовавшиеся нейтральные атомы и группы атомов или выделяются из раствора, или вступают во взаимодействие между собой, образуя так называемые вторичные продукты электролиза.
Электролиз что это
При рассмотрении механизма электролиза нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются еще ионы Н• и ОН’ из воды. Эти ионы перемещаются в электрическом поле так же, как и ионы электролита: водородные ионы — к катоду, а гидроксильные — к аноду. Таким образом, у катода одновременно могут разрядиться два иона: положительный ион электролита (обычно ион металла) и ион водорода из воды.
Какой из них разрядится, — это прежде всего зависит от их относительного положения в ряду напряжений, а также от концентрации ионов и в некоторых случаях от материала электрода, у которого происходит разряд. В общем, чем легче металл отдает свои электроны, чем больше его отрицательный потенциал (по абсолютной величине), тем труднее разряжаются его ионы. Отсюда следует, что при прочих равных условиях легче всего должны разряжаться ионы золота и ионы других малоактивных металлов, труднее всего ионы металлов, стоящих в начале ряда напряжений. Так как ион любого металла, стоящего справа от водорода, легче разрядить, чем ион водорода, то при электролизе солей меди, ртути и др. на катоде выделяются соответствующие металлы.
Ионы металлов, стоящих в ряду напряжений слева от водорода, разряжаются труднее, чем ионы водорода, и тем труднее, чем они дальше отстоят от него. Поэтому при электролизе солей наиболеe aктивных металлов: натрия, калия и кальция, а также магния и алюминия, когда разница между электродными потенциалами металла и водорода очень велика, разряжаются почти исключительно ионы водорода и у катода выделяется газообразный водород. По мере разряда водородных ионов диссоциируют все новые и новые количества молекул воды, вследствие чего у катода накапливаются гидроксильные ионы и раствор становится щелочным.
Иная картина получается при электролизе солей менее активных металлов, стоящих левее водорода, как, например, цинка, железа, никеля и др. Хотя теоретически и здесь должны были бы в первую очередь разряжаться водородные ионы, однако практически у катода происходит выделение металлов. Это кажущееся противоречие объясняется ничтожной концентрацией ионов водорода (сравнительно с концентрацией ионов металла) и особым влиянием вещества электродов, сильно затрудняющим разряд водородных ионов .
Посмотрим теперь, что происходит у анода. К аноду передвигаются отрицательные ионы электролита и гидроксильные ионы воды. Если отрицательные ионы не содержат кислорода, как, например, ионы Cl’, Br’, S», то разряжаются именно эти ионы, а не гидроксильные, которые теряют свой заряд значительно труднее, и у анода происходит выделение хлора, брома, серы. Если же отрицательные ионы содержат кислород (ионы SO4«, NO3‘ и др.), то на аноде выделяется газообразный кислород. В этих случаях, повидимому, гидроксильные ионы воды разряжаются легче, чем ионы кислотных остатков.
При разряде гидроксильных ионов образуются электронейтральные группы ОН, которые не могут существовать в свободном состоянии и сейчас же превращаются в молекулы воды и кислорода:
4OН’ — 4е = 2Н2O + O2
Таким образом, причиной выделения кислорода является разряд гидроксильных ионов. По мере разряда последних диссоциируют новые молекулы воды и у анода происходит накопление водородных ионов.
Рассмотрим несколько типичных случаев электролиза.
1. Электролиз р а с т в о р а СuCl2. Раствор содержит ионы Сu•• и Cl’ и незначительное количество Н• и ОН’ ионов из
воды. При пропускании тока ионы меди перемещаются к катоду, а ионы хлора — к аноду. Принимая от катода по два электрона, ионы Сu•• превращаются в нейтральные атомы, выделяющиеся из раствора. Катод постепенно покрывается медью. В то же время ионы Cl’, достигая анода, отдают ему электроны и превращаются в атомы хлора, которые, соединяясь попарно, образуют молекулы Сl2. У анода выделяется хлор.
Схема электролиза раствора CuCl2

У катода происходит процесс восстановления, у анода — процесс окисления.
2. Электролиз раствора K2SO4. Раствор содержит ионы К• и SO4», а также водородные и гидроксильные ионы воды. Так как ионы калия разряжаются труднее, чем ионы водорода, а ионы SO4» труднее, чем ионы ОН’, то при пропускании тока у катода разряжаются ионы водорода и выделяется водород, а у анода — ионы гидроксила и выделяется кислород.
Схема электролиза раствора K2SO4

Таким образом, при электролизе раствора K2SO4 не разряжается ни один из ионов растворенного электролита, а происходит лишь разложение воды. В то же время, вследствие разряда водородных и гидроксильных ионов воды и непрерывного перемещения ионов К• к катоду, а ионов SO4« к аноду, у катода образуется раствор щелочи (КОН), а у анода раствор кислоты (H2SO4).
Для разложения электролита нужна некоторая определенная минимальная величина напряжения, называемая потенциалом разложения данного электролита. Так, например, если опустить в раствор хлорной меди CuCI2два платиновых электрода и приложить к ним разность потенциалов 0,8 вольта, то вначале ток проходит через раствор, но затем быстро ослабевает и, наконец, совсем прекращается. Причиной прекращения тока является накопление на одном электроде меди, а на другом хлора (адсорбированного платиной), вследствие чего возникает новый элемент, состоящий из меди и хлора в растворе их ионов и дающий ток обратного направления. Указанное явление носит Название поляризации электродов, а электродвижущая сила образовавшегося таким образом элемента называется электродвижущей силой поляризации. Величина ее для молярного раствора СuСl2 легко находится по таблице нормальных потенциалов путем вычитания из потенциала хлора потенциала меди; 1,36 — 0,34 = 1,02 вольта.
Понятно, что для поддержания электролиза нужно приложить извне к электродам разность потенциалов не меньшую, а даже несколько большую, чем 1,02 вольта, чтобы преодолеть электродвижущую силу поляризации. Эта величина и является потенциалом разложения электролита. Из предыдущего видно, что для ее нахождения нужно из потенциала вещества, выделяющегося у анода, вычесть потенциал вещества, выделяющегося у катода. Таким образом, потенциал разложения СuСl2 в молярном растворе равняется 1,02 вольта, потенциал разложения ZnCl2 при тех же условиях будет равняться 1,36— (—0,763) = 2,123 вольта и т. д. Потенциалы разложения кислородных кислот и щелочей в нормальных растворах почти одинаковы (около 1,67 вольта), так как во всех случаях разряжаются одни и те же ионы.
Если в растворе одновременно присутствуют различные катионы и анионы, то электролиз наступает тогда, когда напряжение будет достаточно велико, чтобы разрядить один из имеющихся видов катионов и анионов. Поэтому электролизом часто пользуются при анализе для отделения одного металла от другого. Например, из раствора, содержащего СuСl2 и ZnCl2, при напряжении, допустим, 1,2 вольта будет выделяться только медь, но не цинк, так как потенциал разложения ZnCl2 значительно выше 1,2 вольта.
В приведенных выше примерах электролиза предполагалось, что электроды сделаны из инертного материала, например из угля. При употреблении таких электродов ионы разряжаются как у катода, так и у анода. Иначе протекает процесс, если анод состоит из какого-нибудь металла. В этом случае разряд ионов происходит только у катода; у анода же, наоборот, ионы металла переходят в раствор.
Так, например, если подвергать электролизу раствор сернокислого никеля NiSО4, взяв в качестве анода пластинку металлического никеля, то на катоде, как обычно, выделяется никель, у анода же гидроксильные ионы не разряжаются и никакого выделения кислорода не происходит, но зато никель постепенно растворяется. Растворение никеля можно объяснить присущей всякому металлу способностью посылать в раствор свои ионы. При обычных условиях, когда металл погружен в воду (или в раствор), переход его ионов в раствор быстро, прекращается вследствие появления, на металле отрицательного заряда. В данном же случае благодаря работе источника тока свободные электроны непрерывно «откачиваются» из никелевой пластинки, поэтому ничто не препятствует переходу все новых и новых ионов никеля в раствор.
Схема электролиза раствора NiSO4 (при никелевом аноде)

Следовательно, электролиз никелевой соли при никелевом аноде сводится к выделению никеля на катоде и постепенному растворению анода. В то же время количество никелевой соли в растворе остается неизменным.
Применение растворимых анодов широко используется для покрытия одних металлов другими гальваническим путем. Тот предмет, который хотят покрыть каким-нибудь металлом, например серебром, погружают в раствор серебряной соли, где он служит катодом. В качестве анода берут кусок металлического серебра. Затем пропускают ток до тех пор, пока на поверхности предмета не отложится слой серебра достаточной толщины.
На растворении анодов основаны также электролитические способы очистки некоторых металлов .
Одним из важных технических применений электролиза является гальванопластика — способ получения точных металлических копий с рельефных, предметов путем осаждения на их поверхности электролитическим путем более или менее толстого слоя металла. Этот способ был открыт русским академиком Б. С. Якоби (1801 —1874) в 30-х годах прошлого столетия. «Гальванопластика принадлежит исключительно России, — писал о своем открытии Якоби, — здесь она получила свое начало и образование». Первым практически важным применением гальванопластики в России было изготовление точных клише для печатания различных государственных бумаг, в том числе денежных знаков.
Электролизу можно подвергать не только водные растворы электролитов, но и многие вещества в расплавленном состоянии. Плавление, так же как и растворение, разрушая кристаллическую решетку вещества, делает подвижными ионы, которые до этого были связаны в твердом кристалле, и дает им возможность перемещаться в электрическом поле. Электролизом расплавленной окиси алюминия получают один из важнейших металлов современной техники — алюминий. Почти все легко окисляющиеся металлы, как натрий, калий, кальций и др., тоже получаются путем электролиза их расплавленных солей или оснований.
201 202 203
Вы читаете, статья на тему Электролиз



