Вычисляем КПД электролизеров и генераторов водорода
В связи с большим практическим прорывом в этой области и появлением множества работающих устройств по расщеплению воды с коэффициентом полезного действия больше единицы, (КПД>100%) мы решили прояснить некоторые моменты для сомневающихся и просто для тех, кто решил заняться практикой и начал сборку подобных устройств.
Начнем с того, что все расчеты и цифры приведены для нормальных условий, то есть для среднего давления и комнатной температуры. Мы не будем утомлять Вас сложными формулами, а приведем лишь полезные цифры и информацию, которые помогут на практике.
При расщеплении воды может вырабатываться как отдельно кислород и водород, так и их смесь, называемая газом Брауна или гремучим газом (в народе и на СЕ слэнге «гремучка»). В любом случае топливом является только водород и именно его нужно считать и учитывать.
Основным параметром любого топлива, в том числе и водорода, является его теплотворная способность или удельная теплота сгорания топлива, которые показывают сколько джоулей тепловой энергии будет выделено при сгорании определенного веса или объема вещества. Так как водород — это газ, то нам для расчетов будет удобнее использовать количество Джоулей, выделяемых при сжигании одного литра водорода. То есть Дж/л. Из справочников мы возьмем минимальное усредненное значение, которое равно 10 800 кДж/м3, что в нашем случае составляет 10800 Дж/л. Теперь нам придется вспомнить, каким образом эти цифры можно сопоставить с привычными нам при расчете энергии. За основу давайте возьмем электричество и соответственно его единицы измерения киловатт часы. Тут все просто, 1 ватт мощности это один Джоуль выделяемый за секунду. Отсюда мы без труда выводим следующие цифры, которые пригодятся всем практикам в дальнейшем
— 1 киловатт час электроэнергии это 1 Джоуль * 1000 * 3600 = 3,6 Мега Джоуля или 3,6МДж.
— 1 литр водорода при сжигании выделяет в пересчете на электроэнергию 0,003кВт*часа = 3Ватт часа энергии.
— При КПД приблизительно равном 100%, установка потребляющая мощность 1кВт должна вырабатывать 333,(3) литра водорода в час.
— При КПД приблизительно равном 100% установка потребляющая мощность 1кВт, должна вырабатывать 5,(5) литра водорода в минуту.
Дальше все просто! Имея эти цифры мы без труда можем рассчитать КПД любой установки.
Возьмем для примера классические, продаваемые ныне водородные сварки, которые при потреблении 1,8кВт часа электроэнергии, вырабатывают около 6 литров водорода в минуту. Отсюда следует, что работают они с КПД приблизительно равным 60%. Считается это так: мы знаем, что однокиловаттная установка вырабатывает 5,(5) литра водорода в минуту, а у нас потребление 1,8кВт, значит нам нужно 5,(5) умножить на 1.8, получаем 10. То есть мы выяснили, что для работы со стопроцентным КПД данная установка должна вырабатывать 10 литров водорода, а нам известно со слов производителя, что вырабатывает она максимум 6, значит нам остается только 6 разделить на 10 и умножить на 100%, отсюда и получена цифра в 60%.
С водородом мы разобрались и по-моему тут все просто, теперь давайте сделаем то же самое для газа Брауна или «гремучки». Так как газ Брауна содержит в себе две части водорода и одну часть кислорода, а топливом является только водород, то все наши полученные выше цифры необходимо умножить приблизительно на две третьих (2/3). Отсюда мы получаем:
— 1 литр газа Брауна при сжигании выделяет в пересчете на электроэнергию 0,002кВт*часа = 2Ватт часа энергии.
— При КПД приблизительно равном 100%, установка потребляющая мощность в 1кВт должна вырабатывать 500 литров газа Брауна в час.
— При КПД приблизительно равном 100% установка потребляющая мощность в 1кВт, должна вырабатывать 8,(3) литра газа Брауна в минуту.
Вот и все основные цифры, которые могут понадобиться для приблизительной теоретической оценки вырабатываемого электролизерами газа и его эффективности. Следует также еще раз особо отметить, что цифры даны минимальные и относятся они только к сугубо теоретическим аспектам, которые далеко не всегда подтверждаются на практике. . К ним смело можно прибавить 10%.
Рассмотрим один из недавних примеров, достоверность которого нам известна доподлинно, равно как и все приведенные ниже цифры.
Мы уже публиковали по нему несколько статей и видео, а по последним опытам можем только лишь добавить, что в настоящий момент прототип генератора при потребление от сети тока в девять ампер, вырабатывает в минуту 24 литра газа Брауна. По расчетам получается следующее:
9*220=1,98кВт, таким образом получается, что при 100% КПД выработка газа должна быть 1,98*8,3=16 литров в минуту, а при реальных 24-х литрах установка по всем теоретическим расчетам работает с КПД превышающим 150%, что само по себе не может не радовать. Но все дело в том, что на практике этот КПД еще в несколько раз выше. Рассмотрим еще один вполне конкретный пример.
Были проведены опыты с обычным четырехкиловаттным бензиновым генератором, который был переделан на газ Брауна и был запущен в режиме самозапитки.
На практике были получены следующие основные цифры: на собственную работу, то есть на выработку четырех киловатт энергии генератор тратил только два киловатта вырабатываемой мощности, отдавая оставшиеся два киловатта в полезную нагрузку. При этом электролизер был менее эффективной модели, который от двух киловатт вырабатывал не более 18 литров водорода в минуту и даже меньше, но при этом двигатель все равно устойчиво работал, отдавая в нагрузку два киловатта полезной мощности. Если вспомнить, что КПД классического двигателя внутреннего сгорания не превышает 30%, то есть всего 30% из подаваемого газа идет на генерацию электроэнергии, то получаются совершенно другие цифры.
На практике получается, что даже этот, далеко не самый эффективный на данный момент электролизер, работает с КПД превышающим 600%!
На вопрос «откуда дровишки», то есть откуда же берется этот самый прирост энергии, мы ответить пока не можем и оставляем его физикам-теоретикам. Мы можем лишь еще раз подтвердить, что все описанное выше имеет место быть в том виде, в котором мы и описали и каждый желающий сможет в этом убедиться. Добавим лишь, что мы не посягаем на правильность первого и второго начала термодинамики и на закон сохранения энергии, находя их вполне адекватными и рабочими, что в нашем случае подразумевает только лишь наличие и использование в данной установке дополнительно какого-либо другого вида энергии, который тем не менее пока не вписывается в рамки классической теоретической физики.
На правах рекламы, продолжаем знакомить Вас с интересными сайтами.
На этом сайте продается Тренинг уверенности в себе со скидкой. К сожалению мы сами не проходили данный курс, по этому ничего о нем сказать не можем, но выглядит красиво.
Электричество в газ с КПД 85%.: engineering_ru — LiveJournal
14/04/2014: На прошлой неделе, ЕС начал проект «Helmeth» (Integrated High-Temperature Electrolysis and Methanation for Effective Power to Gas Conversion), в котором несколько партнеров которых координирует Технологический институт Карлсруэ (KIT). Прект нацелен на повышение эффективности двухэтапного процесса получения метана электролизом. При бюджете в 3,8 млн. евро проект фокусируется на изучении способов использовать тепло (получаемое как побочный продукт) для электролиза (высоклтемпературный электролиз до 800 градусов по Цельсию) в получении метана из водорода. Цель состоит в том, чтобы построить демонстрационную установку с КПД 85 КПД. © ФОТОН
Технологии аккумулирования эл.энергии существуют давно. И потребность в них будет очень скоро. В настоящий момент идут исследования в этой области. Существует несколько вариантов:
1) наливные водохранилища (расходы 4-11 центов / кВт*ч)
2) сжатый воздух и водород (> 25 центов / кВт*ч)
3) Можно хранить водород в газовой сети (электролиз, хранение согласно DVGW до 5% в газовой системе; проблемы: точность измерения, коррозия)
4) «Электро-газ» технологии: высокие капитальные вложения, КПД: гидролиз.30%, 44% метанирования;
Прогноз: гидролиза 54-77%, 49-65% метанирование.
таком образом: электро-газ-электро оценка КПД в будущем: общую эффективность 40%.
(источник)
Систему электро-газ можно видеть на картинке:

(при помощи электролиза получаем водород, кислород и тепло. Кислород и тепло идут в продажу. Водород и собранный из воздуха CO2 образуют в каталической реакции метан. Метан поступает в газорастпределительную систему Германии. Общий КПД 60%. КПД электролиза от 75 %.)
Сегодня Германия, благодаря резервуарам, может запасаться газом более чем на 200 ТВт*ч. С точки зрения затрат, наилучшим вариантом было бы использовать систему аккумулирования энергии как можно реже. Но это невозможно. В условиях Германии нет смысла говорить о гидроаккумуляторующих электростанций: ее доля и так мала, но даже повышение этой доли слишком амбициозная задача и почти невозможная географически.
Онлайн калькуляторы водорода, газа Брауна и КПД электролизера
Warning: mysqli_num_fields() expects parameter 1 to be mysqli_result, boolean given in /home/users/m/moderator/domains/zaryad.com/wp-includes/wp-db.php on line 3182
Warning: mysqli_num_fields() expects parameter 1 to be mysqli_result, boolean given in /home/users/m/moderator/domains/zaryad.com/wp-includes/wp-db.php on line 3182
Несколько дней назад мы уже публиковали статью «Вычисляем КПД электролизеров и генераторов водорода», в которой постарались доступным и простым языком изложить принцип расчета КПД электролизеров и генераторов водорода и газа Брауна. Также в вышеупомянутой статье нами были приведены и основные цифры, которые можно использовать для практических расчетов своих генераторов. Но так как тема создания собственных генераторов водорода и электролизеров слишком активно набирает обороты, мы решили еще на порядок упростить задачи по их расчетам и сделали несколько онлайн калькуляторов, которые помогут Вам быстро и удобно получить необходимые цифры и значения.
В данном выпуске:
1. Онлайн калькулятор для расчета КПД электролизеров, а также генераторов водорода и газа Брауна.
2. Онлайн калькулятор для расчета вырабатываемой тепловой мощности.
1. Онлайн калькулятор для расчета КПД электролизеров, а также генераторов водорода и газа Брауна
Данный калькулятор, как и следует из его названия, поможет Вам определить коэффициент полезного действия (КПД) Вашего электролизера, генератора водорода или генератора газа Брауна. Для того, чтобы воспользоваться калькулятором Вы должны выяснить, какую среднюю мощность потребляет Ваш генератор или электролизер в ваттах (возможно указание мощности также в киловаттах и милливаттах). Еще Вам потребуется выяснить или измерить, сколько же реально газа вырабатывает устройство за период времени. Проще всего измерить количество вырабатываемого газа при помощи бутылки и секундомера. Также Вы должны указать и состав Вашего газа, который обычно подразделяется на две основные группы:
— Чистый водород (H)
— Газ Брауна (HHO), также называемый гремучим газом (или же в народе «гремучка»), который содержит в себе смесь водорода и кислорода в пропорции три к одному.
В качестве результата Вы получите реальный КПД генератора, рассчитанный по представлениям современной теоретической физики. Калькулятор выдаст усредненное, минимальное значение. На практике полученный результат может быть значительно превышен.
В качестве разделителя целой и дробной части Вы можете использовать как знак запятой, принятый в качестве официального знака разделителя в России, так и точку, которая применяется в качестве разделителя во многих других странах.
Формула пуста
2. Онлайн калькулятор для расчета вырабатываемой тепловой мощности.
Данный онлайн калькулятор предназначен для вычисления тепловой мощности Вашего электролизера, генератора водорода или газа Брауна. Данные значения часто необходимо знать для того, чтобы рассчитать отопительный котел на водороде для дома, водородную газовую сварку или газовую резку. Задав в калькулятор значение вырабатываемого газа за определенный промежуток времени, Вы получите на выходе тепловую мощность Вашего котла или горелки.
В качестве разделителя целой и дробной части Вы можете использовать как знак запятой, принятый в качестве официального знака разделителя в России, так и точку, которая применяется в качестве разделителя во многих других странах.
Формула пуста
Электролиз воды в промышленных генераторах водорода
ЭЛЕКТРОЛИЗ
это окислительно-восстановительная реакция, которая протекает только под действием электричества. В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:- Анод — электрод к которому подключен положительный проводник;
- Катод — электрод к которому подключен отрицательный проводник.

ЭЛЕКТРОЛИЗ ВОДЫ
Под действием электрического тока вода разделяется на составляющие ее молекулы: водород и кислород. Отрицательно заряженный катод притягивает катионы водорода а положительно заряженный анод — анионы ОН—.Деминерализованная вода, используемая в промышленных электролизных установках сама по себе является слабым электролитом, поэтому в нее добавляют сильные электролиты для увеличения проводимости электрического тока. Зачастую выбирают электролиты с меньшим катионным потенциалом, чтобы исключить конкуренцию с катионами водорода : KOH или NaOH. Электрохимическая реакция протекающая на электродах выглядит следующим образом:
- Реакция на аноде: 2H2O → O2 + 4H+ + 4e− — выделение кислорода;
- Реакция на катоде: 2H2O + 2e− → H2 + 2OH− — выделение водорода.
Далее, чтобы получить чистый водород и кислород, требуется разделить газы образующиеся на электродах, и для этого применяют разделительные ионно-обменные мембраны (см. рисунок). Количество получаемого водорода в два раза больше получаемого кислорода и поэтому давление в водородной полости поднимается в два раза быстрее. Для уравнивания давления в полостях применяют уравнивающую давление мембрану на выходе из электролизера, которая предотвращает передавливание водорода в полость кислорода через каналы предназначенные для циркуляции электролита.
Данный метод является наиболее применяемым методом в промышленности и позволяет получать газообразный водород с КПД от 50 до 70% производительностью до 500 м3/час при удельных энергозатратах 4,5-5,5 Н2м3/кВт-ч.
ЭЛЕКТРОЛИЗ НА ТПЭ
В настоящий момент к наиболее эффективным методом разделения можно отнести электролиз с применением твердо-полимерных электролитов на основе перфторированной ионно обменной мембраны.
Данный тип электролизеров позволяет получать водород с КПД до 90% и является наиболее экологичным. Электролизеры с ТПЭ дороже щелочных в 6-7 раз и поэтому пока не получили свое распространение в промышленности.
Электролиз воды — Electrolysis of water
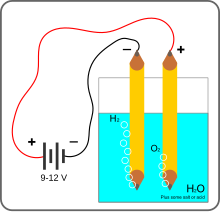 Простая установка для демонстрации электролиза воды в домашних условиях
Простая установка для демонстрации электролиза воды в домашних условиях 
Электролиз воды является разложение воды в кислород и водород газа из — за прохождения электрического тока . Реакция имеет стандартный потенциал -1.23 V, то есть его в идеале требует разность потенциалов 1,23 вольт для расщепления воды.
Этот метод может быть использован для газообразного водорода и кислорода для дыхания. Поскольку водород является важным промышленным товаром, на сегодняшний день большинства промышленных способов получения водорода из природного газа , вместо того, чтобы , в паровом риформинге процесса.
история
Ян Рудольф Deiman и Адриан ван Paets Troostwijk используются, в 1789 году, электростатический машин для производства электричества , который был выписан на золотые электродов в лейденских банках с водой. В 1800 году Алессандро Вольта изобрел гальваническую груду , и через несколько недель Уильям Николсон и Энтони Carlisle использовали его для электролиза воды. Когда Зеноб Теофил Грамм изобрел машину Грамма в 1869 г. электролиза воды стал дешевым способом для производства водорода. Способ промышленного синтеза водорода и кислорода посредством электролиза был разработан Дмитрием Лачинами в 1888 году.
Принцип
Источник электропитания постоянного тока подключен к двум электродам или два пластин ( как правило , изготовленных из металла , какого — либо инертного , такие как платина , нержавеющая сталь или иридий ) , которые помещены в воде. Водород будет появляться на катоде (где электроны входят в воду), и кислород будет появляться на аноде . Предполагая , что идеальную фарадеевскую эффективность , то количество водорода генерируется в два раза превышаю количество кислорода, и оба они пропорциональны к общему электрическому заряду , проведенному раствором. Тем не менее, во многих клетках конкурирующих побочные реакции происходят, что приводит к различным продуктам и меньше , чем идеальная фарадеевская эффективность.
Электролиз из чистой воды требует избыточной энергии в форме перенапряжения , чтобы преодолеть различные барьеры активации. Без лишней энергии электролиз чистой воды происходит очень медленно или вовсе нет. Это отчасти из — за ограниченную самостоятельную ионизацию воды . Чистая вода имеет электропроводность около одной миллионной в морской воде. Многие электролизеры могут также отсутствие необходимых электрокатализаторов . Эффективность электролиза увеличивается за счет добавления электролита (например, соли , с кислотой или основанием ) и использование электрокатализаторах .
В настоящее время электролитический процесс редко используется в промышленных применениях , так как водород , в настоящее время может быть получен более приемлемым из ископаемого топлива .
уравнения
В чистой воде при отрицательно заряженный катод, уменьшение реакция происходит, с электронами (е — ) с катода отдается катионы водорода с образованием газообразного водорода. Полуреакции , сбалансирован с кислотой, является:
- Снижение на катоде: 2 Н + ( водн ) + 2е — → H 2 ( г )
В положительно заряженного анода, окисление происходит реакция, генерации газообразного кислорода и давая электроны к аноду , чтобы замкнуть цепь:
- Окисление на аноде: 2 Н 2 О ( л ) → O 2 ( г ) + 4 Н + ( водно ) + ом —
Та же полуреакция также может быть сбалансирована с основанием, как указано ниже. Не все полуреакции должны быть сбалансированы с кислотой или основанием. Многие из них, как окисление или восстановление воды, перечисленных здесь. Чтобы добавить половину реакции они оба должны быть сбалансированы с любой кислотой или основанием. Кислотно-сбалансирован реакции преобладают в кислых растворах (низкий рН), в то время как базовые балансировкой реакции преобладают в основных растворах (с высоким рН).
| Катод (сокращение): | 2 Н 2 О ( л ) + 2е — | → | Н 2 ( г ) + 2 ОН — ( водн ) |
| Анод (окисление): | 2 ОН — ( водно ) | → | 1/2 O 2 ( г ) + Н 2 О ( л ) + 2 е — |
Сочетание либо полуреакция дает то же общее разложение воды на кислород и водород:
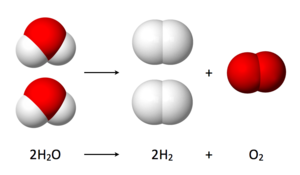
- Общая реакция: 2 Н 2 О ( л ) → 2 Н 2 ( г ) + O 2 ( г )
Число молекул водорода, полученного таким образом, в два раза превышает число молекул кислорода. Предполагая, равную температуру и давление для обоих газов, полученный газ водород имеет, следовательно, в два раза объем производимого газообразного кислорода. Число электронов проталкивается через воду в два раза превышает число генерируемых молекул водорода и в четыре раза числа генерируемых молекул кислорода.
Термодинамика
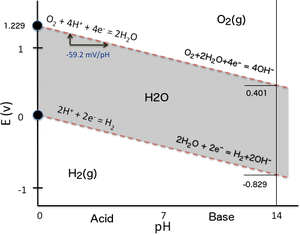 Диаграмма Пурб для воды, в том числе равновесных областей для воды, кислорода и водорода при STP. Вертикальная шкала является электродный потенциал водорода или невзаимодействующих электрода по отношению к SHE электрода, горизонтальный масштаб является рН электролита ( в противном случае невзаимодействующих). Игнорирование перенапряжения , выше верхней линии равновесие условия является газообразным кислородом, и кислорода пузыря от электрода до тех пор , пока не достигается равновесие. Кроме того, ниже нижней линии, равновесное состояние газообразный водород, и водород будет пузыриться от электрода до тех пор , пока не достигается равновесие.
Диаграмма Пурб для воды, в том числе равновесных областей для воды, кислорода и водорода при STP. Вертикальная шкала является электродный потенциал водорода или невзаимодействующих электрода по отношению к SHE электрода, горизонтальный масштаб является рН электролита ( в противном случае невзаимодействующих). Игнорирование перенапряжения , выше верхней линии равновесие условия является газообразным кислородом, и кислорода пузыря от электрода до тех пор , пока не достигается равновесие. Кроме того, ниже нижней линии, равновесное состояние газообразный водород, и водород будет пузыриться от электрода до тех пор , пока не достигается равновесие.Разложение чистой воды на водород и кислород при нормальной температуре и давлении не является благоприятным в термодинамических условиях.
| Анод (окисление): | 2 Н 2 О ( л ) | → | O 2 ( г ) + 4 Н + ( водн ) + 4e — | Е о = 1,23 В (для восстановления полуоси уравнения) | |
| Катод (сокращение): | 2 Н + ( водно ) + 2е — | → | Н 2 ( г ) | Е о = 0,00 В |
Таким образом, стандартный потенциал воды электролизера (E ø ячейки = Е о катоде — Е о аноде ) составляет -1,23 В при 25 ° С при рНе 0 ([H + ] = 1,0 М). При температуре 25 ° С с рН 7 ([H + ] = 1,0 × 10 -7 М), потенциал не изменяется на основе уравнения Нернста . Термодинамический стандартный потенциал клетки может быть получен из стандартного состояния свободных расчетов энергии , чтобы найти ΔG ° , а затем , используя уравнение: ΔG ° = -nFE ° (где Е ° является потенциал клетки). На практике , когда электрохимическая ячейка «ведомая» к завершению, применяя разумный потенциал, она кинетический контролируются. Таким образом, энергия активации, подвижности ионов (диффузия) и концентрация, сопротивление проволоки, поверхность помеха , включая образование пузырьков (вызывает площадь электрода закупорку), и энтропию, требует более приложенного потенциала , чтобы преодолеть эти факторы. Сумма увеличения потенциала , необходимого называется перенапряжением .
выбор Электролит

Если описанные выше процессы происходят в чистой воде, H + катионы будут потребляться / уменьшены на катоде и ОН — анионы будут потребляться / окисляются на аноде. Это может быть проверено путем добавления индикатора рН в воде: вода вблизи катода является основным , а вода вблизи анода является кислой. Эти отрицательные ионы гидроксида , которые приближаются к аноду в основном , в сочетании с положительными ионами гидроксония (H 3 O + ) с образованием воды. Положительные ионы гидроксония , которые приближаются к катоду в основном в сочетании с отрицательными ионами гидроксида с образованием воды. Относительно небольшое количество ионов гидроксония / гидроксид достигают катода / анода. Это может привести к концентрации перенапряжения на обоих электродах.
Чистая вода является достаточно хорошим диэлектриком , так как он имеет низкую автоионизацию , К ш = 1,0 × 10 -14 при комнатной температуре и , таким образом , чистая вода проводит ток плохо, 0,055 мкСм · см -1 . Если очень большой потенциал не применяется , чтобы вызвать увеличение автоионизацией воды электролиз чистой воды протекает очень медленно ограничена общей проводимости.
Если растворимый в воде электролит добавляют, проводимость воды значительно повышается. Электролит диссоциирует на катионы и анионы; анионы устремитесь к аноду и нейтрализовать накопление положительно заряженного Н + там; аналогичным образом , катионы устремляются к катоду и нейтрализовать накопление отрицательно заряженный ОН — там. Это позволяет непрерывный поток электричества.
Электролит для электролиза воды
Необходимо соблюдать осторожность при выборе электролита, так как анион , из электролита находится в конкуренции с ионами гидроксидом , чтобы дать вверх по электрону . Электролита анион с менее стандартным электродным потенциалом , чем гидроксид будет окисляться вместо гидроксида, и ни один газообразный кислорода не будет производиться. Катион с большим стандартным электродным потенциалом , чем ион водорода будет уменьшен вместо этого, и ни один газообразного водорода не будет производиться.
Следующие катионы имеют более низкий электродный потенциал , чем Н + и, следовательно , пригодны для использования в качестве катионов электролита: Li + , Rb + , К + , Cs + , Ва 2+ , Sr 2+ , Са 2+ , Na + и Mg 2 + . Натрия и лития часто используются, так как они образуют недорогие, растворимые соли.
Если кислота используется в качестве электролита, катион Н + , и нет ни одного конкурента для H + , созданного отмежевывается воды. Наиболее часто используемый анион является сульфат ( SO 2-
4 ), так как это очень трудно окислить, со стандартным потенциалом для окисления этого иона к пероксидисульфату иону +2.010 вольта.
Сильные кислоты , такие как серная кислота (H 2 SO 4 ) и сильные основания , такие как гидроксид калия (KOH) и гидроксид натрия (NaOH) часто используют в качестве электролитов из — за их сильные проводящие способности.
Твердый полимерный электролит также может быть использован , такой как Nafion и при нанесении с помощью специального катализатора на каждой стороне мембраны может эффективно разделить молекулу воды с всего лишь 1,5 вольт. Есть также ряд других твердых электролитных систем , которые были опробованы и разработанной с рядом систем электролизных теперь доступен коммерчески , которые используют твердые электролиты.
Чистый электролиз воды
Электролит свободной электролиз чистой воды была достигнута с помощью глубокой суб-Дебай длины нанометрических зазоров электрохимических ячеек . Когда расстояние зазор между катодом и анодом , даже меньше , чем дебаевской длины (1 микрон в чистой воде, около 220 нм в дистиллированной воде), в двухслойных регионы из двух электродов могут перекрываться друг с другом, что приводит к равномерно высокое электрическое поле распределяется внутри весь зазор. Такое высокое электрическое поле может значительно повысить перенос ионов внутри воды ( в основном за счет миграции), дальнейшее повышение уверенности в ионизацию воды и сохранение всей реакции продолжается, и показывает малое сопротивление между двумя электродами. В этом случае две полуреакции соединены друг с другом и ограничиваются шагами переноса электронов (ток электролиза насыщенным при дальнейшем уменьшении расстояния электрода).
методы
Фундаментальная демонстрация
Два провода , идущие от клемм батареи, помещают в чашку воды с количеством электролита , чтобы установить проводимость в растворе. Используя NaCl (поваренную соль) на результатах раствора электролита в хлора газа , а не кислород из — за конкурирующую полуреакцию . С правильными электродами и правильным электролитом, такими как пищевая сода ( бикарбонат натрия ), газа водорода и кислородом будет течь из противоположно заряженных электродов . Кислород будет собирать на положительно заряженного электрода ( анода ) и водорода будут собирать на отрицательно заряженный электрод ( катода ). Следует отметить , что водород положительно заряженный в H 2 молекулы О, так что в конце концов на отрицательном электроде. (И наоборот , для кислорода) .
Следует отметить , что водный раствор воды с ионами хлорида, когда электролизу, приведет либо ОН — если концентрация Cl — низкий, или в газообразный хлор будучи преимущественно разряжается , если концентрация Cl — больше , чем 25% по массе в решение.
 Тест Match используется для обнаружения присутствия газообразного водорода
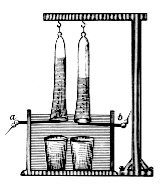
Тест Match используется для обнаружения присутствия газообразного водородаHofmann вольтаметр
Аппарат Гофман часто используются в качестве малого электролизере. Она состоит из трех соединенных вертикальных цилиндров. Внутренний цилиндр является открытым в верхней части , чтобы позволить добавление воды и электролита. Платины электрод помещаются в нижней части каждого из двух боковых цилиндров, соединенного с положительными и отрицательными выводами источника электроэнергии . Когда ток проходит через Вольтметр Hofmann, газообразные формы кислорода на аноде (положительный) и газообразного водорода на катоде (отрицательный). Каждый газ вытесняет воду и собирает в верхней части два наружных труб, где оно может быть отсасывают с запорным краном.
промышленные
Многие промышленные электролизеры очень похожи на Hofmann voltameters , со сложными платиновыми пластинами или сотнями в качестве электродов. Как правило , единственный раз , когда водород преднамеренно производится из электролиза для конкретной точки использования приложений , таких как в случае с гремучими факелами или при чрезвычайно высокая чистотой водород или кислород желательно. Подавляющее большинство водорода получают из углеводородов и в результате содержит следовые количества окиси углерода среди других примесей. Примеси окиси углерода могут быть вредными для различных систем , включая многие топливные элементы .
Высокое давление
Электролиз высокого давления является электролиз воды с помощью сжатого водорода выход около 12-20 МПа (120-200 бар , 1740-2900 фунтов на квадратный дюйм ). Путем повышения давления водорода в электролизере, необходимость внешнего компрессора водорода исключается; среднее потребление энергии для внутреннего сжатия составляет около 3%.
Высокая температура
Высокотемпературный электролиз (также HTE или пар электролиз) представляет собой метод в настоящее время исследуется для электролиза воды с тепловым двигателем . Высокая температура электролиза может быть предпочтительнее традиционной комнатной температуре электролиза , так как часть энергии поступает в виде тепла, что дешевле , чем электричество, а потому что реакция электролиза является более эффективным при более высоких температурах.
Алкалиновая вода
мембранный электролит Полимер
Никель / железо
В 2014 году исследователи объявили систему электролиза , изготовленную из недорогого, обильные драгоценных металлических катализаторов, таких как платина или иридий никель и железо , а не. Структура никель-металл / никель-оксид является более активной , чем чистый металлическим никелем или только чистый оксид никеля. Катализатор значительно снижает требуемое напряжение . Также никель-железные аккумуляторы исследуются для использования в качестве комбинированных батарей и электролиза для получения водорода. Этот «battolysers» можно заряжать и разряжать , как обычные батареи, и будет производить водород при полной зарядке.
Нанометрических зазоров гальванических элементов
В 2017 году исследователи сообщили об использовании нанометрических зазоров электрохимических элементов для достижения высокой эффективности электролита , свободного от чистого электролиза воды при комнатной температуре. В нанометрических зазорах электрохимических ячеек, два электрода настолько близко друг к другу (даже меньше , чем дебаевская длина в чистой воде) , что массовая скорость транспорта может быть даже выше , чем скорость переноса электрона, что приводит к двум полуреакциям соединены друг с другом и ограничена шагом переноса электрона. Эксперименты показывают , что плотность электрического тока от чистого электролиза воды может быть даже больше , чем от 1 моль / л раствора гидроксида натрия. Механизм, «Виртуальная Разбивка механизм», полностью отличается от устоявшейся традиционной электрохимической теории, из — за такой размером нанометрических зазоров эффекта.
Приложения
Около пяти процентов водорода газа , добываемого во всем мире создается путем электролиза. Большая часть этого водорода , полученный путем электролиза представляет собой продукт стороны в производстве хлора и каустической соды . Это яркий пример конкурирующей побочной реакции .
- 2NaCl + 2H 2 O → Cl 2 + Н 2 + 2NaOH
Электролиз солевого раствора , смесь хлорида воды / натрия, только половина электролиз воды , так как хлориды ионы окисляют до хлора , а не воды окисляется до кислорода. Термодинамически, это не было бы ожидать , поскольку потенциал окисления иона хлора меньше , чем у воды, но скорость реакции хлорида намного больше , чем у воды, в результате чего она преобладает. Водород , получаемый в результате этого процесса либо сожжен (преобразование его обратно в воду), используемый для производства специальных химических веществ или различных других мелких приложений.
Электролиз воды также используются для генерации кислорода для Международной космической станции .
Водород позже может быть использован в топливном элементе в качестве способа хранения энергии и воды.
КПД
промышленная продукция
Эффективность современных генераторов водорода измеряются с помощью энергии , потребляемой в стандартном объеме водорода (МДж / м 3 ), при условии стандартной температуры и давления в H 2 . Ниже , энергию , используемую генератором, тем выше будет его эффективность; 100% -efficient электролизер будет потреблять 39,4 киловатт-часов на килограмм (142 МДж / кг) водорода , 12,749 джоулей на литр (12,75 МДж / м 3 ). Практическая электролиз ( с помощью вращающегося электролизера при давлении 15 бар) может потреблять 50 киловатт-часов на килограмм (180 МДж / кг) и еще 15 киловатт-часов (54 МДж) , если водород сжимается для использования в водородных автомобилей.
Электролизер производители обеспечивают эффективность на основе теплосодержания . Для того, чтобы оценить эффективность заявленного электролизера важно установить , как это было определено с помощью поставщика (то есть то , что значение энтальпии, чем плотность тока, и т.д.).
Есть две основные технологии , доступные на рынке, щелочная и протонной обменной мембраной (PEM) электролизера. Щелочные электролизеры дешевле с точки зрения инвестиций (они обычно используют никелевые катализаторы), но менее эффективными; PEM электролизеры, наоборот, являются более дорогими (они обычно используют дорогие металлические катализаторы платиновой группы) , но более эффективны и могут работать при более высоких плотностях тока, и , следовательно , может быть , возможно , дешевле , если производство водорода достаточно велико.
Обычный щелочной электролиз имеет КПД около 70%. Учет принятого использования более высокой теплотворной способностью (из — за неэффективности с помощью тепла может быть перенаправлен обратно в систему , чтобы создать пар , необходимый катализатором), средние рабочие эффективности для PEM электролиза составляет около 80%. Это , как ожидается , увеличится до 82-86% от до 2030 г. Теоретический КПД для PEM электролизеров прогнозируются до 94%.
H 2 производственные затраты ($ -gge облагаемых налогом) на различных цен на природный газУчитывая промышленное производство водорода, а также с использованием текущих лучшими процессов для электролиза воды (PEM или щелочно — электролиз) , которые имеют эффективную электрическую эффективность 70-80%, производство 1 кг водорода (который имеет удельную энергию 143 МДж / кг или около 40 кВт * ч / кг) требуют 50-55 кВт — ч электроэнергии. При стоимости электроэнергии в $ 0,06 / кВт · ч, как указано в Департаменте энергетики производства водорода целях на 2015, стоимость водорода составляет $ 3 / кг. С диапазоне цен на природный газ с 2016 года , как показано на графике ( производства водорода Технология команды дорожной карты, ноябрь 2017 ) положить стоимость SMR водорода при температуре между $ 1.20 и $ 1.50, себестоимость водорода с помощью электролиза еще более двойной 2015 DOE водорода целевые цены. МЭ США целевая цена водорода в 2020 году составляет $ 2,30 / кг, что требует затрат на электроэнергию в размере $ 0,037 / кВтч, что достижимые учитывая последние тендеры PPA для ветровой и солнечной энергии во многих регионах. Это ставит $ 4 / GGE Н2 разливает объективные хорошо в пределах досягаемости, и близко к слегка повышенной стоимости добычи природного газа для SMR.
В других частях мира, паровой риформинг метана составляет от $ 1-3 / кг в среднем. Это делает производство водорода с помощью электролиза стоимости конкурентоспособной во многих регионах уже, как это изложено Nel водорода и других, в том числе статьи МЭА разбирая условия, которые могут привести к конкурентному преимуществу для электролиза.
перенапряжение
Реальные электролизеры воды требуют более высоких напряжений для протекания реакции. Часть , которая превышает 1,23 V называется перенапряжением или повышенным напряжением, и представляет собой любые потери и неидеальности в электрохимическом процессе.
Для хорошо разработанной клетки самого большое перенапряжением является реакция перенапряжение на четыре-электронное окисление воды до кислорода на аноде; электрокатализаторы могут облегчить эту реакцию, и платиновые сплавы являются состоянием техники для этого окисления. Разработка дешевый, эффективный электрокатализатор для этой реакции было бы большим шагом вперед, и является предметом исследования; Есть много подходов, среди них 30-летний рецепт сульфида молибдена , графеновых квантовых точек , углеродных нанотрубок , перовскита , и никель / никель-оксид. Проще реакцию двух электронов для получения водорода на катоде может быть electrocatalyzed почти без перенапряжения платины, или в теории с гидрогеназой фермента . Если другие, менее эффективны, материалы используются для катода (например , графит ), будут появляться большие перенапряжения.
Термодинамика
Электролиз воды в стандартных условиях требует теоретического минимума 237 кДж электрической энергии вход для диссоциации каждый моль воды, которая является стандартной свободной энергии Гиббса образования воды. Он также требует энергии , чтобы преодолеть изменения энтропии реакции. Таким образом, этот процесс не может протекать ниже 286 кДж на моль , если не добавляется никакого внешнего тепла / энергии.
Поскольку каждый моль воды требует два молей электронов , и при условии , что постоянная Фарадея F представляет собой заряд моль электронов (96485 С / моль), отсюда следует , что минимальное напряжение , необходимое для электролиза составляет около 1,23 В. Если электролиз осуществляют при высокой температуре, это напряжение снижается. Это позволяет эффективно электролизера работать на более чем 100% электрической эффективности. В электрохимических системах это означает , что тепло должно подаваться в реактор для поддержания реакции. Таким образом , тепловая энергия может быть использована для части требования электролиза энергии. Аналогичным образом требуемое напряжение может быть снижено (менее 1 В) , если топливо (такие как углерод, спирт, биомасса) подвергают взаимодействию с водой (PEM на основе электролизера при низкой температуре) или ионов кислорода (твердый оксид электролита электролизера основе при высоких температурах ). Это приводит некоторые из энергии в топливе используется для «помочь» процесс электролиза и может уменьшить общую стоимость водорода , полученного.
Однако, наблюдая компонент энтропии (и другие потери), напряжения свыше 1,48 V необходимы для реакции протекать при практических плотностях тока (The термонейтрального напряжении).
В случае электролиза воды, свободная энергия Гиббса представляет собой минимальную работу , необходимую для протекания реакции, и реакция энтальпия количество энергии (работа , так и тепла) , что должно быть обеспечено таким образом продукты реакции при той же температуре в качестве реагента (т.е. стандартной температуры для значений , указанных выше). Потенциально, электролизер работает на 1,48 V была бы 100% эффективность.
Смотрите также
Рекомендации
внешняя ссылка
Новый метод электролиза производит в 4 раза больше водорода

Присутствующий в изобилии природе, водород может стать перспективным чистым источником топлива, однако из-за ряда проблем его применение пока не может получить широкого распространения. Ученые из Южной Кореи разработали новую систему получения газа из воды, которая, по их словам, намного эффективнее других электролизных технологий.
За основу своего изобретения исследовательская группа, в состав которой вошли ученые из Ульсанского национального института науки и техники, Корейского института энергетических исследований и женского университета Сукмун, взяла уже существующую конструкцию под названием «твердая оксидная электролизная ячейка» (SOEC).
В усовершенствованной модели, так же, как и в других электролизерах, электрический ток расщепляет воду на молекулы водорода и кислорода, которые затем отдельно улавливаются. Отличие заключается в том, что в предложенной установке оба электрода являются твердотельными, как и электролит, служащий проводником ионов.

В системах, использующих жидкие электролиты, необходимо постоянно контролировать уровень жидкости. К тому же со временем жидкие электролиты становятся причиной коррозии других компонентов. Твердотельные электролизёры лишены этих недостатков, работают при более высоких температурах и могут извлекать электричество из этого тепла, соответственно, энергозатраты при их функционировании минимальны.
До сегодняшнего дня существовало два варианта ячейки SOEC, в которых использовались разные электролиты: первая конструкция позволяла пропускать только ионы кислорода, а вторая – только ионы водорода. Такое одностороннее движение ограничивало количество производства водорода и требовало улучшений.

Сохранив все преимущества твердотельного электролизера, исследователи разработали новую высокоэффективную гибридную систему (Hybrid-SOEC), в которой используется проводник со смешанными ионами для одновременного переноса как отрицательно заряженных ионов кислорода, так и положительно заряженных ионов водорода (протонов).
Используя смешанный ионный проводник и электроды из слоистого перовскита, Hybrid-SOEC произвел 1,9 литра водорода в час, работая при напряжении ячейки 1,5 В и температуре 700° С. Исследователи говорят, что это в четыре раза эффективнее существующих систем электролиза воды, а после непрерывного функционирования устройства в течение 60 часов признаки ухудшения производительности полностью отсутствовали.
Читайте также: Плавучие солнечные платформы будут добывать водород из морской воды за счет электролиза
Источник: news.unist.ac.kr
А вы что думаете по этому поводу? Дайте нам знать – напишите в комментариях!
Понравилась статья? Поделитесь ею и будет вам счастье!



