Коробка испытательная переходная (КИП) — варианты подключения
Согласно принятым нормам, есть особая группа потребителей, которых нельзя отключать от питающей энергосистемы даже на непродолжительное время. Но что делать, когда для цепей учета необходимо произвести замену трехфазного счетчика или испытательная лаборатория, должна выполнить поверку при помощи эталонного устройства контроля?
При описанных выше условиях обратиться к первому разделу в своде правил установок электрооборудования. В нем указано, что для подключения счетчика с трансформатором тока (в тексте будет использована аббревиатура «ТТ»), должна устанавливаться переходная испытательная коробка, например, такая, как на рисунке 1.
Рисунок 1. КИ-10 (ЛИМГ.301591.009)Назначение
Данное приспособление применяется, когда необходимо выполнить монтаж цепей учета на основе электросчетчиков с трансформаторным включением. Такое решение позволяет проделать работу, без обесточивания потребителей:
- подключать в щиток образцовое приспособление учета;
- производить шунтирование и отключение токовых цепей;
- выполнить расключение определенной фазы.

Первое действие выполняется, когда производится тестирование приспособлений контроля, остальные — при их замене.
Конструктивные особенности и основные характеристики
Рассмотрим, как устроен контактный бокс на примере КИ УЗ (см. рис.2)
Рисунок 2. Расположение контактов в ИКККонтакты с пометками 0, А, В и C используются для силовой цепи, а зажимы, имеющие номера с 1-го по 7-й служат для токового участка. Как выполняется включение КИП, будет рассказано в следующем разделе.
Конструкция КИП представляет собой контактную группу, размещенную в пластиковой коробке из ударопрочного и негорючего поликарбоната. Размеры этой модели — 68х220х33 мм.
Параметры рабочего напряжения и тока – 380 В и 16 А. Изоляционные свойства материала позволяют выдерживать кратковременное превышение до 2000В и 25А. Для изготовления токоведущих частей используется латунь. Допускается ее замена оцинкованной сталью, но срок службы таких контактов становится короче. В связи с этим производители известных брендов отдают предпочтение латуни.
Остальные эксплуатационные характеристики:
- модуль может использоваться при температурном режиме от -40 С° до 60 С°;
- допустимая влажность – не более 98 %;
- для подключения используется провода с минимальным сечением 0,5 мм2 и максимальным – 4 мм2;
- данная модель выпускается со степенью защиты IP20;
- длительность срока эксплуатации — до 30 лет.
Некоторые модели (например, BTS или КИП-5/25) выпускаются с прозрачной крышкой (см. рис. 3). Учитывая, что приспособления данного типа подлежат обязательному опломбированию, такая конструктивная особенность имеет очевидные преимущества, поскольку позволяет контролировать состояние группы контактов.
Рисунок 3. Прозрачная крышка позволит вовремя заметить перегрев зажима при плохом контактеВариант подключения
Обозначения:
- T1, T2, T3 – трансформаторы тока;
- Сч1 – трехфазное приспособление учета;
- К1 – бокс, через который выполняется подключение приспособления контроля.

Особенности схемы:
На рисунке 4 показано, что три фазы и нулевой провод подключаются к соответствующим местам на боксе и идут от него, непосредственно, к приспособлению учета. Очень важный фактор в данном случае – чередование фаз, оно не должно быть нарушено.
При подключении трех ТТ к боксу используется тип соединения «звезда».
Перемычки следует установить также, как продемонстрировано на рисунке 4.
Как производится отключение и подключение приспособления учета или образцового устройства
Выполняя замену необходимо соблюдать очередность действий, начнем описание с процедуры отключения.
Как производить отключение?
Делается это в следующем порядке:
- необходимо зашунтировать токовую цепь, чтобы сделать это, следует вкрутить в обозначенные на рисунке 5 места винты с соответствующей резьбой (как правило, м4). С обратной стороны бокса находится заизолированная шина, винтовое соединение обеспечит надежный контакт с ней. Рисунок 5. Места, куда необходимо вкрутить винты
- Отключаются перемычки, указанные на рисунке 6. При этом, не обязательно их полностью снимать. Достаточно ослабить винты «a» «b» и «c» и перемычки можно будет разомкнуть. Рисунок 6. Перемычки обведены красным овалом, винты, которые нужно ослабить – синими стрелками
- На завершающем этапе производится отключение от бокса приспособления учета.
Подключение нового устройства учета.
После того, как выполнен полный демонтаж, можно приступать к процедуре установки, выполняется она в обратном порядке, а именно:
- Производится монтаж приспособления.
- Выполняется подключение к боксу.
- Производится осмотр бокса на предмет, установлен ли шунт, если нет, то вкручивает соответствующие винты (см. рис. 5).
- К коробке подключается обмотка ТТ.
- Устанавливаются в рабочее положение перемычки в токовой и силовой зонах бокса (рисунок 6 и рисунок 7).
- Снимается шунтирование.
Зачем необходимо шунтирование?
Считаем необходимым дать небольшое пояснение о необходимости замыкать выходную катушку ТТ. Это связано с характерными особенностями таких устройств, нельзя допустить работу ТТ на холостом ходу с разомкнутой вторичной обмоткой. Если данное условие не будет выполнено,- на ней наведется большая ЭДС, что может не только привести к межвитковому замыканию, а и представлять опасность для жизни или здоровья человека.
Подключение образцового приспособления.
Алгоритм действий в такой ситуации примет следующий вид:
- Необходимо замкнуть выходы ТТ.
- Снять токовые перемычки с бокса.
- Отключить силовую часть.
- Подключить к боксу образцовое приспособление.
- Включить силовую часть.
- Отключить замыкающую шину.
- После проведения замеров образцовое устройство отключается и включается штатное, как это сделать было описано выше.
Для проведения тестового замера совершенно не обязательно отключать приспособление контроля от бокса. Особенности конструкции позволяют выполнить подключение, не снимая тестируемое устройство. Для этого контрольное приспособление подключается к нижним контактным группам бокса, а токовые перемычки не устанавливаются на место. В результате, штатное приспособление учета останется на месте, но не будет подключено к ТТ.
Теоретически, можно и не отключать токовые перемычки, но тогда будет довольно велика вероятность влияния штатного устройства на показания образцового приспособления.
Что необходимо принимать во внимание при работе с КИП?
На подключенном испытательном боксе имеется напряжение, опасное для человеческой жизни. Поэтому, для работы с этим устройством необходимо иметь соответствующий уровень допуска (до 1000 вольт).
Поскольку данное приспособление подлежит обязательному опломбированию, то для манипуляций с ним могут быть допущены только лица, имеющие разрешение на проведение таких работ. Когда коммутация будет выполнена, бокс снова опечатывается.
Коробка испытательная переходная ИКП (аналог ИК, ИКК) с прозр. крышкой
Коробка испытательная переходная ИКП (аналог ИК, ИКК) с прозр. крышкой купить по выгодной цене. Выберите городМоскваСанкт-ПетербургЕкатеринбургНовосибирскВолгоградВоронежКазаньКрасноярскНижний НовгородОмскПермьРостов-на-ДонуСамараУфаЧелябинскТюменьКраснодарСаратовВладивостокТомскТверьОренбургПензаЯрославльСургут Пункты выдачи заказов в 104 городах России Отгрузим за 2 дня и доставим бесплатноАртикул: 9900654
Производитель: CHINT
488 ₽
488 ₽
₽
Продается упаковками:
по 4 шт.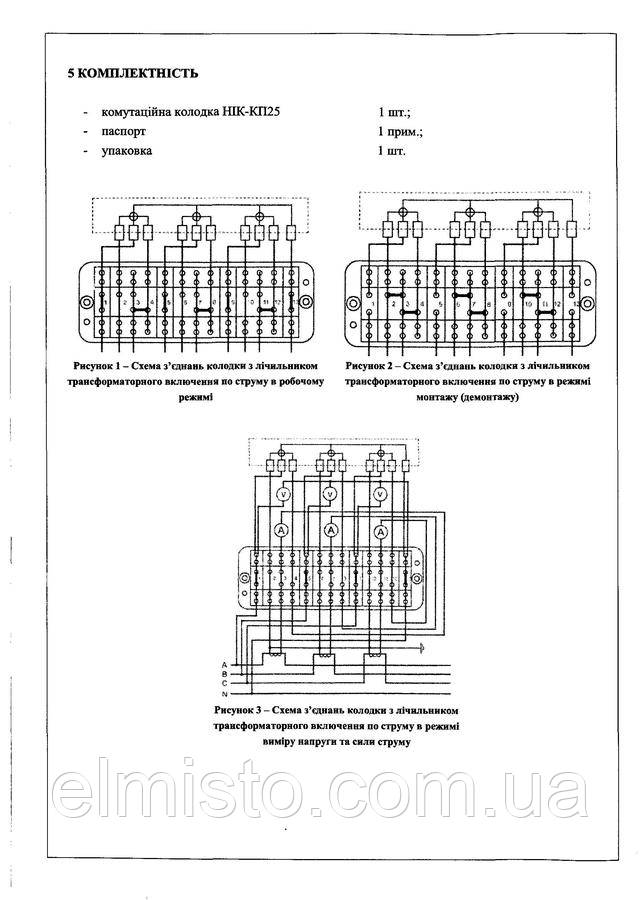
Наличие: Под заказ 4-12 недель
Комплектация и отгрузка за 2 дня Упаковка и доставка бесплатноРеквизиты
ООО «БОНПЕТ», ИНН: 6672272461, КПП: 668601001, ОГРН: 1086672014990, Юридический адрес: 620017, г. Екатеринбург, ул. Фронтовых Бригад, д. 7
Cертификат дистрибьютораКак получить скидку?
Если вы представляете электромонтажное, электрощитовое или промышленное предприятие, позвоните на 8 (800) 511 89 39 (бесплатно по РФ) или напишите на info@chint-electric. ru и мы предложим вам индивидуальные условия работы.
ru и мы предложим вам индивидуальные условия работы.
Мы используем куки, чтобы сайт лучше работал Согласен
Коробка испытательная переходная (КИП) | Заметки электрика
Здравствуйте, уважаемые читатели и гости сайта «Заметки электрика».
Во многих своих статьях, особенно про подключение счетчиков через трансформаторы тока, я упоминал Вам про испытательную переходную коробку (клеммник). Если сокращенно, то КИП.
Так вот сегодня я хотел бы поговорить о ней подробнее.
Итак, для чего нужна эта коробка (клеммник)?
В Главе 1.5, п.1.5.23 ПУЭ 7 издания сказано, что цепи учета электрической энергии необходимо выводить на специальные зажимы или испытательные коробки (клеммники).
Кстати, кто желает проверить свои знания или подготовиться к экзамену по электробезопасности в режиме онлайн, то предлагаю сделать это прямо на сайте.
Для Вас я специально подготовил целый раздел «Онлайн-тесты по электробезопасности» на разные группы.
Испытательная переходная коробка (КИП) предназначена для:
- возможности «закоротить» (зашунтировать) токовые цепи
- отключения токовых цепей
- отключения цепей напряжения по каждой фазе
- подключения образцового электросчетчика
Первые три пункта необходимы для проведения замены электросчетчика без снятия напряжения с электроустановки. Последний пункт относится для подключения образцового или эталонного электросчетчика с целью проверки прибора учета без отключения нагрузки потребителя.
На фотографии выше представлена переходная испытательная коробка, соответствующая техническим условиям МКЮР.301 591.000 ТУ. Она имеет следующие технические характеристики:
- напряжение до 380 (В)
- максимальный ток до 10 (А)
- степень защиты — IP20
- масса — около 500 (г)
- габаритные размеры коробки 33х68х220
Схема подключения испытательной коробки
Ниже смотрите схему подключения счетчика через испытательный клеммник к четырехпроводной сети 380/220 (В):
А вот фотография сверху переходного клеммника с обозначением номеров клемм:
Чтобы «закоротить» (зашунтировать) токовые цепи необходимо просто вкрутить винты М4 в следующие отверстия:
На фотографии выше на клемме 1 винт не вкручен, а на клеммах 2,4 и 6 — вкручены.

Эти винты при вкручивании замыкают цепь через общую шинку, расположенную с обратной стороны клеммника.
Кстати, для защиты общей шинки от замыканий на корпус с обратной стороны применяется прокладка из картона.
После того как токовые цепи закорочены, можно убирать (снимать) перемычки.
Чтобы отключить цепи напряжения по каждой фазе необходимо открутить винты и убрать соответствующую перемычку.
Забыл упомянуть о том, что все перемычки и клеммы у переходной испытательной коробки (КИП) выполнены из латуни, т.к. она меньше подвергается коррозии, а также имеет лучшую электрическую проводимость по сравнению со сталью.
Испытательная коробка закрывается крышкой с винтом для пломбировки.
Крышки у КИП выполняются либо черными (не прозрачными), либо прозрачными. У последней имеется существенный плюс в том, что состояние (положение) контактов и схему подключения счетчика можно увидеть не открывая ее.
Пример подключения испытательной переходной коробки (КИП)
Ниже я приведу Вам пример подключения испытательной коробки. Несколько дней назад я устанавливал счетчики электрической энергии на двух вводных ячейках котельной станции, которые в дальнейшем подключались к системе АСТУЭ.
Панель учета была установлена на стене около сборки ВРУ.
Там же установлены счетчики, испытательные и интерфейсные коробки. Цепи учета (токовые цепи и цепи напряжения) соединяются с трансформаторами тока
и шинами ВРУ с помощью медных проводов ПВ-1 сечением 2,5 кв. мм, проложенных в гофре.На схеме подключения счетчика я подробно останавливаться не буду, т.к. недавно писал статью о подключении трехфазного счетчика через трансформаторы тока в четырехпроводную сеть 380/220 (В), в которой Вы можете со всем подробно ознакомиться.
В заключении я рекомендую Вам посмотреть мой видеоролик, где я более наглядно рассказываю про подключение испытательной коробки на примере счетчика Меркурий 230 ART-03, подключенного через три трансформатора тока в сеть 400 (В):
youtube.com/embed/zkC3tqLm7Ck» allowfullscreen=»» frameborder=»0″>
Дополнение. В данной статье я рассмотрел один из вариантов подключения испытательной коробки. На практике встречается еще одна распространенная схема, о которой я подробно рассказываю в видеоролике (на примере счетчика Меркурий 230 AМ-03, подключенного через три трансформатора тока в сеть 400 В):
P.S. На этом статью на тему испытательная переходная коробка (КИП) я завершаю. Если есть вопросы, то задавайте их в комментариях. Спасибо за внимание.
Если статья была Вам полезна, то поделитесь ей со своими друзьями:
Коробка испытательная переходная | Electric-Blogger.ru
2017-09-13 Статьи, Схемы
Коробка испытательная переходная (КИП), или как ее еще называют испытательная клеммная колодка (ИКК) применяется при подключении счетчиков трансформаторного включения, так как согласно ПУЭ (раздел 1. 5, п.15.23) все цепи учета, подключаемые через трансформаторы, должны быть выведены на специальные зажимы или испытательные коробки.
5, п.15.23) все цепи учета, подключаемые через трансформаторы, должны быть выведены на специальные зажимы или испытательные коробки.
Испытательная коробка служит для закорачивания токовых цепей, отключения токовых цепей и цепей напряжения в каждой фазе счетчиков. Все это необходимо для безопасной замены счетчика без снятия напряжения с электроустановки.
Также коробка испытательная переходная позволяет подключить образцовый (эталонный) счетчик для поверки без отключения нагрузки потребителя.
Сама КИП представляет из себя клеммную колодку в корпусе из карболита с прозрачной или не прозрачной крышкой, все контакты у коробки сделаны из латуни, так как латунь меньше подвержена коррозии и обеспечивает лучшую электрическую проводимость по сравнению со сталью. Также у любой испытательной коробки должен быть винт со сквозным отверстием для пломбировки.
Закорачивание токовых цепей осуществляется с помощью винтов, которые необходимо закрутить в отверстия, обозначенные на рисунке как 2,4,6. Они замыкают цепь через общую шину, которая находится с обратной стороны коробки. После того, как все винты закручены, можно будет снять перемычки. Для отключения цепей напряжения по каждой фазе необходимо убрать перемычку с соответствующих клемм.
Они замыкают цепь через общую шину, которая находится с обратной стороны коробки. После того, как все винты закручены, можно будет снять перемычки. Для отключения цепей напряжения по каждой фазе необходимо убрать перемычку с соответствующих клемм.
А так выглядит стандартная схема подключения трехфазных счетчиков к трансформаторам тока через испытательную коробку.
Первая клемма на коробке — нулевая, через нее входящий нулевой провод приходит на счетчик на клемму 12. Далее идут три клеммных колодки напряжения А, В, С. Верхняя и нижняя клеммы соединены перемычками. Затем идет клемма для подключения заземляющего проводника. Через нее земля приходит на счетчик на клемму 3 и перемычками соединяется с 6 и 9 клеммами счетчика. На клеммы испытательной коробки 2,4,6 приходят токовые цепи со вторичной обмотки трансформаторов тока ( обозначены на схеме цифрой 2), а с клемм 3,5,7 они идут на клеммы счетчика 5,8 и 11.
Сечение проводов для подключения токовых цепей должно быть не менее 2,5 мм2, а цепей напряжения не менее 1,5 мм2.
Коробка испытательная переходная | Блог инженера теплоэнергетика
Для чего нужно и как подключить?Испытательные переходные коробки (клеммники), или, сокращенно – КИП, обычно используют, если нужно подключение счетчиков через трансформатор тока (ТТ). Это является крайне важным для, так называемых, потребителей первой категории, то есть когда перерыв в снабжении электричеством недопустим.
Использование строго регулируется правилами устройства электроустановок (ПУЭ).
Что из себя представляет? Если обратить внимание на внешний вид коробки, то можно заметить, что контакты особым образом сгруппированы, также на них присутствуют перемычки. Это нужно для того, чтобы, когда подключался образцовый прибор, не нужно было отключать основной. При этом, при подключении образцового прибора к свободным концам клемм, перемычки размыкаются. Материал перемычек – латунь. Благодаря ей, обеспечивается лучшая электрическая проводимость ( в отличие от той же стали). Также латунь меньше подвержена коррозийным процессам.
Также латунь меньше подвержена коррозийным процессам.
Чтобы обеспечить безопасное отключение и снятие счетчика (например, если его нужно проверить, или заменить), на этот счет используются колодки.
Крышки у таких коробок бывают черного цвета, либо бесцветные (прозрачные). Последний вариант является наиболее предпочтительным, так как позволяет взглянуть на схему подключения, и проверить состояние контактов, не открывая крышки.
Также коробка оснащена специальным винтом, имеющим сквозное отверстие. Он нужен для пломбировки. При этом, пломба снимается и устанавливается в одно время со счетчиком. Снятие и установка пломбы на ней происходит одновременно со счетчиком.
Для чего может использоваться? Как уже было сказано выше, в основном КИП используют, если нужно подключить счетчик через ТТ.
Также такая испытательная коробка позволяет следующее:
• зашунтировать токовую цепь
• отключить токовую цепь
• отключить цепь по каждой конкретной фазе
• подключить трехфазный индукционный и электронный счетчик
• включить образцовый счетчик для проверки, не отключая нагрузку потребления.
Все это позволяет не снимать напряжение с электроустановки, когда идет замена счетчика. Также можно не отключать нагрузку потребителя, если нужно подключить образцовый счетчик с целью его проверки.
Далее мы рассмотрим подробнее, как происходит процесс подключения такой испытательной коробки.
Как произвести правильное подключение?При установке и подключении испытательных блоков необходимо соблюдать строгий порядок, в соответствии с правилами ПЭУ. Там четко указано, что цепи учета электроэнергии нужно выводить на специально предназначенные для этого зажимы, либо вот на такие испытательные коробки.
В соответствии с правилами, подключение трехфазных индукционных или электрических счетчиков через испытательную коробку чрезвычайно важно. Как уже было сказано выше, это позволит не отключать нагрузку потребления, если необходимо включить образцовый счетчик для проверки. Также это поможет закоротить вторичную цепь трансформатора тока, либо отключить цепь напряжения (при том, на каждую фазу счетчика при его замене).
Будьте внимательны, все работы по: монтажу, демонтажу, подключению и отключению счетчиков и переходных испытательных коробок могут производиться только квалифицированными специалистами. Также эти люди должны иметь специальный допуск (для электроустановок, напряжение которых доходит до 1000 В).
При этом, стоит отметить, что в правилах устройства электроустановок нет конкретных схем по подключению. Но там есть строгие требования к такого рода схемам (в том числе, по возможному закорачиванию, пломбированию). Поэтому, эти требования также необходимо соблюдать.
Зачастую, благодаря установке приборов учета для потребителей, через трансформаторы тока (ТТ), стоимость электроснабжения удешевляется. Но при этом, повышается его надежность. Это связано с тем, что сила тока приборов учета, предназначенных для прямого включения, не высока. Но это ограничение снимается, если использовать трансформаторы тока.
Благодаря этому, непосредственно на том месте, где и происходит установка счетчика, можно будет: заменить и проверить схему присоединения, определиться с погрешностью в измерениях.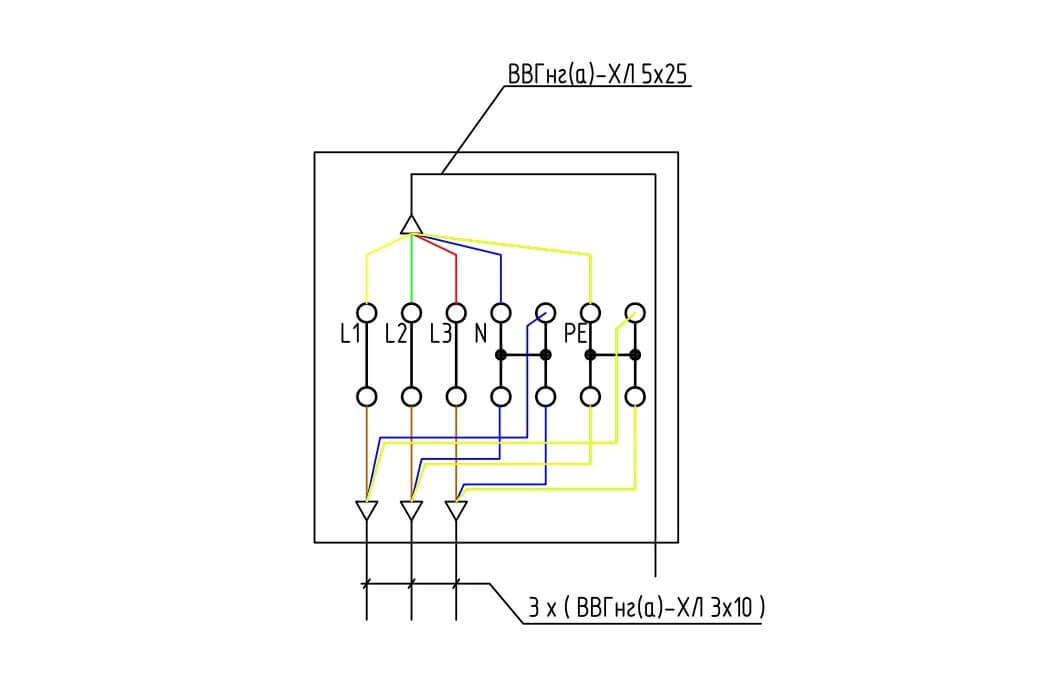 И при этом нагрузочный ток будет оставаться в наличии, нет необходимости отключать потребителей.
И при этом нагрузочный ток будет оставаться в наличии, нет необходимости отключать потребителей.
Наиболее универсальным, распространенным способом подключения, который способен обеспечить безопасность обслуживания, является: подключение счетчиков через ТТ, при помощи переходной коробки для низковольтной сети (220В).
Здесь приведена возможная схема подключения.
Для того, чтобы «закоротить» токовую цепь, достаточно будет просто вкрутить винт в отверстие. Напомню, цепь учета нужно выводить на специально предназначенные для этого зажимы (выбрав отдельные сборки, или же секции из общего ряда). Когда зажимов нет, выбирается установка испытательного блока.
Отсоединять провода и кабель, когда включен образцовый счетчик, не требуется, если есть такие зажимы. Вторичная цепь трансформатора тока будет закорочена, а токовая цепь и цепь напряжения счетчика отключена.
После закорочения токовой цепи, можно будет снять перемычки. Если будет нужно отключить цепь напряжения по каждой из фаз, то достаточно сначала открутить винт, а потом уже снять конкретную необходимую перемычку. Пломбирование также не составит труда, сборки и коробки зажимов электросчетчиков имеют специально предназначенную для этого конструкцию.
Если будет нужно отключить цепь напряжения по каждой из фаз, то достаточно сначала открутить винт, а потом уже снять конкретную необходимую перемычку. Пломбирование также не составит труда, сборки и коробки зажимов электросчетчиков имеют специально предназначенную для этого конструкцию.
Подводя итог:
• Для начала нужно закоротить токовую цепь трансформатора тока при помощи специальных винтов;
• Затем снять перемычки для отключения токовой цепи прежнего счетчика. Это делается для того, чтобы исключить его влияние на показатели образцового счетчика;
• Временно подключить к переходной коробке образцовый счетчик;
• Выкрутить винты, тем самым разомкнув цепь трансформатора.
Обратите внимание, цепь вторичных обмоток трансформатора тока обязательно должна быть заземлена и закорочена, а напряжение снято. Это делается для безопасности. Для этого используются специальные колодки. Использование таких колодок позволит безопасно отключить и снять электрический счетчик для дальнейшей проверки и замены.
Дополнительно, чтобы защитить общую шинку от замыкания, на корпусе коробки, с обратной стороны, имеется картонная прокладка. Стоит отметить, что использование таких переходных коробок происходит только, если счетчик включается через измерительные трансформаторы тока. Если счетчик имеет прямое включение, такую коробку никогда не используют.
С помощью такого устройства можно подключить прибор для снятия замеров, при этом не нарушая схемы.
В целом, переходная коробка является очень полезной вещью. С помощью нее можно проверить все прямо на месте, при этом не потребуется демонтаж. Также можно будет заменить счетчик с непрямым включением, при этом потребитель не будет обесточен. Это действительно удобно.
переходная для электросчетчиков, монтаж коробки
На чтение 7 мин Просмотров 271 Опубликовано Обновлено
При установке измерительных приборов в силовые цепи трехфазного питания особое внимание уделяется приведению контролируемых величин к виду, удобному для подключения к электросчетчику. При значительных токовых нагрузках, достигающих 1000 Ампер, для этого используются специальные преобразовательные устройства – трансформаторы тока (ТТ). При их наличии обслуживание и ремонт подключаемых к линии приборов учета существенно усложняется.
Назначение и особенности ИКК
Испытательная коробка для счетчикаВ ПУЭ особо оговаривается требование, касающееся подключения счетчика к действующим электросетям в части его коммутации через приспособление, называемое испытательная коробка (ИКК). При ее использовании удается закоротить вторичную цепь измерительного трансформатора, что позволяет обесточивать питающие линии по каждой из подводимых к счетчику фаз.
Подключение трансформатора тока через испытательную коробку позволяет превратить процедуру замены и проверки прибора учета в совершенно безопасное занятие. Помимо этого, отключать нагрузку от питающей линии в данном случае не обязательно.
Помимо этого, отключать нагрузку от питающей линии в данном случае не обязательно.
Испытательные коробки для счетчика электроэнергии особо востребованы в следующих ситуациях:
- для шунтирования контрольных цепей;
- если возникла потребность в их полном отключении;
- при необходимости блокирования напряжения по каждой из фаз;
- для подсоединения к контролируемой линии измерительного устройства (электросчетчика).
Потребность в коробках ИКК также объясняется тем, что существует особая группа потребителей, каждый из которых не допускается отключать от электросети даже на короткое время. С учетом того, что периодически возникает потребность в проведении работ со счетчиком, коробка клеммная испытательная ИКК существенно упрощает все операции. В этом случае нет нужды в обесточивании линии питания и установке на место измерительного прибора замещающего его шунта.
Конструкция приспособления
Конструкция ИККТиповые переходные коробки выпускаются в нескольких исполнениях, различающихся своим видом и формой. Чаще всего они имеют вид прямоугольной колодки с толстыми стенками, изготовленными из прочного и негорючего материала (карболита или пластика). В таком исполнении коробка напоминает подложку с размещенными на ней группами клемм, образующих так называемую «зажимную клеть».
Чаще всего они имеют вид прямоугольной колодки с толстыми стенками, изготовленными из прочного и негорючего материала (карболита или пластика). В таком исполнении коробка напоминает подложку с размещенными на ней группами клемм, образующих так называемую «зажимную клеть».
По ее краям делаются сквозные отверстия, используемые для крепления ИКК к стенкам распределительного щита. Ее соединительные контакты изготавливаются на основе латуни или оцинкованной стали (иногда для этого используется фосфористая бронза). Некоторые модели коробок комплектуются такими дополнительными элементами, как фланец или рычажок, упрощающий процесс монтажа.
Переходные контакты выполняются в виде подпружиненных пластин или винтовых фиксаторов, размещаемых на токопроводящих пластинах из латуни, жести или стали. Их применение объясняется устойчивостью этих материалов к коррозии и высокой проводимостью. Сверху колодка закрывается прозрачной крышкой из пластика, надежно фиксируемой на основании. При эксплуатации испытательного приспособления совместно с электросчетчиком его крышка также опечатывается.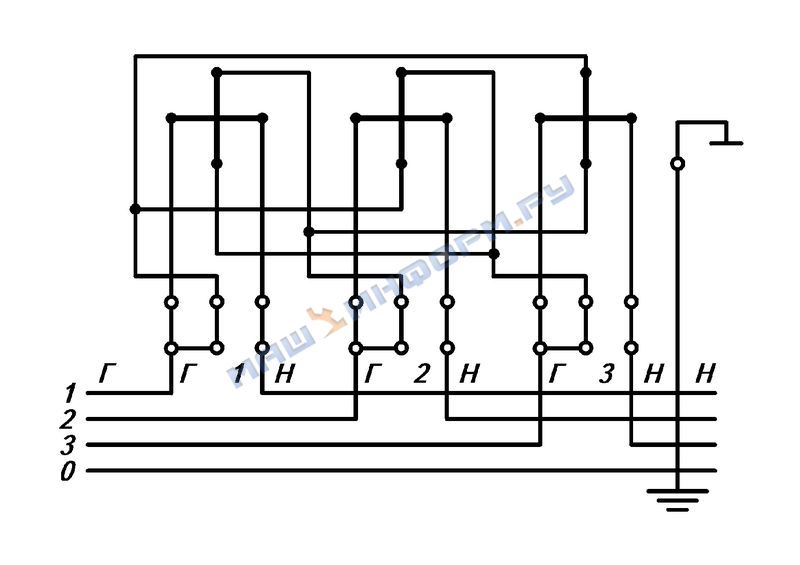 Для этого в ней предусмотрены сквозные ушки для навешивания пломбы или небольшое отверстие под контрольный винт (шуруп). Прозрачность защитного покрытия позволяет визуально контролировать расключение контактных групп.
Для этого в ней предусмотрены сквозные ушки для навешивания пломбы или небольшое отверстие под контрольный винт (шуруп). Прозрачность защитного покрытия позволяет визуально контролировать расключение контактных групп.
Типовые различия
Испытательная коробка в электрощиткеВсе испытательные клеммные коробки прежде всего различают по типу сетевого питания. В соответствии с этим показателем они делятся на следующие виды:
- колодки, устанавливаемые в цепях питания 380 Вольт;
- те же изделия, но рассчитанные на 220 Вольт;
- низковольтные образцы, предназначенные для установки в сети 110 Вольт.
Изделия принято отличать по форме и рабочим размерам. Согласно этим признакам они могут быть круглыми, прямоугольными или квадратными, небольшого размера или укрупненной серии.
В общем случае испытательные коробки классифицируются по следующим характерным признакам:
- назначение;
- способ монтажа;
- количество рядов на подложке;
- число контактных групп в каждом из них;
- тип фиксации и марка провода;
- исполнение (угловые коробки или прямые).

По назначению изделия используются совместно измерителями либо предназначаются для обычных коммутационных операций. Они могут монтироваться на DIN рейку или устанавливаться в кросс-модуль. Возможное количество рядов и контактных групп в этих приспособлениях – один или два с числом контактов от 3-х и более.
В соответствии с используемым способом фиксации все коробки бывают для винтового, барьерного и фиксированного (нажимного) крепления. Марка подключаемого провода выбирается в зависимости от типа используемых в коробке клемм. Винтовые и концевые крепления подходят для всех типов проводников, а в пружинные и ножевые зажимы обычно вставляются их одножильные аналоги. Однако основное различие испытательных колодок для счетчиков в схеме подключения, согласно которой они применяются для одного учетного устройства либо сразу для нескольких образцов.
Испытательные коробки ИКК выпускаются большинством крупных производителей электротехнического оборудования, использующим при их изготовлении различные материалы.
Этот факт подтверждается наличием у ряда изделий различных сертификатов качества.
Монтаж устройства
Схема монтажа ИККПриспособления востребованы при прокладке новых электрических линий и при необходимости их модернизации. При монтаже обязательно выполняются требования ПУЭ, касающиеся правил эксплуатации испытательных коробок. Согласно нормативам, для размещения ИКК потребуется подготовить специально оборудованное место, защищенное от проникновения посторонних лиц и доступное для обслуживающего персонала.
На клеммах коробки допускается объединять только провода из однородных металлов, имеющих электрохимическую совместимость.
Усилие затяжки контактных винтовых соединений не должно быть более 2,5 Nm, что гарантирует сохранность клемм. Кроме того, они не должны иметь повреждений и следов явных дефектов. Фиксация корпуса ИКК в месте установки выполняется только механическим способом – его прикручиванием или закреплением с помощью специальных защелок. Коробка обычно монтируется в электрическом шкафу сразу же после электросчетчика.
Пример подключения
Действия при снятии ПУРасключение реального прибора учета (ЦЭ6803 В100/10 Т1, например) посредством испытательной коробки осуществляется по заранее подготовленной схеме.
Согласно ПУЭ, все трехфазные счетчики должны подключаться через токовые преобразователи и совмещенную с ними переходную коробку.
При выборе трансформаторов удобнее воспользоваться изделием ТОП-0,66 с коэффициентом передачи тока 200/5. В качестве примера подключения рассмотрим коробку КИ 10 или же Б3179, выпускаемую МЭТЗ. Вес не превышает 0,6 кг, габариты – 68х220х33 мм. Последовательность расключения этих изделий:
- В рабочем щитке монтируется счетчик, а затем – сама испытательная коробка и трансформаторы тока.
- ТТ по каждой из фаз объединяются по схеме «звезда»; при этом общий вывод надежно заземляется.
- От него до корпуса коробки протягиваются провода сечением 1,5 мм².
- От счетчика также прокладываются три жилы (2,5 мм²).
Для удобства монтажа перед прокладкой все провода обязательно маркируются: на них указываются начала всех токовых фазных обмоток, а также общий вывод. При этом проводники от электросчетчика заводятся в коробку с верхней ее части, а затем поочередно расключаются в контактной группе. Она должна иметь большую площадь пластин, чем те же контакты, предназначенные для отводов от токовых трансформаторов (они располагаются с нижней стороны коробки).
При этом проводники от электросчетчика заводятся в коробку с верхней ее части, а затем поочередно расключаются в контактной группе. Она должна иметь большую площадь пластин, чем те же контакты, предназначенные для отводов от токовых трансформаторов (они располагаются с нижней стороны коробки).
Расключенная испытательная пластина закрывается сверху крышкой, после чего изделие готово к эксплуатации.
При необходимости проведения каких-либо операций с электрическим счетчиком для его снятия потребуется лишь удалить перемычки в ИКК. После этого цепь ее соединения с учетным прибором разрывается.
Нюансы использования
Испытательные коробки как конструкции простейшего типа не нуждаются в особом обслуживании, что не означает их абсолютной надежности. Согласно требованиям действующих нормативов, в процессе эксплуатации ИКК рекомендуется регулярно подтягивать контакты винтовых зажимов. В процессе эксплуатации проводники нагреваются и слегка деформируются, что вызывает ослабевание соединений.
К коробкам с контактами зажимного типа таких требований обычно не предъявляется. К тому же обращаться с ними намного удобнее, поскольку для отключения измерителя дополнительного инструмента не потребуется.
Процедуры, связанные с установкой, демонтажем, а также вскрытием и последующим за этим пломбированием коробки проводятся только квалифицированными специалистами.
Коробка испытательная переходная ИКП (аналог ИК, ИКК): цена, фото, описание, характеристики
Назначение
Коробка испытательная переходная ИКП предназначенадля подключения трехфазных индукционных и электронных счетчиков и
обеспечивает:
•закорачивание (шунтирование) вторичных цепей измерительных
трансформаторов тока, отключение токовых цепей и цепей
напряжения в каждой фазе счетчиков при их замене.

• Включение образцового счетчика для поверки без отключения
нагрузки потребления.
Применение
Шкафы различного назначения, щиты и сборки, укомплектованныетрехфазными счетчиками электрической энергии.
Согласно главе 1.5, п.15.23 ПУЭ 7 издания, цепи учета электрической
энергии необходимо выводить на специальные зажимы или испытательные
коробки (клеммники).
Материалы
• Контактная группа изготовлена из оцинкованной стали, что
позволяет применять как медные, так и алюминиевые проводники.
• Корпус изготовлен из карболита – материала, стойкого к высоким
(до 300°), температурам, обладающего высокой механической и коррозийной
устойчивостью, отличными электроизоляционными свойствами (диэлектрическая
постоянная от 5.6 до 8.85), не подверженного воздействию агрессивных сред.
• Винты изготовлены из оцинкованной стали.
Применение
• Шкафы различного назначения, щиты и сборки, укомплектованные трехфазнымисчетчиками электрической энергии.

•Согласно главе 1.5, п.15.23 ПУЭ 7 издания, цепи учета электрической энергии
необходимо выводить на специальные зажимы или испытательные коробки (клеммники).
Конструкция
Конструктивно устройство состоит из:
• Основания с группами контактов (зажимами), к которым подключаются
цепи напряжения (0, A, B, C) и тока (1 — 7).
•защитной крышки, фиксируемой винтом, с возможностью опломбировки.
Вы можете купить товар «Коробка испытательная переходная ИКП (аналог ИК, ИКК)» в интернет магазине «ESTALL.RU» со склада в Москве. Отзывы, фото, описание, характеристики.
ПЕРВЫЙ НОМЕР | ВТОРОЙ НОМЕР | ИК КОД | ||||||
| | | | | | |||
0 | без защиты | 0 | без защиты | 00 | без защиты | |||
1 | защищен от твердых предметов более 50 мм e. | 1 | защищен от вертикально падающих капель воды | 01-05 | удар | |||
2 | защищен от твердых предметов более 12 мм e.г. пальцы | 2 | защищен от прямых брызг воды под углом до 15 ° от вертикали | 06 | удар | |||
3 | защита от твердых предметов более 2,5 мм (инструменты + мелкие провода) | 3 | защищен от брызг до 60 ° от вертикали | 07 | удар | |||
4 | защита от твердых предметов более 1 мм (инструменты + мелкие провода) | 4 | защищен от брызг воды со всех сторон — допускается ограниченное проникновение | 08 | удар | |||
5 | защищен от пыли — допускается ограниченное проникновение (без вредных отложений. | 5 | защищен от струй воды под низким давлением со всех сторон — допускается ограниченное проникновение | 09 | удар | |||
6 | полностью защищен от пыли | 6 | защищен от сильных водяных струй, например, для использования на палубах судов — допускается ограниченное проникновение | 10 | удар | |||
7 | защищен от воздействия погружения на глубину от 15 см до 1 м | |||||||
8 | защищен от длительного погружения под давлением | |||||||
I Ингибитор киназы каппа B — обзор
20.5.4 Клеточная передача сигналов
Доказано, что мышьяк вызывает апоптоз, опосредованный АФК, в различных типах клеток, таких как клетки печени и мозга. Однако имеется ограниченная информация о влиянии мышьяка на кардиомиоциты. Хотя было бы заманчиво предположить, что такое же действие можно наблюдать в кардиомиоцитах, существует ограниченная литература, подтверждающая такие утверждения. Рагху и Чериан показали, что при лечении разными дозами АТО (30, 60 и 90 мкМ) в течение 24, 48 и 72 часов кардиомиоциты крысы подвергались апоптозу в зависимости от дозы и времени [116].Аналогичным образом Zhao et al. [117] показали, что As 2 O 3 (2–10 мкМ) снижает жизнеспособность кардиомиоцитов H9c2 дозозависимым образом. Они показали, что повышенная перегрузка АФК и кальцием с повышенной активностью каспазы-3 приводит к сокращению клеток и клеточному апоптозу. Эти изменения можно обратить вспять с помощью ингибитора каспазы-3 Ac-DEVD-CHO и антиоксиданта витамина E [117]. Кроме того, Bessho et al. показали, что ATO запускает апоптоз посредством ROCK-зависимого пути, поскольку использование ингибитора ROCK (Y-27632) приводит к защите клеток кардиобластомы H9c2 от каспазо-опосредованного апоптоза [118].Эти исследования показывают, что апоптоз, опосредованный АФК, может играть ключевую роль в клеточной регуляции кардиомиоцитов. Гибель клеток, вызванная мышьяком, также может играть роль в прогрессировании сердечной недостаточности или ИБС. Хотя апоптоз является ключевым событием, регулирующим выживание кардиомиоцитов после воздействия мышьяка, существует ряд сигнальных путей, которые изменяются в этом процессе.
Используя микроматрицу полного генома, Park and Park показали, что всего через 24 часа после обработки ATO кардиомиоциты H9c2 активировали 405 генов и подавили 499 генов более чем в два раза, что указывает на большие физиологические изменения, поскольку воздействие может вызвать относительно короткий период времени [119].В этом исследовании лечение ATO в субцитотоксической дозе (0,5 ppm) увеличивало образование ROS, что приводило к окислительному стрессу, на что указывало повышение регуляции HO-1 , GST , металлотионеина (MT) и каталазы. Несмотря на образование АФК и окислительный стресс, воздействие As также вызывает кардиотоксичность, модулируя ионные каналы [119]. Металлотионеин — хорошо известный эндогенный антиоксидант, который играет жизненно важную роль в регулировании тяжелых металлов в биологических системах [4]. Хотя модуляция МТ хорошо известна в литературе в отношении токсичности кадмия, мало что известно о ее роли в отравлении мышьяком.Miao et al. [120] продемонстрировали, что МТ, сверхэкспрессирующие сердечные клетки H9c2, и трансгенные мыши (MT-TG) при воздействии клинически значимых доз мышьяка показали значительную защиту от индуцированного мышьяком клеточного апоптоза по сравнению с контрольными животными. Более того, сверхэкспрессирующие МТ клетки и животные предотвращали активацию членов MAPK, таких как ERK1 / 2, JNK и p38, уровень регуляции которых был сильно повышен в контрольных группах [120]. Это исследование ясно показало, что эндогенные антиоксиданты, такие как MT, играют важную роль в регулировании сигнальных путей, таких как MAPK, которые важны для индуцированной мышьяком гибели клеток.Недавно Fan et al. [121] показали, что индуцированные мышьяком ROS и перегрузка кальцием могут увеличивать уровни фосфорилирования членов MAPK, таких как JNK и p38, в модели с удлиненным QT, индуцированным As. Однако с помощью антиоксиданта (генистеина) эти активации можно было значительно снизить, что косвенно привело к подавлению активности каспазы-3, предотвращая апоптоз клеток. Точно так же Ghosh и др. [122] продемонстрировали, что арсенит натрия (NaAsO 2 ) усиливает фосфорилирование IKK и NF-κB в миоцитах новорожденных крыс, что также сопровождается увеличением фосфорилированных p38-MAPK и JNK.Это исследование дополнительно подчеркивает участие сигнального пути MAPK в кардиотоксичности, индуцированной As. Интересно, что при использовании ингибитора IKK (PS-1145) расщепление каспазы-3 и PARP отменялось. Кроме того, ингибитор JNK (SP600125) и ингибитор p38-MAPK (SB203580) также могут снижать фосфорилирование IKK и NF-κB, тем самым уменьшая апоптоз. Более того, когда животных лечили сильнодействующим антиоксидантом, таурином, большинство переменных демонстрировало обратное действие и предотвращало апоптоз [122].
Другой путь, который, как было показано, затрагивается в кардиомиоцитах, — это TGF-β. Chu и соавторы [123] показали, что при введении ATO морским свинкам у них развился удлиненный интервал QT и тяжелый фиброз миокарда. Это сопровождалось увеличением секреции TGF-β1. Интересно, что также было обнаружено, что сердечные фибробласты (а не кардиомиоциты) ответственны за это увеличение секреции TGF-β1, что в конечном итоге привело к паракринному подавлению hERG и Kir2.1 — двух каналов K + , необходимых для I kr и I k1 токов соответственно.Однако благодаря использованию антагониста передачи сигналов TGF-β (LY364947) интерстициальный фиброз и LQTS были устранены. Одновременно аномальные уровни TGF-β1, hERG и Kir2.1 вернулись к норме [123].
Сообщалось также, что мышьяк влияет на окислительно-восстановительный гомеостаз (путь Nrf2-HO-1). Nrf2 представляет собой фактор транскрипции, ответственный за активацию нескольких антиоксидантных генов, которые включают, но не ограничиваются ими, GST , GCL , HO-1 и MRP .Суми и его коллеги показали, что по сравнению с клетками, полученными из других источников (например, печени; LC 25 25 мкМ, почки; LC 25 112 мкМ и мозг; LC 25 49–73 мкМ), кардиомиоциты крысы ( LC 25 4 мкМ) оказались наиболее чувствительными к As III [124]. Интересно, что хотя Nrf2 был активирован в этих других клеточных линиях после обработки As III , он был плохо активирован в кардиомиоцитах. Уровни GCL и MRP также были ниже в кардиомиоцитах, что позволяет предположить, что они имеют пониженную способность метаболизировать и выводить As.Кроме того, антиоксиданты, такие как ресвератрол, также обладают аналогичными эффектами, поскольку они, как было показано, предотвращают подавление Nrf2 и HO-1 у крыс, которым вводили ATO [125]. Ресвератрол также уменьшал образование ROS и окислительное повреждение ДНК. Эти исследования показывают, что низкомолекулярные ингибиторы различных сигнальных путей и антиоксиданты, такие как генистеин и таурин, могут иметь потенциальную терапевтическую ценность против кардиотоксичности, индуцированной As.
Глядя на текущие опубликованные данные, очевидно, что в кардиотоксичность, вызванную мышьяком, участвуют множественные сигнальные пути in vivo , а также in vitro , и антиоксидантная терапия в некоторой степени способна обратить эти эффекты.Трудно утверждать, что одни антиоксиданты будут полноценным средством лечения кардиотоксических эффектов мышьяка, поскольку эти изменения могут быть временными, а токсичный металл все еще может присутствовать в клетках. Однако были исследования, которые показывают, что различные антиоксиданты из синтетических источников или растений могут оказывать благотворное влияние на кардиомиоциты, подвергшиеся воздействию мышьяка.
Zhang et al. показали, что матрин и оксиматрин, два соединения, которые могут быть выделены из рода Sophora , могут сокращать продолжительность APD, которая была увеличена из-за лечения ATO как в желудочковых миоцитах морских свинок, так и в системе сверхэкспрессии гетерологичного HEK человека [126].Однако, в то время как низкие дозы (1 мкМ и 10 мкМ) матрина приводили к увеличению токов I Kr , высокая доза (100 мкМ) приводила к снижению. После длительного лечения оба этих соединения (1 мкМ) могли обратить вспять удлинение QT за счет активации Sp1 (трансактиватора KCNh3 ), что, в свою очередь, привело к увеличению hERG как на уровне транскриптома, так и на уровне протеома. . Это сопровождалось увеличением hERG на клеточной мембране и одновременным увеличением тока I kr токов.Кроме того, сальвианоловая кислота B (Sal B), компонент Salviae miltiorrhizae , также, как сообщается, защищает от индуцированного ATO апоптоза в кардиомиоцитах H9c2 через PI3K / Akt, сигнальный путь, известный своими кардиозащитными эффектами [127]. . Известно, что сигнальный путь PI3K / Akt оказывает защитный эффект, модулируя баланс между антиапоптотическими белками (Bcl-2 и Bcl-xL) и проапоптотическими белками (Bax, Bad и Bak). Стурлан и др. показали, что индуцированный ATO апоптоз происходит из-за подавления Bcl-2 и одновременного повышения уровня Bax [128].Лечение Sal B увеличивало Bcl-2 и Bcl-xL и возвращало Bax к нормальным уровням. Однако при использовании ингибитора PI3K (LY294002) защитный эффект Sal B был утрачен, и кардиомиоциты подверглись апоптозу после лечения ATO [127].
В другом исследовании было показано, что силибинин, экстракт семян расторопши, улучшает образование АФК, индуцированное As, у крыс [129]. Это соединение обладало способностью восстанавливать активность сердечных митохондриальных ферментов (ICDH, SDH, MDH, a-KDH и NADH), которые были потеряны после воздействия As.Листья Corchorus olitorius , популярной культуры в Бангладеш и Западной Бенгалии, являются еще одной формой защиты от кардиотоксичности, индуцированной As [72]. У крыс, которым вводили NaAsO 2 , развился значительный окислительный стресс в ткани миокарда. Это означало подавление некоторых антиоксидантных ферментов, таких как SOD, CAT, GST и GPx. Однако обработка этих крыс водным экстрактом листьев C. olitorius за 15 дней до введения NaAsO 2 защищала их сердечную ткань от индуцированной As кардиотоксичности за счет поддержания активности вышеупомянутых ферментов.Этанольный экстракт Boerhavia diffusa (BDE) также защищает миобласты H9c2 от кардиотоксичности, вызванной ATO [130]. В этом исследовании обработка ATO в различных концентрациях (5, 7,5 и 10 мкМ) снижала целостность митохондрий, вызывала стресс ER, нарушала цитоскелетные сети, ингибировала антиоксидантные ферменты и увеличивала как образование ROS, так и нагрузку Ca 2+ . Однако BDE может полностью изменить патофизиологические свойства обработанных ATO клеток при высоких дозах (10 мкМ).
Разработка новых миметиков NEMO-связывающего домена для ингибирования активации IKK / NF-κB
Рис 5.
Миметики NBD избирательно ингибируют каноническую передачу сигналов NF-κB, воздействуя на ассоциацию NEMO с IKKβ.
(A) Анализ Co-IP, обнаруживающий взаимодействие IKKβ / NEMO. Необработанные клетки 264.7 были предварительно обработаны указанными лекарствами, ДМСО, пептидом 8K-NBD (400 мкМ), SR12460 (100 мкМ), SR12343 (100 мкМ), SR12454 (100 мкМ) и SR11481 (100 мкМ) в течение 30 мин, и затем клетки собирали для Co-IP.NEMO использовался как средство контроля загрузки. (B) Необработанные клетки 264,7, предварительно обработанные SR12343 в указанных концентрациях (0, 25, 50, 100 и 150 мкМ) в течение 30 минут, подвергали анализу Co-IP. Затем продукты связывания NEMO анализировали на уровни IKKβ, IKKα, TRAF2 и IκBα (отрицательный контроль), и уровни NEMO использовали в качестве контроля нагрузки (левая панель). Правая панель показывает уровни белков во входных элементах управления (10% клеточного экстракта, используемого для Co-IP). (C) GST-NEMO (15 нМ), предварительно инкубированный с ингибиторами в указанных концентрациях, инкубировали с IKKβ-FLAG (15 нМ) в течение 30 минут при 30 ° C и выделяли с использованием глутатиона аргарозы.Уровни связывания IKKβ-FLAG с GST-NEMO определяли с помощью вестерн-блоттинга с использованием GST-NEMO в качестве контроля загрузки. (D, E) Необработанные клетки 264.7, предварительно обработанные контрольным носителем или SR12343 (150 мкМ) в течение 30 минут, стимулировали с использованием или без 10 нг / мл TNF-α (D) или 1 мкг / мл LPS (E) в течение 10 минут. Лизаты клеток анализировали на активность сигнального пути IKK / NF-κB, включая активацию комплекса IKK, IκBα и p65. GAPDH использовался в качестве контроля загрузки. (F) Необработанные клетки 264.7 инкубировали с контролем-носителем или SR12343 (100 мкМ) в течение 30 минут с последующей стимуляцией анти-LTβR или без него в течение 8 часов.Клеточные лизаты собирали и анализировали на активацию неканонической передачи сигналов NF-κB, обработку p100 на p52. (G, H) Анализ эффектов SR12343 (150 мкМ) на фосфорилирование JNK и p38MAPK в ответ на TNF-α (G) или LPS (H) с использованием того же клеточного лизата, который использовался на панелях D и E. Co -IP, коиммунопреципитация; GST, глутатион-S-трансфераза; IKK, IκB киназа; JNK, N-концевая киназа c-Jun; ЛПС, липополисахарид; LTβR, рецептор β лимфотоксина; MAPK, митоген-активированная протеинкиназа; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB; NF-κB, ядерный фактор κB; TNF, фактор некроза опухоли; TRAF2, фактор 2, связанный с рецептором TNF.
Подробнее »
Разработка новых миметиков NEMO-связывающего домена для ингибирования активации IKK / NF-κB
Abstract
Ядерный фактор κB (NF-κB) является фактором транскрипции, важным для регуляции врожденного и адаптивного иммунитета, клеточной пролиферации, апоптоза и старения. Нарушение регуляции NF-κB и его вышестоящего регулятора киназы IκB (IKK) способствует патогенезу множественных воспалительных и дегенеративных заболеваний, а также рака.Пептид из 11 аминокислот, содержащий существенный модулятор NF-κB (NEMO) -связывающий домен (NBD), происходящий от С-конца β-субъединицы IKK, действует как высокоселективный ингибитор комплекса IKK, нарушая ассоциацию IKKβ. и субъединица IKKγ NEMO. Модель фармакофоров на основе структуры была разработана для идентификации миметиков NBD путем скрининга in silico. Два оптимизированных ведущих миметика NBD, SR12343 и SR12460, ингибировали индуцированную фактором некроза опухоли α (TNF-α) и липополисахарид (LPS) активацию NF-κB, блокируя взаимодействие между IKKβ и NEMO и подавляя LPS-индуцированное острое воспаление легких у мышей. .Хроническое лечение мышечной дистрофии Дюшенна (МДД) на мышах с помощью SR12343 и SR12460 ослабляло воспалительную инфильтрацию, некроз и мышечную дегенерацию, демонстрируя, что эти низкомолекулярные миметики NBD являются потенциальными терапевтическими средствами для воспалительных и дегенеративных заболеваний.
Информация об авторе
Аберрантная повышающая регуляция ядерного фактора транскрипционного фактора κB (NF-κB) и киназы IκB (IKK), которая регулирует NF-κB, связана с различными воспалительными и дегенеративными заболеваниями у людей, включая старение.Таким образом, разработка эффективных и специфических препаратов, способных снижать активность IKK / NF-κB, имеет значительный терапевтический потенциал. В этом исследовании вычислительный подход, основанный на структуре, был использован для скрининга низкомолекулярных ингибиторов белок-белкового взаимодействия между субъединицами IKKß и IKKγ комплекса IKK. Мы идентифицировали и разработали новый класс малых молекул, которые избирательно ингибируют активацию IKK / NF-κB путем диссоциации комплекса IKK, не влияя на передачу сигналов N-концевой киназы c-Jun (JNK) / p38-митоген-активируемой протеинкиназы (MAPK).Эти новые молекулы уменьшают индуцированное липополисахаридом (ЛПС) острое воспаление у мышей и улучшают мышечную патологию на мышиной модели мышечной дистрофии Дюшенна (МДД) mdx , предполагая, что они будут иметь потенциальную клиническую применимость.
Образец цитирования: Zhao J, Zhang L, Mu X, Doebelin C, Nguyen W., Wallace C, et al. (2018) Разработка новых миметиков NEMO-связывающего домена для ингибирования активации IKK / NF-κB. ПЛоС Биол 16 (6): e2004663. https: // doi.org / 10.1371 / journal.pbio.2004663
Академический редактор: Чайтан Хосла, Стэнфордский университет, Соединенные Штаты Америки
Поступила: 30 октября 2017 г .; Дата принятия: 21 мая 2018 г .; Опубликовано: 11 июня 2018 г.
Авторские права: © 2018 Zhao et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его вспомогательных информационных файлах.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Сокращения: 3D, трехмерный; ADME / Tox, Поглощение, распределение, метаболизм, выведение и токсичность; Али, острое повреждение легких; ALP, щелочная фосфатаза; ALT, аланинаминотрансфераза; АСТ, аспартатаминотрансфераза; Бкл-2, В-клеточная лимфома 2; CD68, кластер дифференциации 68; ЦОГ-2, циклооксигеназа 2; DMD, Мышечная дистрофия Дюшенна; EMSA, анализ сдвига электрофоретической подвижности; eMyHC, тяжелая цепь эмбрионального миозина; ГРМД, мышечная дистрофия золотистого ретривера; GST, глутатион S-трансфераза; HEK293, клетки 293 эмбриональной почки человека; я.п., внутрибрюшинный; IC 50 , половина максимальной ингибирующей концентрации; ИКК, Киназа IκB; Ил-1, интерлейкин 1; iNOS, индуцибельная синтаза оксида азота; JNK, c-Jun N-концевую киназу; LPS, липополисахарид; LTβR, рецептор лимфотоксина β; МАПК, митоген-активированная протеинкиназа; MEF, эмбриональный фибробласт мыши; МТТ, Бромид 3- (4,5-диметилтиазол-2-ил) -2,5-дефенилтетразолия; п.д., необнаруживаемый; NBD, НЕМО-связывающий домен; НЕМО, Основной модулятор NF-κB; NF-κB, ядерный фактор κB; NLS, последовательность ядерной локализации; НЕТ, оксид азота; Pax7, парный бокс-белок 7; PDB, Банк данных о белках; п-JNK, фосфо-c-Jun N-концевую киназу; PTD, домен трансдукции белка; ПУМА, модулятор апоптоза с повышенной регуляцией р53; qRT-PCR, количественная полимеразная цепная реакция в реальном времени; Правый руль, Область Rel-гомологии; RMSD, среднеквадратичное отклонение; SAR, взаимосвязь структура – деятельность; SD, среднеквадратичное отклонение; TA, передняя большеберцовая мышца; TCR, Рецептор Т-клеток; TNF-α, фактор некроза опухоли α; TRAF2, Фактор 2, связанный с рецептором TNF
Введение
Ядерный фактор κB (NF-κB) — это фактор транскрипции, необходимый для регуляции иммунных ответов, пролиферации клеток, апоптоза, эмбрионального развития, старения и рака [1].В клетках млекопитающих семейство NF-κB состоит из 5 субъединиц, RelA / p65, RelB, C-Rel, p50 (p105 / NF-κB1) и p52 (p100 / NF-κB2), все из которых содержат Rel-гомологию. домен (RHD), необходимый для гомо- или гетеродимеризации [1]. Димеры NF-κB изолируются в цитоплазме с помощью ингибирующего белка IκBα, который маскирует консервативную последовательность ядерной локализации (NLS) RelA / p65 для предотвращения ядерной транслокации [1]. При стимуляции IκBα претерпевает фосфорилирование, полиубиквитинирование и опосредуемую протеасомами деградацию, высвобождая димеры NF-κB, чтобы сделать возможным ядерную транслокацию [1].Этот активированный NF-κB понижает или регулирует экспрессию целевого гена за счет связывания с энхансером κB или элементами промотора [1]. Индукторы активности NF-κB включают провоспалительные цитокины, такие как фактор некроза опухоли α (TNF-α), интерлейкин-1 (IL-1) и липополисахарид (LPS), а также лиганды Т-клеточного рецептора (TCR). , генотоксический и окислительный стресс [1].
Активация NF-κB регулируется комплексом киназы IκB (IKK), состоящим из 2 каталитических субъединиц, IKKα и IKKβ, и регуляторной субъединицы, эссенциального модулятора NF-κB (NEMO) / IKKγ [2–4].Домены на С-концах IKKα и IKKβ, необходимые для взаимодействия с α-спиральной областью на N-конце NEMO, называются NEMO-связывающими доменами (NBD) [5]. Пептид из 11 аминокислот, полученный из домена NBD IKKβ (аминокислоты 735–745), может нарушать ассоциацию IKKβ и NEMO и снижать активацию NF-κB при слиянии с доменом трансдукции белка (PTD) для внутриклеточной доставки [5] .
Пептид NBD оказывает сильное терапевтическое действие на многочисленные модели воспалительных и дегенеративных заболеваний у мышей и других видов.Хроническое системное введение пептида NBD ослабляет макрофагально-опосредованный некроз и дегенерацию мышц у мышей mdx , мышиной модели мышечной дистрофии Дюшенна (МДД), а также модели МДД у собак с мышечной дистрофией золотистого ретривера (GRMD) [6 –8]. Точно так же пептид NBD облегчает активный хронический колит у мышей с дефицитом IL-10, не влияя на базальную активность NF-κB при системном введении [9]. Внутрисуставная инъекция пептида NBD также ослабляет синовиальное воспаление и тяжесть артрита на крысиной модели адъювантного артрита [10].Он также улучшает индуцированный воспалением остеокластогенез и артрит путем подавления генов-мишеней NF-κB, TNF-α и IL-1β [11]. Системная доставка пептида NBD снижает тяжесть болезни Паркинсона за счет подавления активации нигральных микроглиев и уменьшения потери дофаминергических нейронов, а также уменьшает нефропатию и атеросклероз у мышей с диабетом 1 типа [12–14]. Кроме того, пептид предотвращает индуцированное ЛПС воспаление легких у овец и улучшает легочную функцию на модели острого респираторного дистресс-синдрома у поросят путем местного применения [15, 16].Более того, клинические испытания пептида NBD для местного лечения диффузной крупноклеточной В-клеточной лимфомы у собак выявили снижение пролиферации злокачественных В-клеток [17]. Кроме того, хроническое системное введение пептида NBD задерживает начало и снижает тяжесть множественных симптомов старения и патологии у мышей Ercc1 — / Δ , мышиной модели прогерии человека [18].
Несмотря на эти сильные и разнообразные терапевтические эффекты пептидов PTD-NBD на животных моделях, стоимость синтеза пептида, короткий период полужизни пептида и его отсутствие пероральной биодоступности ограничивают его клиническое применение.Таким образом, разработка малых молекул, которые имитируют пептид NBD, нацеленных на NBD IKKβ, чтобы нарушить его связывание с NEMO, может иметь клиническое применение. В данном случае модель фармакофоров на основе структуры, которая имитирует эти взаимодействия, была получена из кристаллической структуры комплекса IKK с последующим виртуальным скринингом с использованием этой модели в сравнении с коммерчески доступными базами данных молекул, подобных лекарствам. Полученные совпадения были расставлены по приоритету с использованием фильтрации in silico по абсорбции, распределению, метаболизму, экскреции и токсичности (ADME / Tox) и молекулярной стыковке для определения совпадений с более высоким сродством.Используя их в качестве отправных точек, несколько раундов оптимизации медицинской химии привели к открытию соединений, способных ингибировать LPS- и TNF-α-индуцированную активацию NF-κB, нарушая связь между IKKβ и NEMO. Кроме того, эти соединения проявляли сильные терапевтические эффекты на мышиных моделях LPS-индуцированной эндотоксемии и МДД, что указывает на их потенциал в качестве терапевтических препаратов для клинического лечения заболеваний, вызванных активацией IKK / NF-κB.
Результаты
Создание модели фармакофора на основе структуры с использованием вычислительного подхода, основанного на консервативных взаимодействиях между IKKβ и NEMO
Распознавание малых молекул белками в значительной степени опосредовано комплементарностью поверхности молекул [19, 20].Таким образом, сайт белок-белкового взаимодействия между NEMO и IKKβ потенциально является хорошей мишенью для скрининга лекарств in silico. Чтобы исследовать химические особенности, существенные во взаимодействии белок-белок, была использована рентгеновская структура комплекса NEMO / IKKβ, полученная из банка данных по белкам (PDB) (ID 3BRV), для создания фармакофора на основе структуры (рис. 1A). [21] с использованием модуля генерации фармакофоров LigandScout [22, 23]. Каждый взаимодействующий атом от каждого остатка был «переведен» в фармакофорный элемент, в результате чего фармакофор на основе структуры (рис. 1В) состоял из 8 элементов и 13 исключительных объемов, представляющих важные атомы из окружения белка.
Рис. 1. Разработка модели фармакофора на основе структуры для in silico скрининга миметиков NBD.
(A) Взаимодействующие остатки, извлеченные из рентгеновской структуры комплекса NEMO / IKKβ (PDB ID: 3BRV), использованного при создании модели фармакофора на основе структуры [21]. (B) Трехмерное представление модели фармакофоров на основе структуры. Три гидрофобные группы (F2, F4 и F7: желтые сферы), 1 элемент акцептора водородной связи (F3: красная сфера), 1 донор водородной связи (F5: зеленая сфера), 1 положительная ионизируемая область (F8: синяя сфера) Показаны 1 отрицательно ионизируемый (F6: красная сфера) и 13 исключенных объемов (серые сферы).(C) Химические структуры 3 соединений, прошедших биологическое тестирование [24]. 3D, трехмерный; IKK, IκB киназа; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB; PDB, Банк данных белков.
https://doi.org/10.1371/journal.pbio.2004663.g001
Эта фармакофорная модель была использована для скрининга подмножества лекарственного средства набора базы данных ZINC 10.0 (приблизительно 13,5 миллионов соединений) [24]. Мы идентифицировали 161 соединение, которое соответствовало по крайней мере 6 характеристикам из 8 фармакофорной модели.Двадцать совпадений имели среднеквадратичное отклонение (RMSD) <1 и были дополнительно расставлены по приоритету с использованием свойств, предсказанных ADME / Tox. Три соединения успешно прошли эти фильтры (рис. 1С).
Идентификация низкомолекулярных ингибиторов активации NF-κB
Чтобы определить, ингибируют ли малые молекулы, идентифицированные с помощью скрининга in silico, активацию NF-κB, использовали клеточную линию HEK293, стабильно экспрессирующую репортер люциферазы, управляемый синтетическим NF-κB-зависимым промотором [25].Чтобы вызвать активацию NF-κB, клетки обрабатывали 10 нг / мл TNF-α и собирали через 3 часа после обработки для анализа активности люциферазы. Обработка ZINC120 слегка подавляла активацию NF-κB при концентрации 100 мкМ, тогда как активность люциферазы оставалась неизменной в клетках, обработанных ZINC05682974 или ZINC09327678 (фиг. 2A). Чтобы определить, ингибирует ли ZINC120 NF-κB дозозависимым образом, тестировали концентрации при 0, 6,25, 25, 50 и 100 мкМ. Только высокие концентрации (50 и 100 мкМ) соединения были способны значительно ингибировать TNF-α-индуцированную активацию NF-κB (рис. 2B) [25].
Рис. 2. Идентификация малых молекул, ингибирующих TNF-α-индуцированную активацию NF-κB.
(A) Клетки HEK293, стабильно экспрессирующие репортер люциферазы NF-κB, предварительно обрабатывали указанными небольшими молекулами при 100 мкМ в течение 30 минут с последующей стимуляцией TNF-α (10 нг / мл) в течение 3 часов. Активность люциферазы нормализовали для необработанных стимулированных контрольных клеток. Данные показывают средние значения 2 независимых экспериментов +/- SD. (B) Дозозависимый ответ ZINC120 тестировали с помощью анализа люциферазы NF-κB в клетках HEK293.Было проведено три независимых эксперимента, и показанные данные представляют собой среднее значение +/- SD. (C) Клетки HEK293 обрабатывали производными ZINC120 в концентрации 100 мкМ и проводили анализ люциферазы NF-κB для скрининга малых молекул с более сильным ингибирующим эффектом NF-κB. Данные показывают объединенные результаты 5 независимых экспериментов и представляют собой среднее значение +/- SD. (D) Клетки HEK293 культивировали в присутствии 100 мкМ указанных производных в течение 24 часов, и выживание клеток определяли с помощью анализа МТТ. Жизнеспособность клеток рассчитывали путем нормализации к необработанным клеткам.(E) Дозозависимые ингибирующие эффекты определяли для ZINC5 при 0, 25, 50 и 100 мкМ с использованием анализа люциферазы NF-κB. (F) HEK293 культивировали в присутствии ZINC5 в указанных концентрациях в течение 24 часов, и выживаемость клеток оценивали с помощью анализа МТТ. Данные представляют собой среднее значение +/- SD из 4–5 независимых экспериментов. * P <0,05; ** P <0,01; *** P <0,001. Базовые данные можно найти в S1 Data. НЕК293, клетки 293 почки эмбриона человека; МТТ, 3- (4,5-диметилтиазол-2-ил) -2,5-дефенилтетразолийбромид, колориметрический анализ для оценки метаболической активности клеток; NF-κB, ядерный фактор κB; TNF-α; фактор некроза опухоли α; SD, стандартное отклонение.
https://doi.org/10.1371/journal.pbio.2004663.g002
Чтобы идентифицировать миметики NBD с более высокой биологической активностью, чем ZINC120 или пептид NBD, база данных ZINC 10.0 (примерно 13,5 миллионов соединений) была проверена in silico на структурные аналогичные соединения [26]. Было идентифицировано пятнадцать аналогов с показателем сходства> 90%, и 13, прошедшие все фильтры ADME / Tox, были приобретены для тестирования (таблица S1). Четыре соединения — ZINC9642366 (Zinc1), ZINC3369392 (Zinc5), ZINC3269261 (Zinc8) и ZINC3264658 (Zinc9), а также ингибитор активного сайта IKK, IKKi VII, используемый в качестве положительного контроля, — значительно снижали активность NF-κB, в то время как другие аналоги имели минимальные эффекты (рис. 2С).Чтобы исключить возможность того, что снижение, наблюдаемое в анализах люциферазы, было связано с токсичностью лекарственного средства, для оценки жизнеспособности клеток был проведен колориметрический анализ МТТ с использованием 3- (4,5-диметилтиазол-2-ил) -2,5-дефенилтетразолия бромида. Обработка ZINC8 привела к 40% гибели клеток через 24 часа, что позволяет предположить, что по крайней мере часть снижения активности люциферазы может быть отнесена к цитотоксичности (рис. 2D). Поскольку ZINC5 продемонстрировал сильную ингибирующую эффективность NF-κB в культуре клеток с небольшой токсичностью (менее 10%), он был протестирован на дозозависимое ингибирование NF-κB.ZINC5 показал больший ингибирующий эффект по сравнению с ZINC120 без явной клеточной токсичности (рис. 2E и 2F).
Миметики NBD ингибируют активность связывания ДНК NF-κB
Чтобы подтвердить, что миметики NBD снижают активность киназы IKK, фосфорилирование IκBα с помощью IKK в ответ на 10 нг / мл TNF-α измеряли вестерн-блоттингом через 0, 5 и 10 мин после стимуляции. ZINC5 снижал уровень p-IκBα после стимуляции, в то время как ZINC120 приводил к менее устойчивому снижению (рис. 3A).Чтобы определить, снижают ли миметики также активность связывания ДНК NF-κB, был проведен анализ сдвига электрофоретической подвижности (EMSA) как in vitro, так и in vivo. ZINC5 и ZINC120 были протестированы в клетках C2C12 (линия клеток миобластов мыши) при 200 мкМ, и было показано, что они ингибируют TNF-α-индуцированную активность связывания ДНК NF-κB (рис. 3B). Точно так же однократная внутрибрюшинная (i.p.) инъекция любой из этих 2 небольших молекул в дозе 10 мг / кг ингибировала активность связывания ДНК NF-κB в квадрицепсах, которая хронически повышается у мышей mdx (рис. 3C).Однако ZINC5 был крайне нестабильным даже в средах для культивирования клеток, содержащих FBS, тогда как ZINC120 был относительно более стабильным. Добавление ацетонитрила увеличивало стабильность обоих соединений ZINC, особенно ZINC 5 (рис. 3D).
Рис. 3. Две идентифицированные небольшие молекулы снижают активность связывания ДНК NF-κB in vivo и in vitro.
(A) Уровни p-IκBα с обработкой или без лечения в ответ на TNF-α определяли с помощью вестерн-блоттинга. Клетки HEK293 предварительно обрабатывали ДМСО, ZINC120 (100 мкМ) и ZINC5 (100 мкМ) в течение 30 минут с последующей стимуляцией 10 нг / мл TNF-α в течение 0, 5 и 10 минут.Клеточные лизаты готовили для иммуноблоттинга против p-IκBα. GAPDH использовался в качестве контроля загрузки. (B) EMSA-анализ, выявляющий активность связывания ДНК NF-κB, проводили в миобластах C2C12. Клетки предварительно обрабатывали 200 мкМ ДМСО, ZINC120 и ZINC5 в бессывороточной среде в течение 1 часа. Затем добавляли TNF-α до конечной концентрации 10 нг / мл и инкубировали в течение 15 мин. Ядерный экстракт был получен для анализа EMSA. (C) EMSA-анализ, оценивающий активность связывания ДНК NF-κB in vivo, проводили с квадрицепсами мышей mdx.Однократная доза ZINC120 и ZINC5 в дозе 10 мг / кг вводилась внутрибрюшинно. Квадрицепс собирали через 1 и 2 часа после инъекции для анализа EMSA. (D) Динамика фармакокинетики ZINC5 и ZINC120 в среде FBS или среде FBS, содержащей ацетонитрил. Базовые данные можно найти в S1 Data. EMSA, анализ сдвига электрофоретической подвижности; НЕК293, клетки 293 почки эмбриона человека; внутрибрюшинно, внутрибрюшинно; NF-κB, ядерный фактор κB; t 1/2 , период полураспада; TNF-α; фактор некроза опухоли α.
https: // doi.org / 10.1371 / journal.pbio.2004663.g003
Оптимизация миметиков NBD
ZINC5 и ZINC120 оба содержат сложноэфирные связи, что приводит к их быстрой деградации в присутствии сыворотки (рис. 3D). Для повышения биоактивности и стабильности были проведены исследования взаимосвязи структура-активность (SAR), и было синтезировано и протестировано более 100 малых молекул. Были идентифицированы четыре основных миметика NBD, которые продемонстрировали усиленный ингибирующий эффект по сравнению с исходными соединениями ZINC, в том числе 3 неэфира — SR12343, SR12460 и SR12454 — и 1 сложный эфир SR11481 (рис. 4A и 4B).Эти 3 неэфира значительно ингибировали TNF-α-опосредованную активацию NF-κB с половинными максимальными ингибирующими концентрациями (IC 50 ) 11,34 мкМ, 20,24 мкМ и 37,02 мкМ, соответственно (Таблица 1, Фиг.4B и S1A Фиг.). Сложный эфир SR11481 оказался не таким эффективным (IC 50 45,03 мкМ), возможно, из-за присутствия сложноэфирной связи (рис. 4В). Репортер люциферазы renilla котрансфицировали для нормализации. Чтобы определить, ограничивается ли ингибирующее действие миметиков TNF-α-опосредованной индукцией IKK / NF-κB, была исследована LPS-опосредованная активация NF-κB.Активность NF-κB индуцировали в Raw 264.7 с помощью 1 мкг / мл LPS в течение 2 часов, а IKKi VII (2 мкМ) и пептид 8K-NBD (400 мкМ) включали в качестве положительных контролей. Экспрессия генов-мишеней NF-κB циклооксигеназы 2 (COX-2), IL-6, IL-1β, TNF-α, IκBα и индуцибельной синтазы оксида азота (iNOS) определялась количественной полимеразной цепной реакцией в реальном времени (qRT -PCR) анализ. SR12460 и SR12454, которые более похожи по структуре, чем другие 2 миметика, были способны значительно ингибировать транскрипцию всех тестируемых генов-мишеней NF-κB (рис. 4C).SR12343 демонстрировал профиль, аналогичный профилю пептида 8K-NBD, показывая значительное ингибирование экспрессии COX-2, IL-6 и iNOS при гораздо более низкой концентрации (50 мкМ) по сравнению с пептидом NBD (400 мкМ). SR11481 не вызывал заметного подавления генов-мишеней NF-κB, вероятно, из-за его низкой стабильности. IKKi VII, хотя и способен подавлять большую часть экспрессии гена-мишени NF-κB, не смог подавить экспрессию iNOS, которая значительно ингибировалась пептидом NBD и всеми неэфирными миметиками NBD. Это предполагает, что ингибиторы IKK, нацеленные на АТФ-связывающий карман, вероятно, подавляют экспрессию немного другого набора регулируемых NF-κB генов.
Рис. 4. Модифицированные свинцовые миметики NBD ингибируют TNF- и LPS-индуцированную активацию NF-κB, нарушая связь между NEMO и IKKβ.
(A) Структуры топовых миметиков NBD. (B) Измерение активации NF-κB в ответ на TNF-α с использованием двойных анализов репортера люциферазы. Клетки HEK293, котрансфицированные репортером люциферазы NF-κB и плазмидами SV40-Renilla, предварительно обрабатывали ДМСО или перечисленными небольшими молекулами при 0, 25, 50, 100 и 150 мкМ в течение 30 минут с последующей индукцией TNF-α в течение 3 часов.Приведенные данные являются репрезентативными для 2–3 независимых экспериментов. (C) Миметики NBD подавляли экспрессию генов-мишеней NF-κB в ответ на LPS. Необработанные клетки 264.7 предварительно обрабатывали указанными лекарствами в течение 30 минут, а затем стимулировали 1 мкг / мл LPS в течение 2 часов. Затем клетки собирали для выделения РНК и анализа qRT-PCR. Используемые концентрации лекарственного средства следующие: IKKi VII (2 мкМ), пептид 8K-NBD (200 мкМ), SR12343 (50 мкМ), SR12460 (50 мкМ), SR12454 (50 мкМ) и SR11481 (50 мкМ). Данные представляют 2 независимых эксперимента.(D) Продукция мышиного IL-6, индуцированная LPS, подавлялась миметиками NBD. Необработанные клетки 264,7, предварительно обработанные ДМСО или лекарствами в указанных концентрациях, подвергали воздействию 1 мкг / мл LPS в течение 24 часов, и супернатант собирали для анализа ELISA на мышиный IL-6. * P <0,05; ** P <0,01. Базовые данные можно найти в S1 Data. НЕК293, клетки 293 почки эмбриона человека; IKK, IκB киназа; ИЛ-6, интерлейкин 6; ЛПС, липополисахарид; NBD, NEMO-связывающий домен; н.о., не обнаруживается; NEMO, существенный модулятор NF-κB; NF-κB, ядерный фактор κB; qRT-PCR, качественная полимеразная цепная реакция в реальном времени; TNF-α; фактор некроза опухоли α.
https://doi.org/10.1371/journal.pbio.2004663.g004
Таблица 1. IC 50 миметиков NBD.
Ингибирующие эффекты миметиков NBD на активацию NF-κB измеряли с помощью люциферазных анализов при нескольких концентрациях: 0, 25, 50, 100 и 150 мкМ. IC 50 миметиков NBD определяли на основе зависимой от дозы кривой с использованием GraphPad.
https://doi.org/10.1371/journal.pbio.2004663.t001
Для подтверждения результатов qRT-PCR, уровни продукции IL-6 в Raw 264.7 клеток, активированных LPS, анализировали с помощью ELISA. SR12460 и SR12454 были способны значительно ингибировать секрецию IL-6 дозозависимым образом (рис. 4D). Точно так же SR12343 ингибировал продукцию IL-6, но был не так эффективен, как SR12460 и SR12454, что согласуется с его более высоким IC 50 в клетках HEK293. Хотя SR11481 не смог значительно ингибировать IL-6 на уровне мРНК, наблюдалось значительное снижение накопления белка IL-6 через 24 часа. Более того, SR11481, по-видимому, более эффективен при более низкой концентрации 25 мкМ по сравнению с 50 мкМ.
Миметики NBD нацелены на взаимодействие NEMO / IKKß, чтобы ингибировать передачу сигналов NF-κB
Чтобы определить, нацелены ли новые миметики NBD на взаимодействие NEMO-IKKβ in vivo, проводили коиммунопреципитацию с использованием экстрактов из макрофагов Raw 264.7 (фиг. 5A). Все 4 миметика уменьшают взаимодействие IKKβ-NEMO так же или лучше, чем пептид NBD, причем SR12343 является наиболее эффективным. SR12343 также уменьшал ассоциацию между NEMO и IKKβ в клетках Raw 264.7 дозозависимым образом (фиг. 5B).В этих условиях не наблюдалось взаимодействия между NEMO и фактором 2, связанным с рецептором TNF (TRAF2) или IκBα. Предыдущие исследования показали, что пептид NBD также ингибирует взаимодействие NEMO с IKKα [27]. Однако SR12343 оказывал лишь незначительное влияние на связывание NEMO / IKKα только в наивысшей дозе, предполагая, что эти ингибиторы влияют на взаимодействие NEMO / IKKα с гораздо меньшей эффективностью (рис. 5B). Чтобы продемонстрировать, что SR12343, который был наиболее эффективным миметиком в нарушении взаимодействия NEMO / IKKβ in vivo, непосредственно влияет на взаимодействие NEMO / IKKβ, были проведены исследования in vitro с использованием глутатион-S-трансферазы (GST) с использованием рекомбинантного GST-NEMO и ФЛАГ-IKKβ.Как показано на фиг. 5C, SR12343 был способен нарушить взаимодействие между GST-NEMO и FLAG-IKKβ даже при дозе 12,5 мкМ. Чтобы продемонстрировать, что снижение NF-κB-опосредованной транскрипции при стимуляции TNF-α и LPS (рис. 4) не связано с эффектами вне мишени, активацией сигнального пути NF-κB и путей митоген-активируемой протеинкиназы (MAPK). был исследован методом вестерн-блоттинга. Уровни фосфорилированного комплекса IKK, IκBα и p65 в ответ на TNF-α и LPS были снижены SR12343 (рис. 5D и 5E).Соответственно, деградация IκBα была частично снижена (рис. 5D и 5E). Однако не было изменений в уровнях N-концевой киназы фосфо-c-Jun (p-JNK), p-p38MAPK, общего JNK и p38MAPK при обработке SR12343 (150 мкМ) в ответ на TNF-α или LPS. стимуляция (рис. 5G и 5H). Эти результаты предполагают, что наблюдаемые ингибирующие эффекты SR12343 опосредуются непосредственно через IKK / NF-κB, но не из-за нецелевых эффектов, таких как пути JNK или p38MAPK. Обработка SR12343 также не оказывала влияния на активацию неканонического пути NF-κB рецептором против лимфотоксина β (LTβR), как показано неизмененным процессингом от p100 до p52 (фиг. 5F).
Рис. 5. Миметики NBD избирательно ингибируют каноническую передачу сигналов NF-κB, воздействуя на ассоциацию NEMO с IKKβ.
(A) Анализ Co-IP, обнаруживающий взаимодействие IKKβ / NEMO. Необработанные клетки 264.7 были предварительно обработаны указанными лекарствами, ДМСО, пептидом 8K-NBD (400 мкМ), SR12460 (100 мкМ), SR12343 (100 мкМ), SR12454 (100 мкМ) и SR11481 (100 мкМ) в течение 30 мин, и затем клетки собирали для Co-IP. NEMO использовался как средство контроля загрузки. (B) Необработанные клетки 264,7, предварительно обработанные SR12343 в указанных концентрациях (0, 25, 50, 100 и 150 мкМ) в течение 30 минут, подвергали анализу Co-IP.Затем продукты связывания NEMO анализировали на уровни IKKβ, IKKα, TRAF2 и IκBα (отрицательный контроль), и уровни NEMO использовали в качестве контроля нагрузки (левая панель). Правая панель показывает уровни белков во входных элементах управления (10% клеточного экстракта, используемого для Co-IP). (C) GST-NEMO (15 нМ), предварительно инкубированный с ингибиторами в указанных концентрациях, инкубировали с IKKβ-FLAG (15 нМ) в течение 30 минут при 30 ° C и выделяли с использованием глутатиона аргарозы. Уровни связывания IKKβ-FLAG с GST-NEMO определяли с помощью вестерн-блоттинга с использованием GST-NEMO в качестве контроля загрузки.(D, E) Необработанные клетки 264.7, предварительно обработанные контрольным носителем или SR12343 (150 мкМ) в течение 30 минут, стимулировали с использованием или без 10 нг / мл TNF-α (D) или 1 мкг / мл LPS (E) в течение 10 минут. Лизаты клеток анализировали на активность сигнального пути IKK / NF-κB, включая активацию комплекса IKK, IκBα и p65. GAPDH использовался в качестве контроля загрузки. (F) Необработанные клетки 264.7 инкубировали с контролем-носителем или SR12343 (100 мкМ) в течение 30 минут с последующей стимуляцией анти-LTβR или без него в течение 8 часов. Клеточные лизаты собирали и анализировали на активацию неканонической передачи сигналов NF-κB, обработку p100 на p52.(G, H) Анализ эффектов SR12343 (150 мкМ) на фосфорилирование JNK и p38MAPK в ответ на TNF-α (G) или LPS (H) с использованием того же клеточного лизата, который использовался на панелях D и E. Co -IP, коиммунопреципитация; GST, глутатион-S-трансфераза; IKK, IκB киназа; JNK, N-концевая киназа c-Jun; ЛПС, липополисахарид; LTβR, рецептор β лимфотоксина; MAPK, митоген-активированная протеинкиназа; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB; NF-κB, ядерный фактор κB; TNF, фактор некроза опухоли; TRAF2, фактор 2, связанный с рецептором TNF.
https://doi.org/10.1371/journal.pbio.2004663.g005
Новые миметики NBD подавляют LPS-индуцированное острое воспаление легких in vivo
Для определения стабильности миметиков NBD in vivo их уровни измеряли в плазме мышей через 2 ч после внутрибрюшинного введения. инъекция 10 мг / кг каждого соединения. Концентрация SR12460 была очень высокой в плазме (> 6,5 мкг / мл; 20 мкМ), тогда как уровни в мозге, мышцах, селезенке и печени были ниже. SR12343 и SR12454 имели более низкие концентрации в плазме, при этом SR12343 показал более высокий уровень в печени, а SR12454 показал более высокие концентрации в мышцах и селезенке.Уровень SR11481 не определялся в плазме и тканях (рис. 6А). Поскольку SR12454 и SR12460 имеют сходные химические структуры, а SR11481 демонстрирует плохое воздействие in vivo, SR12460 и SR12343 были выбраны для дальнейшего анализа in vivo. Однако важно отметить, что SR12343 не был таким перорально активным, как SR123460 (S1B фиг.).
Рис. 6. Недавно идентифицированные миметики NBD подавляют LPS-индуцированное острое воспаление in vivo.
(A) Свойство биодоступности SR12460, SR12343, SR12454 и SR11481.Концентрации миметиков NBD определяли в плазме, мозге, мышцах, селезенке и печени через 2 часа после однократного внутрибрюшинного введения. введение 10 мг / кг препаратов; n = 3 на группу. (B) Показана модель для индукции LPS-опосредованного острого воспаления и схема лечения миметиками NBD. Изображение мыши через http://www.clker.com/clipart-mice-blank.html (без авторских прав). (C) Миметики NBD подавляли LPS-индуцированное острое воспаление в печени и легких путем подавления экспрессии гена-мишени NF-κB. Носитель, SR12343, SR12460 и пептид 8K-NBD вводили в дозе 10 мг / кг за 30 мин до обработки LPS.Острое воспаление вызывали внутрибрюшинным введением. инъекция 10 мг / кг ЛПС. Легкие и печень собирали через 2–4 часа после инъекции, и мРНК экстрагировали для анализа qRT-PCR. (D, E) Вестерн-блоттинг был проведен для проверки экспрессии p-IκBα и COX-2 на уровне белка в тканях печени и легких. (F) Уровни IL-6 в сыворотке определяли с помощью ELISA. n = 3–8 в каждой группе. * P <0,05, ** P <0,01. Базовые данные можно найти в S1 Data. ЦОГ-2, циклооксигеназа 2; ИЛ-6, интерлейкин 6; я.п., внутрибрюшинно; ЛПС, липополисахарид; NBD, NEMO-связывающий домен; н.о., не обнаруживается; NEMO, существенный модулятор NF-κB; NF-κB, ядерный фактор κB; qRT-PCR, количественная полимеразная цепная реакция в реальном времени.
https://doi.org/10.1371/journal.pbio.2004663.g006
Чтобы определить их ингибирующие эффекты NF-κB in vivo, SR12343 и SR12460 были протестированы на острой модели системной эндотоксемии, вызванной LPS. Мышей C57BL / 6J предварительно обрабатывали контрольным носителем, пептидом 8K-NBD или миметиками NBD в дозе 10 мг / кг в течение 30 минут с последующей индукцией LPS в дозе 10 мг / кг (фиг. 6B).Легкие и печень собирали через 2–4 часа после обработки для анализа генов-мишеней NF-κB с помощью qRT-PCR. SR12343 был способен значительно ингибировать транскрипционную активность NF-κB в легких, что продемонстрировано ингибированием iNOS, IκBα, COX-2 и IL-6, в то время как экспрессия TNF-α не изменилась (рис. 6C). Эффекты соединений по ингибированию NF-κB были менее эффективными в печени по сравнению с легкими, что продемонстрировано значительным ингибированием только экспрессии COX-2 (фиг. 6C). Несмотря на более низкие концентрации SR12343 в плазме и тканях по сравнению с SR12460, его ингибирование NF-κB / IKK в печени и легких было больше, чем у SR12460 (рис. 6C).Точно так же неотложное лечение SR12343 также влияло на индуцированную LPS экспрессию генов-мишеней NF-κB на уровне белка. Степень фосфорилирования IκBα и уровни ЦОГ-2 были снижены в тканях легких и печени, обработанных SR12343 (рис. 6D и 6E). Уровни IL-6 в сыворотке, обнаруженные с помощью ELISA, значительно увеличились после индукции LPS и были снижены при неотложном лечении SR12343 (фиг. 6F). Эти результаты согласуются с нашим анализом RT-PCR, показанным на фиг. 6C. Однако никаких существенных различий в гистопатологии легких не наблюдалось.Наконец, наблюдалось небольшое снижение количества лейкоцитов и нейтрофилов в группе, получавшей SR12343 (таблица 2). Взятые вместе, результаты демонстрируют, что SR12343 и SR12460 эффективны при ослаблении LPS-индуцированного острого воспаления легких путем подавления экспрессии гена-мишени NF-κB.
Новые миметики NBD уменьшают некроз и мышечную дегенерацию у мышей MDX
Поскольку SR12343 и SR12460 снижали LPS-индуцированную активацию NF-κB in vivo, они были дополнительно протестированы на мышах mdx , мышиной модели DMD, у которой NF-κB активирован хронически [28].Мыши Mdx развиваются нормально при рождении и претерпевают массивный мионекроз, начиная с 3 недель. Лечение мышей mdx ингибиторами IKK / NF-κB эффективно уменьшает воспаление, блокирует некроз и увеличивает регенерацию мышц. Первоначально влияние экстренного лечения SR12343 на активность связывания ДНК NF-κB в передней большеберцовой мышце (TA) у мышей mdx в возрасте 9 недель исследовали с помощью EMSA. Обработка однократной инъекцией 30 мг / кг SR12343 приводила к снижению связывания ДНК NF-κB через 2 часа после инъекции (S4C фиг.).Впоследствии мышей Mdx хронически лечили носителем, SR12343 (30 мг / кг), SR12460 (30 мг / кг) или 8K-NBD (10 мг / кг), начиная с 21 дня, 3 раза в неделю в течение 4 недель. , аналогично режиму дозирования, используемому с пептидом NBD (рис. 7A) [7]. Не наблюдалось значительной потери веса у мышей mdx , подвергавшихся хроническому лечению (фиг. S3A). Кроме того, не наблюдалось повышения уровней аспартатаминотрансферазы (AST), аланинаминотрансферазы (ALT) или щелочной фосфатазы (ALP) у мышей mdx , подвергавшихся хроническому лечению (рис. S3B), что позволяет предположить, что лечение SR12343 и SR12460 не имело явных проявлений. печеночная токсичность.
Рис. 7. Миметики NBD улучшают мышечную патологию и силу хвата у мышей MDX.
(A) Показана схема лечения миметиками NBD у мышей mdx. (B) Окрашивание гематоксилином-эозином мышцы ТА у 7-недельных мышей MDX, получавших лечение или не получавших лечения. Изображения были получены при увеличении 20 ×. Репрезентативные изображения были показаны для каждой группы лечения. (C) Количественное определение процента площади, демонстрирующей некроз или инфильтрацию, с использованием изображения J. (D) qRT-PCR анализ eMyHC и Pax7 в мышце TA.(E) ТА-мышца от 7-недельных мышей MDX, подвергнутых лечению или необработанных, была окрашена ламинином с помощью ИГХ для определения миофибрилл. Слева были показаны общие изображения ТА-мышцы, а с правой стороны — изображения вставной панели. (F) Количественное определение минимального диаметра Ферета в миофибриллах с центральным и нецентральным ядром. (G) Сила передних конечностей, определяемая тестом на силу захвата. Пятинедельных (2 недели после лечения) и 7-недельных (4 недели после лечения) мышей mdx, подвергнутых лечению или не получавших лечения, тестировали на силу захвата передними конечностями.Было проведено пять последовательных тестов, и сила была нормализована по массе тела. Данные представлены как среднее +/- SEM. Используемые дозировки следующие: SR12343 (30 мг / кг), SR12460 (30 мг / кг) и пептид 8K-NBD (10 мг / кг). n = 6–7 в каждой группе. * P <0,05, ** P <0,01. Базовые данные можно найти в S1 Data. eMyHC, тяжелая цепь эмбрионального миозина; ИГХ, иммуногистохимия; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB; Pax7, парный бокс-белок 7; qRT-PCR, количественная полимеразная цепная реакция в реальном времени; TA, tibialis anterior.
https://doi.org/10.1371/journal.pbio.2004663.g007
Чтобы определить, улучшают ли SR12343 и SR12460 мышечную патологию, мышцу ТА окрашивали гематоксилин-эозином для оценки воспалительной инфильтрации, некроза, центрального зародышеобразования и фиброза. Мышцы ТА, обработанные носителем, демонстрировали обширную инфильтрацию и некроз, что отражалось скоплениями воспалительных клеток, дезорганизованными миофибриллами и неравномерным окрашиванием с ограниченной регенерацией мышц. В соответствии с предыдущими исследованиями, лечение пептидом 8K-NBD уменьшало инфильтрацию и некроз воспалительных клеток, как показано на фиг. 7B и 7C, при этом не оказывая значительного влияния на процент централизованных миоядер (фиг. S4A) [29, 30].Лечение SR12343 привело к наиболее значительному патологическому улучшению, представленному ограниченной инфильтрацией и усиленной реконструкцией мышц (Рис. 7B и 7C и S4B Рис.). Точно так же лечение SR12460 улучшило мышечную патологию, хотя и не так эффективно, как SR12343. Кроме того, было проведено окрашивание трихромом по Массону для дальнейшего измерения мышечного фиброза. Хроническое лечение SR12343 уменьшало мышечный фиброз (синий) в диафрагме и мышечных тканях TA по сравнению с контрольной группой (рис. 8A и 8B).Для дальнейшего количественного определения степени воспаления в мышечной ткани mdx диафрагму и мышцу ТА иммуноокрашивали на кластер дифференцировки 68 (CD68), маркер макрофагов. Обработка SR12343 уменьшала количество клеток CD68 + почти на 50% на миофибриллу как в диафрагме, так и в тканях ТА (рис. 8A и 8B). Примечательно, что существует более высокий уровень инфильтрации макрофагами в диафрагме по сравнению с ТА, о чем свидетельствует большее количество клеток CD68 + на миофибрилло.Этот результат согласуется с окрашиванием трихромом, при котором диафрагма проявляла более тяжелый мышечный фиброз по сравнению с ТА. Более того, анализ qRT-PCR выявил значительное улучшение регенерации миофибрилл в ТА-мышце, обработанной SR12343, по сравнению с контрольными носителями, о чем свидетельствует повышенная экспрессия тяжелой цепи эмбрионального миозина (eMyHC), а также парного боксового белка 7 (Pax7), маркера скелетных тканей. мышечные сателлитные клетки (рис. 7D). SR12460 и пептид 8K-NBD также увеличивали экспрессию eMyHC, но в меньшей степени, чем SR12343.Чтобы оценить средний размер волокна непредвзято, мышцу ТА окрашивали ламинином, чтобы очертить миофибриллы, и определяли диаметр всех миоцитов по Ферету на всем срезе мышцы. Размер волокон центрально и нецентрально ядерных миофибрилл был меньше у мышей, получавших SR12343 и пептид 8K-NBD, что свидетельствует об активной реконструкции миофибрилл во время регенеративной фазы (рис. 7E и 7F).
Рис. 8. Хроническое лечение миметиками NBD снижает мышечный фиброз за счет уменьшения инфильтрации макрофагов у мышей mdx .
(A, B) Окрашивание трихромом и CD68 (A) диафрагмы и (B) TA-мышцы у 7-недельных мышей mdx, получавших или не леченных SR12343. CD68 (красный): маркер тканевого макрофага; утрофин (зеленый): краситель для миофибрилл; DAPI (синий): ядра. Изображения трихрома были получены при увеличении 4 × для TA и 10 × для диафрагмы. Изображения IHC были получены при 10 × для TA и 20 × для диафрагмы. Репрезентативные изображения были показаны для каждой группы лечения. Данные представлены как среднее +/- SEM. * P <0,05; ** P <0.01; *** P <0,001. Базовые данные можно найти в S1 Data. CD68, кластер дифференцировки 68; ИГХ, иммуногистохимия; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB; TA, tibialis anterior.
https://doi.org/10.1371/journal.pbio.2004663.g008
Чтобы определить, улучшают ли миметики NBD мышечную силу, через 2 и 4 недели после лечения измеряли силу захвата для оценки силы передних конечностей (рис. 7G). По сравнению с группой носителя SR12343 значительно улучшил силу передних конечностей после 2 недель лечения, что указывает на быстрое восстановление мышц.Все экспериментальные группы, по сравнению с контролем, показали значительно усиленную силу передних конечностей через 4 недели после лечения (рис. 7G). В совокупности два основных соединения — SR12460 и, в частности, SR12343 — заметно улучшили мышечную функцию и мышечную патологию у мышей mdx .
Обсуждение
Пептид NBD, полученный из NBD в IKKβ, обладает высокими терапевтическими свойствами на многочисленных моделях воспалительных и дегенеративных заболеваний у мышей и собак [6–9, 12, 13, 17, 18]. Фактически, пептид NBD гораздо более эффективен в качестве терапевтического средства, чем низкомолекулярные ингибиторы активного центра киназы IKKβ.Однако синтез пептида NBD в больших масштабах может быть проблематичным и чрезвычайно дорогостоящим, что препятствует его клиническому применению для людей, которым требуется большая доза по сравнению с грызунами и собаками. Кроме того, пептид NBD не является активным при пероральном введении. Таким образом, разработка низкомолекулярных миметиков NBD представляет собой значительный прогресс в направлении клинической трансляции этой установленной молекулярной мишени. Здесь мы идентифицировали и оптимизировали несколько новых миметиков NBD, которые избирательно ингибировали активацию IKK / NF-κB.Два основных соединения, SR12343 и SR12460, ингибировали как TNF-α-, так и LPS-индуцированную активацию NF-κB более эффективно и в более низкой концентрации, чем пептид NBD, как в клетках HEK293, так и в Raw 264.7.
Для идентификации миметиков NBD использовалась кампания компьютерного скрининга, основанная на фармакофорной модели [21]. Эта основанная на структуре модель фармакофора была успешно использована для идентификации низкомолекулярных ингибиторов p53-модулятора апоптоза (PUMA), нацеленных на его связывание с членами семейства B-клеточной лимфомы 2 (Bcl-2) через домен Bh4 [31] .Исследование кристаллической структуры взаимодействия NBD-IKKβ продемонстрировало, что аминокислотные остатки W741, W739 и F734 являются важными гидрофобными мотивами IKKβ для динамического взаимодействия с NEMO [21]. Кроме того, всесторонний анализ горячих точек энергии связывания выявил 3 области, критические для интерфейса межбелкового взаимодействия между NEMO и IKKβ: задокументированные области NBD (W739, W741 и L742) и 2 новые области горячих точек с центром на остатках IKKβ L708 / V709 и L719 / I723 [32]. Соответственно, мутантный 11-мерный пептид NBD (735-745) — с заменами аргинина на W741 и W739 — был неспособен связываться с NEMO [27].Более длинный пептид, производный от IKKβ (701-746), содержащий все 3 остатка и домена, проявлял самое сильное сродство к NEMO, с IC 50 около 10 нМ, по сравнению с традиционным 11-мерным пептидом NBD, который был менее активным, с IC 50 около 100 мкМ [21, 32–34].
Чтобы идентифицировать миметики NBD с большей биологической активностью, F734, не содержащийся в 11-аминокислотном пептиде NBD, был включен в нашу фармакофорную модель и скрининг in silico. Новые идентифицированные и оптимизированные миметики NBD были способны ингибировать активность NF-κB дозозависимым образом (IC 50 приблизительно 10-40 мкМ) и были более эффективными, чем 11-мерный пептид NBD [21, 33].Эти результаты согласуются с другими результатами, предполагающими, что, хотя IKKβ 737–742 является основным компонентом, необходимым для образования комплекса IKK, более крупная область, охватывающая IKKβ 701–746 , увеличивает аффинность связывания между IKKβ и NEMO [32, 34, 35].
Идентифицированный и оптимизированный миметик NBD SR12343 был способен диссоциировать комплексы NEMO / IKKβ как in vitro, так и in vivo (рис. 5), что согласуется с предыдущими сообщениями о том, что пептид NBD блокирует ассоциацию предварительно сформированных комплексов IKK в неактивном состоянии [27, 33] .Кроме того, хотя сообщалось, что пептид NBD блокирует взаимодействие NEMO с IKKα и снижает индуцированную IL-1 IKKα-зависимую активацию NF-κB в эмбриональных фибробластах мыши (MEF) [27, 36], SR12343 нарушает связывание NEMO а IKKα гораздо менее эффективен. Эта специфичность для NEMO / IKKβ может быть связана с тем, что в IKKα в положении 734 присутствует метионин вместо фенилаланина, тогда как F734 вместе с W739 и W741 был включен для создания модели фармакофоров. Наши результаты также продемонстрировали, что SR12343 подавлял TNF-α- и LPS-индуцированную активность NF-κB путем ингибирования фосфорилирования IKK, IκBα и p65, не влияя при этом на передачу сигналов JNK и p38MAPK (рис. 5).По-видимому, SR12343 имеет более существенное ингибирование LPS-индуцированной активации NF-κB по сравнению со стимуляцией TNF-α. Возможно, это связано с более сильной вторичной активацией NF-κB при стимуляции TNF-α за счет активации экспрессии множества провоспалительных факторов. Передача сигналов MAPK может стимулироваться подобными провоспалительными факторами, такими как TNF-α и LPS, увеличивая экспрессию провоспалительных генов через AP-1 и NFAT [1, 37]. Кроме того, SR12343 не влияет на передачу сигналов неканонического пути NF-κB через LTβR (рис. 5F).
МиметикиNBD ингибировали уникальную подгруппу генов-мишеней по сравнению с ингибиторами киназы IKK, особенно iNOS, как in vitro, так и in vivo. Экспрессия iNOS в ответ на LPS может быть снижена в 6 раз в клетках Raw 264.7 и на 50% как в легких, так и в печени путем обработки мышей миметиками NBD. iNOS участвует в метаболизме аргинина, что приводит к выработке цитруллина и оксида азота (NO), последний из которых, действуя как свободный радикал, способствует цитотоксичности и повреждению тканей [38].У мышей iNOS-null mdx значительно снизился цитолиз макрофагов и уменьшилось повреждение миофибрилл как в острой, некротической фазе (4 недели), так и в фазе регенерации (6–12 недель), что предполагает критическую роль NO-опосредованного мионекроза в патологии mdx мышей [38]. Мы продемонстрировали снижение некроза, фиброза и воспалительной инфильтрации как в диафрагме, так и в ТА-мышце у обработанных мышей mdx , в частности, мышей mdx , получавших SR12343, по сравнению с контрольной группой.Также, как и у мышей mdx , получавших пептид NBD, обработка миметиками NBD, в частности SR12343, приводила к усилению миогенеза, о чем свидетельствует более высокая экспрессия eMyHC и Pax7 и меньший размер центрально-ядерных волокон (рис. 6). Это согласуется с наблюдаемой способностью NF-κB регулировать дифференцировку клеток посредством регуляции транскрипции циклина D1 [39]. Взятые вместе, наши результаты показывают, что низкомолекулярные миметики NBD могут одновременно ингибировать провоспалительные реакции, снижать цитотоксичность макрофагов и улучшать дегенерацию мышц с даже большей эффективностью, чем пептид NBD.На основании клинического химического анализа сыворотки явных признаков токсического действия на печень у мышей, подвергшихся хроническому лечению, не наблюдалось.
Ранее мы продемонстрировали, что хроническое лечение модели ускоренного старения на мышах Ercc1 — / Δ пептидом NBD задерживало появление многочисленных возрастных симптомов, улучшало патологию и уменьшало клеточное старение. Как и в случае с пептидом NBD, предварительные эксперименты предполагают, что хроническое лечение мышей Ercc1 — / Δ с помощью SR12343 привело к увеличению периода здоровья.Таким образом, эти новые миметики NBD могут использоваться не только для лечения воспалительных и дегенеративных заболеваний, но и для лечения старения.
В совокупности наши данные демонстрируют, что новые низкомолекулярные миметики NBD являются мощными и высокоселективными ингибиторами IKK, которые действуют, нарушая ассоциацию комплексов IKK. Они проявляют значительный ингибирующий эффект на активацию NF-κB в модели LPS-индуцированного острого повреждения легких (ALI) и мышиной модели DMD ( mdx мышей), что свидетельствует о потенциале миметиков NBD стать отдельным классом анти- противовоспалительные препараты.Взятые вместе, миметики NBD могут иметь терапевтическую ценность для лечения хронических воспалительных заболеваний и рака в будущем.
Методы
Заявление об этике
Исследования на животных были рассмотрены и одобрены Комитетом по уходу и использованию животных Скриппса Флориды (протоколы № 15–017 и 15–020) и соответствовали Руководству США HHS по уходу и использованию лабораторных животных. Ежедневный уход за животными осуществлялся Научно-исследовательским центром животных Флориды Скриппса.У Скриппса Флорида есть Гарантия благополучия животных, находящаяся в досье в Управлении защиты лабораторных животных (OLAW), Национальных институтов здравоохранения. Номер гарантии — # A4460-01, действует с 30 января 2009 г. Регистрация Scripps Florida в соответствии с правилами USDA — это сертификат 93-R0015, действующий 5 декабря 2005 г. Ассоциация и аккредитация Международной организации по уходу за лабораторными животными (AAALAC) предоставила Scripps Florida полную аккредитацию. 25 июня 2008 г., а продолжение было присуждено 9 ноября 2011 г.Мышей умерщвляли в возрасте 7 недель вдыханием диоксида углерода.
Клетки и мыши
КлеткиHEK293 и MEF выращивали в среде Игла, модифицированной Дульбекко (с 4,5 г / л глюкозы и L-глутамина), с добавлением 10% фетальной бычьей сыворотки, пенициллина и стрептомицина. Необработанные клетки 264,7 культивировали в среде RPMI-1640, содержащей 10% инактивированной нагреванием фетальной бычьей сыворотки, пенициллин и стрептомицин. C57BL / 10ScSn- Dmd mdx / J и самки мышей C57BL / 6 были приобретены в лаборатории Джексона.Мышей содержали в помещениях для животных Scripps Florida при постоянной температуре и влажности. Протоколы на животных, использованные в этом исследовании, были одобрены Комитетом по уходу и использованию животных Скриппса Флориды. Мышам mdx соответствующего пола трехнедельного возраста вводили дозы SR12343 (30 мг / кг), SR12460 (30 мг / кг), пептид 8K-NBD (10 мг / кг) или носитель путем внутрибрюшинного введения. инъекции 3 раза в неделю в течение 4 недель. Мышей умерщвляли в возрасте 7 недель путем вдыхания двуокиси углерода и собирали ТА-мышцы для гистологического анализа.
Пептид 8K-NBD и малые молекулы
Пептид8K-NBD (KKKKKKKKGGTALDWSWLQTE) был синтезирован на установке пептидного ядра Университета Питтсбурга. Для i.p. инъекции пептид растворяли в 10% ДМСО в PBS. Миметики NBD были приготовлены в соотношении 10:10:80 ДМСО: Твин 80: вода для введения in vivo. Небольшие молекулы ЦИНК были приобретены у Enamine. Все исходные растворы для экспериментов in vitro готовили в ДМСО при 40 мкМ.
Острое воспаление легких, индуцированное ЛПС
LPS (штамм O111: B4) получали в PBS в сублетальной дозе 10 мг / кг.Самкам мышей WT в возрасте 8-10 недель (20-30 г) вводили внутрибрюшинную дозу. инъекция носителя, пептида NBD (10 мг / кг) или малых молекул (10 мг / кг) в течение 30 мин с последующим внутрибрюшинным введением. инъекция физиологического раствора (1 мл / кг) или ЛПС (10 мг / кг). Мышей умерщвляли через 2-4 часа после обработки, и ткани легких и печени собирали для дальнейшего анализа.
Анализ функциональной силы захвата
У обработанных или необработанных мышей mdx в возрасте семи недель измеряли силу захвата передними конечностями с помощью цифрового измерителя силы захвата в паре с металлической сеткой (Bioseb, Vitrolles, Франция).Мышам позволяли крепко держаться за металлическую сетку, и показания получали, осторожно оттягивая хвост назад до освобождения. Было проведено пять последовательных измерений и рассчитана средняя сила.
Анализ люциферазы светлячков
клеток HEK293, стабильно трансфицированных люциферазной репортерной плазмидой, управляемой NF-κB, высевали в 96-луночные планшеты в трех повторностях и предварительно обрабатывали ДМСО или различными небольшими молекулами при указанной концентрации в течение 30 минут с последующей стимуляцией 10 нг / мл TNF- α в течение 3 ч [25].Клетки один раз промывали PBS и собирали в буфере для пассивного лизиса (Promega, Madison, WI). Анализ люциферазы (Promega) выполняли с использованием люминометра в соответствии с инструкциями производителя.
Двойной репортерный анализ люциферазы
клеток HEK293, выращенных в 10-сантиметровых планшетах, котрансфицировали с помощью корепортера плазмиды Renilla, управляемой SV40 (Promega), и плазмиды люциферазы светлячка, управляемой NF-κB в соотношении 1: 3, с липофектамином 2000 (Invitrogen, Карлсбад, Калифорния). .Кратковременно трансфицированные клетки HEK293 выращивали и обрабатывали, как описано выше, и подвергали двойному люциферазному репортерному анализу в соответствии с инструкциями производителя. Вкратце, активность люциферазы светлячка NF-κB и люциферазы Renilla определяли последовательно. Относительную активность люциферазы рассчитывали путем нормализации люциферазы NF-κB к активности люциферазы Renilla.
Анализ МТТ
клеток HEK293 выращивали в 96-луночном планшете при 3 × 10 4 клеток / лунку в трех экземплярах и обрабатывали ДМСО или перечисленными небольшими молекулами при указанных концентрациях в течение 24 часов.Выживание клеток определяли добавлением 20 мкл 5 мг / мл МТТ (тиазолиловый синий тетразолий бромид) в каждую лунку с последующей инкубацией при 37 ° C в течение 3 часов. Среду удаляли, и пурпурный формазан растворяли в 100 мкл ДМСО. Поглощение измеряли при 590 нм на считывающем устройстве для микропланшетов (PerkinElmer, Waltham, MA). Жизнеспособность клеток рассчитывали путем нормализации значений к необработанным контролям.
Вестерн-блоттинг
Клеточный лизат был приготовлен в буфере RIPA (20 мМ Трис-HCl [pH 7,5], 150 мМ NaCl, 1 мМ NaCl 2 ЭДТА, 1 мМ EGTA, 1% NP-40, 1% дезоксихолат натрия, 2.5 мМ пирофосфата натрия, 1 мМ бета-глицерофосфата, 1 мМ Na 3 VO 4 и 1 мкг / мл лейпептина) с добавлением коктейлей 1X ингибиторов протеазы (MilliporeSigma, Сент-Луис, Миссури) и ингибиторов фосфатазы 1X Halt коктейль (ThermoFisher, Waltham, MA). Концентрации белка определяли с помощью анализа белка Лоури, и 30 мкг белка разделяли с помощью гелей MINI-PROTEAN TGX 4–15% SDS-PAGE. Блоты инкубировали с первичными антителами в течение ночи при 4 ° C и вторичными антителами при комнатной температуре в течение 1 часа.Используемые реагенты и антитела: рекомбинантный мышиный TNF-α (10 нг / мл; PeproTech # 315-01A), LPS из Escherichia coli , серотип O111: B4 (1 мкг / мл; Enzo # ALX-581-012. -L001), рекомбинантный мышиный IL-1α (0,5 нг / мл; PeproTech # 211-11A), антитело против LTβR (1: 300; Abcam # ab65089), анти-p-IκBα (1: 1000; CST), IκBα (C-21) антитело (1: 1000; # sc-371), антитело p-IKKα / β (Ser176 / 180) (1: 500; CST # 2697), антитело IKKα (1: 1000; CST # 2682), анти-IKKβ (1: 1000; CST # 8943), антитело p-p65 (Ser536) (93h2) (1: 2000; CST # 3033), антитело p65 (D14E12) (1: 5000; CST # 8242), p100 / Антитело p52 (1: 500; CST # 4882), антитело p-TAK1 (Thr184 / 187) (1: 500; CST # 4508) и анти-GAPDH (1: 5000; CST # 5174).
Совместная иммунопреципитация эндогенного IKKβ и NEMO
Необработанные клетки 264,7 высевали из расчета 1 × 10 6 клеток / лунку в 6-луночные планшеты или 6 × 10 6 клеток / 10 см планшет и предварительно обрабатывали носителем, низкомолекулярными ингибиторами или пептидом NBD в течение 30 мин. Лизаты клеток собирали в буфере для лизиса NP-40 с добавлением коктейлей 1Х ингибиторов протеазы (Sigma). Белки подвергали иммунопреципитации путем инкубации 150 мкг лизатов (1 мкг / мкл) с 10 мкл конъюгированного с агарозой антитела NEMO (FL-419) (sc-8330 AC, Санта-Крус, Даллас, Техас) на роторном шейкере при 4 ° C. за 4 ч.В качестве альтернативы мы инкубировали 500 мкг белковых лизатов с 10-15 мкл антитела NEMO (FL-419) (Santa Cruz) в течение 2 часов при 4 ° C, затем добавляли 50 мкл Dynabeads (ThermoFisher) к комплексу Ab-Ag и инкубировали на ротатор на 1 час при 4 ° C. Комплекс Ag-Ab-Bead затем промывали буфером NP-40 3 раза и один раз PBS. Затем белок денатурировали в буфере для образцов SDS и разделяли с помощью MINI-PROTEAN TGX 4% –15% SDS-PAGE. Десять процентов клеточных лизатов были исследованы в качестве входных контролей на коиммунопреципитацию. Используются следующие антитела: анти-IKKβ (1: 1000; CST # 8943), анти-NEMO (1: 1000; CST # 2685), антитело TRAF2 (C192) (1: 1000; CST # 4724), антитело IKKα ( 1: 1000; CST # 2682) и антитело IκBα (C-21) (1: 1000; # sc-371).
Анализ связывания IKKβ-NEMO
Рекомбинантный полноразмерный NEMO, помеченный GST на N-конце (SignalChem, Ричмонд, Британская Колумбия, Канада) в концентрации 15 нМ, предварительно инкубировали с ингибиторами в течение 15 мин при комнатной температуре с последующей инкубацией с 15 нМ рекомбинантного полноразмерного IKKβ, меченного с FLAG на С-конце (Origene) в течение 30 мин при 30 ° C. Буфер TNT (50 нМ Трис [pH 7,5], 200 мМ NaCl, 1% Triton X-100 и 1 мМ DTT [pH 7,4]) использовали в качестве связывающего и промывочного буфера. Затем продукты связывания инкубировали с 25 мкл гранул глутатион-агарозы (ThermoFisher) в течение 1 ч при 4 ° C на ротаторе.Конечные продукты тщательно промывали буфером TNT 4 раза перед добавлением буфера для образцов. Затем образцы разделяли с помощью гелей SDS-PAGE. Используемые антитела следующие: антитело GST (B-14), HRP (1: 3000; # sc-138 HRP) и моноклональное антитело против FLAG M2 (1: 2000; Sigma-Aldrich, F3165).
EMSA
Цитоплазматические и ядерные фракции экстрагировали с использованием реактивов для ядерной и цитоплазматической экстракции NE-PER (ThermoFisher) в соответствии с инструкциями производителя. Анализ сдвига геля проводили по ранее описанной методике [39].Вкратце, 5 мкг ядерного экстракта инкубировали со сдвигающим связывающим буфером 5X в течение 10 мин при комнатной температуре (Promega). Затем к реакционной смеси добавляли зонд, меченный альфа-32P-дезоксицитодинтрифосфатом, содержащий согласованную последовательность связывания NF-κB в концентрации 200000 имп / мин / мкл, и инкубировали в течение 20 минут при комнатной температуре (MP Biomedicals, Santa Ana , Калифорния). Продукт реакции отделяли на 6% неденатурирующем полиакриламидном геле перед авторадиографической визуализацией. Олигонуклеотидные последовательности являются следующими: матричный олиго NF-κB, 5′-CAGGGCTGGGGATTCCCCATCTCCACAGTTTCACTTC-3 ‘; NF-κB олиго отжига, 5’-GAAGTGAAACTGTGG-3 ‘(Integrated DNA Technologies, Coralville, IA).
qRT-PCR
Быстро замороженные ткани сохраняли в растворе для стабилизации РНК RNAlater (ThermoFisher). Тотальную РНК экстрагировали из клеток или тканей с использованием реагента ТРИЗОЛ (Life Technologies), и 1500 нг мРНК подвергали синтезу кДНК с использованием набора для синтеза кДНК SuperScript VILO. qRT-PCR выполняли в системе StepOnePlus Real-Time PCR с использованием Platinum SYBR Green qPCR SuperMix-UDG (ThermoFisher). Экспрессию целевого гена рассчитывали с использованием сравнительного метода C T (ΔΔC T ) путем нормализации до гена внутреннего контроля Actb (β-актин).Использованы следующие праймеры: Ptgs2 (COX-2) вперед: ACTCATAGGAGAGACTATCAAG; Ptgs2 (COX-2) реверс: GAGTGTGTTGAATTCAGAGG; Nfkbia (IκBα) нападающий: CAGAATTCACAGAGGATGAG; Nfkbia (IκBα) реверс: CATTCTTTTTGCCACTTTCC; Il1b (IL-1β) вперед: GGATGATGATGATAACCTGC; Il1b (IL-1β), обратный: CATGGAGAATATCACTTGTTGG; №2 (iNOS) вперед: TGAAATCCCTCCTGATCTTG; №2 (iNOS) реверс: CCATGTACCAACCATTGAAG; Tnf (TNF) вперед: CTATGTCTCAGCCTCTTCTC; Tnf (TNF) реверс: CATTTGGGAACTTCTCATCC; Ил6 (Ил-6) вперед: AAGAAATGATGGATGCTACC; Il6 (IL-6) реверс: GAGTTTCTGTATCTCTCTGAAG. Actb (β-актин) вперед: GATGTATGAAGGCTTTGGTC; Actb (β-актин) обратный: TGTGCACTTTTATTGGTCTC.
Иммуноферментный анализ
КлеткиRaw 264.7 выращивали в 96-луночных планшетах и предварительно обрабатывали носителем, IKKi VII (2 мкМ) и небольшими молекулами (в указанной концентрации) в течение 1 ч с последующей стимуляцией 1 мкг / мл LPS. Супернатант собирали через 24 часа для анализа ELISA. Концентрацию IL-6 измеряли с использованием набора ELISA для мышиных IL-6 (BD) в соответствии с инструкциями производителя.
Уровни TNF-α и IL-6 в сыворотке мышей определяли с использованием набора ELISA для мышиного TNF-α (BD Biosciences, Франклин Лейкс, штат Нью-Джерси) и набора для ELISA Mouse IL-6 (BD Biosciences) в соответствии со спецификациями производителя. Оптическую плотность определяли при 450 нм с использованием планшет-ридера Spectramax i3 (Molecular Devices, Сан-Хосе, Калифорния). Все стандарты и образцы были измерены в двух экземплярах.
Окрашивание гематоксилином-эозином
Ткани, зафиксированные в 10% нейтральном забуференном формалине (NBF) в течение ночи, заливали парафином.На микротоме делали срезы ткани размером 5 мкм. Окрашивание гематоксилин-эозином проводили по стандартному протоколу [30].
Трихромное пятно Masson
Окрашивание трихромом по Массонувыполняли с помощью набора для окрашивания трихромом, модифицированного Массоном IMEB (IMEB, Сан-Маркос, Калифорния), в соответствии с инструкциями производителя, который окрашивает коллаген в синий цвет, мышечные волокна в красный цвет и ядра в черный цвет. Вкратце, замороженные срезы ткани фиксировали 10% формалином и затем инкубировали в растворе йода, растворе гематоксилина, растворе фушина алой кислоты Биберта, растворе фосфомолибденовой кислоты и анилиновом синем растворе.Затем предметные стекла промывали, обезвоживали и устанавливали для визуализации.
Иммуногистохимия и количественное определение мышц
Для точного количественного определения среднего размера волокна TA-мышцу окрашивали ламинином, чтобы очертить миофибриллы. С помощью программного обеспечения для анализа NIS Elements (Nikon, Melville, NY) сигнал ламинина был скорректирован на фон и подвергся гомогенизации сигнала и усилению структуры с использованием алгоритма локального контраста и сглаживания на основе ядра. Мышечные волокна были определены путем применения однородной бинарной маски к отрицательному пространству изображения ламинина, а затем сегментированы с использованием логического оператора, чтобы изолировать только отрицательное пространство, перекрывающееся с общей площадью ткани, присутствующей на изображении.Ядра, определенные с помощью маркировки Hoechst (Sigma bisBenzimide H 33258), были определены с использованием единой бинарной маски, а сегментация была выполнена с использованием алгоритма водораздела. Волокна с центральными ядрами определялись путем разрушения бинарной маски мышечных волокон так, чтобы присутствовала только центральная часть каждого волокна. Булевский оператор использовался, чтобы определить, перекрываются ли эродированные волокна маской, связанной с ядром, и если да, то они считались централизованными. Затем, используя исходную маску мышечных волокон, были измерены диаметры Фере центрально зародышевых и нецентрально зародышевых волокон.
Замороженные срезы ткани фиксировали 4% параформальдегидом в течение 1 ч и инкубировали с 1% BSA для блокирования. Первичные антитела CD68 (Abcam, Cambridge, MA) и атрофин (Santa Cruz) применяли в соотношении 1: 200 в течение 2 часов. Затем применяли вторичные антитела Alexa Fluor 594 и Alexa Fluor 488 в соотношении 1: 400 в течение 1 часа. Раствор DAPI (1; 1000) использовали для окрашивания ядра клетки. Все процессы проводились при комнатной температуре.
Гематологический и биохимический анализ сыворотки крови
Девять мышей (самцы; C57BL / 6, 9–13 недель) случайным образом были разделены на 3 группы по 3 мыши в каждой группе.Мышам вводили внутрибрюшинно. с носителем (ДМСО: Tween80: H 2 O, 10:10:80) или низкомолекулярным SR12343 (30 мг / кг) в течение 30 минут, а затем вводили внутрибрюшинно. с физиологическим раствором (1 мл / кг) или LPS (10 мг / кг в физиологическом растворе). Через 2 часа мышей умерщвляли удушением CO 2 перед забором крови посредством сердечной пункции. Кровь от каждой мыши помещали в 2 пробирки для сбора крови с коагулянтом или антикоагулянтом гепарином (примерно по 0,6 мл каждая). Образцы в пробирках, покрытых антикоагулянтом гепарином, несколько раз перемешивали вручную и помещали на влажный лед для гематологического анализа с использованием автоматического гематологического анализатора (Hemavet 950FS; Drew Scientific, Miami Lakes, FL).Образцам в пробирках, не содержащих антикоагулянта, давали возможность свернуться перед центрифугированием и отправкой на биохимический анализ сыворотки с использованием анализатора VetScan VS2 с ротором реагентов для комплексного диагностического профиля (Abaxis, Union City, CA). Активности АЛТ, АСТ и АЛТ в сыворотке определяли колориметрическим ферментативным методом с использованием клинического химического анализатора Cobas c311 (Roche Diagnostics, Risch-Rotkreuz, Швейцария) в соответствии с инструкциями производителя.
Исследование фармакокинетики
Фармакокинетический профиль миметиков NBD был определен на самцах мышей C57BL / 6J ( n = 3).Препараты готовили в смеси ДМСО: Твин 80: вода 10:10:80 и вводили внутрибрюшинно. инъекция в конечной дозе 10 мг / кг. Кровь, мозг, мышцы, селезенка и печень собирали через 2 часа после обработки и анализировали масс-спектрометрией, следуя ранее описанному протоколу [40].
Фармакофор модель поколения
Рентгеновская структура комплекса NEMO / IKKβ, полученная из PDB (ID 3BRV), была использована для создания модели фармакофора на основе структуры [21]. Трехмерная (3D) модель фармакофора была создана с помощью LigandScout [22, 23] и основана на взаимодействиях, которые определяют межбелковое взаимодействие, таких как гидрофобные взаимодействия, водородные связи и электростатические взаимодействия.Программа LigandScout определяет особенности, которые учитывают химическую функциональность, но не учитывают строгую структурную топологию или определенные функциональные группы. В результате с помощью скрининга базы данных могут быть идентифицированы совершенно новые потенциальные фармаконы. Более того, для повышения селективности модель LigandScout включает пространственную информацию относительно областей, недоступных для любого потенциального лиганда, тем самым отражая возможные стерические ограничения. В частности, сферы исключенного объема, помещенные в положения, которые стерически не разрешены, автоматически добавляются к сгенерированной модели фармакофоров.Таким образом, основанная на структуре модель фармакофора содержит фармакофорные элементы кандидатов в лиганды в ответ на среду активного сайта белка [41].
Поиск по сходству
Распознавание малых молекул белками в значительной степени опосредовано комплементарностью поверхности молекул. Подходы к разработке лекарств, основанные на структуре, используют это как фундаментальный руководящий принцип; то есть близкородственные молекулы будут вызывать аналогичную активность в биологическом анализе [42, 43].Морфологическое сходство — это метод подобия, зависящий только от формы поверхности и зарядовых характеристик лигандов [44]. Морфологическое сходство определяется как функция Гаусса от различий в расстояниях молекулярных поверхностей 2 молекул в взвешенных точках наблюдения на однородной сетке. Вычисленные поверхностные расстояния включают как расстояния до ближайшей атомной поверхности, так и расстояния до донорных и акцепторных поверхностей. Эта функция зависит от относительного выравнивания молекул, и, следовательно, их выравнивание и конформация должны быть оптимизированы.Проблема конформационной оптимизации решается фрагментацией, конформационным поиском, выравниванием и оценкой, за которыми следует инкрементная реконструкция из выровненных фрагментов с высокими оценками. Проблема выравнивания решается за счет использования того факта, что две невыровненные молекулы или молекулярные фрагменты, которые имеют некоторую степень сходства, будут иметь некоторый соответствующий набор наблюдателей, которые видят одни и те же вещи. Оптимизация подобия 2 невыровненных молекул или молекулярных фрагментов выполняется путем нахождения похожих наборов наблюдателей для каждой молекулы, которые образуют треугольники одинакового размера [41, 44].
Скрининг In silico ADME / Tox
Инструменты компьютерного моделирования использовались для оценки биодоступности, растворимости в воде, потенциала гематоэнцефалического барьера, абсорбции в кишечнике человека, потенциала ингибирования фермента цитохрома P450 (то есть CYP2D6), мутагенности и ингибирования hERG совпадений, полученных в результате скрининга базы данных. Биодоступность, растворимость в воде и всасывание в кишечнике человека оценивали с помощью программного обеспечения ACD / ADME Boxes (ACD Labs, Торонто, Канада; http: // www.acdlabs.com), а мутагенность, ингибирование hERG и CYP2D6 оценивали с помощью скрининга ACD / Tox (ACD Labs, Торонто, Канада; http://www.acdlabs.com).
Статистический анализ
Все значения были представлены как среднее +/- SEM или среднее +/- SD. Для статистического анализа использовались Microsoft Excel и Graphpad Prism 6. Двусторонний тест Стьюдента t был проведен для определения различий между двумя группами. При сравнении различий в более чем 2 группах был проведен однофакторный дисперсионный анализ ANOVA (тест Даннета).Статистически значимым считалось значение P <0,05, показанное как «*» для P <0,05, «**» для P <0,01 и «***» для P <0,001.
Дополнительная информация
S1 Рис. IC
50 и полные фармакокинетические профили миметиков NBD.(A) Дозозависимая кривая миметиков NBD в диапазоне от 0 до 150 мкМ была определена с помощью анализов люциферазы NF-κB в клетках HEK293. (B) Полные фармакокинетические профили вводимых SR12460 и SR12343 i.v. или через желудочный зонд у мышей. Базовые данные можно найти в S1 Data. AUC% Extrap, процент площади под кривой, экстраполированной на бесконечность от T последних до бесконечности; AUC INF_obs , площадь под кривой от 0 до бесконечности; AUC last , площадь под кривой от времени дозирования до последней измеряемой концентрации; C max , максимальная наблюдаемая концентрация; Cl obs , общий клиренс сыворотки; НЕК, клетки 293 почки эмбриона человека; IC 50 , половина максимальной ингибирующей концентрации; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB; NF-κB, ядерный фактор κB; T 1/2 , период полураспада; T max , время максимальной концентрации.
https://doi.org/10.1371/journal.pbio.2004663.s002
(TIF)
S2 Рис. SR12343 снижает активацию NF-κB за счет нарушения фосфорилирования IKKα / β без воздействия на фосфорилирование TAK1.
(A) SR12343 в указанных концентрациях (0, 25, 50, 100 и 150 мкМ) ингибировал фосфорилирование IKKα / β и p65 и предотвращал деградацию IκBα. (B) SR12343 снижал индуцированное IL-1α фосфорилирование TAK1 и IKKβ в IKKα — / — MEF. IKK, IκB киназа; ИЛ-1, интерлейкин 1; MEF, эмбриональный фибробласт мыши; NF-κB, ядерный фактор κB.
https://doi.org/10.1371/journal.pbio.2004663.s003
(TIF)
S3 Фиг. Миметики NBD не проявляют влияния на массу тела у обработанных мышей
mdx .(A) Массу тела мышей mdx , подвергнутых хроническому лечению, контролировали, и никаких существенных различий обнаружено не было. (B) Образцы сыворотки от мышей mdx, подвергавшихся хроническому лечению, анализировали на уровни AST, ALT и ALP, индикаторы повреждения печени, с использованием анализатора клинической химии Cobas c311. Базовые данные можно найти в S1 Data.ALP, щелочная фосфатаза; АЛТ, аланинаминотрансфераза; AST, аспартатаминотрансфераза; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB.
https://doi.org/10.1371/journal.pbio.2004663.s004
(TIF)
S4 Рис. Хроническое лечение миметиками NBD улучшает мышечную патологию путем ингибирования активности связывания ДНК NF-κB у мышей
mdx .(A) Количественная оценка процента централизованных миоядер. (B) Большая область окрашивания гематоксилином-эозином ТА-мышц из разных групп лечения.(C) EMSA-анализ ДНК-связывающей активности NF-κB in vivo проводили с использованием экстрактов из тканей ТА от мышей mdx . Разовая доза SR12343 в дозе 30 мг / кг вводилась внутрибрюшинно. ТА-мышцы собирали через 2 часа после инъекции для анализа EMSA. Базовые данные можно найти в S1 Data. EMSA, анализ сдвига электрофоретической подвижности; внутрибрюшинно, внутрибрюшинно; NBD, NEMO-связывающий домен; NEMO, существенный модулятор NF-κB; NF-κB, ядерный фактор κB; TA, tibialis anterior.
https://doi.org/10.1371/journal.pbio.2004663.s005
(TIF)
Список литературы
- 1. Перкинс Н.Д. Интеграция клеточных сигнальных путей с функцией NF-kappaB и IKK. Обзор природы Молекулярно-клеточная биология. 2007. 8 (1): 49–62. Epub 2006/12/22. pmid: 17183360.
- 2. Занди Э., Ротварф Д.М., Дельхас М., Хаякава М., Карин М. Киназный комплекс IκB (IKK) содержит две субъединицы киназы, IKKα и IKKβ, необходимые для фосфорилирования IκB и активации NF-κB. Клетка. 1997. 91 (2): 243–52.http://dx.doi.org/10.1016/S0092-8674(00)80406-7. pmid: 9346241
- 3. Ямаока С., Куртуа Дж., Бессия С., Уайтсайд С.Т., Вейл Р., Агу Ф. и др. Комплементационное клонирование NEMO, компонента киназного комплекса IκB, необходимого для активации NF-κB. Клетка. 1998. 93 (7): 1231–40. pmid: 9657155
- 4. Рудольф Д., Йе В.К., Уэйкхэм А., Рудольф Б., Наллайнатан Д., Поттер Дж. И др. Тяжелая дегенерация печени и отсутствие активации NF-κB у мышей с дефицитом NEMO / IKKγ. Гены и развитие.2000. 14 (7): 854–62.
- 5. Мэй М.Дж., Д’Аквисто Ф., Мэдж Л.А., Глокнер Дж., Побер Дж. С., Гош С. Селективное ингибирование активации NF-kappaB пептидом, который блокирует взаимодействие NEMO с киназным комплексом IkappaB. Наука. 2000. 289 (5484): 1550–4. Epub 2000/09/01. pmid: 10968790.
- 6. Корнегай Дж., Петерсон Дж. М., Боган Д. Д., Клайн В., Боган Дж. Р., Доу Дж. Л. и др. Доставка NBD улучшает фенотип болезни золотистого ретривера, модель мышечной дистрофии Дюшенна.Скелетные мышцы. 2014; 4:18. Epub 2014/01/01. pmid: 25789154.
- 7. Ачарья С., Виллалта С.А., Баккар Н., Буфа-Интр Т., Янссен П.М., Каратерс М. и др. Взаимодействие передачи сигналов IKK / NF-kappaB в макрофагах и миофибриллах способствует мышечной дегенерации при мышечной дистрофии Дюшенна. Журнал клинических исследований. 2007. 117 (4): 889–901. Epub 2007/03/24. pmid: 17380205.
- 8. Рей Д.П., Ян М., Вачко Дж. Ф., Дауд М., О’Дей Т.Л., Рехман К.К. и др. Системная доставка связывающего домена NEMO / ингибирующего пептида IKKgamma молодым мышам mdx улучшает гистопатологию дистрофических скелетных мышц.Нейробиология болезни. 2011. 43 (3): 598–608. Epub 2011/06/01. pmid: 21624467.
- 9. Davé SH, Tilstra JS, Matsuoka K, Li F, Karrasch T., Uno JK, et al. Улучшение хронического колита у мышей с помощью пептид-опосредованной трансдукции ингибитора киназы IκB пептидом связывающего домена NEMO. Журнал иммунологии. 2007. 179 (11): 7852–9. pmid: 18025231
- 10. Tas S, Vervoordeldonk M, Hajji N, May M, Ghosh S, Tak P. Местное лечение селективным пептидом NEMO-связывающего домена, ингибитором киназы IkappaB, облегчает синовиальное воспаление.Исследования и терапия артрита. 2006; 8 (4): R86.
- 11. Джими Э., Аоки К., Сайто Х., Д’Акусто Ф., Мэй М.Дж., Накамура И. и др. Селективное ингибирование NF-каппа B блокирует остеокластогенез и предотвращает воспалительную деструкцию кости in vivo. Природная медицина. 2004. 10 (6): 617–24. Epub 2004/05/25. pmid: 15156202.
- 12. Гош А., Рой А., Лю Х, Кордовер Дж. Х., Муфсон Э. Дж., Хартли Д. М. и др. Селективное ингибирование активации NF-κB предотвращает потерю дофаминергических нейронов на мышиной модели болезни Паркинсона.Труды Национальной академии наук. 2007. 104 (47): 18754–9.
- 13. Огуиса А., Ресио С., Лазаро И., Маллавиа Б., Бланко Дж., Эджидо Дж. И др. Пептидное ингибирование пути киназы IκB / ядерного фактора-κB защищает от нефропатии и атеросклероза, связанных с диабетом, на мышиной модели диабета 1 типа. Диабетология. 2015. 58 (7): 1656–67. pmid: 25982245
- 14. Джими Э., Аоки К., Сайто Х., Д’Акусто Ф., Мэй М.Дж., Накамура И. и др. Селективное ингибирование NF-каппа B блокирует остеокластогенез и предотвращает воспалительное разрушение кости in vivo.Природная медицина. 2004. 10 (6): 617–24. http://www.nature.com/nm/journal/v10/n6/suppinfo/nm1054_S1.html. pmid: 15156202
- 15. Анкерманн Т., Райснер А., Виманн Т., Крамс М., Кёлер Х., Краузе М.Ф. Местное ингибирование ядерного фактора-κB усиливает уменьшение отека легких сурфактантом в модели лаважа дыхательных путей у поросят. Реанимационная медицина. 2005; 33 (6).
- 16. Мора А.Л., ЛаВой Дж., Маккин М., Стеценко А., Бригам К.Л., Паркер Р. и др. Предотвращение активации NF-κB in vivo с помощью проницаемого для клеток пептида-ингибитора NF-κB.Американский журнал физиологии — клеточная и молекулярная физиология легких. 2005; 289 (4): L536 – L44. pmid: 15951331
- 17. Habineza Ndikuyeze G, Gaurnier-Hausser A, Patel R, Baldwin AS, May MJ, Flood P, et al. Фаза I клинических испытаний системно доставляемого пептида связывающего домена NEMO у собак со спонтанной активированной B-клеточной подобной диффузной большой B-клеточной лимфомой. PLOS ONE. 2014; 9 (5): e95404. Epub 2014/05/07. pmid: 24798348.
- 18. Тилстра Дж.С., Робинсон А.Р., Ван Дж., Грегг С.К., Клаусон С.Л., Рей Д.П. и др.Ингибирование NF-kappaB задерживает вызванное повреждением ДНК старение и старение у мышей. Журнал клинических исследований. 2012. 122 (7): 2601–12. Epub 2012/06/19. pmid: 22706308.
- 19. Валлквист А., Хуанг Р., Танки Н., Ковелл Д. Оценка сходства химической структуры как индикатора торможения клеточного роста. Журнал химической информации и моделирования. 2006. 46 (1): 430–7. Epub 2006/01/24. pmid: 16426077.
- 20. Мартин Ю.К., Кофрон Ю.Л., Трафаген Л.М. Обладают ли сходные по структуре молекулы схожей биологической активностью? Журнал медицинской химии.2002. 45 (19): 4350–8. Epub 2002/09/06. pmid: 12213076.
- 21. Руш М., Сильвиан Л., Бикслер С., Чен Л.Л., Чунг А., Боуз С. и др. Структура домена, ассоциированного с NEMO / IKK, раскрывает архитектуру сайта взаимодействия. Структура. 2008. 16 (5): 798–808. http://dx.doi.org/10.1016/j.str.2008.02.012. pmid: 18462684
- 22. Вольбер Г., Дорнхофер А., Лангер Т. Эффективное наложение малых органических молекул с использованием 3D-фармакофоров. J. Comput Aided Mol Des. 2006. 20 (12): 773–88.pmid: 17051340
- 23. Wolber G, Langer T. LigandScout: 3-D фармакофоры, полученные из лигандов, связанных с белками, и их использование в качестве виртуальных фильтров для скрининга. Журнал химической информации и моделирования. 2005. 45 (1): 160–9. Epub 2005/01/26. pmid: 15667141.
- 24. Джейн А. Морфологическое сходство: метод трехмерного молекулярного сходства коррелирует с распознаванием белок-лиганд. J. Comput Aided Mol Des. 2000. 14 (2): 199–213. pmid: 10721506
- 25. Tilstra JS, Gaddy DF, Zhao J, Davé SH, Niedernhofer LJ, Plevy SE и др.Фармакологическое ингибирование IKK / NF- [kgr] B заставляет антигенпрезентирующие клетки претерпевать TNF [agr] -зависимую запрограммированную гибель клеток, опосредованную ROS. Научные отчеты. 2014; 4.
- 26. Ирвин Дж. Дж., Шойчет Б. К.. ZINC — бесплатная база данных коммерчески доступных соединений для виртуального скрининга. Журнал химической информации и моделирования. 2005. 45 (1): 177–82.
- 27. May MJ, Marienfeld RB, Ghosh S. Характеристика связывающего домена IκB-киназы NEMO. Журнал биологической химии.2002. 277 (48): 45992–6000. pmid: 12244103
- 28. Булфилд G, Силлер WG, Уайт PA, Мур KJ. Х-хромосомно-связанная мышечная дистрофия (mdx) у мышей. Труды Национальной академии наук Соединенных Штатов Америки. 1984. 81 (4): 1189–92. pmid: 6583703
- 29. Рей Д.П., Ян М., Вачко Дж. Ф., Дауд М., О’Дей Т.Л., Рехман К.К. и др. Системная доставка связывающего домена NEMO / ингибирующего пептида IKKγ молодым мышам mdx улучшает гистопатологию дистрофических скелетных мышц.Нейробиология болезней. 2011. 43 (3): 598–608. http://dx.doi.org/10.1016/j.nbd.2011.05.008. pmid: 21624467
- 30. Acharyya S, Villalta SA, Bakkar N, Bupha-Intr T, Janssen PML, Carathers M и др. Взаимодействие передачи сигналов IKK / NF-κB в макрофагах и миофибриллах способствует мышечной дегенерации при мышечной дистрофии Дюшенна. Журнал клинических исследований. 2007. 117 (4): 889–901. pmid: 17380205
- 31. Мустата Г., Ли М., Зевола Н., Бакан А., Чжан Л., Эпперли М. и др.Разработка низкомолекулярных ингибиторов PUMA для смягчения гибели клеток, вызванной излучением. Актуальные темы медицинской химии. 2011; 11 (3): 281–90. pmid: 21320058
- 32. Golden MS, Cote SM, Sayeg M, Zerbe BS, Villar EA, Beglov D, et al. Комплексный экспериментальный и вычислительный анализ горячих точек энергии связывания на интерфейсе NF-κB Essential Modulator (NEMO) / IKKβ белок-белок. Журнал Американского химического общества. 2013. 135 (16): 6242–56. pmid: 23506214
- 33.Байма Е.Т., Гузова Дж. А., Матиалаган С., Нагец Е. Е., Харди М. М., Сонг Л. Р. и др. Новые сведения о клеточных механизмах противовоспалительного действия пептидов домена связывания основного модулятора NF-κB. Журнал биологической химии. 2010. 285 (18): 13498–506. pmid: 20167598
- 34. Кот С.М., Гилмор Т.Д., Шаффер Р., Вебер Ю., Боллам Р., Голден М.С. и др. Мутация несущественных цистеинов показывает, что основной модулятор NF-κB образует конститутивный нековалентный димер, который связывает IκB-киназу-β с высоким сродством.Биохимия. 2013. 52 (51): 9141–54.
- 35. Golden MS, Cote SM, Sayeg M, Zerbe BS, Villar EA, Beglov D, et al. Комплексный экспериментальный и вычислительный анализ горячих точек энергии связывания на интерфейсе NF-κB Essential Modulator / IKKβ белок-белок. Журнал Американского химического общества. 2013. 135 (16): 6242–56.
- 36. Солт Л.А., Мэдж Л.А., Orange JS, Мэй MJ. Индуцированная интерлейкином-1 активация NF-κB является NEMO-зависимой, но не требует IKKβ. Журнал биологической химии.2007. 282 (12): 8724–33. pmid: 17244613
- 37. Macian F, Lopez-Rodriguez C, Rao A. Партнеры в транскрипции: NFAT и AP-1. Онкоген. 2001. 20 (19): 2476–89. pmid: 11402342.
- 38. Вильялта С.А., Нгуен Х.Х., Дэн Б., Гото Т, Тидболл Дж. Изменения фенотипов макрофагов и конкуренция макрофагов за метаболизм аргинина влияют на тяжесть мышечной патологии при мышечной дистрофии. Молекулярная генетика человека. 2009. 18 (3): 482–96. pmid: 18996917
- 39. Guttridge DC, Albanese C, Reuther JY, Pestell RG, Baldwin AS.NF-κB контролирует рост и дифференцировку клеток посредством регуляции транскрипции циклина D1. Молекулярная и клеточная биология. 1999; 19 (8): 5785–99. pmid: 10409765
- 40. Chang MR, He Y, Khan TM, Kuruvilla DS, Garcia-Ordonez R, Corzo CA и др. Эффект против ожирения репрессора малых молекул RORγ. Молекулярная фармакология. 2015; 88 (1): 48–56. pmid: 254
- 41. Delgado ER, Yang J, So J, Leimgruber S, Kahn M, Ishitani T. и др. Идентификация и характеристика нового низкомолекулярного ингибитора передачи сигналов β-катенина.Американский журнал патологии. 2014. 184 (7): 2111–22. pmid: 24819961
- 42. Валлквист А., Хуанг Р., Танки Н., Ковелл Д. Оценка сходства химической структуры как индикатора ингибирования роста клеток. Журнал химической информации и моделирования. 2006. 46 (1): 430–7. pmid: 16426077
- 43. Мартин Ю.К., Кофрон Ю.Л., Трафаген Л.М. Обладают ли структурно похожие молекулы схожей биологической активностью? Журнал медицинской химии. 2002. 45 (19): 4350–8. pmid: 12213076
- 44.Джайн А.Н. Морфологическое сходство: метод трехмерного молекулярного сходства коррелирует с распознаванием белок-лиганд. J. Comput Aided Mol Des. 2000. 14 (2): 199–213. pmid: 10721506
Устойчивая нейрон-специфическая активация IKK / NF-κB генерирует селективный нейровоспалительный ответ, способствующий локальной нейродегенерации с возрастом | Молекулярная нейродегенерация
Glass CK, Saijo K, Winner B, Marchetto MC, Gage FH: механизмы, лежащие в основе воспаления при нейродегенерации.Клетка. 2010, 140: 918-934. 10.1016 / j.cell.2010.02.016.
PubMed Central Статья CAS PubMed Google Scholar
Mattson MP, Meffert MK: Роли NF-kappaB в выживаемости нервных клеток, пластичности и болезнях. Смерть клетки отличается. 2006, 13: 852-860. 10.1038 / sj.cdd.4401837.
Артикул CAS PubMed Google Scholar
Гош С., Хайден М.С.: Новые регуляторы NF-kappaB при воспалении.Nat Rev Immunol. 2008, 8: 837-848. 10.1038 / nri2423.
Артикул CAS PubMed Google Scholar
Хайден М.С., Гош С: Общие принципы передачи сигналов NF-kappaB. Клетка. 2008, 132: 344-362. 10.1016 / j.cell.2008.01.020.
Артикул CAS PubMed Google Scholar
Перкинс Н.Д .: Интеграция клеточных сигнальных путей с функцией NF-kappaB и IKK.Nat Rev Mol Cell Biol. 2007, 8: 49-62. 10.1038 / nrm2083.
Артикул CAS PubMed Google Scholar
Кальчмидт B, Кальчмидт C: NF-kappaB в нервной системе. Cold Spring Harb Perspect Biol. 2009, 1: a001271-10.1101 / cshperspect.a001271.
PubMed Central Статья PubMed Google Scholar
Kaltschmidt B, Widera D, Kaltschmidt C: передача сигналов через NF-kappaB в нервной системе.Biochim Biophys Acta. 2005, 1745: 287-299. 10.1016 / j.bbamcr.2005.05.009.
Артикул CAS PubMed Google Scholar
Memet S: NF-kappaB функции в нервной системе: от развития к болезни. Biochem Pharmacol. 2006, 72: 1180-1195. 10.1016 / j.bcp.2006.09.003.
Артикул CAS PubMed Google Scholar
Herrmann O, Baumann B, de Lorenzi R, Muhammad S, Zhang W., Kleesiek J, Malfertheiner M, Kohrmann M, Potrovita I, Maegele I, et al: IKK опосредует гибель нейронов, вызванную ишемией.Nat Med. 2005, 11: 1322-1329. 10,1038 / нм1323.
Артикул CAS PubMed Google Scholar
Khoshnan A, Ko J, Tescu S, Brundin P, Patterson PH: IKKalpha и IKKbeta регуляция расщепления гентингтина, вызванного повреждением ДНК. PLoS One. 2009, 4: e5768-10.1371 / journal.pone.0005768.
PubMed Central Статья PubMed Google Scholar
Латке М., Магнуцки А., Вальтер П., Вирт Т., Бауманн Б. Активация ядерного фактора каппаба нарушает эпендимный цилиогенез и связывает нейровоспаление с образованием гидроцефалии.J Neurosci. 2012, 32: 11511-11523. 10.1523 / JNEUROSCI.0182-12.2012.
Артикул CAS PubMed Google Scholar
Mattson MP, Camandola S: NF-kappaB в нейрональной пластичности и нейродегенеративных расстройствах. J Clin Invest. 2001, 107: 247-254. 10.1172 / JCI11916.
PubMed Central Статья CAS PubMed Google Scholar
Нурми А., Линдсберг П.Дж., Койстинахо М., Чжан В., Джюттлер Э., Карьялайнен-Линдсберг М.Л., Вей Ф., Франк Н., Шванингер М., Койстинахо Дж .: Ядерный фактор-каппаВ способствует инфаркту после перманентной фокальной ишемии.Гладить. 2004, 35: 987-991. 10.1161 / 01.STR.0000120732.45951.26.
Артикул PubMed Google Scholar
Song XQ, Lv LX, Li WQ, Hao YH, Zhao JP: Взаимодействие ядерного фактора-каппа B и цитокинов связано с шизофренией. Biol Psychiatr. 2009, 65: 481-488. 10.1016 / j.biopsych.2008.10.018.
Артикул CAS Google Scholar
Thompson LM, Aiken CT, Kaltenbach LS, Agrawal N, Illes K, Khoshnan A, Martinez-Vincente M, Arrasate M, O’Rourke JG, Khashwji H, et al: IKK фосфорилирует Хантингтин и нацеливает его на деградация протеасомами и лизосомами.J Cell Biol. 2009, 187: 1083-1099. 10.1083 / jcb.2007.
PubMed Central Статья CAS PubMed Google Scholar
Харари О.А., Ляо Дж. К.: NF-kappaB и врожденный иммунитет при ишемическом инсульте. Ann N Y Acad Sci. 2010, 1207: 32-40. 10.1111 / j.1749-6632.2010.05735.x.
PubMed Central Статья CAS PubMed Google Scholar
Риддер Д.А., Шванингер М: передача сигналов NF-kappaB при ишемии головного мозга.Неврология. 2009, 158: 995-1006. 10.1016 / j.neuroscience.2008.07.007.
Артикул CAS PubMed Google Scholar
Бауманн Б., Вагнер М., Алексич Т., фон Вихерт Г., Вебер К.К., Адлер Г., Вирт Т.: Конститутивной активации IKK2 в ацинарных клетках достаточно, чтобы вызвать панкреатит in vivo. J Clin Invest. 2007, 117: 1502-1513. 10.1172 / JCI30876.
PubMed Central Статья CAS PubMed Google Scholar
Maier HJ, Schips TG, Wietelmann A, Kruger M, Brunner C, Sauter M, Klingel K, Bottger T, Braun T, Wirth T. Активация кардиомиоцит-специфической киназы IkappaB (IKK) / NF-kappaB вызывает обратимую воспалительную кардиомиопатию и сердце отказ. Proc Natl Acad Sci U S. A. 2012, 109: 11794-11799. 10.1073 / pnas.1116584109.
PubMed Central Статья CAS PubMed Google Scholar
Sunami Y, Leithauser F, Gul S, Fiedler K, Guldiken N, Espenlaub S, Holzmann KH, Hipp N, Sindrilaru A, Luedde T. и др .: Активация в печени IKK / NFkappaB сигнализирует о фиброзе печени. хроническое воспаление, опосредованное макрофагами.Гепатология. 2012, 56: 1117-1128. 10.1002 / hep.25711.
Артикул CAS PubMed Google Scholar
Mayford M, Bach ME, Huang YY, Wang L, Hawkins RD, Kandel ER: Контроль формирования памяти посредством регулируемой экспрессии трансгена CaMKII. Наука. 1996, 274: 1678-1683. 10.1126 / science.274.5293.1678.
Артикул CAS PubMed Google Scholar
Gupta SC, Sundaram C, Reuter S, Aggarwal BB: Ингибирование активации NF-kappaB небольшими молекулами в качестве терапевтической стратегии. Biochim Biophys Acta. 2010, 1799: 775-787. 10.1016 / j.bbagrm.2010.05.004.
PubMed Central Статья CAS PubMed Google Scholar
Oeckl P, Lattke M, Wirth T., Baumann B, Ferger B: Астроцит-специфическая активация IKK2 у мышей достаточна для индукции нейровоспаления, но не увеличивает восприимчивость к MPTP.Neurobiol Dis. 2012, 48 (3): 481-487. 10.1016 / j.nbd.2012.06.010. DOI: 10.1016 / j.nbd.2012.06.010. Epub 2012 Jun 30
Статья CAS PubMed Google Scholar
Хагихара Х, Тояма К., Ямасаки Н., Миякава Т: Рассечение зубчатой извилины гиппокампа у взрослой мыши. J Vis Exp. 2009, 33: e1543-doi: 10.3791 / 1543
Google Scholar
Gutierrez H, Hale VA, Dolcet X, Davies A: Передача сигналов NF-kappaB регулирует рост нервных процессов в развивающихся ПНС и ЦНС.Разработка. 2005, 132: 1713-1726. 10.1242 / dev.01702.
Артикул CAS PubMed Google Scholar
Schmeisser MJ, Baumann B, Johannsen S, Vindedal GF, Jensen V, Hvalby OC, Sprengel R, Seither J, Maqbool A, Magnutzki A, et al: IkappaB киназа / ядерный фактор, каппаB-зависимый инсулиноподобный Экспрессия фактора роста 2 (Igf2) регулирует образование синапсов и созревание шипов посредством передачи сигналов рецептора Igf2. J Neurosci. 2012, 32: 5688-5703.10.1523 / JNEUROSCI.0111-12.2012.
Артикул CAS PubMed Google Scholar
Ahn HJ, Hernandez CM, Levenson JM, Lubin FD, Liou HC, Sweatt JD: c-Rel, фактор транскрипции семейства NF-kappaB, необходим для долговременной синаптической пластичности гиппокампа и формирования памяти. Learn Mem. 2008, 15: 539-549. 10.1101 / лм. 866408.
PubMed Central Статья CAS PubMed Google Scholar
Imielski Y, Schwamborn JC, Luningschror P, Heimann P, Holzberg M, Werner H, Leske O, Puschel AW, Memet S, Heumann R и др.: Восстановление взрослого мозга: NF-kappaB контролирует формирование функциональных цепей и гомеостаз тканей в зубчатая извилина. PLoS One. 2012, 7: e30838-10.1371 / journal.pone.0030838.
PubMed Central Статья CAS PubMed Google Scholar
Kaltschmidt B, Ndiaye D, Korte M, Pothion S, Arbibe L, Prullage M, Pfeiffer J, Lindecke A, Staiger V, Israel A, et al: NF-kappaB регулирует формирование пространственной памяти и синаптическую пластичность посредством передача сигналов протеинкиназы A / CREB.Mol Cell Biol. 2006, 26: 2936-2946. 10.1128 / MCB.26.8.2936-2946.2006.
PubMed Central Статья CAS PubMed Google Scholar
Kassed CA, Willing AE, Garbuzova-Davis S, Sanberg PR, Pennypacker KR: Отсутствие NF-kappaB p50 усугубляет дегенерацию нейронов гиппокампа после химического воздействия и ухудшает обучаемость. Exp Neurol. 2002, 176: 277-288. 10.1006 / exnr.2002.7967.
Артикул CAS PubMed Google Scholar
Meffert MK, Baltimore D: физиологические функции мозга NF-kappaB. Trends Neurosci. 2005, 28: 37-43. 10.1016 / j.tins.2004.11.002.
Артикул CAS PubMed Google Scholar
Meffert MK, Chang JM, Wiltgen BJ, Fanselow MS, Baltimore D: NF-каппа B функционирует в синаптической передаче сигналов и поведении. Nat Neurosci. 2003, 6: 1072-1078. 10.1038 / нн1110.
Артикул CAS PubMed Google Scholar
Merlo E, Freudenthal R, Romano A: Сульфасалазин, ингибитор киназы IkappaB, ухудшает долговременную память у краба Chasmagnathus. Неврология. 2002, 112: 161-172. 10.1016 / S0306-4522 (02) 00049-0.
Артикул CAS PubMed Google Scholar
Vorhees CV, Williams MT: Водный лабиринт Морриса: процедуры для оценки пространственных и связанных форм обучения и памяти. Nat Protoc. 2006, 1: 848-858. 10.1038 / nprot.2006.116.
PubMed Central Статья PubMed Google Scholar
Аскано М., Бодмер Д., Курувилла Р.: Эндоцитарный трафик нейротрофинов в нервном развитии. Trends Cell Biol. 2012, 22: 266-273. 10.1016 / j.tcb.2012.02.005.
PubMed Central Статья CAS PubMed Google Scholar
Chen DY, Stern SA, Garcia-Osta A, Saunier-Rebori B, Pollonini G, Bambah-Mukku D, Blitzer RD, Alberini CM: критическая роль IGF-II в консолидации и улучшении памяти.Природа. 2011, 469: 491-497. 10.1038 / природа09667.
PubMed Central Статья CAS PubMed Google Scholar
Huang YZ, Mei L: [Путь передачи сигнала Neuregulin / ErbB в развитии нервной системы]. Шэн Ли Кэ Сюэ Цзинь Чжань. 2001, 32: 197-203.
CAS PubMed Google Scholar
Caldeira MV, Melo CV, Pereira DB, Carvalho R, Correia SS, Backos DS, Carvalho AL, Esteban JA, Duarte CB: нейротрофический фактор мозга регулирует экспрессию и синаптическую доставку альфа-амино-3 субъединицы рецептора -гидрокси-5-метил-4-изоксазол пропионовой кислоты в нейронах гиппокампа.J Biol Chem. 2007, 282: 12619-12628. 10.1074 / jbc.M700607200.
Артикул CAS PubMed Google Scholar
Slipczuk L, Bekinschtein P, Katche C, Cammarota M, Izquierdo I, Medina JH: BDNF активирует mTOR для регулирования экспрессии GluR1, необходимой для формирования памяти. PLoS One. 2009, 4: e6007-10.1371 / journal.pone.0006007.
PubMed Central Статья PubMed Google Scholar
Song I, Huganir RL: Регулирование рецепторов AMPA во время синаптической пластичности. Trends Neurosci. 2002, 25: 578-588. 10.1016 / S0166-2236 (02) 02270-1.
Артикул CAS PubMed Google Scholar
Cunha C, Brambilla R, Thomas KL: Простая роль BDNF в обучении и памяти ?. Front Mol Neurosci. 2010, 3: 1-
PubMed Central PubMed Google Scholar
Sheikh AM, Malik M, Wen G, Chauhan A, Chauhan V, Gong CX, Liu F, Brown WT, Li X: антиапоптотический сигнальный путь BDNF-Akt-Bcl2 нарушен в мозгу аутичных субъектов. J Neurosci Res. 2010, 88: 2641-2647.
CAS PubMed Google Scholar
Camandola S, Mattson MP: NF-kappa B как терапевтическая мишень при нейродегенеративных заболеваниях. Эксперт считает, что цели. 2007, 11: 123-132. 10.1517 / 14728222.11.2.123.
Артикул CAS PubMed Google Scholar
van Loo G, De Lorenzi R, Schmidt H, Huth M, Mildner A, Schmidt-Supprian M, Lassmann H, Prinz MR, Pasparakis M: Ингибирование фактора транскрипции NF-kappaB в центральной нервной системе улучшает аутоиммунный энцефаломиелит у мышей. Nat Immunol. 2006, 7: 954-961. 10.1038 / ni1372.
Артикул CAS PubMed Google Scholar
Zhang G, Li J, Purkayastha S, Tang Y, Zhang H, Yin Y, Li B, Liu G, Cai D: Гипоталамическое программирование системного старения с участием IKK-beta, NF-kappaB и GnRH. Природа. 2013, 497: 211-216. 10.1038 / природа12143.
PubMed Central Статья CAS PubMed Google Scholar
Mattson MP, Culmsee C, Yu Z, Camandola S: Роль ядерного фактора kappaB в выживании и пластичности нейронов. J Neurochem. 2000, 74: 443-456.
Артикул CAS PubMed Google Scholar
Boersma MC, Dresselhaus EC, De Biase LM, Mihalas AB, Bergles DE, Meffert MK: потребность в ядерном факторе-kappaB в синаптогенезе, связанном с развитием и пластичностью. J Neurosci. 2011, 31: 5414-5425. 10.1523 / JNEUROSCI.2456-10.2011.
PubMed Central Статья CAS PubMed Google Scholar
Christoffel DJ, Golden SA, Dumitriu D, Robison AJ, Janssen WG, Ahn HF, Krishnan V, Reyes CM, Han MH, Ables JL и др.: Киназа IkappaB регулирует синаптическую и поведенческую пластичность, вызванную стрессом социального поражения. J Neurosci. 2011, 31: 314-321. 10.1523 / JNEUROSCI.4763-10.2011.
PubMed Central Статья CAS PubMed Google Scholar
Гутьеррес Х, Дэвис AM: Регулирование роста нервных процессов, развития и структурной пластичности с помощью NF-kappaB.Trends Neurosci. 2011, 34: 316-325. 10.1016 / j.tins.2011.03.001.
PubMed Central Статья CAS PubMed Google Scholar
Russo SJ, Wilkinson MB, Mazei-Robison MS, Dietz DM, Maze I, Krishnan V, Renthal W., Graham A, Birnbaum SG, Green TA и др.: Передача сигналов ядерного фактора каппа B регулирует морфологию нейронов и кокаиновая награда. J Neurosci. 2009, 29: 3529-3537. 10.1523 / JNEUROSCI.6173-08.2009.
PubMed Central Статья CAS PubMed Google Scholar
Kaltschmidt C, Kaltschmidt B, Baeuerle PA: Стимуляция ионотропных рецепторов глутамата активирует фактор транскрипции NF-каппа B в первичных нейронах. Proc Natl Acad Sci U S. A. 1995, 92: 9618-9622. 10.1073 / pnas.92.21.9618.
PubMed Central Статья CAS PubMed Google Scholar
Grilli M, Goffi F, Memo M, Spano P: Интерлейкин-1бета и глутамат активируют сайт связывания NF-kappaB / Rel из регуляторной области гена белка-предшественника амилоида в первичных культурах нейронов.J Biol Chem. 1996, 271: 15002-15007. 10.1074 / jbc.271.25.15002.
Артикул CAS PubMed Google Scholar
Грилли М., Пицци М., Мемо М., Спано П. Нейропротекция аспирином и салицилатом натрия посредством блокады активации NF-kappaB. Наука. 1996, 274: 1383-1385. 10.1126 / science.274.5291.1383.
Артикул CAS PubMed Google Scholar
Sarnico I, Boroni F, Benarese M, Alghisi M, Valerio A, Battistin L, Spano P, Pizzi M: нацеливание на IKK2 фармакологическим ингибитором AS602868 предотвращает эксайтотоксическое повреждение нейронов и олигодендроцитов. J Neural Transm. 2008, 115: 693-701. 10.1007 / s00702-007-0016-1.
Артикул CAS PubMed Google Scholar
Deng W, Aimone JB, Gage FH: Новые нейроны и новые воспоминания: как нейрогенез гиппокампа взрослых влияет на обучение и память ?.Nat Rev Neurosci. 2010, 11: 339-350. 10.1038 / номер 2822.
PubMed Central Статья CAS PubMed Google Scholar
Denis-Donini S, Dellarole A, Crociara P, Francese MT, Bortolotto V, Quadrato G, Canonico PL, Orsetti M, Ghi P, Memo M и др.: Нарушение нейрогенеза у взрослых, связанное с кратковременной памятью дефекты у мышей с дефицитом NF-kappaB p50. J Neurosci. 2008, 28: 3911-3919. 10.1523 / JNEUROSCI.0148-08.2008.
Артикул CAS PubMed Google Scholar
Sarnico I, Lanzillotta A, Boroni F, Benarese M, Alghisi M, Schwaninger M, Inta I, Battistin L, Spano P, Pizzi M: NF-kappaB p50 / RelA и димеры, содержащие c-Rel: противоположные регуляторы уязвимости нейронов до ишемии. J Neurochem. 2009, 108: 475-485. 10.1111 / j.1471-4159.2008.05783.x.
Артикул CAS PubMed Google Scholar
Lee RM, Gillet G, Burnside J, Thomas SJ, Neiman P: Роль Nr13 в регуляции запрограммированной гибели клеток в бурсе Фабрициуса.Genes Dev. 1999, 13: 718-728. 10.1101 / gad.13.6.718.
PubMed Central Статья CAS PubMed Google Scholar
Ricca A, Biroccio A, Trisciuoglio D, Cippitelli M, Zupi G, Del Bufalo D: сверхэкспрессия relA снижает онкогенность и активирует апоптоз в раковых клетках человека. Br J Canc. 2001, 85: 1914-1921. 10.1054 / bjoc.2001.2174.
Артикул CAS Google Scholar
Лу Б, Пан П. Т., Ву Н. Х .: Инь и ян действия нейротрофина. Nat Rev Neurosci. 2005, 6: 603-614. 10.1038 / номер 1726.
Артикул CAS PubMed Google Scholar
Ямада К., Набешима Т.: Нейротрофический фактор мозга / передача сигналов TrkB в процессах памяти. J Pharmacol Sci. 2003, 91: 267-270. 10.1254 / jphs.91.267.
Артикул CAS PubMed Google Scholar
Xiu MH, Hui L, Dang YF, Hou TD, Zhang CX, Zheng YL, Chen da C, Kosten TR, Zhang XY: Снижение уровней BDNF в сыворотке при хронической институциональной шизофрении при длительном лечении типичными и атипичными антипсихотиками. Prog Neuropsychopharmacol Biol Psychiatr. 2009, 33: 1508-1512. 10.1016 / j.pnpbp.2009.08.011.
Артикул CAS Google Scholar
Zuccato C, Cattaneo E: нейротрофический фактор головного мозга при нейродегенеративных заболеваниях.Nat Rev Neurol. 2009, 5: 311-322. 10.1038 / nrneurol.2009.54.
Артикул CAS PubMed Google Scholar
Block ML, Zecca L, Hong JS: Опосредованная микроглией нейротоксичность: раскрытие молекулярных механизмов. Nat Rev Neurosci. 2007, 8: 57-69. 10.1038 / номер 2038.
Артикул CAS PubMed Google Scholar
Софронев М.В., Винтерс Х.В.: Астроциты: биология и патология.Acta Neuropathol. 2010, 119: 7-35. 10.1007 / s00401-009-0619-8.
PubMed Central Статья PubMed Google Scholar
Данцер Р., О’Коннор Дж. К., Фройнд Г. Г., Джонсон Р. В., Келли К. В.: От воспаления к болезни и депрессии: когда иммунная система подчиняет себе мозг. Nat Rev Neurosci. 2008, 9: 46-56. 10.1038 / номер 2297.
PubMed Central Статья CAS PubMed Google Scholar
Saha RN, Liu X, Pahan K: Повышение регуляции BDNF в астроцитах с помощью TNF-альфа: пример нейропротекторной роли цитокина. J Neuroimmune Pharmacol. 2006, 1: 212-222. 10.1007 / s11481-006-9020-8.
PubMed Central Статья PubMed Google Scholar
Boycott HE, Wilkinson JA, Boyle JP, Pearson HA, Peers C: Дифференциальное участие TNF-альфа в гипоксическом подавлении транспортеров глутамата астроцитов. Глия.2008, 56: 998-1004. 10.1002 / glia.20673.
Артикул PubMed Google Scholar
Кэмпбелл К.Дж., Роча С., Перкинс Н.Д.: Активное подавление экспрессии антиапоптотического гена с помощью RelA (p65) NF-каппа B. Mol Cell. 2004, 13: 853-865. 10.1016 / S1097-2765 (04) 00131-5.
Артикул CAS PubMed Google Scholar
Dallas M, Boycott HE, Atkinson L, Miller A, Boyle JP, Pearson HA, Peers C: Гипоксия подавляет транспорт глутамата в астроцитах.J Neurosci. 2007, 27: 3946-3955. 10.1523 / JNEUROSCI.5030-06.2007.
Артикул CAS PubMed Google Scholar
Фучиками М., Ямамото С., Моринобу С., Такеи С., Ямаваки С.: Эпигенетическая регуляция гена BDNF в ответ на стресс. Психиатр-расследование. 2010, 7: 251-256. 10.4306 / pi.2010.7.4.251.
Артикул CAS Google Scholar
Li X, Wei W, Ratnu VS, Bredy TW: О потенциальной роли активного деметилирования ДНК в установлении эпигенетических состояний, связанных с нейрональной пластичностью и памятью.Neurobiol Learn Mem. 2013, 105: 125-132.
Артикул PubMed Google Scholar
Lubin FD, Roth TL, Sweatt JD: Эпигенетическая регуляция транскрипции гена BDNF в консолидации памяти о страхе. J Neurosci. 2008, 28: 10576-10586. 10.1523 / JNEUROSCI.1786-08.2008.
PubMed Central Статья CAS PubMed Google Scholar
Sik A, Hajos N, Gulacsi A, Mody I, Freund TF: Отсутствие основного пути передачи сигналов Ca2 + в ГАМКергических нейронах гиппокампа.Proc Natl Acad Sci U S. A. 1998, 95: 3245-3250. 10.1073 / pnas.95.6.3245.
PubMed Central Статья CAS PubMed Google Scholar
Хан HJ, Аллен CC, Buchovecky CM, Йетман MJ, Born HA, Marin MA, Rodgers SP, Song BJ, Lu HC, Justice MJ и др.: Фон напряжения влияет на нейротоксичность и поведенческие аномалии у мышей, выражающих трансактиватор тетрациклина. J Neurosci. 2012, 32: 10574-10586. 10.1523 / JNEUROSCI.0893-12.2012.
PubMed Central Статья CAS PubMed Google Scholar
Schips TG, Wietelmann A, Hohn K, Schimanski S, Walther P, Braun T, Wirth T., Maier HJ: FoxO3 вызывает обратимую сердечную атрофию и аутофагию в модели трансгенных мышей. Cardiovasc Res. 2010, 91: 587-597.
Артикул Google Scholar
Schmidt-Strassburger U, Schips TG, Maier HJ, Kloiber K, Mannella F, Braunstein KE, Holzmann K, Ushmorov A, Liebau S, Boeckers TM, Wirth T: экспрессия конститутивно активных FoxO3 отведений в переднем мозге мыши к потере нейральных предшественников.FASEB J. 2012, 26 (12): 4990-5001. 10.1096 / fj.12-208587. DOI: 10.1096 / fj.12-208587. Epub 2012 30 авг.
Статья CAS PubMed Google Scholar
Schmued LC, Albertson C, Slikker W: Fluoro-Jade: новый флуорохром для чувствительной и надежной гистохимической локализации дегенерации нейронов. Brain Res. 1997, 751: 37-46. 10.1016 / S0006-8993 (96) 01387-Х.
Артикул CAS PubMed Google Scholar
Paxinos G, Franklin KBJ: Мозг мыши в стереотаксических координатах. 2001
Google Scholar
Аспирин подавляет инвазию IKK-β-опосредованного рака простаты за счет нацеливания на матриксную металлопротеиназу-9 и активатор плазминогена урокиназного типа — FullText — Cellular Physiology and Biochemistry 2017, Vol. 41, № 4
Абстрактные
Предпосылки / цели: Было продемонстрировано, что аспирин обладает сильными химиопрофилактическими и противораковыми эффектами в отношении рака простаты.Однако более подробные молекулярные механизмы действия аспирина для подавления инвазии клеток рака простаты до сих пор не выяснены. Методы: Анализы Transwell были выполнены для оценки эффектов аспирина на клеточную инвазию. Активность матричных металлопротеиназ (ММР) и сериновых протеиназ в клеточной среде исследовали с помощью желатиновой зимографии и ELISA. Кроме того, для оценки влияния аспирина на активацию IKK-β измеряли ингибитор фосфорилирования киназы-β (IKK-β) и активность киназы IKK-β. Результаты: Мы обнаружили, что аспирин подавляет инвазию и прикрепление в клетках рака простаты человека. Лечение аспирином значительно привело к снижению матриксной металлопротеиназы-9 (MMP-9) и усилению активности тканевых ингибиторов металлопротеиназы-1 (TIMP-1), которые являются протеолитическими ферментами, способствующими деградации внеклеточного матрикса и базальной мембраны при клеточной инвазии. и метастазы. Наши данные также показали, что аспирин способен подавлять экспрессию активатора плазминогена урокиназного типа (uPA) и ингибитора активатора плазминогена-1 (PAI-1) в клетках.Кроме того, лечение аспирином вызывало сильное снижение активации ядерного фактора-каппа B (NF-κB), ингибитора фосфорилирования κB (IκB) -α вместе с транслокацией NF-κB p65 в ядро и активацией киназы IκB (IKK) — β. . Более того, ингибирующие эффекты аспирина на клеточную инвазию были отменены сверхэкспрессией IKK-β, в то время как ингибитор IKK сенсибилизирует антиинвазивный эффект аспирина в клетках рака простаты. Заключение: Настоящее исследование пришло к выводу, что аспирин подавляет инвазию клеток рака простаты за счет снижения активности MMP-9 и экспрессии uPA за счет снижения IKK-β-опосредованной активации NF-κB, что указывает на то, что способность аспирина ингибировать клеточную инвазию может быть полезным в химиопрофилактике метастатического рака простаты.
© 2017 Автор (ы) Опубликовано S. Karger AG, Базель
Введение
Рак простаты — одно из наиболее часто диагностируемых злокачественных новообразований среди мужчин в мире [1, 2]. Первоначальное лечение рака простаты заключается в подавлении выработки андрогенов яичками путем медикаментозной или хирургической кастрации, но у многих пациентов болезнь прогрессирует. Поскольку не существует эффективных методов лечения распространенного рака простаты с гормонорезистентным или метастатическим фенотипом, очевидна потребность в разработке новых методов, которые могли бы ингибировать прогрессирование или инвазивные способности рака простаты.
Важным этапом в процессе инвазии и метастазирования рака является проникновение во внеклеточный матрикс (ЕСМ) и базальную мембрану, что требует действия протеаз [3]. Ряд протеолитических ферментов, включая матриксные металлопротеиназы (MMP) и сериновые протеиназы, вносят вклад в деградацию ECM в связи с инвазией рака. ММП представляют собой большое семейство протеолитических ферментов, которые могут расщеплять компоненты внеклеточного матрикса. Повышенная активность ММП связана с метастазами при многих типах рака и связана с продвинутой стадией рака и плохим прогнозом пациента [4].Среди ММП желатиназа-A (MMP-2) и желатиназа-B (MMP-9) представляют собой ключевые ферменты для разрушения коллагена типа IV, который является основным компонентом базальной мембраны [5]. Сообщается, что повышенная экспрессия MMP-2 и MMP-9 хорошо известна как способствующие развитию метастазов рака предстательной железы [6], а как MMP-2, так и MMP-9 полезны для прогнозирования прогрессирования рака простаты [7]. Помимо ММП, активаторы плазминогена также участвуют в адгезии и инвазии клеток [8]. Сериновые протеазы активатор плазминогена урокиназного типа (uPA) и его высоко гликозилированный рецептор (uPAR) вместе с ингибитором активатора плазминогена-1 (PAI-1) ответственны за инвазивные характеристики раковых клеток [8].uPA обладает способностью разрушать компоненты ECM, включая ламинин, фибронектин и коллаген, и считается особенно эффективной протеолитической системой при инвазии и метастазах клеток рака простаты [9]. Более того, высокая экспрессия uPA обнаруживается у пациентов с раком простаты по сравнению с пациентами с доброкачественной гиперплазией простаты [10]. Таким образом, представляется разумным рассматривать uPA в качестве допустимой терапевтической мишени и оценивать преимущества блокирования uPA с помощью доступного в настоящее время лечения для предотвращения инвазии и метастазирования при раке простаты.
Сообщалось, что экспрессия ММР и uPA / uPAR находится под регуляцией внеклеточных медиаторов, таких как факторы роста и внутриклеточная передача сигналов, несколькими транскрипционными факторами, такими как ядерный фактор-kappaB (NF-κB) [11, 12]. NF-κB является ключевым фактором транскрипции, участвующим в регуляции экспрессии многих хемокинов и цитокинов, тем самым играя критическую роль в опосредовании воспаления, иммунитета, апоптоза и миграции в раковых клетках. Это димерный фактор транскрипции, состоящий из гомо- или гетеродимера, состоящего из p65 и p50 или близкородственных белков.Обычно NF-κB находится в цитоплазме и образует мультибелковый комплекс с ингибитором NF-κB (IκB). При активации стимулами сигнал активирует киназу IκB (IKK), которая может фосфорилировать IκBα и приводить к его убиквитинизации и деградации [13]. Эти процессы приводят к тому, что высвобожденный NF-κB попадает в ядро и регулирует ряд последующих генов-мишеней [14]. Недавно было продемонстрировано, что блокада активации NF-κB подавляет высвобождение клетками многих медиаторов, в конечном итоге модулируя выживаемость, инвазию, пролиферацию и гибель клеток [12, 15].Следовательно, модуляция NF-κB и связанной с ним экспрессии генов, тем не менее, важна для лечения рака.
Аспирин — нестероидное противовоспалительное средство, которое, как сообщается, играет важную роль в химиопрофилактике канцерогенеза. Было высказано предположение, что противовоспалительная активность аспирина заключается в ингибировании циклооксигеназы-2, NF-κB, iNOS и различных цитокинов [15, 16]. Многие исследования были сосредоточены на аспирине и его способности подавлять инвазию ряда раковых клеток, включая клетки рака груди, толстой кишки, пищевода и легких [17, 18].Более того, есть некоторые свидетельства того, что использование аспирина обратно связано с риском развития рака простаты [19, 20], а аспирин также влияет на рост и метастазирование рака простаты, подавляя активность рецептора андрогена и простатоспецифического антигена [21]. , 22]. Однако потенциальные молекулярные механизмы, с помощью которых аспирин ингибирует инвазию клеток рака простаты, не были четко выяснены.
В настоящем исследовании мы показали, что аспирин подавляет инвазию клеток рака простаты посредством модуляции протеолитических ферментов, которые зависят от IKK-β-опосредованной активации NF-κB.Наши результаты показали роль аспирина как эффективного агента для негативной регуляции инвазии и метастазирования раковых клеток и предположили, что предотвращение инвазии может быть терапевтической стратегией при лечении рака простаты.
Материалы и методы
Химические вещества, реагенты и культура клеток
Аспирин был приобретен у Sigma-Aldrich (Сент-Луис, Миссури) и растворен в 100% этаноле в исследованиях. Эффекты аспирина в экспериментах сравнивали с такой же концентрацией этанола в качестве носителя.Антитела к гистону h3B, β-актину и NF-κB p65 были предоставлены Santa Cruz Biotechnology (Санта-Крус, Калифорния). Антитела к IκB-α, фосфо-IκB-α, IKK-α, IKK-β и фосфо-IKK-α / β были получены от Cell Signaling Technology (Беверли, Массачусетс). IKK-β-специфический ингибитор Bay 65-1942 был от ApexBio Technology (Хьюстон, Техас). Клетки рака предстательной железы человека DU145, LNCaP и PC-3 были приобретены в American Type Cell Collection (Манассас, Вирджиния, США) и культивированы в RPMI-1640, содержащем пенициллин (100 МЕ / мл), стрептомицин (100 мг / мл) с 10% фетальная бычья сыворотка (Hyclone, South Logan, UT).
Анализ клеточной инвазии
Клетки обрабатывали носителем или аспирином, затем проводили трансвелл-анализы в соответствии с ранее описанным [23]. Вкратце, трансвеллеры были покрыты Matrigel (BD Biosciences, Сан-Диего, Калифорния) для анализа клеточной инвазии. Клетки обрабатывали носителем или аспирином в течение 48 часов, а затем клетки высевали с плотностью 5 × 10 4 клеток в верхние камеры трансвеллеров. Нижние камеры были заполнены средой, содержащей носитель или аспирин.После 12 ч инкубации при 37 ° C клетки, проникшие через матригель, фиксировали и подсчитывали под микроскопом.
Анализ прикрепления клеток
Клетки обрабатывали носителем или аспирином в течение 48 часов, а затем клетки высевали в 24-луночные планшеты для тканевых культур с плотностью 10 5 клеток / лунку в 2 мл среды. После инкубации в течение 1 часа при 37 ° C клетки промывали фосфатно-солевым буфером и инкубировали с 2 мл среды еще в течение 1 часа при 37 ° C. После отмывания неприкрепленных клеток прикрепленные клетки окрашивали 0.5% кристаллический фиолетовый в метаноле в течение 10 мин и подсчитывают под микроскопом.
Желатиновая зимография
Для желатиновой зимографии равное количество клеток инкубировали в присутствии или в отсутствие аспирина. Затем собирали клеточную среду и желатинолитической активностью MMP-2, MMP-9, тканевых ингибиторов металлопротеиназы (TIMP) -1 и TIMP-2 определяли с помощью желатиновой зимографии. Вкратце, образцы подвергали невосстановленному SDS-PAGE с использованием 12% геля, содержащего 0,1% желатина. После электрофореза гели промывали в 2 раза.5% раствор Тритона Х-100 при комнатной температуре. Затем гели инкубировали в течение ночи в реакционном буфере (50 мМ Трис / pH 7,4, 100 мМ NaCl, 10 мМ CaCl 2 и 0,02% NaN 3 ) при 37 ° С и окрашивали Кумасси синим.
Анализы активности MMP-2, MMP-9, TIMP-1 и TIMP-2
Активность MMP-2, MMP-9, TIMP-1 и TIMP-2 в клеточной среде оценивали с помощью MMP-2, MMP -9, TIMP-1 и TIMP-2 Amersham Biotrak TM (Amersham Biosciences) в соответствии с инструкциями производителя.Эти анализы основаны на методике количественного иммуноферментного сэндвич-анализа. Перед анализом образцы центрифугировали и проводили три анализа, с каждым образцом в трех экземплярах. Измерения проводили с использованием считывающего устройства для ELISA в спектрофотометре микропланшетов, и результаты рассчитывали как отношение поглощения клеток, обработанных аспирином, к поглощению клеток, обработанных носителем.
Количественное определение уровней uPA и PAI-1
Клетки обрабатывали носителем или аспирином, а затем собирали клеточную среду.Уровни секретируемого uPA и PAI-1 определяли с использованием набора uPA ELISA (Abcam, Кембридж, Великобритания) и набора PAI-1 ELISA (Abcam, Кембридж, Великобритания) в соответствии с инструкциями производителя. Поглощение измеряли при 450 нм с использованием спектрофотометра для микропланшетов. Каждый анализ проводили в трех экземплярах.
Люциферазные анализы
Репортерная конструкция люциферазы NF-κB (NF-κB-Luc), содержащая четыре копии цис-действующих элементов NF-κB, связанных с ТАТА-боксом, была клонирована в базовый вектор pGL3 [24].Клетки помещали в 24-луночные планшеты, затем клетки котрансфицировали плазмидой NF-κB-Luc и плазмидой внутреннего контроля renilla luciferase (pRL-TK) с использованием реагента для трансфекции Lipofectamine 2000 (Invitrogen, Carlsbad, CA), как описано ранее. [25]. Клетки собирали после обработки аспирином, и активность люциферазы измеряли с использованием системы анализа двойных люциферазных репортеров (Promega, Madison, WI). Была измерена активность люциферазы светлячков, и показания были нормализованы по активности люциферазы renilla, которая служила внутренним контролем эффективности трансфекции.
Анализ активности киназы IKK-β
Активность киназы IKK-β определяли с помощью набора HTScan IKK-β Kinase Assay Kit (Cell Signaling Technology). Набор содержит белок киназы GST-IKK-β, биотинилированный пептидный субстрат и фосфосериновое антитело для обнаружения фосфорилированной формы субстратного пептида. Анализ проводили в соответствии с протоколом производителя.
Аденовирусная инфекция
Клетки трансфицировали либо аденовирусами, кодирующими IKK-β, либо β-галактозидазу (β-gal), как описано ранее [26].Трансдукцию аденовирусным вектором проводили в среде в течение ночи, а затем через 24 часа вирусосодержащую среду заменяли свежей средой. Клетки инфицировали аденовирусом IKK-β или β-gal при множественности инфицирования (MOI) 50 в течение 24 часов, достигая примерно 80-90% трансдукции.
Ядерное фракционирование
Клетки обрабатывали, а затем клетки собирали ледяным PBS. Экстракцию ядерного белка проводили по модифицированному протоколу, как описано ранее [13].Вкратце, клетки собирали в буфере для гипотонического лизиса (10 ммоль / л HEPES, pH 7,9, 10 ммоль / л KCl, 0,2 ммоль / л EDTA, 0,1 ммоль / л фенилметилсульфонилфторид и 1 ммоль / л дитиотреитол) с коктейлем ингибиторов протеаз. и инкубировали на льду 5 мин. Лизат клеток охлаждали на льду в течение 10 минут, а затем энергично встряхивали в течение 10 минут в присутствии 0,6% Nonidet P-40. Ядерную фракцию осаждали центрифугированием. Ядерное фракционирование экстрагировали добавлением высокосолевого буфера (20 ммоль / л HEPES, pH 7.9, 400 ммоль / л KCl, 0,2 ммоль / л EDTA, 0,2 ммоль / л фенилметилсульфонилфторида и 1 ммоль / л дитиотреитола с коктейлем ингибиторов протеазы) при непрерывном встряхивании, затем центрифугировали и собирали супернатанты.
Вестерн-блот-анализ
Клетки обрабатывали, затем клетки готовили лизисным буфером и выполняли вестерн-блот-анализ [25]. Белки разделяли с помощью 10% SDS-PAGE, затем переносили на мембраны PVDF и подвергали блоттингу первичными антителами против гистона h3B (1: 400), β-актина (1: 400), NF-κB p65 (1: 400), IκB. -α (1: 1000), фосфо-IκB-α (1: 1000), IKK-α (1: 1000), IKK-β (1: 1000) и фосфо-IKK-α / β (1: 1000) при 4 ° C в течение ночи, а затем инкубируют со вторичным антителом (1: 10000) в течение 2 часов.Блоты нормализовали по β-актину или гистону h3B. Эксперименты повторяли не менее трех раз.
Статистический анализ
Все анализы проводили в трех экземплярах. Результаты анализировали с помощью двустороннего непарного t-критерия Стьюдента с использованием программного обеспечения SPSS (SPSS, Inc., Чикаго, Иллинойс, США) для оценки статистической значимости различий между группами. Данные были представлены как среднее значение ± стандартное отклонение от трех независимых экспериментов. Для всех анализов различия считались значимыми при P <0.05.
Результаты
Аспирин подавил инвазивный потенциал клеток рака простаты
Одной из основных характеристик метастазов является инвазивная способность раковых клеток, поэтому влияние аспирина на инвазию клеток рака простаты было изучено с помощью анализов Transwell. Как показано на рис. 1A, мы обнаружили, что инвазия клеток DU145, LNCaP и PC-3 снизилась примерно на 47%, 66% и 55% после обработки аспирином 5 ммоль / л (P <0,05, P <0,05 и P <0,05 соответственно).Кроме того, мы также исследовали влияние аспирина на прикрепление клеток и обнаружили, что 5 ммоль / л аспирина снижает прикрепление клеток на 72%, 76% и 87% в клетках DU145, LNCaP и PC-3 соответственно (все P <0,05 ; Рис. 1Б).
Рис. 1.
Влияние аспирина на инвазию и прикрепление клеток в клетках рака простаты. (A) Клетки обрабатывали носителем или аспирином (0-5 ммоль / л) в течение 48 часов с последующим 12-часовым периодом инвазии, а затем подсчитывали проникающие клетки в нижнюю мембрану.(B) Клетки обрабатывали носителем или аспирином (0-5 ммоль / л) в течение 48 часов перед 1-часовым анализом прикрепления и подсчитывали прикрепленные клетки. Данные были выражены как кратные изменения относительно клеток, обработанных носителем. Результаты выражали как среднее значение ± стандартное отклонение трех независимых экспериментов. * P <0,05 по сравнению с группой носителя.
Аспирин влиял на активность ММР в клетках рака простаты
Чтобы изучить механизмы, лежащие в основе антиинвазивных эффектов аспирина в клетках рака простаты, исследовали уровни секретируемой активности ММП в клеточной среде.Как показано на фиг. 2A и 2B, активность MMP-9 была значительно подавлена аспирином 5 ммоль / л в клетках DU145, LNCaP и PC-3. Однако на активность MMP-2 аспирин практически не влиял (рис. 2A и 2C).
Рис. 2.
Влияние аспирина на активность ММП-9 и ММП-2. Клетки обрабатывали носителем или аспирином (0-5 ммоль / л) в течение 48 часов, а затем собирали среду. (A) Активность ММП-9 и ММП-2 анализировали с помощью зимографии желатина. Активности выражали как кратные изменения относительно клеток, обработанных носителем, с помощью денситометрического анализа.Кроме того, активности MMP-9 (B) и MMP-2 (C) также анализировали с помощью анализа Amersham Biotrak TM . Результаты были представлены как кратные изменения относительно клеток, обработанных носителем. * P <0,05 по сравнению с группой носителя.
Большинство ММП ингибируются специфическими ингибиторами ТИМП, поэтому мы также проверили, регулирует ли аспирин активности ТИМП-1 и ТИМП-2. Как показано на фиг. 3A и 3B, активность TIMP-1 индуцировалась в клетках DU145 и PC-3 после обработки аспирином 5 ммоль / л, тогда как влияние аспирина на активность TIMP-1 было умеренным в клетках LNCaP.Кроме того, аспирин практически не влиял на активность ТИМП-2 во всех клетках (рис. 3С и 3D). Данные свидетельствуют о том, что аспирин ингибирует инвазию клеток рака простаты частично за счет модуляции активности как ММР-9, так и ТИМП-1 в клетках рака простаты.
Рис. 3.
Влияние аспирина на активность ТИМП-1 и ТИМП-2. Клетки обрабатывали носителем или аспирином (0-5 ммоль / л) в течение 48 часов, а затем собирали среду. (А) Активность ТИМП-1 анализировали с помощью желатиновой зимографии.(B) Активность ТИМП-1 анализировали с помощью анализа Amersham Biotrak TM . (C) Активность ТИМП-2 анализировали с помощью желатиновой зимографии. Активность выражали как кратные изменения относительно клеток, обработанных носителем, с помощью денситометрического анализа. (D) Активность ТИМП-2 анализировали с помощью анализа Amersham Biotrak TM . Результаты были представлены как кратные изменения относительно клеток, обработанных носителем. * P <0,05 по сравнению с группой носителя.
Аспирин регулирует уровни uPA и PAI-1 в клетках рака простаты
Показано, что uPA и PAI-1 участвуют в инвазивной активности рака и играют важную роль в миграции клеток [8, 27], поэтому Было изучено влияние аспирина на количество uPA и PAI-1.Как показано на фиг. 4A и фиг. 4B, уровни секретируемого uPA и PAI-1 значительно снизились в клетках рака простаты после лечения аспирином 5 ммоль / л.
Рис. 4.
Влияние аспирина на уровни секретируемого uPA и PAI-1. Клетки обрабатывали носителем или аспирином (0-5 ммоль / л) в течение 48 часов, а затем определяли уровни uPA (A) и PAI-1 (B) в клеточной среде. Результаты были представлены как кратные изменения относительно клеток, обработанных носителем. * P <0,05 по сравнению с группой носителя.
Аспирин подавляет активацию NF-κB в клетках рака простаты
NF-κB постоянно активируется при различных злокачественных новообразованиях человека, включая рак простаты, и он может регулировать экспрессию многих генов роста и биологическое поведение клеток [15, 28]. Таким образом, была определена роль NF-κB в инвазии клеток после лечения аспирином. Используя анализ экспрессии репортерного гена NF-κB-luc, мы обнаружили, что обработка аспирином вызывает сильное снижение активации NF-κB в клетках DU145, и аналогичные результаты были обнаружены в клетках LNCaP и PC-3 (рис.5А). Соответственно, экспрессия NF-κB p65 в ядре, которая была индикатором транскрипционной активности NF-κB, также ингибировалась в этих клетках, обработанных аспитином (фиг. 5B).
Рис. 5.
Влияние аспирина на активацию NF-κB. (A) Клетки трансфицировали репортером NF-κB-luc в течение 24 часов, затем клетки обрабатывали аспирином (5 ммоль / л) в течение 48 часов и измеряли транскрипционную активность NF-κB с помощью анализа активности люциферазы. Результаты были представлены как кратные изменения относительно клеток, обработанных носителем.(B) Клетки обрабатывали аспирином (5 ммоль / л) в течение 48 часов, готовили экстракты ядер клеток, и экстракт анализировали на экспрессию NF-κB p65 с помощью вестерн-блоттинга. Представляющие интерес полосы были нормализованы относительно гистона h3B, и данные были представлены в виде отношений относительной плотности. (C) Экстракты клеточной цитоплазмы измеряли на экспрессию IκB-α и p-IκB-α. Представляющие интерес полосы были нормализованы относительно β-актина, и данные были представлены в виде отношений относительной плотности. Данные были выражены как среднее значение ± стандартное отклонение трех независимых экспериментов.* P <0,05 по сравнению с группой носителя.
Сообщается, что клетки PC-3 и DU145 обладают высокоинвазивным поведением по сравнению с клетками LNCaP [29], что согласуется с данными настоящего исследования. Поэтому мы использовали клетки DU145, которые были более агрессивными и экспрессировали высокие уровни MMP-9 и uPA по сравнению с клетками PC-3 и LNCaP, для проведения дальнейших экспериментов. Мы выбрали 5 мкмоль / л аспирина, концентрация которого может снизить инвазию клеток DU145, чтобы исследовать регуляцию аспирина на активацию NF-κB.Как показано на фиг. 5C, мы обнаружили, что аспирин резко ингибирует цитоплазматический уровень деградации и фосфорилирования IκB-α.
Аспирин подавлял клеточную инвазию посредством подавления активации IKK-β
Фосфорилирование IκB с помощью IKK является важным этапом активации NF-κB [13, 14]. Чтобы прояснить молекулярные механизмы, с помощью которых аспирин ингибировал активацию NF-κB в клетках рака простаты, мы изучили, влияет ли аспирин на активацию IKK в клетках DU145. Как показано на рис.6A и 6B, лечение аспирином резко подавляло фосфорилирование IKK-β и активность киназы IKK-β, но не влияло на IKK-α.
Рис. 6.
Роль активации IKK-β в эффектах аспирина на клеточную инвазию. (A) Клетки DU145 обрабатывали аспирином (5 ммоль / л) в течение 48 часов. Был проведен вестерн-блоттинг для обнаружения белков IKK-β, IKK-α, фосфо-IKK-β и фосфо-IKK-α. Представляющие интерес полосы были нормализованы относительно β-актина, и данные были представлены в виде отношений относительной плотности.(B) Активность киназы IKK-β измеряли с помощью набора для анализа IKK-β киназы. Данные были выражены как среднее ± стандартное отклонение. * P <0,05 по сравнению с группой носителя. (C) Клетки DU145 инфицировали аденовирусом IKK-β в течение 24 часов, затем клетки обрабатывали аспирином (5 ммоль / л) в течение 48 часов и исследовали клеточную инвазию с помощью анализов трансвелл. Данные были выражены как кратные изменения относительно клеток, обработанных носителем. Результаты выражали как среднее значение ± стандартное отклонение трех независимых экспериментов. * Р <0,05. (D) Клетки DU145 инфицировали аденовирусом IKK-β, затем обрабатывали аспирином (5 ммоль / л) в течение 48 часов или обрабатывали аспирином (5 ммоль / л) в присутствии IKK-β-специфического ингибитора Bay 65-1942. (2 мкмоль / л) в течение 48 часов, а затем активность ММП-9, ММП-2 и ТИМП-1 анализировали с помощью желатиновой зимографии.(E) Уровни секретируемого uPA и PAI-1 определяли в клеточной среде. * P <0,05 по сравнению с группой носителя. (F) Экспрессия ядерного NF-κB p65 и общего IκB-α была проанализирована с помощью вестерн-блоттинга. (G) Клетки DU145 обрабатывали аспирином (5 ммоль / л) в присутствии Bay 65-1942 (2 мкмоль / л) в течение 48 часов, и инвазию клеток исследовали с помощью анализов трансвелл. * Р <0,05.
Кроме того, мы сверхэкспрессировали или подавляли IKK-β и исследовали активацию NF-κB и клеточную инвазию. Как показано на рис.6C, положительное влияние аспирина на клеточную инвазию было эффективно обращено сверхэкспрессией IKK-β, и это было подтверждено обнаружением активности MMP-9 (фиг. 6D), уровней секретируемого uPA и PAI-1 (фиг. 6E). Точно так же ингибирующий эффект аспирина на активацию NF-κB также отменялся сверхэкспрессией IKK-β (фиг. 6F). Кроме того, IKK-β-специфический ингибитор Bay 65-1942 усиливал эффекты аспирина на клеточную инвазию и активацию NF-κB (фиг. 6D, 6E, 6F и 6G). Таким образом, эти результаты предполагают, что подавление IKK-β-опосредованной активации NF-κB может способствовать ингибирующим эффектам аспирина на клеточную инвазию.
Обсуждение
Подавление клеточной инвазии в злокачественные клетки — важное свойство химиопрофилактических агентов. Сообщается, что аспирин эффективен в подавлении роста клеток при агрессивном раке простаты [19, 20]. Однако понимание роли аспирина в инвазии клеток рака простаты все еще отсутствует. В этом исследовании наши результаты показали, что ингибирующие эффекты аспирина на инвазию клеток рака простаты были связаны с подавлением активности MMP-9 и экспрессии секретируемого uPA, которые зависели от IKK-β-опосредованной активации NF-κB.
При инвазии и метастазировании раковых клеток деградация ECM была предложена как важный процесс. В нашем исследовании мы обнаружили, что аспирин подавляет активность MMP-9 с меньшим влиянием на MMP-2 в клетках рака простаты. Указывается, что MMP-9 играет важную роль в прогрессировании различных типов рака, а обильная экспрессия MMP-9, по-видимому, связана с инвазией и агрессивностью клеток рака простаты [30]. Многие исследования показали, что ингибирование инвазии, опосредованной MMP-9, снижает частоту метастазирования клеток и выживаемость рака, предполагая, что подавление MMP-9 полезно у пациентов, страдающих раком [6, 7].MMP-9 ингибируется специфическим ингибитором TIMP-1, который может подавлять ангиогенез и инвазию опухоли путем ингибирования деградации ECM [31]. Наши исследования также показывают, что аспирин увеличивает активность ТИМП-1 в раковых клетках. В общем, связывание ТИМП-1 с активным сайтом ММП-9 приводит к эффективному ингибированию активности ММП-9, а сверхэкспрессия ТИМП-1 снижает рост и инвазию раковых клеток [32]. Следовательно, это означает, что баланс между уровнями MMP-9 и TIMP-1 является критическим детерминантом метастатической активности клеток рака простаты, а также предполагает, что инвазивная и метастатическая способность раковых клеток может быть изменена путем изменения MMP-9. : Соотношение ТИМП-1 [33].Однако следует отметить, что активность ТИМП-1 в клетках LNCaP существенно не изменилась по сравнению с двумя другими протестированными клетками. Это может способствовать более низкой активности NF-κB, экспрессируемой в клетках LNCaP, по сравнению с клетками DU145 и PC-3. Несмотря на это, аспирин по-прежнему оказывает значительное влияние на MMP-2 и клеточную инвазию, что позволяет предположить, что TIMP-1, вероятно, играет незначительную роль в антиинвазивных эффектах аспирина на клетки LNCaP. Поскольку линия клеток LNCaP является линией клеток простаты, созданной с функциональными рецепторами андрогенов и экспрессией простатоспецифического антигена, мы предполагаем, что аспирин играет уникальную роль в различных видах инвазии клеток рака простаты.Кроме того, показано, что экспрессия VEGF, ICAM-1 и IL-8, которая может быть индуцирована экспрессией MMP-9 [34, 35], значительно выше в более метастатических клетках PC-3 и DU-145. по сравнению со слабометастатическими клетками LNCaP [36]. Таким образом, эти отчеты показывают возможную взаимосвязь между экспрессией MMP и проангиогенными факторами, в свою очередь, связаны с повышенной инвазивной способностью рака.
Повышающая регуляция uPA в тканях тесно связана с подвижностью клеток, что может способствовать деградации ECM путем преобразования зимогенного плазминогена в плазмин [37].Считается, что PAI-1 является ингибитором uPA [38]. Помимо связывания с uPA, PAI-1 также может присоединяться к ECM и регулировать клеточную адгезию и миграцию независимо от его способности ингибировать протеазу [27]. Более того, показано, что PAI-1 способствует, а не ингибирует инвазию и метастазирование [38, 39]. Он может защищать раковые клетки от апоптоза и ускорять прогрессирование рака [40], а повышенная экспрессия PAI-1 является индикатором плохого прогноза при многих формах рака [41]. Здесь мы показываем, что лечение аспирином подавляет уровни секретируемого uPA и PAI-1, и это указывает на то, что аспирин может достигать антиинвазивных эффектов в клетках рака простаты человека частично посредством регуляции уровней uPA и PAI-1.
Предыдущие исследования показали, что ингибирование NF-κB значительно снижает клеточную инвазию и ангиогенез на животной модели рака простаты [12]. Молекулярные механизмы воздействия аспирина на NF-κB-опосредованную инвазию в клетки рака простаты не были полностью определены, хотя некоторые полезные подсказки предоставлены предыдущими данными. В одном исследовании сообщалось, что ингибирующий эффект аспирина на активацию NF-κB в клетках рака простаты приводит к подавлению секреции uPA [42].В наших исследованиях лечение аспирином могло подавлять активацию NF-κB, фосфорилирование IκB-α вместе с транслокацией NF-κB p65 в ядро и активацию IKK-β. Важно подчеркнуть, что аспирин специфически подавляет активацию IKK-β. IKK-β имеет решающее значение для транслокации и активации NF-κB, и он может фосфорилировать IκB в N-концевых участках, что приводит к их убиквитинизации и деградации в цитоплазме. В наших исследованиях мы обнаружили, что опосредованное аспирином ингибирование клеточной инвазии отменяется сверхэкспрессией IKK-β, в то время как ингибитор IKK сенсибилизирует антиинвазивный эффект аспирина в клетках рака простаты.Помимо NF-κB, имеется множество доказательств того, что инвазивная способность раковых клеток связана с активацией митоген-активируемых протеинкиназ, таких как ERK1 / 2 [43]. Недавние исследования показали, что фосфорилирование ERK1 / 2 способствует секреции ММП и увеличивает метастазирование клеток рака простаты [44]. Активация ERK1 / 2 может индуцировать экспрессию многих факторов транскрипции, таких как AP-1. ДНК-связывающий элемент AP-1 присутствует во всех промоторах MMP и играет доминирующую роль в активации транскрипции MMP [45].Повышенная экспрессия c-Jun и c-Fos приводит к повышенной экспрессии MMP и способствует инвазии раковых клеток [46, 47]. Кроме того, известно, что активация нескольких других путей, включая N-концевую киназу c-Jun (JNK), p38 и Akt, которые могут индуцировать экспрессию MMP и участвовать во многих типах клеток, является достаточной для индукции инвазивной способности. рака простаты [48-50]. Следовательно, мы предполагаем, что могут существовать другие сигналы, с помощью которых аспирин подавляет клеточную инвазию, и необходимы дальнейшие исследования для выявления дополнительных доказательств.
Таким образом, в этом отчете сделан вывод, что аспирин подавляет инвазию клеток рака предстательной железы за счет снижения активности MMP-9 и секретируемой экспрессии uPA за счет снижения IKK-β-опосредованной активации NF-κB, подтверждая гипотезу о том, что аспирин снижает риск инвазивного рака и предлагает обоснование использования аспирина для предотвращения метастатического рака простаты.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (№ 81402510, 11672332 и 11102235), Национальным планом ключевых исследований и разработок Китая (№2016YFC1101500) и Фонд естественных наук провинции Хэбэй (№ h3015206139).
Заявление о раскрытии информации
Авторы заявили об отсутствии конфликта интересов.
Список литературы
- Hsing AW, Tsao L, Devesa SS: Международные тенденции и закономерности заболеваемости и смертности от рака простаты.Int J Cancer 2000; 85: 60-67.
- Haas GP, Delongchamps N, Brawley OW, Wang CY, de la Roza G: Всемирная эпидемиология рака простаты: перспективы аутопсийных исследований. Кан Дж. Урол 2008; 15: 3866-3871.
- Трюггвасон К., Хойхтя М., Сало Т.: Протеолитическая деградация внеклеточного матрикса при опухолевой инвазии.Biochim Biophys Acta 1987; 907: 191-217.
- Roomi MW, Monterrey JC, Kalinovsky T., Rath M, Niedzwiecki A: Паттерны экспрессии mmp-2 и mmp-9 в линиях раковых клеток человека. Онкол Реп 2009; 21: 1323-1333.
- Нельсон А.Р., Финглтон Б., Ротенберг М.Л., Матрисиан Л.М.: Матричные металлопротеиназы: биологическая активность и клинические последствия.Дж. Клин Онкол 2000; 18: 1135-1149.
- Wilson SR, Gallagher S, Warpeha K, Hawthorne SJ: Усиление продукции mmp-2 и mmp-9 клеточными линиями рака простаты посредством активации рецепторов, активируемых протеазой. Простата 2004; 60: 168-174.
- Zhong WD, Han ZD, He HC, Bi XC, Dai QS, Zhu G, Ye YK, Liang YX, Qin WJ, Zhang Z, Zeng GH, Chen ZN: белок Cd147, mmp-1, mmp-2 и mmp-9 экспрессия в качестве значимых прогностических факторов при раке простаты человека.Онкология 2008; 75: 230-236.
- Андреасен PA, Egelund R, Petersen HH: система активации плазминогена при росте, инвазии и метастазировании опухоли. Cell Mol Life Sci 2000; 57: 25-40.
- Rabbani SA, Xing RH: Роль урокиназы (upa) и ее рецептора (upar) в инвазии и метастазировании гормонозависимых злокачественных новообразований.Инт Дж. Онкол 1998; 12: 911-920.
- Hienert G, Kirchheimer JC, Pfluger H, Binder BR: Активатор плазминогена урокиназного типа как маркер образования отдаленных метастазов в карциномах простаты. Дж. Урол 1988; 140: 1466-1469.
- Shihab PK, Al-Roub A, Al-Ghanim M, Al-Mass A, Behbehani K, Ahmad R: Tlr2 и ap-1 / nf-kappab участвуют в регуляции mmp-9, вызванного термоубитыми Listeria monocytogenes у человека. моноцитарные клетки thp-1.Журнал Инфламм (Лондон) 2015; 12:32.
- Kong D, Li Y, Wang Z, Banerjee S, Sarkar FH: ингибирование ангиогенеза и инвазии с помощью 3,3′-дииндолилметана опосредуется нижележащими генами-мишенями ядерного фактора-каппаба mmp-9 и upa, которые регулируют биодоступность роста эндотелия сосудов фактор рака простаты.Cancer Res 2007; 67: 3310-3319.
- Лю Б., Хань М., Вэнь Дж. К.: Ацетилбританнилактон подавляет неоинтимальную гиперплазию после баллонного повреждения артерии крысы, подавляя активацию ядерного фактора-каппа b. J. Pharmacol Exp Ther 2008; 324: 292-298.
- Ghosh S, Karin M: Недостающие части в головоломке nf-kappab.Cell 2002; 109: S81-96.
- Liao D, Zhong L, Duan T, Zhang RH, Wang X, Wang G, Hu K, Lv X, Kang T: Аспирин подавляет рост и метастазирование остеосаркомы через путь nf-kappab. Clin Cancer Res 2015; 21: 5349-59.
- Cuzick J, Otto F, Baron JA, Brown PH, Burn J, Greenwald P, Jankowski J, La Vecchia C, Meyskens F, Senn HJ, Thun M: аспирин и нестероидные противовоспалительные препараты для профилактики рака: международный консенсус утверждение.Ланцет Онкол 2009; 10: 501-507.
- Schreinemachers DM, Everson RB: использование аспирина и заболеваемость раком легких, толстой кишки и груди в проспективном исследовании. Эпидемиология 1994; 5: 138-146.
- Corley DA, Kerlikowske K, Verma R, Buffler P: Защитная ассоциация аспирина / nsaids и рака пищевода: систематический обзор и метаанализ.Гастроэнтерология 2003; 124: 47-56.
- Джейкобс Э.Дж., Ньютон С.К., Стивенс В.Л., Кэмпбелл П.Т., Фридленд С.Дж., Гапстур С.М.: Ежедневное употребление аспирина и смертность от рака простаты в большой когорте мужчин с неметастатическим раком простаты. Дж. Клин Онкол 2014; 32: 3716-3722.
- Видал А.С., Ховард Л.Е., Морейра Д.М., Кастро-Сантамария Р., Андриоле Г.Л., Фридланд С.Дж.: Аспирин, nsaids и риск рака простаты: результаты исследования сокращения.Clin Cancer Res 2015; 21: 756-762.
- Кашиваги Э., Шиота М., Йокомидзо А., Ицуми М., Инокучи Дж., Учиуми Т., Наито С. Рецептор простагландина ep3 опосредует ингибирующее действие аспирина на рост через рецептор андрогенов и способствует устойчивости к кастрации в клетках рака простаты.Endocr Relat Cancer 2013; 20: 431-441.
- Лучиани М.Г., Кампрегер С., Гаше С. Аспирин блокирует пролиферацию в клетках толстой кишки, вызывая остановку g1 и апоптоз через активацию киназы контрольной точки атм. Канцерогенез 2007; 28: 2207-2217.
- Лю Б., Хань М., Сан Р. Х., Ван Дж. Дж., Лю Ю. П., Вэнь Дж. К.: Ацетилбританнилактон вызывает задержку g1 и апоптоз в гладкомышечных клетках сосудов.Int J Cardiol 2011; 149: 30-38.
- Parrondo R, de las Pozas A, Reiner T., Rai P, Perez-Stable C: активация Nf-каппаба усиливает гибель клеток антимитотическими препаратами в клетках рака простаты человека. Молочный рак 2010; 9: 182.
- Лю Б., Вэнь Дж. К., Ли Б. Х., Фанг Х. М., Ван Дж. Дж., Чжан Ю. П., Ши С. Дж., Чжан Д. К., Хань М. Целекоксиб и ацетилбританнилактон взаимодействуют синергетически, подавляя рост клеток рака молочной железы через cox-2-зависимые и независимые механизмы.Диск о смерти клетки 2011; 2: e185.
- Джу М., Хан Ю.С., Квон М., Садикот Р.Т., Блэквелл Т.С., Кристман Дж. У.: Ядровый белок вируса гепатита С подавляет активацию nf-каппаба и экспрессию циклооксигеназы-2 путем прямого взаимодействия с икапаб-киназой бета. J. Virol 2005; 79: 7648-7657.
- Loskutoff DJ, Curriden SA, Hu G, Deng G: Регулирование клеточной адгезии с помощью pai-1.АПМИС 1999; 107: 54-61.
- Nadiminty N, Tummala R, Liu C, Yang J, Lou W, Evans CP, Gao AC: Nf-kappab2 / p52 индуцирует устойчивость к энзалутамиду при раке простаты: роль рецептора андрогена и его вариантов. Mol Cancer Ther 2013; 12: 1629-1637.
- Pulukuri SM, Gondi CS, Lakka SS, Jutla A, Estes N, Gujrati M, Rao JS: Нокдаун активатора плазминогена урокиназы и рецептора активатора плазминогена урокиназы, направленный на вмешательство РНК, ингибирует инвазию клеток рака простаты, выживание и онкогенность in vivo.J Biol Chem 2005; 280: 36529-36540.
- Павезе Дж. М., Кришна С. Н., Берган Р. К.: Генистеин подавляет отслоение, инвазию и метастазирование клеток рака простаты человека. Am J Clin Nutr 2014; 100: 431S-436S.
- Лиотта Л.А., Стетлер-Стивенсон WG: Инвазия и метастазирование опухоли: дисбаланс положительной и отрицательной регуляции.Cancer Res 1991; 51: 5054s-5059s.
- Крюгер А., Санчес-Свитман О.Н., Мартин Д.К., Фата Дж. Э., Хо А. Т., Орр Ф. У., Рутер У., Коха Р. Сверхэкспрессия хозяина timp-1 придает устойчивость к экспериментальным метастазам в мозг линии клеток фибросаркомы. Онкоген 1998; 16: 2419-2423.
- Riddick AC, Shukla CJ, Pennington CJ, Bass R, Nuttall RK, Hogan A, Sethia KK, Ellis V, Collins AT, Maitland NJ, Ball RY, Edwards DR: Идентификация компонентов деградома, связанных с прогрессированием рака простаты, с помощью анализа экспрессии человека ткани простаты.Br J Cancer 2005; 92: 2171-2180.
- Bergers G, Brekken R, McMahon G, Vu TH, Itoh T, Tamaki K, Tanzawa K, Thorpe P, Itohara S, Werb Z, Hanahan D: Матричная металлопротеиназа-9 запускает ангиогенный переключатель во время канцерогенеза. Nat Cell Biol 2000; 2: 737-744.
- Налла А.К., Горантла Б., Гонди С.С., Лакка С.С., Рао Дж.С.: Нацеливание на mmp-9, upar и катепсин b ингибирует инвазию, миграцию и активирует апоптоз в клетках рака простаты.Cancer Gene Ther 2010; 17: 599-613.
- Aalinkeel R, Nair MP, Sufrin G, Mahajan SD, Chadha KC, Chawda RP, Schwartz SA: Экспрессия генов ангиогенных факторов коррелирует с метастатическим потенциалом клеток рака простаты. Cancer Res 2004; 64: 5311-5321.
- Андреасен П.А., Кьоллер Л., Кристенсен Л., Даффи М.Дж.: Система активатора плазминогена урокиназного типа при метастазировании рака: обзор.Int J Cancer 1997; 72: 1-22.
- Даффи MJ: Активатор плазминогена урокиназы и его ингибитор, pai-1, как прогностические маркеры рака груди: от пилотных исследований до уровня доказательств 1. Clin Chem 2002; 48: 1194-1197.
- Баджу К., Ноэль А., Герард Р. Д., Массон В., Бруннер Н., Холст-Хансен С., Скобе М., Фусениг Н. Е., Кармелиет П., Коллен Д., Фойдарт Дж. М.: Отсутствие ингибитора активатора плазминогена хозяина 1 предотвращает инвазию рака и васкуляризацию.Нат Мед 1998; 4: 923-928.
- Даффи MJ: Протеазы как прогностические маркеры рака. Clin Cancer Res 1996; 2: 613-618.
- МакМахон Г.А., Петитклерк Э., Стефанссон С., Смит Э., Вонг М.К., Вестрик Р.Дж., Гинзбург Д., Брукс П.С., Лоуренс Д.А.: Ингибитор-1 активатора плазминогена регулирует рост опухоли и ангиогенез.J. Biol Chem, 2001; 276: 33964-33968.
- Ллойд Ф.П. младший, Сливова В., Валаховикова Т., Слива Д.: Аспирин подавляет высокоинвазивные клетки рака простаты. Инт Дж. Онкол 2003; 23: 1277-1283.
- Babykutty S, S. PP, J NR, Kumar MA, Nair MS, Srinivas P, Gopala S: Нимболид замедляет миграцию опухолевых клеток, инвазию и ангиогенез, подавляя экспрессию mmp-2/9 посредством ингибирования erk1 / 2 и снижения активности связывания ДНК nf-каппаба в раковых клетках толстой кишки.Мол Carcinog 2012; 51: 475-490.
- Като Т., Фудзита Ю., Накане К., Мизутани К., Теразава Р., Эхара Х, Канимото Ю., Кодзима Т., Нозава И., Дегучи Т., Ито М.: взаимодействие Ccr1 / ccl5 способствует инвазии устойчивых к таксанам клеток рака простаты pc3 за счет увеличения секреции mmps 2/9 и путем активации сигналов erk и rac.Цитокин 2013; 64: 251-257.
- Бенбоу У., Бринкерхофф CE: Сайт ap-1 и регуляция гена mmp: в чем вся суета? Матрица Биол 1997; 15: 519-526.
- Kwon GT, Cho HJ, Chung WY, Park KK, Moon A, Park JH: Изоликвиритигенин подавляет миграцию и инвазию клеток рака простаты: возможное посредничество за счет снижения передачи сигналов jnk / ap-1.J Nutr Biochem 2009; 20: 663-676.
- Gavrilov D, Kenzior O, Evans M, Calaluce R, Folk WR: Экспрессия активатора и рецептора плазминогена урокиназы в сочетании с факторами транскрипции семейства ets и комплекса ap-1 при раке простаты высокой степени. Eur J Cancer 2001; 37: 1033-1040.
- Chien CS, Shen KH, Huang JS, Ko SC, Shih YW: Антиметастатический потенциал физетина включает инактивацию сигнальных путей pi3k / akt и jnk с подавлением экспрессии mmp-2/9 в клетках рака простаты pc-3. Mol Cell Biochem 2010; 333: 169-180.
- Ваялил ПК, Катияр С.К .: Лечение эпигаллокатехин-3-галлатом ингибирует матриксные металлопротеиназы-2 и -9 посредством ингибирования активации митоген-активированных протеинкиназ, c-jun и nf-каппаб в клетках карциномы простаты человека du-145.Простата 2004; 59: 33-42.
- Young B, Purcell C, Kuang YQ, Charette N, Dupré DJ: Регулирование супероксиддисмутазой 1 передачи сигналов, опосредованной CXCR4, в клетках рака простаты зависит от клеточного окислительного состояния. Cell Physiol Biochem 2015; 37: 2071-2084.
Автор Контакты
Бинь Лю
Вторая больница Хэбэйского медицинского университета,
No.215 Heping West Road,
Shijiazhuang, Hebei 050000, (Китай)
Тел. + 86-311-6600-2115, факс + 86-311-6600-2115, электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 20 июня 2016 г.
Принята: 11 января 2017 г.
Опубликована онлайн: 8 марта 2017 г.
Дата выпуска: май 2017 г.
Количество страниц для печати: 12
Количество рисунков: 6
Количество столов: 0
ISSN: 1015-8987 (печатный)
eISSN: 1421-9778 (онлайн)
Для дополнительной информации: https: // www.karger.com/CPB
Лицензия открытого доступа / Дозировка лекарства / Отказ от ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененных материалов требует письменного разрешения. Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Фосфо IKK альфа (T23) антитело (ab38515)
Спасибо за ваш запрос.
Я могу подтвердить, что, поскольку антитело ab105923IKK альфа не было специфически индуцировано против фосфорилированного остатка белка, поэтому вероятно обнаружение как фосфорилированных, так и нефосфорилированных форм белка.
У нас есть следующие антитела, которые специфически обнаруживают некоторые из фосфорилированных остатков. Я могу порекомендовать просмотреть таблицы данных для получения более подробной информации и выбрать один, протестированный на том виде, который вы собираетесь использовать.
ab38515 Антитело против IKK альфа (фосфо T23)
Кролик поликлональный
Применение: ELISA, ICC / IF, IHC-Fr, IHC-P, WB
Реагирует с: человеком, мышью, крысой
https: // www.abcam.com/IKK-alpha-phospho-T23-antibody-ab38515.html (или используйте следующее: https://www.abcam.com/IKK-alpha-phospho-T23-antibody-ab38515.html).
ab17943 Антитело против IKK альфа (фосфо S176 + S180)
Кролик поликлональный
Применения: ICC / IF, WB
Реагирует с: Человек
https://www.abcam.com/IKK-alpha-phospho-S176— S180-antibody-ab17943.html (или используйте следующее: https://www.abcam.com/IKK-alpha-phospho-S176—S180-antibody-ab17943.html).
Мне очень жаль, что, насколько нам известно, они не были протестированы и поэтому не гарантируются при проточной цитометрии.Однако, если вы хотите протестировать эти антитела с помощью проточной цистометрии, не стесняйтесь обращаться ко мне еще раз перед покупкой, ответив на это сообщение, поскольку вы можете иметь право на участие в нашей программе скидок на тестирование.
В противном случае, мы хотели бы побудить всех наших клиентов отправить Abreview через онлайн-таблицу данных о продукте. Мы всегда ценим отзывы клиентов, как положительные, так и отрицательные, и делаем всю информацию о продуктах доступной для исследователей. Кроме того, каждый Abreview зарабатывает Abpoints, которые можно использовать для скидок на будущие покупки или вознаграждения, такие как Amazon.com подарочные сертификаты.
Чтобы узнать больше о нашей системе Abreview, перейдите по следующей ссылке:
https://www.abcam.com/abreviews
Надеюсь, эта информация будет полезной. Пожалуйста, не стесняйтесь обращаться ко мне за дополнительными советами или информацией.
Прочитайте больше .




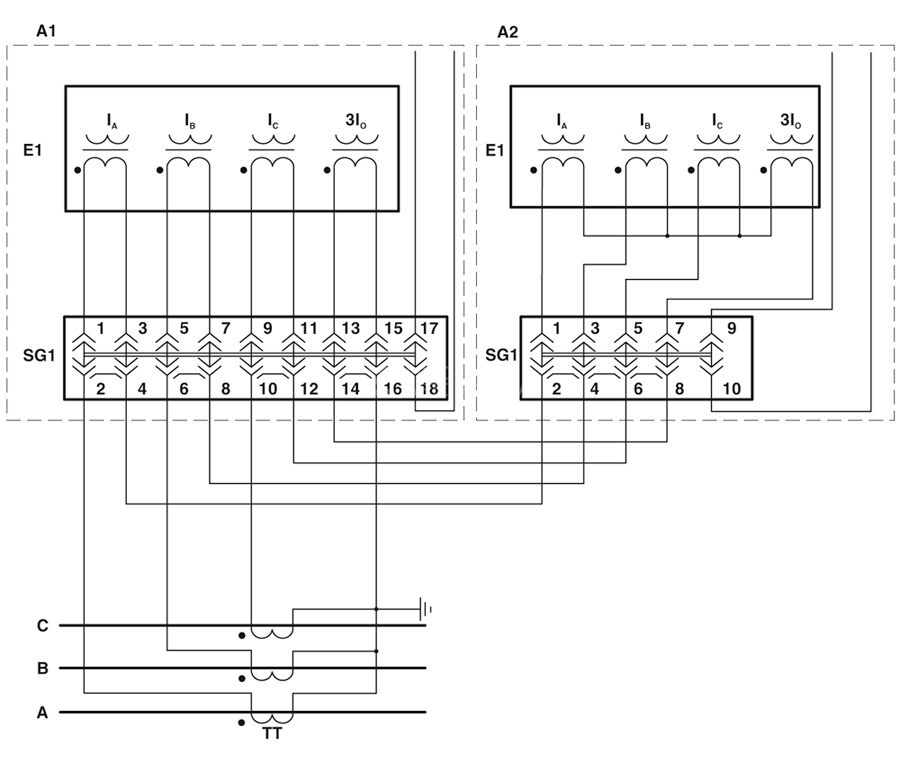
 Для Вас я специально подготовил целый раздел «Онлайн-тесты по электробезопасности» на разные группы.
Для Вас я специально подготовил целый раздел «Онлайн-тесты по электробезопасности» на разные группы.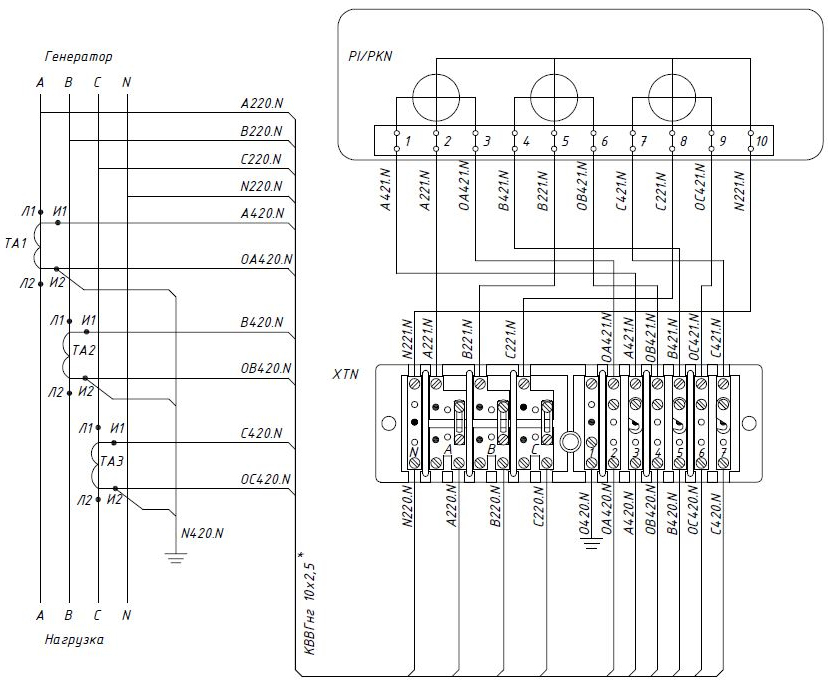


 Этот факт подтверждается наличием у ряда изделий различных сертификатов качества.
Этот факт подтверждается наличием у ряда изделий различных сертификатов качества. г. случайное прикосновение руками
г. случайное прикосновение руками )
)