Катод — Википедия
Материал из Википедии — свободной энциклопедии
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος «ход вниз; нисхождение») — электрод некоторого прибора, из которого вытекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность аноду в который он втекает.
Катод в электрохимии и цветной металлургии
В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.
Знак анода и катода
В литературе встречается различное обозначение знака катода — «−» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «−» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Катод Википедия
 Схема гальванического элемента Даниэля-Якоби
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος «ход вниз; нисхождение») — электрод некоторого прибора, из которого вытекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность аноду в который он втекает.
Катод в электрохимии и цветной металлургии[ | ]

В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах[ | ]
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов[ | ]
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу —
определение, принцип работы и применение
В статье вы узнаете что такое катод, рассмотрим как заряжен катод, историю открытия, а так же применение.
Определение катода
Термин катод используется в области физики для определения отрицательного электрода. Этимология этого термина относится к греческому слову káosek, что переводится как «нисходящий путь».
Электрод называется концом электрического провода, который собирает или передает ток при контакте со средой. В частном случае катодов это электроды, которые имеют отрицательный электрический заряд.
Как заряжен катод
Концы или клеммы батареи или аккумулятора называются полюсами, которые могут быть отрицательными или положительными. Это качество называется полярностью. Направление потока электрического тока условно определялось как поток зарядов, который проходит от положительного полюса к отрицательному полюсу.
В энергосберегающих устройствах, таких как батареи, катод имеет положительную полярность. С другой стороны, если элемент потребляет энергию, катод имеет отрицательную полярность.
Катоды вызывают окислительно-восстановительные реакции (восстановление-окисление), которые приводят к тому, что материал, получающий электроны (элементарные частицы, которые имеют отрицательный заряд), страдает от снижения его степени окисления. С другой стороны, реакции окисления проводятся в анодах (положительных электродах), которые приводят к потере электронов и увеличению степени окисления.
Когда речь заходит об этимологии, известно, что этот термин был изобретен физиком и химиком Майклом Фарадеем из Великобритании, который внес большой вклад в области электрохимии и электромагнетизма. В частности, Фарадей впервые упомянул об этом в контексте своих экспериментальных исследований в области электричества в седьмой серии.
Значение слова «катод» относится к «уходу, спуску», потому что его происхождение происходит от греческого слова, которое можно перевести как «путь, дно»; в этом случае его следует понимать только по отношению к электролиту электрохимических ячеек. Этот электрод называется термоджонным катодом, который из-за теплового эффекта, генерируемого теплом, вызывает эмиссию электронов; Это явление также известно как эффект Эдисона. Этот тип катода, например, является источником электронов, используемых в термоджон-клапанах.
Одним из наиболее важных термодинамических свойств катода является то, что он сам может повысить свою температуру ; для этой цели он циркулирует ток нагрева или использует нить накала, с которой он термически связан. Материалы, которые испускают электроны при низких температурах, наиболее эффективно используют термический эффект; некоторые из наиболее распространенных — это вольфрамовые сплавы (также называемые вольфрамом ), торий и лантаноиды; Другой вариант — покрытие катода оксидом кальция.
С другой стороны, электронные токи, наблюдаемые в вакуумных трубках, представляют собой те, которые образуются в стекле и которые оснащены по меньшей мере двумя электродами, анодом и катодом в конфигурации, которая называется диодом. Когда катод нагревается, он испускает излучение, которое движется к аноду; Если внутренние стеклянные стены позади них имеют покрытие для некоторых флуоресцентных материалов, то они производят интенсивную яркость.

Эта концепция встречается на большинстве телевизионных экранов и мониторов последних десятилетий, потому что они использовали электронно-лучевые трубки, технологию, которая постоянно излучает лучи на стеклянный экран со свинцовым покрытием и фосфор для воспроизведения изображений. Свинец защищает человека от молнии, а фосфор позволяет воспроизводить изображения.
Катод и анод — это плюс или минус: как определить
Анод и катод — два физических термина прикладной электроники, гальванотехнике и химии. Уяснив эти термины, можно понять, почему греется аудио плеер. Путаница в терминологии спровоцирует аварийные ситуации.
Что это такое
Катоды и аноды — электрические проводники, которые имеют электронную проводимость. Посредством анода электрический заряд втекает в аппаратуру, а катода, наоборот, истекает. На первом возникает окислительная реакция (называют восстановитель) и отсылает заряженные частицы, на втором — восстановительная реакция (называют окислитель) и принимает заряженные частицы.

Анод и катод в диоде
Если перемещение электрических проводников проходит от восстановления к окислению по цепи извне, возникает источник электроэнергии. Прибор, с помощью которого преобразовывается химическая энергия в электроэнергию, получил название — гальванический элемент.

Схема гальванического элемента
Чтобы не возникло путаницы, стоит четко усвоить и запомнить отличие плюса и минуса в разных процессах:
В гальванотехнике химические реакции происходят внутри элемента. В электричестве извне не нуждается, так как заряд сам потечет во внешнюю цепь из элемента. В этом случаев катод — положительный, анод — отрицательный.
В электролизе необходим внешний источник тока, включенный в разрыв проводника внешней цепи. Внешний источник создаст разность потенциалов между электрическими проводниками, и вне устройства будет вкачивать ток в элемент. На аноде будет плюс, а на катоде — противоположно.
Важно! Чтобы определить катод и анод это плюс или минус, нужно запомнить: в гальванотехнике отрицательным становится анод, а катод — положительный. У электролитов — противоположно.
Как определить что минус, а что плюс (у диода)
Особенность диодов такова, что они проводит заряд только в одном направлении. Чтобы не ошибиться, обычно на корпусе обозначены маркировки. В случае отсутствия маркировок, чтобы узнать, как все-таки определить полярности анода и катода у диодов, применяют следующие методы.
- Использование мультиметра. Прибор включается в тест-режим. Если на экране засветились цифровые значения — диод подсоединен по прямому маршруту. Красный провод идет к аноду «+„, черный к катоду “-„.
- Внешние признаки:
- символы «+» и «-» на корпусе;
- ближе к аноду нанесены обозначения в форме точек или кольцевых линий;
- вытянутая форма устройства — плюс, приплюснутый — минус;
- Включение питания. Собирается простейшая схема, которая состоит из батарейки и лампы.

Определение полюсов с помощью лампочки
Если включить лампочку, и она начнет гореть — «+» батарейки соединен с положительной полярностью, это есть анод, и прибор будет пропускать через себя ток. Если свет не загорелся, то значит, соединили с отрицательной полярностью — это катод и, соответственно, тока не будет.
- Инструкция по эксплуатации. Производитель вместе с товаром прилагает подробную техническую документацию, где прописаны все необходимые параметры.
Заряд аккумулятора
Если взглянуть на аккумулятор или обычные батарейки, то можно заметить терминалы, отличающиеся обозначением «+» и «-», которые расположены на противоположных концах.
Аккумулятор имеет металлический или пластиковый каркас. Внутри катод сведен с положительной полярностью, а анод подключен к отрицательной полярности. Отделяет их друг от друга заслон, поэтому они не соприкасаются, а электрический заряд свободно протекает между ними. Помогает этому электролит — специальный раствор серной кислоты.

Схема заряда АКБ
Когда проходит химическая реакция заряда с электролитом на одном из электрических проводников, возникнет окислительная реакция. Если включить гальванический компонент в электросеть, электроны с анода перетекут на катод, производя функционирование пока в электролите возникают химические взаимодействия. Работать химический источник электрического тока прекратить только тогда, когда химические составляющие электролита израсходуются.
На заметку. Когда происходит разряд гальванического элемента, то анод является «-», когда заряд — катод имеет знак «+».
Применение в электронике
В электронике применяют особенности диодов впускать заряд по прямому маршруту, но не отпускать обратно.

Р-n переход тока
Работа светодиода заключается в свойстве кристаллов, которые светятся при пропускании через p-n переход тока по прямой.
В электрохимии электрические проводники необходимы при создании автономных источников питания (аккумуляторные батареи), а также при воспроизведении технологических процессов. Аноды, катоды участвуют в электролизе, электроэкстракции, гальваностегии и гальванопластике.
Гальваника — восстановления металла при химических процессах под воздействием электротока. Такая процедура приводит к устойчивости от коррозии узлов и агрегатов механизмов.
Катод — Википедия
Материал из Википедии — свободной энциклопедии
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος — ход вниз; нисхождение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии и цветной металлургии
В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.
Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «-» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[2][3]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.[3][4][5].
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Катод — Википедия
Материал из Википедии — свободной энциклопедии
 Схема гальванического элемента Даниэля-Якоби
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος — ход вниз; нисхождение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии и цветной металлургии

В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Видео по теме
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.
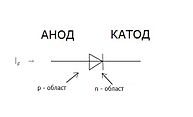
Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «-» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[2][3]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.[3][4][5].
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Катод Википедия
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος «ход вниз; нисхождение») — электрод некоторого прибора, из которого вытекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность аноду в который он втекает.
Катод в электрохимии и цветной металлургии
В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.
Знак анода и катода
В литературе встречается различное обозначение знака катода — «−» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «−» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[2][3]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.[3][4][5].
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.



