Гальванические элементы
Гальваническим элементом называется электрохимическая система, производящая электрическую энергию за счет протекания в ней окислительно-восстановительной реакции. Наиболее распространенными являются гальванические элементы, состоящие из двух электродов с различными потенциалами. Рассмотрим реакцию:
Zn + CuSO4 = ZnSO4 + Cu
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn, Fe, Cu, Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции:
Zn – 2e = Zn2+
Cu2+ + 2e = Cu
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
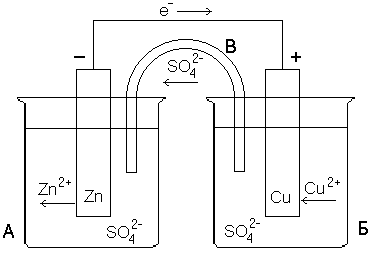
Рисунок 1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд
А заполнен раствором ZnSO4,
сосуд Б – раствором CuSO4.
В первый из них опущена цинковая
пластинка, во второй – медная. Растворы
либо разделены пористой полупроницаемой
перегородкой (пропускает только ионы),
либо соединяются солевым мостиком B,
который представляет собой стеклянную
трубку, заполненную раствором сильного
электролита (обычно KCl
или NH
В данном случае электродные процессы являются гетерогенными, т.к. окисленная и восстановленная формы находятся в разных фазах. В более общем виде гетерогенный электродный процесс можно записать в виде:
Me
(ВФ, тв. фаза) – ne– 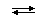 Men+ (aq) (ОФ, раствор)
Men+ (aq) (ОФ, раствор)
Гальванические элементы принято изображать в виде
Анод─ Zn|ZnSO4||CuSO4|Cu +Kатод .
В ионной форме схематическое изображение гальванического элемента: Анод─ Zn|Zn2+||Cu2+|Cu +Kатод .
На границе раздела фаз возникает двойной электрический слой, состоящий из катионов Men+ (в растворе) и электронов (в металле), что приводит к появлению потенциала
Поскольку
самопроизвольно электроны могут
переходить только от электрода с большей
концентрацией электронов к электроду
с меньшей концентрацией, то в процессе
действия рассматриваемого гальванического
элемента электроны во внешней цепи
движутся от цинка к меди. На цинковом
электроде происходит процесс окисления,
так как значение стандартного электродного
потенциала Еº(Zn
Медь в данном процессе играет роль инертного электрода, который передает электроны, поступившие от цинка, ионам Cu2+, находящимся в растворе CuSO4.Таким образом, на медном электроде происходит восстановление катионов меди. Указанные окислительно-восстановительные процесы отображены в схеме гальванического элемента.
Во внутренней цепи ионы SO42-, оказавшиеся в избытке в катодном пространстве, переходят через пористую перегородку или через солевой мостик в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка.
Элемент будет работать до тех пор, пока цинковый анод полностью не растворится или не восстановится вся медь из раствора CuSO4. При описании работы гальванического элемента выделяют процессы, происходящие на электродах, и суммарную окислительно-восстановительную реакцию, указывают направление движения электронов во внешней цепи и ионов в растворе электролита. Для медно-цинкового гальванического элемента:
Zn ‑ 2ē = Zn2 + — процесс окисления на аноде;
Cu2+ + 2ē = Cu – процесс восстановления на катоде;
Zn + Cu 2+= Zn2+ + Cu – суммарная реакция в гальваническом элементе.
Направление
движения электронов – от цинкового
электрода к медному. Ионы SO
Если гальванический элемент находится в условиях, отличных от стандартных, то для расчета ЭДС сначала необходимо найти значения потенциалов электродов в данных условиях по уравнению Нернста, а затем вычислять ЭДС элемента. Поскольку электродвижущая сила гальванического элемента всегда положительная величина, при ее определении вычитают из величины более положительного потенциала величину менее положительного:
ПРИМЕР 1. Вычислить ЭДС гальванического элемента, составленного из стандартных цинкового и оловянного электродов, опущенных в растворы сульфатов цинка и олова.
РЕШЕНИЕ. Запишем уравнения электродных равновесий, устанавливающихся на цинковом и оловянном электродах, и выпишем из таблицы значения их стандартных электродных потенциалов:
Zn2+ + 2ē = Zn; Еº = -0,76B;
Sn2+ + 2ē = Sn; Еº = -0,14B.
Электродный потенциал цинкового электрода имеет более низкое значение, следовательно, цинковый электрод будет анодом, на нем будет происходить процесс окисления. На оловянном электроде с бóльшим значением Еº будет происходить восстановление:
Zn — 2ē = Zn2+ -процесс на аноде;
Sn2+ + 2ē = Sn — процесс на катоде;
Zn
+ Sn2+ = Zn
Электроны по внешней цепи переходят от цинка к олову. Ионы SO42- будут переходить по солевому мостику из катодного пространства в анодное.
ЭДС = E(Sn2+/Sn) — Е(Zn2+/Zn) = -0,14 – (-0,76) = 0,62(В).
ПРИМЕР 2. Гальванический элемент образован электродом Fe2+/Fe с концентрацией ионов Fe2+ = 0,1 моль/л и серебряным электродом Ag+/Ag с концентрацией ионов Ag+ =0,01 моль/л. Написать уравнения электродных процессов, составить схему гальванического элемента, вычислить его ЭДС.
РЕШЕНИЕ.
В таблице находим значения стандартных
электродных потенциалов
окислительно-восстановительных систем:
Eº(Fe
Е (Fe2+/Fe) = -0,44 + 0,059/2lg10-1 = -0,47B;
Е (Ag+/Ag) = +0,8 + 0,059/1lg10-2 = +0,682B.
Поскольку Е(Fe2+/Fe) < E(Ag+/Ag), то на железном электроде будет происходить окисление. т.е. он будет анодом, а на серебряном электроде будет происходить восстановление, т.е. этот электрод будет анодом.:
Fe — 2ē = Fe2+ -процесс на аноде;
Ag+ + ē = Ag — процесс на катоде;
Fe + Ag+ = Fe2+ + Ag — суммарная реакция в гальваническом элементе.
Схема гальванического элемента :
Анод─ Fe|FeSO4||Ag2SO4|Ag +Kатод
Или Анод─ Fe|Fe2+||Ag+|Ag +Kатод.
ЭДС = E(Ag+/Ag) — Е(Fe2+/Fe) = 0,682 – (-0,47) = 1,152(В).
Гальванический элемент может быть составлен не только из различных электродов, но и из одинаковых электродов, погруженных в раствор одного и того же электролита различной концентрации. Такой гальванический элемент называется концентрационным. Он будет действовать до тех пор, пока не произойдет выравнивание концентраций ионов у обоих электродов.
9.2 Гальванический элемент
Принцип работы гальванического элемента можно рассмотреть на примере элемента Даниэля – Якоби (рис 9.2).

Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный
электродный потенциал цинкового
электрода 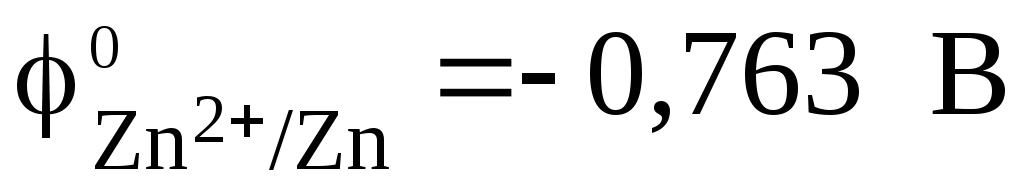 .
Стандартный электродный потенциал
медного электрода
.
Стандартный электродный потенциал
медного электрода  .
Так как
.
Так как ,
то атомы цинка будут окисляться:
,
то атомы цинка будут окисляться:
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступаетцинковыйэлектрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+».
Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток).
На медном электроде происходит процесс восстановления катионов электролитаCu2+:
Электрод, на котором идет реакция восстановления или который принимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO42– к аноду, катионовZn2+к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Реакции (а) и (б) называются электродными реакциями.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
или, с учетом анионов раствора:
Zn + CuSO4= ZnSO4+ Cu. | (г) |
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
MeА+ MeКn+MeАn++ MeК, | (д) |
где индексы А и К относятся к металлам анода и катода соответственно.
Реакции (в) – (д) называются токообразующими реакциями.
Символическая запись (схема) гальванического
элемента имеет вид: 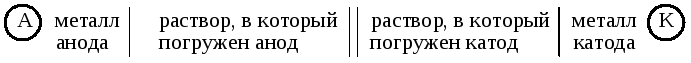
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:
| (9.3) |
Схема гальванического элемента Даниэля– Якоби имеет вид:
Zn|ZnSO4 ||CuSO4|Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой(ЭДС) элементаЕ. Она вычисляется по формуле;
где φк и φа – электродные потенциалы катода и анода соответственно.
Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна:
Е= +0,34 – (–0,76) = 1,10 В.
Электродвижущая сила Ехарактеризует способность гальванического элемента совершать электрическую работу во внешней цепи.
Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала ∆Gпроцесса. Связь между величиной ∆Gи ЭДС описывается уравнением:
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ∆G0связана с константой равновесия этой реакцииКравнсоотношением
| (9.6) |
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимнообратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:

Пример 1.Составьте схему гальванического элемента, в основе которого лежит реакция:Mg+ZnSO4 =MgSO4+Zn.Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на этих электродах. Рассчитайте ЭДС элемента при стандартных условиях. Вычислите константу равновесия для токообразующей реакции.
Решение
В таблице находим значения стандартных электродных потенциалов систем Zn/Zn2+иMg/Mg2+ :
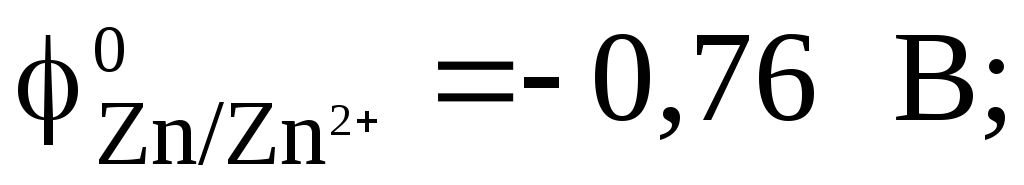

Поскольку 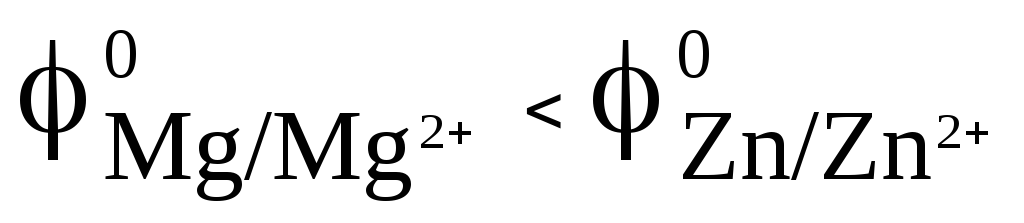 ,
то магниевый электрод выполняет функцию
анода, а цинковый – катода. Схема
гальванического элемента имеет вид:
,
то магниевый электрод выполняет функцию
анода, а цинковый – катода. Схема
гальванического элемента имеет вид:
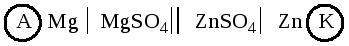
На аноде идет процесс окисления:

На катоде – восстановление катионов среды:
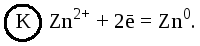
Стандартная ЭДС гальванического элемента
Е= φ0к– φ0а= –0,763 – (–2,37) = 1,607 В.
По уравнениям (9.5) и (9.6) вычислим константу равновесия токообразующей реакции:
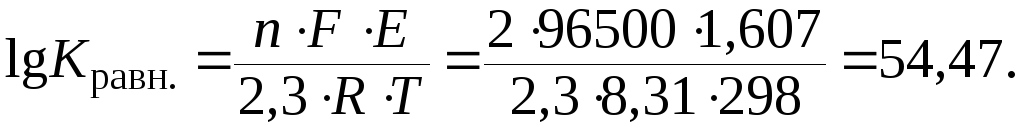
Потенцируя, находим Кравн= 3,5 ∙1054.
Поскольку К>>1, то токообразующая реакция практически необратима.
Пример 2.Составьте схему гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в растворы их солей. Концентрации ионов в растворах:CZn2+ = 0,1 моль/л,CAg+ = 0,01 моль/л. Укажите, какой электрод является катодом, а какой – анодом. Напишите уравнения реакций, протекающих на электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
Решение
Так как концентрации ионов не равны единице, то вначале рассчитаем потенциалы электродов, используя формулу Нернста. Если в условии задачи отсутствует значение температуры, то ее принимают равной стандартной температуре Т= 298 К. Поэтому будем использовать уравнение (9.2):

Подставим числовое значение концентрации в формулу Нернста, используя данные таблицы 9.1:
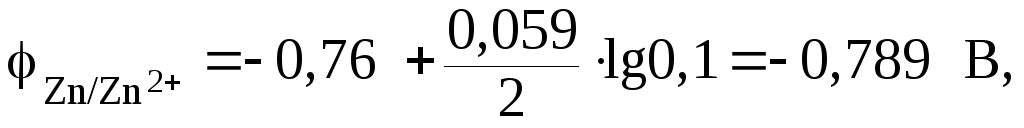
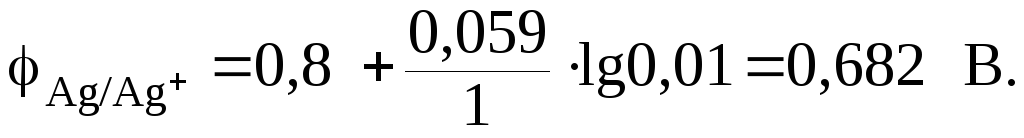
Из расчета
видно, что 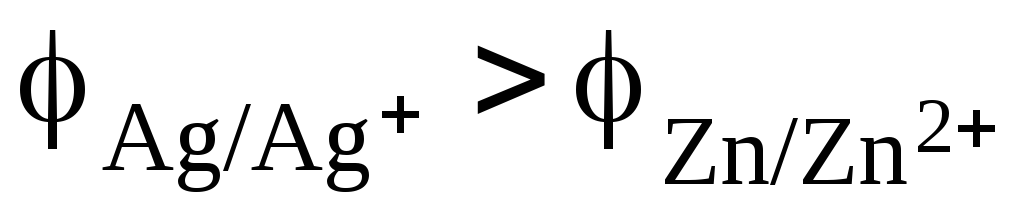 .
Поэтому цинковый электрод выполняет
функцию анода, а серебряный – катода.
.
Поэтому цинковый электрод выполняет
функцию анода, а серебряный – катода.
Схема гальванического элемента:

Вычислим ЭДС элемента по формуле (9.4):
Е= φк– φа = 0,741 – (-0,789) = 1,530 В.
Теперь запишем электродные реакции. На аноде происходит процесс окисления:
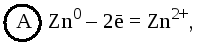
а на катоде – процесс восстановления:
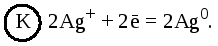
Складывая уравнения электродных процессов (с учетом равенства числа принимаемых и отдаваемых электронов), получаем суммарное уравнение токообразующей реакции: Zn+ 2Ag+=Zn2++ 2Ag.
Задачи
221–226Напишите уравнения катодного и анодного процессов и составьте схему гальванического элемента, при работе которого протекает следующая реакция (см. таблицу). На основании значений стандартных электродных потенциалов рассчитайте константу равновесия данной реакции и ЭДС элемента.
№ задачи | Реакция | Ответ |
221 | Sn + PbCl2 = SnCl2 + Pb | Кр = 2,0; E = 9∙10–3 B |
222 | Zn + Pb(NO3)2 = Zn(NO3)2 + Pb | Кр = 3,5∙1021; E = 0,633 B |
223 | Zn + 2AgNO3 = Zn(NO3)2 + 2Ag | Кр = 8,7∙1052 ; E = 1,56 B |
224 | Ni + 2AgNO3 = Ni(NO3)2 + 2Ag | Кр = 3,8∙1035 ; E = 1,05 B |
225 | Zn + CdSO4 = ZnSO4 + Cd | Кр = 1,56∙1012; E = 0,36 B |
226 | Mg + Ni(NO3) 2 = Mg(NO3)2 + Ni | Кр = 1,7∙108 ; E = 8,23 B |
227–233 Рассчитайте значения электродных потенциалов металла, являющегося анодом, при различных концентрациях раствора: 10; 0,1; 0,01; 0,001 моль/л. Концентрация раствора, в который погружен катод, постоянна и равна 1 моль/л. Определите ЭДС.
Постройте график зависимости ЭДС гальванического элемента от логарифма концентрации раствора, в который погружен анод. Напишите уравнение токообразующей реакции, протекающей в гальваническом элементе.
№ задачи | Гальванический элемент |
227 | Ni|Ni2+ || 2Ag+|2Ag |
228 | Zn | Zn2+ || Cr3+ | Cr |
229 | H2|2H+||Cu2+|Cu |
230 | Mg| Mg2+||Ni2+|Ni |
231 | Al|Al3+||Fe2+|Fe |
232 | Zn | Zn2+||Pb2+|Pb |
233 | Mg| Mg 2+||Bi3+|Bi |
234–236Одним из электродов гальванического элемента является металл (см. таблицу), погруженный в раствор своей соли с концентрацией ионов 0,01 моль/л, а другим – водородный электрод. ЭДС этого элемента составляетЕ, В. Напишите уравнения катодной и анодной реакций, приведите схему гальванического элемента. Рассчитайте потенциал водородного электрода и концентрацию ионов водорода в растворе.Т= 298K.
№ задачи | металл | Е, В | Ответ |
234 | Zn | 0,701 | 0,01 |
235 | Cu | 0,371 | 0,03 |
236 | Ni | 0,250 | 0 |
237–240Запишите уравнения электродных реакций и составьте схему гальванического элемента, работа которого выражается уравнением, представленным в таблице. Укажите, какой электрод является катодом и анодом. Рассчитайте значения электродных потенциалов при концентрациях растворов анодаС1и катодаС2(см. таблицу). Определите ЭДС этого элемента.
№ задачи | Реакция | С1, моль/л | С2, моль/л | Ответы |
237 | Fe + 2Ag+2 Ag + Fe2+ | 0,01 | 0,1 | 1,24 |
238 | Ni + Cu2+ Ni2+ + Cu | 0,1 | 0,1 | 0,59 |
239 | Mg + Pb2+ Mg2+ + Pb | 1 | 0,01 | 2,184 |
240 | Zn + Ni2+ Ni + Zn2+ | 0,01 | 0,01 | 0,513 |
241–244Составьте схему гальванического элемента, состоящего из двух металлов Ме1и Ме2, погруженных в раствор собственных солей с концентрацией ионовС1иС2(см. таблицу). Укажите, какой электрод является катодом и анодом. Напишите уравнения реакций, протекающих на данных электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
№ задачи | Ме1 | Ме2 | С1, моль/л | С2,моль/л | Ответы |
241 | Zn | Ni | 0,01 | 0,01 | 0,51 В |
242 | Fe | Cu | 0,1 | 0,01 | 0,75 В |
243 | Fe | Ag | 0,001 | 0,01 | 1,21 В |
244 | Mg | Fe | 0,01 | 1 | 1,99 В |
245–247Рассчитайте значения электродных потенциалов металлов, приведенных в условии задачи, при концентрациях растворовС1(для 1-го металла) иС2(для 2-го металла). Определите анод и катод. Вычислите ЭДС элемента.
Аналогичные расчеты проведите для концентраций растворов, уменьшенных в 10 раз. Изменится ли ЭДС?
Приведите уравнения электродных реакций.
№ задачи | Ме1 | Ме2 | С1, моль/л | С2 ,моль/л | Ответы |
245 | Zn | Cu | 0, 1 | 0, 1 | 1,10 В |
246 | Al | Ni | 0,1 | 0,01 | 1,41 В |
247 | Mg | Ni | 0,01 | 0,1 | 2,15 В |
248Какой гальванический элемент называется концентрационным? Составьте его схему. Напишите уравнения анодного и катодного процессов, вычислите ЭДС. Гальванический элемент состоит из серебряных электродов, опущенных: первый в 0,01 М, а второй в 0,1 М растворыAgNO3.
Ответ: 0,059 В.
249Составьте схему двух гальванических элементов, в одном из которых никель был бы анодом, в другом – катодом. Напишите для каждого из них уравнения реакций, протекающих на аноде и на катоде, и рассчитайте ЭДС гальванических элементов при стандартных условиях. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов уменьшить в 10 раз?
250Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, проходящих на катоде и аноде.
4. Классификация электродов и гальванических элементов.
Металл, помещенный в раствор, содержащий ионы этого металл, относится к электродам первого рода. В этом случае электродный потенциал определяется активностью катионов металла в электролите (см. уравнение (9.12))
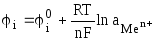 ,
,
и не зависит от
активности анионов, то есть электрод
обратим относительно катиона. Например,  .
.
К электродам
первого рода часто относят амальгамные электроды, отличающиеся тем, что вместо
чистого металла используется раствор
данного металла в ртути (амальгама),
находящийся в контакте с раствором,
содержащим ионы этого металла. Его
потенциал зависит не только от активности
ионов металла в растворе (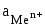 ),
но и от активности металла в амальгамме
(
),
но и от активности металла в амальгамме
( ):
):
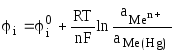 .
(9.16)
.
(9.16)
Иногда к электродам
первого рода относят газовые электроды, обратимые относительно
катиона или аниона. Такие электроды
состоят из инертного металла, находящегося
в одновременном контакте с газообразным
веществом и с раствором, содержащим
ионы этого вещества. Например, в водородном
электроде имеется Pt — пластина, покрытая
слоем электролитической Pt для обеспечения
достаточной площади поверхности и
помещенная в раствор, содержащий ионы
водорода. К Pt — пластине подводится
газообразный водород, обтекающий ее
поверхность. Водородный электрод стандартный,
если 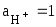 ,
а
,
а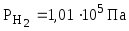 .
.
Водородному
электроду H+ / H2(Pt)
отвечает реакция H+ + e— =  H2,
а электродный потенциал его рассчитывается
из уравнения:
H2,
а электродный потенциал его рассчитывается
из уравнения:
 ,
(9.17)
,
(9.17)
где  = 0.
= 0.
На хлорном электроде протекает реакция:
 Cl2 + e— = Cl—
Cl2 + e— = Cl—
для которой в соответствии с уравнением (9.11):
 ,
(9.18)
,
(9.18)
так как уравнение (9.11) справедливо и для отдельно взятого электрода гальванического элемента.
Электроды второго рода состоят из металла, покрытого слоем труднорастворимого соединения этого металла и помещенного в раствор соли, образующей такой же анион, как и труднорастворимые соединения металла. Примером является хлорсеребряный электрод Ag | KCl, AgCl(ТВ), содержащий серебрянную пластинку с осадком хлорида серебра в растворе хлорида калия.
Равновесие протекающей на нем реакция восстановления ионов серебра
Ag+ + e— = Ag (а)
определяется концентрацией ионов Ag+ в насыщенном растворе хлорида серебра и связано с реакцией:
AgCl = Ag+ + Cl—, (б)
равновесие которой, в свою очередь, зависит от концентрации ионов Cl—. Поэтому потенциал хлорсеребряного электрода в конечном итоге определяется концентрацией раствора хлорида калия. В соответствии с уравнениями (а) и (б) суммарная реакция имеет вид:
AgCl + e— = Ag + Cl—. (в)
Таким образом, в работе хлорсеребрянного электрода участвуют катионы и анионы. Электродный потенциал может быть рассчитан (см. уравнение (12.6)) на основании реакции (а)

или суммарной реакции (в):
 .
(9.19)
.
(9.19)
Другим представителем электрода второго рода является каломельный электрод, широко используемый на практике: Hg | KCl, Hg2Cl2(ТВ), состоящий из ртути, покрытой каломелью Hg2Cl2 и помещенной в раствор KСl.
На этом электроде протекают реакции:
Hg+ + e— = Hg (г)
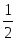 Hg2Cl2 = Hg+ + Cl— (д)
Hg2Cl2 = Hg+ + Cl— (д)
и суммарная реакция вида:
 Hg2Cl2 + e— = Hg + Cl—.
(е)
Hg2Cl2 + e— = Hg + Cl—.
(е)
Как обычно электродный потенциал рассчитывается в соответствии с уравнением (9.11):
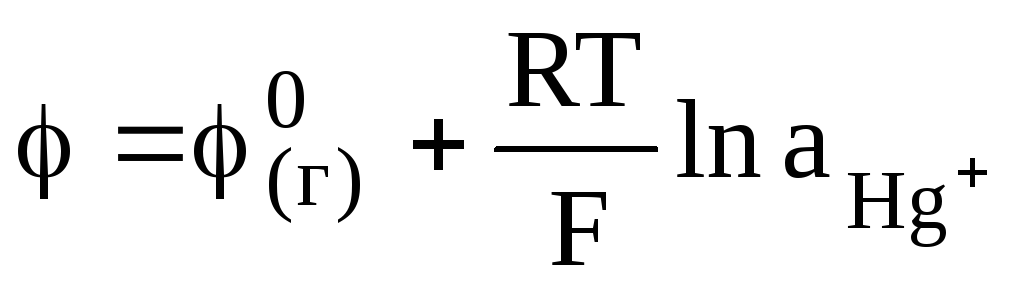 ,
,
 .
(9.20)
.
(9.20)
При получении уравнений (9.19) и (9.20) принимается, что активности чистых AgCl, Hg2Cl2, Ag и Hg равны единице. Электроды второго рода обладают высокой стабильностью потенциалов и применяются в качестве электродов сравнения.
Электроды третьего рода (редокс — электроды) характеризуются тем, что все участники электродной реакции находятся в растворе. Применяемый в них инертный металл — лишь резервуар электронов и непосредственного участия в электродном процессе не принимает. Например, электродом третьего рода является электрод Pt | Fe3+, Fe2+ состоящий из Pt — пластинки, находящейся в растворе, содержащем ионы Fe с различным зарядом (например, раствор FeCl2 и FeCl3). Pt — пластинка приобретает определенный потенциал вследствие того, что ионы Fe с различным зарядом превращаются друг в друга, отдавая ей излишние электроны или приобретая у нее недостающие.
На обсуждаемом электроде происходит реакция:
Fe3+ + e— = Fe2+.
Потенциал электрода соответственно (9.11) равен:
 .
(9.21)
.
(9.21)
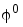 ,
как показывает (9.21) соответствует
условию:
,
как показывает (9.21) соответствует
условию:
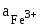 =
=  = 1.
= 1.
Гальванические элементы можно разделить на две группы:
а) химические гальванические элементы;
б) концентрационные гальванические элементы.
Химические гальванические элементы (например, гальванические элемент Даниэля — Якоби, Вестона) состоят из двух различных электродов, помещенных в растворы электролитов одинаковой концентрации. Для этих гальванических элементов характерно превращение энергии химической реакции в энергию электрического тока. К этой группе гальванических элементов принадлежит и гальванический элемент Вестона, используемый в качестве гальванического элемента — эталона.
Концентрационные гальванические элементы состоят из двух одинаковых электродов, помещенных в растворы различных концентраций. Опыт показывает, что электрод, погруженный в менее концентрированный раствор, является отрицательным электродом, а другой, погруженный в более концентрированный раствор — положительным.
Сопоставление опытных фактов приводит к заключению о том, что в основе работы всякого гальванического элемента лежат окислительно — восстановительные реакции, протекающие раздельно: на отрицательном электроде (аноде) — окисление, а на положительном (катоде) — восстановление.
При обозначении устройства гальванических элементов пользуются условной записью: вертикальными черточками обозначаются поверхности раздела фаз. Потенциал, возникающий на границе раздела двух растворов называется диффузионным. Чтобы подчеркнуть его отсутствие, в условной записи элемента используется двойная вертикальная черта:
Zn | ZnSO4 || CuSO4 | Cu.
Если в состав электрода гальванического элемента входит индифферентное, не участвующее в электродной реакции вещество, то его берут в скобки или отделяют запятой:
(Pt) H2 (p=1) | H+ (pH = 6) || KCl (1H), Hg2Cl2(ТВ) | Hg,
а составы фаз, их агрегатное состояние указываюся в скобках у символа фазы. Следуя этой же схеме, обозначается устройство электродов (полуэлементов).
Гальванический элемент: устройство, принцип работы, виды
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.

Принцип работы
Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (h3SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.

Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».

Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Виды
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.

График окислительно-восстановительной реакции
Типичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.

Щелочные батареи
Цинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Половинные реакции:
- Zn + 2OH — -> ZnO + h3O + 2 e —
- 2MnO2 + h3O + 2 e — -> Mn2O 3 + 2OH —
Общая реакция:
- Zn + 2MnO2 -> ZnO + Mn2O3 E = 1,5 В
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.

Сухой элемент
Важно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.

Литий-ионный элемент
Выбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
- Высокая плотность энергии. Высокая плотность энергии является одним из главных преимуществ технологии литиевых батарей, для того чтобы работать дольше.
- Саморазряд. Одной из проблем многих аккумуляторов является скорость саморазряда. Литий-ионные элементы в том, что скорость их саморазряда намного ниже, чем у Ni-Cad и NiMH. Обычно составляет около 5% в первые 4 часа после зарядки, но затем падает до 1 или 2% в месяц.
- Низкие эксплуатационные расходы, поскольку требуют технического обслуживания для обеспечения их производительности.
- Разнообразие типов: для бытовой электроники, для электроинструментов и электромобилей.
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
- Анод, при разряде отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции. Большинство коммерческих элементов в настоящее время используют электрод на основе углерода/графита, однако можно использовать металл или сплав.
- Катод, на разряде принимает электроны из внешней цепи и восстанавливается во время электрохимической реакции. Обычно это переходный металлический оксид или фосфат.
- Электролит.
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.

Аккумуляторная батарейка
Клетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2

Применение ячеек
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
Ответы@Mail.Ru: Гальванический элемент. Как определить что является катодом, а что
Идея с электрохимическим рядом напряжений очень хорошая. Разовьем ее? Если пластинку любого металла опустить в воду, то на границе вода-металл возникает скачок потенциала. Полярные молекулы воды «вытягивают» с пластинки ионы металла, на пластинке получается отрицательный заряд за счет оставшихся электронов. Конечно, гидратированные ионы металла далеко не уйдут, так и находятся у границы пластинки. Но все равно получается разделение зарядов, а следовательно, скачок потенциала. Так будет на границе ЛЮБОГО металла с водой или водным раствором электролита. НО, чем правее стоит металл в ряду напряжений, тем прочнее металлическая связь в решетке металла, тем труднее он отдает свои ионы воде, тем меньше будет скачок потенциала на границе металл вода. И, наоборот, чем левее стоит металл в ряду напряжений, тем легче он отдает свои ионы воде. (Такие металлы, как натрий, калий, кальций вообще растворяются в воде) . Теперь обратимся к системе никель-цинк в воде. Пусть каждая из пластинок будет в своем сосуде с водой (или раствором своей соли, например, цинковая пластинка – в растворе соли цинка (например ZnSO4), никелевая – в растворе соли никеля (NiSO4). Соединим сосуды изогнутой трубкой-мостиком, заполненной также электролитом (в принципе любым, лишь бы не реагировал с сульфатами, а можно и любым из двух сульфатов) . А пластинки соединим проволокой, имеющей некоторое сопротивление. На цинковой пластинке электронов больше, потому что она уже изначально отдала раствору больше ионов цинка, чем никелевая отдала ионов никеля в раствор. Электроны по проволоке пойдут с цинковой пластинки на никелевую. (Формально направление тока, наоборот, от плюса к минусу, т. е. от никеля к цинку) . В результате этого перемещения электронов на обеих границах металл-раствор нарушится равновесие, которое было до соединения. Чтобы восстановить равновесие, часть ионов цинка перейдет в раствор, создавая новые «лишние» электроны на пластинке. На никелевую пластинку пришли электроны с цинка, и для восстановления равновесия часть ионов никеля из раствора вернется на пластинку, нейтрализуя эти электроны. В растворе около никелевой пластинки получился избыток сульфат-анионов, а около цинковой пластинки – недостаток анионов (потому что ионы цинка перешли в раствор) . Для восстановления равновесия анионы по трубке мостику передвинутся от никеля к цинку. Цепь замкнулась. Электроны продолжают идти от цинка к никелю по проволоке, катионы цинка переходят в раствор (цинковая пластинка растворяется) , катионы никеля возвращаются на свою пластинку, анионы по раствору двигаются от никеля к цинку. С точки зрения химии цинк окисляется Zn – 2e = Zn(2+), а на никелевой пластинке происходит восстановление Ni(2+) + 2e = Ni. АНОДОМ НАЗЫВАЕТСЯ ЭЛЕКТРОД, НА КОТОРОМ ПРОИСХОДИТ ОКИСЛЕНИЕ. На катоде соответственно восстановление. Зная это, вы никогда не ошибетесь, потому что плюс и минус менее определенные понятия (при электролизе, например, плюс и минус меняются местами, по сравнению с гальваническим элементом, но анодом всегда остается электрод, на котором происходит окисление) .
по движению электронов. подключить вольтметр. ток постоянный
Вольтметром постоянного тока. Анод -это плюс, катод-минус.
anod bolee aktivnwj metall t.e. Zn, Ni budet katod (sm tablicu elektrootricatelnosti)
я химию лет тридцать назад учил, могу и ошибаться, но, думаю, нужно это использовать. <img src=»//content-29.foto.my.mail.ru/mail/shurik_temryuk/_answers/i-457.jpg» >
<a rel=»nofollow» href=»http://www.xumuk.ru/galvanopara/» target=»_blank»>http://www.xumuk.ru/galvanopara/</a>
9.2 Гальванический элемент
Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию.
Принцип работы гальванического элемента можно рассмотреть на примере элемента Даниэля – Якоби (рис 9.2).

Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный
электродный потенциал цинкового
электрода 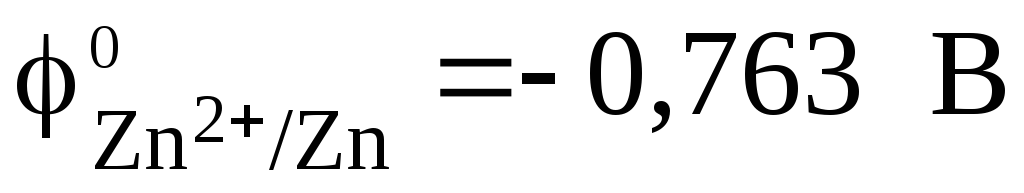 .
Стандартный электродный потенциал
медного электрода
.
Стандартный электродный потенциал
медного электрода 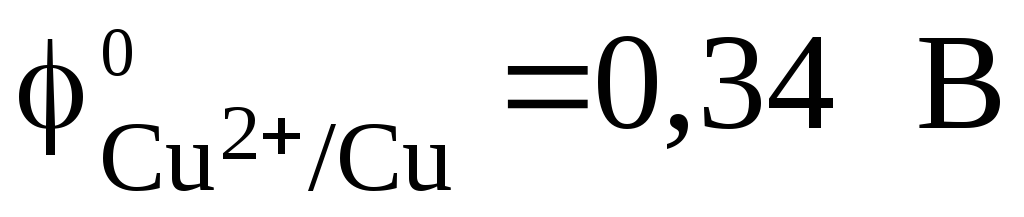 .
Так как
.
Так как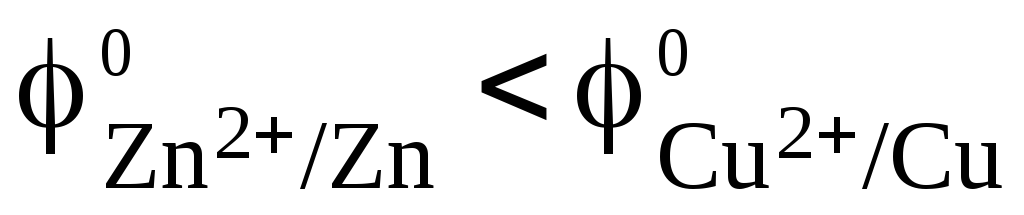 ,
то атомы цинка будут окисляться:
,
то атомы цинка будут окисляться:
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступаетцинковыйэлектрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+».
Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток).
На медном электроде происходит процесс восстановления катионов электролитаCu2+:
Электрод, на котором идет реакция восстановления или который принимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO42– к аноду, катионовZn2+к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Реакции (а) и (б) называются электродными реакциями.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
или, с учетом анионов раствора:
Zn + CuSO4= ZnSO4+ Cu. | (г) |
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
MeА+ MeКn+MeАn++ MeК, | (д) |
где индексы А и К относятся к металлам анода и катода соответственно.
Реакции (в) – (д) называются токообразующими реакциями.
Символическая запись (схема) гальванического
элемента имеет вид: 
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:
| (9.3) |
Схема гальванического элемента Даниэля– Якоби имеет вид:
Zn|ZnSO4 ||CuSO4|Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой(ЭДС) элементаЕ. Она вычисляется по формуле;
где φк и φа – электродные потенциалы катода и анода соответственно.
Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна:
Е= +0,34 – (–0,76) = 1,10 В.
Электродвижущая сила Ехарактеризует способность гальванического элемента совершать электрическую работу во внешней цепи.
Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала ∆Gпроцесса. Связь между величиной ∆Gи ЭДС описывается уравнением:
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ∆G0связана с константой равновесия этой реакцииКравнсоотношением
| (9.6) |
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимнообратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:
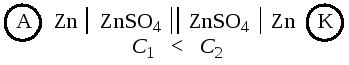
Пример 1.Составьте схему гальванического элемента, в основе которого лежит реакция:Mg+ZnSO4 =MgSO4+Zn.Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на этих электродах. Рассчитайте ЭДС элемента при стандартных условиях. Вычислите константу равновесия для токообразующей реакции.
Решение
В таблице находим значения стандартных электродных потенциалов систем Zn/Zn2+иMg/Mg2+ :
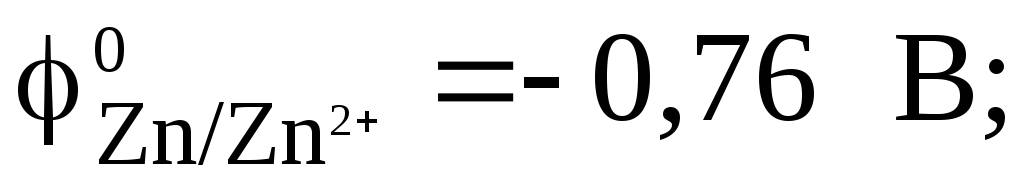

Поскольку  ,
то магниевый электрод выполняет функцию
анода, а цинковый – катода. Схема
гальванического элемента имеет вид:
,
то магниевый электрод выполняет функцию
анода, а цинковый – катода. Схема
гальванического элемента имеет вид:

На аноде идет процесс окисления:

На катоде – восстановление катионов среды:
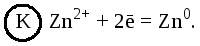
Стандартная ЭДС гальванического элемента
Е= φ0к– φ0а= –0,763 – (–2,37) = 1,607 В.
По уравнениям (9.5) и (9.6) вычислим константу равновесия токообразующей реакции:

Потенцируя, находим Кравн= 3,5 ∙1054.
Поскольку К>>1, то токообразующая реакция практически необратима.
Пример 2.Составьте схему гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в растворы их солей. Концентрации ионов в растворах:CZn2+ = 0,1 моль/л,CAg+ = 0,01 моль/л. Укажите, какой электрод является катодом, а какой – анодом. Напишите уравнения реакций, протекающих на электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
Решение
Так как концентрации ионов не равны единице, то вначале рассчитаем потенциалы электродов, используя формулу Нернста. Если в условии задачи отсутствует значение температуры, то ее принимают равной стандартной температуре Т= 298 К. Поэтому будем использовать уравнение (9.2):

Подставим числовое значение концентрации в формулу Нернста, используя данные таблицы 9.1:
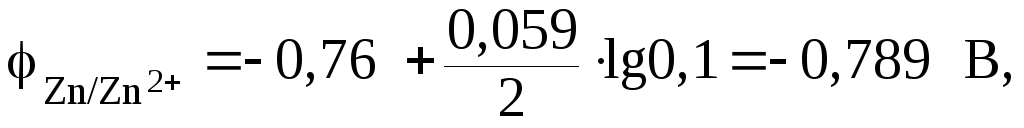
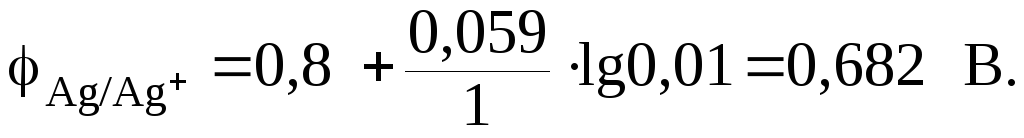
Из расчета
видно, что 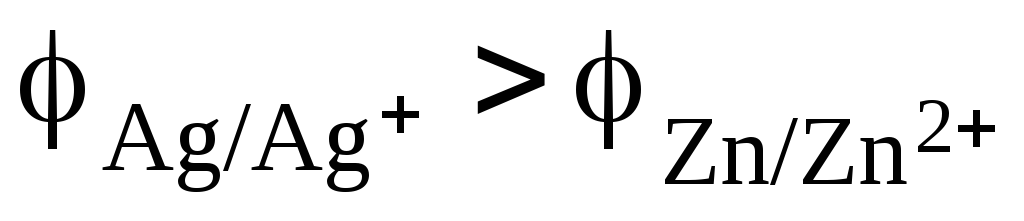 .
Поэтому цинковый электрод выполняет
функцию анода, а серебряный – катода.
.
Поэтому цинковый электрод выполняет
функцию анода, а серебряный – катода.
Схема гальванического элемента:
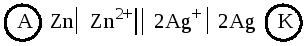
Вычислим ЭДС элемента по формуле (9.4):
Е= φк– φа = 0,741 – (-0,789) = 1,530 В.
Теперь запишем электродные реакции. На аноде происходит процесс окисления:
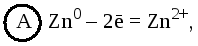
а на катоде – процесс восстановления:
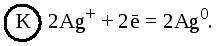
Складывая уравнения электродных процессов (с учетом равенства числа принимаемых и отдаваемых электронов), получаем суммарное уравнение токообразующей реакции: Zn+ 2Ag+=Zn2++ 2Ag.
Задачи
221–226Напишите уравнения катодного и анодного процессов и составьте схему гальванического элемента, при работе которого протекает следующая реакция (см. таблицу). На основании значений стандартных электродных потенциалов рассчитайте константу равновесия данной реакции и ЭДС элемента.
№ задачи | Реакция | Ответ |
221 | Sn + PbCl2 = SnCl2 + Pb | Кр = 2,0; E = 9∙10–3 B |
222 | Zn + Pb(NO3)2 = Zn(NO3)2 + Pb | Кр = 3,5∙1021; E = 0,633 B |
223 | Zn + 2AgNO3 = Zn(NO3)2 + 2Ag | Кр = 8,7∙1052 ; E = 1,56 B |
224 | Ni + 2AgNO3 = Ni(NO3)2 + 2Ag | Кр = 3,8∙1035 ; E = 1,05 B |
225 | Zn + CdSO4 = ZnSO4 + Cd | Кр = 1,56∙1012; E = 0,36 B |
226 | Mg + Ni(NO3) 2 = Mg(NO3)2 + Ni | Кр = 1,7∙108 ; E = 8,23 B |
227–233 Рассчитайте значения электродных потенциалов металла, являющегося анодом, при различных концентрациях раствора: 10; 0,1; 0,01; 0,001 моль/л. Концентрация раствора, в который погружен катод, постоянна и равна 1 моль/л. Определите ЭДС.
Постройте график зависимости ЭДС гальванического элемента от логарифма концентрации раствора, в который погружен анод. Напишите уравнение токообразующей реакции, протекающей в гальваническом элементе.
№ задачи | Гальванический элемент |
227 | Ni|Ni2+ || 2Ag+|2Ag |
228 | Zn | Zn2+ || Cr3+ | Cr |
229 | H2|2H+||Cu2+|Cu |
230 | Mg| Mg2+||Ni2+|Ni |
231 | Al|Al3+||Fe2+|Fe |
232 | Zn | Zn2+||Pb2+|Pb |
233 | Mg| Mg 2+||Bi3+|Bi |
234–236Одним из электродов гальванического элемента является металл (см. таблицу), погруженный в раствор своей соли с концентрацией ионов 0,01 моль/л, а другим – водородный электрод. ЭДС этого элемента составляетЕ, В. Напишите уравнения катодной и анодной реакций, приведите схему гальванического элемента. Рассчитайте потенциал водородного электрода и концентрацию ионов водорода в растворе.Т= 298K.
№ задачи | металл | Е, В | Ответ |
234 | Zn | 0,701 | 0,01 |
235 | Cu | 0,371 | 0,03 |
236 | Ni | 0,250 | 0 |
237–240Запишите уравнения электродных реакций и составьте схему гальванического элемента, работа которого выражается уравнением, представленным в таблице. Укажите, какой электрод является катодом и анодом. Рассчитайте значения электродных потенциалов при концентрациях растворов анодаС1и катодаС2(см. таблицу). Определите ЭДС этого элемента.
№ задачи | Реакция | С1, моль/л | С2, моль/л | Ответы |
237 | Fe + 2Ag+2 Ag + Fe2+ | 0,01 | 0,1 | 1,24 |
238 | Ni + Cu2+ Ni2+ + Cu | 0,1 | 0,1 | 0,59 |
239 | Mg + Pb2+ Mg2+ + Pb | 1 | 0,01 | 2,184 |
240 | Zn + Ni2+ Ni + Zn2+ | 0,01 | 0,01 | 0,513 |
241–244Составьте схему гальванического элемента, состоящего из двух металлов Ме1и Ме2, погруженных в раствор собственных солей с концентрацией ионовС1иС2(см. таблицу). Укажите, какой электрод является катодом и анодом. Напишите уравнения реакций, протекающих на данных электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
№ задачи | Ме1 | Ме2 | С1, моль/л | С2,моль/л | Ответы |
241 | Zn | Ni | 0,01 | 0,01 | 0,51 В |
242 | Fe | Cu | 0,1 | 0,01 | 0,75 В |
243 | Fe | Ag | 0,001 | 0,01 | 1,21 В |
244 | Mg | Fe | 0,01 | 1 | 1,99 В |
245–247Рассчитайте значения электродных потенциалов металлов, приведенных в условии задачи, при концентрациях растворовС1(для 1-го металла) иС2(для 2-го металла). Определите анод и катод. Вычислите ЭДС элемента.
Аналогичные расчеты проведите для концентраций растворов, уменьшенных в 10 раз. Изменится ли ЭДС?
Приведите уравнения электродных реакций.
№ задачи | Ме1 | Ме2 | С1, моль/л | С2 ,моль/л | Ответы |
245 | Zn | Cu | 0, 1 | 0, 1 | 1,10 В |
246 | Al | Ni | 0,1 | 0,01 | 1,41 В |
247 | Mg | Ni | 0,01 | 0,1 | 2,15 В |
248Какой гальванический элемент называется концентрационным? Составьте его схему. Напишите уравнения анодного и катодного процессов, вычислите ЭДС. Гальванический элемент состоит из серебряных электродов, опущенных: первый в 0,01 М, а второй в 0,1 М растворыAgNO3.
Ответ: 0,059 В.
249Составьте схему двух гальванических элементов, в одном из которых никель был бы анодом, в другом – катодом. Напишите для каждого из них уравнения реакций, протекающих на аноде и на катоде, и рассчитайте ЭДС гальванических элементов при стандартных условиях. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов уменьшить в 10 раз?
250Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, проходящих на катоде и аноде.
Лекция по теме «Гальванические элементы»
Учебные вопросы
Понятие гальванического элемента
Потенциалы различных электродов
Электрохимическая поляризация
1. Понятие гальванического элемента
Гальванические элементы состоят из двух электродов, имеющих различный электродный потенциал, электролита, который дает возможность перемещаться ионам от одного электрода к другому, и металлического проводника электронов в результате потока которых может быть получена электрическая энергия постоянного тока.
ЭДС гальванического элемента равна разности равновесных потенциалов положительного электрода (катода) и отрицательного электрода (анода). Если потенциал одного из электродов принять равным нулю, то относительный потенциал второго электрода будет равен ЭДС элемента. Таким образом, можно определить относительный потенциал любого электрода.
Потенциалы различных электродов
Стандартный водородный электрод. Равным нулю принят потенциал стандартного водородного электрода (Е02Н+/Н2 0,0В). Стандартный водородный электрод состоит из платиновой пластины, покрытой платиновой чернью (мелко раздробленной платиной), контактирующей с газообразным водородом под давлением 1атм и раствором серной кислоты, в котором активность ионов водорода Н+ равна единице (рис. 1).
В водородном электроде происходит реакция, аналогичная реакциям, протекающим на поверхности металлических электродов. Платина здесь играет только роль инертного проводника, а ее поверхностный слой адсорбирует (концентрирует) водород. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя на платине электроны.
При этом платина заряжается отрицательно, а раствор – положительно, Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода.
Равновесие на водородном электроде можно представить в виде
2Н+ + 2
 Н2
Н2
Схематически водородный электрод обозначают 2Н+/Н2, где вертикальная черта обозначает поверхность раздела фаз.
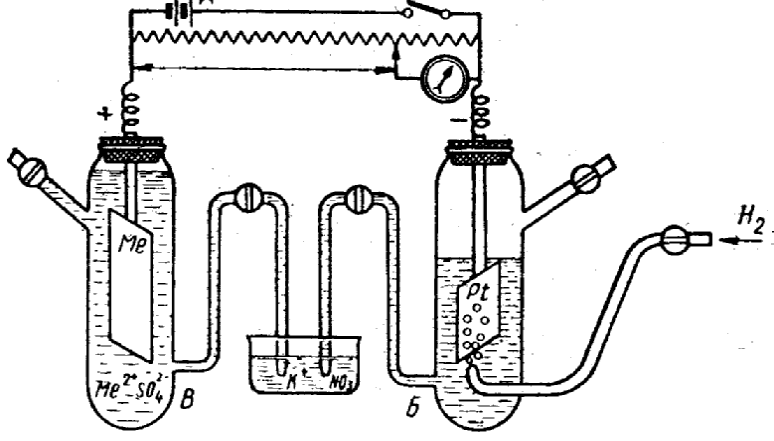
Рис. 1. Ячейка для измерения электродного потенциала металла:
а — аккумулятор; б – стандартный водородный
электрод; в–металлический электрод.
Потенциалы металлических электродов. При погружении металла в раствор, содержащий ионы этого металла, устанавливается равновесие:
Ме  Меn+ + n
Меn+ + n
При равновесии скорость растворения металла равна скорости разряда его ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом. Электродный потенциал металла определяют либо экспериментально компенсационным методом, либо вычисляют. Для его измерения составляется гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод:
(катод) Pt, H2/2H+II Men+/Me (анод)
р =
1 атм,aH+
=
1 атм,aH+ = 1 моль/л
= 1 моль/л
и
измеряется его электродвижущая сила
(ЭДС) в условиях обратимой работы
элемента (при отсутствии тока в цепи)
(рис. 1). Она равна разности равновесных
потенциалов катода и анода ЭДС = (│Ек— Еа│). Так как потенциал стандартного
водородного электрода равен нулю
(Е02Н /Н
/Н =0),
то ЭДС элемента будет равна потенциалу
измеряемого электрода.
=0),
то ЭДС элемента будет равна потенциалу
измеряемого электрода.
Для вычисления электродного потенциала применяют уравнение Нернста:

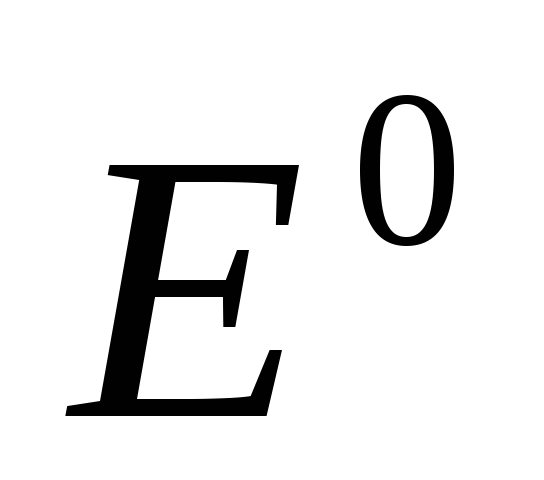 +
+  ln
ln (1) ,
(1) ,
учитывая,
что активность твердой фазы постоянна
и равна 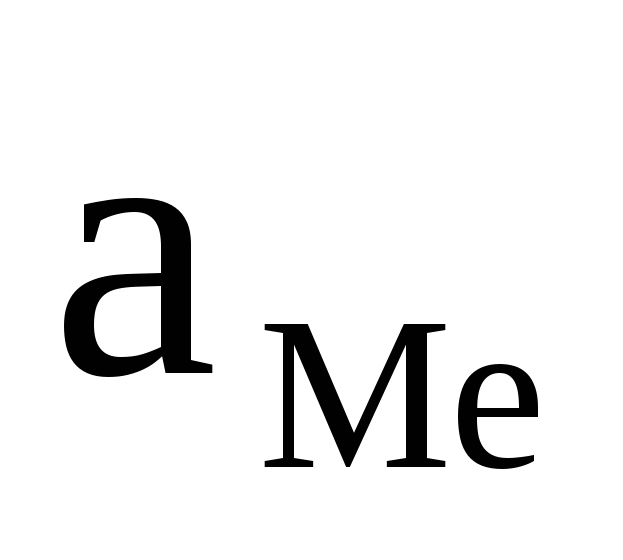 = 1 моль/л, получаем:
= 1 моль/л, получаем:

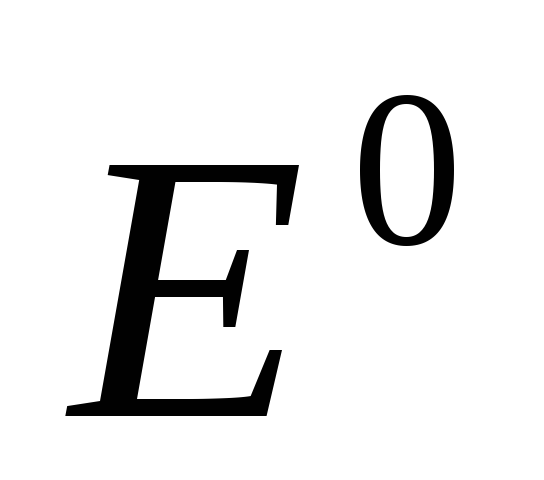 +
+ 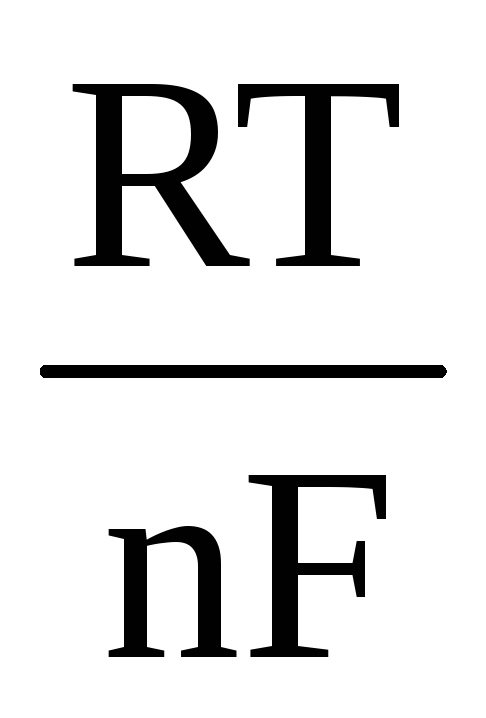 ln
ln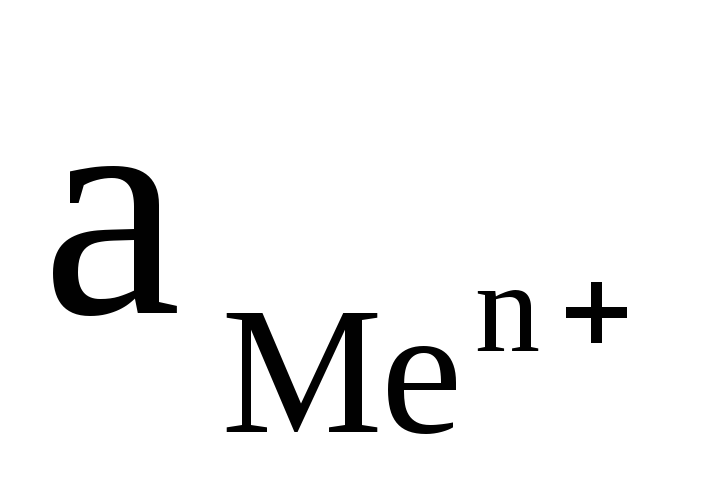 (2),
(2),
где Е0 — стандартный электродный потенциал, В;
R — универсальная газовая постоянная, равная 8,314
Вт-с/моль ∙ К;
Т — температура, К;
n — число электронов, участвующих в электродном про-
цессе;
F — число Фарадея, равное 96500 Кл/моль;
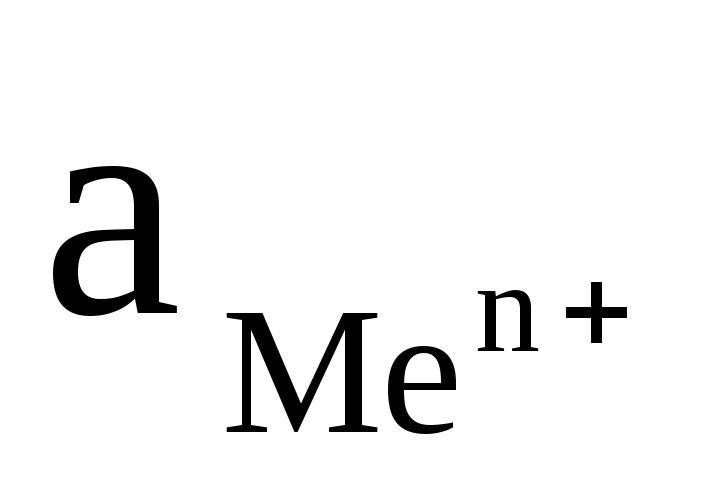 -активность
ионов металла, моль/л.
-активность
ионов металла, моль/л.
Переходя от натуральных логарифмов к десятичным и подставляя в уравнение Нернста Т = 298 К и соответствующие значения R и F уравнение приобретает более простой вид:

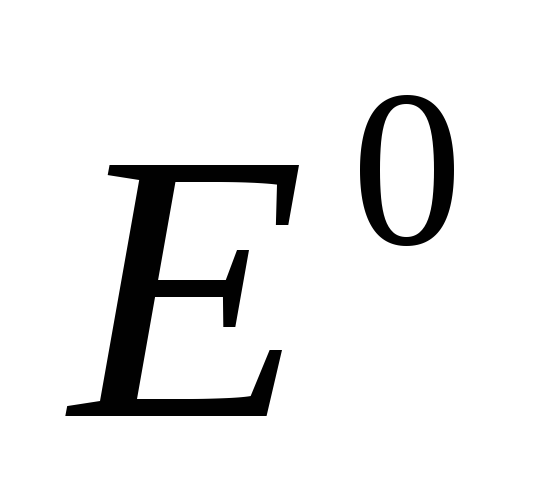 +
+ 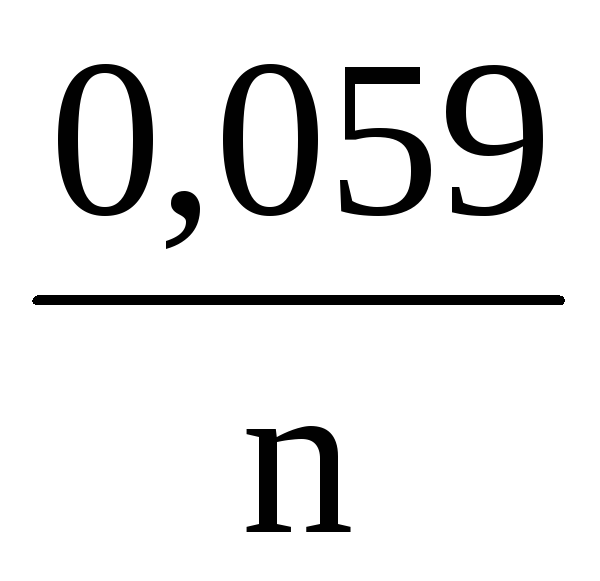
 (3)
(3)
Для
разбавленных растворов, в которых
активности мало отличаются от концентраций
(аМе
 [Men+]),
в уравнении Нернста активность можно
заменить концентрацией:
[Men+]),
в уравнении Нернста активность можно
заменить концентрацией:

 +
+ 
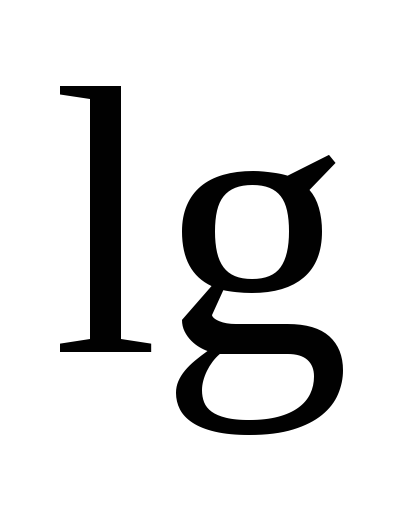 [
[ ]
(4)
]
(4)
Значение
стандартного электродного потенциала
металлического электрода  можно определить экспериментально,
описанным выше, компенсационным методом
при
можно определить экспериментально,
описанным выше, компенсационным методом
при 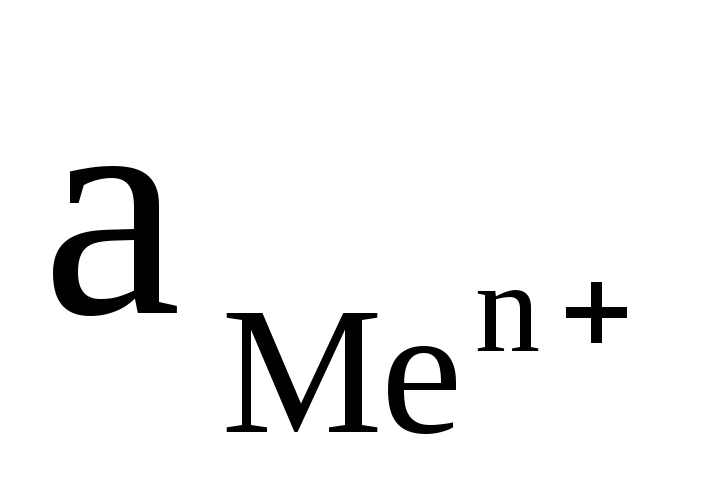 =
1 моль/л..
=
1 моль/л..
Стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с их активностью, равной 1 моль/л, определенный относительно стандартного водородного электрода.
Стандартные потенциалы металлических электродов в водных растворах (ряд стандартных электродных потенциалов) приведены в таблице 1.
Ряд стандартных электродных потенциалов (ряд напряжений металлов). Стандартные электродные потенциалы металлов являются мерой окислительно-восстановительной способности металла и его ионов. Металлы в виде простых веществ – восстановители, ионы металлов – окислители.
Знак электродного потенциала характеризует активность металла относительно водорода. Металлы имеют электродные потенциалы со знаком «минус», если их активность выше активности водорода и «плюс», если они менее активны, чем водород.
Чем отрицательнее значение электродного потенциала металла, тем более сильной восстановительной способностью он обладает. Например, литий, калий, натрий относятся к сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем большей окислительной способностью обладают его ионы.
Активные
металлы начала ряда, а также щелочные
и щелочно -земельные вытесняют водород
из воды. Например, 2K
+ 2H2O 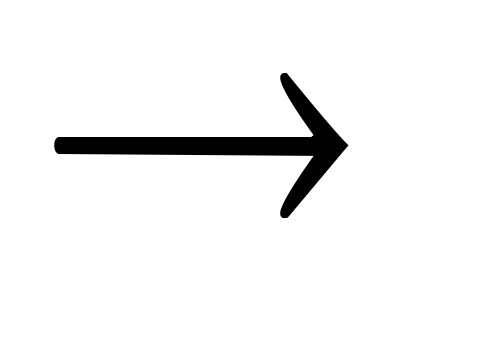 2KOH
+ H2
2KOH
+ H2 .
.
Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием.
Все
металлы, стоящие в ряду стандартных
электродных потенциалов до водорода,
вытесняют его из растворов кислот с
концентрацией (активностью) ионов
водорода 1 моль/л. Например, Zn
+ HCl  ZnCl2 + H2
ZnCl2 + H2 .
.
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов кислот с концентрацией ионов водорода 1 моль/л.
Металлы
способны вытеснять друг друга из
растворов солей. Направление реакции
определяется при этом их взаимным
положением в ряду напряжений. Рассматривая
конкретные случаи таких реакций, следует
помнить, что активные металлы вытесняют
водород не только из воды, но и из любого
водного раствора. Поэтому взаимное
вытеснение металлов из растворов их
солей практически происходит лишь в
случае металлов, расположенных в ряду
после магния. Например, Zn
+ CuSO4  ZnSO4 +Cu.
ZnSO4 +Cu.
Потенциалы газовых электродов. Газовые электроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы, т.е. быть инертным, а также обладать хорошей адсорбционной способностью, так как в электродном процессе участвуют адсорбированный газ и его ионы в растворе. Всем этим требованиям удовлетворяют платина, покрытая электролитическим способом платиновой чернью, и металлы платиновой группы, поэтому они чаще всего используются при создании газовых электродов.
Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов.
Равновесие
на водородном электроде выражается
уравнением 2Н+ + 2 
 Н2 . Уравнение Нернста для расчета потенциала
водородного электрода имеет следущий
вид:
Н2 . Уравнение Нернста для расчета потенциала
водородного электрода имеет следущий
вид:
Е2Н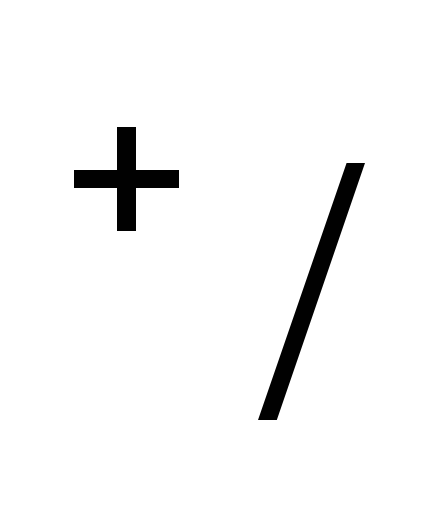 Н
Н =
= 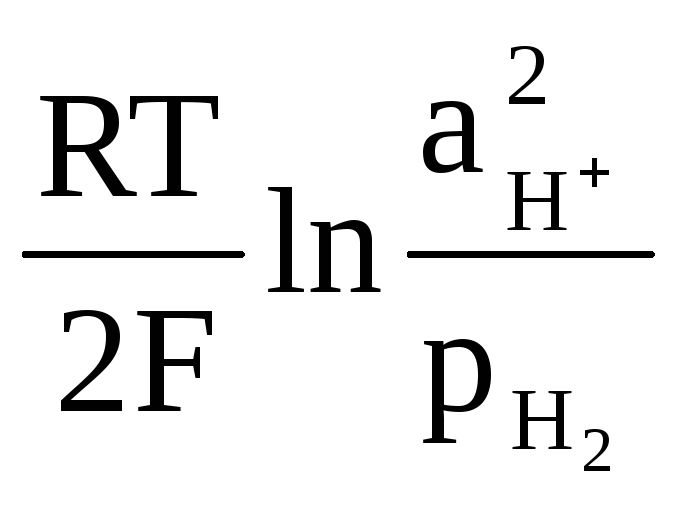 (5)
(5)
или для 298 К
Е2Н Н
Н = ,
(6)
= ,
(6)
где
аН — активность ионов Н+ в электролите; рН
— активность ионов Н+ в электролите; рН — парциальное давление водорода.
— парциальное давление водорода.
Учитывая,
что  = — рН, получаем при 298 К
= — рН, получаем при 298 К
Е2Н Н
Н =
=  ( 7)
( 7)
при
рН =
1 и 298 К уравнение (4.18) приобретает вид:
=
1 и 298 К уравнение (4.18) приобретает вид:
Е2Н Н
Н = — 0,059 рН (8)
= — 0,059 рН (8)
Кислородный электрод состоит из платиновой пластины, контактирующей с кислородом и раствором, содержащим ионы, которые образуются при восстановлении кислорода (ионы ОН—):
О2, Pt │ОН—
Если на кислородном электроде протекает реакция по уравнению:
2
Н2О
+ О2 +
4 
 4 ОН—
4 ОН—
то выражение равновесного потенциала для 298 К имеет вид:
Е2Н О
+О
О
+О /
4ОН
/
4ОН = Е02Н
= Е02Н О
+О
О
+О /
4ОН— +
/
4ОН— + 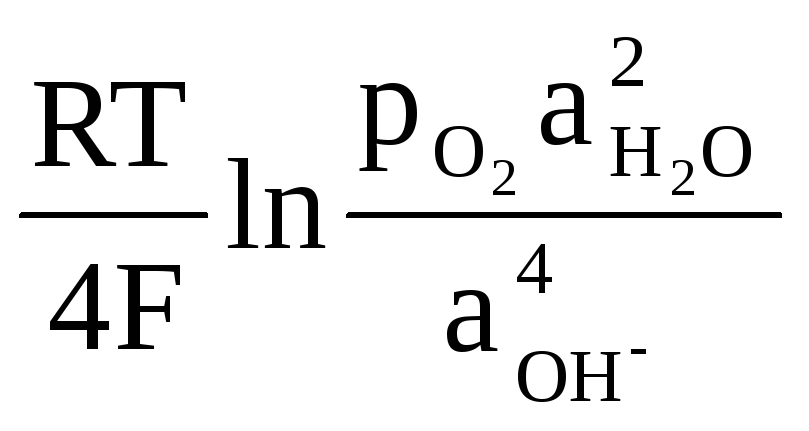 (4.20)
(4.20)
Так
как активность воды в ходе реакции
меняется мало, то ее считают величиной
постоянной и значение  вводят в Е 02Н
вводят в Е 02Н О
+О
О
+О /
4ОН
/
4ОН :
:
Е2Н О
+О
О
+О /
4ОН
/
4ОН = Ео2Н
= Ео2Н О
+О
О
+О /
4ОН
/
4ОН + 0,0147
+ 0,0147 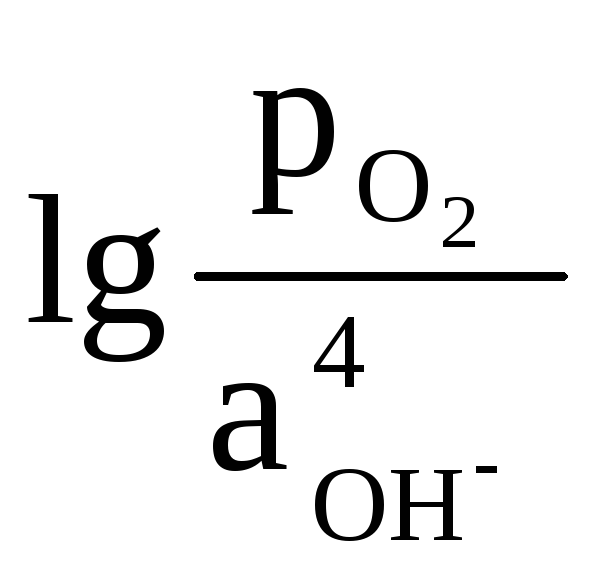 , (9)
, (9)
где Ео2Н О
+О
О
+О /
4ОН
/
4ОН — стандартный потенциал кислородного
электрода, равный 0,401 В (при аОН—= 1 моль/л).
— стандартный потенциал кислородного
электрода, равный 0,401 В (при аОН—= 1 моль/л).
Подставляя
в уравнение (4.21) значение а ОН— = КН О/
аН+ , где КН
О/
аН+ , где КН О — ионное произведение воды, и
О — ионное произведение воды, и 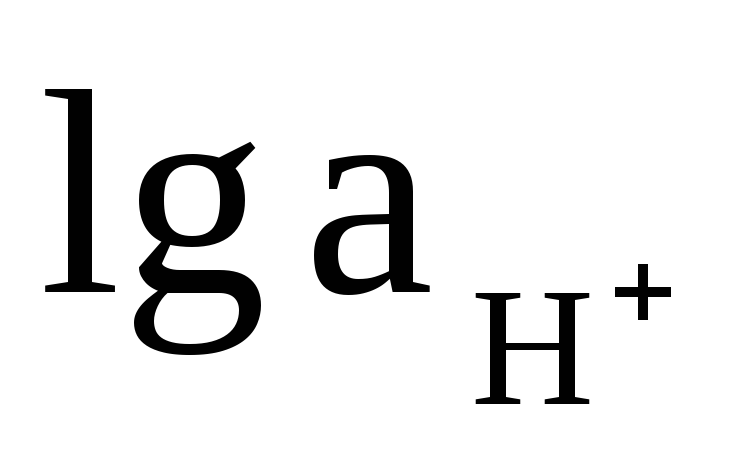 = -рН, получаем
= -рН, получаем
Е2Н О
+О
О
+О /
4ОН
/
4ОН = 1,23 + 0,0147
= 1,23 + 0,0147 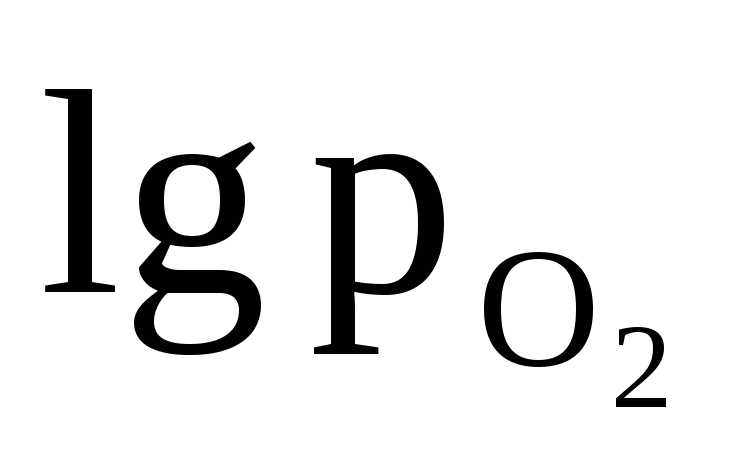 —
0,059 рН (10)
—
0,059 рН (10)
Учитывая,
что 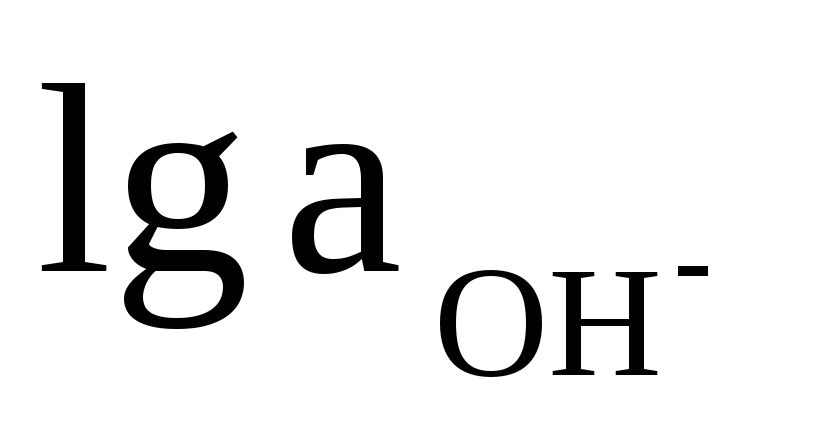 =
— рОН,
=
— рОН,  О
О =
1атм, аН
=
1атм, аН О = 1моль/л и Т=298 К уравнение ( 4.20)
приобретает вид:
О = 1моль/л и Т=298 К уравнение ( 4.20)
приобретает вид:
Е2Н О
+О
О
+О /
4ОН
/
4ОН = Ео2Н
= Ео2Н О
+О
О
+О /
4ОН
/
4ОН +
0,059
+
0,059  (11)
(11)
Зависимости потенциалов водородного и кислородного электродов от рН раствора приведены в таблице.
Таблица. Газовые электроды
Уравнение | Электрод и его обозначения | |||
водородный | кислородный | |||
2Н+/Н2 | 2H2O/H2,2OH—,Pt | Pt,O2,4H+/2H2O | Pt,O2,2H2O/4OH— | |
pH < 7 | pH | pH < 7 | pH | |
электродного процесса | 2Н+ +2 | 2
Н2О
+2 | О2+
4Н+ +
4 | 2Н2О
+О2 + 4 |
Ео, В | 0,000 | -0,828 | 1,229 | 0,401 |
уравнение Нернста |
|
|
| |
Для расчета электродного потенциала: а) при Т=298К б) при Т=298К и
| |
| -0,059рН + 0,0147 | = 1,229-0,059рН |
Потенциалы окислительно-восстановительных электродов. Любая электродная реакция представляет собой окислительно-восстановительную реакцию. К окислительно-восстановительным электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из металлического проводника, контактирующего с раствором, содержащим окислители и восстановители. К металлу в окислительно-восстановительных электродах предъявляются те же требования, что и к металлическому проводнику в газовых электродах.
В общем виде равновесие на электроде записывается уравнением:
Ox
+ n
 Red
Red
Схема электрода соответственно может быть записана в форме
Pt│Ox, Red,
где Ox – окисленная форма вещества; Red – восстановленная форма вещества.
Уравнение Нернста для расчета потенциала окислительно-востановительного электрода имеет вид:
 (12)
(12)
В более сложных окислительно-восстановительных процессах участвуют ионы ОН— или Н+. В этих случаях, как и потенциалы кислородного и водородного электродов, окислительно-восстановительные потенциалы зависят от рН. Например, для реакции:
MnO4— + 8 H+ +
5 

 Mn2+ +
4 H2O
Mn2+ +
4 H2O
в которой ионы MnO4— являются окисленной формой вещества, а ионы Mn2+— восстановленной формой вещества, потенциал определяется уравнением:
 (13)
(13)
Под
знаком логарифма в уравнении (12)
отсутствует активность воды, которая
при электродных реакциях остается
практически постоянной и вводится в
значение Ео.
Подставляя числовые значения величин
R
и F
в уравнение (…) и учитывая, что  ,
получаем для 298 К:
,
получаем для 298 К:
 (14)
(14)
Как видно, окислительно-восстановительный потенциал мало зависит от активностей ионов MnO4— и Mn2+ и существенно меняется с изменением рН раствора. Значения стандартных потенциалов некоторых окислительно-восстановительных систем приведены в справочных таблицах.
Потенциал окислительно-восстановительных электродов служит мерой окислительной и восстановительной способности систем.
Чем выше значение стандартного потенциала окислительно-восстановительного электрода, тем более сильным окислителем будет его окисленная форма.
Чем ниже значение стандартного потенциала окислительно-восстановительного электрода, тем более сильным восстановителем будет его восстановленная форма.
В соответствии с уравнением Нернста окислительно-восстановительная способность систем также зависит от активности окисленной и восстановленной форм вещества, а для реакций с участием ионов Н+ и ОН— и от рН среды.
Для
определения направления
окислительно-восстановительных процессов
необходимо рассчитать электродвижущую
силу ∆Е как разность потенциалов
окислительно-восстановительных
электродов ∆Е = ( ),
участвующих в данном процессе. Реакция
будет протекать в направлении, в котором
∆Е положительна. Электрод, имеющий большую
величину электродного потенциала
является катодом, т.е. электродом–окислителем
(
),
участвующих в данном процессе. Реакция
будет протекать в направлении, в котором
∆Е положительна. Электрод, имеющий большую
величину электродного потенциала
является катодом, т.е. электродом–окислителем
(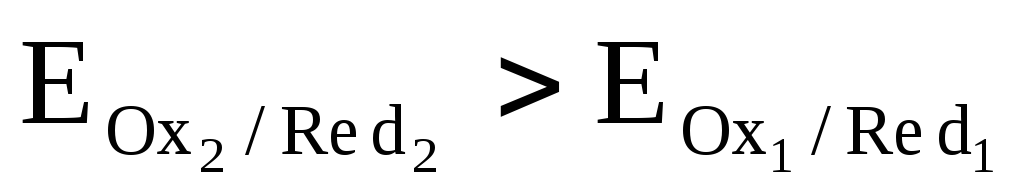 ).
Электрод-восстановитель имеет меньшую
величину электродного потенциала и
играет роль анода. Например, реакция
).
Электрод-восстановитель имеет меньшую
величину электродного потенциала и
играет роль анода. Например, реакция
Sn2+ + 2 Fe3+ Sn4+ + 2 Fe2+
Sn4+ + 2 Fe2+
при  = 1 моль/л осуществляется в прямом
направлении, так как ∆Е положительна при условии, что электрод
Fe3+/Fe2+ является катодом, т.е. электродом-окислителем.
= 1 моль/л осуществляется в прямом
направлении, так как ∆Е положительна при условии, что электрод
Fe3+/Fe2+ является катодом, т.е. электродом-окислителем. 
 (табл. 2).
(табл. 2).








 ,Pt
,Pt 7
7 7
7
 Н2
Н2

 Н2
Н2 +
2ОН—
+
2ОН—
 2Н2О
2Н2О
 4
ОН—
4
ОН—
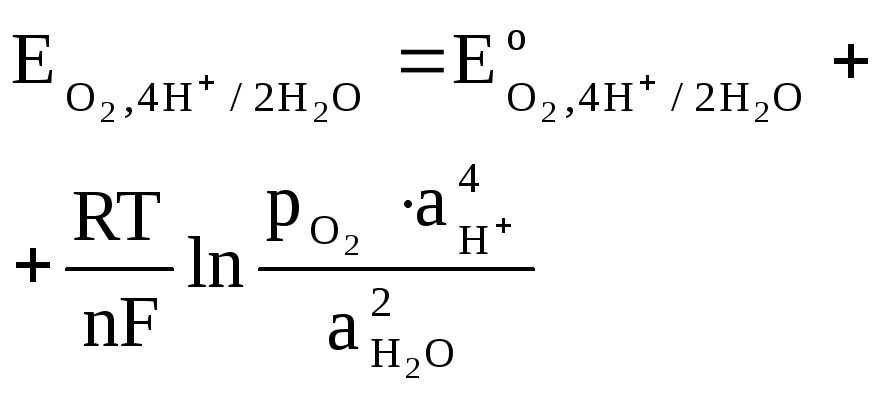
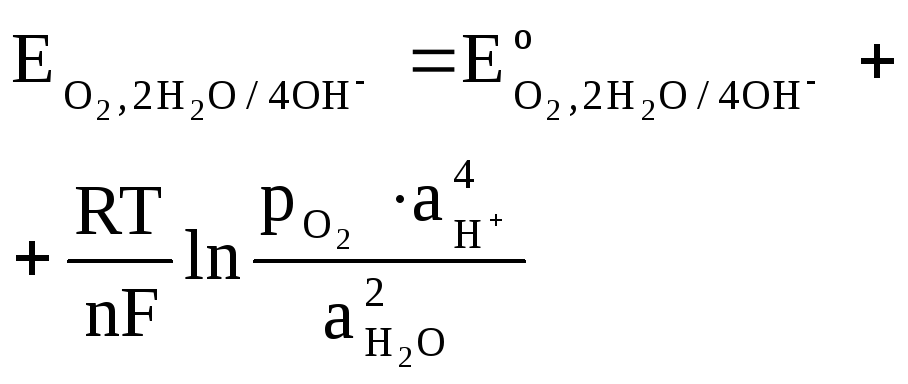
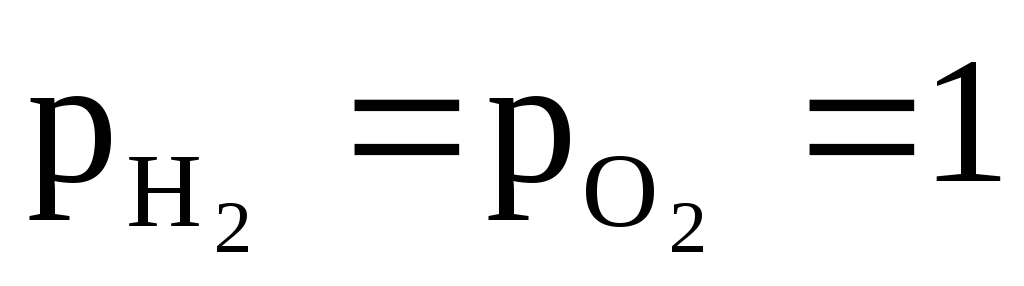
 =
=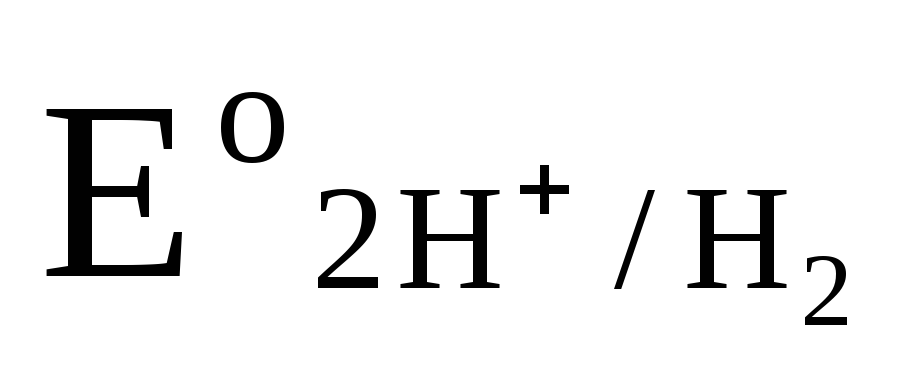 —0,059рН-0,0295
—0,059рН-0,0295
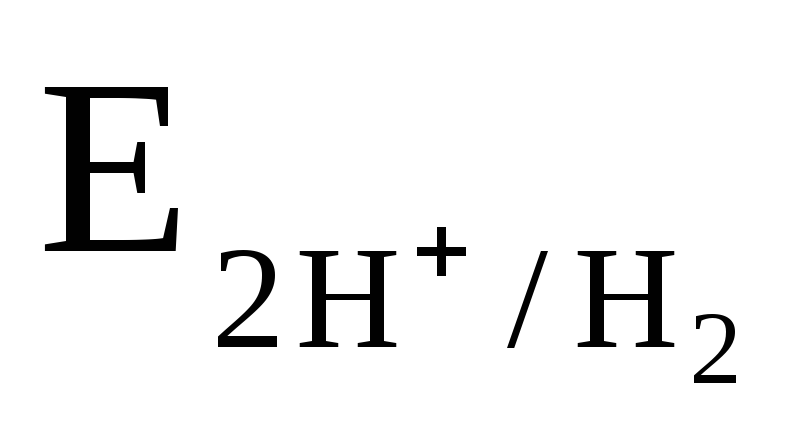 =-0,059
рН
=-0,059
рН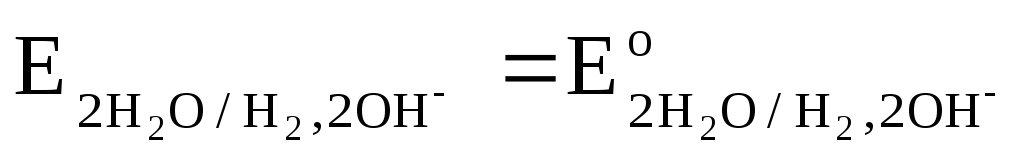 —0,059рН-0,0295
—0,059рН-0,0295 +0,828
+0,828 —0,828-0,059рН+
0,828
= -0,059 рН
—0,828-0,059рН+
0,828
= -0,059 рН —
—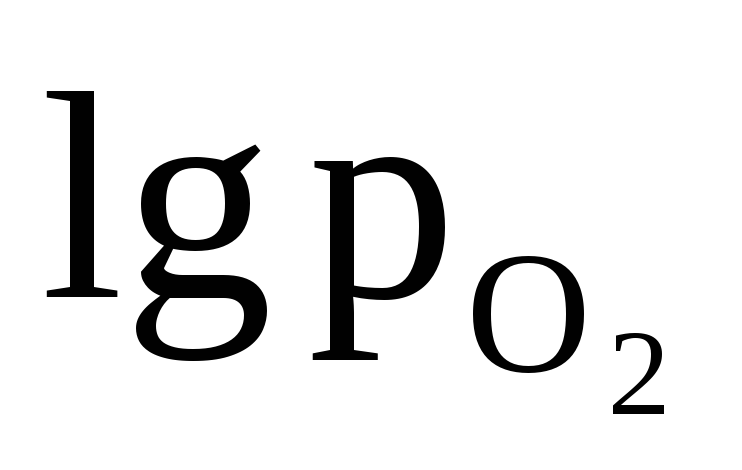
 =1,229-0,059рН
=1,229-0,059рН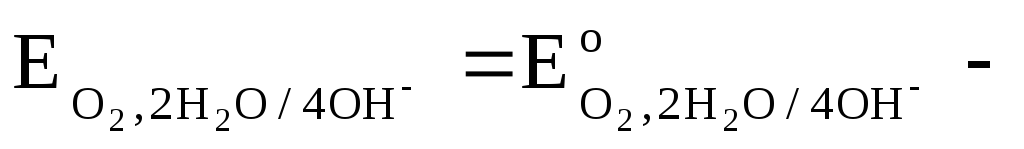 -0,059рН
+0,147
-0,059рН
+0,147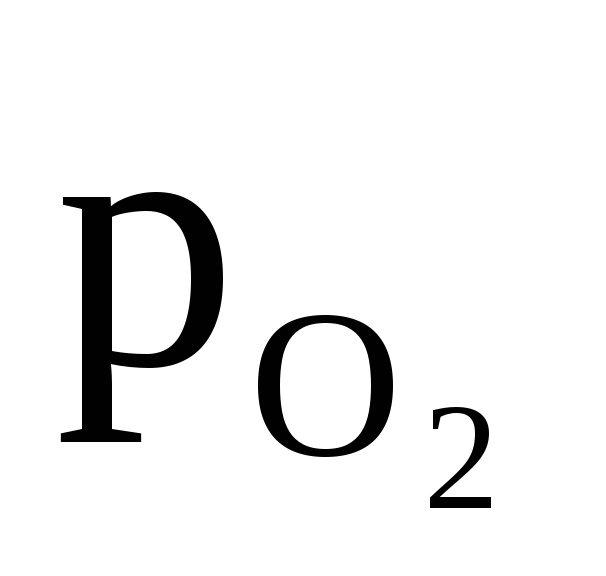 +0,828
+0,828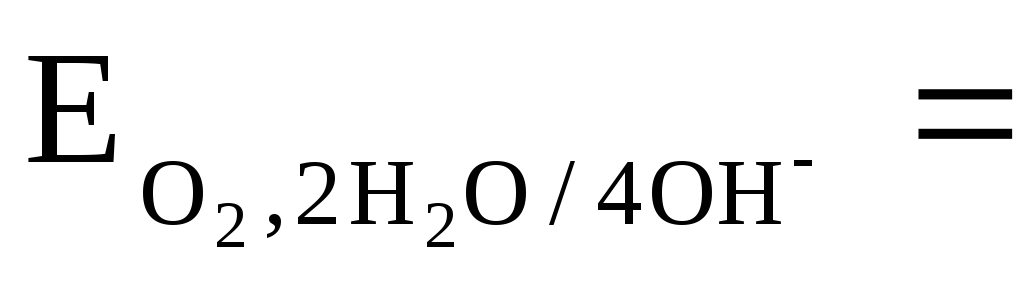 0,401-
0,059рН + 0,828 =
0,401-
0,059рН + 0,828 =