|
Вопрос |
Комментарий |
|
А1. Как изменяются металлические свойства в следующем ряду элементов Be,Mg,Ca,Sr,Ba? 1. не изменяются 2. усиливаются 3. ослабевают 4. изменяются периодически |
Все это элементы главной подгруппы II группы периодической системы Д.И. Менделеева. По группе сверху вниз металлические свойства усиливаются.
Правильный ответ 2. |
|
А2. Какой из перечисленных металлов легче всего окисляется на воздухе? 1. алюминий 2. магний 3 натрий 4. берилий |
Активность металлов главных подгрупп увеличивается влево и вниз по периодической системе. Поэтому среди представленных металлов легче всего будет окисляться на воздухе натрий. Правильный ответ 3. |
|
А3. В каком соединении марганец проявляет степень окисления +6? 1. HMnO4 2. Mn2O3 3. KMnO4 4. Na2MnO4 |
Определяем степень окисления марганца в каждом веществе, зная, что О-2, а Н+1, и степень окисления щелочных металлов +1.Сумма всех степеней окисления в молекуле должна быть равна 0. Правильный ответ 4. |
|
А4. Восстановительными свойствами обладает: 1. Fe3+ 2. Cu2+ 3. Na 4. Na+ |
Восстановительными свойствами обладает металлический натрий.
Правильный ответ 3. |
|
А5. В какой из приведенных пар оба гидроксида амфотерны? 1. Al(OH)3и Ba(OH)2 2. Al(OH) 3. Al(OH)3и NaOH 4. Ca(OH)2и Zn(OH)2 |
Амфотерные гидроксиды образуют Be, Zn, Al, Cr3+, Fe. Поэтому среди приведенных вариантов оба гидроксиды амфотерные Al(OH)3 и Zn(OH)2.
Правильный ответ 2. |
|
А6. Какие гидроксиды соответсвуют оксидам Li2O и Cr2O3? 1. LiOH, HCrO4 2. LiOH, Cr(OH)2 3. HLiO, Cr(OH) 4. LiOH, Cr(OH)3 |
В гидроксиде и в оксиде степени окисления должны быть равны.
Правильный ответ 4. |
|
А7. В какой паре оксиды марганца являются соответственно основным и кислотным? 1. MnO и Mn2O7 2. MnO и MnO3 3. MnO2 и MnO3 4. MnO3 и Mn2O7 |
Степени окисления +1, +2, +3 – оксиды проявляют основные свойства. Степени окисления +6 и +7 – это кислотные оксиды. Эти требования совпадают в первой строчке.
Правильный ответ 1. |
|
А8. Составьте уравнение реакции алюминия с соляной кислотой. Найдите сумму коэффициентов перед формулами всех электролитов. 1. 6 2. 8 3. 10 4. 13 |
2Al + 6HCl → 2AlCl3 + 3H2↑ Электролиты – это 6HCl → 2AlCl3, и сумма коэффициентов равна 8.
|
|
А9. Реакция между какими веществами соответсвует следующему сокращенному ионному уравнениюCu2+ + Zn→ Zn2+ +Cu? 1. Cu и раствор ZnCl2 2. Cu(OH)2 и Zn 3. Zn и раствор CuCl2 4. CuO и Zn |
В виде ионов могут присутствовать только растворимые соединения. Нужно найти растворимое соединение меди (II).
Правильный ответ 3. |
|
1. при взаимодействии натрия с водой 2. при электролизе водного раствора хлорида натрия 3. при взаимодействии пероксида натрия с водой 4. при взаимодействии растворов нитрата натрия и гидрокида калия |
В варианте №4 обменная реакция не произойдет.
Правильный ответ 4. |
|
А11. Что усиливает коррозию металлических деталей, находящихся в воде? 1. добавление в воду ингибитора коррозии 2. применение деталей заклепок из более активного металла 3. применение деталей заклепок из менее активного металла 4. окрашивание деталей |
Более активный металл уменьшает коррозию металла защищаемого. Поэтому если использовать применение деталей заклепок из менее активного металла, то коррозия основного металла усилится.
Правильный ответ 3. |
|
А12. Каким способом нельзя устранить временную жесткость воды? 1. добавлением питьевой соды 2. кипячением 4. добавлением кальцинированной соды |
В трех полследних пунктах жесткость воды уменьшится, так как образуется осадок CaCO3↓. При добавлении питьевой соды ничего не изменится.
Правильный ответ 1. |
|
А 13. Какой восстановитель не используется в металлургическом производстве? 1. оксид углерода (II) 2. водород 3. электрический ток 4. медь |
Медь – это малоактивный металл. Она не может использоваться восстановителем в металлургическом производстве.
Правильный ответ 4. |
|
А14. Конечным продуктом в цепочке превращений на основе соединений натрия Na 1. Натрий 2. Карбонат натрия 3. Гидроксид натрия 4. Гидрокарбонат натрия |
2Na +2 H2O → 2NaOH + H2↑ NaOH + CO2 → NaHCO3 2NaHCO3
Правильный ответ 2. |
|
А15. При электролизе раствора хлорида калия на катоде происходит: 1. Восстановление воды 2. Окисление воды 3. Восстановление ионов калия 4. Окисление хлора |
На катоде происходит восстановление,поэтому 2 и 4 вариант исключаем. При электролизе водных растворов солей калия (активный металл) сначала происходит электролиз воды. Правильный ответ 1. |
|
А16. При электролизе раствора нитрата серебра на катоде выделяется 1. Серебро 2. Водород 3. Серебро и водород 4. Кислород и водород |
Серебро находится правее водорода в электрохимическом ряду напряжений металлов. Значит, на катоде будет выделяться только серебро.
Правильный ответ 1. |
Электролиз водных растворов с получением металлов
В металлургии электролиз применяют для полученпя и очистки металлов. Например, электролизом водных растворов солей получают цинк, кадмий, марганец, никель, олово, железо. Этот метод широко используют для получения металлов высокой степени чистоты путем электролитической очистки технических металлов. Электролизом расплавов соединений получают алюминий, магний, натрий, кальций и другие металлы. [c.215]Марганец получают электролизом водного раствора сульфата марганца (П) с инертными электродами. Определите массу марганца, который будет получен, если на аноде выделится кислород объемом 56 л (нор—мальные условия). Учтите, что массовая доля выхода кислорода составляет 100%, а металла —80%. [c.116]
Электролиз водных растворов — важная отрасль металлургии тяжелых цветных металлов меди,висмута, сурьмы,олова, свинца, никеля, кобальта, кадмия, цинка. Он применяется также для получения благородных и рассеянных металлов, марганца и хрома. Электролиз используют непосредственно для катодного выделения металла после того, как он был переведен из руды в раствор, а раствор подвергнут очистке. Такой процесс называют электроэкстракцией. Электролиз применяется также для очистки металла — электролитического рафинирования. Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Рафинирование и электроэкстракцию проводят с жидкими электродами из ртути и амальгам (амальгамная металлургия) и с электродами из твердых металлов. К электролитическим способам получения металлов относят также цементацию — восстановление ионов металла другим более электроотрицательным металлом. Цементация основана на тех же принципах, что и электрохимическая коррозия при наличии локальных элементов. Выделение металлов осуществляют иногда восстановлением их водородом, которое также может включать электрохимические стадии ионизации водорода и осаждение ионов металла за счет освобождающихся при этом электронов. [c.227]
На электролизе водных растворов солей основано также и электроосаждение — выделение металла на катоде в виде плотного или порошкообразного осадка. Этот метод служит для получения гальванических покрытий, копий и матриц — в первом случае, или при извлечении, очистке и разделении металлов с получением металлических порошков — во втором случае. [c.251]
Для получения чистого никеля применяют метод электролиза водного раствора сульфата никеля (П) с инертными электродами. Б процессе электролиза на аноде был собран кислород объемом 8,96 (условия нормальные, массовая доля выхода 100%). Рассчитайте массу никеля, который образуется на катоде, если массовая доля выхода металла равна 75%. [c.118]
Курс Технология электрохимических производств , читаемый на соответствующих кафедрах технологических, химико-технологических и политехнических вузов, включает ряд разделов, в которых рассматриваются процессы электролиза водных растворов без выделения и с выделением металлов, электрохимического синтеза неорганических и органических веществ, электролиза расплавов, а также основы производства источников электрической энергии. Естественно, что подробное изложение этих вопросов в книге ограниченного объема невозможно, да и не требуется по учебному плану. Задачей курса является общее ознакомление студентов с процессами превращения химической энергии в электрическую (в производстве химических источников тока) и с возможными путями использования электролиза для получения различных продуктов. [c.7]
Важным направлением электролиза водных растворов с осаждением металлов является гальванотехника. В гальванотехнике получили широкое распространение такие способы покрытия, как никелирование, хромирование, цинкование, лужение, серебрение, золочение и др. Видом гальванотехники является гальванопластика (Б. С. Якоби) — получение металлических копий различных пред-м(>тов (художественных изделий) электроосаждением металла, типографских клише, печатных схем в радиотехнике и т. д. [c.165]
Электролиз расплавленных сред используют для получения ряда металлов, сплавов и других соединений, которые другими методами получить невозможно или экономически невыгодно. К примеру, щелочные и щелочноземельные металлы, такие как натрий, калий, кальций, магний, ряд тугоплавких и редких металлов, а также фтор получают электролизом расплавленных сред, поскольку электролизом водных растворов их получить практически невозможно из-за высокой реакционной способности (фтор, щелочные металлы) и протекании на электродах, в основном, процессов выделения водорода (на катоде) или кислорода (на аноде). [c.202]
В данной книге мы не можем охватить все области применения электрохимических технологий в народном хозяйстве страны, поэтому рассмотрим лишь основные электрохимические способы получения неорганических соединений, газов и металлов электролизом водных растворов, ряда металлов и фтора — электролизом расплавленных сред, некоторые химические источники тока. [c.5]
Газообразный хлор, получаемый электролизом водных растворов щелочных металлов, должен содержать не менее 96% хлора и не более 2% СО2 и 1% На- Хлор, полученный методом электролиза с диафрагмой, должен содержать не более 0,5% Hj. Содержание влаги после осушки не должно превышать 0,04 вес. %. [c.29]
Электролизом (электрометаллургия) получают щелочные металлы, алюминий,, бериллий. Электролит не должен содержать ионов водорода, потому что во время электролиза водных растворов их солей на катоде выделяется не металл, а водород (почему ). В электролите не должно быть ионов металлов, выделяющихся при электролизе на катоде, так как они загрязняют получаемый металл. Чтобы выполнить эти условия в электролизные ванны загружают очищенные вещества, получение которых есть стадия технологического процесса. [c.144]
Электролиз водных растворов щелочных металлов без разделения электродных пространств можно проводить в таких условиях, чтобы газообразный хлор практически не выделялся. Если обеспечить достаточно интенсивное перемещивание слоев электролита, прилегающих к аноду и катоду, то выделяющийся на аноде хлор будет растворяться в электролите и подвергаться гидролизу. Начнется взаимодействие хлора с полученной на катоде щелочью с образованием раствора гипохлорита натрия I2 + Н2О НСЮ + H I (1-11) [c.14]
Электролиз растворов электролитов проводить легче, чем электролиз их расплавов, так как электролиты — соли и щелочи — плавятся при очень высоких температурах. Но не всякий элемент может быть получен в свободном
1.4.9 Электролиз расплавов и растворов (солей, щелочей, кислот)
Видеоурок 1: Электролиз солей
Видеоурок 2: Электролиз кислот и щелочей
Лекция: Электролиз расплавов и растворов (солей, щелочей, кислот)
 Электролиз расплавов и растворов
Электролиз расплавов и растворов
Сегодня речь пойдет об окислительно – восстановительных процессах, происходящих в расплавах и растворах, мы поговорим об электролизе. Для начала скажем, что такое расплав и раствор.
Расплав – это жидкое состояние вещества, промежуточное между плавлением и кипением.
Как вы понимаете этот процесс происходит под воздействием температуры и при нормальных условиях расплавы в основном являются твердыми веществами.
Раствор – это гомогенная смесь частиц растворителя, растворенного вещества и продуктов их взаимодействия.
Растворителем может быть жидкое вещество, самое распространенное – это вода, а также твердое или газообразное вещества.
Теперь об электролизе, что в дословном переводе означает разложение электрическим током.
Электролиз — окислительно-восстановительный процесс в расплавах или растворах электролита, протекающий на электродах под воздействием постоянного электрического тока.
Данный процесс лежит в основе электрохимии, разделе химии, изучающем электрохимические процессы в растворах и расплавах веществ. С помощью электролиза получают неорганические и органические вещества, металлы и их сплавы, обрабатываются и очищаются поверхности металлов и пр. Только с помощью электролиза получают чистый водород, никель, натрий и др. Да и вообще если необходимо получить любой металл в чистом виде применяют электролиз.
 Вы понимаете, что протекать электролиз может только в средах, проводящих ток, преимущественно это растворы солей, щелочей и кислот. Для проведения электролиза нужен любой источник постоянного электрического тока, имеющий положительный и отрицательный полюса. К нему подсоединяются два электрода: катод и анод. Далее эти электроды опускаются в раствор или расплав для проведения электролиза. Мы представили прибор, в котором осуществляется электролиз. Это электролизер.
Вы понимаете, что протекать электролиз может только в средах, проводящих ток, преимущественно это растворы солей, щелочей и кислот. Для проведения электролиза нужен любой источник постоянного электрического тока, имеющий положительный и отрицательный полюса. К нему подсоединяются два электрода: катод и анод. Далее эти электроды опускаются в раствор или расплав для проведения электролиза. Мы представили прибор, в котором осуществляется электролиз. Это электролизер.
Анод (А+) — положительный электрод, к нему перемещаются анионы. Они отдают свои электроны аноду, и вследствие чего постепенно разряжаются. Образуется процесс окисления.
 Характерные особенности электролиза расплавов
Характерные особенности электролиза расплавов
Соли и щелочи при расплавлении распадаются на ионы, которые во время электролиза направленно движутся: катионы восстанавливаются на катоде, анионы окисляются на аноде. Рассмотрим пример электролиза расплава хлорида натрия NaCl, который распадается на ионы: катионы Na+ и анионы Сl¯. В результате катионы движутся к катоду и принимают от него электроны, а анионы движутся к аноду и отдают электроны.
Схематически этот процесс выглядит так:
| Катод ← Na+ | Сl– → Анод |
| Na+ + 1ē → Na° | 2Сl– – 2 ē → Сl2 |
| Восстановление | Окисление |
В сумме мы получим:
Ионное уравнение: 2Na+ + 2С1¯ → 2Na° + С12°Молекулярное уравнение: 2NaCl → 2Na° + Сl2º
 Закономерности электролиза растворов
Закономерности электролиза растворов
Электролиз раствора имеет отличие от электролиза расплавов, тем, что в нем процессы проходят несколько сложнее. Это обуславливается тем, что в электролизе раствора принимает участие вода. Молекула воды представляет собой диполь, то есть она имеет оба «+» и «-» полюса. Поэтому молекулы воды перемещаются и к катоду и к аноду.
В результате мы получим на катоде: 2H2O + 2ē → 2OH− + H2;
на аноде: 2H2O − 4ē → O2 + 4H+.
Это значит, что при электролизе раствора молекулы воды состязаются за восстановление на катоде и окисление на аноде с катионами и анионами, образующимися при диссоциации электролита. Результат данного процесса будет зависеть от типа электролита.
Рассмотрим процессы, происходящие на катоде:
Процессы на катоде не зависят от материала катода, а зависят только от типа катиона.
- Если катион соли является активным металлом, находящийся в ряду напряжений металлов до алюминия включительно, то на катоде мы увидим восстановление молекул воды с выделением водорода: 2H2O + 2ē → 2OH− + H2;
- Если катион соли является металлом средней активности, находящийся в ряду активности от алюминия до водорода, то на катоде будут одновременно восстанавливаться и молекулы воды и катионы металла: 2H2O + 2ē → 2OH− + H2; Men+ + ne → Me0;
- Если в электролите есть катион водорода (кислота) или катион малоактивного металла (соль), то восстанавливаться будут только катионы электролита, в случае кислоты: Men+ + ne → Me0.
Рассмотрим процессы, происходящие на аноде:
Процессы на аноде зависят и от материала анода, и от аниона.
Если анод растворимый (материал анода железо, медь, серебро, цинк и все металлы, которые окисляются в процесе электролиза), то независимо отаниона окисляется материал анода: Cu0 – 2e → Cu2+
Если анод нерастворимый, т.е. инертный (уголь, графит, золото, платина), то
- При электролизе растворов солей бескислородных кислот (за исключением F−), то на аноде идет процесс окисления аниона. К примеру: S2- − 2e → S0;
- При электролизе растворов щелочей, то на аноде окисляются гидроксо группы: 4ОН− − 4ē → 2H2O + O2;
- При электролизе растворов солей оксокислот и фторидов, за исключением органических кислот, то окисляются молекулы воды и выделяется кислород: 2H2O − 4ē → O2 + 4H+.
Пример схемы электролиза раствора сульфата калия K2SO4 с инертным анадом*:
| Катод ← 4K+ | 2SO42- → Анод |
| 4K+ | 2SO42- |
| 4Н2О + 4ē → 4ОН— + 4Н | 2Н2О → 4Н+ + 2О + 4ē |
| Восстановление | Окисление |
В данном случае идет электролиз воды, на катоде выделился водород, на аноде кислород: 2H2O → 2H2 ↑+ O2↑
* Инертный электрод (графит или платина) используется, когда необходимо установить простой электрический контакт с раствором и не возникало никаких дополнительных реакций с участием самого вещества электрода.
Электролиз. Электролиз растворов. Электролиз расплавов
Электролиз — это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз — это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать — рассказано дальше) и, конечно, электролит. Электролит — это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие — в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно — анод. Электрод, заряженный отрицательно — катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину.
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
В домашних условиях, из тех веществ, что имеются практически у каждого, можно без труда получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щёлочь! Но будьте осторожны с хлором — этот газ ядовит!
Первый опыт проведём с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (можно взять кальцинированную соду), опустите туда электроды и включите источник питания. Как только ток пойдёт через раствор, сразу станут заметны пузырьки газа, которые образуются у электродов: у «+» будет выделяться кислород, у «-» водород. Именно такое распределение газов происходит из-за того, что возле анода «+» происходит скопление отрицательных ионов OH—, и восстановление кислорода, а возле катода «-» скапливаются ионы щелочного металла, которые содержатся в кальцинированной соде (Na2CO3), имеющие положительный заряд (Na+) и одновременно происходит восстановление водорода. Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Li <K <Rb <Cs <Ba <Ca <Na <Mg <Al <Mn <Cr <Zn <Fe <Cd <Co <Ni <Sn <Pb <h3 <Cu <Ag <Hg <Pt <Au
В следующем опыте по электролизу будем получать чистую медь (Cu).
Для этого нам потребуется раствор медного купороса CuSO4, который содержит растворённую медь. Медь стоит в ряду напряжений металлов после водорода, поэтому она и будет выделятся на электроде. Приготовьте раствор медного купороса, опустите в него электроды и включите источник питания. Как и в предыдущем опыте с раствором кальцинированной соды, на адоде «+» будет восстанавливаться кислород. В то же время катод «-» будет покрываться тёмно-красным слоем меди, которая восстанавливается из раствора до чистого металла.
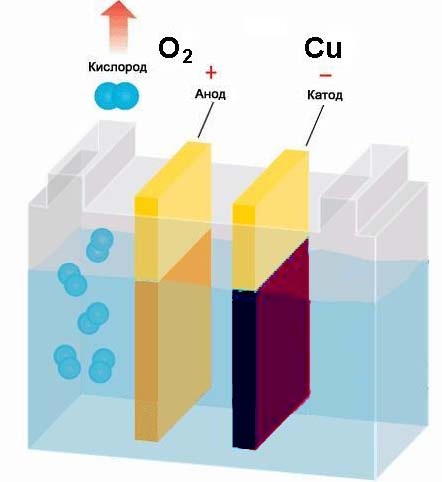
Мы провели 2 опыта по электролизу растворов и можем подвести результат: При пропускании тока через раствор на положительном электроде — аноде — восстанавливаются отрицательно заряженные ионы (в нашем случае — кислород). Отрицательно заряженные ионы ещё называют анионами. На отрицательном электроде — катоде — восстанавливаются положительные ионы (в нашем случае это водород и медь). Положительные ионы называют катионами. Катионами обычно выступают все металлы и водород. Но в некоторых химических соединениях катионами являются газы и неметаллы. Это зависит от степени окисления элемента в химическом соединении.
Проведём ещё один опыт по электролизу. На этот раз мы будем пропускать ток через раствор поваренной соли (NaCl).
Но должен заранее предупредить, этот электролиз нужно проводить в хорошо проветриваемой комнате, так как выделяемый из раствора чистый газ — хлор (Cl2) очень токсичен. Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:

Электролиз раствора поваренной соли. Схема сбора газа
Итак, начнём. Приготовьте раствор поваренной соли (NaCl). К положительному полюсу источника питания подключите инертный электрод (например — графитовый стержень), к отрицательному — подойдёт любой материал, проводящий ток. Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода («+»). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте «нюхать»его в банке — можно сильно отравится! (Статья о хлоре). На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H2) и восстанавливаться натрий, который будет тут же вступать в реакцию с водой, образуя натриевую щёлочь.
Электролиз расплавов
При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ — хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл — натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы. Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Выделение металла на электродах при электролизе раствора его соли | Задачи 692
Задача 692.
В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди?
Решение:
Стандартные электродные потенциалы систем:
Следовательно, 02 >03 > 01. Поэтому сначала будет выделяться серебро, затем, медь и только после этого никель.
Ответ: Ag, Cu, Ni.
Задача 693.
Раствор содержит ионы Fe2+, Ag+, Bi3+, Pb2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла?
Решение:
Следовательно, 02 > 03 > 04 > 01. Поэтому сначала будут выделяться ионы серебра, за-тем, висмута, свинца и только после этого железа.
Ответ: Ag+, Bi3+, Pb2+, Fe2+.
Задача 694.
Составить схему процессов, происходящих на медных электродах при электролизе водного раствора КNO3.
Решение:
2H2O — 4 ⇔ O2↑ + 4Н+; 04 = 1,228B.
Так как значение электродного потенциала системы K+ — 2 ⇔ K0 (-2,924В) значительно ниже, чем потенциал водородного электрода в нейтральной среде 2H2O + 2 ⇔ H2↑ + 2ОH— (-0,41В), а значение электродного потенциала меди намного выше значений потенциалов калия и воды, то на катоде будет наблюдаться восстановление ионов меди:
Cu2+ + 2 ⇔ Cu0.
Ионы меди будут приходить к катоду от анода, а ионы калия будут накапливаться в катодном пространстве.
На аноде будет происходить электрохимическое окисление меди, так как электродный потенциал системы
Cu0 — 2 ⇔ Cu2+ (+0,337В) значительно ниже электродного потенциала системы
2H2O — 4 ⇔ O2↑ + 4Н+ (+1,228В):
Cu0 — 2 ⇔ Cu2+.
Медь – материал анода будет растворяться, и накапливаться вместе с приходящими к аноду нитрат-ионами.
Таким образом, при электролизе раствора нитрата калия на медных электродах происходит растворение медного анода и осаждение чистой меди на медном катоде. Ионы калия и нитрат-ионы в процессе электролиза не участвуют, а являются средой для проведения электролиза и остаются в растворе. Следовательно, энергия электрического тока при этом электролизе расходуется на перенос меди с анода на катод. Данный процесс можно использовать для рафинирования меди очистка её от примесей. Медные пластины соединяют с источником постоянного тока таким образом, чтобы очищения медь была катодом, а неочищенная медь – анодом.
Задача 695.
Имеется раствор, содержащий КСI и Сu(NO3)2. Предложить наиболее простой способ получения практически чистого KNO3.
Решение:
Для получения практически чистого KNO3 из смеси КСI и Сu(NO3)2 можно предложить электрохимический метод, основанный на проведении электролиза данной смеси. Стандартный электродный потенциал системы
Cu2+ + 2 ⇔Cu0 (+0,34В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В) и системы K+ + 1 ⇔ K0 (-2,924В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
Cu0 — 2 ⇔ Cu2+.
Ионы калия будут накапливаться в катодном пространстве.
На аноде будет происходить электрохимическое окисление ионов хлора Cl—, не смотря на то, что стандартный электродный потенциал системы Cl— — 2 ⇔ Cl* (1,359В) менее положителен, чем системы:
2H2O — 4 ⇔O2↑ + 4Н+ (1,228В):
2Cl— — 2 ⇔ 2Cl*; Cl + Cl* =Cl2.
Нитрат-ионы будут накапливаться в анодном пространстве. Сложив уравнения катодного и анодного процессов, получим суммарное уравнение электролиза:
Cu2+ + 2Cl— ⇔ Cu0 + Cl2↑
катод анод
Ионно-молекулярная форма процесса:
Cu(NO3)2 + 2KCl ⇔ Cu + 2K+ + Cl2↑ + 2NO3—
у катода у анода
Молекулярная форма процесса:
Cu(NO3)2 + 2KCl ⇔Cu + Cl2↑ + 2КNO3
Таким образом, при электролизе смеси КСI и Сu(NO3)2 на катоде выделяется металлическая медь, а на аноде – газообразный хлор. Оставшиеся ионы калия и нитрат-ионы можно выделить в виде чистой кристаллической соли KNO3 методом выпаривания из раствора после проведения электролиза смеси солей.




 X1
X1 Х2
Х2
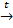 Na2CO3 + H2O+ CO2↑
Na2CO3 + H2O+ CO2↑