5.Биосинтез антибиотиков, его регуляция.
Развитие м/о продуцента антибиотиков имеют 2х фазный характер: 1)трофофаза или фаза сбалансированного роста характеризуется тем, что в культуре продуцента происходит быстрое накопление биомассы, сопряженное с интенсивным потреблением компонентов субстрата – углерода, азота, фосфора, некоторые сниженные рН среды. Биосинтез не осуществляется в эту фазу. 2)идиофаза – фаза несбалансированного роста, характеризуется снижением общего кол-ва биомассы вследствие автолиза части клеток. Среда обогащена продуктами обмена автолиза, возрастает значение рН, синтезируются антибиотики. Принцип 2х фазности развития м/о продуцента антибиотика характерен для организмов, развивающихся в периодической культуре при использовании в качестве посевного материала молодые культуры или споры. У многих м/о продуктивность снижается в присутствии избытка углерода, особенно глюкозы – накопленным катоболитным репрессором, поэтому источник углерода необходимо добавлять в среду небольшими порциями, другой способ получения мутантов устойчив к катоболитной репрессии. Во многих случаях источник азота – фосфор. Также могут снизить образование антибиотиков, поскольку фосфат ингибирует транскрипцию некоторых генов синтеза антиб, поэтому необходимо контролировать концентрацию в течение всей ферментации или получать мутанты менее чувствительные к этим регуляторам процесса. Сами антиб как конечный продукт могут осуществлять регуляцию своего синтеза при помощи обратной связи. Данный способ позволяет контролировать процесс образования антиб, т.е стимулировать выделение в окружающую среду и т.о снижать его концентрацию в клетке (метод проницаемости мемраны). Поскольку антиб вторичные метаболиты, они синтезируются из первичных, поэтому необх наличие предшественников. У грибов р.пеницилиум аминоадипиновая к-та является предшественником биосинтеза лизина и пенициллина. Поскольку лизин явл конечным продуктом он ингибирует первый фермент своего синтеза, что сопровождается снижению кол-ва всех промежуточных продуктов, в том числе и адипиновой к-ты, след-но синтез пенициллина снижается. При внесении адипиновой к-ты в проц ферментации ингибирующий эффект лизина снижается и наоборот. Если высокое содерж лизина, в среде наблюдается ингибир пенициллин. Наряду с аминоадипиновой к-ой продуцент пенициллина мецифалоспарина нуждается в цистеине и валине. М/о культивируют глубинным способом в условиях аэрации и ист питания. Механизмы устойчивости к собств антиб связаны с инактивацией их в клетке, либо выделение их в окружающую среду, кроме того устойчивость обусловлена модификацией на генном уровне.
6.Механизмы биологического действия антибиотиков.
По механизму действия антиб делят на следующие группы: 1)антиб, обладающие конкурентным действием в процессе метаболизма (пурамицин). 2)ингибирующие синтез клеточной стенки (пенициллины, цифалоспорины). 3)нарушающие ф-ии мембраны (грамицедин, трихомицин). 4)подавляющие синтез нуклеиновых к-т: а)синтез РНК (новобиоцин, неолицин), б)синтез ДНК (актиномицин, митомицин). 5)ингибиторы синтетических пуринов и перимединов (азосерин). 6)подавляет синтез белка (тетрациклин, хлоранфеникол). 7)ингибиторы дыхания (амномицин). 8)ингибиторы окислительного фосфорилирования (грамицидины). 9)обладают антиметаболитными сойствами (50 антиб, в их числе циклосирин). Антибиотики – это специфичный продукт жизнедеятельности организмов или их модификации, обладающие высокой физиологической активностью по отношению к определенным группам м/о (бактреии, грибы, микроводоросли, протозола), также к вирусам или к злокачественным опухолям, задерживая их рост или полностью подавляя их развитие. Спецефичность антибиотиков: 1)обладают высокой биологической активностью. 2)избирательностью биологического действия. Делят на 2 группы: 1)антиб узкого спектра действия (бензил пенициллин, новобиацин, гризиофульфин и т.д). 2)широкого спектра действия (тетрациклин, хлоранфеникол). Антиб могут накапливаться в клетке, могут выделятся во внешнюю среду, а могут то и др. Антиб – это конечный продукт метаболизма. Определенный м/о может синтезировать один или несколько антибиотиков. Антиб выступают в качестве фактора антоганизма, также выполняют функцию регуляторов ферментных систем. Ок 6 тыс антибиотических веществ природных и синтетических.
6. Сравните кривые роста микроорганизмов при получении первичных и вторичных метаболитов в биотехнологическом производстве. Ответ
Рост бактерий – это деление клетки на две дочерние, генетически полностью идентичные исходной материнской клетке. В оптимальных условиях популяция бактерий удваивается каждые 9,8 мин. В среднем рост популяции бактерий описывается экспоненциальным законом.
Рост микроорганизмов-продуцентов (зависимость логарифма числа клеток от времени) имеет вид S – образной кривой. Выделяют четыре фазы роста – 1 – lag-фаза, 2 – фаза экспоненциального роста или log-фаза, 3 – стационарная фаза, 4 – фаза отмирания. Во время 1-ой lag-фазы (привыкание) бактерии адаптируются к новым условиям, идет синтез РНК, ферментов и других биологически важных соединений. 2-я фаза — экспоненциальная фаза – период удвоения клеток, зависимость логарифма числа клеток от времени представляет собой прямую. Очевидно, что рост микроорганизмов не может продолжаться бесконечно из-за истощения питательной среды и накопления токсичных продуктов метаболизма. В период 3-ей, стационарной фазы, скорости роста и отмирания клеток выравниваются, и число клеток остается постоянным. Последняя фаза 4-ая – фаза отмирания — уменьшение числа клеток за счет истощения питательной среды.
Метаболиты, обычно малые молекулы — это промежуточные соединения или продукты метаболизма. Различают первичные и вторичные метаболиты. Первичные метаболиты (аминокислоты, нуклеотиды) непосредственно вовлечены в процессы роста и развития клеток. Вторичные метаболиты (антибиотики, алкалоиды, стероиды, пигменты) не являются необходимыми для роста клеток.
В отличие от синтеза первичного метаболита, который происходит одновременно с ростом и размножением культуры, для продуцента вторичных метаболитов принято говорить о трофофазе (когда культура растет и размножается) и идиофазе (когда рост замедляется или останавливается и начинается синтез продукта). Механизмы переключения путей метаболизма с первичного на вторичный не ясны.
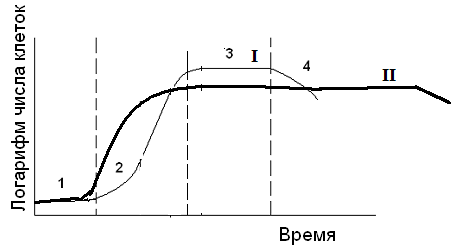
Рис. 1. Сравнительная характеристика кривых роста микроорганизмов.
I — кривая роста микроорганизмов при получении первичных метаболитов: 1 – lag-фаза, 2 – фаза экспоненциального роста или log-фаза, 3 – стационарная фаза, 4 – фаза отмирания. II – кривая роста микроорганизмов при получении вторичных метаболитов (более короткая фаза роста и более длительная стационарная фаза).
Микроорганизмы,
производящие вторичные метаболиты,
вначале проходят стадию быстрого роста,
трофофазу, во время которой синтез
вторичных метаболитов незначителен.
По мере замедления роста из-за истощения
одного или нескольких необходимых
питательных веществ в культуральной
среде микроорганизм переходит в идиофазу;
именно в этот период синтезируются
идиолиты (вторичные метаболиты).

Рис. 2. Особенности ферментационного процесса при получении антибиотиков:
1 – трофофаза, II – идиофаза, 1 – биомасса клеток, 2 – антибиотик, 3 – углеводы, 4 – источники азота.
Особенности культурального роста микроорганизмов-продуцентов необходимо учитывать при производстве. Например, в случае антибиотиков большинство микроорганизмов в процессе трофофазы чувствительно к собственным антибиотикам, однако во время идиофазы они становятся к ним устойчивыми.
Чтобы уберечь микроорганизмы, продуцирующие антибиотики, от самоуничтожения, важно быстро достичь идиофазы и затем культивировать микроорганизмы в этой фазе. Это достигается путем варьирования режимов культивирования и составом питательной среды на стадиях быстрого и медленного роста.
5.6 кривые роста
Рост микроорганизмов можно охарактеризовать как S — образную кривую. Первая стадия — стадия быстрого роста, или логарифмическая, для которой характерен синтез первичных метаболитов. Далее наступает фаза медленного роста, когда увеличение биомассы клеток резко замедляется. Микроорганизмы, производящие вторичные метаболиты, вначале проходят стадию быстрого роста, трофофазу, во время которой синтез вторичных веществ незначителен. По мере замедления роста из-за истощения одного или нескольких необходимых питательных веществ в культуральной среде микроорганизм переходит в идиофазу; именно в этот период синтезируются идиолиты. Идиолиты, или вторичные метаболиты, не играют явной роли в процессах метаболизма, они вырабатываются клетками для адаптации к условиям окружающей среды, например, для защиты. Их синтезируют не все микроорганизмы, а в основном нитчатые бактерии, грибы и спорообразующие бактерии. Таким образом, продуценты первичных и вторичных метаболитов относятся к разным таксономическим группам.
Кривая накопления биомассы обычно совпадает с кривой накопления первичных метаболитов и не совпадает с кривой накопления метаболитов вторичных. В частности это относится к таким вторичным метаболитам, как антибиотики, которые наиболее быстро накапливаются в среде именно тогда, когда биомасса почти не возрастает.

Рис.1. Сравнительная характеристика кривых роста микроорганизмов.
1-индукционный период; 2- фаза экспоненциального роста; 3- фаза линейного роста; 4- фаза замедления роста; 5- стационарная фаза; 6-фаза отмирания культуры.
I кривая роста микроорганизмов при получении первичных метаболитов,
II – кривая роста микроорганизмов при получении вторичных метаболитов.

Рис. 2. Особенности ферментационного процесса при получении антибиотиков:
1 – трофофаза, II – идиофаза, 1 – биомасса клеток, 2 – антибиотик, 3 – углеводы, 4 – источники азота.
Особенности культурального роста этих микроорганизмов необходимо учитывать при производстве. Например, в случае антибиотиков большинство микроорганизмов в процессе трофофазы чувствительно к собственным антибиотикам, однако во время идиофазы они становятся к ним устойчивыми.
Чтобы уберечь микроорганизмы, продуцирующие антибиотики, от самоуничтожения, важно быстро достичь идиофазы и затем культивировать микроорганизмы в этой фазе. Это достигается путем варьирования режимов культивирования и составом питательной среды на стадиях быстрого и медленного роста.
Получение антибиотиков » СтудИзба
Лекция № 3
Тема: Получение антибиотиков
План:
1. Общая характеристика вторичных метаболитов, в т.ч. антибиотиков.
2. Характеристика химического синтеза и мутационного биосинтеза антибиотиков.
3. Современное промышленное получение антибиотиков — технология микробного биосинтеза.
Ключевые слова: идиолиты, идиофаза, тропофаза.
Спектр продуктов, образующихся методами биотехнологии необычайно широк и разнообразен. Ими являются природные макромолекулы – белки, ферменты, полисахариды, полиэфиры (поли-β-гидроксибутират), выделенные из клеток микроорганизмов, тканей и органов растений и животных. По отношению к процессу роста низкомолекулярные продукты метаболизма живых клеток делятся на первичные и вторичные метаболиты. Первичные метаболиты необходимы для роста клеток. К ним относятся структурные единицы биополимеров – аминокислоты, нуклеотиды, моносахариды, а также витамины, коферменты, органические кислоты и другие соединения. Вторичные метаболиты – антибиотики, пигменты, токсины – низкомолекулярные соединения, не требующиеся для выживания клеток и образующиеся по завершении фазы их роста, т.е. идиофазы, поэтому их еще называют идиолитами. Среди вторичных метаболитов ведущее место по объему производства занимают антибиотики.
В мире ежегодно производится антибиотиков почти на 20 млрд долларов. По оценкам ВОЗ, каждый год ученые обнаруживают от 100 до 200 новых антибиотиков в рамках исследовательских программ по поиску среди тысяч различных микроорганизмов таких, которые синтезировали бы уникальные антибиотики. Однако, получение, лабораторные и клинические испытания новых лекарственных средств обходятся дорого, поэтому до применения доходят только те из них, которые имеют большую терапевтическую ценность и представляют экономический интерес. Это всего лишь 1-2% от всех обнаруживаемых антибиотиков.
Обычно антибиотик действует не на все микроорганизмы подряд, да это и нежелательно, поскольку могут уничтожиться и полезные микроорганизмы человеческого организма. Поэтому должен быть набор различных антибиотиков для лечения разных болезней. Есть и другое обоснование – возбудители болезней постепенно «привыкают» к действию антибиотиков, т.е. возникают виды бактерий, которые нечувствительны к старому антибиотику. Такое привыкание происходит не быстро, а в течение 10-15 лет. Поскольку есть такой феномен «привыкания» или резистентности, ученым необходимо искать новые антибиотики и продуцирующие их микроорганизмы.
Антибиотики продуцируются плесневыми грибами, актиномицетами, эубактериями и другими микроорганизмами. Некоторые из этих организмов способны продуцировать большое количество антибиотиков. Так, 6 родов филаментозных грибов производят около 1000 различных антибиотиков, в том числе пенициллин и цефалоспорин, а три рода актиномицетов – 3000 антибиотиков. Среди актиномицетов наибольший вклад вносит род Streptomyces, один из видов которого – S.griseus синтезирует более 50 антибиотиков.
Образование антибиотиков – это генетически закрепленная особенность метаболизма микроорганизмов, проявляющаяся в том, что каждый вид (или даже штамм) способен продуцировать один или несколько строго специфичных для него антибиотиков.
2. Химический синтез антибиотиков чрезвычайно сложный. Направленный биосинтез антибиотиков осуществляется путем прямой ферментации микроорганизма – продуцента с подходящим предшественником, что индуцирует синтез ферментов вторичного метаболизма в идиофазе. Точный механизм индуцирования первичными метаболитами генов, кодирующих синтез ферментов вторичного метаболизма, не расшифрован. Например, производство бензилпенициллина в значительной степени стимулируется добавками его метаболического предшественника – фенилуксусной кислоты; пропионовая кислота и пропиловый спирт инициируют биосинтез макролидов. Аналогичный эффект вызывает использование ингибиторов метаболизма. Например, при подавлении процесса введения хлора микроорганизм S. aureofaciensобразует тетрациклин, а не хлортетрациклин, а при ингибировании реакции метилирования им синтезируется деметилированное производное хлортетрациклина.
Другой способ получения антибиотиков состоит в использовании для их биосинтеза блокированных мутантов, у которых блокировано (отсутствует) определенное звено в цепи реакций, ведущих к синтезу антибиотика. Так, мутанты Nocardia mediterranei, у которых нарушена способность к ацилированию, образует аналог предшественника рифамицина – В-рифамицин, который служит исходным веществом для получения многих синтетических рифамицинов, используемых в лечении туберкулеза и проказы.
3. Современное промышленное получение антибиотиков – это сложная многоступенчатая биотехнологическая схема, состоящая из ряда последовательных стадий.
1) стадия биосинтеза антибиотика – основная биологическая стадия процесса. Процесс культивирования антибиотиков или идиолитов проходит две фазы (двуступенчатое культивирование). На первой фазе – трофофазе, происходит накопление достаточного количества биомассы, которая выращивается на среде для роста микроорганизма. Эта фаза должна быть быстрой, а питательная среда дешевой. Биосинтез антибиотиков возрастает в фазе замедленного роста клеточной популяции, т.е. в конце трофофазы и достигает максимума в стационарной или идиофазе. В конце трофофазы изменяется энзиматический статус клеток, появляются индукторы вторичного метаболизма, освобождающие гены вторичного метаболизма из-под влияния катаболитной репрессии. Поэтому любые механизмы, тормозящие клеточную пролиферацию и активный рост, стрессовые ситуации, активируют процесс образования антибиотиков. Поэтому в идиофазе ведут ферментацию на продуктивной среде. Большинство антибиотиков получают при глубинной аэробной ферментации периодического действия в асептических условиях. Период ферментации длится около 7-10 суток. К примеру, в биосинтезе пенициллина ферментация питательной среды осуществляется составом, включающем: глюкозу – 1,5%, лактозу – 5% (лактоза снимает катаболитную репрессию глюкозы), аммония сульфат и фосфаты – 0,5 — 1%, кукурузный экстракт – 2-3%, предшественники антибиотика – фенокси- или фенилуксусная кислота – 0,3-0,6%, мел – 0,5-1%, пеногаситель – 0,5-1%; температуру ферментации поддерживают на уровне 22-260 С при рН от 5,0 до 7,5 и аэрации 1 м3воздуха на 1 м3 среды в 1 минуту. Продолжительность ферментации – 4 суток.
2) Следующая, стадия предварительной обработки культуральной жидкости – отделение культуральной жидкости от биомассы продуцента путем фильтрации.
3) стадия выделения и очистки антибиотика. Для медицинских целей технология выделения и очистки имеет особое значение. Обычно она включает сложные многоступенчатые комбинации различных операций: экстракцию антибиотиков подходящими растворителями, осаждение и перекрисстализацию их из разных сред, фракционирование на ионообменных смолах, лиофильную и распылительную сушку готовых препаратов. 4) стадия получения готовой продукции, изготовления лекарственных форм и расфасовки. Антибиотики выделяют или в виде сравнительно неочищенных препаратов (натриевая соль пенициллина), или в виде высокоочищенных вешеств (прокаиновая соль пенициллина), предназначенных для клинического использования. Выход антибиотиков обычно составляет несколько десятков граммов на 1 литр.
Использованная литература:
1. Медицинская биотехнология. К.Х.Әлмағамбетов, Ә.Ө.Байдүйсенова. // Астана. – 2009. – 232с.
2. Основы биотехнологии. Т.А.Егорова, С.М.Клунова, Е.А.Живухина. // Москва. – «Академия». – 2008. – 208с.
3. Биотехнология. Н.В.Загоскина, Л.В.Назаренко и др. // Москва. – «Оникс». – 2009. – 496с.
Контрольные вопросы:
- Основные классы антибиотиков новых поколений в зависимости от химической природы.
- Классификация антибиотиков по механизму действия — СРС.
- Технологии производства антибиотиков.
- Основные пути поиска антибиотиков новых поколений — СРС.
- Биотехнология промышленного получения антибиотика.
- Характеристика вторичных метаболитов.
- Химический синтез антибиотиков
- Мутационный биосинтез антибиотиков.
- Характеристика Р. Chrysogenum – продуцента пенициллина.
7.2. Производство антибиотиков
Технологический процесс производства антибиотиков представлен на рис. 20.
Биосинтез антибиотика осуществляется микроорганизмами на определённом этапе их развития. Эта закономерность характерна для бактерий, мицелиальных грибов (Penicillium chrysogenum, Aspergillus fumi-gatus и др.) и для большинства актиномИцетов, образующих такие антибиотики, как стрептомицин, хлортетрациклин, окситетрациклин и другие. Максимально высокую активность штамма-продуцента способна обеспечить технология рекомбинантных ДНК, так как можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Генно-инженерные подходы используются для увеличения выхода антибиотиков и соответственно снижения стоимости их производства.
Примеры промышленных продуцентов основных антибиотиков, используемые в РФ, представлены в табл. 3.
При проведении первой стадии технологического процесса (рис. 20) применяют натуральные среды неопределенного состава, к числу которых относят продукты крахмалопаточного производства, агар, желатин, отруби, зерно. Композиция натуральных сред неопределенного состава не является постоянной. Например, агар, получаемый из разных видов морских водорослей, по химическому составу — сложный эфирный комплекс полисахарида с серной кислотой и разнообразными микроэлементами. Агар содержит также жирные кислоты, биотин, тиамин или его


компоненты. В картофельной среде с глюкозой и пептоном, при одной и той же партии пептона и химически чистой глюкозы, состав картофельного экстракта зависит от сорта картофеля, места его произрастания, времени уборки, срока и режима хранения и других причин. Поэтому для получения сопоставимых результатов, особенно при изучении физиологических и биохимических особенностей микроорганизма, применяют синтетические среды, в состав которых входят определенные химически чистые соединения, взятые в точно указанных концентрациях.
Задача второй стадии — создать оптимальные условия для развития продуцента и максимально возможного биосинтеза необходимого антибиотика. Особенность производства антибиотиков — двухфазный характер развития продуцентов. В первой фазе развития культуры, носящей название тропофазы (фазы сбалансированного роста микроорганизма), идет интенсивное накопление биомассы продуцента. Продуцент синтезирует белки, нуклеиновые кислоты, углеводы, ферменты, и другие БАВ, необходимые для роста микроорганизма; наблюдается быстрое потребление основных компонентов субстрата, интенсивное поглощение кислорода. В культуральной среде может снижаться рН, как результат накопления органических кислот. В тропофазе антибиотик, как правило, не образуется или его количество незначительное. Возможно, в этой фазе синтез ферментов, принимающих участие в образовании антибиотика, подавлен. Во второй фазе — идиофазе (фазе несбалансированного роста микроорганизма) — накопление биомассы замедлено. Культуральная среда уже обеднена компонентами, необходимыми для развития продуцента и обогащена продуктами его жизнедеятельности. В культуре преобладают протеолитические процессы, приводящие к её подщелачиванию. Продукты метаболизма микроорганизма частично используются на построение клеток мицелия, частично — на синтез антибиотика. Максимум биосинтеза антибиотика в культуральной среде наступает, как правило, после максимального накопления биомассы, этот максимум неодинаков у разных микроорганизмов и при разных условиях культивирования.
Практика промышленной микробиологии показывает, что процесс получения того или иного продукта жизнедеятельности активнее идет в смешанных культурах, при совместном развитии нескольких видов (чаще двух) микроорганизмов. Совместным культивированием специально подобранных микроорганизмов создают условия, при которых значительно увеличивается образование антибиотиков, как результат активации ряда биохимических процессов. В смешанных культурах ферментативная реакция служит ответом на проявление определенных антагонистических взаимоотношений. При совместном культивировании различных микробов могут возникать своеобразные гибриды этих организмов, обладающие иными свойствами по сравнению с исходными чистыми культурами.
С накоплением определенной концентрации антибиотика рост микроорганизмов прекращается (например, Streptomyces griseus прекращает свой рост при концентрации в среде стрептомицина сульфата 0,5%). Из культуральной среды антибиотики выделяют экстракцией органическими растворителями, осаждением, адсорбцией.
Очистку антибиотиков проводят повторной заменой растворителя, адсорбционно-хроматографическими методами, ВЭЖХ. От степени чистоты препарата, влажности, температуры, рН растворителя зависит стабильность антибиотика.
Затем оценивают антимикробный спектр, стерильность, токсичность, пирогенность, действие на лейкоциты крови и другие показатели.
На всех стадиях получения антибиотика строго соблюдается технологическая дисциплина, все процессы осуществляются в асептических условиях.
ОСНОВЫ БИОТЕХНОЛОГИИ
Количество просмотров публикации ОСНОВЫ БИОТЕХНОЛОГИИ — 337
1. Основные направления биотехнологии.
2. Пути регуляции клеточного метаболизма.
3. Механизмы регуляции катаболизма клетки.
4. Механизмы регуляции анаболизма клетки.
5. Регуляция метаболизма в разветвленных схемах биосинтетических превращений.
6. Биосинтез первичных метаболитов.
7. Биосинтез вторичных метаболитов.
Биотехнология — ϶ᴛᴏ использование микроорганизмов, культур клеток животных и растений, метаболизм и биосинтетические способности которых обеспечивают выработку специфических, необходимых человеку веществ.
Возникновение и развитие биотехнологии базируется прежде всего на использовании микроорганизмов.
Основные направления биотехнологии:
1. Генная инженерия — ϶ᴛᴏ раздел биотехнологии, который изучает способы модификации ДНК и перенесение ее из одних организмов в другие. Возникла благодаря интенсивному прогрессу вирусологии, бактериологии, генетики, энзимологии, молекулярной биологии.
Цель: встраивание природной ДНК в плазмиду или геном, такая клетка дает клоны трансформирующих клеток, способных к образованию в больших количествах специфических целевых веществ. Цель – создание высокопродуктивных штаммов для традиционных микробиологических процессов. Достижения генетики используются в селекции, ᴛ.ᴇ. выведении новых форм организмов со свойствами, резко отличающимися от свойств исходных форм.
Методы селекции:
1). Естественный отбор
2). Искусственный отбор
3). Искусственный отбор измененных форм, индуцированных мутаенезом.
4). Получение измененных форм путем гибридизации, когда объединенные полезные признаки исходных форм активизируются в гибриде.
2. Микробная биотехнология.
3. Клеточная инженерия
4. Химическая энзимология (ферментология)
5. Инженерная энзимология
С помощью биотехнологии получают антибиотики, витамины, ферменты, аминокислоты, нуклеотиды, стероиды, гормоны, интерфероны, вакцины, диагностические препараты, антитела, органические кислоты, биополимеры, биопестициды и т.д.
2. Микроорганизмы осуществляют множество реакций, которые катализируются различными ферментами.
Все эти процессы катализируют сотни ферментов, которые в свою очередь синтезирует клетка
Регуляция клеточного метаболизма идет на двух уровнях:
1. На уровне регуляции синтеза ферментов.
2. На уровне регуляции активности ферментов
РЕГУЛЯЦИЯ НА УРОВНЕ СИНТЕЗА
Синтез каждого фермента регулируется отдельным геном. Несмотря на постоянство генотипа микроорганизмы очень подвижны в отношении к своему составу и метаболизму в ответ на окружающую среду.
Существуют два вида ферментов:
1. Ферменты, которые синтезируются вне зависимости от окружающей среды — ϶ᴛᴏ конститутивные ферменты (эндоферменты) или ферменты анаболизма (синтеза). Их образование осуществляется путем регуляции по принципу обратной связи, а именно ингибирования или репрессии.
2. Ферменты, которые образуются только тогда, когда в среде присутствуют их субстраты. Это так называемые индуцибельные ферменты или ферменты катаболизма, ᴛ.ᴇ. те ферменты, которые участвуют в использовании субстратов (питательных веществ) —
экзоферменты. Изменение количества индуцибельных ферментов в клетке происходит под действием индукции или катаболитной регуляции.
РЕГУЛЯЦИЯ НА УРОВНЕ АКТИВНОСТИ ФЕРМЕНТОВ
Регуляция на уровне активности ферментов свойственна ключевым ферментам обмена веществ. Активность повышается под действием положительного эффектора и снижается под действием ингибитора (отрицательного эффектора).
РЕГУЛЯЦИЯ СИНТЕЗА ФЕРМЕНТОВ КАТАБОЛИЗМА КЛЕТКИ
1. Индукция — ϶ᴛᴏ регуляция синтеза ферментов реакций разложения. Индукция относительно повышает скорость синтеза ферментов в ответ на присутствие в среде определенного химического вещества – индуктора (субстрат, его аналог, продукты реакции). Индукция обеспечивает клетке возможность использовать аминокислоты и энергию для синтеза тех ферментов, которые необходимы ей в данный момент.
Наиболее распространена модель Жакоба – Моно
ДНК
R – ген, закодированный на синтез активного белка – репрессора.
Р – ячейка, где находится РНК – полимераза
О – ген – оператор, управляет работой структорного гена S
S – структурный ген, ответственный за синтез целевого белка
В случае если в среде нет индуктора, белок – репрессор соединяется с геном и блокирует прохождение РНК – полимеразы к гену S. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, РНК – полимераза, катализирующая транскрипцию ДНК в информационную РНК, не достигает гена S, следовательно не проходит синтеза белка, или трансформации. В случае если в среде присутствует индуктор, он связывается с белком – репрессором, изменяет его структуру, переводя а неактивное состояние. Белок – репрессор в таком состоянии не может связаться с геном О. РНК – полимераза проходит вдоль молекулы ДНК через ген О, который включает ген S. Происходит транскрипция, а затем трансляция.
2. Катаболитная регуляция – если в среде находится несколько субстратов, которые клетка способна использовать, она выбирает наилучший и вырабатывает ферменты для его использования. Обычно это глюкоза. По мере ее потребления синтезируется фермент для расщепления другого субстрата и т.д.
РЕГУЛЯЦИЯ СИНТЕЗА ФЕРМЕНТОВ АНАБОЛИЗМА
4.1. Репрессия: ген R закодирован на синтез неактивного белка апорепрессора. В случае если в среде присутствует корепрессор (продукт реакции), он взаимодействует с апорепрессором и переводит его в активное состояние. Корепрессор и апорепрессор взаимодействуют с геном О и блокируют движение РНК – полимеразы. Синтеза белка не происходит. В случае если корепрессор отсутствует, неактивный апорепрессор не может соединиться с геном О. РНК- полимераза проходит к гену S, который включается в работу.
2. Ингибирование: в данном случае ингибитором должна быть конечный продукт реакции. Каждый фермент имеет два центра: активный – для связывания субстрата и ингибиторный – для связывания ингибитора.
В случае если ингибитор соединяется с ферментом, то изменяется структура активного центра, что затрудняет взаимодействие с субстратом. Этот эффект принято называть аллостерическим. Зависимость скорости реакции от концентрации субстрата имеет следующий вид
Регуляция синтеза ферментов анаболизма принято называть регуляцией по принципу обратной связи.
5. В случае если клеткой в общей цепи метаболических реакций
F
f
а в с d
А →В →С →Е →D
k
К
образуется не один, а несколько продуктов (А,В,С,Е,К,D,F) с участием соответствующих ферментов (a,в,c,d,f,k), то существует ряд механизмов регуляции синтеза этих метаболитов.
Первый механизм: дифференцированная регуляция изоферментами. Допустим, что А→В – реакция превращения А в В катализируется несколькими изоферментами, но синтез каждого из них контролируется различными конечными продуктами.
Второй механизм: согласованная регуляция по принципу обратной связи. Превращение вещества А в В катализируется одним ферментом, но образуется несколько конечных продуктов, которые согласовано ингибируют его синтез.
Третий механизм: кумулятивная регуляция по принципу обратной связи, каждый конечный продукт способен вызвать очень слабое ингибирование/репрессию синтеза фермента͵ но комбинация конечных отдельных продуктов имеет кумулятивный характер.
6. Биосинтез первичных метаболитов. Первичные метаболиты — ϶ᴛᴏ низкомолекулярные соединения необходимые для роста микроорганизмов. Их молекулярная масса менее 1500 дальтон. Наиболее важные среди них — аминокислоты, органические кислоты, пуриновые и пиримидиновые основания. Микробная клетка не производит избытка этих метаболитов, а следовательно не накапливает их, но есть микроорганизмы с нарушением обмена веществ, их используют в биотехнологии для получения необходимых веществ.
Разработано две методики получения первичных метаболитов:
1. Накопление промежуточных продуктов, или ограничение синтеза конечного продукта.
Существует цепь метаболических реакций, каждый из этих этапов катализируется своим ферментом. Нам крайне важно получить промежуточный продукт С. Продукт Е подавляет синтез фермента а, D – подавляет синтез в. Чтобы накопить вещество С, получают мутантный штамм, у которого отсутствует фермент с.
В случае если к питательной среде (клетке) подводится недостаточное количество вещества Е или D, то репрессии синтеза ферментов а и в не происходит (сама клетка веществ Е и D в отсутствии фермента с не синтезирует) .
2. Накопление конечных продуктов рассматривается на примере синтеза аминокислоты – лизина; бактериями лизин синтезируется по разветвленной схеме.
Исходное вещество аспартат, который под действием фермента Ф1 превращается в аспартилфосфат, а затем в ряд аминокислот: лизин, треонин, лейцин, метионин.
аспартат
↓Ф1
аспартилфосфат
↓
аспартилполуальдегид
Ф2
лизин гомосерин
треонин метионин
лейцин
Без фермента Ф2 – только в лизин, а с ферментом Ф2 – в треонин, лейцин и метионин.
У каждой из этих аминокислот механизм согласованной регуляции на синтез фермента Ф1.В случае если используются микроорганизмы, у которых отсутствует фермент Ф2 ,то ингибирующий эффект на синтез фермента Ф1 будет недостаточным. Лизин будет синтезироваться в больших количествах.
7. Синтез вторичных метаболитов — ϶ᴛᴏ молекулы веществ, которые синтезируются на последних стадиях ростового цикла, они не требуются для роста организма, но играют существенную роль в его жизнедеятельности.
Весь цикл роста и развития организма можно разделить на две фазы:
1. Трофофаза – фаза начального роста.
2. Идиофаза – фаза конечного роста.
Ко вторичным метаболитам относятся: антибиотики, гормоны, алколоиды, токсины.
При биосинтезе вторичных метаболитов установлено влияние следующих регуляционных механизмов:
1. Индукция ферментов: индуктор стимулирует синтез фермента͵ но в структуру вторичного метаболита не включается.
2. Регуляция по принципу обратной связи (репрессия конечным продуктом в разветвленной схеме биосинтеза).
3. Катоболитная регуляция (используется для получения пенициллина).
При выращивании гриба Penicillium notatum – продуцента пенициллина в питательную среду вносят смесь глюкозы и лактозы. Глюкоза необходима для роста͵ лактоза расходуется медленно, но хорошо поддерживает синтез пенициллина. По этой причине целесообразно в трофофазе добалять глюкозу, а в идиофазе – добавлять лактозу.
8. БИОТРАНСФОРМАЦИЯ, ФАКТОРЫ ЕЕ ОПРЕДЕЛЯЮЩИЕ.
Биотрансформация — ϶ᴛᴏ неполное превращение органических соединений ферментами микроорганизмов. Используются растущие клетки для получения веществ, которые невозможно получить другим путем. При трансформации участвуют один или несколько ферментов, в связи с этим исходное вещество меняется незначительно. Трансформация используется для получения веществ, которые невозможно получить другим путем, к примеру, из глюкозы получают глюконовую кислоту. Д-фенилаланин превращается в L-фенилаланин.
Преимущества в сравнении с химическим синтезом:
1. Специфическое действие микробных ферментов позволяет осуществлять тонкую перестройку молекул органических веществ с помощью простых технических схем, минуя многостадийные синтезы.
2. Ферменты действуют в условиях, не требующих повышенной температуры.
3. Образуется небольшое количество побочных продуктов, в т.ч. засоряющих окружающую среду.
4. Получают большой выход биомассы.
Факторы, определяющие биотрансформацию:
1. Регуляция синтеза ферментов, для которой используют индукцию. В среду добавляют индуктор -субстрат или его аналоᴦ. В этом случае предотвращается катаболитное подавление синтеза нужных ферментов.
2. Используют мутантные штаммы, у которых отсутствует фермент, разлагающий целевой продукт.
3. Используют смесь двух субстратов, из которых один потребляется микроорганизмом для роста͵ а другой превращается в целевой продукт.
4. Используется проницаемость микробных мембран, то есть осуществляется регуляция поступления веществ за счёт синтеза определенных пермеаз.
9. РЕГУЛЯЦИЯ МИКРОБНОГО СИНТЕЗА ФЕРМЕНТОВ.
Для получения в биотехнологии целевого фермента осуществляют:
1. Выбор продуцента: проводится скрининг штаммов и выбирают наиболее активный по способности синтезировать нужный фермент.
2. Разрабатываются условия выращивания этого микроорганизма с целью максимального биосинтеза фермента: подбор питательной среды, определенная температуры для роста͵ рН, уровень аэрации.
3. Изучается динамика биосинтеза, ᴛ.ᴇ. определяется время выращивания, соответствующее максимальному накоплению фермента.
4. Разработка схемы выделения и очистки фермента.
В процессе культивирования используется механизм индукции. Чтобы исключить катоболитное подавление синтеза, из питательных сред выводят легкодоступные источники углерода. Чтобы подавить репрессию, ингибирование, ᴛ.ᴇ. синтез веществ, действующих на синтез нужного фермента͵ из среды выводят продукты синтеза.
Преимущества микробного синтеза ферментов:
1. В качестве питательной среды используют дешевое сырье (отходы производств).
2. Цикл ферментации достаточно короткий: 36-40 часов при поверхностном культивировании, 48- 70 часов – при глубинном.
3. Простые процессы фракционирования и разделения ферментов.
4. Микроорганизмы способны к сверхсинтезу.
ПАРАДОКС: КАК ИЗБЕЖАТЬ САМОУБИЙСТВА — Med24info.com
Многие антибиотики активны в отношении тех самых микроорганизмов, которые их образуют. Действительно, если суспензию спор или фрагменты мицелия внести в свежую питательную среду, содержащую антибиотик, образуемый этим же организмом, роста не будет. Здесь мы имеем дело с кажущимся парадоксом: штамм, способный синтезировать большие количества антибиотика, не может расти при низких его концентрациях. Этот парадокс можно разрешить, предположив наличие одного или нескольких следующих механизмов: 1) репрессия синтеза антибиотика во время роста; 2) изменение проницаемости;
- инактивация антибиотика; 4) изменение внутриклеточной мишени антибиотика.
- РЕПРЕССИЯ СИНТЕЗА АНТИБИОТИКА
Зачастую антибиотик образуется только после завершения роста культуры. Это наблюдение привело к появлению терминов тропофаза и идиофаза. Первый термин означает период роста вегетативного мицелия, а второй — период синтеза антибиотика. Синтез антибиотиков часто репрессируется веществами, способствующими быстрому росту клеток, такими как глюкоза (катаболитная репрессия), ионы аммония (репрессия азотом) и фосфат. Когда уровень этих питательных веществ низок, скорость роста клеток замедляется и синтез антибиотика дерепрессируется. Таким образом, антибиотик синтезируется только тогда, когда организм продуцента «физиологически» нечувствителен к нему.
- ИЗМЕНЕНИЕ ПРОНИЦАЕМОСТИ
Показано, что определенные высокопродуктивные штаммы отличаются от низкопродуктивных проницаемостью для антибиотика, который они образуют. Они более эффективно транспортируют антибиотик наружу и утратили способность ассимилировать или транспортировать его из среды.
- ИНАКТИВАЦИЯ АНТИБИОТИКА
Даже при наличии отмеченных выше механизмов внутриклеточные концентрации антибиотиков могут достигать ингибиторных уровней. В этом случае штамм может избежать самоубийства за счет ферментативной инактивации антибиотика.
- ИЗМЕНЕНИЕ МИШЕНИ
У высокопродуктивных мутантов часто изменяется структура субклеточной мишени антибиотика (рибосом, РНК-полимеразы и т. д.) и, следовательно, штамм-продуцент становится менее чувствительным к антибиотику.
Часто у одного штамма одновременно работает несколько механизмов, как в случае высокопродуктивных мутантов, образующих рифамицин В. Рифамицин S, ключевой метаболит при биосинтезе рифамицина, являющийся токсическим веществом, инактивируется за счет конденсации с гликолом с образованием рифамицина В, нетоксичного вещества. Рифамицин В, по-видимому, эффективнее выделяется, чем рифамицин S. Наконец, РНК-полимераза (мишень рифамицинов) высокопродуктивного штамма менее чувствительна к рифамицину S, чем тот же фермент из штамма дикого типа.



