Гальваническое покрытие медью в домашних условиях
№ 5
Меднение. Никелирование Меднение Меднение стали
Медные покрытия, как правило, не применяются в качестве самостоятельного покрытия ни для декоративных целей, ни для защиты стальных деталей от коррозии.
Это связано с тем, что медь в атмосферных условиях легко окисляется, покрываясь налетом окислов.
Однако благодаря хорошему сцеплению осажденной меди с различными металлами медное покрытие применяется в многослойных защитно-декоративных покрытиях в качестве промежуточного подслоя, а также для защиты стальных деталей от цементации.
В гальванопластике медные осадки применяются для изготовления металлических копий, барельефов, волноводов и матриц.
Электролиты меднения подразделяют на кислые и щелочные. Из кислых электролитов используют сернокислые и борфтористоводородные. Наибольшее применение нашли сернокислые электролиты, отличающиеся простотой состава, устойчивостью и высоким выходом по току (до 100%). Недостатком этих электролитов является невозможность непосредственного покрытия стальных и цинковых деталей вследствие контактного выделения меди, имеющей плохое сцепление с основным металлом.
Поэтому перед меднением стальных детален в кислых электролитах их предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. К недостаткам сернокислых электролитов относятся также их незначительная рассеивающая способность и более грубая: структура осадков по сравнению с другими электролитами.
К щелочным электролитам меднения относятся цианистые, пирофосфатные и другие электролиты.
Цианистые медные электролиты обладают высокой рассеивающей способностью, мелкокристаллической структурой осадков, возможностью непосредственного меднения стольных деталей. К недостаткам относятся низкая плотность тока и неустойчивость состава вследствие карбонизации свободного цианида под действием двуокиси углерода воздуха. Кроме того, цианистые электролиты характеризуются пониженным выходом по току (не более 60-70%).
Кислые электролиты меднения
Медь сернокислая — 150-250 г/л
Никель хлористый — 50-70 г/л
Температура = 18-25°С
Плотность тока = 1-4 А/дм2
При перемешивании электролита сжатым воздухом можно довести катодную плотность тока до 6-8 А/дм2.
Для приготовления сернокислого электролита меднения растворяют медный купорос, фильтруют его в рабочую ванну и при непрерывном помешивании добавляют серную кислоту.
При нанесении медных покрытий из сернокислого электролита медные аноды растворяются в основном с образованием двухвалентных ионов, которые, разряжаясь на катоде, осаждаются в виде металлической меди.
Однако наряду с этими процессами происходят п другие, нарушающие нормальное течение электролиза. Возможно также анодное растворение с образованием одновалентных ионов, хотя и в меньшей степени.
В электролите, омывающем металлическую медь, идет также химический обратимый процесс: Cu + Cu2+ = 2Cu+.
Накопление в растворе ионов одновалентной меди в больших количествах приводит к сдвигу реакции влево, в результате чего выпадает металлическая губчатая медь.
В растворе, кроме того, происходит окисление сернокислой одновалентной меди за счет кислорода воздуха н серной кислоты, особенно при воздушном перемешивании: Cu2SO4 + ½O2 + h3SO4 = 2CuSO4 + h3O.
На катоде процесс заключается в разряде двухвалентных и одновалентных ионов меди, но в связи с тем, что концентрация ионов одновалентной меди приблизительно в 1000 раз меньше концентрации ионов двухвалентной меди, катодный процесс выглядит так: Cu2+ + 2е- = Cu. Выход по току составляет 100%.
Для получения плотного гладкого осадка в электролите необходимо присутствие серной кислоты.
Меднение гальваникой и гальванопластика в домашних условиях
Серная кислота выполняет ряд функций:
значительно повышает электропроводность электролита;
понижает активность ионов меди, что способствует образованию мелкозернистых осадков;
предотвращает гидролиз сернокислой закисной меди, который сопровождается образованием рыхлого осадка закиси меди.
Дефекты при эксплуатации сернокислого электролита меднения и способы их устранения
Дефект | Причина дефекта | Способ устранения |
Грубая крупнокристаллическая структура осадков | Недостаток кислоты | Добавить кислоту |
Высокая плотность тока | Снизить плотность тока | |
Шероховатые осадки | Загрязнение электролита механическими примесями | Отфильтровать электролит |
Черные и коричневые полосы на покрытии | Присутствие в электролите примесей тяжелых металлов, мышьяка, сурьмы | Проработать электролит, при большом содержании примесей электролит заменить |
Пористые, рыхлые осадки | Наличие в электролите солей железа | Отфильтровать электролит, проработать его током |
Светлые блестящие полосы на покрытии, осадки хрупкие | Присутствие в электролите органических примесей | Отфильтровать электролит, проработать его током |
Борфтористоводородный электролит обладает несколько более высокой рассеивающей способностью, чем сернокислый.
Кроме того, в борфтористоводородных электролитах можно применять высокие плотности тока. Состав электролита (г/л) и режим меднения:
Медь борфтористоводородная – 35-40 г/л
Кислота борная – 15-20 г/л
Кислота борфтористоводородная – 15-20 г/л
Никель хлористый – 50-70 г/л
Температура = 18-25°С
Плотность тока = до 10 А/дм2
Электролит перемешивают сжатым воздухом или механической мешалкой.
Для приготовления борфтористоводородного электролита в борфтористоводородную кислоту небольшими порциями вводят свежеосажденную углекислую медь.
Раствор углекислой меди готовят подливанием подогретого концентрированного раствора соды к раствору сернокислой меди при перемешивании. Полученный осадок декантируют, промывают и растворяют в борфтористоводородной кислоте. В приготовленный раствор добавляют свободную борфтористоводородную и борную кислоту до требуемого значения рН (1-1,5). В ванну с полученным электролитом доливают воду до рабочего уровня.
(Деканта́ция, деканти́рование — в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка.)
 Электрохимический процесс — электро-тип, то есть. осаждение более толстого массивного слоя металла на поверхность объекта, форма которого должна быть распространена, скопирована, достаточно распределена. Например, гальванопластика используется в тех случаях, когда металлическая деталь имеет очень сложную форму и ее трудно или невозможно изготовить обычными способами (литье или механическая обработка).
Электрохимический процесс — электро-тип, то есть. осаждение более толстого массивного слоя металла на поверхность объекта, форма которого должна быть распространена, скопирована, достаточно распределена. Например, гальванопластика используется в тех случаях, когда металлическая деталь имеет очень сложную форму и ее трудно или невозможно изготовить обычными способами (литье или механическая обработка).
Таким образом, скульптуры иногда воспроизводятся по образцам (автомобиль «Аполлон» на пьедестале Большого театра выполнен гальванопластикой).
Этот процесс относительно прост и может быть легко воспроизведен в домашних условиях.
Печать копируется из статьи или статьи для копирования, то есть из легкого металла, воска, пластика или гипса. Субъект, который нужно скопировать, вымыть с мылом, добавляется к картонной коробке и выливается низкоплавким сплавом из древесины или других сплавов.
После литья объект удаляют и полученную форму обезжиривают и ударяют путем литья в электролитической ванне.
Чтобы не откладывать металл по бокам формы, где нет никакого впечатления, они покрываются щеткой с расплавленным воском или парафином. После литья меди низкоплавкий металл растворяется в кипящей воде и получается матрица. Матрица заливается штукатуркой или свинцом, и копия готова. Следующая композиция для воска используется для изготовления пресс-форм:
Воск …………… 20 веков.
Гальванический. Бейкер, покрывающий алюминий.
час
Парафин ……… 3 v. час
Графит ……….. 1 v. час
Если форма изготовлена из диэлектрика (воск, пластик, парафин, гипс), его поверхность
покрытый электропроводящим слоем.
Передаточный слой может быть осажден с извлечением определенных металлов (серебра, меди, никеля) или механическими средствами — путем протирания поверхности графитом в виде листьев из щетки мягких волос.
Графит тщательно измельчают в фарфоровом растворе, просеивают через сито или марлю и наносят на поверхность продукта мягкой кистью или ватой. Графит лучше держит глину. Формы гипса, дерева, стекла, пластика и папье-маше покрыты раствором воска в бензине. На поверхности, которая не успевает высохнуть, поместите графит в порошок и излишек, без контроля графита.
Гальваническое покрытие просто отделено от графитовой формы. Если форма выполнена из металла, необходимо создать проводящую фольгу из оксида, сульфида или другой нерастворимой соли, такую как серебро — серебросодержащий хлорид свинца — сульфид свинца, чтобы обеспечить хорошее отделение от покрытия.
Медь, серебро и свинцовые поверхности обрабатываются 1% раствором сульфида натрия, что приводит к образованию нерастворимых сульфидов.
Отложение металла на поверхности пресс-формы. Готовая форма погружается в гальваническую ванну, схема которой находится под напряжением, так что снимаемая пленка не растворяется. Во-первых, «уплотнение» (покрытие) проводящего слоя меди осуществляется при низкой плотности тока в растворе этого
Серокислотная медь (сульфат меди) … 150-200 г.
Серная кислота 7-15 г
Этиловый спирт 30-50 мл
Вода …………………………………………. 1000 мл
Рабочая температура электролита составляет 18-25 ° С, плотность тока составляет 1 — 2 А / дм2.
Алкоголь необходим для
увеличить смачиваемость поверхности. Когда вся поверхность «подталкивается» медным слоем, форма переносится на электролит, предназначенный для гальванопластики. При гальванизации (медь) рекомендуется следующая композиция:
Серийно кислотная медь (сульфат меди) …..
340 c. час
Серная кислота 2 v. час
Вода …………………………………………. .1000 v. час
Температура электролита составляет 25-28 ° С. Плотность тока составляет 5-8 А / дм2.
Используя метод электроформовки, вы можете взять металлическое кружево для декоративно-художественного декоративно-художественного оформления различных предметов. Кружево растягивается на раме и пропитано парафином.
Затем вы протираете их между бумажными листами, чтобы удалить лишний парафин. Затем наносят электропроводящий слой тонкого графита, а избыток тщательно подталкивают кружевом. Путь провода — край кружева, он прикреплен к пластиковой раме или раме толстой проволоки с изолированным винилхлоридом вместе с кружевом, погруженным в электролит.
Лак, покрытый медью, обрабатывается латунной щеткой. Припаяйте их свинцовым припоем.
Гальваноспециальная обработка металлических кружев — использование декоративного слоя из серебра или золота или окисления.
<<<Вернуться назад
Технологии -> пекарь
пекарь
Покрытие баком
Медные покрытия обычно не используются как самостоятельное покрытие для декоративных целей, а также для защиты стальных деталей от коррозии. Это связано с тем, что медь в атмосферных условиях легко окисляется, покрывается окислением.
Однако из-за хорошей адгезии осажденной меди к различным металлам медное покрытие используется в многослойных защитных и декоративных покрытиях в качестве промежуточных подошв, а также для защиты стальных деталей от газификации.
Для электроформования медные нанотрубки используются для изготовления металлических копий, рельефов основания, волноводов и матриц.
Медные электролиты делятся на кислотные и щелочные.
Кислотные электролиты используются сульфатными и борфтористоводородными. Наибольшее применение было доступно для сульфатных электролитов, характеризующихся их простым составом, стабильностью и высокой силой тока (до 100%).
Недостатком этих электролитов является невозможность непосредственного применения стальных и цинковых деталей для отделения медных контактов, которые плохо склеиваются с основным металлом.
Поэтому перед нанесением меди на стальные детали в кислотных электролитах они предварительно сохраняются в цианидных электролитах или наносимых тонких никелевых пластин. Недостатки сульфатных электролитов также являются их незначительной рассеивающей способностью и более грубыми: структура осаждения по сравнению с другими электролитами.
Электролиты щелочной меди покрывают цианидом, пирофосфатом и другими электролитами.
Цианид-медные электролиты обладают высокой дисперсионной способностью, мелкокристаллической структурой осаждения, возможностью непосредственных медных табличных объектов. К недостаткам относятся низкая плотность тока и нестабильность состава за счет карбонизации свободного цианида под воздействием углекислого газа в воздухе.
Быстрое накопление меди.
Кроме того, цианидные электролиты характеризуются сниженной мощностью тока (не более 60-70%).
Будьте осторожны! Компания «LV-Engineering» не предоставляет услуги по гальванизации! Наша организация осуществляет проектирование гальванических изделий, производство гальванических ванных комнат и полипропиленовых линий, монтажные и пуско-наладочные работы в данном направлении.
Кислотные электролиты
Сульфат меди — 150-250 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока составляет 1-4 А / дм2
Когда электролит смешивается со сжатым воздухом, плотность катодного потока может быть подключена к 6-8 А / дм2.
Для приготовления медносульфатного электролита растворите сульфат меди, процедите в рабочую пантеру и добавьте серную кислоту при непрерывном перемешивании.
Когда медные покрытия наносят из сульфатного электролита, аноды меди сначала растворяются с образованием двухвалентных ионов, которые осаждаются в виде металлической меди при выгрузке на катод.
Однако наряду с этими процессами существуют и другие, которые препятствуют нормальному течению электролиза. Анодное растворение возможно также при образовании одновалентных ионов, хотя и в меньшей степени.
В электролите, который удаляет медный металл, существует также химически обратимый процесс: Cu + Cu2 + = 2Cu +.
Накопление ионов иона иона в растворе в больших количествах приводит к тому, что реакция перемещается влево, а это означает, что к нему принадлежит медная медь.
Раствор также окисляет сульфаты меди из-за атмосферной серной кислоты N, особенно воздуха во время смешивания: Cu2SO4 + 1 / 2O2 + h3SO4 = 2CuSO4 + h3O.
На катоде в процессе отходящий двухвалентных и одновалентных ионов меди, но из-за того, что концентрация ионов одновалентной меди около 1000 раз ниже, чем концентрация ионов двухвалентной меди, катодная методом электроосаждения выглядит следующим образом: Cu 2+ + 2e = Cu. Токовый выход составляет 100%.
Присутствие сорбиновой кислоты требуется для получения плотного гладкого осадка в электролите.
Серная кислота выполняет множество функций: она значительно увеличивает электропроводность электролита; он уменьшает активность ионов меди, что способствует образованию мелких зерен; предотвращает гидролиз сульфата железа, что сопровождается образованием свободного осадка из оксида меди.
Ошибки электролита медно-сульфатного электролита и методы их устранения
| ошибка | Причина ошибки | средство |
| Грубая структура грубых осадков | Кислотный дефицит | Добавить кислоты |
| Высокая плотность тока | Уменьшить плотность тока | |
| Грубые сквозняки | Загрязнение электролита механическими примесями | Фильтровать электролит |
| Черные и коричневые линии на обложке | Наличие в электролитных примесях тяжелых металлов, мышьяка, сурьмы | Проверьте электролит с высоким содержанием примесей, замените электролит |
| Пористые, рыхлые отложения | Присутствие солей железа в электролите | Фильтруйте электролит и заряжайте его электричеством |
| На крышке есть яркие блестящие линии, которые являются хрупкими | Присутствие органических примесей в электролите | Фильтруйте электролит и заряжайте его электричеством |
Борфторогидроэфир имеет немного большую мощность распыления, чем серная кислота.
Кроме того, флюсы высокой плотности могут использоваться в борфтористоводных электролитах. Состав электролита (г / л) и способ применения меди:
Гидрохлорид борфторида меди — 35-40 г / л
Борная кислота — 15-20 г / л
Соляная кислота — 15-20 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока = до 10 А / дм2
Электролит смешивают со сжатым воздухом или механической мешалкой.
Свежую измельченную углеродную медь вводили небольшими порциями для приготовления скважинного углеводородного электролита в борфтористовородной кислоте.
Раствор углеродной меди готовят путем нагревания нагретого концентрированного раствора сульфата натрия в раствор сульфата меди путем смешивания. Полученный осадок декантируют, промывают и растворяют в борфтористой кислоте. К желаемому раствору добавляют свободную бороновую кислоту и борную кислоту до желаемого значения рН (1-1,5). Добавить воду на рабочую поверхность в ванне с электролитом.
 Если перед вами стоит задача омеднения каких-либо деталей в автомобиле, то оказывается это вполне возможно сделать в домашних условиях. Для этого не потребуется особых знаний и умений, да и все материалы и реагенты вполне можно найти в магазинах или своих запасах. Что же, давайте посмотрим как можно сделать омеднение.
Если перед вами стоит задача омеднения каких-либо деталей в автомобиле, то оказывается это вполне возможно сделать в домашних условиях. Для этого не потребуется особых знаний и умений, да и все материалы и реагенты вполне можно найти в магазинах или своих запасах. Что же, давайте посмотрим как можно сделать омеднение.
Когда делают омеднение и можно ли его использовать для коррозионного покрытия
Прежде чем рассказать о самом процессе, хотелось бы сказать пару слов о прагматичности такой операции.
Многие из автолюбителей не особо знакомых с химией сейчас скажут о необходимости омеднения всего чего попадется под руку, но мы вас предостерегаем от этого! Почему!? Да потому что все металлы между собой образуют гальваническую пару. Такая гальваническая пара образуется даже при попадании воды, а если средой будет еще и кислота, то процесс пойдет в разы быстрее.
Суть процесса в гальванической паре сводится к следующему. Более активный металл отдает свои электроны, а менее активный принимает. Вот так и образуется самая простая «батарейка» в которой протекает электрический ток.
Давайте теперь взглянем на стандартные электродные потенциалы:
— для меди Е0(Сu2+/Cu)=0,34В;
— для железа E0(Fe2+/Fe)=-0,44В.
В итоге получается не все так гладко.
Ведь в такой гальванической паре У железа электродный потенциал более активным. Опять же у меди электродный потенциал более положителен, чем у железа, поэтому она будет менее активна.
В итоге электроны потекут от железа к меди, что приведет к коррозии железа.


Все это мы рассказали к тому, что бездумно покрывать медью все что вам попадется под руку на машине не рекомендуется. Ведь в этом случае вы можете значительно сократить жизненный цикл многих железных деталей (крепеж, кузовные детали).
Гальваническое меднение
Не зря для сохранения железа применяют цинк, там ситуация с электродными потенциалами обратная.
Однако омеднение может применяться для декоративной отделки железа, если покрытие будет находиться в сухости.
Также медь может применяться в случаях, где необходимо обеспечить передачу электрического тока между контактами. Опять же надо следить за их чистотой.
Медь может применяться в условиях применения пар с незначительным трением скольжения. Все это в целом вполне жизнеспособные варианты. А значит и омеднение все же имеет шанс на его реализацию.
Тогда не будем более медлить, расскажем непосредственно о процессе омеднения.
Процесс омеднение деталей в домашних условиях (расчет слоя покрытия при определенном токе)
Омеднение происходит в растворе. По сути этот процесс обратный гальванической паре, то есть тому, о чем мы рассказывали в абзаце выше.
Для раствора нам понадобиться кислота, можно взять электролит используемых для аккумуляторов. Воду и медный купорос.

Для раствора берется 100 мл электролита на 20 мл воды и добавляется 20 г медного купороса.
В качестве донора меди можно взять медные пластинки или обычный медный провод, предварительно очищенный от изоляции. Итак, именно в этот самый раствор и помещаем медь. При этом подключаем блок питания постоянного напряжения питания к меди (+) и к железу (-). Ток на блоке питания выставляем тот, при котором мы планируем за определенный период времени нанести определенный слой меди. Это уже задача по химии школьной программы.
И получается все так…
I= (плотность меди (8920 кг/м3)*площадь детали (скажем 0,1 м3)*(требуемый слой (скажем 0,0001 м, то есть 0,1 мм))/ (электрохимический эквивалент для меди это 6,6*〖10〗^(-7)
* желаемое время, скажем 3 часа – 10800 секунд). Считаем…
I=8920*0,1*0,0001/0,0000066*10800=0,0892/0,07128=1,25 А
То есть за 3 часа при токе 1,25 А у нас будет покрытие в 0,1 мм на детали площадью 0,1 м3. Вот как-то так и считаем все аналогичные вариации.

А да, время от времени не забываем помешивать раствор, чтобы процесс шел равномерно.

После того как омеднение завершено, вытаскиваем детали из раствора и отмываем хорошо с щелочью, то есть с мылом.

Если есть каике-то заусенцы и отклонения от формы, то их вполне можно пройтись наждачной бумагой и заполировать.
Собственно вы теперь не меньше знаете, как производить омеднение поверхности.
Надо сказать, что по тому же принципу производится и оцинкование и хромирование… В итоге понимая принцип происходящего процесса можно перенести процесс покрытия поверхности и на другие металлы.
Состояние электрического тока растворов цианистого меди значительно отличается от тех, которые считаются наиболее благоприятными в кислотных растворах. Из-за того, что образуются сильные сложные ионы и очень низкая скорость диссоциации, активность ионов меди в цианидном растворе настолько мала, что потенциал около 1 В становится более отрицательным, чем раствор серной кислоты.
Увеличивая плотность тока, катодный потенциал меди в цианидных электролитах, в отличие от кислоты, сильно изменяется в направлении электроотрицательных значений (рис.
84), который определяет условия кристаллизации и распределения металла на поверхности катода; С этой точки зрения условия в цианидных электролитах чрезвычайно благоприятны.
Но именно из-за потенциала катода быстро растет с плотностью тока, это не может быть существенно увеличено, в противном случае выходной ток металла может быть сведен к нулю.

Рис. 84. Кривые поляризации медных электролитов:
1-сульфатного электролита 1,5-n. CuSO4 + 1,5-n.
h3S04; 2-цианидный электролит композиции 0,25-n.
CuCN + 0,6-n. NaCN + 0,25-n. Na2C03; 3 — тот же электролит при 45 ° C; 4 представляет собой тот же электролит в присутствии Na2S2O3
Еще одно важное различие в кислотности цианидных электролитов следует рассматривать как значительные изменения в характеристиках меди в зависимости от концентрации свободного цианида, в то время как свободная серная кислота оказывает очень мало влияния на характеристики меди в кислотных электролитах.
Если в растворе, содержащем 9 г меди на литр в форме цианидной соли (0,1 м.
Гальванизация собственными руками дома: технологии и оборудование
CuCN) и 13 г / л KCN, медный потенциал -0,60 В, в присутствии 26 г / л KCN этот потенциал равен -0,964 В и в присутствии 65 г / л -1,169 В.
Катодная поляризация также сильно зависит от концентрации солей меди в электролите, в то время как кислотные электролиты оказывают незначительное влияние.
Анодный процесс в цианидных электролитах также сопровождается значительной поляризацией, размер которой в основном определяется содержанием свободного цианида.
Отсутствие цианидного анода неактивно до полного растворения их растворения. Таким образом, содержание свободного цианида оказывает диаметрально противоположное воздействие на процессы катодного и анодного; Сначала требуется минимальное содержание свободного цианида (катодная плотность тока может быть выше, чем ниже цианид в электролите), второй — по величине (анод пассивации начать с самой высокой плотностью тока, тем выше содержание цианида).
Это значительно ограничивает выбор концентрации цианида, который является основным компонентом электролита из соли меди.
Для большинства цианидов электролиты не могут полностью использовать методы, которые позволяют им использовать увеличенную плотность тока, такую как смешивание или значительное повышение температуры, по той причине, что эти процессы ускорили гидролиз цианида. Даже в состоянии покоя при комнатной температуре цианид электролита разрушается быстрее, чем кислота, что приводит к абсорбции углекислого газа из воздуха.
Электролиты из цианид-меди, нанесенные на катод, извлечение из одновалентных ионов, т. Е. При 1 Ач теоретически получают в два раза больше меди, чем в кислотных электролитах, где медь присутствует в виде двухвалентных ионов.
Тот факт, что цианистые электролитный баланс потенциал медь сильно отрицательная с более высоким потенциалом плотности тока переместился от электрических величин служат в качестве основы для суждения невозможности осаждения меди из цианистых электролитов при высоких плотностях тока (по заказу 10 А / дм 2) с теоретическим или вблизи теоретического выхода поток.
На самом деле это справедливо только для разбавленных цианидных электролитов, не страдают от перемешивания и нагрева. При определенных условиях медь может выделяться на электролитах с цианидным катодом, особенно при низком содержании свободного цианида в электролите при высоких температурах и при смешивании при достаточно высокой плотности тока и эффективности тока, близкой к теоретической.
Делаем меднение стекла в домашних условиях
Делаем меднение стекла в домашних условиях.

Понадобится:
1. ёмкость
2. лабораторный блок питания, или старый блок питания от чего — либо до 1,5 V и до 1А
3. провода и зажимы
4. токопроводящий лак
5. электролит
6. медные пластины и проволока
7. Объект меднения
Гравируем с помощью алмаза на бусине будущий медный рисунок.
Гравировка делается для лучшего сцепления.
Наносим токопроводящий слой.
В магазинах я нашла только графитовый, результат меня не сильно порадовал, поэтому заменила на медный.
Этот лак из за границы, но в России медный я тоже нашла, только аэрозоль,
что для моих целей опять же не слишком удобно.
Погружаем в электролит медные пластины.
Ставим держатель, крепим на него бусину.
Для электролита использовала дистиллированную воду, медный купорос, серную кислоту, спирт. 
Устанавливаю напряжение 1V.
Сила тока не регулируется, всё происходит как то само:)
Чем ниже напряжение, тем ровнее будет слой меди.
Моя задача получить фактуру, поэтому я ставлю 1.
Через несколько часов можно снизить, чтобы слой был чуть более гладким,
но оставался фактурным.
Результат через 14 часов.

Так как напряжение было выше, чем требуется для блестящего медного слоя,
у меня получился матовый слой, который требует доработки.
Зачищаю крацовкой все неровности и попутно медь начинает блестеть.

Проходимся мелкой наждачной бумагой, если есть необходимость.
Далее оксидируем.
Вода, всё тот же медный купорос и перманганат калия.
Нагреваем до 70 — 80 градусов по Цельсию.
Для контроля температуры очень удобны бесконтактные инфракрасные термометры с лазерным прицелом.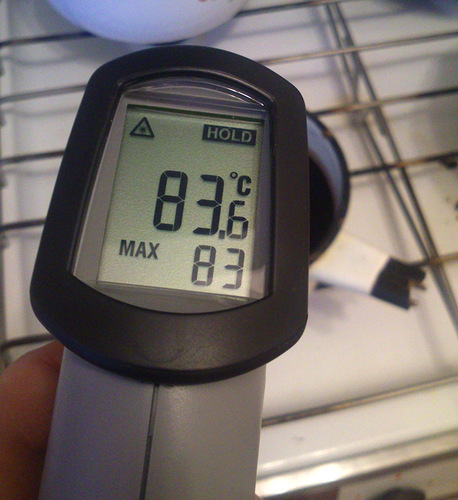
Стекло, конечно заколённое в печи и ему ничего не будет, но на всякий случай наношу состав кистью.
Через пару минут начинает окрашиваться.
Когда цвет тонировки становится желаемым, достаём, промываем.
У меня бусина светлая и я делаю лёгкий, тёплый тон.
Затем полируем.
Пастой пользуюсь белой DIALUX 
Смываем излишки пасты. Можно мылом или средством для мытья посуды.
После просушки проверяем не осталось ли заусенцев.
Если где то остались, можно поправить вот такими пилками для полировки ногтей:)
розовая — шлифовка
белая — заглаживает мелкие царапинки и
серая — полировка.
Я пользуюсь только первыми двумя в данном случае.
Держать максимально удобно вот так.
Та дам! Бусина готова.

Проблемы гальванического меднения в производстве печатных плат
Главная → Проблемы гальванического меднения в производстве печатных платВ настоящее время одной из важнейших проблем в технологии изготовления печатных плат является получение равномерных по толщине покрытий на поверхности и в отверстиях. При металлизации отверстий применяют электролиты меднения. Но равномерное покрытие медью требуется не только в отверстиях, но и по всей заготовке платы, т.к. от этого будет зависеть равномерность травления проводящего рисунка и, отчасти, величина бокового подтрава под фоторезистом.
Медь — пластичный и легко полирующийся металл с
удельным весом 8,9 кг/м3 и температурой плавления 1084°С.
Теплопроводность меди 330 ккал/м·час·°С, а удельное электрическое сопротивление
0,0175 Ом·мм2/м.
Гальваническое осаждение меди было открыто в 1838 г. русским академиком Б.С. Якоби. С этого времени меднение широко применяется во многих отраслях промышленности.
Нормальный потенциал меди +0,34 В. Гальванически осажденная медь имеет красивый розовый цвет, но в атмосферных условиях легко реагирует с влагой, углекислотой воздуха, с сернистыми газами — покрывается окислами, гидроксидами, карбонатами, сульфидами и в результате темнеет. При этом ее переходное электрическое сопротивление резко возрастает. Медь интенсивно растворяется в азотной кислоте, медленнее — в хромовой, значительно слабее — в серной, и почти не реагирует с соляной кислотой. введение окислителей резко увеличивает скорость этих реакций. Органические кислоты и аммиак легко взаимодействуют с медью.
Часто применяется меднение посредством химического восстановления меди из ее растворов, особенно при покрытии диэлектриков. Толщина получающегося при этом слоя меди весьма мала, измеряется долями микрона и образовавшийся слой, вернее налет, металлической меди служит основой для последующего гальванического наращивания меди из кислых электролитов.
1.1. Этапы изготовления ПП
Процесс производства печатных плат прошло долгий путь от приклеивания медной фольги к диэлектрику и ручного лужения, до сложных автоматизированных химических и электрохимических процессов. Качество, ремонтопригодность, а также габаритные размеры готовой продукции во многом зависят от качества изготовления печатных плат.
Перечень технологических операций входящих в процесс производства печатных плат:
1) нарезка заготовок и образование базовых отверстий — в производстве нарезку материала выполняют методом штамповки с одновременной пробивкой базовых отверстий на технологическом поле;
2) химическая металлизация печатных плат заключается в последовательности химических реакций осаждения меди, используемой в качестве слоя, или подслоя при нанесении основного слоя токопроводящего рисунка гальваническим способом;
3) гальваническая металлизация применяются для увеличения тонкого слоя химической меди с целью последующего нанесения на поверхность проводящего слоя;
4) нанесение рисунка схемы на печатные платы или их слои необходимо для получения защитной маски требуемой конфигурации при осуществлении процессов и травления проводящего слоя;
5) травление меди с пробельных мест - формирование проводящего рисунка схемы;
6) удаление защитной маски после операций травлений;
7) оплавление металлорезиста — гальванически нанесенный металлорезист олово-свинец;
8) нанесение защитного покрытия на плату наносится в специальной распылительной камеры, в качестве защитного материала может использоваться лак, флюсы ацитоноканифольные или спиртоканифольные.
Одной из основных стадий процесса производства ПП является создание проводников электрического тока на поверхности диэлектрического материала путем нанесения гальванического покрытия — меди.
Гальваническую металлизацию в производстве ПП применяют:
- для образования проводящего рисунка схемы с толщиной меди в отверстиях не менее 25 мкм;
-
для предварительного увеличения тонкого слоя химической меди до
толщины 5‒8 мкм с
целью последующего формирования рисунка схемы; для нанесения металлического
резиста, например олово-свинец, толщиной 10‒20 мкм либо специальных покрытий золотом,
серебром толщиной 2‒5 мкм.
1.2. Гальваническое осаждение меди
Для гальванического осаждения меди разработано большое количество электролитов, которые, обычно, разделяют на две группы: кислые и щелочные.
1.2.1. Кислые электролиты
К кислым электролитам относятся сульфатные и фторборатные электролиты. Их основные достоинства — простота состава и устойчивость в эксплуатации, но они обладают низкой рассеивающей способностью. Также из них невозможно непосредственно меднить сталь из-за выпадения контактной меди, а, следовательно, плохое сцепление со сталью слоя меди. Вследствие этого меднение осуществляется после предварительного осаждения медного слоя (3-4 мкм) из щелочных электролитов или после осаждения никелевого слоя (3-5 мкм).
Из кислых электролитов наиболее распространен сульфатный электролит. Основными компонентами сульфатных электролитов являются сульфат меди и серная кислота.
Предполагается, что на катоде разряд двухвалентных ионов меди протекает в две стадии:
Cu2+ → Cu+ → Cu0.
Причем, замедленной стадией является:
Cu2+ + e— → Cu+.
Доля каждой стадии зависит от состава электролита и режима электролиза: плотности тока, температуры перемешивания. Электропроводность нейтральных растворов сульфата меди невелика, поэтому в них добавляют серную кислоту, которая значительно повышает электропроводность растворов температуры перемешивания.
Выход меди по току составляет практически 100 %, так как выделение водорода на катоде не происходит, поскольку потенциалы выделения меди имеют более положительные значения, чем потенциалы выделения водорода.
Повышение
кислотности электролита способствует уменьшению растворимости сульфата меди,
что приводит к снижению верхнего предела допустимой плотности тока. Для
увеличения концентрации ионов меди в прикатодном слое применяют перемешивание.
В этом случае кислотность электролитов можно увеличивать. Чем интенсивнее
перемешивание, тем выше может быть содержание серной кислоты. Повышение
температуры способствует увеличению растворимости сульфата меди: при 25 °С-
23,05 г CuSO4 на 100 г воды; при 100 °С — 73,6 г. Повышенная кислотность
способствует получению более мелкокристаллических осадков.
Вблизи анодов наряду с ионами Cu2+ в растворе могут находиться в незначительном количестве ионы одновалентной меди, образующиеся в результате протекания реакции:
Cu + Cu2+ → 2Cu+.
При накоплении в растворе ионов Cu+ равновесие будет сдвигаться влево, и металлическая медь будет выпадать в виде осадка.
При недостаточной кислотности раствора сульфат одновалентной меди будет гидролизоваться с образованием Сu(ОН)2 или Сu2О
Cu2SO4 + H2O ↔ Cu2O + H2SO4.
В результате в электролите будут взвешенные частицы металлической меди и оксида меди, которые, включаясь в катодный осадок, делают его темным, шероховатым, а иногда - рыхлым.
Присутствие серной кислоты способствует протеканию реакций окисления одновалентной меди:
Cu2SO4 + H2SO4 + 1/2О2 → 2CuSO4 + Н2О;
Cu2O + 2H2SO4 + 1/2O2 → 2CuSO4 + 2H2O.
Таким образом, серная кислота прежде всего нужна для предупреждения накопления ионов Cu+ и гидролиза ее солей.
В сульфатные электролиты иногда вводят поверхностно-активные вещества. Эти вещества вводят для повышения катодной поляризации, что способствует получению более мелкозернистых плотных, иногда блестящих, осадков. Благоприятное действие этих добавок сказывается в том, что они предупреждают образование наростов на краях и выступающих частях деталей. Наилучшими добавками являются декстрин (не более 1 г/л).
Для получения блестящих медных покрытий предложено большое количество блескообразующих добавок, обеспечивающих зеркальный блеск покрытий, придающих им пластичность и снижающих внутренние напряжения.
При работе с электролитами для получения блестящих покрытий особое внимание следует уделять анодам. Используют аноды марки АМФ, не дающие шлама и содержащие 0,03‒0,06 % фосфора. В остальных случаях применяют аноды из чистой рафинированной меди (99,9 %), содержащей не более 0,1 % примесей.
Взвешенные частицы шлама обычно являются причиной грубого шероховатого осадка. Для предотвращения попадания шлама в электролит рекомендуется аноды помещать в чехлы из кислотостойкого материала и вести непрерывную фильтрацию электролита.
На качество получаемых блестящих покрытий большое влияние оказывает концентрация ионов Сl—.При пониженной концентрации снижается блеск покрытий и образуются прижоги на острых кромках деталей, при повышенном содержании образуются полосы на покрытиях.
Вредными примесями в медных сульфатных электролитах являются мышьяк, сурьма, некоторые органические вещества, образующие коллоидные растворы, анодный шлам.
Кроме сульфатных, используют фторборатные электролиты. Эти электролиты обладают высокой устойчивостью; получающиеся покрытия плотные и мелкокристаллические, рассеивающая способность электролитов примерно такая же, как у сульфатных. Большая растворимость фторбората меди позволяет применять повышенные плотности тока. Из этих электролитов осаждать медь непосредственно на стальные детали нельзя; необходим подслой никеля или меди из цианидных электролитов.
1.2.2. Щелочные электролиты
К щелочным электролитам относятся цианидные, пирофосфатные и этилендиаминовые электролиты. Основные достоинства: высокая рассеивающая способность, получение мелкокристаллических осадков, возможность непосредственно меднить стальные детали.
Довольно распространены цианидные электролиты. Условия осаждения меди из цианидных электролитов существенно отличаются от условий осаждения в кислых электролитах.
В цианидных электролитах медь находится в составе комплексных ионов. Степень диссоциации, а, следовательно, и активность ионов меди очень мала. Поэтому потенциал выделения меди в них примерно на 0,9‒1,2 В отрицательнее, чем в сульфатных растворах.
При малом количестве цианида аноды пассивируются. При недостаточном количестве свободного цианида, когда происходит пассивация анодов и на них разряжаются ионы ОН‒ с выделением кислорода, то не весь образующийся кислород выделяется в виде газа, а часть его расходуется на окисление цианида в цианит. Уменьшение содержания цианидов происходит также из-за взаимодействия их с углекислотой воздуха и образования карбонатов (NаCN→ Nа2CO3 ).
Содержание свободного цианида оказывает на катодный и анодный процессы противоположное влияние: для катодного процесса требуется минимальное содержание цианидов, для анодного — максимальное. При недостатке свободного KCN на анодах образуется зеленоватая пленка CuCN из-за того, что ионы меди не в состоянии перейти в комплексное соединение. Свободная поверхность анода уменьшается, плотность тока растет, и анодное растворение происходит с образованием ионов двухвалентной меди, которые в виде нерастворимого гидрата осаждаются на аноде. При этом аноды пассивируются и наблюдается интенсивное выделение кислорода.
Основными компонентами медных цианидных электролитов являются комплексный цианид меди и свободный цианид натрия. Степень диссоциации комплексных ионов очень мала и уменьшается с увеличением содержания CN‒ в комплексе. Этим, по-видимому, объясняется повышение катодной поляризации при увеличении содержания свободного цианида в электролите.
Содержание меди в электролите во время работы обычно уменьшается вследствие недостаточной растворимости анодов. Снижение концентрации ионов меди в электролитах приводит к образованию пористых осадков. Работая с малоконцентрированными медными электролитами, можно применять только пониженные плотности тока.
Постоянным компонентом цианидных электролитов является карбонат. Он накапливается в результате окисления цианида кислородом воздуха, особенно при нагревании:
2NаCN + 2Н2О + 2NаOH + О2 = 2Nа2CO3 + 2NH3.
Присутствие карбонатов в небольших количествах полезно, поскольку при этом повышается электропроводность электролитов. Однако при их накоплении свыше 70 г/л, а в концентрированных — до 140 г/л аноды проявляют склонность к пассивированию, а покрытия получаются пористыми. Карбонаты можно удалять при помощи хлорида бария и вымораживанием, охлаждая электролит до ‒ 5 °С. Карбонаты натрия легче выпадают в осадок, чем калиевые. Сульфаты существенного влияния на процесс электролиза не оказывают.
Введение в электролит депассиваторов, в качестве которых применяют сегнетову соль KNаC4H4O6·4H2O и роданид калия KCNS, позволяет повысить рабочую плотность тока и устранить пассивацию анодов, но при этом следует одновременно повышать температуру электролита.
Высококонцентрированные по меди электролиты, содержащие депассиваторы, позволяют применять высокие плотности тока (до 10 А/дм2) при повышенной температуре и перемешивании. При этом возможно получить выход по току, близкий к 100 %.
Сульфиды, вводимые в электролит, играют роль восстановителя, предупреждая накопление в ванне ионов меди Cu2+[5, 6].
Для замены ядовитых цианидных электролитов применяют пирофосфатные и этилендиаминовые электролиты.
Из пирофосфатных электролитов получают медные осадки с мелкозернистой структурой. При нанесении тонких слоев осадки получаются гладкими, блестящими или полублестящими. Преимущества пирофосфатных электролитов перед кислыми заключаются в высокой рассеивающей способности и возможности непосредственно проводить меднение стальных деталей в разбавленном пирофосфатном электролите.
Основные компоненты пирофосфатных электролитов: CuSO4 или Сu2Р2О7 и К4Р2О7 или Nа4P2O7. В растворах в присутствии Nа4P2O7 образуется комплексная соль Nа6[Cu(P2O7)2]. При избытке свободного пирофосфата может образовываться Nа2[Cu(P2O7)2]. Константы нестойкости комплексов [Сu(Р2О7)2]6‒ и [Сu(Р2О7)2]2‒ соответственно равны 3·10‒3 и 2·10‒9.
В щелочных растворах при рН = 8 и достаточном избытке свободных ионов Р2О74‒ медь находится преимущественно в виде шестизарядных комплексных ионов [Сu(Р2О7)2]6‒.
В пирофосфатные электролиты вводят азотнокислый аммоний NH4NO3, который способствует повышению допустимой катодной и анодной плотностей тока и улучшает качество осадков. Из пирофосфатных электролитов можно получать блестящие осадки. В качестве блескообразующих добавок вводят Nа2SeO3 совместно с лимонной или триоксиглутаровой кислотой, 2-меркаптотиазол и другие вещества.
При повышенных плотностях тока может происходить пассивация анодов за счет образования на их поверхности труднорастворимой оксидной или солевой пленки. Введение в электролит NH4OH, Nа2HPO4·12H2O, NH4NO3, сегнетовой соли, лимонной кислоты и других добавок улучшает работу анодов и повышает допустимую анодную плотность тока [1, 2]. Катодный потенциал меди в пирофосфатных электролитах имеет более отрицательное значение, чем в кислых электролитах.
Большая катодная поляризация объясняется пассивированием поверхности катода вследствие адсорбции ионов Р2О74‒ или образования оксидных (Сu2О8) и труднорастворимых соединений (Сu2Р2О7) в виде фазовой пленки.
Предполагают, что выделение меди на катоде из пирофосфатных растворов происходит в результате восстановления двухзарядных комплексов:
CuP2O72- + 2e— → Cu + Р2О74-,
образующихся при диссоциации шестизарядных комплексов:
Cu(P2O7)26‒ → CuP2O72‒ + Р2О74‒.
Повышение температуры ускоряет выделение меди, что связано как с ускорением диффузии комплексных анионов к катоду, так и с облегчением их разряда.
Анодный выход по току в этих электролитах несколько выше катодного, поэтому при корректировке нет необходимости добавлять медные соли. Анодную плотность тока рекомендуется поддерживать в пределах 2‒4 А/дм2. При более низкой плотности тока растворение идет недостаточно быстро, при более высокой — на поверхности анодов образуется труднорастворимая оксидная пленка.
Для предотвращения пассивации анодов необходимо достаточное количество свободных анионов Р2О74‒ и достаточно высокое значение рН раствора. Повышение температуры способствует отводу продуктов реакции и, следовательно, уменьшению пассивации анодов. Для этой же цели в электролиты вводят депассиваторы, которые способствуют снижению активности ионов Cu2+ в прианодном пространстве.
При работе пирофосфатных ванн меднения рекомендуется проводить фильтрацию электролита: для полублестящих осадков — периодически или непрерывно, для блестящих - непрерывно.
Составы растворов электролитов и технологические режимы процесса гальванического меднения
|
Тип |
Номер состава |
Состав электролита |
Режим обработки |
Дополнительные указания |
||
|
Компонент |
Коли-чество, г/дм3 |
Темпе-ратура, 0С |
Плотность тока, А/дм2 |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Кислые электролиты |
1 |
CuSO4∙5H2O H2SO4 |
150-250 50-70 |
18-25 |
1-3 |
При плотности тока более 2 А/дм2 обработку проводят барботажом сжатым воздухом |
|
Кислые электролиты |
2 |
CuSO4∙5H2O H2SO4 NаCl Блеско- образователь |
180-220 45-65 0,05-0,15 4-6 |
20-30 |
0,8-9 |
Обработку проводят перемешиванием электролита сжатым воздухом и фильтрацией электролита; iа=0,4-5 А/дм2; аноды — медные с фосфором |
|
3 |
Cu(BF4) HBF4 H3BO3 |
200-225 5-20 20-35 |
15-30 |
2-6 |
||
|
Щелочные электролиты |
4 |
CuCN NаCN NаOH |
20-30 5-10 5-10 |
15-55 |
0,3-2 |
Допускается наличие углекислого натрия до 80 г/дм3 |
|
5 |
CuSO4∙5H2O K4P2O7 NH4OH 25%p-p H4P2O7 Аммоний лимонно-кислый |
75-100 300-375 2-15 1-10 15-25 |
50-75 |
0,5-5 |
||
|
6 |
CuSO4∙5H2O Этилендиамин (NH4)2SO4 |
180-250 90-125 60 |
20-40 |
0,5-3 |
||
Особенностью этилендиаминовых электролитов меднения является возможность непосредственного меднения стальных деталей. Детали в ванну загружают под током плотностью в 5 раз превышающей рабочую. Составы большинства электролитов меднения приведены в таблице.
1.3. Подготовка поверхности перед гальваническим осаждением металлов.
Подготовка поверхности является неотъемлемой и весьма существенной операцией всего технологического процесса нанесения металлических покрытий. Основное требование ‒ прочность сцепления между основой и металлическим покрытием ‒ может быть удовлетворено только в том случае, если между ними нет посторонних загрязнений, чаще всего в виде жиров и окислов. Она включает: механическую обработку, обезжиривание моющими растворами, электрохимическую обработку и травление.
1.3.1. Подготовка металлической поверхности.
Механическая обработка детали выбирается с тем расчетом, что после нанесения покрытия класс чистоты поверхности снизится на 1‒2 единицы в зависимости от металла покрытия и его толщины. Особое внимание следует обратить на резьбовые соединения, которые могут потребовать дополнительной обработки после покрытия.
После тщательной промывки в горячей проточной воде детали отправляют в ванну электрохимического обезжиривания, где анодно (за счет подтравливания) или катодно (под током выделяющегося водорода) снимаются остатки загрязнений. Поверхность считается чистой, если после окунания вода стекает сплошной пленкой, т.е. при достижении полной смачиваемости поверхности.
Процесс травления зависит от материала деталей, конструкции и наносимого покрытия. Большие проблемы возникают при наличии окалины, возникающей в процессе механической обработки. Недопустимо обрабатывать сборочные узлы, паяные соединения, т.к. возможны подтравливание поверхности.
В зависимости от назначения покрытий, метода их нанесения и операций, предшествующих процессу нанесения покрытий, подготовку поверхности основного металла ведут различными способами. При горячем методе нанесения защитных покрытий подготовка поверхности сводится к обезжириванию и травлению. Если перед покрытием изделия подвергались отжигу, при котором жиры сгорают, то можно ограничиться одним травлением. Такая же подготовка поверхности необходима перед нанесением антикоррозионных (недекоративных) покрытий гальваническим путем, если изделия предварительно подвергались термической обработке.
Если перед гальваническим покрытием изделия подвергались обработке резанием или давлением в присутствии смазки, то поверхность их становится гидрофобной ‒ не смачивается водными растворами солей и кислот. В этих случаях подготовка поверхности начинается с растворения минеральных жиров в органических растворителях, после чего удаляют окислы.
Более сложная подготовка поверхности перед нанесением защитно-декоративных покрытий (медных, никелевых, хромовых, серебряных). В этом случае недостаточно удаления жиров и окислов. Необходима тщательная механическая обработка с применением тонких абразивов с целью получения максимально гладкой поверхности. Такая подготовка необходима главным образом потому, что в процессе нанесения защитно-декоративных покрытий дефекты поверхности не только не исчезают, но часто становятся более рельефными, так как плотность тока и толщина покрытий на макровыступах больше, чем в макроуглублениях.
1.3.2 Подготовка поверхности диэлектрика.
Механическая подготовка крупных и средних деталей, осуществляемая для получения микрошероховатости поверхности часто заключается в мокрой или сухой абразивной обдувке сжатым воздухом давлением 0,1‒0,6 Мпа или обработке абразивными кругами и лентами на шлифовально-полировалных станках. Мелкие детали массового производства галтуют с абразивом во вращающихся барабанах или колоколах, а также в виброустановках.
Удаление различных загрязнений, образующихся на поверхности диэлектриков в процессе механической или иной обработки, при хранении и транспортировании, удаляются в щелочных растворах или органических растворителях. Обработку проводят путем погружения деталей в раствор, в парах органических растворителей, струйным методом. Их выбор, а также выбор состава раствора и оборудования производится в зависимости от вида, степени загрязнения поверхности и природы диэлектрика. При этом подбирают такие составы и режимы обработки, при которых легко удаляются жировые загрязнения, а обрабатываемый материал не растворяется, не набухает и не растрескивается. Используемые для обезжиривания щелочные растворы в основном те же, что и для металлов.
Непосредственно перед травлением в некоторых случаях выполняют операцию предтравления, которая включает обработку поверхности диэлектрика органическими растворителями, их смесями или эмульсиями, растворами кислот, щелочей, солей. К предтравлению также относят термообработку, облучение, обработку ультразвуком, и другие виды воздействия. Кондиционирование снимает или разрыхляет поверхностный слой, способствуя улучшению травимости диэлектрика. Одновременно снижаются продолжительность и температура травления, удлиняется период эксплуатации раствора.
Травление представляет собой химический процесс, в результате которого изменяются структура и химические свойства поверхности диэлектрика. При этом ей придают требуемые шероховатость, гидрофильность и способность к реакции при выполнении последующих операций нанесения покрытия.
1.4 Рассеивающая способность.
Качество и свойства электрохимических покрытий определяются не только структурой, но и равномерностью распределения металла по толщине слоя на поверхности покрываемых изделий. Согласно закону Фарадея, толщина d электрохимических покрытий зависит от плотности тока i , продолжительности электролиза τ и с учетом выхода по току ВТ металла и его электрохимического эквивалента g может быть вычислена по формуле
Расчет по формуле (1.1) дает лишь среднюю толщину покрытия. На практике ток распределяется по поверхности электрода неравномерно, поэтому фактическая плотность тока и толщина покрытия на различных участках катода различны: на одних больше среднего значения, на других меньше. Это может отрицательно сказаться на свойствах покрытия, поскольку на отдельных участках его толщина может быть меньше минимально допустимой.
Распределение тока и металла по поверхности катода зависит:
1) от геометрических факторов размера и формы электродов и ванны, расположения электродов относительно друг друга и стенок ванны;
2) от электрохимических факторов электропроводимости электролита, характера изменения катодной поляризации и выхода по току металла с изменением плотности тока.
Различают первичное и вторичное распределение тока.
Первичное зависит только от соотношения геометрических параметров электролитической ванны. Оно наблюдается при отсутствии зависимости катотодной поляризации от плотности тока и одинаково для геометрически подобных систем любого масштаба.
Вторичное, или действительное, распределение тока отклоняется от первичного, как правило, в сторону большей равномерности.
Оно зависит от поляризуемости катода , удельной электропроводимости раствора х и геометрических размеров системы. Параметром, обобщающим действие геометрических и электрохимических факторов на распределение тока, является критерий электрохимического подобия Э, представляющий собой произведение
где l 0 — определяющий геометрический размер системы.
В геометрически подобных системах, чем больше критерий электрохимического подобия, тем более равномерно распределение тока.
Способность электролита изменять первичное распределение тока называют рассеивающей способностью электролита. Обычно этот термин употребляют и для оценки способности электролита давать равномерные по толщине покрытия на изделиях сложного профиля. Поэтому принято различать соответственно рассеивающую способность по току (РСТ ) и рассеивающую способность по металлу (РСМ ).
Современные представления о механизме перераспределения тока в электролитах основываются на теории полей поляризации. При прохождении тока через электролитическую ванну в ней возникает электрическое поле. Как и любое другое электрическое поле, поле в электролитической ванне может быть охарактеризовано функцией распределения в нем потенциала в виде математического уравнения, связывающего значение потенциала U электрического поля в данной точке с координатами этой точки х и у:
В каждой данной электролитической ванне уравнение имеет свой конкретный вид. Обычно функцию распределения потенциала в электрическом поле называют просто потенциалом данного поля. При отсутствии зависимости поляризации от плотности тока в электролитической ванне реализуется первичное поле, потенциал которого обозначается Ut и определяется только соотношением геометрических параметров ванны.
Появление на электродах поляризации, зависящей от плотности тока, можно рассматривать как появление так называемого поля поляризации, потенциал которого обозначается Uo. На значение Uo влияют геометрические параметры электролитической ванны и электрохимические характеристики электролита: электропроводимость и поляризуемость. Это поле Uo , суммируясь с первичным полем, дает в результате реально существующее на практике вторичное поле, потенциал которого обозначается U 2 . Очевидно, что:
Если поляризуемость стремится к бесконечности, то поле поляризации называют предельным полем поляризации, потенциал его равен. Вторичное поле в этом случае называют предельным полем, потенциал которого равен.
Чтобы оценить рассеивающую способность электролитов, применяют ячейки различных конструкций, в которых экспериментально определяют распределение тока и металла и полученные с исследуемыми электролитами результаты сопоставляют. Иногда распределение тока и металла определяют расчетным путем.[14] По этим данным обычно приводят качественную характеристику рассеивающей способности; считают, что она выше у того электролита , у которого вторичное распределение тока или металла в данной ячейке более равномерное.
1.5. Выводы по литературному обзору
В производстве ПП создание проводников электрического тока на поверхности и в отверстиях диэлектрического материала осуществляется путем нанесения меди гальваническим способом.
Нанесение медного покрытия возможно в кислых и щелочных электролитах. К кислым электролитам относятся сульфатные и фторборатные электролиты. Их основные достоинства — простота состава и устойчивость в эксплуатации, но они обладают низкой рассеивающей способностью.
К щелочным электролитам относятся цианидные, пирофосфатные и этилендиаминовые электролиты. Основные достоинства: высокая рассеивающая способность, получение мелкокристаллических осадков, возможность непосредственно меднить стальные детали
Для практических целей в гальванике в основном используют сернокислые и пирофосфатные электролиты меднения.
Подготовка поверхности является неотъемлемой и весьма существенной операцией всего технологического процесса нанесения металлических покрытий. Основное требование ‒ прочность сцепления между основой и металлическим покрытием. Подготовка поверхности включает в себя механическую обработку, обезжиривание и травление. Критерием оценки качественной подготовки служит полная смачиваемость металлизируемой поверхности.
Качество и свойства электрохимических покрытий определяется структурой и равномерностью распределения металла по толщине слоя на поверхности покрываемых изделий. Способность электролита изменять первичное распределение тока называют рассеивающей способностью электролита.
Рассеивающая способность электролита (РС) — это способность электролита давать равномерные по толщине покрытия на деталях сложного профиля или способность электролита изменять первичное распределение тока.
Распределение тока и металла по поверхности катода зависит: от размера и формы электродов и ванны, расположения электродов относительно друг друга и стенок ванны; от электрохимических факторов электропроводимости электролита, характера изменения катодной поляризации и выхода по току металла с изменением плотности тока.
Для осуществления быстрого исследования и тестирования работоспособности различных электролитов, применяемых в гальваническом производстве, используется электрохимическая ячейка с угловым катодом — ячейка Хулла.
Данная
статья является интеллектуальной собственностью ООО «НПП Электрохимия»
Любое копирование без прямой ссылки на сайт www.zctc.ru преследуется по
закону. Текст статьи обработан сервисом Яндекс «Оригинальные тексты»
Гальванопластика подручными средствами: часть2. Электролит
Итак, поскольку было немало желающих узнать больше о том, как просто и бюджетно попробовать себя в гальванопластике, пишу продолжение этого мастер-класса: часть 1. В этот раз я расскажу о приготовлении электролита. Мы занимаемся меднением, так что наш электролит состоит из: медного купороса, серной кислоты, воды.


Купить купорос можно в хозяйственных/цветочных/садовых магазинах. Для более серьезного занятия лучше купить химически чистый медный купорос и чистую серную кислоту или готовый сернокислый электролит. При нормальной эксплуатации одного литра (для мелких предметов) вам хватит очень надолго.
Скажу сразу, во избежание вопросов. Да, медный купорос — это отрава. Но для насекомых. Он практически безвреден для млекопитающих, коими, надеюсь, являются читатели сего МК 🙂 . Конечно, руки надо мыть хорошо.
Классический рецепт сернокислой медной ванны (грамм на литр воды):
Медный купорос ……………200—250
Серная кислота ……….. 50—70
Растворимость медного купороса снижается по мере увеличения концентрации серной кислоты. То есть концентрацию нужно примерно выжерживать, это не «допуски», это значит что надо стараться делать 200-50 или 250-70.
Это все теория. На практике, искать химически чистые вещества и работать с чистой кислотой — неохота. Так что мы идем в хозяйственный за медным купоросом, а потом в автомагазин за автомобильным электролитом — это вода с серной кислотой. Будьте осторожны! Не прижимайте к себе банку с электролитом, я так однажды лишилась куртки — верхний слой разъело. Можете капнуть электролит на бумажку и посмотреть, как ее сожжет кислота — она почернеет, а может даже рассыпется. После этого вам уже не нужно будет напоминать о технике безопасности 🙂
Итак — в топку теорию — к практике! Когда я первый раз разводила электролит, я сделала так (на 1л):
— разводим 200 г. медного купороса (пачка) в 0.5 л воды
— фильтруем полученный раствор (важно!!!!)
— доливаем 134 мл. автомобильного электролита (это две маленькие баночки из-под детского питания по 80 г)
— доводим дистиллированной водой до 1 л. и хорошо перемешиваем.
Теперь, если вы все-таки взяли где-то чистую серную кислоту. ПОМНИТЕ! Наливать только кислоту в воду, а никак не наоборот!!! И ооочень медленно. Иначе вода закипит и все это начнет брызгаться и разбегаться. Но, если у вас готовый автомобильный электролит, то вам это уже не грозит — он достаточно разбавлен. Медный купорос, для лучшего растворения, разводите в теплой воде.
Теперь о фильтрации — это очень важно!. Ведь купорос из хозяйственного магазина очень грязный, содержит примеси различных нерастворимых веществ. Потому профильтровать нужно хорошо. Можно это делать с помощью специальной фильтр-бумаги, если есть. Я делаю так: сначала фильтрую через вату, положенную на влажную салфетку, сверную вдвое. Салфетку нужно сначала выполоскать — она вся в креме или еще неизвестно в чем. Затем даю отстояться — внизу банки оседает муть, раствор приобретает прозрачность.Потом фильтрую еще раз, стараясь не слить муть со дна банки — ее слить в унитаз. По итогам у меня получилоь примерно 0.8 литра электролита. То есть
примерно 700 мл раствора (остальное слилось),
примерно 100 мл (93мл) автоэлектролита.
В процессе гальванизации электролит будет испаряться — это испаряется вода. Ее нужно просто иногда понемногу доливать.
Совет: возле вашей установки поставьте миску или банку с водой. Если вам нужно достать-посмотреть изделие, или вы на себя или еще куда-то случайно капнули — вы сможете быстренько ополоснуть это в банке, а потом уже промыть под краном как следует.
Еще совет: если у вас старая облупленная ванна — лучше не занимайтесь приготовлением электролита в ней, а выберете железную, или просто более новую эмалированную раковину. Поверхность без эмали замечательно красится в трогательный голубой цвет медным купоросом. Оттереть можно, но долго, нудно, и неохота.
Тот электролит, что не влезет к вам в емкость, просто налейте в банку, закройте, уберите в шкаф. Может пригодится потом.
Так или иначе — электролит в вашей установке будет загрязняться — его надо фильтровать, например раз в две недели. Пыль нападает, муха залетит, на вашей заготовке что-нибудь налипнет, да мало ли. Наличие примесей приведет к неравномерному осаждению меди.
И последнее на этот раз: существуют «присадки» для придания блеска или «блескообразователи». Они делают металл более хрупким, но изделие получается сразу блестящим, или, по крайней мере, с матовым блеском. Я, к сожалению, пока не могу посоветовать ничего конкретного — еще не разобралась чего и сколько. Но советую вам поискать, как ищу сейчас я. Шкурить столь сложную и тонкую поверхность (например листики) без бормашинки тяжко — блескообразователи могли бы помочь.
Постараюсь в ближайшие дни написать заключение — подготовка образца и сам процесс.
P.S.: По просьбе в комментариях, пишу дополнительно про меры безопасности: кислота хоть и разбавлена, но оставить легкий ожог и испортить любимую рубашку хватит. А вот если еще в глаз попадет…
Так что лучше работать хотябы в очках и перчатках, хотябы при смешивании электролита. Еще неплохо бы фартук, ну, и, разумеется, убрать подальше от детей!! Предлагаю вам просто попробовать действие электролита на разные материалы — капните по капельке, посмотрите что будет. Представьте себя на месте образца. Тогда Вам уже не нужно будет что-то объяснять. 🙂
Меднение в домашних условиях — 2 самых эффективных способа
Процесс меднения металлических изделий называется гальваностегией. Он основан на осаждении на поверхность деталей другого металла, растворимого в специальной жидкости.
Технология омеднения включает изготовление раствора и создание разноименных электродов. В процессе гальваностегии, ионы меди, растворенные в электролите, притягиваются отрицательным полюсом (обрабатываемая деталь) на свою поверхность.
Омеднение различных деталей в промышленных масштабах применяется не только, как конечный процесс обработки поверхности металлических изделий. Он может использоваться для подготовки деталей к следующей операции, например, никелированию, серебрению или хромированию изделий.
Эти металлы плохо осаждаются на поверхность стальных деталей, а на омедненную поверхность ложатся очень хорошо. В свою очередь медь, осевшая на стальные детали, держится прочно и способствует выравниванию различных дефектов на ее поверхности.
Видео урок по меднению пули своими руками
Меднение деталей в растворе с электролитом
Для металлических деталей можно выполнить меднение в домашних условиях. Рассмотрим меднение, с опусканием детали в раствор с электролитом. Для этого необходимо иметь:
- небольшие медные пластины,
- несколько метров токопроводящей проволоки;
- источник тока, с напряжением до 6 В;
- рекомендуется также использовать реостат, для регулирования тока и амперметр.
Порядок работы
- В качестве жидкости, хорошо растворяющей медь, применяется обычный электролит. Его можно купить или приготовить в домашних условиях. Для этого потребуется 3 мл серной кислоты, на каждые 100 мл дистиллированной воды. Необходимый раствор, можно получить, добавив в полученный электролит до 20 гр. медного купороса.
- Перед началом процесса меднения детали, ее необходимо очистить наждачкой, чтобы снять оксидную пленку с поверхности.
- Затем, деталь обезжиривается горячим содовым раствором, и промывается чистой водой.
- В стеклянную емкость, нужного объема, наливается приготовленный раствор электролита.
- Затем, туда опускаются две медные пластины, на токопроводящих проводах. Между двумя медными пластинами подвешивается, предназначенная для меднения в домашних условиях деталь, на аналогичном проводе. Необходимо проследить, чтобы медные пластины и деталь были полностью залиты раствором электролита.
- На следующем этапе, концы проводов от медных пластин подсоединяются к плюсовой, а обрабатываемая деталь к минусовой клеммам источника тока. Последовательно, в созданную электрическую цепь нужно подсоединить реостат и амперметр. После включения тока в цепи, он реостатом устанавливается в пределах 15 мА на 1 см? площади поверхности детали.
- Выдержав, обрабатываемую деталь в растворе, в пределах 15-20 минут, нужно выключить электропитание и извлечь изделие из раствора. За этот непродолжительный промежуток времени, поверхность детали покроется тонким слоем меди. Толщина покрытия будет зависеть от продолжительности процесса меднения. Таким образом, можно достичь меднения поверхности любого изделия слоем в 300 мкм и более.
Меднение детали, без опускания в раствор
Второй способ меднения в домашних условиях металлических изделий, подразумевает выполнение этого процесса без опускания обрабатываемой детали в раствор электролита.
Этот вариант подходит для нанесения покрытия на цинковые и алюминиевые изделия.
Порядок работы
- Для этого способа меднения потребуется многожильный медный провод, с двух концов которого, необходимо снять изоляцию. С одной стороны мягкий провод нужно растеребить. Таким образом получается изделие в виде кисточки. Чтобы удобнее в дальнейшем было работать, к этому концу провода нужно привязать твердый предмет в виде рукоятки. Второй очищенный конец провода нужно соединить к положительной клемме источника электрического тока. Напряжение не должно превышать 6 В.
- Ранее описанным способом нужно приготовить электролит, размешанный с медным купоросом. В этом методе меднения деталей, раствор можно наливать в любую посуду. Рекомендуется выбрать широкую тару, чтобы было удобно макать медную кисточку из проволоки. Далее необходимо небольшую металлическую деталь положить в эту посуду, с невысокими краями. Предварительно ее нужно очистить, прокипятить в жидкости со стиральным порошком, и промыть. Эту деталь нужно соединить с помощью провода к отрицательной клемме источника тока, с напряжением 6 В.
- Процесс меднения происходит следующим образом. Растеребленный конец медной проволоки нужно периодически обмакивать в растворе электролита, с медным купоросом и проводить вдоль детали, не прикасаясь «кистью» к ее поверхности. Но нужно предусмотреть, чтобы между концом кисти и деталью был небольшой слой раствора (катод и анод должны быть всегда смочены электролитом). В процессе меднения отрицательно заряженная деталь притягивает ионы меди и ее поверхность покрывается небольшим красным слоем. После нанесения покрытия, изделие нужно высушить и натереть до блеска.
Таким меднением, без погружения изделия в электролит, чаще обрабатываются детали больших размеров. Они не вмещаются в подобранную посуду с электролитом, и поверхность обрабатывается кистью небольшими участками.
Видео руководство по меднению деталей в домашних условиях
Процесс меднения в домашних условиях
Меднением называется процесс гальванического нанесения меди на различные поверхности. Слой меди обладает сильной адгезией к металлам, сглаживает дефекты покрываемой поверхности, имеет высокую электропроводность и пригоден для дальнейшей обработки. Меднение может использоваться как самостоятельный процесс, так и как часть более сложных (серебрение, никелирование, хромирование). Наряду с промышленным способом практикуется меднение в домашних условиях, позволяющее решить множество бытовых задач. Кроме высоких технических характеристик, данное покрытие прекрасно выглядит, что определяет его использование в различных дизайнерских решениях.
Технология меднения
В промышленных условиях меднение происходит в мощных гальванических ваннах, укомплектованных средствами автоматики и другим специальным оборудованием. Однако, этот процесс доступен для выполнения и дома, позволяя обойтись без сложной химической аппаратуры.
Последовательность технологических операций следующая:
1. С металлической поверхности удаляется оксидная пленка. Используется наждачная бумага, щетка, полировочные пасты;
2. Покрываемый предмет обезжиривается раствором соды и тщательно промывается водой;
3. В стеклянную емкость на медной проволоке погружаются две медные пластины (аноды), между ними подвешивается деталь;
4. Аноды подключаются к «плюсу» источника постоянного тока, а омедняемая деталь к «минусу»;
5. В электрическую цепь последовательно включается реостат, регулирующий силу тока, и амперметр. В качестве источника постоянного тока можно применить автомобильный аккумулятор или блок питания;
6. Электролит наливается в емкость таким образом, чтобы он полностью покрывал поверхность анодов. Выполнять эту операцию следует особенно аккуратно, не допуская попадания едкой жидкости на открытые участки тела!
7. Плотность тока устанавливается на уровне 2А на дм2 обрабатываемой поверхности, температура электролита: 20–26 градусов, продолжительность обработки: 20-25 минут;
8. Омедненная деталь извлекается из емкости, процесс закончен. Толщина медного слоя может быть увеличена за счет большего времени пребывания детали в гальванической ванне.
Состав электролита не сложен: кислота серная – 40 г, сернокислая медь – 190 г, вода – 980 г.
Несколько советов по меднению:
- сернокислую медь можно приобрести в магазинах для садоводов и огородников, а серную кислоту и дистиллированную воду — в автомагазинах;
- в качестве гальванической ванны необходимо использовать емкость из материала, устойчивого к действию агрессивных сред. Можно взять стеклянную банку или небольшую пластмассовую канистру;
- чтобы слой наносимой меди не получился рыхлым, следует максимально тщательно отполировать подготавливаемую поверхность. Кроме того, рабочий ток должен быть не слишком большим. Потеря времени будет компенсирована качеством получившегося изделия.
Примеры меднения своими руками
Иногда требуется заменить вышедшую из строя медную мебельную фурнитуру, а в продаже имеются только никелированные изделия. В этом случае можно легко собрать установку для нанесения меди. Необходимые приборы и материалы: блок питания 12 В / 3 А, серная кислота и медный купорос.
Сначала необходимо удалить никелировку. Для этого деталь удерживается пинцетом, на который подается «минус» от блока питания. Тряпочкой, закрепленной на
плюсовом электроде, смоченной в 5% серной кислоте, протирается поверхность изделия.
При снятии никелировки образуются ядовитые пары, от которых необходимо защищать органы дыхания. Желательно использовать специальные очки и респиратор с угольным фильтром. Очищенная поверхность полируется.
Следующий шаг – сборка простейшей гальванической установки. В банку помещается медный электрод, соединяемый с «плюсом» БП, и обрабатываемая деталь, подключаемая к «минусу».
Заливается электролит, состоящий из медного купороса, воды и 5% серной кислоты в пропорции 1/5/3 и подается ток. Готовые изделия полируются до приятного блеска.
Для домашнего меднения существует множество различных применений. Наносить медь можно на алюминиевые столовые приборы, давая им вторую жизнь, на рыболовные блесны, подсвечники и многое другое. Особенно впечатляют работы, в которых декоративное покрытие нанесено на неметаллические предметы: стебли растений, листья, желуди и даже на высушенных насекомых. Природная фактура исходного материала, сочетаясь с красотой гальванического покрытия, создает неповторимый художественный эффект.
Технология изготовления подобных изделий несколько сложнее, но вполне осуществима дома. В покрываемом материале отсутствует токопроводящий слой, поэтому вместо него используется специальный электропроводный лак, наносимый на поверхность. Рецептура лака включает в себя органические растворители, пленкообразователи и тонкодисперсный графитовый порошок, обеспечивающий электропроводность.
Лак наносится тонким слоем на сухое растение, высыхает, и через час все готово для меднения. После гальванической обработки можно дополнительно улучшить внешний вид изделия. Существует несколько способов придания гальванической меди различных цветовых оттенков, в том числе с помощью патинирования, химического окрашивания и оксидирования.
Качество художественных работ, полученных по этим технологиям, находится на уровне настоящих ювелирных украшений.
Уважаемые читатели, комментируйте статью, задавайте вопросы, подписывайтесь на новые публикации — нам интересно ваше мнение 🙂
Статьи, которые Вам будут интересны:
Влияние анодного материала на качество нанесения гальванических медных покрытий
Шлам представляет собой выкрошившиеся кристаллики металла, окислы, межкристаллические включения и пр. Этот шлам легко взмучивается в ванне, осаждается на покрываемую поверхность, ухудшая внешний вид и качество покрытия. Чтобы шлам не попадал в ванну, на аноды надевают анодные мешки с завязками, удерживающими их от сползания. Мешки шьют из хлориновой ткани хлориновыми нитками, вытянутыми из самой ткани. Верхний край мешка должен быть на 50-70 мм выше зеркала электролита, чтобы шлам не мог выплеснуться в ванну. На каждый анод лучше надевать по два мешка один на другой (для гарантии непрорыва). Перед употреблением мешки необходимо выдержать в 5 % серной кислоте, промыть водопроводной водой, затем — деионизованной; их необходимо периодически снимать с анодов, стирать и перед повторным применением внимательно проверять на целостность. Медные аноды для классических процессов кислого меднения должны содержать не менее 0,02 % фосфора. Аноды, не содержащие фосфор, негативно влияют на процесс металлизации, а также растворяются с образованием шлама. Производители предлагают медные аноды с широким диапазоном со- держания фосфора от 0,03 до 0,16 %. Неравномерное распределение фосфора в объеме анода ухудшает процесс металлизации, как и неправильно выбранное его содержание.
Для электролитов меднения, применяемых при изготовлении печатных плат, используются меднофосфористые аноды марки АМФ (ГОСТ 767-70), содержащие от 0,02 до 0,1 % фосфора, растворяющиеся равномерно без образования шлама. При более высоком содержании фосфора (0,13 %) на аноде образуется пассивная пленка, что сопровождается значительным увеличением переходного сопротивления на границе медь-электролит вплоть до прекращения процесса при ia=2,5 А/дм2 . При малом его содержании (менее 0,02 %) аноды начинают шламить, т. е. образующиеся при растворении одновалентные ионы меди не связываются фосфором, и в результате реакции 2Cu+ à Cu0 + Cu2+ частицы металлической меди образуют шламы.
Перед завешиванием в ванну новые медные аноды необходимо подтравить в растворе персульфата аммония (200-250 г/л + 5-7 г/л серной кислоты) или в растворе азотной кислоты, разбавленной 1:3 с водой, чтобы убрать верхний окисный слой.
Если аноды АМФ горячекатаные, то поверхностный слой вследствие выгорания фосфора обеднен им, по- этому такие аноды рекомендуется выдержать в раство- ре персульфата аммония 20-30 минут для растворения наружного слоя толщиной 40-50 мкм.
Анодный выход по току с увеличением анодной плотности тока снижается за счет пассивирования анода, затрудняющего его растворение. Простейшим и самым распространенным способом улучшения растворимости анодов считается способ снижения плотности анодного тока путем завешивания в ванну анодов с большей площадью, чем покрываемая поверхность. Для стабилизации анодного процесса, предотвращения пассивации анодов, улучшения их растворимости желательно иметь анодную поверхность, в 2-3 раза превосходящую катодную и не изменяющуюся при эксплуатации ванн.
Длина анода должна быть подобрана таким образом, чтобы нижний край печатной платы находился на уровне (и даже несколько ниже) нижней кромки анодов, иначе появляется значительная концентрация тока на нижних краях платы, и медь начинает «гореть». Расстояние между анодом и платой должно быть не менее 20 см. Зазор между анодами на одной штанге не должен превышать половины расстояния между анодами и покрываемой площадью для обеспечения равномерности осаждаемого медного слоя на заготовки печатных плат. Для наращивания 25 мкм меди на 1 дм2 поверхности печатной платы с двух сторон необходимо израсходовать 4,47 г медного анода.
В настоящее время в качестве анодного материала при электрохимическом меднении традиционно используют медные пластины или бруски, что не всегда позволяет сохранять постоянство анодной поверхности.
Важнейшим фактором при проведении гальванического осаждения металла является необходимость поддерживать определенное соотношение анодной и катодной поверхностей. Это соотношение должно сохраняться постоянным, поскольку его изменение вызывает ряд проблем, таких как:
- избыточное шламообразование;
- повышение эксплуатационных расходов;
- неравномерное осаждение.
По мере растворения поверхность плоского анода значительно уменьшается, что создает определенную трудность в сохранении постоянной площади поверхности анода.
При применении брусков в корзинах картина меняется в лучшую сторону. Но здесь возникает проблема «зависания» брусков в корзине. Зависшие бруски могут перекрывать друг друга с образованием пустот, что также приводит к неравномерному осаждению металла.
Шаровые аноды не подвержены процессу «зависания» РИС 1. Они непрерывно оседают на дно корзины, не мешая друг другу РИС 2. Поэтому анодная поверхность остается постоянной, и соблюдается соотношение анод- ной и катодной поверхностей.
В качестве материала для изготовления анодных корзин при гальваническом меднении рекомендуется использовать титан РИС 3. На титане в присутствии ничтожных следов кислорода или иных окислителей образуется тонкая непроводящая окисная пленка. Такая пленка разрушается только в присутствии ионов фтора. При пользовании титановыми корзинами необходимо, чтобы корзина была всегда наполнена анодным материалом выше верхнего края покрываемой площади. Титановая корзина может находиться без тока в неработающей ванне.
Медные шаровые аноды по сравнению с традиционными (в виде полос) позволяют вести процесс нанесения покрытий при постоянных технологических режимах на высоких плотностях тока с практически полным использованием меди. При этом получаются беспористые мелкокристаллические покрытия.
Применение плоских анодов и брусков в корзинах требует периодического контроля их состояния. Каждый анод нужно проверить для определения степени его растворения и необходимости замены. Также должна быть проверена каждая анодная корзина с брусками, что включает развязывание и последующее завязывание анодных мешков, встряхивание корзины для оседания брусков в корзине и освобождения места для введения дополнительного анодного материала. Если брусок встал поперек корзины, то приходиться выгружать всю корзину и заполнять ее заново.
Ручное обслуживание мешков и корзин сокращает срок службы оборудования: мешки рвутся, корзины ломаются, повреждаются электрические контакты. В то же время равномерное оседание, характерное для шаров, означает, что регулярное добавление анодного материала может производиться без остановки процесса электроосаждения.
Для поддержания постоянной анодной поверхности необходимо часто менять вырабатывающиеся плоские аноды. Во многих случаях не происходит и 50 % растворения таких анодов. Использование шаровых анодов устраняет данную проблему, т. к. шары растворяются полностью, обеспечивая экономичность процесса.
Для правильного протекания процесса гальванического осаждения меди в ванне должно быть определенное количество анодов. Рассмотрим, как меняется количество анодного материала различной конфигурации при одной и той же эффективной анодной поверхности.
За эффективную анодную поверхность — 186 дм2 (в данном случае) принята поверхность, обращенная к катоду (на практике в процессе электроосаждения участвует также как минимум 30 % поверхности анода, обращенной к стенке ванны). Данная анодная поверхность используется в гальванических ваннах с окном завеса заготовок печатных плат размером 1×1 м.
Важнейшим фактором при проведении гальванического осаждения металла является необходимость поддерживать определенное соотношение анодной и катодной поверхностей. Это соотношение должно сохраняться постоянным, поскольку его изменение вызывает ряд проблем
- Плоские аноды. Используются два ряда анодов по 16 штук в каждом, то есть 32 анода размером 0,508×0,762×7,62 дм. Эффективная анодная поверхность при этом составила 175 дм2, общий вес анодов ~ 768 кг.
- Бруски. Используются два ряда корзин по 8 корзин в каждом (всего 16 корзин). Размер корзины 7,6×1,53×0,77 дм. Эффективная анодная поверхность при этом составила 180,6 дм2, вес меди в одной корзине — 50,5 кг. Общий вес анодов 808 кг.
- Шаровые аноды. Используются такие же корзины, но более узкие (0,38 дм), вес меди в одной корзине составляет 26 кг, а в 16 — 456 кг. Эффективная анодная поверхность — 180,6 дм2.
Как показывают расчеты, использование шаровых анодов позволяет значительно снизить количество анодного материала при той же эффективной анодной поверхности. Необходимо отметить, что расчеты не учитывают увеличение площади поверхности в корзинах за счет использования шаров. Для наращивания 25 мкм меди на 1 дм2 поверхности печатной платы с двух сторон необходимо израсходовать 4,47 г медного анода.
Для нормальной стабильной работы электролита меднения и получения качественного медного покрытия очень важно следить за состоянием анодов. А для уменьшения трудоемкости, повышения рентабельности производства, снижения капитальных затрат рекомендуется использовать титановые корзины с медными шариками вместо плоских анодов и брусков. В настоящее время шаровые аноды широко используются на многих крупных предприятиях, постепенно вытесняя традиционные анодные материалы.
- Справочное руководство по гальванотехнике. Ч. 1. Перев. с нем. Москва: Металлургия, 1972.
- Журнал «Гальванотехника и обработка поверхности». № 4’ 1993.
- А. Медведев. Технология производства печатных плат. Москва: Техносфера, 2005.
- Краткий справочник гальванотехника. Ямпольский А. М., Ильин В. А., Л. «Машиностроение», 1972 г.
- С. С. Виноградов. Организация гальванического производства. Оборудование, расчет производства, нормирование. /Под редакцией проф. В. Н. Кудрявцева. — Изд. 2-е, перераб. и доп.; «Глобус». М., 2005.
- В. А. Ильин. Химические и электрохимические процессы в производстве печатных плат. Выпуск 2. Приложение к журналу «Гальванотехника и обработка поверхности». Москва, 1994.
- Технологии в производстве электроники. Часть II. Справочник по производству печатных плат / Под редакцией П. Семенова. М.: ООО «Группа ИДТ», 2007.
- Технологии в электронной промышленности. № 3’ 2006.



