Галогениды (минералы) — Википедия
Материал из Википедии — свободной энциклопедии
Представитель минералов класса галогенидов — флюоритГалогениды — группа минералов, представляющих собой соединения галогенов с другими химическими элементами или радикалами.
К галогенидным минералам относятся фтористые, хлористые и очень редкие бромистые и иодистые соединения. Фтористые соединения (фториды), генетически связаны с магматической деятельностью, они являются возгонами вулканов или продуктами гидротермальных процессов, иногда имеют осадочное происхождение.
Галогенидные минералы являются oсадками морей и озёр и главными минералами соляных толщ и месторождений. Некоторые галогенные соединения образуются в зоне окисления сульфидных (медных, свинцовых и других) месторождений.
Типичные минералы класса фторидов — виллиомит NaF, флюорит CaF2, криолит Na3AlF6; класса хлоридов — галит NaCl, сильвин КCl, карналлит KMgCl3·6(H2O). Сырьё в пищевой, химической, металлургической промышленности
- Минералогия и петрография,. — М.: Государственное научно-техническое издательство литературы по геологии и охране недр, 1958. — С. 179.
|
|
ГАЛОГЕНИДЫ, хим.
соед. галогенов с др. элементами. К галогенидам обычно относят соед., в к-рых атомы галогена
имеют большую электроотрицательность, чем др. элемент. Галогенидов не образуют Не, Ne
и Аг. К простым, или бинарным, галогенидам ЭХn (n-чаще всего целое
число от 1 у моногалогенидов до 7 у IF Степень окисления галогенов в галогенидах обычно равна — 1, в межгалогенных соед. у СЦ Вг, I она может быть + 1, 4- 3, + 5, а у I в IF7 +7. По характеру
связи элемент-галоген простые галогениды подразделяют на ионные и ковалентные.
В действительности связи имеют смешанный характер с преобладанием вклада
той или иной составляющей. Галогениды щелочных и щел.-зем. металлов, а также многие
моно- и дигалогениды др. металлов-типичные соли, в к-рых преобладает ионный
характер связи. Большинство из них относительно тугоплавки и малолетучи,
хорошо растворимы в воде; в водных р-рах почти полностью диссоциируют на
ионы. Св-вами солей обладают также тригалогениды Р3Э. Р-римость в воде
ионных галогенидов, как правило, уменьшается от иодидов к фторидам. Хлориды, бромиды
и иодиды Ag Увеличение
числа атомов галогенов в галогенидах металлов или отношения заряда металла к радиусу
его иона приводит к повышению ковалентной составляющей связи, снижению
р-римости в воде и термич. устойчивости галогенидов, увеличению его летучести, повышению
окислит. способности и склонности к гидролизу. Эти зависимости наблюдаются
для галогенидов металлов одного и того же периода и в ряду галогенидов одного и того же металла.
Их легко проследить на примере термич. св-в. Напр., для галогенидов металлов 4-го
периода т-ры плавления и кипения составляют соотв. 771 и 1430°С для КС1,
772 и 1960°С для СаС12, 967 и 975 °С для ScCK, — 24,1 и 136°С
для Т1С1 Галогениды неметаллов более ковалентны, чем галогениды металлов. Так, т-ры возгонки SiF4 ( — 95 °C и GeF4 ( — 36 °C гораздо ниже, чем у TiF4 и ZrF4, также и т-ры кипения SiCl4 (57,0 °С) и GeCl4(83,12°C) ниже, чем у Т1С14 и ZrCl4. Ковалентные SiF4 и GeF4, в отличие от TiF4 и ZrF4, почти мгновенно гидролизуются водой. Средняя энергия связи элемент — галоген уменьшается при переходе от фторидов к иодидам и с повышением п (см. табл.). ЭНЕРГИЯ СВЯЗИ В НЕКОТОРЫХ ГАЗООБРАЗНЫХ
ГАЛОГЕНИДАХ, кДж/моль
К смешанным галогенидам, содержащим наряду с атомами к.-л. элемента атомы двух или большего числа галогенов, относятся, напр., хлоропентафторид серы SC1F5, бромохлороди-фторид углерода CBrClF2, к межгалогенным соед. ХХn‘ (п = = 1, 3, 5 или 7)-ClF, BrF3, BrF5, IF7 и др. Полигалогениды содержат анионы Хn— (X == Вг, I; п = 3, 5, 9), напр. КВr3, К19. Гидрогалогениды МНn Хn+1 , или МНn Хn+2 Многие металлы и неметаллы образуют галогениды, содержащие изолированные или мостиковые атомы О (соотв. оксо-и оксигалогениды), напр. оксотрифторид ванадия VOF3, диоксифторид ниобия NbO2F, диоксодииодид вольфрама WO2I2, карбонилгалогениды СОХ2, нитрилгалогениды NO2X, нитрозилгалогениды NOX, тионилгалогениды SOX2. Характер связей элементов с галогенами в окси-и оксогалогенидах неметаллов более ковалентный, чем в соответствующих соед. металлов. Комплексные галогениды (галогенометаллаты) содержат комплексные анионы, в к-рых атомы галогенов являются лигандами, напр. гексахлороплатинат(IV) калия K2[PtCl6], гептафторотанталат(V) натрия Na[TaF7], гексафтороарсенат(V) лития Li[AsF6]. наиб. термич. устойчивостью обладают фторо-, оксофторо- и хлорометаллаты. По характеру связей к комплексным галогенидам близки ионные соед. с катионами NF4+, N2F3+, C1F2+, XeF+ и др. Для
многих галогенидов характерны ассоциация и полимеризация в жидкой и газовой фазах
с образованием мостиковых связей. наиб. склонны к этому галогениды металлов I и
II групп, А1С1 Фториды значительно отличаются по св-вам от др. галогенидов. Однако в простых галогенидах эти отличия выражены менее резко, чем в самих галогенах, а в комплексных галогенидах-слабее, чем в простых. Многие
ковалентные галогениды (особенно фториды)-сильные к-ты Льюиса, напр. AsF5,
SbF5, BF3, A1C13. Фториды входят в состав
сверхкислот. Высшие галогениды восстанавливаются металлами и Н Галогениды металлов V-VIII групп, кроме Сr и Мn, восстанавливаются Н2 до металлов, напр.: WF6 + 3Н2 -> W + 6HF Многие ковалентные и ионные галогениды металлов взаимодействуют между собой с образованием комплексных галогенидов, напр.: КС1 + ТаС15 -> К[ТаС16] Более
легкие галогены могут вытеснять более тяжелые из галогенидов. Кислород может окислять
галогениды с выделением С12, Вr2 и I2. Одна из
характерных р-ций ковалентных галогенидов-взаимод. с водой (гидролиз) или ее парами
при нагр. (пирогидролиз), приводящее к образованию оксидов, окси- или оксогалогенидов,
гидроксидов и галогеноводородов. Исключение составляют CF Галогениды получают непосредственно из элементов, взаимод. галогеноводородов или галогеноводородных к-т с элементами, оксидами, гидроксидами или солями, а также обменными р-циями. Галогениды широко используют в технике как исходные в-ва для получения галогенов, щелочных и щел.-зем. металлов, как компоненты стекол и др. неорг. материалов; они являются промежут. продуктами в произ-ве редких и нек-рых цветных металлов, U, Si, Ge и др. В природе галогениды образуют отдельные классы минералов, в к-рых представлены фториды (напр., минералы флюорит, криолит) и хлориды (сильвин, карналлит). Бром и иод входят в состав нек-рых минералов в виде изоморфных примесей. Значительные кол-ва галогенидов содержатся в воде морей и океанов, в соляных и подземных рассолах. Некоторые галогениды, напр. NaCl, К.С1, СаС12, входят в состав живых организмов. О псевдогалогенидах
см., напр., Галогены, об орг. галогенидах-Галогенангидриды карбоновых
кислот, Галогензамещенные углеводородов. Э.Г. Раков.
Страница «ГАЛОГЕНИДЫ» подготовлена по материалам химической энциклопедии. Еще по теме: |
ГАЛОГЕНИДЫ — это… Что такое ГАЛОГЕНИДЫ?
, хим. соед. галогенов с др. элементами. К Г. обычно относят соед., в к-рых атомы галогена имеют большую электроотрицательность, чем др. элемент. Г. не образуют Не, Ne и Аг. К простым, или бинарным, галогенидам ЭХ n (n-чаще всего целое число от 1 у моногалогенидов до 7 у IF7 и ReF7, но м. б. и дробным, напр. 7/6 у Bi6Cl7) относят, в частности, соли галогеноводородных к-т и межгалогенные соединения (напр., галогенфториды). Существуют также смешанные Г., полигалогениды, гидрогалогениды, оксогалогениды, оксигалогениды, гидроксогалогениды, тиогалогениды и комплексные Г.
Степень окисления галогенов в Г. обычно равна Ч 1, в межгалогенных соед. у СЦ Вг, I она может быть + 1, 4- 3, + 5, а у I в IF7 +7.
По характеру связи элемент-галоген простые Г. подразделяют на ионные и ковалентные. В действительности связи имеют смешанный характер с преобладанием вклада той или иной составляющей. Г. щелочных и щел.-зем. металлов, а также многие моно- и дигалогениды др. металлов-типичные соли, в к-рых преобладает ионный характер связи. Большинство из них относительно тугоплавки и малолетучи, хорошо растворимы в воде; в водных р-рах почти полностью диссоциируют на ионы. Св-вами солей обладают также тригалогениды Р3Э. Р-римость в воде ионных Г., как правило, уменьшается от иодидов к фторидам. Хлориды, бромиды и иодиды Ag+ , Сu+, Hg+ и Pb+ плохо растворимы в воде.
Увеличение числа атомов галогенов в Г. металлов или отношения заряда металла к радиусу его иона приводит к повышению ковалентной составляющей связи, снижению р-римости в воде и термич. устойчивости Г., увеличению его летучести, повышению окислит. способности и склонности к гидролизу. Эти зависимости наблюдаются для Г. металлов одного и того же периода и в ряду Г. одного и того же металла. Их легко проследить на примере термич. св-в. Напр., для Г. металлов 4-го периода т-ры плавления и кипения составляют соотв. 771 и 1430
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
галогениды — Химическая энциклопедия
ГАЛОГЕНИДЫ
хим. соед. галогенов с др. элементами. К Г. обычно относят соед., в которых атомы галогена имеют большую электроотрицательность, чем др. элемент. Г. не образуют He, Ne и Ar. К простым, или бинарным, галогенидам ЭХn (n-чаще всего целое число от 1 у моногалогенидов до 7 у IF7 и ReF7, но м. б. и дробным, напр. 7/6 у Bi6Cl7) относят, в частности, соли галогеноводородных кислот и межгалогенные соединения (напр., галогенфториды). Существуют также смешанные Г., полигалогениды, гидрогалогениды, оксогалогениды, оксигалогениды, гидроксогалогениды, тиогалогениды и комплексные Г.
Степень окисления галогенов в Г. обычно равна −1, в межгалогенных соед. у СЦ Вг, I она может быть + 1, 4- 3, +5, а у I в IF7 +7.
По характеру связи элемент-галоген простые Г. подразделяют на ионные и ковалентные. В действительности связи имеют смешанный характер с преобладанием вклада той или иной составляющей. Г. щелочных и щел.-зем. металлов, а также многие моно- и дигалогениды др. металлов-типичные соли, в которых преобладает ионный характер связи. Большинство из них относительно тугоплавки и малолетучи, хорошо растворимы в воде; в водных растворах почти полностью диссоциируют на ионы. Свойствами солей обладают также тригалогениды РЗЭ. Растворимость в воде ионных Г., как правило, уменьшается от иодидов к фторидам. Хлориды, бромиды и иодиды Ag+ , Cu+, Hg+ и Pb+ плохо растворимы в воде.
Увеличение числа атомов галогенов в Г. металлов или отношения заряда металла к радиусу его иона приводит к повышению ковалентной составляющей связи, снижению растворимости в воде и термич. устойчивости Г., увеличению его летучести, повышению окислит. способности и склонности к гидролизу. Эти зависимости наблюдаются для Г. металлов одного и того же периода и в ряду Г. одного и того же металла. Их легко проследить на примере термич. свойств. Например, для Г. металлов 4-го периода температуры плавления и кипения составляют соотв. 771 и 1430 °C для KCl, 772 и 1960 °C для CaCl2, 967 и 975 °C для ScCK, — 24,1 и 136 °C для TlCl4. Для UF3т. пл. ~ 1500 °C, UF4 1036 °C, UF5 348 °C, UF6 64,0 °C В рядах соед. ЭХn при неизменном n ковалентность связи обычно увеличивается при переходе от фторидов к хлоридам и уменьшается при переходе от последних к бромидам и иодидам. Так, для AlF3т. возг. 1280 °C, AlCl3 180 °C, т. кип. А1Br3 254,8 °C, AlI3 407 °C. В ряду ZrF4, ZrCl4, ZrBr4, ZrI4 температура возгонки равна соотв. 906, 334, 355 и 418 °C. В рядах MF,, и MCl„, где M — металл одной подгруппы, ковалентность связи уменьшается с ростом атомной массы металла. Фторидов и хлоридов металлов с примерно одинаковым вкладом ионной и ковалентной составляющей связи немного.
Г. неметаллов более ковалентны, чем Г. металлов. Так, температуры возгонки SiF4 ( −95 °C и GeF4 ( −36 °C гораздо ниже, чем у TiF4 и ZrF4, также и температуры кипения SiCl4 (57,0 °C) и GeCl4(83,12 °C) ниже, чем у TlCl4 и ZrCl4. Ковалентные SiF4 и GeF4, в отличие от TiF4 и ZrF4, почти мгновенно гидролизуются водой.
Средняя энергия связи элемент — галоген уменьшается при переходе от фторидов к иодидам и с повышением n (см. табл.).
ЭНЕРГИЯ СВЯЗИ В НЕКОТОРЫХ ГАЗООБРАЗНЫХ ГАЛОГЕНИДАХ, кДж/моль

К смешанным Г., содержащим наряду с атомами к.-л. элемента атомы двух или большего числа галогенов, относятся, напр., хлоропентафторид серы SC1F5, бромохлороди-фторид углерода CBrClF2, к межгалогенным соед. ХХn‘ (n = = 1, 3, 5 или 7)-ClF, BrF3, BrF5, IF7и др. Полигалогениды содержат анионы Хn− (X == Вг, I; n = 3, 5, 9), напр. KBr3, К19. Гидрогалогениды МHn Хn+1 , или МHn Хn+2 — продукты присоединения галогеноводородов к Г. металлов; содержат ионы HnX−n+1. Наиболее устойчивы гидрофториды металлов.
Многие металлы и неметаллы образуют Г., содержащие изолированные или мостиковые атомы О (соотв. оксо- и оксигалогениды), напр. оксотрифторид ванадия VOF3, диоксифторид ниобия NbO2F, диоксодииодид вольфрама WO2I2, карбонилгалогениды СОХ2, нитрилгалогениды NO2X, нитрозилгалогениды NOX, тионилгалогениды SOX2. Характер связей элементов с галогенами в окси- и оксогалогенидах неметаллов более ковалентный, чем в соответствующих соед. металлов.
Комплексные Г. (галогенометаллаты) содержат комплексные анионы, в которых атомы галогенов являются лигандами, напр. гексахлороплатинат(IV) калия K2[PtCl6], гептафторотанталат(V) натрия Na[TaF7], гексафтороарсенат(V) лития Li[AsF6]. Наиб. термич. устойчивостью обладают фторо-, оксофторо- и хлорометаллаты. По характеру связей к комплексным Г. близки ионные соед. с катионами NF4+, N2F3+, C1F2+, XeF+и др.
Для многих Г. характерны ассоциация и полимеризация в жидкой и газовой фазах с образованием мостиковых связей. Наиб. склонны к этому Г. металлов I и II групп, AlCl3, пентафториды Sb и переходных металлов, оксофториды состава MOF4. Известны Г. со связью металл — металл, напр. Hg2Cl2.
Фториды значительно отличаются по свойствам от др. Г. Однако в простых Г. эти отличия выражены менее резко, чем в самих галогенах, а в комплексных Г. — слабее, чем в простых.
Многие ковалентные Г. (особенно фториды)-сильные кислоты Льюиса, напр. AsF5, SbF5, BF3, A1C13. Фториды входят в состав сверхкислот. Высшие Г. восстанавливаются металлами и H2, напр.:

Г. металлов V-VIII групп, кроме Cr и Mn, восстанавливаются H2 до металлов, напр.:
WF6 + 3H2 → W + 6HF
Многие ковалентные и ионные галогениды металлов взаимодействуют между собой с образованием комплексных Г., напр.:
KCl + TaCl5 → К[TaCl6]
Более легкие галогены могут вытеснять более тяжелые из Г. Кислород может окислять Г. с выделением Cl2, Br2 и I2. Одна из характерных реакций ковалентных Г. — взаимод. с водой (гидролиз) или ее парами при нагр. (пирогидролиз), приводящее к образованию оксидов, окси- или оксогалогенидов, гидроксидов и галогеноводородов. Исключение составляют CF4, CCl4 и SF6, устойчивые к парам воды при высоких температурах.
Г. получают непосредственно из элементов, взаимод. галогеноводородов или галогеноводородных кислот с элементами, оксидами, гидроксидами или солями, а также обменными реакциями.
Г. широко используют в технике как исходные вещества для получения галогенов, щелочных и щел.-зем. металлов, как компоненты стекол и др. неорг. материалов; они являются промежут. продуктами в производстве редких и некоторых цветных металлов, U, Si, Ge и др.
В природе Г. образуют отдельные классы минералов, в которых представлены фториды (напр., минералы флюорит, криолит) и хлориды (сильвин, карналлит). Бром и иод входят в состав некоторых минералов в виде изоморфных примесей. Значительные количества Г. содержатся в воде морей и океанов, в соляных и подземных рассолах. Некоторые Г., напр. NaCl, KCl, CaCl2, входят в состав живых организмов.
О псевдогалогенидах см., напр., галогены, об орг. Г. — галогенангидриды карбоновых кислот, галогензамещенные углеводородов.
Э. Г. Раков
Источник: Химическая энциклопедия на Gufo.me
Значения в других словарях
- ГАЛОГЕНИДЫ — ГАЛОГЕНИДЫ, соединения, содержащие один из ГАЛОГЕНОВ (элемент VII группы периодической таблицы). Например: фторид натрия, бромоводород, хлорид калия и йодид калия. Научно-технический словарь
- галогениды — галогениды мн. Соединения галогенов с другими элементами. Толковый словарь Ефремовой
- ГАЛОГЕНИДЫ — ГАЛОГЕНИДЫ — химические соединения галогенов с другими элементами (фториды, хлориды, бромиды, иодиды). Большой энциклопедический словарь

ГАЛОГЕНИДЫ • Большая российская энциклопедия
ГАЛОГЕНИ́ДЫ (от греч. ἅλς – соль и γενῄς – рождающий, рождённый), химич. соединения галогенов с др. элементами, обычно – менее электроотрицательными. К Г. относят фториды, хлориды, бромиды, иодиды.
Г. щелочных и щёлочноземельных металлов (напр., $\ce {NaF, CaF_2, KCl, BaI_2}$), ряд моно- и дигалогенидов др. металлов (напр., $\ce {AgI, PbCl_2}$), а также тригалогениды РЗЭ (напр., $\ce {LaCl_3}$) – типичные соли – имеют высокие темп-ры плавления и кипения. Многие Г. хорошо растворимы в воде ($\ce {NaCl, CaCl_2}$ и др.), некоторые – плохо растворимы (напр., $\ce {CaF_2}$). Многие Г., в т. ч. Г. переходных металлов ($\ce {Ti, Zr, Nb}$ и др.) и Г. неметаллов ($\ce {P, Sb}$ и др.), гидролизуются водой с образованием соответствующих галогеноводородных кислот. Большинство Г. при нормальных условиях – твёрдые вещества, но известны также жидкие (напр., $\ce {TiCl_4, GeCl_4}$) и газообразные (напр., $\ce {SiF_4, SF_6}$) вещества.
Галогениды природные образуют отд. классы минералов, растворены в мор. воде. Г. получают непосредственно из элементов, взаимодействием галогеноводородов с оксидами, гидроксидами, солями, обменными реакциями и др. методами. Многие Г. (поваренная соль, сулема) находят применение с древних времён. Г. широко используют как исходные вещества для получения галогенов и щелочных металлов или как промежуточные продукты, напр. в произ-ве циркония, урана.
К Г. относят также межгалогенные соединения и соединения, содержащие, кроме атомов металла (неметалла) и галогена, атомы др. элементов (так, оксогалогениды содержат атомы кислорода, напр. оксохлорид серы, или тионилхлорид, $\ce {SOCl_2}$). Такие соединения могут быть газами, жидкостями или легкоплавкими твёрдыми веществами и гидролизуются водой.
О галогенидах $\ce {Ag, Al, K, Ca, Na, P, S, Si, Ti} $ см. в соответствующих статьях.
ОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ | Энциклопедия Кругосвет
Содержание статьиОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ (органогалогениды, галогензамещенные углеводороды) – класс органических соединений, которые содержат атомы галогена Hal, соединенные с углеводородной группой. Этот класс соединений описывает формула R–Hal, где R – углеводородная группа, Hal = F, Cl, Br, I.
В зависимости от положения атома Hal в углеводородной цепи различают первичные, вторичные и третичные органогалогениды.
В первичных органогалогенидах атом галогена присоединен к первичному атому С (т.е. связанному, помимо галогена, только с одним углеродным атомом: СH3–CH2–Cl, СH3–CH2–CH2– Cl). Первичный атом С выделен жирным шрифтом.
Во вторичных органогалогенидах атом галогена присоединен к вторичному атому С (связанному, помимо галогена, с двумя углеродными атомами: СH3–CH2–CH(Cl)–СH3), вторичный атом С выделен жирным шрифтом.
В третичных органогалогенидах атом галогена присоединен к третичному атому С (жирный шрифт), связанному одновременно с тремя атомами углерода: (СH3)3С–Cl. Таким образом, атом галогена, в соответствии с типом атома С, к которому он присоединен, также называют первичным, вторичным или третичным.
В зависимости от типа органической группы, связанной с галогеном, различают алкилгалогениды R–Hal, (где R – насыщенная или ненасыщенная алифатическая группа) и арилгалогениды Ar–Hal (Ar – фенильная, нафтильная группа и т.п.).
Номенклатура органических галогеноидов.
Названия органогалогенидов составляют следующим образом: к названию углеводородной группы добавляют слово «хлорид» (фторид, бромид, йодид), например, СH3–CH2–Cl – этилхлорид, СH3–CH(Br)–СH3 – изопропилбромид. В более сложных случаях за основу берут название углеводорода, углеродную цепь нумеруют и затем используют нумерацию, чтобы указать положение галогена и других заместителей вдоль основной цепи. Все заместители перечисляют в алфавитном порядке (рис. 1). Названия, составленные по таким правилам, называют систематическими.
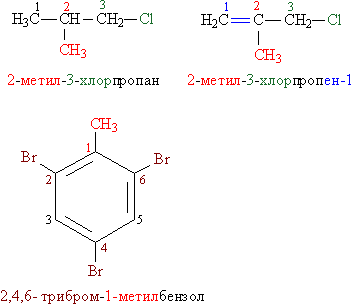
Рис. 1. СИСТЕМАТИЧЕСКИЕ НАЗВАНИЯ АЛКИЛ- И АРИЛГАЛОГЕНИДОВ. Замещающие группы и соответствующие им цифровые индексы выделены различающимися цветами.
Если все атомы Н в углеводороде замещены атомами галогена, то к названию соединения добавляют приставку «пер», например, Cl3C–CCl3 – перхлорэтан. Для некоторых галогенуглеводородов широко используют исторически сложившиеся тривиальные названия (см. ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ): HCCl3 –хлороформ (систематическое название трихлорметан), CH2=CH–Cl – винилхлорид (систематическое название хлорэтен).
Физические свойства органических галогеноидов.
Фторсодержащие алкилгалогениды, как правило, газообразные, хлор-, бром- и йодосодержащие – бесцветные подвижные жидкости (на свету йодосодержащие соединения приобретают коричневую окраску из-за частичного разложения). Температуры кипения алкилгалогенидов увеличиваются в направлении от фтора к йоду, и с ростом числа атомов галогена в соединении. Арилгалогениды – высококипящие жидкости. Органические галогениды неограниченно смешиваются с большинством органических растворителей и практически не смешиваются с водой.
Химические свойства органических галогеноидов.
Реакции органогалогенидов имеют некоторые общие закономерности: их реакционная способность возрастает в ряду RCl RI, поэтому алкилйодиды (как наиболее химически активные) используются для различных лабораторных синтезов, а в промышленных процессах широко применяются алкилхлориды, т.к. хлор более распространен в природе и получение, а также использование хлорпроизводных экономически целесообразнее. Химическая активность галогена в RHal снижается при увеличении размера органической группы R, а также при переходе от первичных органогалогенидов к вторичным.
Реакционная способность органогалогенидов определяется тем, что в группировке С–Cl отрицательный заряд у хлора больше, чем у атома С, поэтому на атоме хлора возникает частичный отрицательный заряд d–, а на атоме С – положительный заряд d+, это называют поляризацией связи – возникают как бы полюса (рис. 2, первый фрагмент). Реагенты, несущие отрицательный заряд (анионы), движутся к положительному полюсу молекулы (к атому С, рис. 2, второй фрагмент). С помощью пары электронов, поставляемой анионом, образуется новая связь О–С. Возникает переходный комплекс (промежуточное соединение), в котором атом С имеет пять химических связей (рис. 2, третий фрагмент). Такой комплекс неустойчив и распадается, отщепляя анион Cl–, который уносит с собой пару электронов и отрицательный заряд.
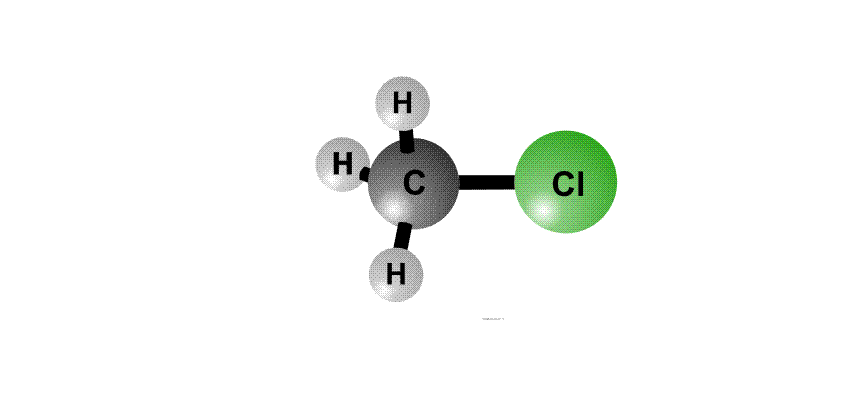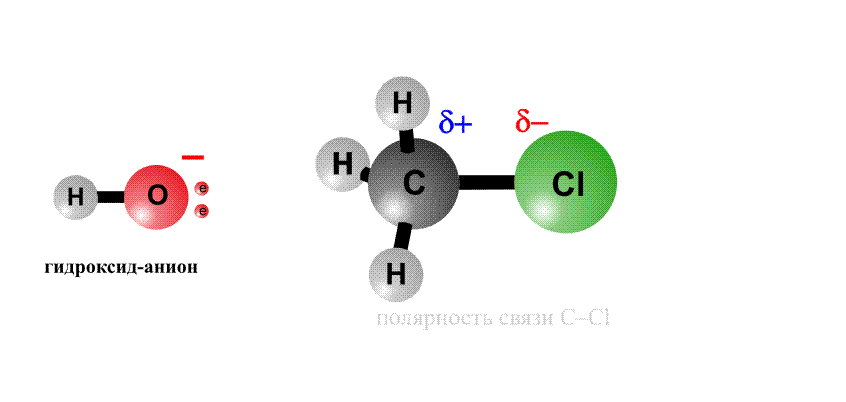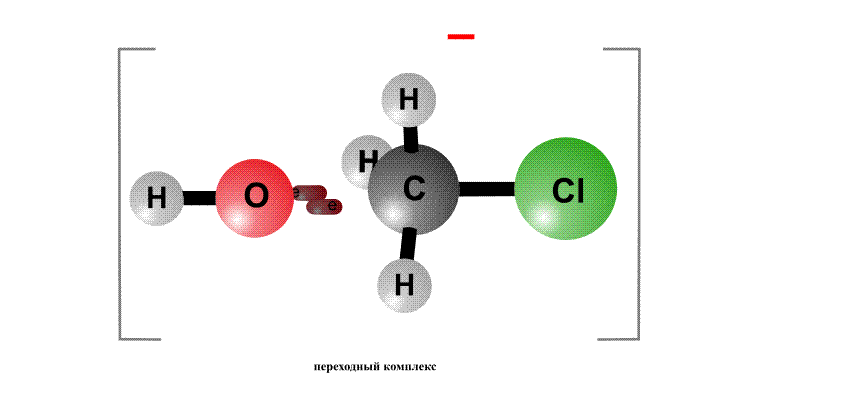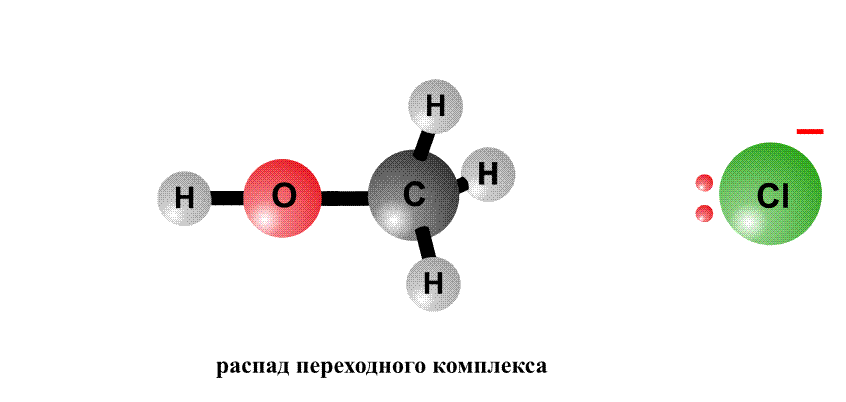
Анион НО–, несущий отрицательный заряд, приближается к молекуле алкилхлорида с той стороны, где сосредоточен частичный положительный заряд. Образуется связь О–С. Возникший переходный комплекс с атомом С, содержащим пять химических связей, нестабилен и распадается, связь C–Cl разрывается, и анион Cl– уносит с собой пару электронов и отрицательный заряд.
Процессы, когда замещающая группа (ОН) приближается к реагенту не с той стороны, где расположена уходящая группа (Cl), часто встречаются в органической химии (см. ВАЛЬДЕНОВСКАЯ ПЕРЕГРУППИРОВКА).
Схема (рис. 2) «не работает», когда атом галогена присоединен к атому С, участвующему в образовании двойной связи (винилхлорид CH2=CH–Cl), или непосредственно присоединен к ароматическому ядру (хлорбензол C6H5Cl). Кратная связь и ароматическая группа оттягивают на себя электроны, в результате поляризация связи C–Cl заметно снижается и соединение становится неактивным. Если «отодвинуть» атом Hal от двойной связи или ароматического ядра с помощью промежуточной группы CH2, то активность Hal резко возрастает, например, в аллилхлориде CH2=CH–CH2Cl или бензилхлориде C6H5CH2Cl. Через CH2-группу влияние кратной связи и ароматической группы не передается.
В соответствии со схемой (рис. 2) алкилгалогениды реагируют с разнообразными анионами, эти реакции показаны не в ионной форме, а в виде суммарного уравнения реакции. От алкилгалогенидов ведут пути практически ко всем крупным классам органических соединений. При взаимодействии с водными растворами разбавленных щелочей алкилгалогениды образуют спирты:
Н3C–Cl + NaOH = Н3C–OH + NaCl
Растворы концентрированных щелочей отщепляют от алкилгалогенида HCl, что приводит к образованию двойной связи:
Н3C–СН2–Cl + NaOH ® Н2C=СН2 + NaCl + Н2О
Реакция с алкоголятами щелочных металлов приводит к простым эфирам:
Н3C–Cl + NaOR ® Н3C–OR + NaCl
Из солей карбоновых кислот образуются сложные эфиры
Н3C–Cl + NaOC(O)R ® Н3C– OC(O)R + NaCl
Исходя из цианидов, получают нитрилы – соединения с фрагментом C–CєN:
Н3C–Cl + NaCєN ® Н3C–CєN + NaCl
Кислые сульфиды (соли сероводородной кислоты) приводят к образованию тиолов, называемых тиоспиртами, поскольку они представляют собой S-содержащие аналоги спиртов ne(S вместо О):
Н3C–Cl + KSH ® Н3C–SH + KCl
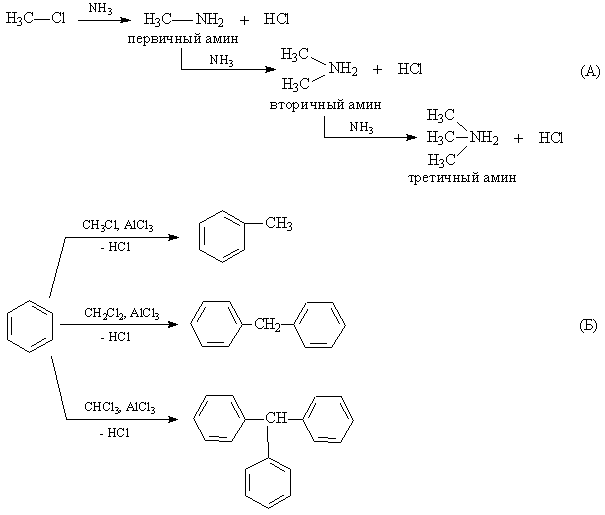
Взаимодействие с аммиаком сопровождается образованием первичных аминов, а в результате последовательных замещений – вторичных и третичных аминов (рис. 3А).
Алкилгалогениды используют и как алкилирующие агенты (в соединение вводится алкильная группа). В присутствии катализатора AlCl3 бензол алкилируется, если же в молекуле алкилхлорида есть два или более атома Hal, то он выступает в роли центра, объединяющего несколько бензольных колец (рис. 3Б).
Два атома Hal, расположенные у соседних углеродных атомов, открывают дополнительные возможности для синтеза. При действии металлического Zn на такие соединения в спиртовой среде образуются двойные или тройные связи (в зависимости от количества Hal в молекуле):
BrCH2–CH2Br + Zn ® CH2=CH2 + ZnBr2
Br2CH–CHBr2 + Zn ® CHєCH + ZnBr2
Если атомы Hal присоединены к удаленным атомам С, то цикл замыкается:
BrCH2–CH2– CH2–CH2Br + Zn ® CH2–CH2– CH2–CH2 + ZnBr2
В отличие от цинка металлический натрий может взаимодействовать и с соединениями, содержащими только один Hal, при этом он сдваивает органические группы (реакция Вюрца). Если в реакции участвуют различные алкилгалогениды, то сдваиваются как одинаковые, так и различные группы R:
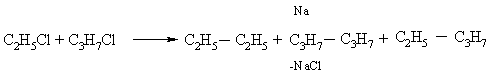
Получение органическихз галогенидов.
Прямое галогенирование углеводородов как алифатических, так и ароматических обычно приводит к смеси продуктов с различной степенью галогенирования:
C Н4 + Cl2 ® C Н3Cl + C Н2Cl2 + CНCl3
Йодировать таким способом углеводороды не удается, зато йод оказывается предпочтительным при другом способе получения галогенуглеводородов – присоединением HHal к двойной связи в олефинах, при этом наиболее легко присоединяется HI. Такой способ, называемый обычно гидрогалогенированием, в отличие от предыдущего, позволяет получать не смесь продуктов, а индивидуальные соединения. В соответствии с правилом Марковникова галоген присоединяется к тому атому С, который связан с меньшим числом атомов Н:
Н3C–СН=СН2 + HBr ® Н3C–СНBr–СН3
Присоединяться к двойной связи могут не только галогенуглеводороды, но и сами галогеналкилы, так получают перхлорированные (полностью хлорированные) углеводороды:
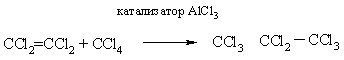
Тройная связь может присоединять галогенуглеводороды, в промышленности гидрохлорированием ацетилена синтезируют винилхлорид:
СНєСН + HCl ® СН2=СНCl
Широко используемый полимер поливинилхлорид (ПВХ) получают полимеризацией винилхлорида.
Взаимодействие спиртов галогеноводородами также приводит к галогеналкилам, это равновесный процесс (возможен как прямой, так и обратный процессы, обозначено сдвоенными стрелками), чтобы сдвинуть реакцию в нужном направлении, из реакционной среды удаляют образующуюся воду, связывая ее с помощью серной кислоты или ZnCl2:
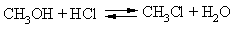
ОН-группу в спиртах можно заменить галогеном с помощью галогенидов фосфора, в зависимости от природы связанного с фосфором галогена получают соответственно хлор-, бром- или йодалкилы:
С2Н5ОН + PCl5® С2Н5Cl + PОCl3 + НCl
2С2Н5ОН + PI3® 2 С2Н5I + HPО2 + НCl
Применение органических галогеноидов.
Способность органогалогенидов растворять жиры и масла определила их применение в качестве средств для обезжиривания металлических поверхностей.
Тетрахлорэтилен ССl2 = ССl2 используют в установках для чистки одежды (химическая чистка).
Фторхлорзамещенные метаны и этаны CHC1F2, CF2C1–CF2C1 – негорючие вещества, газообразные при комнатной температуре, легко сжижаются под давлением, это позволяет использовать их для заполнения баллонов, в которые предварительно помещены различные бытовые препараты – косметические средства, лекарственные вещества, инсектициды и краски (аэрозольная упаковка).
Соединения сходного состава CF2C12 и CHF2C1 (торговые названия фреоны и хладоны) применяют в качестве хладагентов, это вещества, которые при кипении или в процессе расширения отнимают теплоту от охлаждаемого объекта и затем после сжатия передают ее охлаждающей среде – воде или воздуху. Хладагенты – «рабочие вещества» в холодильных установках.
Фторхлорзамещенные метаны и этаны используют также как вспенивающие агенты при производстве пенопластов.
Трифторбромметан CF3Br и тетрафтордибромэтан C2F4Br2 – легкокипящие негорючие жидкости с весьма высокой плотностью паров, их используют для заполнения огнетушителей особого типа, использование которых не требует присутствия человека. Баллон, содержащий такое вещество, с предварительно открытым вентилем быстро помещают в горящее помещение и плотно закрывают дверь. Пары галогенуглеводорода, постепенно заполняют все помещение, начиная от пола, вытесняют воздух и останавливают горение.
Винилхлорид СН2=СНCl – мономер, при полимеризации которого получают широко распространенный полимер поливинилхлорид (ПВХ), используемый для создания пленочных материалов, в качестве электроизоляции проводов и кабелей, в быту он известен как материал для изготовления линолеума и искусственной кожи.
Полимеризацией тетрафторэтилена CF2=CF2 получают политетрафторэтилен (фторопласт, тефлон), обладающий необыкновенным сочетанием эксплуатационных свойств: механической прочностью, высокими диэлектрическими параметрами, исключительной химической устойчивостью, низким коэффициентом трения, а также широкой областью рабочих температур (от –260 до +260° С). Из фторопласта изготавливают пленки, волокна, шланги, электроизоляцию для проводов и кабелей, химические реакторы, контейнеры для агрессивных жидкостей, трущиеся детали, не требующие смазки, и даже протезы органов человека.
Михаил Левицкий
Галогены — это… Что такое Галогены?
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 декабря 2011. |
| Группа → | 17 (VIIA) | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 | |||||||
| 5 | |||||||
| 6 |
| ||||||
| 7 |
| ||||||
Галоге́ны (от греч. ἁλός — соль и γένος — рождение, происхождение; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
 |  |  |
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F−) = +2,87 В и Eo(Cl2/Cl−) = +1,36 В показывают, что окислить ионы F− и Cl− можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде:
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na+ переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl− в Cl2) и накапливаются у катода (образование OH−). Перемещение OH− в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH− реагировал бы с Cl2 и сводил на нет весь результат.
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха.
Физические свойства галогенов
Фтор является трудносжижаемым, а хлор легкосжижаемым газом с удушливым резким запахом. Энергия связи галогенов сверху вниз по ряду изменяется не равномерно. Фтор имеет аномально низкую энергию связи (151 кДж/моль), это объясняется тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (Cl2 243, Br2 199, I2 150,7, At2117 кДж/моль). От хлора к астату энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. Аналогичные аномалии имеют и температуры кипения (плавления):
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309[2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
- 2Al + 3F2 = 2AlF3 + 2989 кДж,
- 2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
- Н2 + F2 = 2HF + 547 кДж,
- Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
- Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
- Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
- 3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
- 2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
- 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
- Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
- Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
- Cl2 + hν → 2Cl,
- Cl + Н2 → HCl + Н,
- Н + Cl2 → HCl + Cl,
- Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов (hν), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
- СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
- СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
- Cl2 + 2HBr = 2HCl + Br2,
- Cl2 + 2HI = 2HCl + I2,
- Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
- Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
- Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
- 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
- Si + 2Br2 = SiBr4(ж) + 433 кДж,
- Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
- I2 + I− → I−3.
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
- 2Li + At2 = 2LiAt — астатид лития.
А при диссоциации образуются не только протоны, но и ионы At+:HAt диссоц. на:2HAt=H++At—+H—+At+.
Примечания
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 211. — 623 с. — 100 000 экз.



