Онлайн урок: Галогены по предмету Химия 8 класс
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
В свободном состоянии молекулы галогенов состоят из двух атомов.
Некоторые физические свойства галогенов собраны в таблице.
Галоген | Фтор | Хлор | Бром | Йод |
Внешний вид | Бледно-желтый газ с резким запахом | Желто-зеленый газ с резким запахом | Коричневая жидкость с резким удушающим запахом | Тёмно-серые кристаллы |
Относительная атомная масса | 19 | 35,4 | 79,9 | 126,9 |
Температура плавления | –220 °С | –101 °С | –7 °С | 114 °С |
Температура кипения | –188 °С | –35 °С | 59 °С | 184 °С |
Растворимость в воде | Окисляет воду | Небольшая | Небольшая | Небольшая |
Растворимость в органических растворителях | Окисляет растворитель | Небольшая | Хорошая | Хорошая |
Водные растворы галогенов называют соответственно:
- хлорной водой
- бромной водой
- йодной водой
Все галогены ядовиты.
Физиологическое действие галогенов определяется сильными окислительными свойствами.
Особенно опасен фтор (F). При вдыхании даже небольших количеств фтора развивается отек легких, разрушается костная ткань.
Хлор (Cl) применялся как боевое отравляющее вещество во время Первой мировой войны. Отравление хлором вызывает легочные и бронхиальные заболевания.
Токсичность йода (I) используется при хлорировании воды – одном из способов очистки питьевой воды и обеззараживания сточных вод.
Однако в последнее время из-за токсичности хлора всё чаще применяют озонирование – обработку воды озоном.
Озон при разложении даёт кислород, который в небольших концентрациях не ядовит.
Пары брома (Br) вызывают удушье, головокружение, головную боль. При попадании брома на кожу образуются сильные, не заживающие длительное время ожоги.
Наименее ядовит из галогенов йод (I)
Кристаллический йод также может вызвать ожог кожи. Именно из-за небольшой токсичности йод применяется как антисептик в медицине.
Галогены химически очень активны, реагируют с очень многими простыми и сложными веществами.
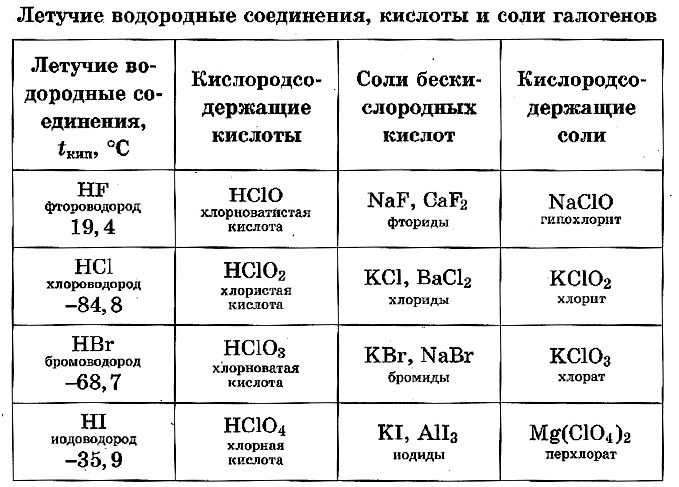
С водородом они образуют бинарные соединения: HF, HCl, HBr, HI
Это ядовитые газы с резким запахом, напоминающим запах соответствующих галогенов.
Эти газы хорошо растворяются в воде и диссоциируют на ионы, образуя кислоты, которые реагируют с металлами с образованием галогенидов и выделением водорода.
Первые две кислоты используются больше двух других и поэтому имеют собственные названия:
хлороводородная кислота HCl (соляная)
фтороводородная кислота HF (плавиковая)
Своё название они получили из-за того, что хлороводородная кислота HCl (соляная) образует поваренную соль:
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
фтороводородная кислота HF (плавиковая), хотя и не очень сильная именно как кислота, но способна растворять стекло: фтор в составе кислоты вытесняет кислород из оксида кремния (основного компонента стекла):
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Это свойство плавиковой кислоты используется при нанесении надписей и рисунков на стекло.
Галогены активно реагируют с металлами, образуя соли:
- фториды
- хлориды
- бромиды
- йодиды
При повышенной температуре хлор реагирует с медью, железом и некоторыми другими не очень активными металлами.
Металлы, как правило, горят в галогенах ярким пламенем с образованием большого количества искр.
Интересна реакция горения алюминия в броме.
Реакция сопровождается выделением большого количества энергии. Образующийся бромид алюминия сразу же гидролизуется во влаге воздуха с образованием большого количества дыма – выглядит это очень эффектно.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Тем не менее, хлор вполне можно хранить в стальных баллонах, потому что при отсутствии влаги реакция не идёт – главное, чтобы хлор был сухим. Баллоны с хлором окрашивают в зеленый цвет с тёмно-зеленой полосой или в желтый цвет с зеленой полосой.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Большинство неметаллов непосредственно взаимодействуют с галогенами.
С хлором и бромом энергично взаимодействуют сера и фосфор:
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Галогены взаимодействуют и со сложными веществами (водой, сероводородом).
Причем активность галогенов в подгруппе убывает сверху вниз.
Если вам когда-нибудь зададут вопрос: «А может ли гореть вода?» – смело отвечайте: «Да, может».
Всё дело в том, что более сильный окислитель вытесняет более слабый из его соединений.
Точно также происходит и с водой, если на неё воздействовать фтором (фтор – более сильный окислитель, чем кислород).
В атмосфере фтора вода в прямом смысле горит.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Химическая реакция горения воды в струе фтора выглядит так:
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Галогены также способны вытеснять друг друга из солей – более активный элемент вытесняет менее активный.
На этом основан промышленный метод получения йода: хлор пропускают через насыщенный раствор морской соли, который содержит большое количество йодидов, и йод выделяется в виде простого вещества:
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Галогены. Элементы VIIA-группы. Хлор, фтор. Конспект по химии
Галогены. Элементы VIIA-группы. Хлор, фтор
Ключевые слова: галогены, VIIA-группа, хлор, фтор, бром, йод, характеристика элемента, строение галогенов, получение хлора.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
Галогены (от греч. hals – соль и лат. genui – рождать, т. е. «рождающие соли») — это элементы VIIA-группы – фтор F, хлор Cl, бром Вг, йод I. Электронная конфигурация валентного слоя атомов галогенов в стационарном состоянии ns2np5. Радиусы атомов галогенов от фтора к йоду увеличиваются, энергия ионизации и электроотрицательности уменьшается, неметаллические свойства ослабляются.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ХЛОР
Хлор Cl – элемент № 17, в Периодической системе химических элементов Д. И. Менделеева находится в 3–м периоде, в VIIA группе. Электронная конфигурация атома хлора в стационарном состоянии 1s22s22p63s23p5: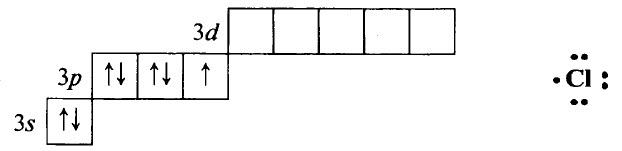
В своих соединениях хлор проявляет валентности:
Наиболее характерными степенями окисления хлора являются следующие:
Высший оксид хлора – оксид хлора (VII) Cl2О7 – кислотный оксид, высшим гидроксидом хлора является хлорная кислота НСlO4 (сильная кислота).
Водородное соединение хлора – хлороводород НCl (газ при обычных условиях), его водный раствор – соляная кислота, сильный электролит.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ФТОР
Фтор F – элемент № 9, находится во 2–м периоде, в VIIA группе. Электронная конфигурация внешнего электронного атома фтора 1s22s22p5:
В атоме фтора нет вакантных орбиталей на втором энергетическом уровне для перехода атома в возбуждённое состояние. Переход на вакантные орбитали третьего энергетического уровня потребовал бы слишком больших затрат энергии, следовательно, фтор может быть только одновалентен.
Электроотрицательность фтора среди других элементов максимальна (∼4,0 по шкале Полинга). Следовательно, для фтора невозможны положительные степени окисления. Возможные степени окисления фтора: 0 (F2) и –1 (HF, KF и т. д.).
СТРОЕНИЕ ГАЛОГЕНОВ – ПРОСТЫХ ВЕЩЕСТВ
Галогенам не присуща аллотропия, каждому элементу – галогену (Hal) соответствует одно простое вещество Наl2. Галогены – вещества молекулярного строения.
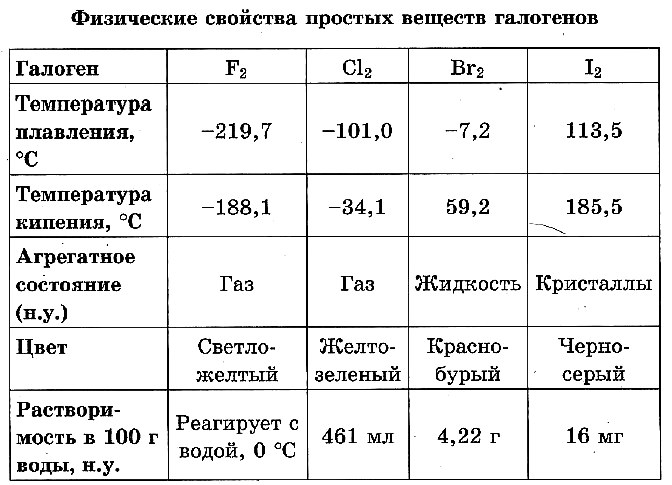
При обычных условиях фтор F2 – зеленовато–жёлтый газ; хлор Cl2 – жёлто–зелёный газ; бром Вг2 – красно–бурая жидкость, примерно в 3 раза тяжелее воды; йод I2 – фиолетово–чёрные кристаллы с металлическим блеском. Все галогены обладают характерным запахом.
Хлор, бром, йод умеренно растворимы в воде, их растворы называются соответственно хлорной, бромной и йодной водой (фтор с водой реагирует).
ПОЛУЧЕНИЕ ХЛОРА
В промышленности хлор получают электролизом расплава поваренной соли.
Лабораторные способы получения хлора основаны на окислении хлора в соляной кислоте с помощью таких окислителей, как перманганат калия, дихромат калия или диоксид марганца. Приведём примеры этих реакций:

Конспект урока по химии «Галогены. Элементы VIIA-группы. Хлор, фтор «. Выберите дальнейшее действие:
Галогены — это… Что такое Галогены?
ГАЛОГЕНЫ — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной массы. Галоидоводородные кислоты, их соли и простые органические галоидные соединения имеют также много общих физических и химических свойств. Г. используются в химической промышленности, для очистки воды и отходов, в производстве пластмасс, фармацевтических препаратов, целлюлозы и бумаги, тканей, смазочных материалов, как отбеливающие и дезинфицирующие моющие средства. Хлор применяется в производстве специальных аккумуляторов и хлорированных углеводородов. Диоксид хлора служит отбеливающим средством в пищевой, кожевенной, текстильной промышленности, а также окислителем, бактерицидом и антисептиком. Бром и йод применяются при синтезе органических красителей, при получении ряда металлов высокой чистоты и др.
Газы (фтор, хлор) и пары брома и йода раздражают органы дыхания. Вдыхание относительно низких концентраций этих газов и паров вызывает острые неприятные ощущения, которые сопровождаются чувством удушья, кашлем, стеснением в груди. Из-за повреждения легочной ткани происходит скопление жидкости в легких, развивается отек, который может оказаться смертельным. Резко выраженное раздражающее действие проявляется и при др. контактах — с кожным покровом, слизистыми глаз и при приеме внутрь с тяжелыми острыми и отдаленными последствиями.
Содержание галогенов и их соединений
в воздухе рабочей зоны
Наименование вещества, № CAS, синонимы | ПДК, мг/м3 | Характеристика |
Фтор [7782-41-4] | 0,03 | п, «+», 1 класс |
Фтороводород [7664-39-3] | 0,05 | п, 1 класс |
Фторид кислорода [7783-41-7] | 0,01 | п, «+», 1 класс |
Фторид натрия [7681-49-4] | 1 | а, «+», 2 класс |
Фторид кальция [7789-75-5] | 2,5 | п, 2 класс |
Хлор [7782-50-5] | 1 | п, «+», 2 класс |
Хлороводород [7447-01-0] | 5 | п, 2 класс |
Диоксид хлора [10049-04-4] | 0,1 | п, 2 класс |
Фосген [75-44-5] | 0,5 | п, 2 класс |
Хлорид серы [10025-67-9] | 0,3 | п, 2 класс |
Бром [7726-95-6] | 0,5 | п, «+», 2 класс |
Бромоводород [10035-10-6] | 2 | п, 2 класс |
Таллийбромид [7789-40-4] | 0,01 | а, 1 класс |
Йод [7553-56-2] | 1 | п, 2 класс |
Сокращения и обозначения: ПДК — предельно допустимая концентрация в воздухе рабочей зоны; п — пары; а — аэрозоль; класс — класс опасности вещества согласно ГОСТ 12.1.007—76; «+» — требуется специальная защита кожи и глаз.
Фтор (Ф.). Обладая чрезвычайно высокой реакционной способностью и проникая через защитные барьеры организма, Ф. вызывает многие нарушения обмена веществ, что позволяет оценивать его как яд политропного характера действия. В концентрациях 23 мг/м3 в течение 15 мин, 16 мг/м3 — 30 мин, 7,8 мг/м3 — 60 мин Ф. вызывает сильное раздражение верхних дыхательных путей. Длительное поступление Ф. в организм ингалляционно или с питьевой водой в концентрациях, превышающих допустимый уровень, ведет к заболеванию флюорозом.
Профессиональный флюороз чаще всего встречается у рабочих электролизных цехов алюминиевых заводов, производств плавиковой кислоты и ее солей, суперфосфата и др. Клинические проявления хронического флюороза регистрируются у части лиц при стаже 10—15 лет и более в условиях повышенных концентраций. К ранним признакам заболевания (1-я стадия из 3 стадий) относятся: жалобы на общее недомогание, слабость, повышенную утомляемость, раздражение слизистых оболочек глаз и носа, носовые кровотечения, жжение в носоглотке, боли в суставах и костях, головные боли, головокружения, боли в сердце, диспепсические явления.
Объективная симптоматика свидетельствует о развитии гипертрофических ринита, фарингита, ларингита; иногда — изъязвления и прободения носовой перегородки, нарушения бронхиальной проходимости. Обнаруживаются нейроциркулярная дистония, компенсаторная гиперфункция миокарда, пародонтоз, нарушение эмали зубов, хронический гастрит, проявления токсического гепатита и нарушение функционального состояния почек. Рентгенографических проявлений остеосклероза не выявляется.
У больных флюорозом (1-я и 2-я стадии) все указанные субъективные и объективные проявления резко усиливаются; в костно-суставной системе регистрируются периостальные наслоения. Обнаруживаются: выраженная легочная недостаточность, склерозирование сосудов сетчатки глаза, снижение проводимости звука. При прекращении контакта с Ф. проявления висцеральных нарушений уменьшаются, но костные изменения сохраняются длительное время.
При соприкосновении с кожей пары Ф. вызывают у человека зуд, раздражение, появление пузырей, мацерацию век, конъюнктивит, воспалительные и дистрофические изменения слизистой оболочки глаз и роговицы. Контакт с чистым Ф. вызывает ожог II степени, при концентрации 150—300 мг/м3 — раздражение открытых частей кожи.
Фтороводород очень токсичен; сильно раздражает дыхательные пути, слизистые оболочки глаз, носа (с кровотечением), полости рта, гортани и бронхов. Действует на ЦНС, вызывая приступы тетании. Возможно нарушение коронарного кровообращения, падение АД. Могут быть бронхиты, пневмосклероз, дистрофические изменения в печени и миокарде. При очень высоких концентрациях — спазм гортани и бронхов. Смерть в результате кровоизлияний и отека легких. В эксперименте на крысах в концентрациях 4,98 и 0,47 мг/м3 обладает эмбриотропным и мутагенным эффектами.
Фториды (Ф.) — соли фтороводородной кислоты, протоплазматические яды, нарушающие прежде всего углеводный, кальциевый и фосфорный обмен. При остром отравлении Ф. действуют на ЦНС и мускулатуру, при заглатывании — местное действие в желудочно-кишечном тракте. При хронической интоксикации — основные изменения в костях и зубах. Выявляются также сосудистые нарушения в органах дыхания, пищеварительном тракте, в нервной системе и кожном покрове. Тяжесть токсического действия фторсодержащих соединений зависит от их растворимости в биологических средах, что определяет количество поглощенного фтора.
Хлор (Х.). Газообразный Х. — прежде всего раздражитель органов дыхания. При концентрациях 6—8 мг/м3 он раздражает слизистые оболочки верхних дыхательных путей, бронхов и глаз. При высоких концентрациях и длительном воздействии поражения распространяются на глубокие отделы дыхательных путей, вызывая явления токсического трахеобронхита, появление признаков бронхиолита, бронхопневмонии, а иногда токсического отека легких. Концентрации 100—200 мг/м3 при 30—60 мин воздействия оцениваются как опасные для жизни.
В производственных условиях чаще всего встречаются легкие формы отравления. Жалобы на боль и жжение в груди, першение в горле, сухой кашель, затруднение дыхания, небольшое удушье, резь в глазах, слезотечение. Объективно — умеренная гиперемия слизистой оболочки дыхательных путей, серозные выделения из носа; в легких рассеянные сухие (местами влажные) хрипы. В острый период — головная боль, боль в подложечной области в правом подреберье. В крови — лейкоцитоз, нейтрофилия; в моче — белок. Последствия острых отравлений Х. могут усиливаться на протяжении 36 ч после контакта. Поэтому пострадавшие должны находиться под наблюдением врача. При отравлении средней тяжести все проявления субъективного и объективного характера усиливаются: увеличен и гиперемирован язычок, отечны дужки миндалин, истинные и ложные голосовые связки. Напряжена дыхательная мускулатура; кровь темная, густая, легко свертывается, что нередко приводит к закупорке вен, особенно на ногах.
Как отдаленные последствия острых отравлений Х. наблюдаются хронические катары верхних дыхательных путей, хронические рецидивирующие бронхиты и перибронхиты с последующим возникновением пневмосклероза, эмфиземы, бронхоэктатической болезни, легочно-сердечной недостаточности. У лиц, имеющих стаж работы с Х. свыше 5 лет, на флюорограммах обнаружено усиление рисунка корней легких, а после 8 лет — усиление и деформация легочного рисунка. Длительное воздействие малых концентраций Х. может привести к атрофическому катару верхних дыхательных путей, хроническому бронхиту, пневмосклерозу. На коже наблюдаются прыщи. Может происходить разрушение зубной эмали.
Хлороводород. При высоких концентрациях — раздражение слизистых, в особенности носа, конъюнктивит, помутнение роговицы. Охриплость голоса, чувство удушья, покалывание в груди, кашель с кровью в мокроте. Концентрации 75—150 мг/м3 для человека непереносимы; 50—75 мг/м3 переносятся с трудом; при 15 мг/м3 — раздражение слизистых оболочек верхних дыхательных путей и глаз. Длительное воздействие вызывает катары дыхательных путей, эрозию эмали зубов, изъязвление слизистой оболочки носа (иногда ее прободение), желудочно-кишечные расстройства. При непосредственном контакте с кожей возникает ожог и серозное воспаление с пузырями, изъязвления развиваются только при длительном воздействии.
Диоксид хлора раздражает дыхательные пути и глаза — подобно газообразному хлору, только в значительно большей степени. Раздражение и жжение в глазах ощущается в первые секунды при концетрациях 3—5 мг/м3. Кратковременное острое воздействие вызывает развитие бронхита астомоидного характера и эмфизему легких.
Фосген (Ф.) вызывает отек в результате поражения капилляров легких, приводящего к резкому повышению проницаемости воды и белка для капилляров и стенок легочных альвеол. Вследствие накопления жидкости в легких и затруднения газообмена наступает кислородное голодание организма, которое усиливается из-за повышения вязкости крови. Раздражающее действие на верхние дыхательные пути выражено не резко. Признаки легкого бронхита после однократного кратковременного воздействия Ф. в концентрации 16—19 мг/м3 быстро ослабевают и исчезают — «ложное выздоровление». Через латентный период (1—23 ч), длительность которого определяется тяжестью отравления, развиваются все признаки отека легких и токсической пневмонии, которые начинаются с нижних долей: повышается температура, наступает одышка, учащение дыхания, цианоз кожи и слизистых; развиваются нарушения кровообращения, кровь сгущена, повышена ее свертываемость, увеличено количество лейкоцитов и эритроцитов. В тяжелых случаях — потеря сознания. При длительном воздействии концентрация 5 мг/м3 опасна для жизни. Частые осложнения: бронхопневмония, облитерирующие бронхиолиты. В случае выздоровления клинические проявления, а также слабость и одышка исчезают медленно. Возможные частые последствия: эмфизема легких, хронические пневмонии.
Хлорид серы обладает специфическим раздражающим действием. Концентрация, вызывающая у человека раздражение верхних дыхательных путей, — 10 мг/м3; раздражение конъюнктивы глаз при минутной экспозиции 5 мг/м3.
Бром (Б.) относится к группе раздражающих веществ, обладающих сильным местноприжигающим действием. Длительный контакт Б. с тканями организма может вызвать глубокие ожоги, которые долго не заживают и приводят к образованию язв. Имеют место нарушения функции ЦНС, проявляющиеся в усилении процессов торможения в коре головного мозга. Начальные (пороговые) проявления раздражения у человека наблюдаются при воздействии Б. в концентрации 1—6 мг/м3; выраженный раздражающий эффект — при 13—22 мг/м3; содержание Б. в концентрации 30—60 мг/м3 считается чрезвычайно опасным для жизни; 200—220 мг/м3 — смертельно для человека.
При легкой интоксикации Б. — те же симптомы, как при соответствующем воздействии хлора. При более высоких концентрациях Б. усиливается раздражение. Слизистые оболочки носоглотки, верхних дыхательных путей, язык и конъюнктива приобретают коричневый цвет. Возможны бронхиальная астма, блефароспазм, вегетативные нарушения и гиперплазия щитовидной железы, сопровождающаяся ее дисфункцией. Сердечно-сосудистые нарушения проявляются в форме дегенерации миокарда и гипотонии. Происходят изменения отдельных функций печени и почек. Концентрации Б. в крови колеблются от 0,15 мг на 100 см3 до 1,5 мг на 100 см3 независимо от степени интоксикации.
Бромоводород по степени токсичности в 3 раза слабее, чем бром, но более чем в 2 раза сильнее хлороводорода. Раздражает слизистые оболочки верхних дыхательных путей и глаз. Порог раздражающего действия при однократной 4-часовой ингаляции в эксперименте на животных равен 26 мг/м3; изменения функционального состояния ЦНС и терморегуляции выявлено при концентрации 66 мг/м3. Хроническое отравление характеризуется воспалением верхних дыхательных путей, нарушением состава периферической крови, изменением функции ЦНС и нарушением пищеварения. Контакт с кожей и слизистыми оболочками может привести к ожогам.
Йод (Й.). Пары Й. даже в низких концентрациях чрезвычайно сильно раздражают дыхательные пути и глаза и в меньшей степени — кожу. При длительном воздействии в концентрации 1,03 мг/м3 Й. может вызвать незначительное раздражение конъюнктивы. Концентрации выше указанной приводят к усиливающемуся раздражению глаз и дыхательных путей (в итоге — к отеку легких). Др. системные повреждения в результате вдыхания паров Й. наблюдались у рабочих только при концентрациях, значительно превышающих ПДК. В таких условиях выявлены (помимо выраженных изменений в органах зрения и дыхательной системе): дисфункция щитовидной железы, снижение АД, функциональные изменения в миокарде и в ЦНС по типу астено-вегетативного синдрома. Хроническое воздействие Й. может привести к развитию заболевания, называемого «йодизм», при котором имеют место тахикардия, тремор, потеря массы тела, бессонница, диарея, конъюнктивит, ринит, бронхит.
Й. в кристаллической форме или в виде концентрированных растворов является сильным раздражителем кожи. Он с трудом удаляется с кожи, проникает внутрь, вызывая дальнейшие нарушения. Повреждения кожи напоминают тепловые ожоги, окрашенные в коричневый цвет. Из-за оставшегося в тканях Й. могут образовываться незаживающие язвы. Действие йодоводорода и йодоводородной кислоты подобно действию хлороводорода и хлороводородной кислоты, но выражено слабее.
Галогеналканы — Википедия

 Гексахлорэтан
ГексахлорэтанГалогеноалканы (алкилгалогениды) — органические соединения, которые содержат в своём составе связь «углерод-галоген». Их строение можно представить, исходя из строения углеводорода, в котором связь С-Н заменена на связь С-Х, (Х — фтор, хлор, бром, иод). В силу того, что атомы галогенов являются более электроотрицательными, чем атом углерода, связь С-Х поляризована таким образом, что атом галогена приобретает частичный отрицательный заряд, а атом углерода — частичный положительный. Соответственно, алкилгалогениды являются ярко выраженными электрофилами, и на этом свойстве основано их применение в органическом синтезе.
Согласно рекомендациям ИЮПАК, галогеналканы следует называть по заместительной либо радикало-функциональной номенклатуре. В заместительной номенклатуре атомы галогенов обозначаются приставками «фтор-», «хлор-», «бром-» или «иод-», которые добавляются к названию родоначального углеводорода с указанием перед ними локанта — номера атома углерода, с которым связан галоген. Например, вещество CH3-CHBr-CH2-CH3 будет называться «2-бромбутан». При наличии в составе молекулы нескольких атомов одного и того же галогена необходимо указать все локанты, а также использовать соответствующие множащие приставки: «ди-», «три-», «тетра-» и т. д. Так, Br-CH2-CH2-Br называется «1,2-дибромэтан»[1].
Название соединения по радикало-функциональной номенклатуре составляется из названия органического радикала и класса соединения («фторид», «хлорид», «бромид», «иодид») с использованием, если необходимо, множащих приставок. Например, CH3-CHBr-CH2-CH3 — втор-бутилбромид; Br-CH2-CH2-Br — этилендибромид. Эта номенклатура, как правило, применяется для простых галогеналканов, в составе которых содержится один атом галогена[1].
Традиционно в русском языке используется также другой вариант радикало-функциональной номенклатуры, в котором класс галогеналкана выражается в виде прилагательных «фтористый», «хлористый», «бромистый», «иодистый». Например, метилиодид — иодистый метил, изопропилхлорид — хлористый изопропил[2].
В рамках номенклатуры ИЮПАК сохраняются некоторые тривиальные названия галогеналканов: хлороформ CHCl3, бромоформ CHBr3 и иодоформ CHI3[1]. Полностью галогенированные алканы, в которых на галоген замещены все атомы водорода, называются пергалогенированными[2].
Галогеналканы делятся по признаку строения углеводородного радикала, к которому присоединён атом галогена. Выделяют первичные (RCH2X), вторичные (R2CHX) и третичные галогениды (R3CX)[2].
Строение молекул[править | править код]
Галогены являются электроотрицательными элементами, поэтому введение их в молекулы приводит к возникновению полярных связей типа C→X, где X — атом галогена. Такое смещение электронной плотности называют отрицательным индуктивным эффектом галогена; на атоме углерода возникает частичный положительный заряд, а на атоме галогена — частичный отрицательный заряд. Наиболее полярной является связь со фтором (как наиболее электроотрицательным галогеном), а наименее полярной — с иодом. Количественно полярность связи выражается при помощи величины дипольного момента, который учитывает частичные заряды на атомах и расстояние между этими зарядами (то есть длину связи). Поскольку эти два компонента изменяются в противоположных направлениях, дипольный момент в ряду связей C-X изменяется неравномерно[3].
| Молекула | Электроотрицательность галогена | Длина связи C-X, Å | Дипольный момент, Д |
|---|---|---|---|
| CH3F | 4,0 | 1,39 | 1,85 |
| CH3Cl | 3,0 | 1,78 | 1,87 |
| CH3Br | 2,8 | 1,93 | 1,81 |
| CH3I | 2,5 | 2,14 | 1,62 |
Из связей типа C-X только связь С-F (464 кДж/моль) прочнее связи C-H (414 кДж/моль). Энергия связи уменьшается при увеличении радиуса галогена и длины связи: C-Cl (355 кДж/моль), C-Br (309 кДж/моль), C-I (228 кДж/моль)[4].
Физические свойства[править | править код]
Галогеналканы, в основном, бесцветны, хотя иодиды на свету могут в небольшой степени разлагаться и приобретать красную или коричневую окраску из-за выделяющегося иода. Низшие галогениды имеют сладковатый запах[2].
Галогеналканы почти не растворяются в воде, но смешиваются со многими органическими растворителями[2].
Температура кипения галогеналканов отражает силу их межмолекулярного взаимодействия в жидком состоянии. Обеспечивают межмолекулярное взаимодействие преимущественно силы Ван-дер-Ваальса. При рассмотрении температуры кипения различных галогеналканов можно заметить следующие зависимости:
- Разветвлённые изомеры имеют более низкую температуру кипения, чем линейные (н-бутилбромид — 100 °С, трет-бутилбромид — 72 °С). Причина заключается в том, что разветвлённые соединения имеют более сферическую форму и меньшую площадь поверхности. Из-за этого силы Ван-дер-Ваальса проявляются слабее.
- Если сравнивать алкан и галогеналкан сходной структуры и молекулярной массы, то температура кипения галогеналкана будет выше (этан — −89 °С, бромметан — 4 °С). Это связано с полярностью галогенида и большей поляризуемостью брома по сравнению с метилом.
- Температуры кипения фторалканов близки к температурам кипения алканов соответствующей молекулярной массы (н-гексан — 69 °С, 1-фторпентан — 63 °С). Это связано с небольшим размером фтора и его низкой поляризуемостью[5].
Плотность жидких галогеналканов выше, чем плотность алканов соответствующей молекулярной массы. Это объясняется тем, что галогены в принципе имеют большую массу на единицу объёма. Например, атом брома и метильная группа имеют практически одинаковый ван-дер-ваальсовский радиус, но атомная масса брома в 5 раз выше. Также плотности всех бромалканов и иодалканов выше плотности воды (1,46 г/мл при 25 °С у бромэтана и 1,936 г/мл у иодэтана). Хлоралканы легче воды (0,891 г/мл у 1-хлорпропана), но ди- и полихлоралканы уже тяжелее воды (1,48 г/мл у хлороформа, 2,89 г/мл у бромоформа, 4,00 у иодоформа)[6].
Общими методами получения галогеналканов являются реакции галогенирования и гидрогалогенирования, но конкретные способы получения зависят от природы галогена[7].
Получение фторалканов[править | править код]
В промышленности монофторалканы и дифторалканы синтезируют двумя способами. Первый из них заключается в присоединении фтороводорода к алкенам или алкинам. Второй основан на замещении хлора или брома на фтор под действием фтороводорода или фторидов металлов[8].
- Ch3=Ch3+HF→Ch4Ch3F{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH_{2}+HF\rightarrow CH_{3}CH_{2}F}}}
- RCl+KF→RF+KCl{\displaystyle {\mathsf {RCl+KF\rightarrow RF+KCl}}}
Разработаны также подходы к синтезу моногидроперфторалканов CnHF2n+1. Их получают присоединением HF к перфторалкенам или декарбоксилированием перфторкарбоксилатов в присутствии доноров протонов[8].
Перфторалканы получают фторированием алканов под действием фторида кобальта(III) или фторида серебра(II), а также электрохимическими методами[8].
- R3CH+2CoF3→R3CF+HF+2CoF2{\displaystyle {\mathsf {R_{3}CH+2CoF_{3}\rightarrow R_{3}CF+HF+2CoF_{2}}}}
- 2CoF2+F2→2CoF3{\displaystyle {\mathsf {2CoF_{2}+F_{2}\rightarrow 2CoF_{3}}}}
Получение хлоралканов[править | править код]
Хлорметан синтезируют в промышленности как хлорированием метана, так и замещением OH-группы в метаноле под действием хлороводорода. Второй из этих методов набирает всё большую популярность, поскольку он, в отличие от первого, не создаёт в процессе производства побочный хлороводород, который необходимо утилизировать, а расходует его. Комбинация обоих методов позволяет производить хлорметан без особо больших выбросов хлороводорода[9]. Дихлорметан и трихлорметан также получают реакцией хлорирования метана[10]. Для получения тетрахлорметана также используют хлорирование метана, но некоторые заводы основаны на хлоририровании сероуглерода[11].
- Ch5+Cl2→hvCh4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}{\xrightarrow[{}]{hv}}CH_{3}Cl+HCl}}}
- Ch4OH+HCl→Al2O3Ch4Cl+h3O{\displaystyle {\mathsf {CH_{3}OH+HCl{\xrightarrow[{}]{Al_{2}O_{3}}}CH_{3}Cl+H_{2}O}}}
- CS2+2Cl2→CCl4+2S{\displaystyle {\mathsf {CS_{2}+2Cl_{2}\rightarrow CCl_{4}+2S}}}
Этилхлорид получают хлорированием этана, а более замещенные хлорэтаны — присоединением HCl или Cl2 к этилену или винилхлориду[12]. 2-Хлорпропан образуется при присоединении HCl к пропену[13]. Бутилхлорид и трет-бутилхлорид получают из соответствующих спиртов: бутанола-1 и трет-бутилового спирта под действием HCl[13].
Также в промышленности производят хлорированные парафины, которые представляют собой смеси, полученные воздействием газообразного хлора на смеси алканов с цепью разной длины (C10-C13, C14-C17, C18-C20, C20-C28)[14].
Получение бромалканов[править | править код]
Бромалканы в промышленности получают, в основном, реакциями присоединения и замещения. Бром быстро и количественно присоединяется по двойным углерод-углеродным связям, образуя дибромиды. Монобромиды получают присоединением к алкенам бромоводорода. Если алкен несимметричный, то региоселективность такого присоединения зависит от условий реакции: в условиях ионного механизма оно отвечает правилу Марковникова. Если реакцию проводить в радикальных условиях, её региоселективность противоположна (образуется менее замещённый бромид)[15].
- RCH=Ch3+HBr→FeBr3RCHBrCh4{\displaystyle {\mathsf {RCH\!\!=\!\!CH_{2}+HBr{\xrightarrow[{}]{FeBr_{3}}}RCHBrCH_{3}}}}
- RCH=Ch3+HBr→O2RCh3Ch3Br{\displaystyle {\mathsf {RCH\!\!=\!\!CH_{2}+HBr{\xrightarrow[{}]{O_{2}}}RCH_{2}CH_{2}Br}}}
Реакции замещения заключаются в замещении некоторого атома в органическом соединении на бром. В случае алканов реакцию проводят с использованием молекулярного брома при термическом, фотохимическом или ином инициировании. Такое замещение оказывается полезным только в том случае, если замещение происходит не случайным образом в нескольких положениях, а преимущественно в одном — там, где атом водорода отрывается наиболее легко[15].
- R3CH+Br2→t,hvR3CBr+HBr{\displaystyle {\mathsf {R_{3}CH+Br_{2}{\xrightarrow[{}]{t,hv}}R_{3}CBr+HBr}}}
Также в промышленности применяются другие реакции замещения на бром:
Иногда токсичный молекулярный бром можно заменить другими бромирующими агентами: N-бромсукцинимидом, 1,3-дибром-5,5-диметилгидантоином, трибромизоциануровой кислотой, а также кристаллическими трибромидами аммония, сульфония и фосфония[15].
Получение иодалканов[править | править код]
Иодалканы получают, обрабатывая спирты смесью иода и красного фосфора. Так, например, получают иодметан и иодэтан. Также применяют реакции присоединения иода или галогенидов иода к алкенам, замещения хлора или брома под действием иодидов щелочных металлов и реакцию спиртов с трифенилфосфитом и иодметаном[16].
Реакции нуклеофильного замещения[править | править код]
Галогеналканы вступают в реакции с разнообразными нуклеофилами. В этих процессах нуклеофил присоединяется к атому углерода, связанному с галогеном, а атом галогена выступает как уходящая группа. Суммарно происходит замещение атома галогена нуклеофилом.
- Nu−+R−X→R−Nu+X−{\displaystyle {\mathsf {Nu^{-}+R\!\!-\!\!X\rightarrow R\!\!-\!\!Nu+X^{-}}}}
Благодаря разнообразию нуклеофилов галогеналканы можно превратить в органические соединения самых различных классов: спирты, амины, простые и сложные эфиры, нитрилы, другие галогеналканы и т. д.[17].
- RCh3X+NaOH→RCh3OH+NaX{\displaystyle {\mathsf {RCH_{2}X+NaOH\rightarrow RCH_{2}OH+NaX}}}
- RCh3X+Nh4→RCh3Nh4+X−→RCh3Nh3{\displaystyle {\mathsf {RCH_{2}X+NH_{3}\rightarrow RCH_{2}NH_{3}^{+}X^{-}\rightarrow RCH_{2}NH_{2}}}}
- RCh3X+RONa→RCh3OR+NaX{\displaystyle {\mathsf {RCH_{2}X+RONa\rightarrow RCH_{2}OR+NaX}}}
- RCh3X+RCOONa→RCh3OCOR+NaX{\displaystyle {\mathsf {RCH_{2}X+RCOONa\rightarrow RCH_{2}OCOR+NaX}}}
- RCh3X+NaCN→RCh3CN+NaX{\displaystyle {\mathsf {RCH_{2}X+NaCN\rightarrow RCH_{2}CN+NaX}}}
- RCh3X+NaI→RCh3I+NaX{\displaystyle {\mathsf {RCH_{2}X+NaI\rightarrow RCH_{2}I+NaX}}}
Все эти реакции протекают преимущественно по двум механизмам: мономолекулярному SN1 и бимолекулярному SN2. Оба приводят к одному и тому же продукту с точки зрения структуры, но имеют некоторые кинетические и стереохимические отличия[17].
Механизм SN1 характерен для третичных галогенидов и других галогенидов, которые при отщеплении галогенид-иона дают устойчивые карбокатионы (например, аллилгалогенидов и бензилгалогенидов). Вторичные галогениды вступают в эту реакцию медленнее, а первичные — совсем медленно. Согласно механизму SN1, реакция нуклеофильного замещения протекает в две стадии: сначала происходит гетеролитический разрыв связи С-Х, а затем образовавшийся карбокатион реагирует с нуклеофилом. Реакция имеет первый порядок по субстрату; её скорость не зависит от концентрации нуклеофила. Если в исходном галогениде атом галогена был связан с хиральным атомом углерода, то в ходе реакции хиральность утрачивается и образуется рацемический продукт[17].

Механизм SN2 характерен для первичных галогенидов и чуть менее для вторичных галогенидов, поскольку его реализации мешают стерические препятствия, возникающие в сильно замещённых галогенидах. Согласно механизму SN2, реакция нуклеофильного замещения протекает в одну стадию: нуклеофил образует связь с атомом углерода при одновременном разрыве связи с уходящей группой. Реакция имеет первый порядок по субстрату и первый порядок по нуклеофилу. Если в исходном галогениде атом галогена был связан с хиральным атомом углерода, то в ходе реакции происходит обращение конфигурации: [17].

Реализация конкретного механизма зависит от типа галогенида (стерических препятствий, стабилизации карбокатиона), нуклеофильности реагента, характера растворителя (его ионизирующей и сольватационной способности), природы уходящей группы[17].
Реакции отщепления[править | править код]
Под действием оснований, в том числе щелочей, происходит отщепление галогеноводородов HX от галогеналканов и образуются алкены. Такие реакции также называют β-элиминированием (по месту отщепления атома водорода) и классифицируют по механизмам E1 (мономолекулярный) и E2 (бимолекулярный)[18].
В бимолекулярном механизме E2 происходит синхронное отщепление протона основанием, образование двойной С=С-связи и отщепление уходящей группы. В механизме E1 (также E1cB) стадия отщепления протона выделяется в отдельную стадию и является скоростьлимитирующей[18].


Если при отщеплении галогеноводорода может получиться два изомерных алкена, их соотношение регулируется правилом Зайцева. Основания, которые применяются при проведении реакций отщепления, являются также нуклеофилами, поэтому с реакциями отщепления конкурируют реакции нуклеофильного замещения[18].
Тригалогенметаны вступают в реакции α-элиминирования, когда протон и галогенид-ион отщепляются у одного и того же атома углерода. При этом происходит образование карбенов[18].
- CHCl3+NaOH→CCl2+NaCl+h3O{\displaystyle {\mathsf {CHCl_{3}+NaOH\rightarrow CCl_{2}+NaCl+H_{2}O}}}
Известно также отщепление молекул галогена от дигалогенидов. Под действием цинка в спиртовой среде 1,2-дигалогениды превращаются в алкены. Если атомы галогена расположены в более удалённых положениях эта реакция приводит к образованию циклоалканов[7].
Получение металлоорганических соединений[править | править код]
Галогеналканы реагируют с активными металлами, образуя металлоорганические соединения либо продукты их дальнейшего превращения. При реакции с натрием происходит образование натрийорганического соединения, которое реагирует со второй молекулой галогеналкана, давая алкан с удвоенным числом атомов углерода. Данное превращение известно как реакция Вюрца[19].

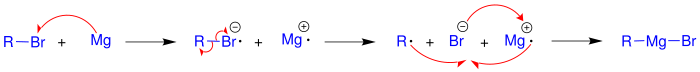
В среде диэтилового эфира или ТГФ галогеналканы вступают в реакцию с металлическим магнием, образуя реактивы Гриньяра RMgX. Эти реагенты широко используются в органическом синтезе в качестве нуклеофильных реагентов[19]. Аналогичным способом, по реакции с литием, получают литийорганические реагенты[7].
Реакция Фриделя — Крафтса[править | править код]
Галогеналканы применяют для алкилирования по Фриделю — Крафтсу. При этом галогеналканы реагируют с ароматическими соединениями в присутствии кислот Льюиса[7].
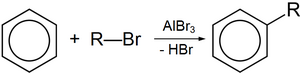
Применение фторалканов[править | править код]
Фторалканы представляют интерес как более безопасный класс фреонов по сравнению с хлорсодержащими фреонами. Последние выходят из употребления в связи с запретами в законодательстве различных стран. Фторалканы не оказывают вредного воздействия на озоновый слой и оказывают низкий вклад в парниковый эффект. Перфторалканы (например, перфтордекалин) применяются в производстве кровезаменителей[20].
Применение хлоралканов[править | править код]
Большую долю рынка хлорметанов занимает четырёххлористый углерод, основное использование которого заключается в дальнейшем производстве фреонов трихлорфторметана (R-11) и дифтордихлорметана (R-12). С 1976 года, когда появилась теория разрушения озонового слоя, производство четырёххлористого углерода снижается. Также его применяют как дезинфицирующее средство и фунгицид для зерновых[21].
Хлорметан и дихлорметан занимают по 25 % рынка хлорметанов. Хлорметан расходуется преимущественно на производство силиконов (60-80 % от рынка). Его использование в производстве топливной присадки тетраметилсвинца постепенно сокращается. Дихлорметан используют преимущественно в качестве моющего средства и растворителя для краски (40-45 %), для создания давления в аэрозолях (20-25 %), а также в качестве экстрагирующего растворителя[21].
Трихлорметан среди хлорметанов занимает наименьшую долю рынка (16 %). В основном он используется для производства дифторхлорметана (R-22) (90 % от производимого количества). Также он находит применение как экстрагирующий растворитель. Из-за токсикологических свойств его практически не применяют в качестве ингаляционного анестетика[21].
Хлорэтан находит широкое применение в производстве тетраэтилсвинца. По состоянию на 2006 год, 80-90 % хлорэтана в США и около 60 % в Европе приходилось на эту отрасль. Поскольку потребность в этой присадке резко уменьшается, сокращается также и производство хлорэтана. В сравнительно небольшом количестве хлорэтан используется для получения этилцеллюлозы и для реакций алкилирования[22].
1,1-Дихлорэтан используется главным образом как сырьё для производства 1,1,1-трихлорэтана[23]. 1,2-Дихлорэтан в основном используется (по данным 1981 года) для получения винилхлорида (около 85 % от общего количества). Около 10 % 1,2-дихлорэтана расходуют на производства других хлорсодержащих растворителей. Остальная часть находит применение в производстве этилендиаминов[24].
1,1,1-Трихлорэтан используют как промышленный растворитель, а также в текстильной промышленности и химчистка[25]. Более токсичный 1,1,2-трихлорэтан нельзя использовать как растворитель, поэтому он используется как промежуточное соединение в производстве 1,1,1-трихлорэтана и 1,1-дихлорэтилена[26].
- ↑ 1 2 3 Favre H. A., Powell W. H. Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013. — The Royal Society of Chemistry, 2014. — P. 656–661. — DOI:10.1039/9781849733069-FP001.
- ↑ 1 2 3 4 5 Химическая энциклопедия, 1988, с. 485.
- ↑ 1 2 Brown, 2012, p. 298–299.
- ↑ Brown, 2012, p. 301.
- ↑ Brown, 2012, p. 299–300.
- ↑ Brown, 2012, p. 300–301.
- ↑ 1 2 3 4 Химическая энциклопедия, 1988, с. 486.
- ↑ 1 2 3 Siegemund et al., 2016, p. 7–8.
- ↑ Rossberg et al., 2006, p. 12.
- ↑ Rossberg et al., 2006, p. 14.
- ↑ Rossberg et al., 2006, p. 18.
- ↑ Rossberg et al., 2006, p. 30–50.
- ↑ 1 2 Rossberg et al., 2006, p. 83.
- ↑ Strack et al., 2011, p. 523–524.
- ↑ 1 2 3 4 Yoffe et al., 2013, p. 6–8.
- ↑ Lyday and Kaiho, 2015, p. 10.
- ↑ 1 2 3 4 5 Нейланд, 1990, с. 229–233.
- ↑ 1 2 3 4 Нейланд, 1990, с. 233–234.
- ↑ 1 2 Нейланд, 1990, с. 229.
- ↑ Siegemund et al., 2016, p. 10.
- ↑ 1 2 3 Rossberg et al., 2006, p. 25–26.
- ↑ Rossberg et al., 2006, p. 32.
- ↑ Rossberg et al., 2006, p. 34.
- ↑ Rossberg et al., 2006, p. 42.
- ↑ Rossberg et al., 2006, p. 46.
- ↑ Rossberg et al., 2006, p. 49.
Ullmann’s Encyclopedia of Industrial Chemistry
- Siegemund G., Schwertfeger W., Feiring A., Smart B., Behr F., Vogel H., McKusick B., Kirsch P. Fluorine Compounds, Organic (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2016. — DOI:10.1002/14356007.a11_349.pub2.
- Rossberg M., Lendle W., Pfleiderer G., Tögel A., Dreher E.-L., Langer E., Rassaerts H., Kleinschmidt P., Strack H., Cook R., Beck U., Lipper K.-A., Torkelson T. R., Löser E., Beutel K. K., Mann T. Chlorinated Hydrocarbons (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2006. — DOI:10.1002/14356007.a06_233.pub2.
- Strack H., Cook R., Mann T. Chlorinated Paraffins (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2011. — DOI:10.1002/14356007.o06_o02.
- Yoffe D., Frim R., Ukeles S. D., Dagani M. J., Barda H. J., Benya T. J., Sanders D. C. Bromine Compounds (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2013. — DOI:10.1002/14356007.a04_405.pub2.
- Lyday P. A., Kaiho T. Iodine and Iodine Compounds (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2015. — DOI:10.1002/14356007.a14_381.pub2.
Галогены — это… Что такое Галогены?
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
ГАЛОГЕНЫ — (устар. выражение галоиды) химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals соль и genes рождающий (при соединении с металлами… … Большой Энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
ГАЛОГЕНЫ — ПОДГРУППА VIIA. ГАЛОГЕНЫ ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ Галогены и особенно фтор, хлор и бром имеют большое значение для промышленности и лабораторной практики как в свободном состоянии, так и в виде различных органических и неорганических… … Энциклопедия Кольера
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ГАЛОГЕНЫ — ГАЛОИДЫ ИЛИ ГАЛОГЕНЫ химические элементы: хлор, иод, бром, фтор, образующие с металлами соли без кислорода, напр. хлористый натрий (повар. соль). Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГАЛОИДЫ или ГАЛОГЕНЫ … Словарь иностранных слов русского языка
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и… genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия
| 1. |
Выбери галоген
Сложность: лёгкое |
1 |
| 2. |
Свойства галогенов
Сложность: лёгкое |
1 |
| 3. |
Вытеснительный ряд галогенов
Сложность: лёгкое |
1 |
| 4. |
Хлороводород и соляная кислота
Сложность: лёгкое |
1 |
| 5. |
Значение и применение соединений галогенов
Сложность: среднее |
1 |
| 6. |
Ряд галогенов
Сложность: среднее |
1 |
| 7. |
Строение и свойства галогенов
Сложность: среднее |
2 |
| 8. |
Соляная кислота не реагирует
Сложность: среднее |
2 |
| 9. |
Реагируют с соляной кислотой
Сложность: сложное |
3 |
| 10. |
Определи галоген
Сложность: сложное |
4 |
История открытия галогенов — фтор | хлор | бром | йод
Галогены буквально означает «солерождающие» (от лат. «галос» – соль и «генус» – рождать). Это название элементы получили за способность взаимодействовать с металлами с образованием типичных солей, например, хлорида натрия.
Открытие фтора
О его существовании догадывались многие химики конца XVIII – начала XIX века. «Фторос» – разрушение, гибель (греч.). В 1771 г. Карл Шееле получил HF. Сам фтор был открыт в 1886 г. французским химиком А. Муассаном электролизом безводного фтороводорода:
2HF → H2 + F2, -23 °C, эл. ток.
Однако в присутствии комиссии фтор получить не удалось из-за слишком тщательной очистки фтороводорода. Дело в том, что сам фтороводород не электропроводен (связь ковалентно-полярная), электропроводность обеспечивается присутствием KF, который образует с HF комплекс KF + HF → KHF2. Ион HF2— достаточно устойчив, поэтому расплав HF, содержащий KF, содержит ионы K+ и HF2—, которые и обеспечивают электропроводность. Через 20 лет за открытие фтора А. Муассан получил Нобелевскую премию.
Фердинанд Фредерик Анри МуассанОткрытие хлора
Впервые хлор был получен и описан К. Шееле в 1774 г. Получен он был действием концентрированной соляной кислоты на пиролюзит (MnO2·H2O):
MnO2 + 4HCl(конц.) = MnCl2 + 2H2O + Cl2↑
Однако ни сам Шееле, ни его современники не считали этот газ самостоятельным химическим элементом. После победы кислородной теории А. Лавуазье над теорией флогистона хлор стали считать оксидом еще неоткрытого элемента мурия (А. Лавуазье, К. Бертолле, Г. Дэви). После 3-х лет попыток получить мурий Г. Дэви пришел к выводу, что это – простое вещество (1810 г.), которое назвал хлорином («хлорос» – желто-зеленый, греч.). В 1811 г. Ж. Л. Гей-Люссак назвал его хлором. Считается, что первооткрыателем хлора был К. Шееле.
Карл Вильгельм ШеелеОткрытие брома
Впервые был получен Ю. Либихом, но он «проглядел» открытие, приняв бром за смесь хлора и йода. Поэтому открытие принадлежит французу А. Балару (30 ноября 1825 г.).
А. Балар при обработке хлорной водой щелока из золы морских водорослей выделил красно-бурую жидкость с резким, неприятным запахом. Балар предположил, что это вещество хлорид иода и тщетно пытался обнаружить иод. Однако ему не удалось разложить это вещество. Изучив физические и химические свойства нового вещества, Балар пришел к выводу, что обнаружил новое простое вещество, очень пoхожее на хлор и иод по его химическим свойствам, образующее аналогичные соединения, но имеющее различия в физических свойствах и химическом поведении.
Антуан Жером БаларА. Балар назвал новое вещество муридом (от латинского слова muria — рассол). 15 ноября 1825 г. исследователь отправил сообщение об открытии в Парижскую Академию наук, которое было заслушано 3 июля 1826 г. Специальная комиссия, в состав которой вошли знаменитые химики Ж. Гей-Люссак, Л. Теннар и Л. Воклен, 14 августа 1826 г. подтвердила открытие Балара. Комиссия, получив новое вещество согласно методам Балара и изучив его свойства, пришла к единодушному выводу, что бром является новым простым веществом. Комиссией было предложено для этого вещества другое название — бром (от греческого слова «бромос» — зловонный, дурно пахнущий). В то время соляная кислота называлась муриевой, а соли ее — муриатами, так что название, предложенное А. Баларом, могло привести к недоразумениям.
Открытие йода
Открыт в 1811 г. французским химиком-селитроваром Б. Куртуа.
Согласно легенде, на заводе, где вырабатывалась селитра, рабочие как-то погнались за кошкой. Убегая от преследователей, кошка случайно опрокинула сосуд с серной кислотой на остатки солей от выработки селитры, и тогда вдруг из образовавшейся смеси выделились густые фиолетовые пары.
Н2SО4 + 2НI = 2Н2О + SО2 + I2
Куртуа заинтересовался этим явлением и внимательно стал изучать новое вещество. Он нашел, что фиолетовые пары при охлаждении оседают в виде черных с металлическим блеском кристаллов, новое вещество соединяется с водородом, фосфором, металлами, а с аммиаком образует крайне взрывчатое вещество.
О своих наблюдениях и выводах Куртуа сообщил двум своим друзьям из Дижона – Н. Клеману и Ш. Б. Дезорму. Клеман проделал все эксперименты, о которых ему рассказал Куртуа, убедился в полной справедливости его выводов и в январе 1813 г. сделал небольшое сообщение ученым Парижа о загадочном веществе.
Новое вещество привлекло внимание двух знаменитых ученых – французского Ж. Л. Гей-Люссака и английского Г. Дэви, которые независимо друг от друга принялись изучать его свойства. Ученые пришли к выводу, что открытое Куртуа вещество новый элемент. Гей-Люссак назвал его йодом, а Дэви – йодином («йоэйдэс» – «фиолетовый», древнегреч.). Во всем мире прижилось первое название и лишь в Англии йод называют йодином.
Жозеф Луи Гей-ЛюссакОткрытие астата
Второй после технеция элемент. Получен в 1940 г. американскими учеными Т. (Д.) Корсоном, У. (К.) Макензи и Э. Сегре:
209Bi + α → 211At + 2n0
“Астатос” – “неустойчивый, нестабильный”, греч.
Унунсептий — Uus был получен в 2009-2010 годах в Объединённом институте ядерных исследований в Дубне (Россия). Это 117-й элемент с периодом полураспада — 78 миллисекунд.



