Фторид бериллия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 31 января 2016; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 31 января 2016; проверки требуют 7 правок.Фтори́д бери́ллия — бинарное химическое соединение с химической формулой BeF2. Бесцветные кристаллы.В воде растворяется, образует кристаллогидрат. Ядовит.
- Непосредственно из элементов:
- Be+F2 → BeF2{\displaystyle {\mathsf {Be+F_{2}\ {\xrightarrow {\ }}\ BeF_{2}}}}
- BeO+2 HF →220oC BeF2+h3O{\displaystyle {\mathsf {BeO+2\ HF\ {\xrightarrow {220^{o}C}}\ BeF_{2}+H_{2}O}}}
- Be(OH)2+2 HF → BeF2+2 h3O{\displaystyle {\mathsf {Be(OH)_{2}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+2\ H_{2}O}}}
- BeCO3+2 HF → BeF2+CO2↑+h3O{\displaystyle {\mathsf {BeCO_{3}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+CO_{2}\uparrow +H_{2}O}}}
- Действием фтора на оксид бериллия:
- 2 BeO+2 F2 →400oC 2 BeF2+O2{\displaystyle {\mathsf {2\ BeO+2\ F_{2}\ {\xrightarrow {400^{o}C}}\ 2\ BeF_{2}+O_{2}}}}
- Разложением (NH4)2[BeF4]:
- (Nh5)2[BeF4] →800−1100oC BeF2+2 Nh5F{\displaystyle {\mathsf {(NH_{4})_{2}[BeF_{4}]\ {\xrightarrow {800-1100^{o}C}}\ BeF_{2}+2\ NH_{4}F}}}
Фторид бериллия образует бесцветные гигроскопические кристаллы гексагональной сингонии, решетка типа α-кварца с параметрами a = 0,4750 нм, c = 0,5186 нм, Z = 3. Также известна тетрагональная модификация с параметрами ячейки a = 0,660 нм, c = 0,674 нм, Z = 8.
- Be2++h3O ⇄ BeOH++H+{\displaystyle {\mathsf {Be^{2+}+H_{2}O\ \rightleftarrows \ BeOH^{+}+H^{+}}}}
- Безводный фторид бериллия получают нагреванием кристаллогидрата в токе фтористого водорода:
- BeF2⋅h3O →150oC BeF2+h3O{\displaystyle {\mathsf {BeF_{2}\cdot H_{2}O\ {\xrightarrow {150^{o}C}}\ BeF_{2}+H_{2}O}}}
- При нагревании кристаллогидрата на воздухе получается оксифторид бериллия:
- 2 BeF2⋅h3O →τoC Be2OF2+2 HF{\displaystyle {\mathsf {2\ BeF_{2}\cdot H_{2}O\ {\xrightarrow {\tau ^{o}C}}\ Be_{2}OF_{2}+2\ HF}}}
- Разлагается в водных растворах при кипячении:
- BeF2+2 h3O →100oC Be(OH)2↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+2\ H_{2}O\ {\xrightarrow {100^{o}C}}\ Be(OH)_{2}\downarrow +2\ HF\uparrow }}}
- Разлагается сильными концентрированными кислотами:
- BeF2+h3SO4 → BeSO4↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+H_{2}SO_{4}\ {\xrightarrow {\ }}\ BeSO_{4}\downarrow +2\ HF\uparrow }}}
- С щелочами реагирует по-разному в зависимости от концентрации:
- BeF2+2 NaOH → Be(OH)2↓+2 NaF{\displaystyle {\mathsf {BeF_{2}+2\ NaOH\ {\xrightarrow {\ }}\ Be(OH)_{2}\downarrow +2\ NaF}}}
- BeF2+4 NaOH → Na2[Be(OH)4]+2 NaF{\displaystyle {\mathsf {BeF_{2}+4\ NaOH\ {\xrightarrow {\ }}\ Na_{2}[Be(OH)_{4}]+2\ NaF}}}
- BeF2+2 NaF → Na2[BeF4]↓{\displaystyle {\mathsf {BeF_{2}+2\ NaF\ {\xrightarrow {\ }}\ Na_{2}[BeF_{4}]\downarrow }}}
- Металлотермическим восстановлением магнием получают металлический бериллий:
- BeF2+Mg →700oC Be+MgF2{\displaystyle {\mathsf {BeF_{2}+Mg\ {\xrightarrow {700^{o}C}}\ Be+MgF_{2}}}}
- В производстве металлического бериллия.
- Компонент специальных стекол.
- В солевой смеси ядерных реакторов на расплавленных солях.
Фторид бериллия — это… Что такое Фторид бериллия?
Фтори́д бери́ллия — бинарное химическое соединение с химической формулой BeF2. Бесцветные кристаллы. Образует кристаллогидрат.
Получение
- Непосредственно из элементов:
- Действием фтора на оксид бериллия:
- Разложением (NH4)2[BeF4]:
Физические свойства
Фторид бериллия образует бесцветные гигроскопические кристаллы гексагональной сингонии, решетка типа α-кварца с параметрами a = 0,4750 нм, c = 0,5186 нм, Z = 3. Также известна тетрагональная модификация с параметрами ячейки a = 0,660 нм, c = 0,674 нм, Z = 8.
Химические свойства
- Безводный фторид бериллия получают нагреванием кристаллогидрата в токе фтористого водорода:
- При нагревании кристаллогидрата на воздухе получается оксифторид бериллия:
- Разлагается в водных растворах при кипячении:
- Разлагается сильными концентрированными кислотами:
- С щелочами реагирует по разному в зависимости от концентрации:
- С фторидами щелочных металлов и аммония образует комплексные соединения тетрафторбериллаты, из которых тетрафторбериллат натрия малорастворим в воде:
- Металлотермическим восстановлением магнием получают металлический бериллий:
Применение
- В производстве металлического бериллия.
- Компонент специальных стекол.
- В солевой смеси ядерных реакторов на расплавленных солях.
Фторид бериллия — Википедия
Материал из Википедии — свободной энциклопедии
Фтори́д бери́ллия — бинарное химическое соединение с химической формулой BeF2. Бесцветные кристаллы.В воде растворяется, образует кристаллогидрат. Ядовит.
Получение
- Непосредственно из элементов:
- Be+F2 → BeF2{\displaystyle {\mathsf {Be+F_{2}\ {\xrightarrow {\ }}\ BeF_{2}}}}
- BeO+2 HF →220oC BeF2+h3O{\displaystyle {\mathsf {BeO+2\ HF\ {\xrightarrow {220^{o}C}}\ BeF_{2}+H_{2}O}}}
- Be(OH)2+2 HF → BeF2+2 h3O{\displaystyle {\mathsf {Be(OH)_{2}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+2\ H_{2}O}}}
- BeCO3+2 HF → BeF2+CO2↑+h3O{\displaystyle {\mathsf {BeCO_{3}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+CO_{2}\uparrow +H_{2}O}}}
- Действием фтора на оксид бериллия:
- 2 BeO+2 F2 →400oC 2 BeF2+O2{\displaystyle {\mathsf {2\ BeO+2\ F_{2}\ {\xrightarrow {400^{o}C}}\ 2\ BeF_{2}+O_{2}}}}
- Разложением (NH4)2[BeF4]:
- (Nh5)2[BeF4] →800−1100oC BeF2+2 Nh5F{\displaystyle {\mathsf {(NH_{4})_{2}[BeF_{4}]\ {\xrightarrow {800-1100^{o}C}}\ BeF_{2}+2\ NH_{4}F}}}
Физические свойства
Фторид бериллия образует бесцветные гигроскопические кристаллы гексагональной сингонии, решетка типа α-кварца с параметрами a = 0,4750 нм, c = 0,5186 нм, Z = 3. Также известна тетрагональная модификация с параметрами ячейки a = 0,660 нм, c = 0,674 нм, Z = 8.
Химические свойства
- Be2++h3O ⇄ BeOH++H+{\displaystyle {\mathsf {Be^{2+}+H_{2}O\ \rightleftarrows \ BeOH^{+}+H^{+}}}}
- Безводный фторид бериллия получают нагреванием кристаллогидрата в токе фтористого водорода:
- BeF2⋅h3O →150oC BeF2+h3O{\displaystyle {\mathsf {BeF_{2}\cdot H_{2}O\ {\xrightarrow {150^{o}C}}\ BeF_{2}+H_{2}O}}}
- При нагревании кристаллогидрата на воздухе получается оксифторид бериллия:
- 2 BeF2⋅h3O →τoC Be2OF2+2 HF{\displaystyle {\mathsf {2\ BeF_{2}\cdot H_{2}O\ {\xrightarrow {\tau ^{o}C}}\ Be_{2}OF_{2}+2\ HF}}}
- Разлагается в водных растворах при кипячении:
- BeF2+2 h3O →100oC Be(OH)2↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+2\ H_{2}O\ {\xrightarrow {100^{o}C}}\ Be(OH)_{2}\downarrow +2\ HF\uparrow }}}
- Разлагается сильными концентрированными кислотами:
- BeF2+h3SO4 → BeSO4↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+H_{2}SO_{4}\ {\xrightarrow {\ }}\ BeSO_{4}\downarrow +2\ HF\uparrow }}}
- С щелочами реагирует по разному в зависимости от концентрации:
- BeF2+2 NaOH → Be(OH)2↓+2 NaF{\displaystyle {\mathsf {BeF_{2}+2\ NaOH\ {\xrightarrow {\ }}\ Be(OH)_{2}\downarrow +2\ NaF}}}
- BeF2+4 NaOH → Na2[Be(OH)4]+2 NaF{\displaystyle {\mathsf {BeF_{2}+4\ NaOH\ {\xrightarrow {\ }}\ Na_{2}[Be(OH)_{4}]+2\ NaF}}}
- BeF2+2 NaF → Na2[BeF4]↓{\displaystyle {\mathsf {BeF_{2}+2\ NaF\ {\xrightarrow {\ }}\ Na_{2}[BeF_{4}]\downarrow }}}
- Металлотермическим восстановлением магнием получают металлический бериллий:
- BeF2+Mg →700oC Be+MgF2{\displaystyle {\mathsf {BeF_{2}+Mg\ {\xrightarrow {700^{o}C}}\ Be+MgF_{2}}}}
Применение
- В производстве металлического бериллия.
- Компонент специальных стекол.
- В солевой смеси ядерных реакторов на расплавленных солях.
| Фторид бериллия | |
|---|---|
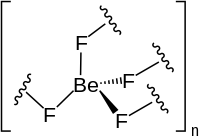 | |
| Общие | |
| Систематическое наименование | Фторид бериллия |
| Сокращения | Бесцветные кристаллы |
| Традиционные названия | Фтористый бериллий |
| Хим. формула | BeF2 |
| Физические свойства | |
| Молярная масса | 47,01 г/моль |
| Плотность | 1,986 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 552 °C |
| • кипения | 1169 °C |
| Мол. теплоёмк. | 51,84 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1027 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 84,625 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7787-49-7 |
| PubChem | 24589 |
| Рег. номер EINECS | 232-118-5 |
| SMILES | [Be+2].[F-].[F-] |
| InChI | 1S/Be.2FH/h;2*1H/q+2;;/p-2JZKFIPKXQBZXMW-UHFFFAOYSA-L |
| RTECS | DS2800000 |
| ChEBI | 49499 |
| ChemSpider | 22992 |
| Безопасность | |
| Токсичность | Ядовит |
| Пиктограммы ECB |   |
| NFPA 704 | |
Фторид бериллия — Википедия
Материал из Википедии — свободной энциклопедии
Фтори́д бери́ллия — бинарное химическое соединение с химической формулой BeF2. Бесцветные кристаллы.В воде растворяется, образует кристаллогидрат. Ядовит.
Получение
- Непосредственно из элементов:
- Be+F2 → BeF2{\displaystyle {\mathsf {Be+F_{2}\ {\xrightarrow {\ }}\ BeF_{2}}}}
- BeO+2 HF →220oC BeF2+h3O{\displaystyle {\mathsf {BeO+2\ HF\ {\xrightarrow {220^{o}C}}\ BeF_{2}+H_{2}O}}}
- Be(OH)2+2 HF → BeF2+2 h3O{\displaystyle {\mathsf {Be(OH)_{2}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+2\ H_{2}O}}}
- BeCO3+2 HF → BeF2+CO2↑+h3O{\displaystyle {\mathsf {BeCO_{3}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+CO_{2}\uparrow +H_{2}O}}}
- Действием фтора на оксид бериллия:
- 2 BeO+2 F2 →400oC 2 BeF2+O2{\displaystyle {\mathsf {2\ BeO+2\ F_{2}\ {\xrightarrow {400^{o}C}}\ 2\ BeF_{2}+O_{2}}}}
- Разложением (NH4)2[BeF4]:
- (Nh5)2[BeF4] →800−1100oC BeF2+2 Nh5F{\displaystyle {\mathsf {(NH_{4})_{2}[BeF_{4}]\ {\xrightarrow {800-1100^{o}C}}\ BeF_{2}+2\ NH_{4}F}}}
Физические свойства
Фторид бериллия образует бесцветные гигроскопические кристаллы гексагональной сингонии, решетка типа α-кварца с параметрами a = 0,4750 нм, c = 0,5186 нм, Z = 3. Также известна тетрагональная модификация с параметрами ячейки a = 0,660 нм, c = 0,674 нм, Z = 8.
Химические свойства
- Be2++h3O ⇄ BeOH++H+{\displaystyle {\mathsf {Be^{2+}+H_{2}O\ \rightleftarrows \ BeOH^{+}+H^{+}}}}
- Безводный фторид бериллия получают нагреванием кристаллогидрата в токе фтористого водорода:
- BeF2⋅h3O →150oC BeF2+h3O{\displaystyle {\mathsf {BeF_{2}\cdot H_{2}O\ {\xrightarrow {150^{o}C}}\ BeF_{2}+H_{2}O}}}
- При нагревании кристаллогидрата на воздухе получается оксифторид бериллия:
- 2 BeF2⋅h3O →τoC Be2OF2+2 HF{\displaystyle {\mathsf {2\ BeF_{2}\cdot H_{2}O\ {\xrightarrow {\tau ^{o}C}}\ Be_{2}OF_{2}+2\ HF}}}
- Разлагается в водных растворах при кипячении:
- BeF2+2 h3O →100oC Be(OH)2↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+2\ H_{2}O\ {\xrightarrow {100^{o}C}}\ Be(OH)_{2}\downarrow +2\ HF\uparrow }}}
- Разлагается сильными концентрированными кислотами:
- BeF2+h3SO4 → BeSO4↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+H_{2}SO_{4}\ {\xrightarrow {\ }}\ BeSO_{4}\downarrow +2\ HF\uparrow }}}
- С щелочами реагирует по разному в зависимости от концентрации:
- BeF2+2 NaOH → Be(OH)2↓+2 NaF{\displaystyle {\mathsf {BeF_{2}+2\ NaOH\ {\xrightarrow {\ }}\ Be(OH)_{2}\downarrow +2\ NaF}}}
- BeF2+4 NaOH → Na2[Be(OH)4]+2 NaF{\displaystyle {\mathsf {BeF_{2}+4\ NaOH\ {\xrightarrow {\ }}\ Na_{2}[Be(OH)_{4}]+2\ NaF}}}
- BeF2+2 NaF → Na2[BeF4]↓{\displaystyle {\mathsf {BeF_{2}+2\ NaF\ {\xrightarrow {\ }}\ Na_{2}[BeF_{4}]\downarrow }}}
- Металлотермическим восстановлением магнием получают металлический бериллий:
- BeF2+Mg →700oC Be+MgF2{\displaystyle {\mathsf {BeF_{2}+Mg\ {\xrightarrow {700^{o}C}}\ Be+MgF_{2}}}}
Применение
- В производстве металлического бериллия.
- Компонент специальных стекол.
- В солевой смеси ядерных реакторов на расплавленных солях.
Фторид бериллия — Википедия. Что такое Фторид бериллия
Материал из Википедии — свободной энциклопедииФтори́д бери́ллия — бинарное химическое соединение с химической формулой BeF2. Бесцветные кристаллы.В воде растворяется, образует кристаллогидрат. Ядовит.
Получение
- Непосредственно из элементов:
- Be+F2 → BeF2{\displaystyle {\mathsf {Be+F_{2}\ {\xrightarrow {\ }}\ BeF_{2}}}}
- BeO+2 HF →220oC BeF2+h3O{\displaystyle {\mathsf {BeO+2\ HF\ {\xrightarrow {220^{o}C}}\ BeF_{2}+H_{2}O}}}
- Be(OH)2+2 HF → BeF2+2 h3O{\displaystyle {\mathsf {Be(OH)_{2}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+2\ H_{2}O}}}
- BeCO3+2 HF → BeF2+CO2↑+h3O{\displaystyle {\mathsf {BeCO_{3}+2\ HF\ {\xrightarrow {\ }}\ BeF_{2}+CO_{2}\uparrow +H_{2}O}}}
- Действием фтора на оксид бериллия:
- 2 BeO+2 F2 →400oC 2 BeF2+O2{\displaystyle {\mathsf {2\ BeO+2\ F_{2}\ {\xrightarrow {400^{o}C}}\ 2\ BeF_{2}+O_{2}}}}
- Разложением (NH4)2[BeF4]:
- (Nh5)2[BeF4] →800−1100oC BeF2+2 Nh5F{\displaystyle {\mathsf {(NH_{4})_{2}[BeF_{4}]\ {\xrightarrow {800-1100^{o}C}}\ BeF_{2}+2\ NH_{4}F}}}
Физические свойства
Фторид бериллия образует бесцветные гигроскопические кристаллы гексагональной сингонии, решетка типа α-кварца с параметрами a = 0,4750 нм, c = 0,5186 нм, Z = 3. Также известна тетрагональная модификация с параметрами ячейки a = 0,660 нм, c = 0,674 нм, Z = 8.
Химические свойства
- Be2++h3O ⇄ BeOH++H+{\displaystyle {\mathsf {Be^{2+}+H_{2}O\ \rightleftarrows \ BeOH^{+}+H^{+}}}}
- Безводный фторид бериллия получают нагреванием кристаллогидрата в токе фтористого водорода:
- BeF2⋅h3O →150oC BeF2+h3O{\displaystyle {\mathsf {BeF_{2}\cdot H_{2}O\ {\xrightarrow {150^{o}C}}\ BeF_{2}+H_{2}O}}}
- При нагревании кристаллогидрата на воздухе получается оксифторид бериллия:
- 2 BeF2⋅h3O →τoC Be2OF2+2 HF{\displaystyle {\mathsf {2\ BeF_{2}\cdot H_{2}O\ {\xrightarrow {\tau ^{o}C}}\ Be_{2}OF_{2}+2\ HF}}}
- Разлагается в водных растворах при кипячении:
- BeF2+2 h3O →100oC Be(OH)2↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+2\ H_{2}O\ {\xrightarrow {100^{o}C}}\ Be(OH)_{2}\downarrow +2\ HF\uparrow }}}
- Разлагается сильными концентрированными кислотами:
- BeF2+h3SO4 → BeSO4↓+2 HF↑{\displaystyle {\mathsf {BeF_{2}+H_{2}SO_{4}\ {\xrightarrow {\ }}\ BeSO_{4}\downarrow +2\ HF\uparrow }}}
- С щелочами реагирует по разному в зависимости от концентрации:
- BeF2+2 NaOH → Be(OH)2↓+2 NaF{\displaystyle {\mathsf {BeF_{2}+2\ NaOH\ {\xrightarrow {\ }}\ Be(OH)_{2}\downarrow +2\ NaF}}}
- BeF2+4 NaOH → Na2[Be(OH)4]+2 NaF{\displaystyle {\mathsf {BeF_{2}+4\ NaOH\ {\xrightarrow {\ }}\ Na_{2}[Be(OH)_{4}]+2\ NaF}}}
- BeF2+2 NaF → Na2[BeF4]↓{\displaystyle {\mathsf {BeF_{2}+2\ NaF\ {\xrightarrow {\ }}\ Na_{2}[BeF_{4}]\downarrow }}}
- Металлотермическим восстановлением магнием получают металлический бериллий:
- BeF2+Mg →700oC Be+MgF2{\displaystyle {\mathsf {BeF_{2}+Mg\ {\xrightarrow {700^{o}C}}\ Be+MgF_{2}}}}
Применение
- В производстве металлического бериллия.
- Компонент специальных стекол.
- В солевой смеси ядерных реакторов на расплавленных солях.
Фторид бериллия — Вики
| Фторид бериллия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Фторид бериллия |
| Сокращения | Бесцветные кристаллы |
| Традиционные названия | Фтористый бериллий |
| Хим. формула | BeF2 |
| Физические свойства | |
| Молярная масса | 47,01 г/моль |
| Плотность | 1,986 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 552 °C |
| • кипения | 1169 °C |
| Мол. теплоёмк. | 51,84 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1027 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 84,625 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7787-49-7 |
| PubChem | 24589 |
| Рег. номер EINECS | 232-118-5 |
| SMILES | [Be+2].[F-].[F-] |
| InChI | 1S/Be.2FH/h;2*1H/q+2;;/p-2JZKFIPKXQBZXMW-UHFFFAOYSA-L |
| RTECS | DS2800000 |
| ChEBI | 49499 |
| ChemSpider | 22992 |
| Безопасность | |
| Токсичность | Ядовит |
| Пиктограммы ECB |   |
| NFPA 704 | |



