43.Электролиз. Законы электролиза
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплавэлектролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательныеионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление
электролиза широко применяется в
современной промышленности.
В частности, электролиз является одним
из способов промышленного
получения алюминия, водорода,
а также гидроксида
натрия, хлора,
хлорорганических
соединений
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
В 1832 году Фарадей установил,
что масса m вещества, выделившегося на
электроде, прямо пропорциональна
электрическому заряду q, прошедшему
через электролит: 
 называется электрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
называется электрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.Вывод закона Фарадея
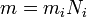 (1)
(1)
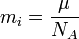 (2)
(2)
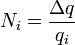 (3)
(3)  (4)
(4)
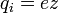 ,
где z — валентность атома (иона)
вещества, e — заряд
электрона (5)
,
где z — валентность атома (иона)
вещества, e — заряд
электрона (5)
Подставляя (2)-(5) в (1), получим
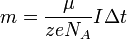
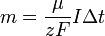
где 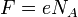

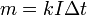
Второй закон Фарадея
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом
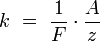
где  — постоянная
Фарадея.
— постоянная
Фарадея.
Второй закон Фарадея записывается в следующем виде:
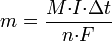
где 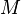 — молярная
масса данного
вещества, образовавшегося (однако не
обязательно выделившегося — оно
могло и вступить в какую-либо реакцию
сразу после образования) в результате
электролиза, г/моль;
— молярная
масса данного
вещества, образовавшегося (однако не
обязательно выделившегося — оно
могло и вступить в какую-либо реакцию
сразу после образования) в результате
электролиза, г/моль; 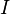
 —
время, в течение которого проводился
электролиз, с;
—
время, в течение которого проводился
электролиз, с; 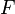 — постоянная
Фарадея,Кл·моль−1;
— постоянная
Фарадея,Кл·моль−1; 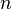 —
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
Однако это не всегда так; например, при
электролизе раствора соли меди(II) может
образовываться не только свободная
медь, но и ионы меди(I) (при небольшой
силе тока).
—
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
Однако это не всегда так; например, при
электролизе раствора соли меди(II) может
образовываться не только свободная
медь, но и ионы меди(I) (при небольшой
силе тока).Законы электролиза Фарадея и их применение для расчета количественных характеристик процесса электролиза
Электролизомназывается совокупность электрохимических окислительно-восстановительных реакций, протекающих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. При этом на катоде происходит процесс
Fe3+ + e – → Fe2+ ; (3.54)
Cu2+ + 2 e – → Cu. (3.55)
Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или взаимодействовать с продуктами катодного процесса, которые рассматриваются в этом случае как промежуточные вещества. Например, восстановление воды:
2 H2O + 2 e – → H2 + 2 OH–. (3.56)
На аноде окисляются ионы или молекулы, поступающие из объема электролита, например:
4 OH– – 4 e – → 2 H2O + H2; (3.57)
2 Cl– – 2 e – → Cl2,– (3.58)
или принадлежащие материалу анода. в последнем случае анод растворяется, например:
Cu – 2
Протекание электродных реакций зависит от состава и концентрации электролита, материала электродов, электродного потенциала, температуры, гидродинамических условий.
Процессы электролиза описываются законами Фарадея, которые в объединенной форме читаются следующим образом: массы веществ, испытавших электрохимические превращения на электродах, прямо пропорциональны количеству протекшего через электролит электричества и электрохимическим эквивалентам этих веществ:

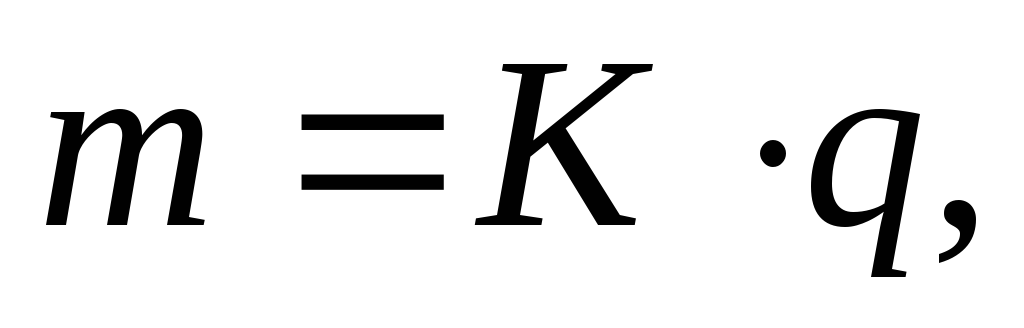 (3.60)
(3.60)где m – масса вещества, превратившегося на электроде (выделившегося на электроде),
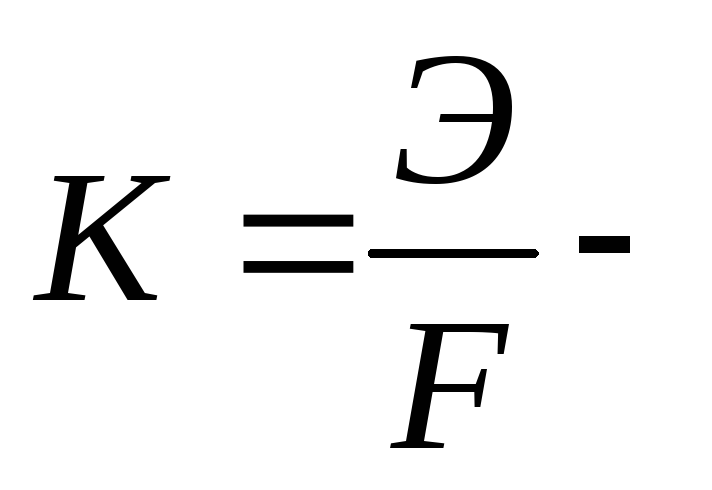 электрохимический
эквивалент – величина характеризующая массу
продуктов электролиза, выделившихся
на электродах при прохождении через
электролит 1 Кл электричества;
электрохимический
эквивалент – величина характеризующая массу
продуктов электролиза, выделившихся
на электродах при прохождении через
электролит 1 Кл электричества;
Э – химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении, г/экв;
F – число Фарадея (96485 Кл/г-экв) – количество электричества, необходимое для химического превращения (выделения на электроде) 1 г-экв вещества.
Так как q = I · τ (I – сила тока, А; τ – продолжительность электролиза, с), то уравнение закона Фарадея может быть записано следующим образом:
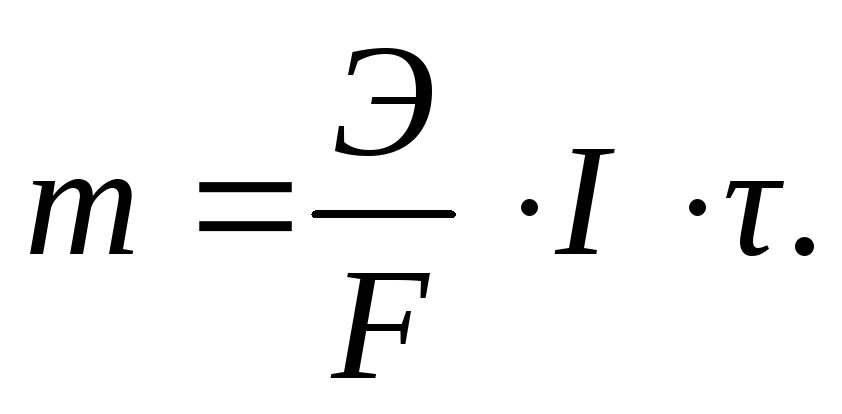 (3.61)
(3.61)
Химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении рассчитывается по формуле:
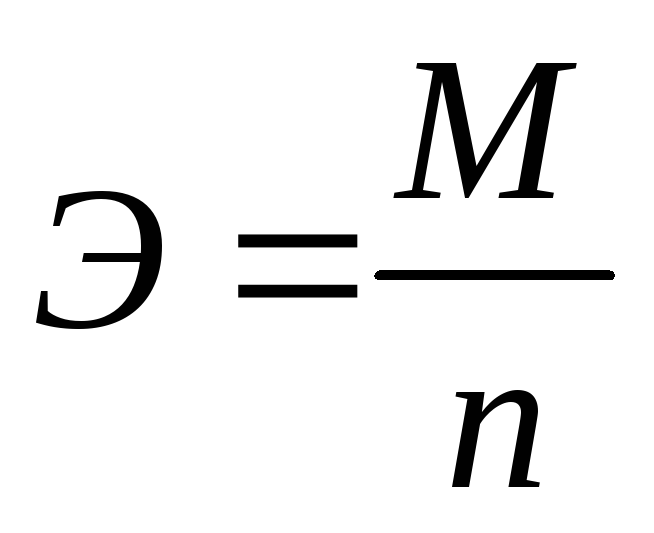 , (3.62)
, (3.62)
где М– молярная масса вещества, претерпевающего превращение на электроде, г/моль;
n– количество электронов, участвующих в одном акте химического превращения.
При электрохимических процессах часто наблюдаются отклонения от законов Фарадея: масса действительно полученного или разложившегося продукта не соответствует теоретической. Эти отклонения – кажущиеся и возникают за счет одновременного протекания побочных электрохимических процессов; химических реакций, в которые вступает продукт; потерь продукта и потерь электроэнергии на преодоление сопротивления электролизера. Эффективность электрохимического процесса оценивается выходом по току Вт:
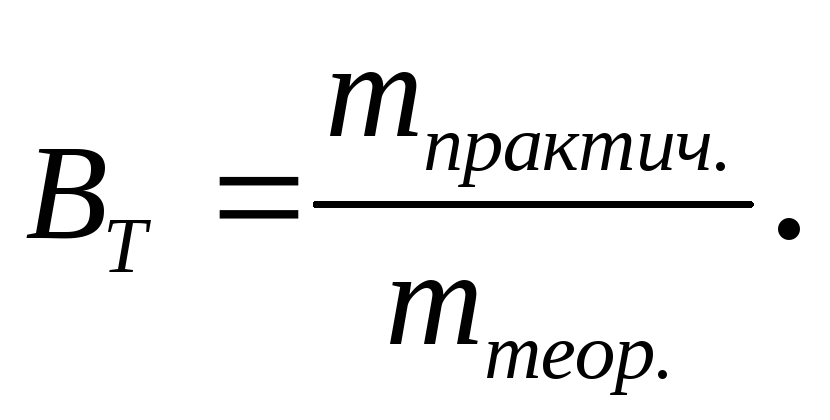 (3.63)
(3.63)
Эта величина может быть выражена в процентах:
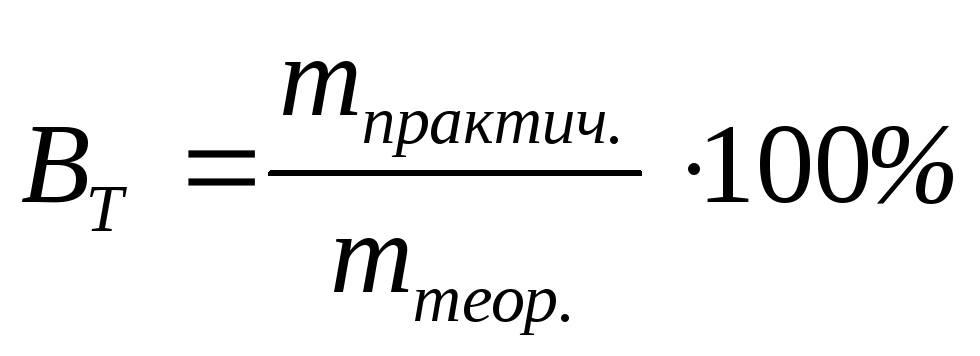 .
(3.64)
.
(3.64)
Тогда практическое количество вещества, образующееся при электролизе рассчитывается по формуле:
 .
(3.65)
.
(3.65)
П р и м е р 3.18. Какое количество алюминия выделится при электролизе за время 12 ч, если сила тока I =2,5 A, а выход по току составляет 88 %. Молярная масса алюминия М, равная его грамм-атомной массе А, составляет 26,98 г/моль.
Р е ш е н и е
Выделение алюминия при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Al3+ + 3 e – = Al; n = 3.
Химический эквивалент алюминия рассчитываем по формуле (3.62):
Э = М / 3 = 26,98 / 3 = 8,99 г/экв.
Продолжительность электролиза τ = 12 час = 12 · 3600 = 43200 с.
По объединенному закону Фарадея (3.61) находим теоретическое количество алюминия, выделяющееся при электролизе в указанных условиях:
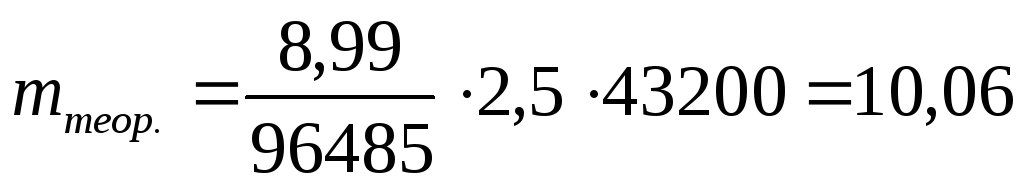 г.
г.
Практическое количество выделившегося при электролизе алюминия находим с учетом величины ВТ по формуле (3.65):

П р и м е р 3.19. Определить время, необходимое для выделения при электролизе 1,2 г меди, если сила тока I = 2 A, а выход по току ВТ = 96 %.
Р е ш е н и е
На основании формулы (3.64) находим, на какое теоретическое количество меди необходимо рассчитывать продолжительность электролиза:
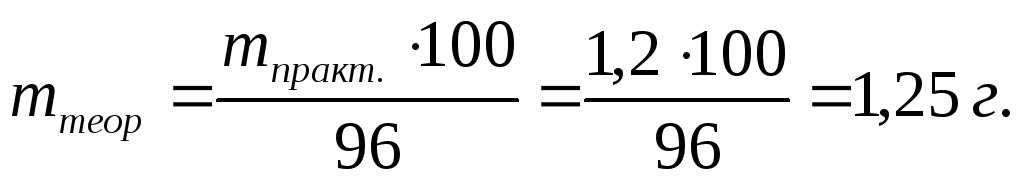
Выделение меди при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Сu2+ + 2 e– = Cu; n = 2.
Химический эквивалент меди рассчитываем по формуле (3.62):
Э = М / 2 = 63,54 / 2 = 31,77 г/экв.
Из уравнения закона Фарадея (3.61) находим время процесса:
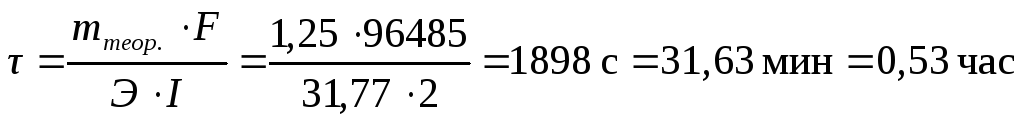
Закон Фарадея для электролиза: формулы
Содержание:
- Суть процесса электролиза
- Первый закон Фарадея
- Второй закон Фарадея
- Видео
Электрический ток, проходящий через растворы электролитов, способствует разложению веществ и дает возможность получать химически чистые материалы. Данный процесс получил наименование электролиза, нашедшего широкое применение в промышленном производстве. Физические преобразования проводников, находящихся в жидкости, объясняет закон Фарадея для электролиза, на основании которого анод выполняет функцию положительного электрода, а катод – отрицательного.
С помощью этого явления осуществляется не только очистка металлов от примесей, но и выполняется нанесение тонких покрытий, защищающих и украшающих металлические поверхности.
Суть процесса электролиза
Электролизом называются процессы окислительно-восстановительных реакций, протекающие под принудительным воздействием электрического тока. Для его выполнения используется специальная емкость с электролитическим раствором, куда погружаются металлические штыри, соединенные с наружным источником питания.

Электрод, соединенный с полюсом отрицательного значения источника тока, считается катодом. Именно в данном месте частицы электролита восстанавливаются. Другой электрод подключается к плюсовому полюсу и носит название анода. На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
К категории инертных относятся аноды, изготовленные из материала, не окисляющегося во время электролиза. В качестве примера можно привести графитовые или платиновые электроды. Растворимыми являются практически все остальные виды металлических анодов, подверженных окислению в ходе электролитической реакции.
Электролитами чаще всего служат различные виды растворов или расплавов, внутри которых происходит хаотичное движение заряженных частиц – ионов. Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.

Таким образом, на катоде и аноде происходит накопление так называемых суммарных продуктов, состоящих из электрически нейтральных веществ. Весь процесс электролиза выполняется под напряжением, подаваемым на электроды. Данное напряжение Uэл-за является типичным примером разности потенциалов, требующейся для обеспечения нормального течения электролитических реакций. Чисто теоретически это напряжение принимает вид формулы: Uэл-за = Еа – Ек, в которой Еа и Ек являются потенциалами химических реакций, происходящих на аноде и катоде.
Существует определенная связь между количеством электричества, протекавшего через раствор, и количеством вещества, выделенного в период электролитической реакции. Данное явление было описано английским физиком Фарадеем и оформлено в виде двух законов.
Первый закон Фарадея
Данный закон был выведен ученым экспериментальным путем. Он определяет пропорциональную зависимость между массой вещества, образующегося на электроде и зарядом, проходящим через электролитический раствор.
Эту пропорцию наглядно отображает формула m=k х Q=k х I х t, где k является коэффициентом пропорциональности или электрохимическим эквивалентом, Q – заряд, прошедший через электролит, t – время прохождения заряда, m – масса вещества, образовавшегося на электроде в результате реакции.

Первый закон Фарадея служит для определения количества первичных продуктов, образовавшихся в процессе электролиза на электродах. Масса этого вещества составляет суммарную массу всех ионов, попавших на электрод. Это подтверждается формулой m=m0 х N = m0 х Qq0 = m0q0 х I х t, в которой m0 и q0 соответственно являются массой и зарядом единичного иона. N=Qq0 – определяет количество ионов, попавших на электрод за время прохождения заряда Q через раствор электролита.
Следовательно, величина электрохимического эквивалента k представляет собой соотношение массы иона m0 используемого вещества и заряда q0 этого иона. Известно, что величина заряда иона составляет произведение валентности n этого вещества и элементарного заряда е, то есть, q0 = n х e. Исходя из этого, электрохимический эквивалент k будет выглядеть следующим образом: k = m0q0 = m0 х NAn х e х NA = 1F х μn. В этой формуле NA является постоянной Авогадро, μ – молярной массой данного вещества. F = e х NA является постоянной Фарадея и составляет 96485 Кл/моль.
Числовое значение данной величины равняется заряду, который должен быть пропущен через раствор электролита, для того чтобы на электроде выделился 1 моль вещества с одинаковой валентностью. Рассматриваемый закон Фарадея для электролиза примет вид еще одной формулы: m = 1F х μn х I х t.
Второй закон Фарадея
Следующий закон ученого Фарадея описывает, как электрохимический эквивалент будет зависеть от атомной массы вещества и его валентности. У этого коэффициента будет прямая пропорциональная зависимость с атомным весом и обратно пропорциональная – с валентностью вещества. С введением данной величины, второй закон Фарадея формулируется как пропорция электрохимических эквивалентов вещества и собственных химических эквивалентов этих веществ.

Если значения электрохимических эквивалентов взять за k1, k2, k3…kn, а химические эквиваленты принять за х1, х2, х3…xn, то k1/x1 = k2/x2 = k3/x3…kn/xn. Данное соотношение является постоянной величиной, одинаковой для любых используемых веществ: с = k/x и составляет 0,01036 мг-экв/к. Именно такое количество вещества в миллиграмм-эквивалентах выделяется на электродах за период прохождения в электролите электрического заряда, равного одному кулону.
Следовательно, второй закон Фарадея можно представить в виде формулы: k = cx. Если данной выражение использовать вместе с первым законом Фарадея, то в результате получится следующее выражение: m = kq = cxq = cxlt. Здесь категория с представляет собой универсальную постоянную, в размере 0,00001036 г-экв/к. Подобная формулировка дает возможность понять, что одни и те же токи, пропущенные через одинаковый промежуток времени в двух различных электролитах, выделят из них вещества с соблюдением рассмотренного химического эквивалента.
Поскольку x = A/n, то масса выделяемого вещества будет выглядеть как m = cA/nlt, с соблюдением прямой пропорции с атомным весом и обратной пропорции с валентностью.
Законы электролиза
Процессы электролиза подчиняются законам Фарадея:
Первый закон:
Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита.
Второй закон:
При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам.
Для расчетов используют объединенное уравнение законов Фарадея:
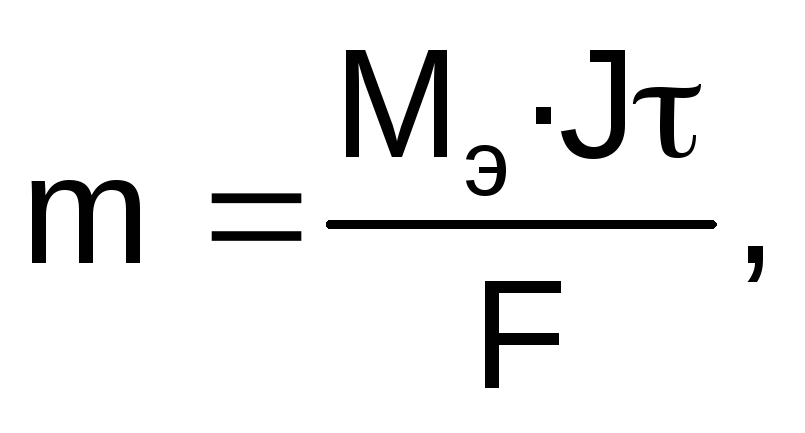
где m – масса электролита, подвергшаяся химическому превращению, или масса вещества, выделившегося на электроде, г; Мэ – молярная масса эквивалентов вещества, г/моль; J – сила тока, А; — время электролиза, с; F – число Фарадея (96500 Кл/моль).
Молярная масса эквивалентов вещества рассчитывается по формуле:
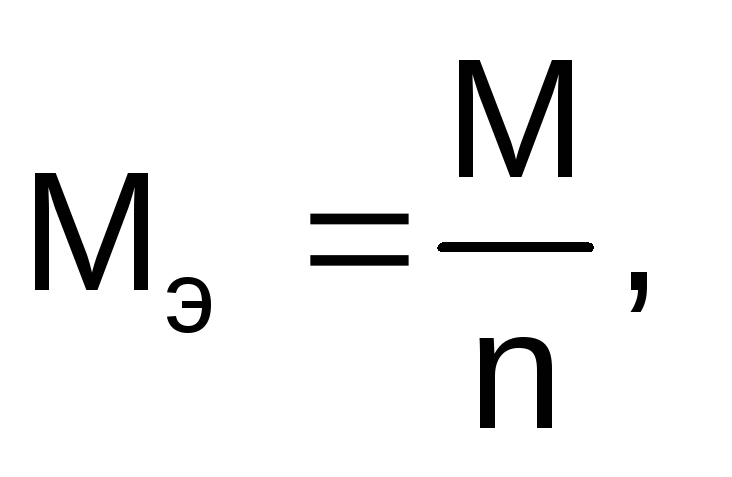
где М – молярная масса вещества, г/моль;
n – число электронов, участвующих в электродном процессе.
Для расчета объемов газообразных продуктов электролиза в законе Фарадея молярная масса эквивалентов вещества Мэ заменяется на молярный объем эквивалента газа при нормальных условиях (Vэ), который рассчитывается по формуле:
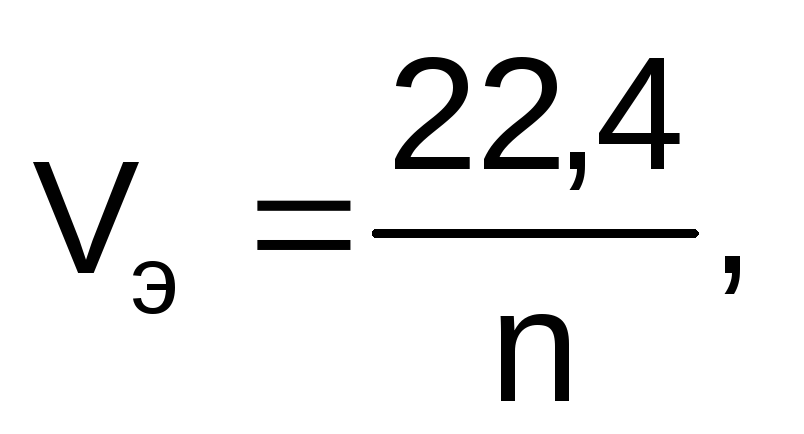
где 22,4 – это объем,
который занимает 1 моль любого газа при
нормальных условиях, л; n
– число 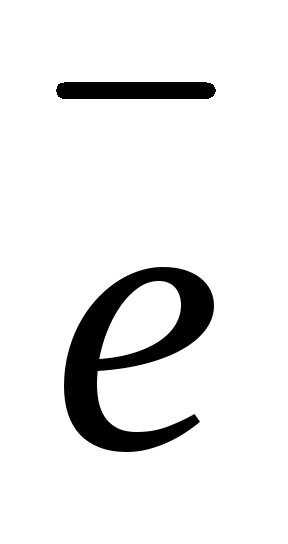 ,
отданных или принятых 1 моль газа.
,
отданных или принятых 1 моль газа.
При проведении электролиза в реальных условиях, вследствие побочных процессов масса вещества, выделившегося на электроде, оказывается меньше массы, рассчитанной по закону Фарадея. Отношение массы вещества, полученной при электролизе (mпракт.) к массе вещества, рассчитанной по закону Фарадея (mтеор.), выраженное в процентах, называется выходом по току (Вт):
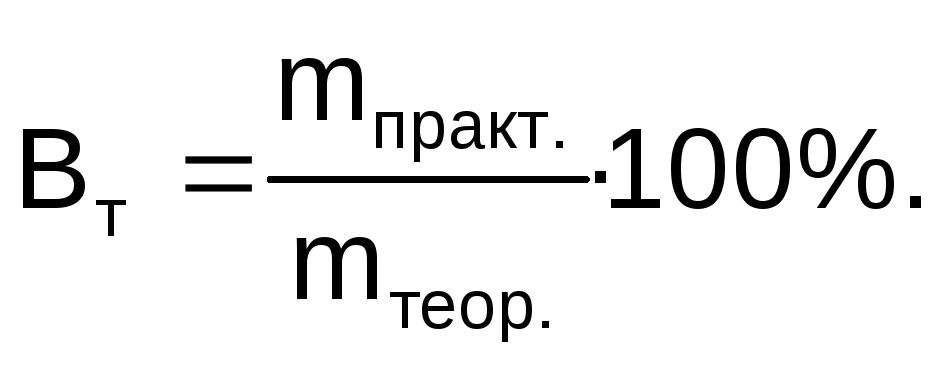
Пример 1. Составьте электронные уравнения электродных процессов, протекающих при электролизе раствора CuSO4. Определите массу меди и объем газа, выделившихся на электродах при прохождении тока силой 5 А в течение 2 часов.
Решение. В водном растворе CuSO4 диссоциирует по схеме
CuSO4 Cu2+ + SO42–
При электролизе раствора соли CuSO4 на катоде будут восстанавливаться ионы Cu2+, а на аноде – окисляться молекулы воды.
К атод
(–):Cu2+ + 2
атод
(–):Cu2+ + 2
Cu
2
Cu
2
Анод (+): 2Н2О
— 4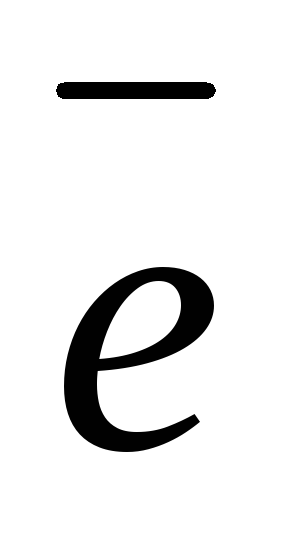
О2 + 4Н+ 1
О2 + 4Н+ 1

Суммарная реакция: 2CuSO4 + 2H2O 2Cu + O2 + 2H2SO4
Молекулы H2SO4 образуются в результате побочной реакции между ионами Н+ и кислотными остатками SO42–, которые накапливаются у поверхности анода.
Масса меди, выделившейся на катоде:
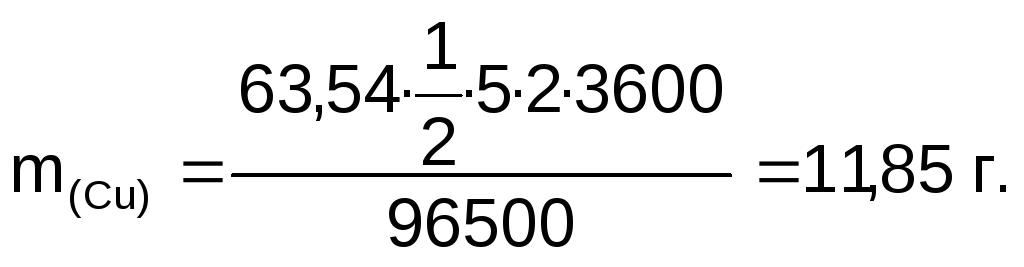
Объем кислорода, выделившегося на аноде:

Ответ: m(Сг)=11,85
г; 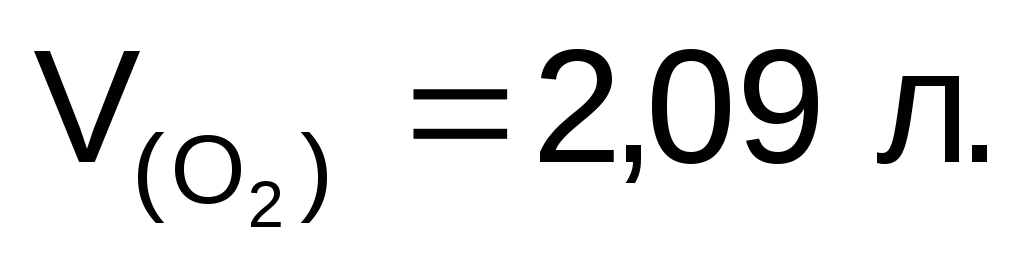
Пример 2. Составьте схему электролиза водного раствора соли NaCl и рассчитайте массу образовавшегося на катоде гидроксида натрия, если на аноде выделилось 1,12 л газа.
Решение. В водном растворе NaCl диссоциирует по схеме:
NaCl Na+ + Cl–
При электролизе раствора NaCl на катоде будет восстанавливаться водород из молекул воды, а на аноде – окисляться ионы Cl– до газообразного Cl2:
К атод
(–): 2Н2О
+ 2
атод
(–): 2Н2О
+ 2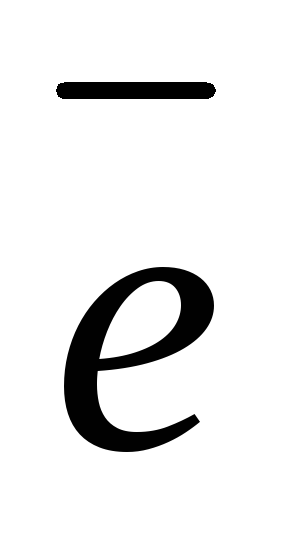
Н2 + 2ОН– 1
Н2 + 2ОН– 1
Анод (+): 2Cl– — 2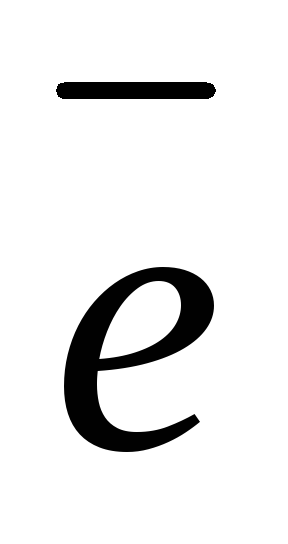
Cl2 1
Cl2 1

Суммарная реакция: 2NaCl + 2H2O H2 + 2NaOH + Cl2
Молекулы NaОН образуются в результате взаимодействия ионов ОН– с ионами Na+, которые накапливаются у поверхности катода.
Молярный объем эквивалента хлора:
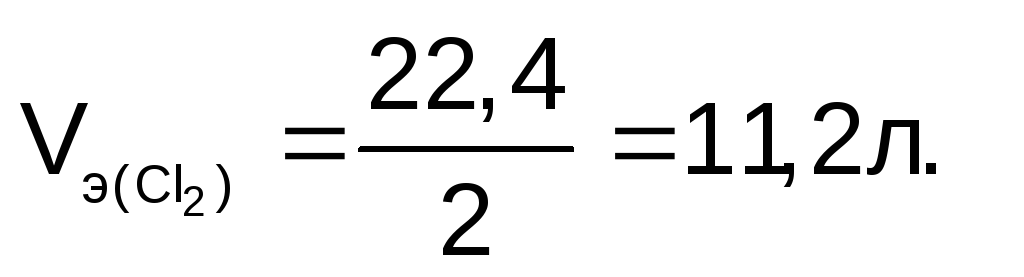
Количество эквивалентов хлора:
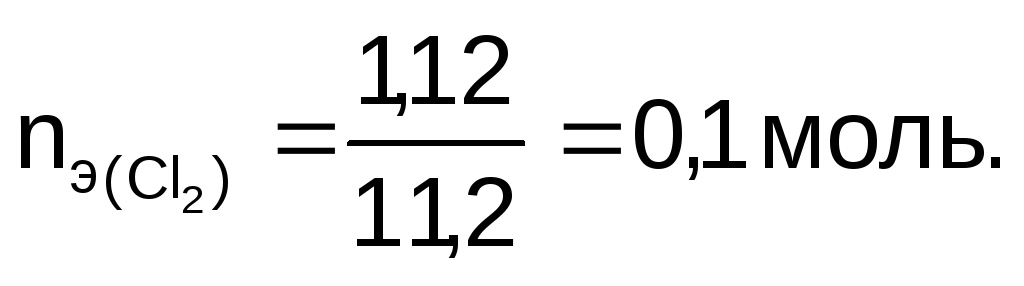
Так как на электродах выделяется одинаковое количество эквивалентов веществ, то
nэ(NaOH) = 0,1 моль.
Масса образовавшегося NaOH:
n(NaOH) = Mэ(NaOH)nэ(NaOH) = 40 0,1 = 4 г.
Ответ: 4 г.
Пример 3. Определите массу цинка, который выделится на катоде при электролизе сульфата цинка в течение 1 часа при токе 26,8 А, если выход цинка по току равен 58%. Составьте схему электродных процессов.
Решение. Согласно закону Фарадея масса выделившегося цинка:
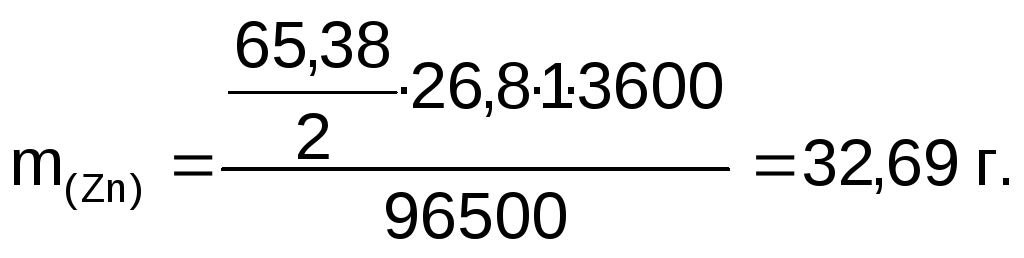
С учетом выхода по току практически выделившаяся масса цинка:

С хема
электролиза раствораZnSO4:
хема
электролиза раствораZnSO4:
ZnSO4 Zn2+ + SO42–
К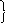
1
атод (–):Zn2+ + 2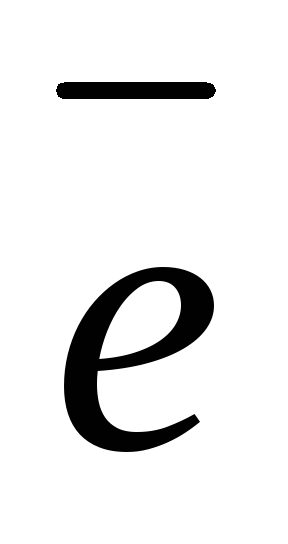
Zn
Zn 2H2O
+ 2
H2 + 2OH–
H2 + 2OH–
А нод
(+): 2H2O
— 4
нод
(+): 2H2O
— 4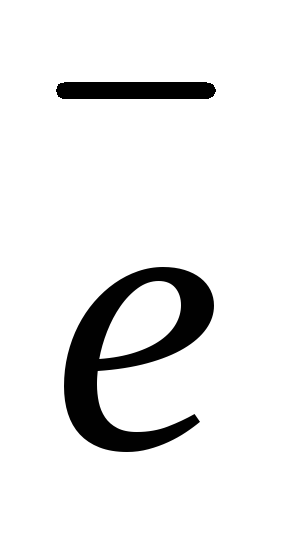
O2 + 4H+ 1
O2 + 4H+ 1
Cуммарная реакция:
2ZnSO4 + 4H2O Zn + H2 + Zn(OH)2 + O2 + 2H2SO4
Низкий выход по току цинка объясняется тем, что одновременно с цинком на катоде восстанавливаются молекулы воды и часть электричества расходуется на этот процесс.
Ответ: 18,96 г.
Электролиз. Законы фарадея
Окислительно-восстановительный процесс, принудительно протекающий под действием электрического тока, называется электролизом.
Электролиз проводят в электролизере, заполненном электролитом, в который погружены электроды, подсоединенные к внешнему источнику тока.
Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита. Электрод, подсоединенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода.
Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом.
Инертным называется анод, материал которого не окисляется в ходе электролиза. К инертным электродам относятся, например, графитовый (угольный) и платиновый.
Растворимым называется анод, материал которого может окисляться в ходе электролиза. Большинство металлических электродов являются растворимыми.
В качестве электролита могут быть использованы растворы или расплавы. В растворе или расплаве электролита ионы находятся в хаотичном движении. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду, а анионы — к аноду и, соответственно, на электродах они могут разряжаться.
При электролизе расплавов с инертными электродами на катоде возможно восстановление только катионов металла, а на аноде − окисление анионов.
При электролизе водных растворов на катоде кроме катионов металла, могут восстанавливаться молекулы воды, а в кислых растворах — ионы водорода Н+. Таким образом, на катоде возможны следующие конкурирующие реакции:
(-) К: Меn+ + nē → Me
2H2O + 2 ē → H2 + 2 OH—
2Н+ + 2 ē → Н2
26
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала.
При электролизе водных растворов с растворимым анодом, кроме окисления анионов, возможны реакции окисления самого электрода, молекул воды и в щелочных растворах гидроксид-ионов (ОН—):
(+) А: Me — n ē → Меn+
окисление аниона Е0
2H2O – 4 ē O2 + 4 H+
4OH–— 4 ē = O2 +2H2O
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала.
Для электродных реакций приведены равновесные потенциалы в отсутствии электрического тока.
Электролиз — процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений. Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации называется перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, плотность тока, температура, рН-среды и др.
Перенапряжения катодного выделения металлов сравнительно невелики.
С высоким перенапряжением, как правило, протекает процесс образования газов, таких как водород и кислород. Минимальное перенапряжение водорода на катоде в кислых растворах наблюдается на Pt (=0,1 В), а максимальное −на свинце, цинке, кадмии и ртути. Перенапряжение изменяется при замене кислых растворов на щелочные. Например, на платине в щелочной среде перенапряжение водорода =0,31 В (см. приложение).
Анодное выделение кислорода также связано с перенапряжением. Минимальное перенапряжение выделения кислорода наблюдается на Pt-электродах (=0,7 В), а максимальное − на цинке, ртути и свинце (см. приложение).
27
Из вышеизложенного следует, что при электролизе водных растворов:
1) на катоде восстанавливаются ионы металлов, электродные потенциалы которых больше потенциала восстановления воды (-0,82В). Ионы металлов, имеющие более отрицательные электродные потенциалы чем -0,82В, не восстанавливаются. К ним относятся ионы щелочных и щелочноземельных металлов и алюминия.
2) на инертном аноде с учетом перенапряжения кислорода протекает окисление тех анионов, потенциал которых меньше потенциала окисления воды (+1,23В). К таким анионам относятся, например, I—, Br—, Cl—, NO2—, ОН—. Анионы СO32-, РO43-, NO3—, F— — не окисляемы.
3) при электролизе с растворимым анодом, в нейтральных и кислых средах растворяются электроды из тех металлов, электродный потенциал которых меньше +1,23В, а в щелочных – меньше, чем +0,413В.
Суммарными продуктами процессов на катоде и аноде являются электронейтральные вещества.
Для осуществления процесса электролиза на электроды необходимо подать напряжение. Напряжение электролиза Uэл-за – это разность потенциалов, необходимая для протекания реакций на катоде и аноде. Теоретическое напряжение электролиза (Uэл-за, теор) без учета перенапряжения, омического падения напряжения в проводниках первого рода и в электролите
Uэл-за, теор = Eа – Eк , (7)
где Eа , Eк — потенциалы анодных и катодных реакций.
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит тока выражается двумя законами Фарадея.
I закон Фарадея. Количество вещества, образовавшегося на электроде при электролизе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита:
, (8)
28
где k – электрохимический эквивалент, г/Кл или г/А·ч; Q – количество электричества, Кулон, Q =It; t-время, с; I-ток, А; F = 96500 Кл/моль (А·с/моль) = 26,8 А·ч/моль – постоянная Фарадея; Э- эквивалентная масса вещества, г/моль.
В электрохимических реакциях эквивалентная масса вещества определяется:
. (9)
n –число электронов, участвующих в электродной реакции образования этого вещества.
II закон Фарадея. При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
, (10)
где m1 и m2 – массы веществ 1 и 2, Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2.
На практике часто вследствие протекания конкурирующих окислительно-восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству.
Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Вт называется выраженное в процентах отношение количества фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор:
Пример 10. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие вещества будут выделяться на электродах, если угольный электрод заменить на медный?
Решение: В растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным электродам.
На катоде возможны следующие процессы восстановления:
29
(-) К: Na+ + ē → Na
2H2O + 2 ē → H2 + 2 OH—
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в прикатодном пространстве гидроксид- ионов ОН—. Имеющиеся у катода ионы натрия Na+ совместно с ионами ОН— будут образовывать раствор щелочи NaOH.
На аноде возможны следующие реакции:
(+)А: 2 SO42- — 2 ē → S2O82-
2 H2O — 4 ē → 4H+ + O2.
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала. Поэтому на аноде будет протекать окисление молекул воды с выделением кислорода, а в прианодном пространстве накапливаются ионы Н+. Имеющиеся у анода ионы SO42- с ионами Н+ будут образовывать раствор серной кислоты H2SO4.
Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6H2O = 2H2 + 4 NaOH + O2 + 2H2SO4.
катодные продукты анодные продукты
При замене угольного (инертного) анода на медный на аноде становится возможным протекание еще одной реакции окисления – растворение меди:
Cu – 2 ē → Cu2+
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарная реакция электролиза выразится уравнением:
Na2SO4 + 2H2O + Cu = H2 + 2 NaOH + CuSO4.
катодные продукты анодный продукт
Пример 11. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
30
Решение: В растворе хлорида никеля в электродных процессах могут участвовать ионы никеля Ni2+, Cl— и молекулы воды. В качестве инертного анода можно использовать графитовый электрод.
На катоде возможны следующие реакции:
(-) К: Ni2+ + 2 ē → Ni
2H2O + 2 ē → H2 + 2 OH—
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
На аноде возможны следующие реакции:
(+) А: 2 Cl— — 2 ē → Cl2
2H2O – 4 ē O2 + 4 H+.
Согласно величинам стандартных электродных потенциалов на аноде
должен выделяться кислород. В действительности, из-за высокого перенапряжения кислорода на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока равной 1а/см2, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора:
Ni2+ + 2Cl— = Ni + Cl2.
на катоде на аноде
Пример 12. Вычислить массу вещества и объем газа, выделившихся на инертных электродах при электролизе водного раствора нитрата серебра AgNO3, если время электролиза составляет 25 мин, а сила тока 3 А.
Решение. При электролизе водного раствора AgNO3 в случае с нерастворимым анодом (например, графитовый) на электродах протекают процессы:
(-) К: Ag+ + ē → Ag ,
2H2O + 2 ē → H2 + 2OH— .
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов серебра.
(+) A: 2H2O – 4 ē O2 + 4 H+,
анион NO3— не окисляем.
31
Анодные и катодные процессы связаны между собой: восстановление на катоде идет в той мере, в какой идет окисление на аноде. Другими словами, число электронов в анодной и катодной реакции должно быть одинаково, следовательно, катодную реакцию необходимо домножить на 4.
Суммарное уравнение электролиза нитрата серебра AgNO3:
4 AgNO3 + 2H2O = 4Ag + O2 + 4HNO3
на катоде анодные продукты
На катоде выделяется серебро. Эквивалентная масса cеребра г/моль. Массу серебра рассчитываем по первому закону Фарадея:. На аноде образуется кислород. Эквивалентная масса кислородаг/моль. Массу кислорода рассчитываем по второму закону Фарадея:, откудаг или в литрахл.
Законы электролиза:
Первый закон Фарадея: масса конкретного вещества mтеор, выделившегося на электроде, прямо пропорциональна количеству электричества, прошедшего через электролизер:
mтеор → ∞Q.
Введение в полученное соотношение коэффициента пропорциональности К превращает его в уравнение:
mтеор = к Q.
Коэффициент К называют электрохимическим эквивалентом. При Q = 1Кл, к= mтеор, т.е. электрохимический эквивалент – это масса вещества, выделившегося на электроде при прохождении через электролизер 1 кулона электричества.
Т.к. Q =It, то mтеор= k It,
где I — сила тока, прошедшего через электролизер, А;
t — время проведения электролиза, с.
Второй закон: если через электролизеры проходят одинаковые количества электричества, то массы веществ, выделившихся на электродах, относятся между собой как их эквивалентные массы, или
при Q=const m1/m2=Э1/Э2,
где m1, Э1 – масса и эквивалентная масса первого вещества, г;
m2, Э2 — масса и эквивалентная масса второго вещества, г.
Поменяем местами средние члены равенства:
m1/ МЭ1= m2/ МЭ2,
т.к. m/ МЭ=nэкв – это количества вещества эквивалентов, то
n экв1= n экв2,
n экв1 и n экв2, – этоколичества эквивалентов первого и второго веществ.
Следовательно, если через электролизеры проходят одинаковые количества электричества, то количества эквивалентов веществ, выделяющихся на электродах, образующихся и разлагающихся в растворах, будут равны.
Для выделения на электроде одного эквивалента любого вещества необходимо затратить одно и тоже количества электричества, равное приблизительно 96500 Кл.
1 моль эквивалентов несет 6,02∙1023 частиц, а каждая частица несет заряд 1∙10-19Кл, поэтому суммарный заряд 1 моля эквивалента равен:
F= NA∙ qe= 6,02∙1023∙1.6∙10-19=96493,3 = 96500Кл/моль-экв.
Количество электричества F, равное заряду моля электронов, необходимое для выделения на электроде одного эквивалента вещества называется числом Фарадея.
На основании этого:
из первого закона: при прохождении через электролизер 1 Кл электричества на электроде выделяется масса вещества, равная его электрохимическому эквиваленту К.
из второго закона: при прохождении через электролизер F кулонов электричества на электроде выделяется масса вещества, равная его химическому эквиваленту Э:
1 Кл
К г,
Кл
К г,
F Кл М Э г.
Кл М Э г.
К=М Э/ F
После подстановки в уравнение 1-го закона:
mтеор = M экв I∙t/F V = Vэкв t∙I/ F
При проведении электролиза расплава или раствора масса выделенного на электроде вещества mпр из-за побочныхпроцессов, протекающих в электролизере и соответственно требующих расхода электрической энергии, всегда меньше mтеор, рассчитанной по уравнению. Отношение mпр к mтеор называется выходом по току В.Т., выделяемого на электроде вещества, т.е.
В.Т. = mпр/ mтеор∙100%
Преобразовав соотношение получим:
mпр = mтеор∙В.Т.%/100% или mпр = Э I∙t∙В.Т.%/ F∙100%
если в электролизере выделяется газообразное вещество, то его количество удобнее выражать в объемных единицах. Получается
Vтеор = Vэкв I∙t В.Т.%/ F 100%
Эквивалентный объем газа рассчитывают с использование следствия из закона Авогадро: моль любого газа при н.у. занимает объем 22.4л.
Моль кислорода имеет массу 32г и занимает объем 22,4л, а эквивалент кислорода равен 8г и занимает объем 5,6л
32г———22,4л
8г — ——-х л
Х=5,6л.
Кинетика электродных процессов. Поляризация.
Опыт показывает, что при пропускании через какой-либо электролит тока с разностью потенциалов на зажимах ванны, например, в 1 в (при платиновых электродах), сила тока в процессе электролиза, постепенно уменьшаясь, через некоторое время практически становится равной нулю. В соответствии с законом Ома ( I=E/R ) Это может происходить либо по причине увеличения суммы внутреннего и внешнего сопротивлений, либо в результате падения ЭДС.
Увеличение общего сопротивления цепи может происходить в том случае, если на электродах отлагаются вещества, плохо проводящие электрический ток (сера, окисиды и др.). Однако главной причиной уменьшения силы тока в электролитической ванне является падение ЭДС. вследствие возникновения новой ЭДС, действующей в противоположном направлении и называемой ЭДС. поляризации. Возникновение противоположно направленной ЭДС (явление поляризации) наблюдается также и при прохождении электрического тока через гальванический элемент.
При отсутствии тока величина электродного потенциала определяется электрохимическим равновесием на границе соприкосновения металла с раствором. При прохождении тока через гальваническую цепь на поверхности электрода происходят различного рода реакции (например, выделение водорода или металла на отрицательном электроде и реакции выделения кислорода или растворения металлов на положительном). Вследствие этого равновесие у поверхности электрода нарушается и потенциал электрода изменяется (поляризация электродов) . Величина сдвига потенциала зависит от плотности тока (т. е. от силы тока, приходящейся на единицу поверхности электрода). Чем больше плотность тока, тем больше величина поляризации. Кроме того, поляризация зависит от природы электрода, состава раствора, температуры, природы реакции, протекающей на поверхности электрода, и других условий.
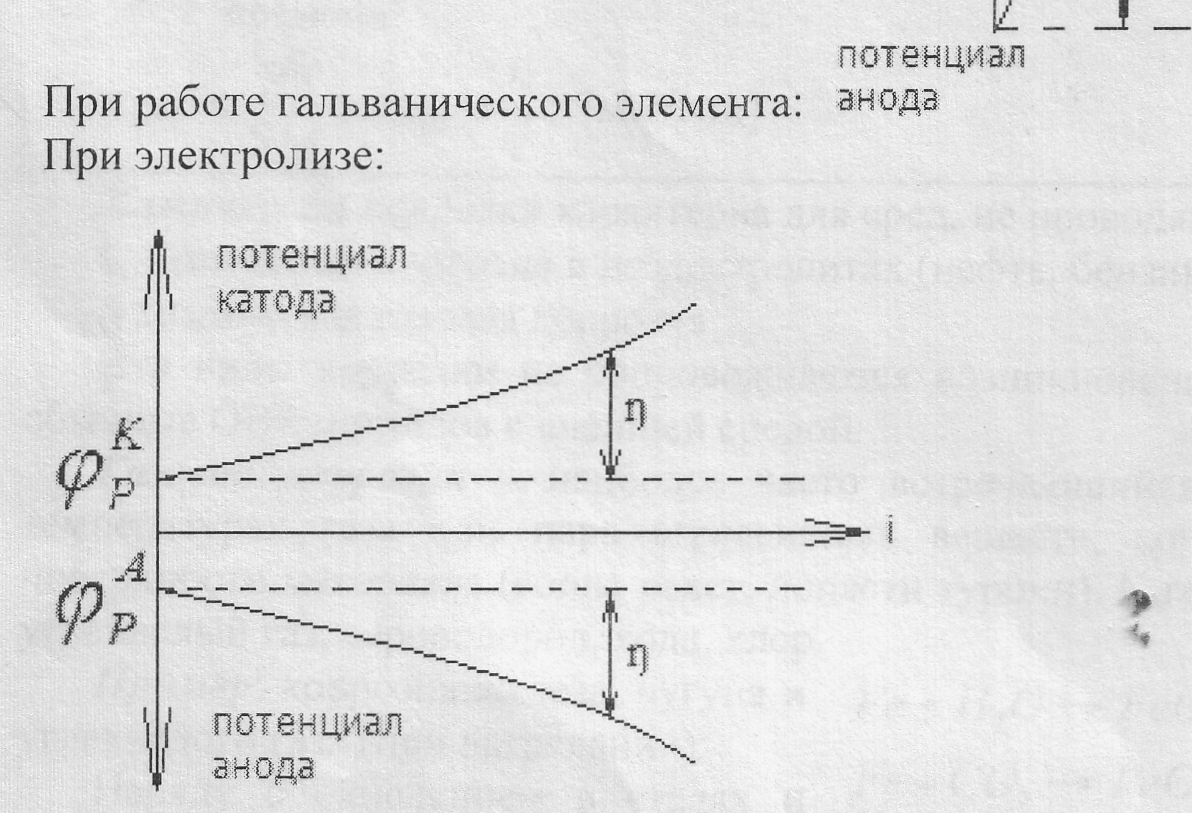
Поляризация (ή) – изменение потенциала электрода при прохождении через него тока.
Т.к. поляризация наблюдается как на катоде, так и на аноде, то различают катодную и анодную поляризации:
ηк = φр – φк
ηА= φА – φр
Поляризация в отрицательную сторону называется катодной, в положительную – анодной.
Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от протекающего тока. Т.к. электроды м.б. разными по площади, то в зависимости от площади электродов при φ= const могут быть разные токи, скорость реакции (Iтока) обычно относится к единице площади поверхности i = I/S (A/м2)
Явление поляризации ‘нежелательно как при проведении электролиза, так и при работе гальванических элементов. Поляризация снижает полезное напряжение гальванических -элементов и, наоборот, повышает напряжение, которое необходимо приложить к электролитической ячейке для проведения электролиза.
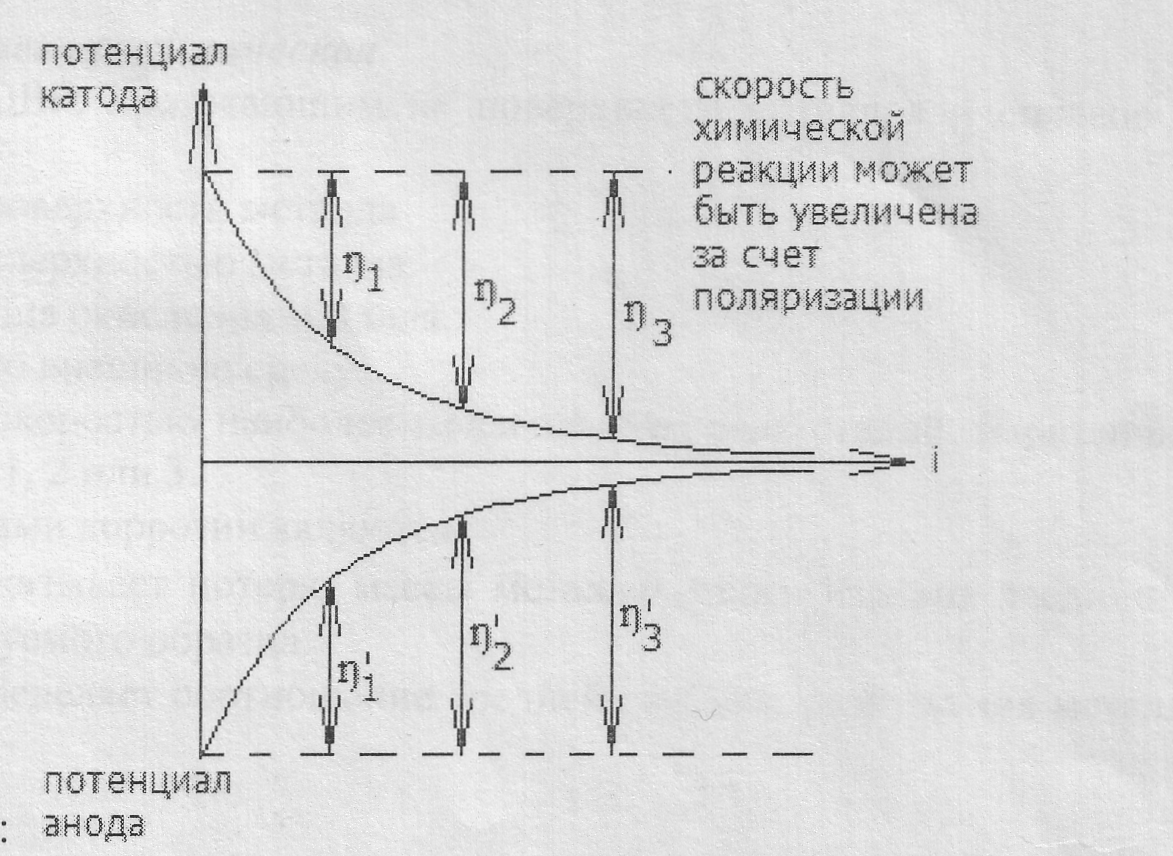
Поляризация вызывается различными причинами. Чаще всего она связана с изменением концентрации растворов у электродов (концентрационная поляризация) или же с изменением состояния поверхности электродов вследствие отложения на них других веществ (электродная поляризация).
Допустим, что в электролитической ванне с раствором медного купороса и электродами из чистой меди (катод) и черновой меди (анод) проводится электролиз. При этом ионы меди из раствора выделяются на медном катоде, а ионы S042_ вызывают переход меди из куска черновой меди в раствор (анодное растворение). Через некоторое время концентрация CuS04 у электродов станет неодинаковой: у катода она будет меньше, у анода — больше.
Внутри ванны возникнет концентрационный элемент ЭДС которого направлена противоположно внешней э. д. с, вызывающей электролиз, а именно: внешняя э. д. с. ■стремится выделить ионы меди на катоде, а э. д. с. концентрационного элемента способствует переходу ионов меди с катодной пластинки в раствор. Э.д.с. концентрационной поляризации незначительна и легко устраняется при перемешивании раствора. —
Другой вид поляризации можно наблюдать, если, к примеру, провести электролиз раствора соляной кислоты между электродами из платины. При электролизе, вследствие выделения на катоде водорода, а на аноде хлора, платиновые электроды превращаются в газовые. Внутри ванны возникает водородо-хлорная гальваническая цепь, э.д. с. которой направлена противоположно внешней и может быть приблизительно рассчитана по величинам нормальных электродных потенциалов. Так как
Е°Cl2/Cl— = + 1,358 в, Е°H2/H+ =0,000, то
E = Е°Cl2/Cl— — Е°H2/H = 1,358 – 0,0 = 1,36 В
Химическую поляризацию устраняют добавкой веществ (деполяризаторов), быстро вступающих в реакцию с продуктами, вызывающими поляризацию. Так, например, во всех случаях, когда поляризация вызывается выделением водорода, в катодное отделение прибавляют легко восстанавливающиеся вещества (например, HN03, К2Сг207, Мп02 и др.).
При выделении па электродах водорода и кислорода катодным деполяризатором должен быть окислитель, а анодным — восстановитель.
Вследствие поляризации для каждого электролита существует некоторое минимальное значение напряжения, которое необходимо приложить к платиновым электродам для того, чтобы мог нормально протекать электролиз. Оно называется напряжением разложения. Величина напряжения разложения зависит от природы продуктов, выделяемйгх при электролизе на электродах. Так, например, величины напряжения разложения водных растворов кислородных кислот и щелочей примерно одинаковы (около 1,7 в). Объясняется это тем, что при электролизе указанных электролитов на электродах выделяются газообразные водород и кислород, следовательно, возникает одна и та же поляризационная водородо-кислородная цепь с противоположно направленной э.д. с, которую приходится преодолевать внешней э.д. с.
Казалось бы, что для осуществления нормального течения электролиза необходимо приложить к электродам внешнюю ЭДС..теоретически равную (но не меньшую) э. д. с. гальванического элемента, возникающего внутри ванны в ходе того или иного процесса. Однако фактически требуемая величина напряжения разложения в большинстве случаев оказывается большей, чем э.д. с. поляризации. Разность между истинным значением напряжения разложения и ЭДС соответствующего гальванического элемента называется перенапряжение
Практическая работа 3 Расчет электролиза
ПРАКТИКА
Прохождение электрического тока через электролиты. Законы электролиза Фарадея.
При прохождении тока через некоторые растворы, например, через раствор серной кислоты, происходит разложение воды на составные части – водород и кислород, которые выделяются на пластинах, соединенных соответственно с отрицательным и положительным полюсами батареи. Такого рода растворы, разлагающиеся химически при прохождении через них тока, называются электролитами, а сам процесс разложения вещества электрическим током – электролизом. Проводники, погруженные в электролит для подведения к нему тока называются электродами: положительный электрод – анод, отрицательный электрод – катод. Продукты разложения электролита, например, водород и кислород, в опыте, выделяются на электродах все время, пока идет ток. Массу выделившегося вещества можно измерить. Если подобрать такой раствор, при котором выделяющееся вещество оседает в виде твердого осадка на электроде, то эту массу можно измерить без затруднений. Например, если пропускать ток через раствор медного купороса, то на катоде оседает медь. Это явление можно легко наблюдать, если катод сделать из угля – на черной поверхности угля будет заметен красноватый слой выделившейся меди. Взвешивая катод до и после опыта, можно определить массу осадившегося металла. Измерения показывают, что масса вещества, выделившегося на электродах, зависит от силы тока и времени электролиза. Замыкая цепь на разные промежутки времени, можно убедиться в том, что масса выделившегося вещества пропорциональна времени прохождения тока. Также масса выделившегося вещества пропорциональна силе тока. Таким образом, получается, что масса выделившегося вещества пропорциональна произведению силы тока и времени электролиза. Все это позволило Фарадею сформулировать важный закон, который носит его имя: масса вещества, выделившегося на электроде, пропорциональна заряду, или количеству электричества, прошедшему через электролит. Это первый закон Фарадея. Если m – масса выделившегося вещества, I – сила тока, t – время электролиза, q – полный заряд, прошедший через ванну за время t, то первый закон Фарадея можно записать так:
m = Kq = KIt, где K – коэффициент пропорциональности.
Полагая в этой формуле заряд q = 1, получим, что коэффициент K равен массе вещества, выделяемого зарядом в 1 Кл, или иначе массе вещества, выделяемого током 1А за 1 с. Исследования Фарадея показали, что величина K является характерной для каждого вещества. Величина K называется электрохимическим эквивалентом данного вещества. Таким образом, получаем, что электрохимическим эквивалентом вещества, называется масса этого вещества, выделяемая при электролизе одним кулоном протекшего через раствор электричества.
Электрохимические
эквиваленты различных веществ существенно
отличны один от другого. Ответ на вопрос
– от каких свойств вещества зависит
его химический эквивалент, дает следующий
важный закон, который также был установлен
Фарадеем на опыте (второй закон Фарадея):
электрохимические эквиваленты различных
веществ пропорциональны их молярным
массам и обратно пропорциональны числам,
выражающим их химическую валентность.
Уяснить этот закон можно с помощью
следующего примера: Молярная масса
серебра равна 0,1079 кг/моль, его валентность
– 1. Молярная масса цинка равна 0,0654
кг/моль, его валентность – 2. Поэтому по
второму закону Фарадея электрохимические
эквиваленты серебра и цинка должны
относиться как: 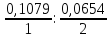 = 3,30
= 3,30
Если по прежнему обозначить через K [кг/Кл] электрохимический эквивалент вещества, через M [кг/моль] – его молярную массу, а через n – валентность (n = 1, 2, …), то второй закон Фарадея можно переписать в виде:
K
= 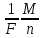
Здесь
через 1/F обозначен коэффициент
пропорциональности, который является
универсальной постоянной, т. е. имеет
одинаковое значение для всех веществ.
Величина F называется постоянной Фарадея.
Ее значение, найденное экспериментально
равно: F = 96484 Кл/моль. Отношение молярной
массы какого-либо вещества к его
валентности M/n называют химическим
эквивалентом данного вещества. Это
отношение показывает, какая масса
данного вещества необходима для замещения
одного моля водорода в химических
соединениях. У одновалентных веществ
химический эквивалент численно равен
молярной массе. Пользуясь этим понятием,
можно выразить второй закон Фарадея
следующим образом: электрохимические
эквиваленты веществ пропорциональны
их химическим эквивалентам. Теперь
можно выразить оба закона Фарадея в
виде одной формулы: m
= 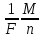 q
=
q
= 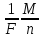 It,
где m
– масса вещества, выделяющегося при
прохождении через электролит количества
электричества q. Это объединенный закон
Фарадея. Эта формула имеет простой
физический смысл. Положим в ней m = M/n, т.
е. возьмем массу одного химического
эквивалента данного вещества. Тогда
получи F = q. Это значит, что постоянная
Фарадея численно равна заряду q, который
необходимо пропустить через любой
электролит, чтобы выделить на электродах
вещество в количестве, равном одному
химическому эквиваленту. Электролиз
находит техническое применение в таких
процессах как электролитический метод
получения чистых металлов, гальваностегия,
гальванопластика.
It,
где m
– масса вещества, выделяющегося при
прохождении через электролит количества
электричества q. Это объединенный закон
Фарадея. Эта формула имеет простой
физический смысл. Положим в ней m = M/n, т.
е. возьмем массу одного химического
эквивалента данного вещества. Тогда
получи F = q. Это значит, что постоянная
Фарадея численно равна заряду q, который
необходимо пропустить через любой
электролит, чтобы выделить на электродах
вещество в количестве, равном одному
химическому эквиваленту. Электролиз
находит техническое применение в таких
процессах как электролитический метод
получения чистых металлов, гальваностегия,
гальванопластика.
Задание: Зная, что химический эквивалент водорода равен 1,045∙10-8 кг/Кл, вычислите электрохимический эквивалент хлора. Валентность хлора равна 1, относительные атомные массы хлора и водорода равны 35,45 и 1,008.
Практическая работа №3:
Серебрение пластинок производится при плотности тока j = 0,5 А/дм2, при этом за время t = 5 ч выделяется масса m = 2 кг серебра. Найти площадь пластинок. Электрохимический эквивалент серебра K = 1,118×10-6 кг/Кл.
Указания:
Записать «Дано»
Записать численные значения и единицы измерения всех физических величин, перевести дольные и кратные значения величин в целые.
Использовать формулу первого закона Фарадея.
Использовать формулу для связи силы тока, плотности тока с площадью пластин: I = j×S
Скомбинировать две вышеприведенные формулы, выразить неизвестную площадь пластин через известные величины, подставить численные значения и вычислить.
Электролитическая ванна для получения алюминия рассчитана на 25000 А. Электролиз алюминия производится при рабочем напряжении 4,8 В на ванне. Выход по току (КПД) равен 86%. Электрохимический эквивалент K = 0,335 г/А×ч. Сколько алюминия производится за сутки? Каков расход электроэнергии на 1 кг алюминия?
Указания:
Записать «Дано»
Записать численные значения и единицы измерения всех физических величин, перевести дольные и кратные значения величин в целые.
Использовать формулу первого закона Фарадея с учетом КПД: m = ηKIt, η — КПД
Использовать формулу для работы тока A = UIt, так как она равна потребляемой электроэнергии.
Расход электроэнергии найти, используя формулу: γ =
 ,
где γ – расход электроэнергии.
,
где γ – расход электроэнергии.Сделать проверку размерности полученных величин.
Под каким напряжением следует проводить электролиз воды на установке с КПД 80%, чтобы при затратах электроэнергии не более 965 кДж выделившийся кислород находился в объеме 1л под давлением 200 кПа при температуре 300К? Постоянная Фарадея, валентность кислорода и молярная газовая постоянная равны соответственно 96500 Кл/моль; 2; 8,31 Дж/(моль×К).
Указания:
Записать «Дано»
Записать численные значения и единицы измерения всех физических величин, перевести дольные и кратные значения величин в целые.
Искомое напряжение найти, выразив его из формулы: Eполезная = qU, где Eполезная – электроэнергия (полезная), идущая непосредственно на выделение кислорода.
Исходя из того, что КПД определяется по формуле: η =
 ,
выразить из этой формулы Eполезная.
,
выразить из этой формулы Eполезная.Найти величину заряда из объединенного закона Фарадея: m =
 , выразив из него q.
, выразив из него q.Подставив формулы из пунктов d и e в формулу для напряжения (пункт с), получить формулу для напряжения. В этой формуле помимо напряжения остается неизвестной масса выделившегося кислорода.
Массу выделившегося кислорода найти, выразив ее из уравнения Менделеева-Клапейрона: pV =
 RT, M = 32×10-3 кг/моль – молярная масса кислорода.
RT, M = 32×10-3 кг/моль – молярная масса кислорода.Подставив формулу для массы m в полученную в пункте f формулу для напряжения, получить конечную формулу, подставить численные значения и вычислить.
Сделать проверку размерности полученных величин.
При никелировании изделия в течение 1 часа отложился слой никеля толщиной l = 0,01 мм. Определить плотность тока j, если атомная масса никеля A = 0,0587 кг/моль, валентность n = 2, плотность никеля ρ = 8,9×103 кг/м3.
Указания:
Записать «Дано»
Записать численные значения и единицы измерения всех физических величин, перевести дольные и кратные значения величин в целые.
Использовать объединенный закон Фарадея: m =

Использовать формулы для массы: m = ρ×V = ρ×l×S, для силы тока: I = j×S, где S – площадь покрытия никелем.
Подставить формулы из пункта d в формулу из пункта c.
Выразить плотность тока, подставить численные значения и вычислить.
Сделать проверку размерности полученных величин.
При электролизе раствора серной кислоты затрачивается мощность 37 Вт. Определить сопротивление электролита, если за время 50 мин выделилось 0,3 г водорода. КПД установки 80%. Постоянная Фарадея 96,5×103 Кл/моль. Атомная масса и валентность водорода равны соответственно 1,0×10-3 кг/моль и 1. Указания:
Записать «Дано»
Записать численные значения и единицы измерения всех физических величин, перевести дольные и кратные значения величин в целые.
Использовать объединенный закон Фарадея: m =
 ,
где η – КПД установки.
,
где η – КПД установки.Использовать формулы — закона Ома: I =
 ,
мощности: P = U×I
,
мощности: P = U×IВыразить из объединенного закона Фарадея силу тока.
Скомбинировав формулы пункта d,выразить искомое сопротивление электролита.
Подставить формулу из пункта e в формулу для сопротивления из пункта f.
Подставить численные значения и вычислить.
Сделать проверку размерности полученных величин.
Контрольные вопросы:
Сформулируйте первый закон Фарадея.
Сформулируйте второй закон Фарадея.
Сформулируйте объединенный закон Фарадея.
Что такое химический эквивалент данного вещества?
Что такое постоянная Фарадея?
Укажите численное значение и единицу измерения постоянной Фарадея.
Какой из электродов называется анодом, а какой катодом?
Каким образом можно измерить массу выделившегося вещества.
Укажите, при каких технологических процессах применяется электролиз и кратко поясните в чем заключается каждый из этих процессов.




 ,
где γ – расход электроэнергии.
,
где γ – расход электроэнергии.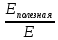 ,
выразить из этой формулы Eполезная.
,
выразить из этой формулы Eполезная.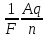 , выразив из него q.
, выразив из него q. RT, M = 32×10-3 кг/моль – молярная масса кислорода.
RT, M = 32×10-3 кг/моль – молярная масса кислорода.
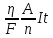 ,
где η – КПД установки.
,
где η – КПД установки.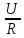 ,
мощности: P = U×I
,
мощности: P = U×I