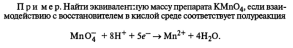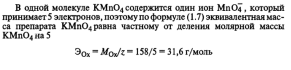2. Закон Авогадро и его следствия.
1.Химия – часть естествознания. Химические процессы. Типы химических соединений. Химическая номенклатура. Номенклатура средних, кислых, основных солей.
Химия – часть естествознания.
Химия-наука о веществах. Она изучает вещества и их превращения, сопровождающиеся изменением внутреннего строения вещества и электронной структуры взаимодействующих атомов, но не затрагивающие состав и структуру ядер.
Известно около 7000000 химических соединений и из них 400000 неорганических.
Химия – одна из фундаментальных дисциплин. Она является частью естествознания, наук о природе. Она связана с множеством других наук, таких как физика, медицина, биология, экология и т.д.
Химические процессы.
Типы химических соединений.
Химическая номенклатура.
В настоящее время для названия химических элементов используют тривиальную и рациональную номенклатуру, причем последняя делится на русскую, полусистематическую (международную) и систематическую.
В тривиальной номенклатуре используют исторически сложившиеся собственные имена химических веществ. Они не отражают состав химических соединений. Использование таких названий чаще всего дань традиции. Пример: СаО – негашеная известь, N2О – веселящий газ.
В рамках русской номенклатуры используют для названия химических соединений корни русских названий, а в полусистематической – латинских. Чтение формул химических соединений начинается справа налево. И русская и полусистематическая номенклатуры в полной мере отражаю состав химических соединений. Пример: СаО – окись кальция (оксид кальция), N2O – полуокись азота (оксид азота I).
В целях унификации и упрощения формирования названий международный союз теоретической и прикладной химии предложил иную систему формирования химических соединений. Согласно этим правилам называть эти вещества следует слева направо. Пример: СаО – кальций оксид, N2O – диазот оксид.
В настоящее время самые распространенные в использовании русская и полусистематическая номенклатура.
Номенклатура средних, кислых, основных солей.
По химическому составу различают средние, кислые, основные соли. Существуют еще двойные, смешенные и комплексные соли. Большинство солей независимо от их растворимости в воде являются сильными электролитами.
Нормальные соли.
Закон Авогадро.
Амадео Авогадро в 1811 году выдвинул гипотезу, которая в дальнейшем была подтверждена опытными данными и потому стала называться законом Авогадро:
Одинаковые объемы различных газов при одинаковых условиях (температуре и давлении) содержат одинаковое число молекул.
Авогадро предположил, что молекулы простых газов состоят из двух одинаковых атомов. Таким образом, при соединении водорода с хлором их молекулы распадаются на атомы, которые образуют молекулы хлористого водорода. Из одной молекулы хлора и одной молекулы водорода образуется две молекулы хлористого водорода.
Равные количества газообразных веществ, находящихся при одинаковых условиях (давлении и температуре), занимают равные объемы. В частности: при нормальных условиях 1 моль любого газа занимает объем, равный 22.4 литра. Этот объем называют молярным объемом газа. Нормальные условия: 273К, 760мм рт. ст. или 1,01*10^5Па.
Плотности любых газообразных веществ, находящихся при одинаковых условиях (Т, Р), относятся как их мольные (молярные) массы.
Отношение плотностей – относительная плотность одного газа по другому (Dотн.), тогда отношение молярных масс – тоже равно Dотн.
Если относительная плотность газа определена по водороду или по воздуху, то значение μ=2Dн и μ=29Dвозд. Где 29 – мольная масса воздуха.
Если газ находится в реальных условиях, то его объем вычисляется по формуле Менделеева-Клапейрона:
P*V=(m/μ)*R*T, где R=8,31 Дж/моль*К
Газовые смеси.
Если в газовой смеси нет взаимодействия, то каждый газ смеси обладает своими индивидуальными свойствами и подчиняется рассмотренным ранее законам.
Состав газовых смесей может выражаться: массовыми, объемными, мольными долями.
Массовая доля газа – отношение массы газа к массе всей газовой смеси.
Объемная доля газа – отношение объема газа к объему всей смеси.
Мольная доля газа – отношение числа молей газа к числу молей смеси.
Одним из следствий закона Авогадро: объемная доля = мольной доле.
Основные характеристики газовой смеси суммируются из характеристик ее компонентов. Так общее давление газовой смеси равно сумме парциальных давлений газа.
3. Закон эквивалентов. Эквивалент. Эквивалентная масса и эквивалентный объем. Эквивалентные массы сложных соединений.
Эквивалент.
Эквивалентом вещества (элемента) Э называется такое его количество, которое взаимодействует с одним молем атомов водорода или вообще с одним эквивалентом любого другого вещества (элемента). Например, найдем эквивалент некоторых веществ: HCl – 1 моль, h3O. С одним молем водорода соединяется 1 моль хлора и ½ атомов кислорода, и следовательно эквиваленты равна соответственно 1 и ½.
Эквивалентная масса и эквивалентный объем.
Эквивалентная масса (Эм) называется масса одного эквивалента вещества (элемента).
Эквивалентные массы ранее рассмотренных элементов равны Эм(Cl)=35.3 г/моль, Эм(O)=8 г/моль.
Эквивалентную массу любого элемента можно определить по формуле: Эм=μ/СО, где СО- абсолютная величина степени окисления в соединениях. Поскольку большинство элементов имеют переменную степень окисления, то значения их эквивалентов в различных соединениях различно. Например найдем
Если в задаче указаны объемы газов, то удобнее пользоваться понятием эквивалентный объем, вычисляемый с помощью закона Авогадро. Эквивалентным объемом называется объем занимаемый при н.у. одним эквивалентом вещества. Так 1 моль водорода, т.е. 2г. Занимает объем 22.4л., следовательно 1г. (т.е. одна эквивалентная масса), будет занимать 11,2л. Аналогично можно найти эквивалентный объем кислорода который равен 5.6л.
Закон эквивалентов.
Массы реагирующих веществ, а также продуктов реакции пропорциональны изх эквивалентным массам. m1/m2=Эм1/Эм2
Для химической реакции:
νаА+νвВ=νсС+νдД справедливо nЭм(А)=nЭм(В)=nЭм(С)=nЭм(Д)
Где nЭм – число эквивалентных масс. Поэтому если известно число эквивалентных масс одного из веществ, то отпадает необходимость в подсчете числа Эм оставшихся веществ. Очевидно, что число эквивалентных масс равно отношению массы вещества к эквивалентной массе.
Закон эквивалентов для эквивалентных объемов записывается в следующем виде:
V1/V2=Эv1/Эv2
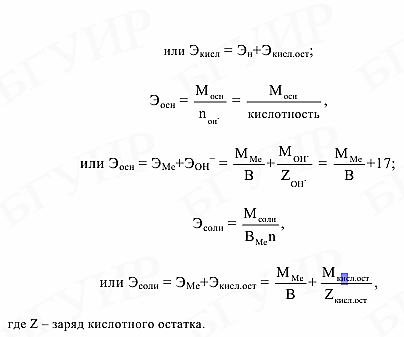
Эквивалентные массы сложных соединений.
На основе закона эквивалентных масс справедливы следующие формулы для расчета Эм:
Эм(оксида)=μ(оксида)/∑СОэл-та ,где ∑СОэл-та – суммарная степень окисления одного из элементов (она равна произведению степери окисления элемента на число атомов этого элемента)
Эм(соли)=μ(соли)/∑z , где ∑z – суммарный заряд иона (катиона или аниона).
Эм(кислоты)=μ(кислоты)/nh(основность-число Н)
Эм(основания)=μ(основания)/nон(кислотность основания – число ОН)
h4PO4+2KOH=K2HPO4+2h3O
3Ca(OH)2+h4PO4=(CaOH)3PO4+3h3O
Al2(SO4)3+6KOH=2Al(OH)3+3K2SO4
Электрон является объектом микромира и в своем поведении он подчиняется особым законам, не похожим на законы макромира. Движение объектов микромира описывается не законами механики Ньютона, а законами квантовой механики. Квантовая механики основывается на двух основных принципах.
Принцип корпускулярно-волнового дуализма.
Согласно этому принципу поведение объектов микромира может быть описано как движение частицы (корпускулы) и как волновой процесс. Физически это представить невозможно. Математически это описывается уравнением Де Бройля:
ק=(h*ν)/m*υ, где ν – длина волны, соответствующая электрону массой m и движущегося со скоростью υ.
Принцип неопределенности Гейзенберга.
Для электрона не возможно с какой либо точностью определить координату х и импульс (px=m*Vx, где Vx – скорость электрона в направлении координаты х)
ΔxΔp≥h/2∏
Из этих двух принципов складывается ветоятностно-статистический характер квантовой механики.
6. Последовательность заполнения электронами состояний в атомах различных элементов (энергетические состояния электронов в многоэлектронных атомах). Электронные формулы многоэлектронных атомов на примере элементов 2 и 3 периодов. Принцип Паули. Правило Хунда. Электронные формулы элементов в основном и возбужденных состояниях на примере атомов азота, углерода, серы.
Последовательность заполнения электронами состояний в атомах различных элементов (энергетические состояния электронов в многоэлектронных атомах).
Согласно принципу минимума энергии, наиболее точным состоянием атома будет то, при котором электроны размещаются на орбиталях с наименьшей энергией. Состояние атома, которое характеризуется минимальным значением энергии электрона называется основным (невозбужденным).
Порядок заполнения орбиталей энергетически определяется:
1).принцип минимума энергии
2).принцип Паули
3).правило Хунда
Принцип наименьшей энергии
Так появление второго электрона у атома гелия приводит к тому, что на эффект взаимодействия электрона с положительным ядром, влияет еще и сила отталкивания электронов между собой. При дальнейшем росте электронов, внутренние или основные электроны препятствуют взаимодействию внешних с ядром. То есть внутренние электроны экранируют внешние, В связи с этими причинами в многоэлектронных атомах различаются подуровни с соответственно различным значением энергии. Порядок чередования подуровней определяется двумя правилами Клечковского:
1).Меньшая энергия отвечает подуровню с меньшим значением суммы n+l
2).При одинаковых значениях суммы меньшая энергия отвечает подуровню с меньшим значением m
Таблица. 4s подуровень по энергии ниже, чем 3d подуровень, т.к. s электроны меньше экранируются, чем d электроны, т.к. могут ближе проникнуть к ядру.
Принцип Паули
В атоме не может быть двух электронов с одинаковым наборов квантовых чисел. Таким образом, на одной орбитали может находится не более двух электронов, причем с разными спинами вращения.
Правило Хунда
Подуровень заполняется таким образом, чтобы их суммарный спин был максимальным. То есть в пределах подуровня сначала заполняется максимальное число квантовых ячеек.
7. Характер изменения химических свойств элементов по мере увеличения их порядкового номера. S-, p-, d-, f— элементы. Связь между электронной конфигурацией атомов элементов и их положением в периодической системе.
Характер изменения химических свойств элементов по мере увеличения их порядкового номера.
При увеличении порядкового номера в периодах слева направо нарастают неметаллические (кислые) свойства. В группах нарастают металлические (основные свойства). Это приводит к тому, что вблизи диагонали проведенной из левого верхнего угла в правый нижний элементы образующие соединения амфотерного характера.
Кроме того, периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения атомов, а именно числом электронов на их внешних энергетических уровнях.
S-, p-, d-, f— элементы. Связь между электронной конфигурацией атомов элементов и их положением в периодической системе.
Начало каждого периода соответствует началу застройки нового энергетического уровня. Номер периода определяет номер внешнего уровня. Он является застраивающимся у элементов главных подгрупп. Т.е. s и p элементов. У d элементов идет заполнение первого с наружи уровня. У f- второго снаружи. Т.е. внешний и застраивающийся уровень не всегда совпадают. Т.к у d элементов заполняется первый снаружи уровень, а химические свойства в первую очередь определяются структурой внешнего энергетического уровня, то химические свойства этих элементов похожи между собой (например, все они металлы). У них отсутствует резкое изменение свойств при переходе от элемента к элементу. Как, например, у s и p элементов. Еще более похожи свойства f элементов (лантаноиды и актиноиды), поскольку у них заполняются еще более глубокие подуровни.
10.Ковалентность в методе валентных связей. Валентные возможности атомов элементов второго периода в основном и возбужденном состояниях. Сравнить валентные возможности (ковалентность) S и О, F и Cl в рамках метода валентных связей.
Ковалентность в методе валентных связей.
Каждый атом предоставляет один из пары электронов. Общее число электронных пар, которое он образует с атомами других элементов, называется ковалентностью.
Валентные возможности атомов элементов второго периода в основном и возбужденном состояниях.
Сравнить валентные возможности (ковалентность) S и О, F и Cl в рамках метода валентных связей.
1. Основные законы химии. Закон эквивалентов. Эквиваленты, эквивалентные массы и эквивалентные объемы (для газов).
закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам, или массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
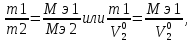
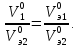
где m1, m2, MЭ1, MЭ2 – массы и эквивалентные массы реагирующих веществ; V01, V02, V0э1, V0э2 – объемы и эквивалентные объемы газообразных веществ, измеренные (рассчитанные) при нормальных условиях.
Для приведения объема к нормальным условиям используется уравнение, объединяющее законы Бойля – Мариотта и Гей-Люссака,
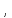
 где
P
и V
– давление и объем газа при данной
температуре Т; V0
– объем газа при нормальных давлении
(Р0 = 101332 Па) и температуре (Т0 = 273 К).
где
P
и V
– давление и объем газа при данной
температуре Т; V0
– объем газа при нормальных давлении
(Р0 = 101332 Па) и температуре (Т0 = 273 К).
Эквивалентом (Э) химического элемента называется такое его количество, которое соединяется (замещает) с 1 моль атомов водорода или 1/2 моль атомов кислорода,выражается в молях (М). Эквивалентная масса (МЭ) – масса одного эквивалента вещества, выраженная в граммах. Эквивалент водорода равен его молю атомов, т.е. ЭН = 1 М, а
эквивалентная масса водорода равна 1 г/моль. Эквивалент кислорода равен 1/2 моль атомов кислорода, т.е. ЭО = 1/2 M, а эквивалентная масса кислорода равна 8 г/моль.
Эквивалентным объемом (VЭ) называется объем, занимаемый при данных условиях одним эквивалентом газообразного вещества. При нормальных условиях (н.у.) эквивалентный объем (V0Э) находят исходя из
мольного объема газов, равного 22,4 л. Так как эквивалентная масса водорода равна 1 г/моль, а мольная масса водорода, как простого вещества, равна 2 г/моль, то эквивалентный объем водорода в 2 раза меньше мольного, т.е. V0Э(Н2) = 11,2 л. Эквивалентная масса кислорода равна 8 г/моль, а мольная масса его равна 32 г/моль, то его эквивалентный объем в 4 раза меньше мольного, т.е. V0Э(О2) = 5,6 л.
Эквиваленты и эквивалентные массы простых веществ рассчитываются по
формуле 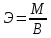 ,
где М – мольная масса элемента, г/моль;
В – валентность.
,
где М – мольная масса элемента, г/моль;
В – валентность.
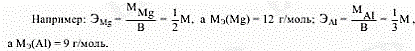
Эквивалентом сложного вещества называется такое его количество, которое может замещать, присоединять или быть каким-либо другим способом эквивалентно одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Эквиваленты
и эквивалентные массы сложных веществ
рассчитываются по формуле 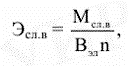
где Мсл.в – мольная масса сложного вещества, г/моль; В – валентность элемента, образующего соединение; n – число атомов элемента в соединении. Выражения для расчета эквивалентных масс оксидов, кислот, оснований и
солей
имеют вид 
2. Основные определения и понятия в химической термодинамике. Внутренняя энергия, теплота, работа.
Внутренняя энергия (U) характеризует общий запас энергии системы. Сюда входят: энергия колебания атомов, кинетическая и по-тенциальная энергии молекул, энергия движения электронов, межъя-дерное взаимодействие и т. д., т. е. все виды энергии всех частиц, со-ставляющих систему, за исключением потенциальной энергии положе-ния системы в пространстве и кинетической энергии движения системы как целого.
Внутренняя энергия является функцией состояния, т. е. изменение ее не зависит от того, через какие промежутки (стадии) идет процесс, а оп-ределяется только исходным и конечным состоянием. Эта величина экс-тенсивная, измеряется в Дж или кал. (ккал.).
Абсолютная величина внутренней энергии системы не поддается оп-ределению, однако можно определить ее изменение ∆U = U2 – U1 в раз-личных процессах. Если ∆U возрастает, то считается положительной ве-личиной, и отрицательной, если ∆U уменьшается. Изменение внутренней энергии при переходе от одного состояния к
другому может осуществляться как в форме теплоты (Q), так и в форме работы (А).
Теплота (Q) является мерой энергии, переданной от одного тела дру-гому за счет разницы температур этих тел. Эта форма передачи энергии связана с хаотическими столкновением молекул соприкасающихся тел.
При этом молекулы более нагретого тела передают энергию молекулам менее нагретого тела. Перенос массы при этом не происходит.
Работа (А) — это мера передачи энергии от системы, совершающей работу, к системе, над которой совершается работа, или, другими сло-вами, мера энергии, переданной от одного тела к другому, за счет пере-мещения масс под действием каких-либо сил. Сюда относится: поднятие
тел в поле тяготения, переход электричества от большего к меньшему потенциалу, расширение газа и т. п.
Теплота и работа зависят от пути протекания процесса, следователь-но они не являются функциями состояния. Теплота и работа характери-зуют способ или форму передачи энергии. Теплоту выражают в Дж или кал. (ккал.), работу — в Дж. Для любого физико-химического процесса справедливо равенство:
Q = ∆U + A, (4.7)
которое означает, что теплота (Q), подведенная к системе, расходуется на увеличение ее внутренней энергии (∆U) и на работу (А), совершенную системой. Уравнение (4.7) — математическое выражение первого закона
термодинамики.
Следует заметить, что работа А представляет собой сумму
A=P∆V+A’ max, (4.9)
где P∆V — работа преодоления внешнего давления Р, необходимая для удержания системы в состоянии механического равновесия,
∆V — изменение объема от V1 к V2, V2 > V1,
A’ max— работа против электрических, гравитационных и других сил, т. е. не связанная с изменением термодинамических параметров
(так называемая полезная работа).
Учитывая, что для химических взаимодействий наиболее характерна работа расширения (A’max = 0), выражение (4.7) запишем в виде:
Q = ∆U + P·∆V. (4.10)
.Тогда, для изохорических процессов (V = const),
P ∆V = 0, QV = ∆U, (4.11)
которое означает, что вся подведенная к системе теплота (QV) расходует-ся на увеличение внутренней энергии.
способы соединения конденсаторов (последовательное, параллельное и смешанное). Вывод формул эквивалентной емкости. — КиберПедия
2) Рассчитать по индивидуальным заданиям эквивалентную емкость батареи конденсаторов и ее рабочее напряжение.
№ 1
С1=15мкф
С2=С3=20мкф
С4=С5=20мкф
С общ. — ?
————————————————————————————————————————-
№ 2
С1=С6=10мкф
С2=С3=С4=6мкф
С5=8мкф
Собщ. — ?
—————————————————————————————————————————
№ 3
С1=С6=30мкф
С2=20мкф
С3=С4=С5=30мкф
С общ. — ?
————————————————————————————————————————
№4
С1=С2=10мкф
С3=С4=20мкф
С5=10мкф
С общ. — ?
————————————————————————————————————————-
№5
С1=6мкф
С2=5мкф
С3=10мкф
С4=2мкф
С общ. — ?
————————————————————————————————————————————
№6
С1=С2=С3=30мкф
С4=С5=5мкф
С общ. — ?
№7
С1=С2=С3=90мкф
С4=50мкф
С5=30мкф
С общ. — ?
№8
С1=5мкф
С2=С3=20мкф
С4=С5=10мкф
С общ. — ?
————————————————————————————————————————-
№ 9
С1=С2=20мкф
С3=С4=10мкф
С5=5мкф
С общ. — ?
—————————————————————————————————————————
№10
С1=10мкф
С2=С3=20мкф
С4=С5=40мкф
С6=10мкф
С общ. — ?
—————————————————————————————————————————
№11
С1=С2=20мкф
С3=С4=10мкф
С5=630мкф
С общ. — ?
№12
С1=20мкф
С2=С3=20мкф
С4=С5=С6=30мкф
С общ. — ?
№13
С1=30мкф
С2=С3=С4=60мкф
С5=10мкф
С общ. — ?
№14
С1=С2=20мкф
С3=С4=20мкф
С5=5мкф
С общ. — ?
№15
С1=С2=20мкф
С3=С4=10мкф
С5=30мкф
С общ. -?
№16
С1=15мкф
С2=С3=10мкф
С4=С5=20мкф
С общ. – ?
№ 17
С1=5мкф
С2=С3=20мкф
С4=10мкф
С общ. — ?
————————————————————————————————————————
№ 18
С1=10мкф
С2=20мкф
С3=С4=С5=60мкф
С общ. — ?
№ 19
С1=5мкф
С2=С3=20мкф
С4=10мкф
С5=10мкф
С общ. — ?
—
№ 20
С1=15мкф
С2=С3=20мкф
С4=С5=10мкф
С общ. — ?
№21
С1=С2=5мкф
С3=С4=10мкф
С5=20мкф
С общ. — ?
№ 22
С1=С6=10мкф
С2=С3=С4=6мкф
С5=8мкф
С общ. — ?
——————————————————————————————————————————
№ 23
С1=С2=10мкф
С3=С4=5мкф
С5=10мкф
С общ. — ?
—————————————————————————————————————————
№ 24
С1=С2=2мкф
С3=5мкф
С4=6мкф
С общ. — ?
—————————————————————————————————————————
№ 25
С1=10мкф
С2=20мкф
С3=С4=С5=60мкф
С общ. — ?
Задание № 2
Тема «Расчет электрических цепей»
Общие сведения об электрических целях: определение, классификация. Электрический ток его определение, направление, сила тока, плотность. Электрическая проводимость и сопротивление проводников. Зависимость сопротивления от температуры. Законом Ома для участка и полной цепи. Основные элементы электрических цепей: источники и приемники электрической энергии, их мощность и К.П.Д. назначение вспомогательных элементов цепи режиму работы электрической цепи: холостой ход, нормальный, рабочий, короткого замыкания. Закон Джоуля – Ленца. Нагрев проводов. Выбор сечения проводов в зависимости от допустимого тока. Условное обозначение на электрическую схему. Участки схем электрических цепей: ветвь, узел, контур. Потеря напряжения в линиях электропередачи. Расчет электрических цепей с помощью знаков, Ома и Кирхгофа. Понятие о расчете сложных цепей.
Обучающийся должен знать:
— единицы измерения силы тока, потенциала, напряжения.
— закон Ома для участка и полной цепи;
— схемы включения амперметра и вольтметра в электрической цепи;
— закон Джоуля – Ленца;
— первое и второе правила Кирхгофа.
уметь:
— составлять простейшие электрические схемы;
— применять законы Ома для расчета электрических цепей;
— выбирать методы расчета в зависимости от типа цепей тока;
— производить преобразование цепей с последовательным, параллельным и смешанным соединением элементов.
— составлять уравнения Кирхгофа для расчета электрических цепей;
— составлять исходные уравнения для расчетов сложной цепи постоянного тока, в том числе уравнение баланса мощностей;
Задание
1) по индивидуальным заданиям определить эквиваленты сопротивление электрической цепи со смешанным соединением элементов.
2) произвести расчет электрических цепей по законам Ома и составить баланс мощностей,получив схему сложной электрической цепи рассчитать токи по закону Кирхгофа
№ 1. Найти токи
J4=8A J5-?
J6=6A J7-?
J1=1A
J2=6A
J3=3A
—————————————————————————————————————-
№ 2. Найти токи
J5=1А J6=9А J3=7А
J1=8А J2-? J4-?
№ 3. Найти токи
J4=20A J3-? J7-?
J1=8A J5=14A
J2=2A J6=1A
————————————————————————————————————————
№ 4. Найти токи
UAB=240B
UCД=160B
R5=12 J2=20A
J4=15A J5=5A
RAB-? RCД-? R1-?
R2-? R3-? R4-?
J1-? J3-? J-?
————————————————————————————————————————
№ 5. Найти токи
UAB=100B R2=10 Ом
R5=20 Ом J2=6A
J4=1,6A J5=2,4A
UCД-? RAB-? RCД-?
R1-? R3-? R4-?
J1-? J3-?
——————————————————————————————————————
№ 6. Найти токи методом узлового напряжения.
Е1= Е2= Е3=10B
R1=2Ом R2=1Ом R3=5Ом R4=1Ом
——————————————————————————————————————-
№ 7. Составить уравнения по методу контурных токов.
——————————————————————————————————————-
№ 8. Найти токи методом узлового напряжения Найти токи
Е1=5В Е2=10В Е3=2В
R1=1Ом R2=2Ом R3= R4=1Ом R5=2Ом
№ 9.
Найти токи методом узлового напряжения
Е1=5В Е2=10В Е3=6В
R1=2Ом R2=5Ом R3=1Ом
№ 10. Составить уравнения методом контурных токов.
———————————————————————————————————————————-
№ 11. Составить уравнение методом контурных токов
№ 12. Составить уравнения по методу контурных токов.
————————————————————————————————————————————
№ 13. Составить уравнение методом контурных токов.
————————————————————————————————————————————
№ 14. Составить уравнение методом контурных токов.
№ 15. Составить уравнение методом контурных токов.
————————————————————————————————————————
№ 16. Составить уравнение методом контурных токов.
—————————————————————————————————————————
№ 17. Составить уравнение методом контурных токов.
————————————————————————————————————————
№ 18. Составить уравнения методом контурных токов.
—————————————————————————————————————————
№ 19. Составить уравнения методом контурных токов.
—————————————————————————————————————————
№ 20. Составить уравнения методом контурных токов.
—————————————————————————————————————————
№ 21. Найти токи методом узлового напряжения.
Е1=5В Е2=10В Е3=20В
R1=2Ом R2=5Ом R3=2Ом R4=8Ом
————————————————————————————————————————-
№ 22. Составить уравнения методом узловых и контурных уравнений.
————————————————————————————————————————-
№ 23. Найти токи методом узлового напряжения.
Е1= Е2= Е3=10B
R1=2Ом R2=1Ом R3=5Ом R4=1Ом
№ 24. Составить уравнения по 1 и 2 законам Кирхгофа.
—————————————————————————————————————————
№ 25. Составить уравнения по 1 и 2 законам Кирхгофа.
—————————————————————————————————————————
Задание № 3 .
эквивалентная емкость — это… Что такое эквивалентная емкость?
- эквивалентная емкость
эквивалентная емкость
—
[Я.Н.Лугинский, М.С.Фези-Жилинская, Ю.С.Кабиров. Англо-русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.]Тематики
- электротехника, основные понятия
Справочник технического переводчика. – Интент. 2009-2013.
- эквивалентная доза облучения
- эквивалентная загрузка белым шумом
Смотреть что такое «эквивалентная емкость» в других словарях:
эквивалентная схема варикапа и туннельного диода — Сп параллельная емкость; gпер отрицательная проводимость; rп сопротивление потерь; Lg последовательная индуктивность; Cпер емкость перехода. Черт.7 [ГОСТ 25529 82] Тематики полупроводниковые приборы … Справочник технического переводчика
Эквивалентная схема — (схема замещения, эквивалентная схема замещения) электрическая схема, в которой все реальные элементы заменены максимально близкими по функциональности цепями из идеальных элементов. Содержание 1 Необходимость эквивалентных схем 2 … Википедия
Эквивалентная цепь — Эквивалентная схема (схема замещения, эквивалентная схема замещения) электрическая схема, в которой все реальные элементы заменены максимально близкими по функциональности цепями из идеальных элементов. Содержание 1 Необходимость эквивалентных… … Википедия
емкость — 3.5.2 емкость: Количество электричества или электрический заряд, который в обозначенных условиях обеспечивает полностью заряженная батарея. Источник: ГОСТ Р МЭК 60079 0 2011: Взрывоопасные среды. Часть 0. Оборудование. Общие требования … Словарь-справочник терминов нормативно-технической документации
емкость фазы (сети) — 3.4 емкость фазы (сети): Общая сосредоточенная (эквивалентная распределенной) электрическая емкость трех фаз (одной, двух фаз) сети относительно земли. Источник: ГОСТ Р 52273 2004: Устройства защиты от токов утечки рудничные для сетей напр … Словарь-справочник терминов нормативно-технической документации
максимальная внутренняя емкость ( Ci) — 3.23 максимальная внутренняя емкость ( Ci): Суммарная эквивалентная внутренняя емкость, которая может оказаться на соединительных устройствах электрооборудования. Источник: ГОСТ Р 51330.10 99: Электрооборудование взрывозащищенное. Часть 11.… … Словарь-справочник терминов нормативно-технической документации
максимальная внутренняя емкость (С i) — 3.5.7 максимальная внутренняя емкость (С i) [(maximum internal capacitance (Сi)]: Суммарная эквивалентная внутренняя емкость электрооборудования, которую рассматривают как подсоединенную параллельно соединительным устройствам искробезопасных… … Словарь-справочник терминов нормативно-технической документации
Импульсный трансформатор — (ИТ) трансформатор, предназначенный для преобразования тока и напряжения импульсных сигналов с минимальным искажением исходной формы импульса на выходе. Содержание 1 Описание 2 Эквивалентные схемы … Википедия
максимальная — максимальная: Максимально возможная длина ЗО, в пределах которой выполняются требования настоящего стандарта и технических условий (ТУ) на извещатели конкретных типов, Источник: ГОСТ Р 52651 2006: И … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р МЭК 60122-1-2009: Резонаторы оцениваемого качества кварцевые. Часть 1. Общие технические условия — Терминология ГОСТ Р МЭК 60122 1 2009: Резонаторы оцениваемого качества кварцевые. Часть 1. Общие технические условия оригинал документа: 2.2.21 антирезонансная частота (anti resonance frequency) fa: Высшая из двух частот кварцевого резонатора в… … Словарь-справочник терминов нормативно-технической документации
1.Эквивалент. Эквивалентная масса. Эквивалентный объём. Закон эквивалентов.
Эквивалентом веществаназывается условная частица, в целое число раз меньшая (или равная), чем соответствующая ей структурная или формульная единица вещества (атом, молекула, ион), участвующая в конкретной реакции.
Эквивалентная масса равна отношению молярной массы элемента к его окислительному числу.
Эквивалентная масса оксидаравна сумме эквивалентных масс данного элемента и кислорода.
Эквивалентная масса солиравна отношению молярной массы соли к произведению числа атомов металла на его валентность.
Эквивалентная масса основанияравна отношению молярной массы основания к числу замещенных гидроксогрупп.
Эквивалентная масса кислотыравна отношению молярной массы кислоты к числу замещенных атомов водорода.
 Эквивалентный
объём
Эквивалентный
объём
Объём, который занимает эквивалент вещества С, называется эквивалентным. Он может быть найден делением эквивалентной массы вещества на плотность или делением объема на число эквивалентов этого числа.
Закон эквивалентов.
Согласно закону эквивалентов, вещества взаимодействуют и образуются в эквивалентных количествах.
2.Примеры расчёта эквивалента элемента, оксида, основания, соли, кислоты, окислителя, восстановителя.
ЭЛЕМЕНТА. Определим эквивалентную массу серы в молекуле серной кислоты. Окислительное число серы в молекуле серной кислоты равно 6. По формуле эквивалентная масса серы равна M/B= 32/6 = 5,33 г/моль.
ОКСИДА. Определим эквивалентную массу оксида серы. Окислительное число серы в молекуле оксида серы равно 4. По формуле эквивалентная масса серы рана М/В=32/4=8г/моль. Эквивалентная масса оксида по формуле равна ЭS+ЭO=8+8=16г/моль.
ОСНОВАНИЯ. Определим эквивалентную массу молекулы оксида алюминия. По формуле ЭAl(OH)3=78/3=26г/моль.
СОЛИ. Определим эквивалентную массу молекулы хлорида алюминия. В молекуле AlCl3 число атомов металла равно 1, а валентность равна 3. По формуле ЭAlCl3=133,5/(1*3)=44,5г/моль.
КИСЛОТЫ. Определим эквивалентную массу молекулы серной кислоты. Серная кислота двуосновная. По формуле эквивалентная масса серной кислоты равна М/(чз Н)=98/2=49г/моль.
ОКИСЛИТЕЛЯ.


ВОССТАНОВИТЕЛЯ. Найти эквивалентную массуZnдля данной реакции:
Zn+CuSO4=ZnSO4+Cu
Zn-2e→Zn2+-восстановитель
Cu2++ 2e → Cu-окислитель
ЭZn=M/z=65/2=33
3.

ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ.
Количество теплоты, переданное системе, идет на изменение внутренней энергии системы и на совершаемую системой работу против внешних сил.
Q = ΔU + W (4.4)
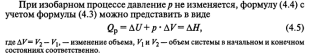

ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ.
Характеризует направленность реальных, необратимых процессов теплообмена: Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого к телу более нагретому.


ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ.
В конденсированных системах при абсолютном нуле и вблизи него процесс протекает без изменения энтропии.
4.Энергия Гиббса. Направленность самопроизвольных химических реакций.
Энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность химической реакции.
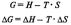
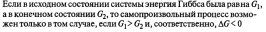
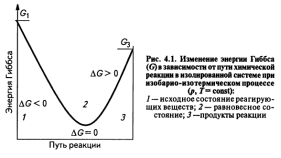


5.Термохимический закон Гесса. Тепловой эффект реакции.
Закон Гесса: тепловой эффект химической реакции не зависит от пути реакции, а зависит только от вида и начального и конечного состояния веществ.

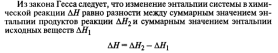
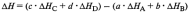
Тепловой эфффект реакции.


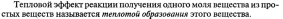

6.Скорость химической реакции. Закон действия масс.
Скорость химической реакции – это изменение концентрации исходного или образовавшегося в реакции вещества в единицу времени.

Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.

7.Зависимость скорости химической реакции от температуры. Температурный коэффициент. Закон Вант-Гоффа. Теория активации.
Закон Вант-Гоффа: при повышении температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза.
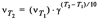

Уравнение Аррениуса:
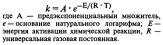

8.Явление катализа. Катализаторы, принцип действия. Теория переходного состояния и образования активированных комплексов. Биокатализаторы.




9.Химическое равновесие с точки зрения термодинамики. Константа равновесия.



10.Смещение химического равновесия. Принцип Ле Шателье.

11.Агрегатные состояния. Растворы: понятие, теория. Растворы насыщенные, ненасыщенные, пересыщенные.
Состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразными изменениями объема и физических свойств вещества, называются агрегатными. Вещества могут существовать в твердом, жидком и газообразном состоянии. Переходы вещества из одного состояния в другое обусловлены изменением характера теплового движения частиц и их взаимодействия. Газом называют состояние вещества, из которого без понижения температуры не может быть получено твердое или жидкое состояния. Переход вещества из жидкого состояния в газообразное при температурах ниже критической называется парообразованием. Пар можно получить также сублимацией твердого вещества. Обратные процессы перехода пара в жидкое и твердое состояние называется конденсацией. В основе изучения газообразного состояния лежит понятие об идеальном газе. К состоянию идеального газа приближаются газы при низких давлениях, когда расстояния между молекулами настолько велики, что можно принебречь силами притяжения между ними. Уравнение Менделеева-Клапейрона pV=n*RT
Перход твердого вещества в жидкое называется плавлением. Обратный процесс –кристаллизацией. Температура, при которой существуют три фазы вещества называется тройной точкой.



ПОНЯТИЕ О РАСТВОРАХ

В гомогенных системах частицы растворенного вещества раздроблены до молекулярных размеров. Такие системы называются истинными растворами и просто растворами и являются весьма устойчивыми. В истинных растворах