Этиленгликоль, моноэтиленгликоль, МЭГ.
Описание продукта (химическая формула, назначение):
— Формула: HO-Ch3-Ch3-OH
— Молекулярная масса: 62,07
ГОСТ 19710-83 Этиленгликоль.
Этиленгликоль получают при гидратации окиси этилена.
1. Технические характеристики.
№ Наименование показателя Норма высший сорт 1-й сорт
ОКП 24 2212 0120 ОКП 24 2212 0130
1. Массовая доля этиленгликоля, %, не менее 99,8 99,5
2. Массовая доля диэтиленгликоля, %, не более 0,05 1,0
3. Цвет, единицы Хазена, не более
— В обычном состоянии 5 20
4. Массовая доля остатка после прокаливания, %, не более 0,001 0,002
5. Массовая доля железа (Fe), %, не более 0,00001 0,0005
6. Массовая доля воды, %, не более 0,1 0,5
7. Массовая доля кислот в пересчете на уксусную кислоту, %,
не более 0,0006 0,005
Настоящий стандарт распространяется на этиленгликоль, получаемый гидратацией окиси этилена, и устанавливает требования к этиленгликолю, изготовленному для нужд народного хозяйства и экспорта.
Этиленгликоль применяют в производстве синтетических волокон, смол, растворителей, низкозамерзающих и гидравлических жидкостей, косметике и для других целей.
По внешнему виду этиленгликоль представляет собой прозрачную жидкость.
Моноэтиленгликоль — это двухатомный спирт, бесцветная, вязкая, сладковатая на вкус жидкость, с температурой кипения 197 oС, плотностью при 20 oС = 1,112-1,113 г/см3, температурой начала замерзания минус 12-13 oС.
Исключительно важным свойством этиленгликоля является его способность понижать температуру замерзания водных растворов. При определенном соотношении системы «вода — этиленгликоль» можно получить жидкость с необходимой температурой замерзания от минус 1 до минус 70 oС. Водные растворы этиленгликоля не расширяются при замерзании и не образуют сплошной твердой массы, а превращаются в кашицеобразную рыхлую массу, объем которой больше первоначального только на 0,25%-0,30%.
2. Плотность этиленгликоля в зависимости от температуры
оС кг/дм3 оС кг/дм3 оС кг/дм3
-10 1,1352 12 1,1194 34 1,1042
-9 1,1346 13 1,1188 35 1,1036
-8 1,134 14 1,1182 36 1,103
-7 1,1334 15 1,1176 37 1,1022
-6 1,1328 16 1,117 38 1,1014
-5 1,1322 17 1,1162 39 1,1006
-4 1,1316 18 1,1154 40 1,0998
-3 1,131 19 1,1146 41 1,099
-2 1,1304 20 1,1138 42 1,0984
-1 1,1298 21 1,113 43 1,0978
0 1,129 22 1,1124 44 1,0972
1 1,127 23 1,1118 45 1,0966
2 1,1266 24 1,1112 46 1,096
3 1,1261 25 1,1106 47 1,0954
4 1,1257 26 1,11 48 1,0948
5 1,1253 27 1,1092 49 1,0942
6 1,1249 28 1,1084 50 1,0936
7 1,1245 29 1,1076 51 1,093
8 1,124 30 1,1068 52 1,092
9 1,1227 31 1,106 53 1,091
10 1,1214 32 1,1054 54 1,09
11 1,12 33 1,1048 55 1,089
Температура замерзания водно-гликолевой смеси
Температура замерзания водно-гликолевого раствора
3. Сравнительная характеристика физико-химических свойств воды и моноэтиленгликоля
Молярная масса 18,01 62,07
Плотность при 20оС, кг/м3 998,2 1113
Температура замерзания, оС 0 -12
Температуры кипения при 0,1 МПа, оС 100 197,7
Теплоемкость при 20оС, кДж/(кг*оС) 4,184 2,422
Коэффициент теплопроводности,
Вязкость при 20оС, мм2/с 1,0 19-20
Теплота испарения, кДж/кг 2,258 0,800
Коэффициент объемного
расширения (0-100оС) 0,00046 0,00062
4. Свойства водных растворов этиленгликоля
Концентрация этиленгликоля, Плотность кг/дм3, Температура замерзания, оС
% по массе при 20оС
36,4 1,0506 -20
45,6 1,0627 -30
52,6 1,0713 -40
58,0 1,0780 -50
63,1 1,0833 -60
66,7 1,0856 -73
72,1 1,0923 -60
78,4 1,0983 -50
Этиленгликоль в очищенном виде – это прозрачная бесцветная жидкость маслянистой консистенции без запаха.
Этиленгликоль применяют в качестве теплоносителя в системах нагрева и отопления, используют в системах охлаждения как холодоноситель в производстве антифризов, тосолов, гидравлических, тормозных жидкостей для автомобилей. Еще несколько сфер использования этиленгликоля: производство смол, синтетических волокон, растворителей, полиуретанов, душистых и взрывчатых веществ, кожевенная промышленность и фармакология.
Особо отметим, что этиленгликоль как низкозамерзающая жидкость (антифриз) заменяет воду из-за низкой температуры замерзания и более высокой температуры кипения. Этиленгликоль т.о., применяется, как охлаждающая жидкость в ДВС, антиобледенитель в авиации, хладоноситель в системах охлаждения.
Вернуться к списку…
Вязкость жидкостей, водных растворов, паров и газов (Таблица)
Вязкость жидкостей
Динамическая вязкость, или коэффициент динамической вязкости ƞ (ньютоновской), определяется формулой:
η = r / (dv/dr),
где r – сила вязкого сопротивления (на единицу площади) между двумя соседними слоями жидкости, направленная вдоль их поверхности, а dv/dr– градиент их относительной скорости, взятый по направлению, перпендикулярному к направлению движения. Размеренность динамической вязкости ML-1T-1, ее единицей в системе СГС служит пуаз (пз) = 1г/см*сек=1дин*сек/см2=100 сантипуазам (спз)
Кинематическая вязкость определяется отношением динамической вязкости ƞ к плотности жидкости p. Размерность кинематической вязкости L2T-1, ее единицей в системе СГС служит стокс (ст) = 1 см2/сек=100 сантистоксам (сст).
Текучесть φ является величиной, обратной динамической вязкости. Последняя для жидкостей уменьшается с понижением температуры приблизительно по закону φ=А+В/Т, где А и В являются характеристическими постоянными, а Т обозначает абсолютную температуру. Величины А и В для большого количества жидкостей были даны Бэррером.
Таблица вязкость воды
Данные Бингхема и Джексона, выверенные по национальному стандарту в США и Великобритании на 1 июля 1953 года, ƞ при 200С=1,0019 сантипуаза.
Температура, 0С | Ƞ, спз | Температура, 0С | Ƞ, спз |
0 | 1,7865 | 50 | 0,5477 |
5 | 1,5138 | 60 | 0,4674 |
10 | 1,3037 | 70 | 0,4048 |
15 | 1,1369 | 80 | 0,3554 |
20 | 1,0019 | 90 | 0,3155 |
25 | 0,8909 | 100 | 0,2829 |
30 | 0,7982 | 125 | 0,220 |
40 | 0,6540 | 150 | 0,183 |
Таблица вязкость различных жидкостей Ƞ, спз
Жидкость | 00С | 100С | 200С | 300С | 400С | 500С | 600С | 700С | 1000С |
Анилин | — | 6,53 | 4,39 | 3,18 | 2,40 | 1,91 | 1,56 | 1,29 | 0,76 |
Ацетон | 0,397 | 0,358 | 0,324 | 0,295 | 0,272 | 0,251 | — | — | — |
Бензол | — | 0,757 | 0,647 | 0,560 | 0,491 | 0,436 | 0,389 | 0,350 | — |
Бромбензол | 1,556 | 1,325 | 1,148 | 1,007 | 0,889 | 0,792 | 0,718 | 0,654 | 0,514 |
Кислота муравьиная | — | 2,241 | 1,779 | 1,456 | 1,215 | 1,033 | 0,889 | 0,778 | 0,547 |
Кислота серная | 56 | 49 | 27 | 20 | 14,5 | 11,0 | 8,2 | 6,2 | — |
Кислота уксусная | — | — | 1,219 | 1,037 | 0,902 | 0,794 | 0,703 | 0,629 | 0,464 |
Масло касторовое | — | 2420 | 986 | 451 | 231 | 125 | 74 | 43 | 16,9 |
Масло прованское | — | 138 | 84 | 52 | 36 | 24,5 | 17 | 12,4 | — |
Н-Октан | 0,710 | 0,618 | 0,545 | 0,485 | 0,436 | 0,394 | 0,358 | 0,326 | 0,255 |
Н-Пентан | 0,278 | 0,254 | 0,234 | 0,215 | 0,198 | 0,184 | 0,172 | 0,161 | 0,130 |
Ртуть | 1,681 | 1,661 | 1,552 | 1,499 | 1,450 | 1,407 | 1,367 | 1,327 | 1,232 |
Сероуглерод | 0,436 | 0,404 | 0,375 | 0,351 | 0,329 | — | — | — | — |
Спирт метиловый | 0,814 | 0,688 | 0,594 | 0,518 | 0,456 | 0,402 | 0,356 | — | — |
Спирт этиловый | 1,767 | 1,447 | 1,197 | 1,000 | 0,830 | 0,700 | 0,594 | 0,502 | — |
Толуол | 0,771 | 0,668 | 0,585 | 0,519 | 0,464 | 0,418 | 0,379 | 0,345 | 0,268 |
Углекислота (жидкая) | 0,099 | 0,085 | 0,071 | 0,053 | — | — | — | — | — |
Углерод четыреххлористый | 1,348 | 1,135 | 0,972 | 0,845 | 0,744 | 0,660 | 0,591 | 0,533 | 0,400 |
Хлороформ | 0,704 | 0,631 | 0,569 | 0,518 | 0,473 | 0,434 | 0,399 | — | — |
Этилацетат | 0,581 | 0,510 | 0,454 | 0,406 | 0,366 | 0,332 | 0,304 | 0,278 | — |
Этилформиат | 0,508 | 0,453 | 0,408 | 0,368 | 0,335 | 0,307 | — | — | — |
Эфир этиловый | 0,294 | 0,267 | 0,242 | 0,219 | 0,199 | 0,183 | 0,168 | 0,154 | 0,119 |
Относительная вязкость некоторых водных растворов (таблица)
Концентрация растворов предполагается нормальным, который содержит в 1л один грамм-эквивалент растворенного вещества. Вязкости даны по отношению к вязкости воды при той же температуре.
Вещество | Температура, °С | Относительная вязкость | Вещество | Температура, °С | Относительная вязкость |
Аммиак | 25 | 1,02 | Кальций хлористый | 20 | 1,31 |
Аммоний хлористый | 17,6 | 0,98 | Кислота серная | 25 | 1,09 |
Калий йодистый | 17,6 | 0,91 | Кислота соляная | 15 | 1,07 |
Калий хлористый | 17,6 | 0,98 | Натр едкий | 25 | 1,24 |
Таблица вязкость водных растворов глицерина
Удельный вес 25°/25°С | Весовой процент глицерина | Т1 спз | ||
| 200С | 250С | 300С | |
1,26201 | 100 | 1495,0 | 942,0 | 622,0 |
1,25945 | 99 | 1194,0 | 772,0 | 509,0 |
1,25685 | 98 | 971,0 | 627,0 | 423,0 |
1,25425 | 97 | 802,0 | 521,5 | 353,0 |
1,25165 | 96 | 659,0 | 434,0 | 295,8 |
1,24910 | 95 | 543,5 | 365,0 | 248,0 |
1,20925 | 80 | 61,8 | 45,72 | 34,81 |
1,12720 | 50 | 6,032 | 5,024 | 4,233 |
1,06115 | 25 | 2,089 | 1,805 | 1,586 |
1,02370 | 10 | 1,307 | 1,149 | 1,021 |
Вязкость жидкостей при высоких давлениях по Бриджмену
Таблица относительная вязкость воды при высоких давлениях
Давление кгс/см3 | 0°С | 10,3°С | 30°С | 75°С |
1 | 1,000 | 0,779 | 0,488 | 0,222 |
1000 | 0,921 | 0,743 | 0,514 | 0,239 |
2000 | 0,957 | 0,754 | 0,550 | 0,258 |
4000 | 1,11 | 0,842 | 0,658 | 0,302 |
6000 | 1,35 | 0,981 | 0,786 | 0,367 |
8000 | — | 1,15 | 0,923 | 0,445 |
10000 | — | — | 1,06 | — |
Таблица относительная вязкость различных жидкостей при высоких давлениях
Ƞ=1 при 30°С и давление 1 кгс/см2
Жидкость | Температура, °С | Давление кгс/см2 | |||
| 1000 | 4000 | 8000 | 12000 | |
Ацетон | 30 | 1,68 | 4,03 | 9,70 | — |
75 | 1,30 | 2,79 | 5,78 | 10,7 | |
Н-Пентан | 30 | 2,07 | 7,03 | 22,9 | 70,2 |
75 | 1,46 | 4,74 | 13,2 | 31,1 | |
Сероуглерод | 30 | 1,45 | 3,23 | 6,92 | 15,5 |
75 | 1,12 | 2,35 | 4,69 | 8,83 | |
Спирт метиловый | 30 | 1,47 | 2,96 | 5,62 | 9,95 |
75 | 0,857 | 1,61 | 2,80 | 4,52 | |
Спирт этиловый | 30 | 1,59 | 4,14 | 10,5 | 24,5 |
75 | 0,747 | 1,95 | 4,30 | 8,28 | |
Эфир этиловый | 30 | 2,11 | 6,20 | 18,2 | 46,8 |
75 | 1,41 | 3,99 | 9,69 | 20,5 | |
Вязкость твердых тел (ПЗ)
Твердые тела | Вязкость |
Венецианский скипидар при 17,3° | 1300 |
Смола при 0° | 51*1010 при 15°; 1,3*1010 |
Лед (глетчерный) | 12*1013 |
Вар сапожный при 8° | 4,7*108 |
Натронное стекло при 575° | 11*1012 |
Патока светлая (Лайл) при 12° | 1400 |
Таблица вязкость газов и паров
Динамическая вязкость газов обычно выражается в микропуазах (мкпз). Согласно кинетической теории вязкость газов должна не зависеть от давления и изменяться пропорционально квадратному корню из абсолютной температуры. Первый вывод оказывается в общем правильным, исключением являются очень низкие и очень высокие давления; второй вывод требует некоторых поправок. Для изменения ƞ в зависимости от абсолютной температуры Т наиболее часто применяется формула:
Газ или пар | 00С | 200С | 500С | 1000С | 1500С | 2000С | 2500С | 3000С | Постоянная Сёзерлэнда, С |
Азот | 166 | 174 | 188 | 208 | 229 | 246 | 263 | 280 | 104 |
Аргон | 212 | 222 | 242 | 271 | 296 | 321 | 344 | 367 | 142 |
Бензол | 70 | 75 | 81 | 94 | 108 | 120 | — | — | — |
Водород | 84 | 88 | 93 | 103 | 113 | 121 | 130 | 139 | 72 |
Воздух | 171 | 181 | 195 | 218 | 239 | 258 | 277 | 295 | 117 |
Гелий | 186 | 194 | 208 | 229 | 250 | 270 | 290 | 307 | — |
Закись азота | 137 | 146 | 160 | 183 | 204 | 225 | 246 | 265 | 260 |
Кислород | 192 | 200 | 218 | 244 | 268 | 290 | 310 | 330 | 125 |
Метан | 103 | 109 | 119 | 135 | 148 | 161 | 174 | 186 | 164 |
Неон | 298 | 310 | 329 | 365 | 396 | 425 | 453 | — | 56 |
Пары воды | — | — | — | 128 | 147 | 166 | 184 | 201 | 650 |
Сернистый газ | 117 | 126 | 140 | 163 | 186 | 207 | 227 | 246 | 306 |
Спирт этиловый | — | — | — | 109 | 120 | 136 | 152 | — | — |
Углекислота | 138 | 146 | 163 | 186 | 207 | 229 | 249 | 267 | 240 |
Углерода окись | 166 | 177 | 189 | 210 | 229 | 246 | 264 | 279 | 102 |
Хлор | 123 | 132 | 145 | 169 | 189 | 210 | 230 | 250 | 350 |
Хлороформ | 94 | 102 | 112 | 129 | 146 | 160 | — | — | — |
Этилен | 97 | 103 | 112 | 128 | 141 | 154 | 166 | 179 | 226 |
Таблица вязкость некоторых газов при высоких давлениях (мкпз)
Газ | Температура, 0С | Давление в атмосферах | ||||
| 50 | 100 | 300 | 600 | 900 | |
Азот | 25 | 187 | 199 | 266 | 387 | 495 |
Азот | 50 | 197 | 208 | 267 | 370 | 470 |
Азот | 75 | 207 | 217 | 268 | 361 | 442 |
Углекислота | 40 | 181 | 483 | — | — | — |
Этилен | 40 | 134 | 288 | — | — | — |
Вязкость диэтиленгликоля — Справочник химика 21
С повышением давления вязкость диэтиленгликоля значительно возрастает и при 6,9 МПа (70 кгс/см ) она в 3—4 раза выше, чем при атмосферном давлении [10, с. 531]. Зависимость вязкости диэтиленгликоля и его водных растворов от температуры приведена на рис. 39, [c.124]Низкомолекулярные неводные растворители (спирты, кетоны, эфиры, гликоли) широко используются в нефтегазовой практике как добавки в кислотные растворы при этом решается широкий круг задач. Солянокислотные композиции в сочетании с моно- и диэтиленгликолями обладают меньшей растворяющей способностью, так как имеют более высокие значения поверхностного натяжения и вязкости. К их числу относятся составы, содержащие одноатомный ( i —С4) или многоатомный спирты. Метанол при содержании 10 % ослабляет действие на карбонаты, а влияние изопропанола проявляется уже при концентрации 2 см /100 см . [c.373]
Повышение температуры при разделении ассоциированных систем приводит к улучшению не только равновесной, но и кинетической характеристики процесса. Перестройка молекул в растворах, разрушение ассоциатов воды и растворителя при повышенных температурах приводит к ускорению адсорбции, в связи с чем в динамическом опыте выходная кривая становится более крутой, высота работающего слоя уменьшается, а время до проскока и динамическая активность увеличиваются (рис. 6,5). Улучшению кинетики способствует уменьшение вязкости раствора. Так, в системе диэтиленгликоль — вода при повышении температуры с 25 до 75 °С вязкость раствора уменьшается примерно в 6 раз, а коэффициент диффузии воды в растворителе значительно увеличивается- [c.166]
Области применения диэтиленгликоля и этиленгликоля весьма сходны, однако вследствие меньшей летучести, более высокой температуры кипения и вязкости использование диэтиленгликоля для некоторых целей предпочтительнее. В 1970 г. в США общее потребление диэтиленгликоля составило около 150 тыс. т. Из них 30% [c.136]
Полиэфирная смола ПНТ-2 (ТУ В-115—68) получается поликонденсацией диэтиленгликоля с фталевым и малеиновым ангидридом в диметакриловом эфире триэтиленгликоля (продукт ТГМ-3). Применяется в качестве основы клея, герметика или связующего для изготовления изделий на стекловолокнистой основе. Вязкость при 20°С не более 2000 сП. Срок хранения не более 3 месяцев. [c.313]
В результате можно сделать вывод о том, что дивиниловый эфир диэтиленгликоля хорошо вступает в реакцию сополимеризации с а-метилстиролом и является сшивающим агентом. Характеристическая вязкость растворимой части в толуоле охарактеризованных выше полимеров колебалась в пределах 6—7. [c.338]
С растворами других водорастворимых производных целлюлозы таких, как метилцеллюлоза, Na-КМЦ, оксиэтилцеллюлоза, а также с растворами нейтральных гумми, желатины, Na-альгината, декстринов, сахаров, крахмала, поливинилового спирта, мыла и т. д. Несовместимость наблюдается при смешении равных объемов с глицерином, этиленгликолем, диэтиленгликолем, пиридином, этаноламином. Указывается, что минеральные кислоты вызывают осаждение СЦ из растворов средневязкого типа, а органические — нет. Прибавление щелочей не вызывает желатинизации или осаждения, но резко снижает вязкость. [c.152]
Водные растворы этиленгликоля широко применяются в качестве антифриза [1—3], для этих же целей используется диэтиленгликоль [2] о применении полигликолей нам указаний не встретилось. Имеются довольно подробные сведения о температурах замерзания воды (первичной кристаллизации фазы льда) для этиленгликоля [2—6], а для системы вода — этиленгликоль из-за сильной вязкости растворов и застывания их при охлаждении в
Сравнение основных эксплуатационных свойств этиленгликоля, пропиленгликоля и их растворов как основы для теплоносителей
Растворы как этиленгликоля (ЭГ) и пропиленгликоля (ПГ) позволяют эффективно снизить температуру замерзания воды и для большинства приложений могут быть использоваться взаимозаменяемо или даже в смеси. Однако существуют многие незначительные на первый взгляд различия в свойствах между ЭГ и ПГ. По крайней мере два ключевых параметра определяют, какой из гликолей выбран для конкретного теплоносителя – это токсичность и вязкость .
Токсичность:
ЭГ более токсичен, чем ПГ. Примерно 56 — 114 г ЭГ может быть смертельной дозой при попадании в организм взрослого человека. И наоборот, ПГ является пищевой добавкой, которая не является вредной для человека, если попадает в организм в умеренных количествах. В результате использование ЭГ более жестко регламентируется по сравнению с ПГ. Таким образом, решение о использовании ПГ в качестве теплоносителя принимается в том случае, когда возможен контакт с человеком (например, в системах бытового отопления).
Вязкость:
Не смотря на то, что различия в вязкостях между теплоносителями на основе ЭГ и ПГ при повышенных температурах минимальны, при температурах ниже -18 °C различия становятся значительным. Если теплоноситель используется, в основном, при низких температурах, предпочтительней использовать продукты на основе ЭГ. Кроме того, теплоносители на основе ЭГ потребует менее мощных насосов при низкотемпературной эксплуатации. Некоторые менее значительные различия в производительности между ЭГ и ПГ решения перечислены ниже:
Теплоносители на основе этиленгликоля:
• более высокий коэффициент теплопередачи,
• более низкая температура замерзания водных растворов,
• меньшая способность к набуханию пластмасс / эластомеров,
• более высокое поверхностное натяжение — меньше протечек.
Теплоносители на основе пропиленгликоля:
• лучшая защита от кавитационной эрозии,
• концентрат не замерзает.
Сравнение основных физических свойств:
| Этиленгликоль, 100% | Пропиленгликоль, 100% | Этиленгликоль, раствор 50% | Пропиленгликоль, раствор 50% |
Молекулярная масса | 62,1 | 76,1 |
|
|
Температура замерзания, °С | -13,33 | -57,22 | -36,67 | -33,89 |
Удельная плотность | 1,110 | 1,033 | 1,082 | 1,050 |
Теипереатура вспышки, °С | 115,56 | 104,44 | — | — |
Температура кипения, °С | 197,22 | 187,22 | 107,22 | 105,56 |
Давление паров, мм ртутного столба при 25 °C) | 0,12 | 0,22 | 16 | 21 |
Поверхностное натяжение, дин/см (при 25 °C) | 47 | 36 | 56 | 45 |
Параметр растворимости | 17,1 | 15 | — | — |
Вязкость, сПз при 25 °C | 16,5 | 44,0 | 3,4 | 5,4 |
Вязкость, сПз при -35 °C | — | 20000 | 64 | 263 |
Вязкость, сПз при 77 °C | 3,5 | 4,5 | 1,04 | 1,20 |
Перепад давления (psi/30,5м) при -35 °C | — | — | 28,11 | 48,64 |
Перепад давления (psi/30,5м) при 77 °C | 12,5 | 12,6 | 10,61 | 10,43 |
Биологическое разложение (20 день) часть кислорода / часть гликоля | 1,15 | 1,45 |
|
|
Теоретическая потребность в кислороде | 89 | 86 |
|
|
Подробней ознакомится с предлагаемыми теплоносителями Вы можете по ссылке.
Источник: Автор: Ионин В.А., ООО «Силоксан» по материалам сайта: http://www.dow.com/heattrans/
Гликоли — Википедия
Материал из Википедии — свободной энциклопедии
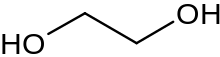
Глико́ли (дио́лы, двухатомные спирты) — класс органических соединений, содержащих в молекуле две гидроксильные группы. Имеют общую формулу CnH2n(OH)2. Простейшим гликолем является этиленгликоль НО−СН2−СН2−ОН.
Названия гликолей образованы от названий соответствующих углеводородов с суффиксами -диол или -гликоль:
- HO−Ch3−Ch3−OH{\displaystyle {\ce {HO-Ch3-Ch3-OH}}} — 1,2-этандиол, этиленгликоль,
- HO−Ch3−Ch3−Ch3−OH{\displaystyle {\ce {HO-Ch3-Ch3-Ch3-OH}}} — 1,3-пропандиол, 1,3-пропиленгликоль.
Низшие гликоли представляют собой бесцветные прозрачные жидкости со сладковатым вкусом. Безводные гликоли гигроскопичны. Из-за наличия двух полярных OH-групп в молекулах гликолей у них высокие вязкость, плотность, температуры плавления и кипения.
Низшие гликоли хорошо растворяются в воде и органических растворителях (спиртах, кетонах, кислотах и аминах). В то же время гликоли сами являются хорошими растворителями для многих веществ, за исключением ароматических и высших предельных углеводородов
Гликоли обладают всеми свойствами спиртов (образуют алкоголяты, простые и сложные эфиры), при этом гидроксильные группы реагируют независимо друг от друга, образовывая смесь продуктов.
С альдегидами и кетонами гликоли образуют 1,3-диоксоланы и 1,3-диоксаны.
Гликоли синтезируют несколькими основными способами:
- гидролиз соответствующих дихлоралканов
- Cl−Ch3−Ch3−Cl→200 ∘C, 10 MPaNa2CO3HO−Ch3−Ch3−OH,{\displaystyle {\ce {Cl-Ch3-Ch3-Cl->[{\ce {Na2CO3}}][200~^{\circ }{\text{C, 10 MPa}}]HO-Ch3-Ch3-OH,}}}
- окисление алкенов перманганатом калия,
- гидратация оксиранов (эпоксидов).
Гликоли служат в качестве растворителей и пластификаторов. Этиленгликоль и пропиленгликоль используются в качестве антифриза и гидравлических жидкостей. Благодаря высокой температуре кипения (например, 285 °C у триэтиленгликоля), гликоли нашли применение в качестве тормозной жидкости. Гликоли применяются для получения различных эфиров, полиуретанов и др.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл — Дар). — 623 с.
Диэтиленгликоль — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 января 2019; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 января 2019; проверки требуют 3 правки.Диэтиленгликоль, двуэтиленовый спирт (дигликоль) — химическое соединение, представитель двухатомных спиртов.
Диэтиленгликоль является прозрачной вязкой жидкостью. Гигроскопичен, обладает сладковатым вкусом. Растворим в воде, низших спиртах, ацетоне, анилине, феноле и хлороформе. Ограниченно растворим в бензоле, диэтиловом эфире и четырёххлористом углероде. Плохо растворим в минеральных и растительных маслах.
Наличие в молекуле диэтиленгликоля двух спиртовых групп приводит к образованию внутри- и межмолекулярных водородных связей — с другими веществами, содержащими электроотрицательный атом (вода, амины).
Может быть использован в качестве топлива для портативных горелок. Горит пламенем, практически не имеющим цвета, при этом выделяется большое количество теплоты:
- C4H10O3(ж) + 5O2(г) = 4CO2(г) + 5H2O(г) + 2376,39 кДж.
Диэтиленгликоль склонен к автоокислению. Автоокисление значительно ускоряется при наличии примесей пероксидных соединений (пероксиды, гидропероксиды) и замедляется при добавлении ингибиторов (хиноны, гидрохиноны). Окисляясь, диэтиленгликоль приобретает желтоватую окраску.
Диэтиленгликоль проявляет свойства как гликолей, так и сложных эфиров. С карбоновыми кислотами, их ангидридами и хлорангидридами образует сложные моно- и диэфиры, с альдегидами и кетонами в присутствии катализатора — фосфорной кислоты — соответствующие циклические ацетали.
Дегидрирование диэтиленгликоля на катализаторе (медь, цинк-медь-хром) приводит к 1,4-диоксан-2-ону. Дегидрирование на щелочных катализаторах даёт 1,4-диоксан. При оксиэтилировании при 150‒200оС в присутствии щелочных катализаторов образуется полиэтиленгликоль.
Реагирует с фосгеном, образующиеся продукты являются очень реакционноспособными. Для бис-хлоруглекислого эфира дигликоля возможна реакция с аллиловым спиртом в присутствии щелочи.
Является ядом. При попадании в организм вызывает острое отравление, в первую очередь, поражает почки и печень[1]. ПДК диэтиленгликоля в воздухе рабочей зоны составляет 10 мг/м3. Однако его ингаляционное воздействие невелико из-за низкой упругости паров.
Промышленный синтез диэтиленгликоля заключается в следующих процессах:
- Оксиэтилирование этиленгликоля
- Синтез этиленгликоля из этиленоксида (как побочный продукт)
Диэтиленгликоль является сырьём в промышленном получении сложных эфиров, полиуретанов, олигоэфиракрилатов. Он служит пластификатором, эффективным экстрагентом ароматических веществ в процессах риформинга. Диэтиленгликоль используется как осушитель газов, в качестве основного компонента антифризов, гидравлических и гидротормозных жидкостей, как растворитель нитратов целлюлозы и полиэфирных смол.
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Температура растворов этиленгликоля — Справочник химика 21
Водные растворы этиленгликоля и глицерина замерзают при низких температурах, поэтому их используют в качестве антифризов — жидкостей с низкой температурой замерзания, применяемых для охлаждения двигателей внутреннего сгорания. [c.373] Свойство растворов понижать температуру замерзания воды широко используется в практике для приготовления так называемых антифризов, которые представляют собой водные растворы некоторых органических и неорганических веществ. Эти растворы не замерзают при низких температурах и потому широко применяются для охлаждения двигателей автомобилей и тракторов в условиях Крайнего Севера. Например, такой антифриз, как 55%-ный раствор этиленгликоля в воде, не замерзает даже при температуре 233 К- [c.106]
Этиленгликоль и глицерин — высококипящие жидкости сладкого вкуса, смешивающиеся с водой во всех отношениях. Этиленгликоль применяется в качестве составной части так называемых антифризов, т. е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. Водный раствор этиленгликоля (58%-ный по массе) замерзает только при температуре -50 °С. Этиленгликоль применяется и для изготовления синтетического волокна лавсан (см. разд. 31.1.1). При приеме внутрь — сильно ядовит. [c.572] По условиям эксплуатации компрессорные установки газонаполнительных станций работают при температурах до —30 °С. Поэтому в ряде случаев целесообразно применение двухконтурных замкнутых систем охлаждения с использованием во вторичном контуре аппаратов воздушного охлаждения, а в первичном жидкостном контуре сорока пяти процентный раствор этиленгликоля в воде или введение антифриза с присадками. Система охлаждения газа — воздушная с использованием аппаратов воздушного охлаждения в стационарных установках допускается водяное охлаждение. В конструкции компрессора должна быть предусмотрена минимальная подача смазки на цилиндры и сальники. [c.330]
С. Смеси этиленгликоля с водой замерзают при значительно более низкой температуре. Самую низкую температуру замерзания (—75° С) имеет раствор, состоящий из 33% воды и 67% этиленгликоля. Эти свойства водных растворов этиленгликоля широко используются для изготовления низкозамерзающих жидкостей, применяемых в автомобильных и авиационных двигателях. Качество концентрированного этиленгликоля контролируется в основном по его физическим свойствам плотности, показателю преломления и по результатам разгонки в стандартном аппарате. [c.296]
Водные и спиртовые растворы этиленгликоля применяются как не замерзающие при низких температурах растворы, заменяющие воду в радиаторах автомобильных и авиационных моторов в зимних условиях,— антифризы. Во многих случаях он может служить заменителем глицерина. В последнее время применяется также для получения лавсана — ценного синтетического волокна. [c.315]
Этиленгликоль (этандиол) СН2ОН—СНгОН — бесцветная вязкая жидкость, растворимая в воде и многих органич



