Электролиз ℹ️ понятие, правила применения первого и второго законов Фарадея, уравнения и схемы процесса на катоде и аноде, примеры решений
Огромной популярностью в металлургии и химической промышленности имеет такой физико-химический процесс, как электролиз, происходящий с помощью электролизера. Чтобы понять принцип его действия, нужно изучить определение, нюансы и особенности явления.
Понятие электролиза
Электролиз — процесс, который возникает при воздействии электрического тока на электролит и заключается в выделении электродами составных частей.
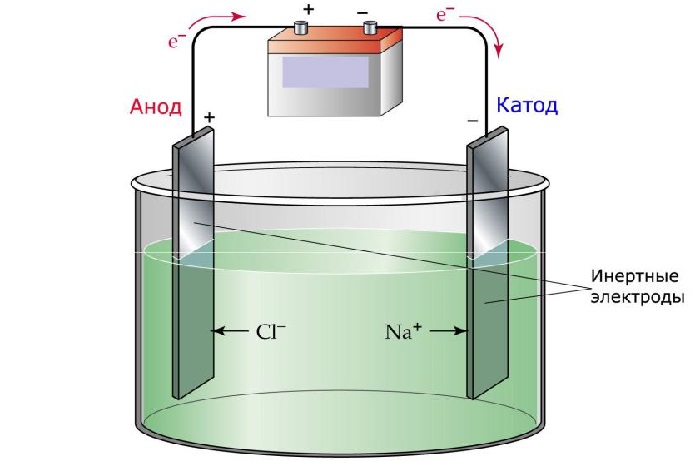
Значение явления заключается в том, что путём воздействия электричества на ионы можно организовывать новые формы, структуры или даже сами вещества. Это позволяет человеку контролировать некоторые процессы, протекающие на молекулярном уровне. Законы данного явления в химии и физике открыл английский учёный Фарадей.
Явление происходит при участии электродов, которые делятся на катод и анод:
-
катод — электрод с отрицательным зарядом, на котором происходит восстановление катионов;
-
анод — электрод с положительным зарядом, где происходит окисление анионов.
Приборы чаще всего изготавливаются из материалов, пропускающих электрический ток, например, из графита или большинства металлов. Оба прибора подключаются к отрицательному и положительному полюсам соответственно.
Явление происходит в следующем порядке:
-
Диссоциация.
-
Электролиз.
Очень важно не путать такие близкие определения, как гидролиз и электролиз. Первым явлением считается разложение раствора вещества на ионы (заряженные частицы) в воде.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой
Проверка первого закона Фарадея происходит следующим образом:
-
нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
-
если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
-
при этом будет верным следующее равенство: Г= Г1+Г2.
Второй закон Фарадея
Данное правило, установленное Фарадеем, указывает на

Таким образом, электрохимический эквивалент прямо пропорционален атомной массе вещества, но валентности вещества он обратно пропорционален.
Таблица изменения веществ с помощью электролиза
Усиление восстановительных способностей веществ:
|
Na+ |
Mg2+ |
Al3+ |
Zn2+ |
Fe3+ |
Ni2+ |
Sn2+ |
Pb2+ |
H+ |
Cu2 |
Ag+ |
|
Натрий |
Магний |
Алюминий |
Цинк |
Железо |
Никель |
Олово |
Свинец |
Водород |
Медь |
Серебро |
Усиление окислительных способностей веществ:
|
I- |
Br- |
Cl- |
OH- |
NO3- |
CO32- |
SO42-. |
|
Йодид (соли, образованные йодоводородной кислотой) |
Бромид (соли, образованные бромоводородной кислотой) |
Хлорид (соли, образованные соляной кислотой) |
Гидроксид |
Нитрат (соли, образованные азотной кислотой) |
Карбонат (соли, образованные угольной кислотой) |
Сульфат (соли, образованные серной кислотой) |
|
Катод (отрицательный) |
Анод (положительный) |
|
Восстановление катионов после водорода |
Окисление анионов кислот, не содержащих кислорода |
|
Восстановление катионов, имеющих среднюю активность |
Окисление анионов оксокислот |
|
Восстановление наиболее активных катионов |
Окисление анионов гидроксидов |
|
Восстановление катионов водорода |
|
Уравнения и схемы процессов электролиза, протекающих на катоде и аноде
Электролиз воды
Вода является слабым электролитом, из-за чего процесс будет протекать очень медленно.
Общее уравнение реакции: 2H2O => 2H2 + O2.

Схема водного электролиза:
|
Анод |
Катод |
|
2H2O => O2 + 4H+ + 4e– |
4H+ + 4e– => 2H2 |
|
3H2O => O3 + 6e– + 6H+ |
O2 + 2H2O + 2e– => H2O2 + 2OH– |
Электролиз расплавов солей
Данную разновидность реакции можно рассмотреть на примере расплава гидроксида натрия, то есть NaOH.

|
Диссоциация гидроксида |
NaOH => Na+ + OH- |
|
Окислительный и восстановительный процессы |
4OH- — 4ē => 2H2O + O2↑ (окисление) Na+ + 1ē => Na0 (восстановление) |
|
Электролиз |
4NaOH => 4Na + 2H2O + O2 |
Электролиз растворов солей
Явление можно рассмотреть на примере поваренной соли, имеющей формулу NaCl.

Схема с использованием инертных электродов:
|
Диссоциация соли |
NaCl => Na+ + Cl- |
|
Окислительный и восстановительный процессы |
2Cl- — 2ē => Cl2↑ 2H2O + 2ē => H2↑ + 2OH-. |
|
Электролиз |
2NaCl + 2H2O => H2↑ + Cl2↑ + 2NaOH. |
Таким образом, продуктом химической реакции было получение гидроксид натрия.
Также следует отметить такую особенность солей карбоновых кислот, как их способность к декарбоксилированию, как например реакция с ацетатом калия:
2CH3COOK + 2H2O => H2+ 2KOH + CH3-CH3 + 2CO2.
Электролиз веществ — одна из важнейших тем при изучении химии как неорганической, так и органической. Нужно научиться решать подобные задачи для полного понимания химических процессов и метаморфозов веществ.
Электролиз — Википедия
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом и т.д.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t},если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=μzeNAIΔt{\displaystyle m={\frac {\mu }{zeN_{A}}}I\Delta t}
- m=μzFIΔt{\displaystyle m={\frac {\mu }{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=μFz{\displaystyle k={\frac {\mu }{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A}иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
1. Соль активного металла и бескислородной кислоты:
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): Na++e−=Na0{\textstyle {\ce {Na+ + e- = Na^0}}}
A(+): Cl−−e−⟶Cl0⟶Cl2{\displaystyle {\ce {Cl- — e- -> Cl^0 -> Cl2}}}
Вывод: 2NaCl⟶2Na+Cl2↑{\displaystyle {\ce {2NaCl -> 2Na + Cl2 ^}}}
2. Соль активного металла и кислородсодержащей кислоты:
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}}
K(-): 2Na++2e−=2Na0{\displaystyle {\ce {2Na+ + 2e- = 2Na^0}}}
A(+): 2SO42−−4e−=2SO3+O2{\displaystyle {\ce {2SO4^2- — 4e- = 2SO3 + O2}}}
Вывод: 2Na2SO4⟶4Na+2SO3↑+O2↑{\displaystyle {\ce {2Na2SO4 -> 4Na + 2SO3 ^ + O2 ^}}}
3. Гидроксид: активный металл и гидроксид-ион:
NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}}
K(-): Na++e−=Na0{\displaystyle {\ce {Na+ + e- = Na^0}}}
A(+): 4OH−−4e−=2h3O+O2{\displaystyle {\ce {4OH- — 4e- = 2h3O + O2}}}
Вывод: 4NaOH⟶4Na+2h3O+O2↑{\displaystyle {\ce {4NaOH -> 4Na + 2h3O + O2 ^}}}
Растворы
Активные металлы
1. Соль активного металла и бескислородной кислоты
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): 2h3O+2e−=h3+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 + 2OH-}}}
A(+): Cl−−e−⟶Cl0⟶Cl2{\displaystyle {\ce {Cl- — e- -> Cl0 -> Cl2}}}
Вывод: 2NaCl+2h3O⟶h3↑+Cl2↑+2NaOH{\displaystyle {\ce {2NaCl + 2h3O -> h3 ^ + Cl2 ^ + 2NaOH}}}
2. Соль активного металла и кислородсодержащей кислоты
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}}
K(-): 2h3O+2e−=h3↑+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 ^ + 2OH-}}}
A(+): 2h3O−4e−=O2↑+4H+{\displaystyle {\ce {2h3O — 4e- = O2 ^ + 4H+}}}
Вывод: 2h3O⟶2h3↑+O2↑{\displaystyle {\ce {2h3O -> 2h3 ^ + O2 ^}}}
3. Гидроксид: активный металл и гидроксид-ион
NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}}
K(-): 2h3O+2e−=h3↑+2OH−{\displaystyle {\ce {2h3O + 2e- = h3 ^ + 2OH-}}}
A(+): 4OH−−4e−=O2↑+2h3O{\displaystyle {\ce {4OH- -4e- = O2 ^ + 2h3O}}}
Суммарно: 4h3O+4e−+4OH−=2h3↑+4OH−+4e−+O2↑+2h3O{\displaystyle {\ce {4h3O + 4e- + 4OH- = 2h3 ^ + 4OH- + 4e- + O2 ^ + 2h3O}}}
Вывод: 2h3O⟶2h3↑+O2↑{\displaystyle {\ce {2h3O -> 2h3 ^ + O2 ^}}}
Менее активные металлы и неактивные металлы
1. Соль менее активного металла и бескислородной кислоты
ZnCl2⟷Zn2++2Cl−{\displaystyle {\ce {ZnCl2 <-> Zn^2+ + 2Cl-}}}
K(-): Zn2++2e−=Zn0{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}}
A(+): 2Cl−−2e−=2Cl0{\displaystyle {\ce {2Cl- — 2e- = 2Cl^0}}}
Вывод: ZnCl2⟶Zn+Cl2↑{\displaystyle {\ce {ZnCl2 -> Zn + Cl2 ^}}}
2. Соль менее активного металла и кислородсодержащей кислоты
ZnSO4⟷Zn2++SO42−{\displaystyle {\ce {ZnSO4 <-> Zn^2+ + SO4^2-}}}
K(-): Zn2++2e−=Zn0{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}}
A(+): 2h3O−4e−=O2↑+4H+{\displaystyle {\ce {2h3O — 4e- = O2 ^ + 4H+}}}
Вывод: 2ZnSO4+2h3O⟶2Zn+2h3SO4+O2{\displaystyle {\ce {2ZnSO4 + 2h3O -> 2Zn + 2h3SO4 + O2}}}
3. Гидроксид: невозможно (нерастворим)
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
Ссылки
| |||
ЭЛЕКТРОЛИЗ — Физический энциклопедический словарь
Совокупность электрохим. процессов, проходящих на электродах, погружённых в электролит, при прохождении по нему электрич. тока. В результате этих процессов в-ва, входящие в состав электролита, выделяются в свободном виде.
Проводимость электролитов — ионная, прохождение тока в них связано с переносом в-ва. На аноде происходит электрохим. окисление отрицательно заряж. ионы становятся нейтр. атомами и выделяются из р-ра, а на катоде — восстановит. реакция: положит. ионы получают недостающие эл-ны.
Изучение и применение Э. началось в кон. 18 — нач. 19 вв. Осн. законы Э. были установлены экспериментально М. Фарадеем в 1833—34. Согласно первому закону Фарадея, масса m выделившегося на аноде в-ва пропорц. времени t прохождения через электролит тока и силе тока I:
m=kIt;
коэфф. пропорциональности k наз. электрохимическим эквивалентом данного в-ва.
Второй закон Фарадея устанавливает связь электрохим. эквивалента с химическим эквивалентом А—m/n, где m — молярная (или атомная) масса, n — заряд иона (в ед. абс. величины заряда эл-на е):
k=(1/F)A,
где F — Фарадея постоянная, численно равная заряду, к-рый должен пройти через электролит, чтобы на электроде выделилась масса в-ва, численно равная k. Этот заряд переносят ионы, кол-во к-рых в массе в-ва, численно равной хим. эквиваленту, составляет
NA/n ,
где NA— число Авогадро (число молекул в грамм-молекуле).
Поэтому F=qn(NA/n),
где qn — заряд одного иона. Так как заряд иона qn=ne, то F=eNA = 96500 Кл/моль.
Э. лежит в основе электрохим. метода получения чистых в-в, а также используется для создания тонких слоев одних в-в на поверхности других (никелирование, хромирование и Т. Д.).
Источник: Физический энциклопедический словарь на Gufo.me
Значения в других словарях
- электролиз — ЭЛЕКТРОЛИЗ, а, м. (спец.). Разложение (растворение, распад) вещества на составные части при прохождении через него электрического тока. | прил. электролизный, ая, ое и электролитический, ая, ое. Толковый словарь Ожегова
- электролиз — Электр/о́/лиз/. Морфемно-орфографический словарь
- электролиз — -а, м. Химические процессы, протекающие в электролитах и на погруженных в них электродах при прохождении через электролиты постоянного электрического тока. [От греч. ’ήλεκτρον — янтарь и λύσις — разложение] Малый академический словарь
- электролиз — Электролиз, электролизы, электролиза, электролизов, электролизу, электролизам, электролиз, электролизы, электролизом, электролизами, электролизе, электролизах Грамматический словарь Зализняка
- ЭЛЕКТРОЛИЗ — ЭЛЕКТРОЛИЗ, ХИМИЧЕСКАЯ РЕАКЦИЯ, происходящая при прохождении постоянного тока через ЭЛЕКТРОЛИТ. Процесс заключается в перемещении положительных ионов к отрицательному ЭЛЕКТРОДУ (КАТОДУ) и отрицательных ионов к положительному электроду (АНОДУ). Научно-технический словарь
- электролиз — ЭЛЕКТР’ОЛИЗ, электролиза, мн. нет, ·муж. (от слова электрический и ·греч. lysis — растворение) (физ.). Разложение вещества на составные части при прохождении через его раствор электрического тока. Толковый словарь Ушакова
- электролиз — ЭЛЕКТРОЛИЗ -а; м. [от сл. электрический и lysis — разложение, отделение] Спец. Химические процессы (разложение, распад вещества), протекающие на погружённых в электролит электродах при прохождении электрического тока. ◁ Электролитический (см.). Толковый словарь Кузнецова
- Электролиз — (от Электро… и греч. lysis — разложение, растворение, распад) совокупность процессов электрохимического окисления-восстановления (См. Окисление-восстановление) на погруженных в электролит (См. Большая советская энциклопедия
- ЭЛЕКТРОЛИЗ — ЭЛЕКТРОЛИЗ (от электро… и…лиз) — совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит электродах при прохождении электрического тока. Большой энциклопедический словарь
- электролиз — ЭЛЕКТРОЛИЗ совокупность электрохим. окислительно-восстановит. процессов, происходящих при прохождении электрич. тока через электролит с погруженными в него электродами. Химическая энциклопедия
- электролиз — сущ., кол-во синонимов: 1 гальванолиз 1 Словарь синонимов русского языка
- электролиз — орф. электролиз, -а Орфографический словарь Лопатина
- электролиз — электролиз м. Химический процесс разложения вещества на составные части при прохождении через него электрического тока. Толковый словарь Ефремовой
- электролиз — Электролиза, мн. нет, м. [от слова электрический и греч. lysis – растворение] (физ.). Разложение вещества на составные части при прохождении через его раствор электрического тока. Большой словарь иностранных слов
- Электролиз — См. Электролитическая диссоциация и Электрохимия. Энциклопедический словарь Брокгауза и Ефрона
- электролиз — ЭЛЕКТРОЛИЗ а, м. électrolyse f., > нем. Elektrolyse. Разложение веществ при помощи электрического тока на составные элементы (напр. воды на кислород и водород). Павленков 1911. Словарь галлицизмов русского языка

что такое в Физической энциклопедии
Смотреть что такое ЭЛЕКТРОЛИЗ в других словарях:
ЭЛЕКТРОЛИЗ
[electrolysis] — совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит электродах при прохожде
ЭЛЕКТРОЛИЗ
м. elettrolisi f Итальяно-русский словарь.2003. Синонимы: гальванолиз
ЭЛЕКТРОЛИЗ
электролиз (электр тогы арқылы химиялық элементтердің өз тектеріне ажырасу процесі)
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ(греч.) Разложение химических соединений посредством электрического (гальванического) тока на их составные части.Словарь иностранных слов, во
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ, -а, м. (спец.). Разложение (растворение, распад) вещества на составные части при прохождении через него электрического тока. || прилагатель
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ, -а, м. (спец.). Разложение (растворение, распад) веществана составные части при прохождении через него электрического тока. II прил.элек
ЭЛЕКТРОЛИЗ
м. физ. электролиз (электр тогунун зат аркылуу өткөндө ал заттын составдык бөлүктөргө бөлүнүшү).
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ, ХИМИЧЕСКАЯ РЕАКЦИЯ, происходящая при прохождении постоянного тока через ЭЛЕКТРОЛИТ. Процесс заключается в перемещении положительных ионов к
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ, -а, м. (спец.). Разложение (растворение, распад) вещества на составные части при прохождении через него электрического тока. || прил. эл
ЭЛЕКТРОЛИЗ
• электролиз m english: electrolysis, electrowinning deutsch: Elektrolyse f , elektrolytische Gewinnung f français: electrolyse Синонимы: гальв
ЭЛЕКТРОЛИЗ
(от Электро… и греч. lysis — разложение, растворение, распад) совокупность процессов электрохимического окисления-восстановления (См. Окислени
ЭЛЕКТРОЛИЗ
Electrolysis — Электролиз. (1) Химическая реакция, в результате прохождения электрического тока через электролит. (2) Разделение химических составляющ
ЭЛЕКТРОЛИЗ
процесс разложения электр. током водных растворов солей или самой воды, подкисленной какой-либо кислотой. Продуктами распада солей служат металл и кисл
ЭЛЕКТРОЛИЗ
— (от электро… и …лиз) — совокупность процессовэлектрохимического окисления — восстановления, происходящих на погруженныхв электролит электродах пр
ЭЛЕКТРОЛИЗ
Электролиз — см. Электролитическая диссоциация и Электрохимия.
ЭЛЕКТРОЛИЗ
электролиз м. Химический процесс разложения вещества на составные части при прохождении через него электрического тока.
ЭЛЕКТРОЛИЗ
совокупность электрохим. окислит.-восстановит. процессов, происходящих при прохождении электрич. тока через электролит с погруженными в него электрода
ЭЛЕКТРОЛИЗ
М мн. нет kim. elektroliz (maddənin içindən elektrik cərəyanı keçdikdə onun tərkib hissələrinə ayrılması).
ЭЛЕКТРОЛИЗ
electrolysis* * *электро́лиз м.electrolysisподверга́ть электро́лизу — electrolyzeвну́тренний электро́лиз — internal electrolysis* * *electrolysisСино
ЭЛЕКТРОЛИЗ
электролиз м хим. Elektrolyse f cСинонимы: гальванолиз
ЭЛЕКТРОЛИЗ
, процессы электрохимического окисления — восстановления, происходящие на погруженных в электролит электродах при прохождении электрического тока. Прим
ЭЛЕКТРОЛИЗ
(от электро… и …лиз), совокупность процессов эл.-хим. окисления-восстановления, происходящих на погружённых в электролит электродах при прохождении
ЭЛЕКТРОЛИЗ
Начальная форма — Электролиз, винительный падеж, единственное число, мужской род, неодушевленное
ЭЛЕКТРОЛИЗ
Ударение в слове: электр`олизУдарение падает на букву: оБезударные гласные в слове: электр`олиз
ЭЛЕКТРОЛИЗ
корень — ЭЛЕКТР; соединительная гласная — О; корень — ЛИЗ; нулевое окончание;Основа слова: ЭЛЕКТРОЛИЗВычисленный способ образования слова: Сложение осн
ЭЛЕКТРОЛИЗ
▲ постоянный ток ↑ через, жидкость, содержащий, ион электролит — жидкость (раствор соли, щелочи, кислоты; расплав), способная проводитьэлектрический
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ а, м. électrolyse f., > нем. Elektrolyse. Разложение веществ при помощи электрического тока на составные элементы (напр. воды на кислоро
ЭЛЕКТРОЛИЗ
электро́лиз, электро́лизы, электро́лиза, электро́лизов, электро́лизу, электро́лизам, электро́лиз, электро́лизы, электро́лизом, электро́лизами,
ЭЛЕКТРОЛИЗ
м. elettrolisi f — электролиз в водных растворах- внутренний электролиз- водный электролиз- электролиз в расплавленных солях
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ (от электро… и греч. lysis — разложение, растворение, распад), совокупность процессов электрохимич. окисления-восстановления на погруже
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ (от электро … и …лиз), совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит эл
ЭЛЕКТРОЛИЗ
электролиз [см. электро… + …лиз] — разложение веществ (напр., воды, растворенных или расплавленных солей) при прохождении через них постоянного эле
ЭЛЕКТРОЛИЗ
см. Электролитическая диссоциация и Электрохимия.
ЭЛЕКТРОЛИЗ
(от электро… и греч. lysis — разложение, растворение, распад) — хим. процессы, протекающие в электролите при прохождении через него пост. электрич. т
ЭЛЕКТРОЛИЗ
-а, м. Химические процессы, протекающие в электролитах и на погруженных в них электродах при прохождении через электролиты постоянного электрического
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ (от электро… и …лиз) — совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит эл
ЭЛЕКТРОЛИЗ
Трок Триоз Трио Трилок Трико Трек Тори Тор Толлер Толки Толк Тол Ток Тоз Тире Тир Тилл Тикер Тик Тизер Терлик Теор Тело Рэкет Ротик Рот Ролл Ролик Рол
ЭЛЕКТРОЛИЗ
1) Орфографическая запись слова: электролиз2) Ударение в слове: электр`олиз3) Деление слова на слоги (перенос слова): электролиз4) Фонетическая транскр
ЭЛЕКТРОЛИЗ
электро’лиз, электро’лизы, электро’лиза, электро’лизов, электро’лизу, электро’лизам, электро’лиз, электро’лизы, электро’лизом, электро’лизами, электро’
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ, процессы электрохимического окисления — восстановления, происходящие на погруженных в электролит электродах при прохождении электрического
ЭЛЕКТРОЛИЗ
электролиз сущ., кол-во синонимов: 1 • гальванолиз (1) Словарь синонимов ASIS.В.Н. Тришин.2013. . Синонимы: гальванолиз
ЭЛЕКТРОЛИЗ
electrolysis– внутренний электролизСинонимы: гальванолиз
ЭЛЕКТРОЛИЗ
электролизאֶלֶקטרוֹלִיזָה נ’* * *אלקטרוליזהСинонимы: гальванолиз
ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ электролиза, мн. нет, м. (от слова электрический и греч. lysis — растворение) (физ.). Разложение вещества на составные части при прохождении
ЭЛЕКТРОЛИЗ (ОТ ЭЛЕКТРО … И …ЛИЗ)
ЭЛЕКТРОЛИЗ (от электро … и …лиз), совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит эл
ЭЛЕКТРОЛИЗ (ОТ ЭЛЕКТРО… И…ЛИЗ)
ЭЛЕКТРОЛИЗ (от электро… и…лиз), совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит элек
ЭЛЕКТРОЛИЗ — это… Что такое ЭЛЕКТРОЛИЗ?
(от электро… и греч. lysis — разложение, растворение, распад) — совокупность электрохим. реакций (т. е. хим. реакций с участием свободных электронов), протекающих на поверхностях электродов в гальванич. цепи при пропускании через неё электрич. тока от внеш. источника и приводящих к хим. разложению растворителя или др. компонентов электролита (ионного проводника) и к образованию новых веществ. Если ток возникает в результате действия самой гальванич. цепи, то говорят о то-кообразующих реакциях.
Гальванич. цепь — электрич. цепь из последовательно включённых электронных и ионных проводников. В простейшем случае может быть представлена схемой
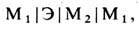
где М 1 и М 2 — электронные проводники (металлы), Э — электролит (напр., раствор к-ты, основания или соли, расплав соли и т. д.). Электрохим. реакция в гальванич. цепи сосредоточена на поверхности электродов, т. е. в местах контакта электронного и ионного проводников. В этих местах поток электронов в первом проводнике сменяется на поток ионов во втором. Электрохим. реакция служит стоком заряж. частиц, подходящих из объёма фазы к поверхности раздела, и источником частиц, отходящих от поверхности в глубь фазы. В результате обеспечивается непрерывность электрич. тока («эстафетная» передача зарядов) и предотвращается накопление или исчезновение заряж. частиц в поверхностном слое. Электрохим. реакции подчиняются з а к о н а м Ф а р а д е я (М. Faraday, 1833- 1834), согласно к-рым кол-во превращаемых в реакции веществ строго пропорционально кол-ву прошедшего через гальванич. цепь электричества, а также пропорционально хим. эквивалентам (отношениям молярной массы к кол-ву электронов, участвующих в реакции одной молекулы) каждого вещества.
Характер электрохим. реакций зависит от хим. природы контактирующих проводников и от направления тока. На аноде (металлич. электроде, из к-рого ток переходит в ио-нопроводящий проводник — электролит) протекают реакции окисления с выделением свободных электронов, на катоде (обратное направление тока) — реакции восстановления с потреблением электронов из металла. При Э. анод — положительный электрод гальванич. цепи, катод — отрицательный. Примером анодной реакции является электролитич. выделение хлора из хлоридных растворов или расплавов на металлич. электроде
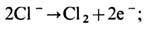
в результате реакции на поверхности раздела прекращается поток ионов Cl— в электролите и возникает поток электронов в металле. Примером катодной реакции является электролитич. выделение водорода из водных растворов электролитов
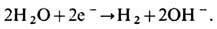
В замкнутой цепи катодная и анодная реакции сопряжены и протекают с одинаковой скоростью, т. е. выделяющееся в единицу времени на аноде кол-во электронов равно кол-ву электронов, вступающих за это время в реакцию на катоде. В ур-нии общей хим. реакции, протекающей в цепи в целом, электроны в явном виде уже не фигурируют. Для упомянутого примера реакций на аноде и катоде общая реакция имеет вид
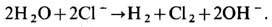
Э. используют для производства ряда веществ путём электрохим. превращений компонентов электролита — растворителя, растворённых или расплавленных солей, специально добавляемых веществ и т. год) и щёлочи (ок. 35 млн. т в год). Широко распространён Э. растворов или расплавов солей разных металлов с катодным восстановлением ионов металлов с целью производства этих металлов (электрометаллургия) или их осаждения в виде тонкого защитного или декоративного слоя на основу из др. металла (электроосаждение, гальваностегия). Производство алюминия (ок. 15 млн. т в год) основано на Э. эвтектич. смеси кремнезёма и расплавленного криолита при темп-ре 950 °С. Э. применяют также для производства или рафинирования большинства др. цветных металлов. С помощью Э. на аноде получают сильные окислители — фтор, перхлораты, персульфаты, перманганаты и др. Э. используют также для синтеза нек-рых органич. веществ, напр. себациновой кислоты (на аноде, из метанольного раствора моноэфира адипиновой кислоты), адипонитрила (на катоде, из раствора акрилнитрила) и др.
Реакции Э. проводят в спец. электролизёрах (электроли-тич. ячейках, гальванич. ваннах), основными составными частями к-рых являются блоки положительных и отрицательных электродов, электролит, межэлектродные сепараторы (для разделения продуктов реакций на аноде и катоде), корпус (бак) и системы регулирования.
Осн. параметры реакций Э.: плотность тока на аноде и катоде (отношение общей силы тока к площади поверхности соответствующего электрода), напряжение на выводах (клеммах) электролизёра. В зависимости от характера электрохим. реакций и природы целевого продукта применяют плотности тока от 10 до 104 А/м 2. Напряжение на выводах отд. электролизёра составляет 2-5 В. Часто соединяют электролизёры последовательно в секции (группы) с общим напряжением 200-400 В. Наиб. мощные промышленные электролизёры рассчитаны на токи порядка 100 кА. В. С. Багоцкий.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
Электролиз — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза (см. ниже).
Применение
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, в медицине получения живой(щелочной)и мертвой(кислой) воды, а также гидроксида натрия, хлора, хлорорганических соединенийК:Википедия:Статьи без источников (тип: не указан)[источник не указан 3920 дней], диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
<math>m=k\cdot q=k\cdot I\cdot t</math>
,
если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности <math>k</math> называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- <math>m = m_i N_i</math> (1)
- <math>N_i = \frac{\Delta q}{q_i}</math> (3)
- <math>\Delta q = I \Delta t</math> (4)
- <math>q_i = e z</math>, где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
- <math>m = \frac{\mu}{z e N_A} I \Delta t</math>
- <math>m=\frac{\mu}{z F} I \Delta t</math>,
где <math>F=e N_A</math> — постоянная Фарадея.
- <math>k = \frac{\mu}{F z}</math>
- <math>m = kI \Delta t</math>
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
- <math>k \ = \ { 1 \over F } \cdot { A \over z }</math>,
где <math>F</math> — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- <math>m=\frac{M{\cdot}I{\cdot}{\Delta}t}{n{\cdot}F}</math>,
где <math>M</math> — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; <math>I</math> — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; <math>{\Delta}t</math> — время, в течение которого проводился электролиз, с; <math>F</math> — постоянная Фарадея, Кл·моль−1; <math>n</math> — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
I. Активные металлы
1. Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K»катод»(-): Na+ + 1e = Na0
A»анод»(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2. Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
II. Менее активные металлы
Точно так же
III. Неактивные металлы
Точно так же
Растворы
I. Активные металлы
1. Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K»катод»(-): 2H2O + 2e = H2 + 2OH−
A»анод»(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2. Соль активного металла и кислородсодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → 2H2 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2OH— — 2e=O2 + H2
Вывод: 2NaOH + 2H2O (электролиз) → 2NaOH + 2H2 + O2
II. Менее активные металлы
1. Соль менее активного металла и бескислородной кислоты
ZnCl2 ↔ Zn2+ + 2Cl−
K»катод»(-): Zn2+ + 2e = Zn0
A»анод»(+): 2Cl− — 2e = 2Cl0
Вывод: ZnCl2 (электролиз) → Zn + Cl2
2. Соль менее активного металла и кислородсодержащей кислоты
ZnSO4 ↔ Zn2++SO42−
K(-): Zn2+ + 2e = Zn0
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2ZnSO4 + 2H2O(электролиз) → 2Zn + 2H2SO4 + O2
3. Гидроксид: невозможно (нерастворим)
III. Неактивные металлы
Точно так же
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
К:Википедия:Статьи без источников (тип: не указан)Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- 1) при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- 2) электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- 3) уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Напишите отзыв о статье «Электролиз»
Примечания
- ↑ Обратное обозначение знака катода и анода встречается в литературе при описании гальванических элементов
- ↑ [www.xumuk.ru/encyklopedia/2/5329.html Электросинтез — Химическая энциклопедия]
Ссылки
- [electricalschool.info/main/electrotehnolog/664-jelektroliz.html Процессы, протекающие при электролизе]
- [www.chemport.ru/chemical_encyclopedia_article_4474.html Статья «Электролиз» (Химическая энциклопедия)]
- [hydropark.ru/equipment/electrodialysis.htm Электродиализ]
- [enviropark.ru/course/category.php?id=3 Электрофлотация]
- [www.youtube.com/watch?v=AN3KIdqO17E Учебный фильм «Электролиз»]
Отрывок, характеризующий Электролиз
Поезд Ростовых в эту ночь стоял в Мытищах, в двадцати верстах от Москвы. 1 го сентября они выехали так поздно, дорога так была загромождена повозками и войсками, столько вещей было забыто, за которыми были посылаемы люди, что в эту ночь было решено ночевать в пяти верстах за Москвою. На другое утро тронулись поздно, и опять было столько остановок, что доехали только до Больших Мытищ. В десять часов господа Ростовы и раненые, ехавшие с ними, все разместились по дворам и избам большого села. Люди, кучера Ростовых и денщики раненых, убрав господ, поужинали, задали корму лошадям и вышли на крыльцо.В соседней избе лежал раненый адъютант Раевского, с разбитой кистью руки, и страшная боль, которую он чувствовал, заставляла его жалобно, не переставая, стонать, и стоны эти страшно звучали в осенней темноте ночи. В первую ночь адъютант этот ночевал на том же дворе, на котором стояли Ростовы. Графиня говорила, что она не могла сомкнуть глаз от этого стона, и в Мытищах перешла в худшую избу только для того, чтобы быть подальше от этого раненого.
Один из людей в темноте ночи, из за высокого кузова стоявшей у подъезда кареты, заметил другое небольшое зарево пожара. Одно зарево давно уже видно было, и все знали, что это горели Малые Мытищи, зажженные мамоновскими казаками.
– А ведь это, братцы, другой пожар, – сказал денщик.
Все обратили внимание на зарево.
– Да ведь, сказывали, Малые Мытищи мамоновские казаки зажгли.
– Они! Нет, это не Мытищи, это дале.
– Глянь ка, точно в Москве.
Двое из людей сошли с крыльца, зашли за карету и присели на подножку.
– Это левей! Как же, Мытищи вон где, а это вовсе в другой стороне.
Несколько людей присоединились к первым.
– Вишь, полыхает, – сказал один, – это, господа, в Москве пожар: либо в Сущевской, либо в Рогожской.
Никто не ответил на это замечание. И довольно долго все эти люди молча смотрели на далекое разгоравшееся пламя нового пожара.
Старик, графский камердинер (как его называли), Данило Терентьич подошел к толпе и крикнул Мишку.
– Ты чего не видал, шалава… Граф спросит, а никого нет; иди платье собери.
– Да я только за водой бежал, – сказал Мишка.
– А вы как думаете, Данило Терентьич, ведь это будто в Москве зарево? – сказал один из лакеев.
Данило Терентьич ничего не отвечал, и долго опять все молчали. Зарево расходилось и колыхалось дальше и дальше.
– Помилуй бог!.. ветер да сушь… – опять сказал голос.
– Глянь ко, как пошло. О господи! аж галки видно. Господи, помилуй нас грешных!
– Потушат небось.
– Кому тушить то? – послышался голос Данилы Терентьича, молчавшего до сих пор. Голос его был спокоен и медлителен. – Москва и есть, братцы, – сказал он, – она матушка белока… – Голос его оборвался, и он вдруг старчески всхлипнул. И как будто только этого ждали все, чтобы понять то значение, которое имело для них это видневшееся зарево. Послышались вздохи, слова молитвы и всхлипывание старого графского камердинера.
Камердинер, вернувшись, доложил графу, что горит Москва. Граф надел халат и вышел посмотреть. С ним вместе вышла и не раздевавшаяся еще Соня, и madame Schoss. Наташа и графиня одни оставались в комнате. (Пети не было больше с семейством; он пошел вперед с своим полком, шедшим к Троице.)
Графиня заплакала, услыхавши весть о пожаре Москвы. Наташа, бледная, с остановившимися глазами, сидевшая под образами на лавке (на том самом месте, на которое она села приехавши), не обратила никакого внимания на слова отца. Она прислушивалась к неумолкаемому стону адъютанта, слышному через три дома.
– Ах, какой ужас! – сказала, со двора возвративись, иззябшая и испуганная Соня. – Я думаю, вся Москва сгорит, ужасное зарево! Наташа, посмотри теперь, отсюда из окошка видно, – сказала она сестре, видимо, желая чем нибудь развлечь ее. Но Наташа посмотрела на нее, как бы не понимая того, что у ней спрашивали, и опять уставилась глазами в угол печи. Наташа находилась в этом состоянии столбняка с нынешнего утра, с того самого времени, как Соня, к удивлению и досаде графини, непонятно для чего, нашла нужным объявить Наташе о ране князя Андрея и о его присутствии с ними в поезде. Графиня рассердилась на Соню, как она редко сердилась. Соня плакала и просила прощенья и теперь, как бы стараясь загладить свою вину, не переставая ухаживала за сестрой.
– Посмотри, Наташа, как ужасно горит, – сказала Соня.
– Что горит? – спросила Наташа. – Ах, да, Москва.
И как бы для того, чтобы не обидеть Сони отказом и отделаться от нее, она подвинула голову к окну, поглядела так, что, очевидно, не могла ничего видеть, и опять села в свое прежнее положение.
– Да ты не видела?
– Нет, право, я видела, – умоляющим о спокойствии голосом сказала она.
И графине и Соне понятно было, что Москва, пожар Москвы, что бы то ни было, конечно, не могло иметь значения для Наташи.
Граф опять пошел за перегородку и лег. Графиня подошла к Наташе, дотронулась перевернутой рукой до ее головы, как это она делала, когда дочь ее бывала больна, потом дотронулась до ее лба губами, как бы для того, чтобы узнать, есть ли жар, и поцеловала ее.
– Ты озябла. Ты вся дрожишь. Ты бы ложилась, – сказала она.
– Ложиться? Да, хорошо, я лягу. Я сейчас лягу, – сказала Наташа.
С тех пор как Наташе в нынешнее утро сказали о том, что князь Андрей тяжело ранен и едет с ними, она только в первую минуту много спрашивала о том, куда? как? опасно ли он ранен? и можно ли ей видеть его? Но после того как ей сказали, что видеть его ей нельзя, что он ранен тяжело, но что жизнь его не в опасности, она, очевидно, не поверив тому, что ей говорили, но убедившись, что сколько бы она ни говорила, ей будут отвечать одно и то же, перестала спрашивать и говорить. Всю дорогу с большими глазами, которые так знала и которых выражения так боялась графиня, Наташа сидела неподвижно в углу кареты и так же сидела теперь на лавке, на которую села. Что то она задумывала, что то она решала или уже решила в своем уме теперь, – это знала графиня, но что это такое было, она не знала, и это то страшило и мучило ее.
– Наташа, разденься, голубушка, ложись на мою постель. (Только графине одной была постелена постель на кровати; m me Schoss и обе барышни должны были спать на полу на сене.)
– Нет, мама, я лягу тут, на полу, – сердито сказала Наташа, подошла к окну и отворила его. Стон адъютанта из открытого окна послышался явственнее. Она высунула голову в сырой воздух ночи, и графиня видела, как тонкие плечи ее тряслись от рыданий и бились о раму. Наташа знала, что стонал не князь Андрей. Она знала, что князь Андрей лежал в той же связи, где они были, в другой избе через сени; но этот страшный неумолкавший стон заставил зарыдать ее. Графиня переглянулась с Соней.
– Ложись, голубушка, ложись, мой дружок, – сказала графиня, слегка дотрогиваясь рукой до плеча Наташи. – Ну, ложись же.
– Ах, да… Я сейчас, сейчас лягу, – сказала Наташа, поспешно раздеваясь и обрывая завязки юбок. Скинув платье и надев кофту, она, подвернув ноги, села на приготовленную на полу постель и, перекинув через плечо наперед свою недлинную тонкую косу, стала переплетать ее. Тонкие длинные привычные пальцы быстро, ловко разбирали, плели, завязывали косу. Голова Наташи привычным жестом поворачивалась то в одну, то в другую сторону, но глаза, лихорадочно открытые, неподвижно смотрели прямо. Когда ночной костюм был окончен, Наташа тихо опустилась на простыню, постланную на сено с края от двери.
– Наташа, ты в середину ляг, – сказала Соня.
– Нет, я тут, – проговорила Наташа. – Да ложитесь же, – прибавила она с досадой. И она зарылась лицом в подушку.
Графиня, m me Schoss и Соня поспешно разделись и легли. Одна лампадка осталась в комнате. Но на дворе светлело от пожара Малых Мытищ за две версты, и гудели пьяные крики народа в кабаке, который разбили мамоновские казаки, на перекоске, на улице, и все слышался неумолкаемый стон адъютанта.
Долго прислушивалась Наташа к внутренним и внешним звукам, доносившимся до нее, и не шевелилась. Она слышала сначала молитву и вздохи матери, трещание под ней ее кровати, знакомый с свистом храп m me Schoss, тихое дыханье Сони. Потом графиня окликнула Наташу. Наташа не отвечала ей.
– Кажется, спит, мама, – тихо отвечала Соня. Графиня, помолчав немного, окликнула еще раз, но уже никто ей не откликнулся.
Скоро после этого Наташа услышала ровное дыхание матери. Наташа не шевелилась, несмотря на то, что ее маленькая босая нога, выбившись из под одеяла, зябла на голом полу.
Как бы празднуя победу над всеми, в щели закричал сверчок. Пропел петух далеко, откликнулись близкие. В кабаке затихли крики, только слышался тот же стой адъютанта. Наташа приподнялась.
– Соня? ты спишь? Мама? – прошептала она. Никто не ответил. Наташа медленно и осторожно встала, перекрестилась и ступила осторожно узкой и гибкой босой ступней на грязный холодный пол. Скрипнула половица. Она, быстро перебирая ногами, пробежала, как котенок, несколько шагов и взялась за холодную скобку двери.
Ей казалось, что то тяжелое, равномерно ударяя, стучит во все стены избы: это билось ее замиравшее от страха, от ужаса и любви разрывающееся сердце.
Она отворила дверь, перешагнула порог и ступила на сырую, холодную землю сеней. Обхвативший холод освежил ее. Она ощупала босой ногой спящего человека, перешагнула через него и отворила дверь в избу, где лежал князь Андрей. В избе этой было темно. В заднем углу у кровати, на которой лежало что то, на лавке стояла нагоревшая большим грибом сальная свечка.
Электролиз | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Раздел: Электрохимия
Открытие электролиза стало возможным после изобретения Вольтом батареи гальванических элементов (1799). Уже в 1800 г. английские исследователи Никольсон и Карлейль открыли электролиз: они установили, что при прохождении постоянного тока в воде или водных растворах вода распадается на водород и кислород. Более поздние исследования были завершены в 1833 г. Майклом Фарадеем в виде законов. Ионы, образующие ток в электролитах (рис. 7.16), имеют названия:
Анионы (гр. — восходящий) — отрицательно заряженные ионы, движущиеся к аноду;
Катионы (идущие книзу) — положительно заряженные ионы, движущиеся к катоду.
При прохождении тока через электролит ионы подходят к электродам, где могут; выделяться на электродах, нейтрализоваться на них, вступать во вторичные реакции с электродами или же с растворителем. Продукты вторичных реакций выделяются на электродах или переходят в раствор.
В упрощенном понимании:
выделение на электродах составных электролита при прохождении тока в нем называется электролизом.
| Рис. 7.16. Ток в электролитах |
Рассмотрим примеры:
а)
- Электролит — водный раствор HCl.
- Диссоциация: HCl ⇆ H+ + Cl—.
- Анод: 2Cl— — 2e— → Cl2.
- Катод: 2H+ + 2e— → H2.
Здесь расходуется растворенное вещество, а на электродах выделяются газообразные водород и хлор. Вторичных реакций нет.
б)
- Водный раствор H2SO4.
- Диссоциация: H2SO4 ⇆ 2H+ + SO2-4; H2O ⇆ H+ + OH—.
- Анод: 4OH— — 4e— → 2H2O + O2.
- Катод: 2H+ + 2e— → H2.
- В растворе остается: SO2-4 + 2H+ → H2SO4. Материал с сайта http://worldofschool.ru
Эта реакция происходит, если электроды изготовлены из платины или никеля. Кислород выделяется на аноде.
в)
- Электроды медные. Водный раствор CuSO4.
- Диссоциация: CuSO4 ⇆ Cu2+ + SO2-4; H2O ⇆ H+ + OH—.
- Катод: Cu2+ + 2e— → Cu0 — выделяется на катоде.
- Анод: 4OH— — 4e— → 2H2O + O2 — кислород выделяется на аноде.
Анод растворяется, а медь выделяется на катоде.
На этой странице материал по темам:Электролиз физика формулы
Как применяется электролиз кратко
Что называется электролизом?



