Химический потенциал — Википедия
У этого термина существуют и другие значения, см. Потенциал.Хими́ческий потенциа́л μ{\displaystyle \mu } — термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. Определяет изменение термодинамических потенциалов (энергии Гиббса, внутренней энергии, энтальпии и т. д.) при изменении числа частиц в системе. Представляет собой энергию добавления одной частицы в систему без совершения работы. Применяется для описания материального взаимодействия. Определение химического потенциала можно записать в виде:
- dE=TdS−PdV+μdN,{\displaystyle dE=TdS-PdV+\mu dN,}
где E{\displaystyle E} — энергия системы, S{\displaystyle S} — её энтропия, N{\displaystyle N} — количество частиц в системе.
Эта формула определяет, кроме химического потенциала μ{\displaystyle \mu }, также давление P{\displaystyle P} и температуру T{\displaystyle T}.
Для систем, состоящих из одного компонента, химический потенциал задаётся формулой
- μ=E−TS+PVN=GN,{\displaystyle \mu ={E-TS+PV \over N}={G \over N},}
где G{\displaystyle G} — потенциал Гиббса.
Если энергия системы зависит не от объёма, а от других термодинамических параметров A1,A2…{\displaystyle A_{1},A_{2}…}, исходная формула принимает вид
- dE=TdS−∑iaidAi+μdN.{\displaystyle dE=TdS-\sum _{i}a_{i}dA_{i}+\mu dN.}
Если в системе имеется несколько разных типов частиц, есть столько же разных химических потенциалов.
Химический потенциал служит естественной независимой переменной для большого термодинамического потенциала.
Важность химического потенциала для термодинамики обусловлена, помимо прочего, тем, что одним из условий термодинамического равновесия в системе является одинаковость химического потенциала любого компонента системы в различных фазах и в разных точках одной фазы
Для однородных многокомпонентных систем открытых систем
- dE=TdS−PdV+∑jμjdmj,{\displaystyle dE=TdS-PdV+\sum _{j}\mu _{j}dm_{j},}
где mj{\displaystyle m_{j}} — масса j{\displaystyle j}-го компонента[K 1], μj{\displaystyle \mu _{j}} — химический потенциал этого компонента, по определению равный[K 2][2][3][4]
| μk≡(∂E∂mk)S,V,{mj≠k}.{\displaystyle \mu _{k}\equiv \left({\frac {\partial E}{\partial m_{k}}}\right)_{S,V,\{m_{j\neq k}\}}.} | (Дефиниция химического потенциала компонента) |
Величину изменение энергии системы за счёт вариации масс составляющих систему веществ
| z≡∑jμjdmj,{\displaystyle z\equiv \sum _{j}\mu _{j}dm_{j},} | (Химическая работа бесконечно малого процесса в открытой однородной системе) |
не имеющую общепринятого названия, чаще всего называют элементарной химической работой[K 3][5][6][7][8][9][10][11][12][13][14][15][16][17][18]
| q≡TdS{\displaystyle q\equiv T\mathrm {d} S} | (Теплота бесконечно малого процесса в открытой однородной системе) |
и учесть, что элементарная работа расширения/сжатия равна
| w=−PdV,{\displaystyle w=-P\mathrm {d} V,} | (Элементарная работа расширения/сжатия в однородной системе) |
то химическая работа может быть вычислена[29]:
- z=∑jμjdmj=dE−q−w=dE−TdS+PdV.{\displaystyle z=\sum _{j}\mu _{j}\mathrm {d} m_{j}=\mathrm {d} E-q-w=\mathrm {d} E-T\mathrm {d} S+P\mathrm {d} V.}
Для системы в пространственно неоднородном внешнем поле следует учитывать зависимость химического потенциала компонента от напряжённости поля[1].
Если система находится в электрическом поле, то химический потенциал электрически заряженных частиц называют электрохимическим потенциалом
Если система находится в гравитационном поле, то условием её равновесия служит постоянство суммы химического потенциала компонента в отсутствие поля и его гравитационного потенциала[35][36] (конкретизация этого условия для идеального газа даёт барометрическую формулу[1]), и по аналогии с электрохимическим потенциалом химический потенциал компонента в поле тяготения можно назвать гравихимическим потенциалом
Химический потенциал анизотропного тела есть тензор второго ранга, зависящий от тензора напряжений[37]. Как и тензор напряжений, который в изотропных средах становится шаровым[38][39], в изотропных средах для задания шарового тензора химического потенциала достаточно единственной скалярной величины
- ↑ Под компонентом в данной формуле можно понимать как независимый компонент, так и составляющее вещество: использование масс независимых компонентов, а не масс составляющих систему веществ означает отказ от прямого рассмотрения влияния химических реакций на массы веществ в системе, ибо химические превращения в ней уже учтены при подсчёте числа компонентов.
- ↑ Индексы у частной производной означают постоянство энтропии, объёма и масс всех компонентов, кроме k{\displaystyle k}-го.
- ↑ В понятии «химическая работа» термин «работа» не имеет отношения к понятию «термодинамическая работа» и использован просто как синоним словосочетания «изменение энергии», связанное с переносом массы j{\displaystyle j}-го компонента через
- ↑ 1 2
- ↑ Chemical potential, μ // IUPAC Gold Book.
- ↑ Гамбург Ю. Д., Химическая термодинамика, 2016, уравнение (1.29), с. 28.
- ↑ Залевски К., Феноменологическая и статистическая термодинамика, 1973, уравнение (5.2), с. 54.
- ↑ 1 2 Борщевский А. Я., Физическая химия, т. 1, 2017, с. 242.
- ↑ Гамбург Ю. Д., Химическая термодинамика, 2016, с. 28.
- ↑ Кириллин В. А. и др., Техническая термодинамика, 2016, с. 467.
- ↑ Аминов Л. К., Термодинамика и статистическая физика, 2015, уравнение (3.6), с. 56.
- ↑ Морачевский А. Г., Фирсова Е. Г.
- ↑ Кокотов Ю. А., Химический потенциал, 2010, с. 14, 16.
- ↑ Lebon G. e. a., Understanding Non-equilibrium Thermodynamics, 2008, expression (1.22), p. 14.
- ↑ Тер Хаар Д., Вергеланд Г., Основы термодинамики, 2006, с. 171.
- ↑ Борисов И. М., Введение в химическую термодинамику, 2005, уравнение (1.103), с. 80.
- ↑ Еремин В. В. и др., Основы физической химии, 2005, уравнение (2.2), с. 29.
- ↑ Жариков В. А., Основы физической геохимии, 2005, уравнение (2.4), с. 31.
- ↑ 1 2
- ↑ Emanuel G., Advanced classical thermodynamics, 1987, expression (6.11), p. 119.
- ↑ Callen H. B., Thermodynamics and an Introduction to Thermostatistics, 1985, expression (2.9), p. 36.
- ↑ Путилов К. А., Термодинамика, 1971, с. 125.
- ↑ Зоммерфельд А., Термодинамика и статистическая физика, 1955, с. 147.
- ↑ Свиридов В. В., Свиридов А. В., Физическая химия, 2016, уравнения (4.47)—(4.50), с. 120—121.
- ↑ Тамм М. Е., Третьяков Ю. Д., Физико-химические основы неорганической химии, 2004, уравнения (1.3), с. 11.
- ↑ Пригожин И., Кондепуди Д., Современная термодинамика, 2002, подпись к рис. (2.4), с. 53.
- ↑ Зубарев Д. Н., Первое начало термодинамики, 1992, с. 555.
- ↑ Кубо Р., Термодинамика, 1970, с. 16.
- ↑ Базаров И. П., Термодинамика, 2010, с. 29.
- ↑ Кокотов Ю. А., Химический потенциал, 2010, с. 16.
- ↑ Callen H. B., Thermodynamics and an Introduction to Thermostatistics, 1985, expression (2.8), p. 36.
- ↑ 1 2 Залевски К., Феноменологическая и статистическая термодинамика, 1973, с. 54.
- ↑ Гуггенгейм, 1941, с. 122—123.
- ↑ Callen H. B., Thermodynamics and an Introduction to Thermostatistics, 1985, p. 35.
- ↑ Guggenheim, 1985, p. 300.
- ↑ Русанов, 2013, с. 19.
- ↑ Салем, 2004, с. 245.
- ↑ Зимон А. Д., Коллоидная химия, 2015, с. 147.
- ↑ Гуггенгейм, 1941, с. 141.
- ↑ Русанов, 2013, с. 21.
- ↑ Заславский, 1986, с. 189.
- ↑ Мейз, 1974, с. 87.
- ↑ Русанов, 2013, с. 25.
- Аминов Л. К. Термодинамика и статистическая физика. Конспекты лекций и задачи. — Казань: Казан. ун-т, 2015. — 180 с.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3. (недоступная ссылка)
- Химический потенциал // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Большая физическая энциклопедия в 5-ти томах. Гл. ред. А. М. Прохоров. Москва «Советская энциклопедия» 1988 г.
- Борисов И. М. Введение в химическую термодинамику. Классическая термодинамика. — Уфа: РИО БашГУ, 2005. — 208 с. — ISBN 5-7477-1212-8. (недоступная ссылка)
- Борщевский А. Я. Физическая химия. Том 1 online. Общая и химическая термодинамика. — М.: Инфра-М, 2017. — 868 с. — (Высшее образование: Бакалавриат). — ISBN 978-5-16-104227-4. (недоступная ссылка)
- Воронин Г. Ф. Основы термодинамики. — М.: Изд-во Моск. ун-та, 1987. — 192 с. (недоступная ссылка)
- Гамбург Ю. Д. Химическая термодинамика. — М.: Лаборатория знаний, 2016. — 237 с. — (Учебник для высшей школы). — ISBN 978-5-906828-74-3. (недоступная ссылка)
- Гуггенгейм. Современная термодинамика, изложенная по методу У. Гиббса / Пер. под ред. проф. С. А. Щукарева. — Л.—М.: Госхимиздат, 1941. — 188 с.
- Еремин В. В., Каргов С. И., Успенская И. А. и др. Основы физической химии. Теория и задачи. — М.: Экзамен, 2005. — 481 с. — (Классический университетский учебник). — ISBN 5-472-00834-4.
- Жариков В. А. Основы физической геохимии. — М.: Наука; Изд-во МГУ, 2005. — 656 с. — (Классический университетский учебник). — ISBN 5-211-04849-0, 5-02-035302-7.
- Залевски К. Феноменологическая и статистическая термодинамика: Краткий курс лекций / Пер. с польск. под. ред. Л. А. Серафимова. — М.: Мир, 1973. — 168 с. (недоступная ссылка)
- Заславский Б. В. Краткий курс сопротивления материалов. — М.: Машиностроение, 1986. — 328 с.
- Зимон А. Д. Коллоидная химия: Общий курс. — 6-е изд. — М.: Красанд, 2015. — 342 с. — ISBN 978-5-396-00641-6.
- Зоммерфельд А. Термодинамика и статистическая физика / Пер. с нем. — М.: ИЛ, 1955. — 480 с. Архивная копия от 25 сентября 2017 на Wayback Machine
- Зубарев Д. Н. Первое начало термодинамики (рус.) // Физическая энциклопедия. — Большая Российская энциклопедия, 1992. — Т. 3: Магнитоплазменный — Пойнтинга теорема. — С. 555.
- Кириллин В. А., Сычев В. В., Шейндлин А. Е. Техническая термодинамика. — М.: Изд. дом МЭИ, 2016. — 496 с. — ISBN 978-5-383-01024-2. (недоступная ссылка)
- Кокотов Ю. А. Химический потенциал. — СПб.: Нестор-История, 2010. — 412 с. — ISBN 978-5-98187-668-4. (недоступная ссылка)
- Кубо Р. Термодинамика. — М.: Мир, 1970. — 304 с. (недоступная ссылка)
- Мейз Дж. Теория и задачи механики сплошных сред. — М.: Мир, 1974. — 319 с.
- Морачевский А. Г., Фирсова Е. Г. Физическая химия. Термодинамика химических реакций. — 2-е изд., испр. — СПб.: Лань, 2015. — 101 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1858-9. (недоступная ссылка)
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур / Пер. с англ. — М.: Мир, 2002. — 461 с. — (Лучший зарубежный учебник). — ISBN 5-03-003538-9. Архивная копия от 23 сентября 2017 на Wayback Machine
- Путилов К. А. Термодинамика / Отв. ред. М. Х. Карапетьянц. — М.: Наука, 1971. — 376 с. (недоступная ссылка)
- Румер Ю. Б., Рывкин М. Ш. Термодинамика, статистическая физика и кинетика. М., Наука, 1977. 552 с.
- Русанов А. И. Лекции по термодинамике поверхностей. — СПб.—М.—Краснодар: Лань, 2013. — 237 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1487-1.
- Салем Р. Р. Физическая химия. Термодинамика. — М.: Физматлит, 2004. — 351 с. — ISBN 5-9221-0078-5.
- Свиридов В. В., Свиридов А. В. Физическая химия. — СПб.: Лань, 2016. — 597 с. — ISBN 978-5-8114-2262-3. (недоступная ссылка)
- Тамм М. Е., Третьяков Ю. Д. Неорганическая химия. Том 1. Физико-химические основы неорганической химии / Под. ред. акад. Ю. Д. Третьякова. — М.: Академия, 2004. — 240 с. — (Высшее профессиональное образование). — ISBN 5-7695-1446-9.
- Тер Хаар Д., Вергеланд Г. Основы термодинамики / Пер. с англ.. — М.: Вузовская книга, 2006. — 200 с. — ISBN 5-9502-0197-3.
- Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Стробоскопические приборы — Яркость. — 760 с. — ISBN 5-85270-101-7.
- Каллен Г.[en]. Thermodynamics and an Introduction to Thermostatistics. — 2nd ed. — N. Y. e. a.: John Wiley, 1985. — xvi + 493 p. — ISBN 0471862568, 9780471862567. (недоступная ссылка)
- Cook G., Dickerson R. H.Understanding the chemical potential // American Journal of Physics.— 1995.—63.— pp. 737—742
- Guggenheim E. A. Thermodynamics: An Advanced Treatment for Chemists and Physicists. — Amsterdam: North-Holland, 1985. — xxiv + 390 с. — ISBN 0 444 86951 4.
- Kaplan T. A.The Chemical Potential // Journal of Statistical Physics .—2006.—122.— pp. 1237—1260
Стандартный электродный потенциал — Википедия
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Вычисление стандартных электродных потенциалов[править | править код]
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал принят равным 0,00 В, и любой электрод, для которого электродный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0,036 В
Fe2+ + 2e− → Fe(тв) −0,44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0,77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.[источник не указан 399 дней]
Таблица стандартных электродных потенциалов[править | править код]
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGo должна быть отрицательной в соответствии со следующим уравнением:
- ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
- если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
- если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Стандартные электродные потенциалы даны при стандартных условиях. Однако реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
E=E0+RTnFlnaOxaRed{\displaystyle E=E^{0}+{\frac {RT}{nF}}\ln {\frac {a_{\rm {Ox}}}{a_{\rm {Red}}}}}
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
Электродный потенциал — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 мая 2017; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 мая 2017; проверки требуют 3 правки. У этого термина существуют и другие значения, см. Потенциал.Электро́дный потенциа́л — ЭДС элемента, составленного из данного электрода и стандартного водородного электрода, электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ЭДС, что не вполне правильно (хотя эти величины взаимосвязаны)..
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Способы устранения омической составляющей при измерении[править | править код]
 Трёхэлектродная схема
Трёхэлектродная схема- Компенсационная схема
- Трёхэлектродная схема
Потенциал покоя — Википедия
Потенциа́л поко́я — мембранный потенциал возбудимой клетки (нейрона, кардиомиоцита) в невозбужденном состоянии. Он представляет собой разность электрических потенциалов, имеющихся на внутренней и наружной сторонах мембраны и составляет у теплокровных от −55 до −100 мВ[1]. У нейронов и нервных волокон обычно составляет −70 мВ.
Возникает вследствие диффузии положительно заряженных ионов калия в окружающую среду из цитоплазмы клетки в процессе установления осмотического равновесия. Анионы органических кислот, нейтрализующие заряд ионов калия в цитоплазме, не могут выйти из клетки, однако ионы калия, концентрация которых в цитоплазме велика по сравнению с окружающей средой, диффундируют из цитоплазмы до тех пор, пока создаваемый ими электрический заряд не начнёт уравновешивать их градиент концентрации на клеточной мембране.
В 1902 году Юлиус Бернштейн выдвинул гипотезу, согласно которой клеточная мембрана пропускает внутрь клетки ионы К+, и они накапливаются в цитоплазме. Расчет величины потенциала покоя по уравнению Нернста для калиевого электрода удовлетворительно совпал с измеренным потенциалом между саркоплазмой мышцы и окружающей средой, который составлял около — 70 мВ.
Согласно теории Ю. Бернштейна, при возбуждении клетки её мембрана повреждается, и ионы К+ вытекают из клетки по концентрационному градиенту до тех пор, пока потенциал мембраны не становится равным нулю. Затем мембрана восстанавливает свою целостность, и потенциал возвращается к уровню потенциала покоя. Это утверждение, относящееся скорее к потенциалу действия, было опровергнуто Ходжкином и Хаксли в 1939 году.
Теорию Бернштейна касательно потенциала покоя подтвердил Кеннет Стюарт Коул (Kenneth Stewart Cole), иногда его инициалы ошибочно пишут как K.C. Cole, из-за его прозвища, Кейси («Kacy»). ПП и ПД изображены на известной иллюстрации Коула и Curtis, 1939. Этот рисунок стал эмблемой Membrane Biophysics Group of the Biophysical Society.
Для того, чтобы на мембране поддерживалась разность потенциалов, необходимо, чтобы была определенная разность концентрации различных ионов внутри и снаружи клетки.
| Ионы | Концентрация в саркоплазме (ммоль/л) | Концентрация вне клетки (ммоль/л) |
|---|---|---|
| K+ | 140 | 2,5 |
| Na+ | 10 | 120 |
| Cl— | 3-4 | 120 |
| Ca2+ | <0,001 | 2 |
| A— (полипептиды) | 140 | 0 |
С помощью уравнения Нернста можно рассчитать равновесный трансмембранный потенциал для K+, который и определяет значение ПП. Но значение потенциала покоя полностью не совпадает с EK+, так как в создании его участвуют также ионы натрия и хлора, вернее, их равновесные потенциалы.
Впоследствии было доказано, что основной вклад в создание потенциала покоя вносит выходящий калиевый ток, который осуществляется через специфические белки-каналы — калиевые каналы постоянного тока. В покое калиевые каналы открыты, а натриевые каналы закрыты. Ионы калия выходят из клетки по градиенту концентрации, что создает на наружной стороне мембраны избыток положительных зарядов; при этом на внутренней стороне мембраны остаются отрицательные заряды. Некоторый (небольшой) вклад в создание потенциала покоя вносит также работа так называемого «натрий-калиевого насоса», который образован особым мембранным ферментом — натрий-калиевой АТФазой.
Потенциал покоя для большинства нейронов составляет величину порядка −60 мВ — −70 мВ. У клеток невозбудимых тканей на мембране также имеется разность потенциалов, разная для клеток разных тканей и организмов.
ПП формируется в два этапа.
Первый этап: создание незначительной (-10 мВ) отрицательности внутри клетки за счёт обмена Na+ на K+ в соотношении 3 : 2 (на каждые 3 иона натрия, выведенные наружу, приходится 2 иона калия, вобранные внутрь). Таким образом, клетка теряет больше положительного заряда, чем приобретает, и в результате заряжается отрицательно. Обмен ионов осуществляет натрий-калиевый насос с затратой энергии АТФ. До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов.
Результаты деятельности мембранных ионных насосов-обменников на первом этапе формирования ПП таковы:
1. Дефицит ионов натрия (Na+) в клетке.
2. Избыток ионов калия (K+) в клетке.
3. Появление на мембране слабого электрического потенциала (-10 мВ).
Второй этап: создание значительной (-60 мВ) отрицательности внутри клетки за счёт утечки из неё через мембрану ионов K+. Ионы калия K+ покидают клетку и уносят с собой из неё положительные заряды, доводя отрицательность до −70 мВ.
Итак, мембранный потенциал покоя — это дефицит положительных зарядов внутри клетки, возникающий за счёт работы натрий-калиевого насоса и (в большей мере) последующей утечки из клетки положительных ионов калия.
- Дудель Й., Рюэгг Й., Шмидт Р. и др. Физиология человека: в 3-х томах. Пер. с англ / под ред Р. Шмидта и Г. Тевса. — 3. — М.: Мир, 2007. — Т. 1. — 323 с илл. с. — 1500 экз. — ISBN 5-03-000575-3.
Потенциал действия — Википедия
 Распространение потенциала действия по аксону
Распространение потенциала действия по аксонуПотенциа́л де́йствия — волна возбуждения, перемещающаяся по мембране живой клетки в виде кратковременного изменения мембранного потенциала на небольшом участке возбудимой клетки (нейрона или кардиомиоцита), в результате которого наружная поверхность этого участка становится отрицательно заряженной по отношению к внутренней поверхности мембраны, в то время, как в покое она заряжена положительно. Потенциал действия является физиологической основой нервного импульса.
Благодаря работе «натрий-калиевого насоса» концентрация ионов натрия в цитоплазме клетки очень мала по сравнению с окружающей средой. При проведении потенциала действия открываются потенциал-зависимые натриевые каналы и положительно заряженные ионы натрия поступают в цитоплазму по градиенту концентрации, пока он не будет уравновешен положительным электрическим зарядом. Вслед за этим потенциал-зависимые каналы инактивируются и отрицательный потенциал покоя восстанавливается за счёт диффузии из клетки положительно заряженных ионов калия, концентрация которых в окружающей среде также значительно ниже внутриклеточной.
- Предспайк — процесс медленной деполяризации мембраны до критического уровня деполяризации (местное возбуждение, локальный ответ).
- Пиковый потенциал, или спайк, состоящий из восходящей части (деполяризация мембраны) и нисходящей части (реполяризация мембраны).
- Отрицательный следовой потенциал — от критического уровня деполяризации до исходного уровня поляризации мембраны (следовая деполяризация).
- Положительный следовой потенциал — увеличение мембранного потенциала и постепенное возвращение его к исходной величине (следовая гиперполяризация).
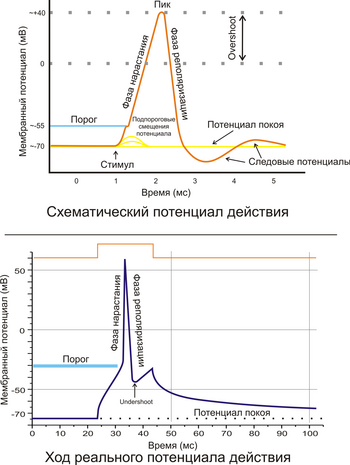 Рис. 2. A. Схематичное изображение идеализированного потенциала действия. B. Реальный потенциал действия пирамидного нейрона гиппокампа крысы. Форма реального потенциала действия обычно отличается от идеализированной.
Рис. 2. A. Схематичное изображение идеализированного потенциала действия. B. Реальный потенциал действия пирамидного нейрона гиппокампа крысы. Форма реального потенциала действия обычно отличается от идеализированной.Поляризация мембраны живой клетки обусловлена отличием ионного состава с её внутренней и наружной стороны. Когда клетка находится в спокойном (невозбуждённом) состоянии, ионы по разные стороны мембраны создают относительно стабильную разность потенциалов, называемую потенциалом покоя. Если ввести внутрь живой клетки электрод и измерить мембранный потенциал покоя, он будет иметь отрицательное значение (около −70 — −90 мВ). Это объясняется тем, что суммарный заряд на внутренней стороне мембраны существенно меньше, чем на внешней, хотя с обеих сторон содержатся и катионы, и анионы. Снаружи — на порядок больше ионов натрия, кальция и хлора, внутри — ионов калия и отрицательно заряженных белковых молекул, аминокислот, органических кислот, фосфатов, сульфатов. Надо понимать, что речь идёт именно о заряде поверхности мембраны — в целом среда и внутри, и снаружи клетки заряжена нейтрально.
Потенциал мембраны может изменяться под действием различных стимулов. Искусственным стимулом может служить электрический ток, подаваемый на внешнюю или внутреннюю сторону мембраны через электрод. В естественных условиях стимулом часто служит химический сигнал от соседних клеток, поступающий через синапс или путём диффузной передачи через межклеточную среду. Смещение мембранного потенциала может происходить в отрицательную (гиперполяризация) или положительную (деполяризация) сторону.
В нервной ткани потенциал действия, как правило, возникает при деполяризации — если деполяризация мембраны нейрона достигает некоторого порогового уровня или превышает его, клетка возбуждается, и от её тела к аксонам и дендритам распространяется волна электрического сигнала. (В реальных условиях на теле нейрона обычно возникают постсинаптические потенциалы, которые сильно отличаются от потенциала действия по своей природе — например, они не подчиняются принципу «всё или ничего». Эти потенциалы преобразуются в потенциал действия на особом немиелинезированном участке аксона — его начальном сегменте, и затем обратно распространяется на сому нейрона и дендриты.
Рис. 3. Простейшая схема, демонстрирующая мембрану с двумя натриевыми каналами в открытом и закрытом состоянииЭто обусловлено тем, что на мембране клетки находятся ионные каналы — белковые молекулы, образующие в мембране поры, через которые ионы могут проходить с внутренней стороны мембраны на наружную и наоборот. Большинство каналов ионо-специфичны — натриевый канал пропускает практически только ионы натрия и не пропускает другие (это явление называют селективностью). Мембрана клеток возбудимых тканей (нервной и мышечной) содержит большое количество потенциал-зависимых ионных каналов, способных быстро реагировать на смещение мембранного потенциала. Деполяризация мембраны в первую очередь вызывает открытие потенциал-зависимых натриевых каналов. Когда одновременно открывается достаточно много натриевых каналов, положительно заряженные ионы натрия устремляются через них на внутреннюю сторону мембраны. Движущая сила в данном случае обеспечивается градиентом концентрации (с внешней стороны мембраны находится намного больше положительно заряженных ионов натрия, чем внутри клетки) и отрицательным зарядом внутренней стороны мембраны (см. Рис. 2). Поток ионов натрия вызывает ещё бо́льшее и очень быстрое изменение мембранного потенциала, которое и называют потенциалом действия (в специальной литературе обозначается ПД).
Согласно закону «всё-или-ничего» мембрана клетки возбудимой ткани либо не отвечает на стимул совсем, либо отвечает с максимально возможной для неё на данный момент силой. То есть, если стимул слишком слаб и порог не достигнут, потенциал действия не возникает совсем; в то же время, пороговый стимул вызовет потенциал действия такой же амплитуды, как и стимул, превышающий пороговый. Это отнюдь не означает, что амплитуда потенциала действия всегда одинакова — один и тот же участок мембраны, находясь в разных состояниях, может генерировать потенциалы действия разной амплитуды.
После возбуждения нейрон на некоторое время оказывается в состоянии абсолютной рефрактерности, когда никакие сигналы не могут его возбудить снова, затем входит в фазу относительной рефрактерности, когда его могут возбудить исключительно сильные сигналы (при этом амплитуда ПД будет ниже, чем обычно). Рефрактерный период возникает из-за инактивации быстрого натриевого тока, то есть инактивации натриевых каналов (см. ниже).
Распространение потенциала действия[править | править код]
По немиелинизированным волокнам[править | править код]
По немиелинизированному волокну потенциал действия распространяется непрерывно. Проведение нервного импульса начинается с распространением электрического поля. Возникший потенциал действия за счет электрического поля способен деполяризовать мембрану соседнего участка до критического уровня, в результате чего на соседнем участке генерируются новые потенциалы. Сам потенциал действия не перемещается, он исчезает там же, где возник. Главную роль в возникновении нового потенциал действия играет предыдущий.
Если внутриклеточным электродом раздражать аксон посередине, то потенциал действия будет распространяться в обоих направлениях. Обычно же потенциал действия распространяется по аксону в одном направлении (от тела нейрона к нервным окончаниям), хотя деполяризация мембраны происходит по обе стороны от участка, где в данный момент возник потенциал. Одностороннее проведение потенциала действия обеспечивается свойствами натриевых каналов — после открытия они на некоторое время инактивируются и не могут открыться ни при каких значениях мембранного потенциала (свойство рефрактерности). Поэтому на ближнем к телу клетки участке, где до этого уже «прошел» потенциал действия, он не возникает.
При прочих равных условиях распространение потенциала действия по аксону происходит тем быстрее, чем больше диаметр волокна. По гигантским аксонам кальмара потенциал действия может распространяться почти с такой же скоростью, как и по миелинизированным волокнам позвоночных (около 100 м/c).
По миелинизированным волокнам[править | править код]
По миелинизированному волокну потенциал действия распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах безмиелиновых волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. Потенциал действия, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до критического уровня, что приводит к возникновению в них новых потенциалов действия, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье потенциал действия возбуждает 2-й, 3-й, 4-й и даже 5-й, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля.
«Скачкообразное распространение» увеличивает скорость распространения потенциала действия по миелинизированным волокнам по сравнению с немиелинизированными. Кроме того, миелинизированные волокна толще, а электрическое сопротивление более толстых волокон меньше, что тоже увеличивает скорость проведения импульса по миелинизированным волокнам. Другим преимуществом сальтаторного проведения является его экономичность в энергетическом плане, так как возбуждаются только перехваты Ранвье, площадь которых меньше 1 % мембраны, и, следовательно, необходимо значительно меньше энергии для восстановления трансмембранных градиентов Na+ и K+, расходующихся в результате возникновения потенциал действия, что может иметь значение при высокой частоте разрядов, идущих по нервному волокну.
Чтобы представить, насколько эффективно может быть увеличена скорость проведения за счёт миелиновой оболочки, достаточно сравнить скорость распространения импульса по немиелинизированным и миелинизированным участкам нервной системы человека. При диаметре волокна около 2 µм и отсутствии миелиновой оболочки скорость проведения будет составлять ~1 м/с, а при наличии даже слабой миелинизации при том же диаметре волокна — 15—20 м/с. В волокнах большего диаметра, обладающих толстой миелинововой оболочкой, скорость проведения может достигать 120 м/с.
Скорость распространения потенциала действия по мембране отдельно взятого нервного волокна непостоянна — в зависимости от различных условий эта скорость может очень значительно уменьшаться и, соответственно, увеличиваться, возвращаясь к некоему исходному уровню.
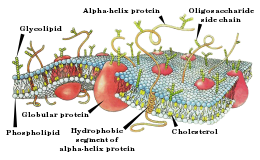 Схема строения мембраны клетки.
Схема строения мембраны клетки.Активные свойства мембраны, обеспечивающие возникновение потенциала действия, основываются главным образом на поведении потенциалзависимых натриевых (Na+-) и калиевых (K+-) каналов. Начальная фаза ПД формируется входящим натриевым током, позже открываются калиевые каналы и выходящий K+-ток возвращает потенциал мембраны к исходному уровню. Исходную концентрацию ионов затем восстанавливает натрий-калиевый насос.
По ходу ПД каналы переходят из состояния в состояние: у Na+-каналов основных состояний три — закрытое, открытое и инактивированное (в реальности дело сложнее, но этих трёх достаточно для описания), у K+-каналов два — закрытое и открытое.
Поведение каналов, участвующих в формировании ПД, описывается через проводимость и вычисляется через коэффициенты переноса (трансфера).
Коэффициенты переноса были выведены Ходжкином и Хаксли.[1][2]
- Проводимость для калия GK на единицу площади [S/cm²]
- Проводимость для натрия GNa на единицу площади [S/cm²]
рассчитывается сложнее, поскольку, как уже было сказано, у потенциал-зависимых Na+-каналов, помимо закрытого/открытого состояний, переход между которыми описывается параметром m{\displaystyle m}, есть ещё инактивированное/не-инактивированное состояния, переход между которыми описывается через параметр h{\displaystyle h}



