Эквивалент вещества — Википедия
Материал из Википедии — свободной энциклопедии
Эквивале́нт вещества́ или просто эквивале́нт — реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-осно́вных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции NaOH+HCl=NaCl+h3O{\displaystyle {\ce {NaOH + HCl = NaCl + h3O}}} эквивалентом будет реальная частица — ион Na+{\displaystyle {\ce {Na^+}}}, а в реакции Zn(OH)2+2HCl=ZnCl2+2h3O{\displaystyle {\ce {Zn(OH)2 + 2HCl = ZnCl2 + 2h3O}}} эквивалентом будет мнимая частица 12Zn(OH)2{\displaystyle {\ce {{\frac {1}{2}}Zn(OH)2}}}.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число молей вещества, эквивалентное одному молю катионов водорода в рассматриваемой реакции.
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества[править | править код]
Молярная масса эквивалентов обычно обозначается как μeq{\displaystyle \mu _{eq}} или Meq.{\displaystyle M_{eq}.}
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества:
- Meq=feqM.{\displaystyle M_{eq}=f_{eq}M.}
Фактор эквивалентности[править | править код]
Отношение эквивалентной молярной массы к собственной молярной массе вещества называется фактором эквивалентности (обозначается обычно как feq{\displaystyle f_{eq}}).
Число эквивалентности[править | править код]
Число эквивалентности Z{\displaystyle Z} представляет собой небольшое положительное целое число, равное числу эквивалентов (молей) некоторого вещества, содержащихся в 1 моле этого вещества. Фактор эквивалентности feq{\displaystyle f_{eq}} связан с числом эквивалентности следующим соотношением: feq=1Z.{\displaystyle f_{eq}={\frac {1}{Z}}.}
Например, в реакции
- Zn(OH)2+2HCl=ZnCl2+2h3O{\displaystyle {\ce {Zn(OH)2 + 2HCl = ZnCl2 + 2h3O}}}
эквивалентом является мнимая частица 12Zn(OH)2{\displaystyle {\ce {{\frac {1}{2}}Zn(OH)2}}}. Число 12{\displaystyle {\frac {1}{2}}} есть фактор эквивалентности, Z{\displaystyle Z} в данном случае равно 2.
Z=X⋅Y{\displaystyle {Z}={X}\cdot {Y}}
| вещество | реакция | |||
|---|---|---|---|---|
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |
| X{\displaystyle {X}} | число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |
| Y{\displaystyle {Y}} | характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
*Для инертных газов Z=1.{\displaystyle Z=1.}
Фактор эквивалентности помогает сформулировать закон эквивалентности.
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
Эквивалент – это реальная или условная
частица, которая в кислотно-основных реакциях присоединяет
(или отдает) один ион Н
H3PO4 + 2KOH ® K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
|
f |
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH ® K3PO4 + 3H2O fЭ(H3PO4) = 1/3
H3PO4 + KOH ® KН2PO4 + H2O fЭ(H3PO4) = 1.
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
|
Частица |
Фактор эквивалентности |
Примеры |
|
Элемент |
, где |
|
|
Простое вещество |
, где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента |
fЭ(H2) = 1/(2×1) = 1/2; fЭ(O2) = 1/(2×2) = 1/4; fЭ(O3) = 1/(3×2) = 1/6 |
|
Оксид |
, где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента |
fЭ(Cr2O3) = 1/(2×3) = 1/6; fЭ(H2O) = 1/(2×1) = 1/2; fЭ(P2O5) = 1/(2×5) = 1/10 |
|
Кислота |
, где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты) |
fЭ(H2SO4) = 1/1 = 1 (основность равна 1) или fЭ(H2SO4) = 1/2 (основность равна 2) |
|
Основание |
, где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) |
fЭ(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или fЭ(Cu(OH)2) = 1/2 (кислотность равна 2) |
|
Соль |
, где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка |
fЭ(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку)
|
|
Частица в окислительно-восстановительных реакциях |
, где – число электронов, участвующих в процессе окисления или восстановления |
Fe2+ + 2® Fe0 fЭ(Fe2+) =1/2;
MnO4– + 8H+ + 5 ® ® Mn2+ + 4H2O fЭ(MnO4–) = 1/5 |
|
Ион |
, где z – заряд иона |
fЭ(SO42–) = 1/2 |
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl2 (средняя соль):
.
fЭ(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2.
б) КНСО3 (кислая соль):
.
fЭ(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4 (основная соль):
.
fЭ( (MgOH)2SO4 ) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
|
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8 МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка) МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17 МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка). |
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента ( или VЭ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль». При н.у. получаем:
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
|
nэ(реагента1) = … = nэ(реагентаn) = nэ(продукта1) = … = nэ(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
где m1 и m2 – массы реагентов и (или) продуктов реакции, г;
, – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль;
V1, V2 – объемы реагентов и (или) продуктов реакции, л;
,– молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.
Л.А. Яковишин
Химический эквивалент. Расчетные задачи
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТ
(ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
В.К.Камышова, И.Л.Волчкова
Методическое пособие для студентов 1-го курса всех направлений
Москва Издательство МЭИ 2010
ВВЕДЕНИЕ
К началу XIX века произошел резкий прорыв в изучении количественных методов исследования веществ, что привело к новому фундаментальному изменению в естествознании вообще и в химии в частности.
Резкий прорыв в изучении количественных методов исследования веществ в началу XIX века привел к новому фундаментальному изменению в естествознании вообще и в химии в частности.
После открытия Лавуазье закона сохранения массы последовал целый ряд новых количественных закономерностей – стехиометрических законов.
 Первым
стехиометрическим законом стал закон
эквивалентов, который сформулировал
немецкий химик Иеремия Вениамин Рихтер
в результате проведенных им в 1791-1798
г.г. опытов по изучению количеств веществ
в реакциях нейтрализации и обмена,
обобщенных в работе «Начальные основания
стехиометрии или искусства измерения
химических элементов». Первоначальная
формулировка закона эквивалентов
(термин «эквивалент» ввел в 1767 г.
Г.Кевендиш) была следующей: «Если одно
и то же количество какой либо кислоты
нейтрализуется различными количествами
двух оснований, то эти количества
эквивалентны и нейтрализуются одинаковым
количеством любой другой кислоты».
Первым
стехиометрическим законом стал закон
эквивалентов, который сформулировал
немецкий химик Иеремия Вениамин Рихтер
в результате проведенных им в 1791-1798
г.г. опытов по изучению количеств веществ
в реакциях нейтрализации и обмена,
обобщенных в работе «Начальные основания
стехиометрии или искусства измерения
химических элементов». Первоначальная
формулировка закона эквивалентов
(термин «эквивалент» ввел в 1767 г.
Г.Кевендиш) была следующей: «Если одно
и то же количество какой либо кислоты
нейтрализуется различными количествами
двух оснований, то эти количества
эквивалентны и нейтрализуются одинаковым
количеством любой другой кислоты».
Открытый В.Рихтером закон подтвердил убеждения многих химиков в том, что химические соединения взаимодействуют не в произвольных, а в строго определенных количественных соотношениях.
Теоретическая часть
Понятие «химический эквивалент»
Химическим эквивалентом (Э(В)) (по рекомендациям ИЮПАК) называется условная или реальная частица, равная или в целое число раз меньшая соответствующей ей формульной единице*:

где В – формульная единица вещества: реально существующая частица, такая как атом (Cu, Na, C), молекула (N2, HCl, KOH, Al2(SO4)3, CO2), анионы (OH—, SO42-), катионы (Cu 2+, K+), радикалы (-NО2, С2Н5-), условные молекулы кристаллических веществ и полимеров, любые другие частицы вещества;
 —
эквивалентное число, показывающее какое
число эквивалентов вещества В условно
содержится в данной формульной единице
этого вещества;
—
эквивалентное число, показывающее какое
число эквивалентов вещества В условно
содержится в данной формульной единице
этого вещества;
 = fэкв. — фактор эквивалентности.
= fэкв. — фактор эквивалентности.
Использование фактора эквивалентности как дробной величины менее удобно.
Эквивалентное число Z всегда больше или равно 1 и является безразмерной величиной; при Z=1 эквивалент соответствует формульной единице вещества.
Расчет эквивалентного числа различных формульных единиц представлен в таблице 1.1.
Величины эквивалентного числа, а, следовательно, и эквивалента зависят от химической реакции, в которой участвует данное вещество.
* ранее под химическим эквивалентом понимали количество вещества, которое присоединяет или замещает 1 моль атомов водорода в ходе реакции. Однако это понятие относится не к самому эквиваленту, а к количеству вещества эквивалента.
В обменных реакциях, например, в реакции нейтрализации фосфорной кислоты, эквивалентное число (эквивалент) кислоты меняется в зависимости от полноты протекания реакции:
для реакции H3PO4 + 3KOH → K3PO4 + 3H2O эквивалентное число Z(H3PO4)= =n(Н+)=3, т.к. в реакции участвуют три иона Н+ фосфорной кислоты, и эквивалентом H3PO4 будет являться условная частица 1/3H3PO4 (Э (H3PO4)= 1/3H3PO4).
Таблица 1.1. Расчет эквивалентного числа Z вещества.
частица | эквивалентное число Z | Пример |
Элемент | Z(Э) = В(Э), где В(Э) – валентность элемента | Z(S)h3SO4 = 6 Z(C)CO2 = 4 |
Простое вещество | Z(в-ва) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z(O2) = 2∙2=4 Z(Cl2) = 2∙1=2 |
Оксид | Z(Э2Ох) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z(Н2О) = 2∙1=2 Z(SО2) = 1∙4=4 Z(Al2О3) = 2∙3=6 |
Кислота | Z(к-ты) = n(Н+), где n(Н+) – число отданных в ходе реакции ионов Н+ (основность кислоты) | Z(Н2SО4) = 1 – основность равна 1 Z(Н2SО4) = 2 – основность равна 2 |
Основание | Z(осн-я) = n(ОН—), где n(ОН—) – число отданных в ходе реакции гидроксид ионов ОН— (кислотность основания) | Z(Са(ОН)2 = 1 – кислотность равна 1 Z(Са(ОН)2) =2 – кислотность равна 2 |
Соль | Z(соли) = n(Ме)∙В(Ме) = n(А)∙В(А), где n(Ме), В(Ме) – число атомов металла и его валентность n(А), В(А) – число кислотных остатков и их валентность | Z(Na2SО4) = 2∙1=1∙2=2 Z(Al2(CO3)3) = 2∙3=3∙2=6 |
Частица в ОВР | Z(частицы) = nе, где n е – число электронов, участвующих в процессе, на одну формульную единицу | SO42-+2H++ +2e→SO32-+H2O Z(SО42-)=2, Z(H+)=1 2Cl— — 2e→Cl2 Z(Cl—)=1, Z(Cl2)=2 |
ион | Z(иона) = n, где n– заряд иона | Z(SО42-) = 2 |
В реакции H3PO4 + KOH → KН2PO4 + H2O замещается только один ион водорода Н+ и поэтому Z(H3PO4)=1, а эквивалентом кислоты является частица H3PO4 (Э(H3PO4)= 1H3PO4).
Эквивалентное число (эквивалент) элемента также может меняться в зависимости от вида соединения, в состав которого он входит. Например, в оксиде Cr2O3 эквивалентное число хрома Z(Cr)=3 и, следовательно, эквивалентом хрома является условная частица 1/3Cr, а в хромовой кислоте Н2CrО3 эквивалентное число хрома Z(Cr)=6, а эквивалент Э(Cr)=1/6Cr.
В обменных реакциях эквивалентное число (эквивалент) определяется стехиометрией реакции. Например,
Cr2(SO4)3 + 12KOH → 2K3[Cr(OH)6] + 3K2SO4
на одну формульную единицу Cr2(SO4)3 затрачивается 12 формульных единиц КОН. Следовательно, эквивалентное число Z(Cr2(SO4)3)=12, а Z(КОН)=1. Эквивалентом Cr2(SO4)3 будет являться условная частица 1/12 Cr2(SO4)3, а Э(КОН)=1КОН.
Для установления значений эквивалентных чисел Z(В) по уравнениям реакций обмена достаточно найти наименьшее общее кратное всех стехиометрических коэффициентов в уравнении реакции и разделить их на него. В рассматриваемом выше уравнении наименьшее общее кратное равно 12:
1/12Cr2(SO4)3 + KOH → 1/6K3[Cr(OH)6] + 1/4K2SO4
Для данной реакции эквивалентные числа равны: Z(Cr2(SO4)3)=12, Z(КОН)=1, Z(K3[Cr(OH)6])=6, а Z(K2SO4)=4.
В окислительно-восстановительных реакциях эквивалентные числа окислителя и восстановителя определяются числом электронов, которое принимает одна формульная единица окислителя или отдает одна формульная единица восстановителя.
Для окислительно-восстановительной реакции
K
 2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O
2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O 6 1
2Cl— — 2e → Cl2 3
Эквивалентные числа определяют по числу электронов, участвующих в соответствующих полуреакциях, в расчете на одну формульную единицу Cr2O72-, Cr3+, Cl—, Cl2, то есть Z(Cr2O72-)=6, Z(Cr3+)=3, Z(Cl—)=1, Z(Cl2)=2. Соответственно эквивалентные числа веществ также будут равны: Z(К2Cr2O7)=6, Z(Cr Cl3)=3, Z(НCl)=1.
1.2. Расчеты эквивалентов
Эквивалент (Э) — это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода (Н+) в ионообменных реакциях или одному электрону (е—) в окислительно-восстановительных реакциях.
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
эквивалентом будет являться условная (мнимая) частица 1/2Zn(OH)2.
Так же, как в случае молекул, атомов или ионов, эквивалент описывают с помощью химических формул. Например, гидроксид калия во всех обменных реакциях может присоединять один ион водорода, следовательно, эквивалентом гидроксида калия будет молекула КОН. Э={КОН}. Эквивалентом соляной кислоты в ионообменных реакциях будет НСl. Э={НСl}. Цинк может окисляться только до Zn2+, следовательно, в окислительно-восстановительных реакциях эквивалентом цинка будет условная величина, половина его атома или иона, Э=1/2{Zn}. Для фосфорной кислоты Э=1/3{Н3РО4}. Это химическая формула эквивалента.
Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, получила название фактора эквивалентности, fЭ.
Так, в рассматриваемых случаях эквивалентом гидроксида калия будет молекула КОН и fЭ(КОН) = 1, fЭ(НСl) = 1, а эквивалентом иона Zn2+ будет половина иона Zn2+, fЭ(Zn) = 1/2.
Масса одного моля эквивалентов называется молярной массой эквивалентов вещества (эквивалентной массой) МЭ . Она рассчитывается, как произведение фактора эквивалентности на молярную массу вещества:
МЭ =fЭ∙М (г/моль) (1)
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей.
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента, VЭ, (или эквивалентный объем) — объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента.
Он измеряется в литрах и вычисляется (при н.у., Т0 = 273 К, Р0 = 760 мм рт. ст. или 101,3 кПа), как произведение фактора эквивалентности на молярный объем газа:
VЭ = fЭ∙Vм = fЭ∙22,4 (л) (2)
Физический смысл эквивалента заключается в том, что эквивалент характеризует реакционные возможности вещества: сколько именно ионов водорода или эквивалентных ему однозарядных частиц может использовать молекула (ион) вещества в ионообменных реакциях, или сколько именно электронов потребуется для превращения этой молекулы (иона) в окислительно-восстановительных реакциях (ОВР).
Максимальное содержание эквивалентов в молекуле вещества, как в ионообменных реакциях, так и в ОВР можно определить по формулам, рассматривая состав соединения.
Пример 1. В обменных реакциях при максимальном содержании эквивалентов в молекуле определить: а) фактор эквивалентности, fЭ; б) химическую формулу эквивалента, Э; в) молярную массу эквивалентов, МЭ, для следующих веществ из классов кислот, оснований и солей: Н3РО4, Са(ОН)2, Аl2(SО4)3
Решение: Для кислот, оснований и солей фактор эквивалентности в обменных реакциях при максимальном содержании эквивалентов в молекуле определяется по формуле: 1
fЭ = —— (3) n∙z
где n — число функциональных групп в молекуле,
z — абсолютная величина заряда функциональной группы.
Функциональными группами в кислотах являются ионы водорода, в основаниях — ионы гидроксила, в солях — ионы металла. Конечно, в кислых солях также ионы Н+, а в основных — ОН—, в зависимости от реакции. Таким образом:
для Н3РО4 а) fЭ = 1/3, б) Э = 1/3{Н3РО4},
в) МЭ = fЭ∙М(Н3РО4) = 1/3(3,0 + 31,0 + 4∙16,0) = 98,0/3 = 32,7 г/моль
для Са(ОН)2 а) fЭ = 1/2, б) Э = 1/2{Са(ОН)2},
в) МЭ = fЭ∙М(Са(ОН)2) = 1/2(40,1 + 2∙17,0) = 74,1/2 = 37,0 г/моль.
для Аl2(SО4)3 а) fЭ = 1/(2∙3) = 1/6, б) Э = 1/6{Аl2(SО4)3},
в) МЭ = fЭ∙М(Аl2(SО4)3) = 1/6(2∙27,0 + 3∙96,0) = 342/6 = 57,0 г/моль
Оксиды делятся на солеобразующие (кислотные, амфотерные, основные) и несолеобразующие. Для несолеобразующих (безразличных) оксидов СО, N2О, NО характерны окислительно-восстановительные реакции, (ОВР). В ОВР эквивалент всегда рассчитывается по изменению степени окисления.
Для солеобразующих оксидов в реакциях не ОВР фактор эквивалентности определяется по формуле (3) для кислот (оснований), ангидридом которых является данный оксид.
Пример 2. Определить в реакциях присоединения/разложения, не являющихся ОВР, а) фактор эквивалентности, fЭ; б) химическую формулу эквивалента, Э; в) молярную массу эквивалентов, МЭ, а для газов и г)объем моля эквивалентов, VЭ, при максимальном содержании эквивалентов в молекуле для следующих веществ из класса оксидов. СО2 — газ, СаО, Р2О5.
Решение: СО2 — кислотный оксид, является ангидридом двухосновной угольной кислоты Н2СО3, в соответствии с чем его фактор эквивалентности составляет 1/2.
а) fЭ = 1/2; б) Э = 1/2{СО2}, в) МЭ = fЭ∙МСО2 = 1/2 (12,0 + 2∙16,0) = 44,0/2 = 22,0 г/моль. Так как СО2 — газ, определяем еще объем моля эквивалентов (эквивалентный объем): г) VЭ = fЭ∙22,4 = 11,2 л.
СаО — основной оксид, являющийся ангидридом двухкис-лотного основания Са(ОН)2, в соответствии с чем его фактор эквивалентности составляет 1/2.
а) fЭ = 1/2, б) Э = 1/2{СаО}, в) МЭ = fЭ∙МСаО = 1/2(40,1 + 16,0) = 56,1/2 = 28,0 г/моль.
Р2О5 — кислотный оксид, дающий при взаимодействии с водой две молекулы трехосновной фосфорной кислоты Н3РО4. по реакции:
Р2О5 + 3Н2О = 2Н3РО4
Следовательно, одна молекула Р2О5эквивалентна 6 ионам водорода, в соответствии с чем, его фактор эквивалентности находится из формулы fЭ = 1/(2∙3) и составляет 1/6.
а) fЭ = 1/6, б) Э = 1/6{Р2О5},
в) МЭ = fЭ∙МР2О5 = 1/6(2∙31,0 + 5∙16,0) = 142/6 = 23,67 г/моль
Если дана конкретная реакция, то состав эквивалента следует определять из сопоставления начальных и конечных продуктов реакции.
В первую очередь следует определить, с каким типом реакции мы имеем дело: с окислительно-восстановительной реакцией (ОВР) или с не-ОВР. К последним относятся реакции, в которых не меняются степени окисления элементов, например, ионнообменные реакции и часть реакций разложения. Из определения эквивалента следует, что в зависимости от типа реакции, по разному определяется состав эквивалента вещества. В ионообменных реакциях (не-ОВР) надо рассматривать, сколько ионов водорода или эквивалентных ему частиц (Nа+, К+, ОН—, Сl— и т.д.) взаимодействует с рассматриваемым веществом. Напоминаем, что окислительно-восстановительными реакциями (ОВР), являются такие, в которых изменяются степени окисления (С.О.) элементов.
В ОВР для того, чтобы определить фактор эквивалентности и правильно записать химическую формулу эквивалента, надо определить С.О. окисляющегося или восстанавливающегося элемента в данном веществе до и после реакции и определить число электронов, перемещаемых в оболочке этого элемента. Согласно определению, эквивалент составит такую часть молекулы, которая приходится на 1 электрон. Никакого учета коэффициентов в реакциях при этом не требуется.
Пример 3. Определить: фактор эквивалентности, fЭ, химическую формулу эквивалента, Э, молярную массу эквивалентов, МЭ, и (для газов) молярный объем эквивалентов, VЭ, реагирующих веществ в следующих реакциях:
1. Аl(ОН)3 + 2НСl = АlОНСl2 + 2Н2О
2. 2Н2S(Г) + 3О2(Г) = 2SО2 + 2Н2О
Решение. Реакция 1 является ионообменной В ней Аl(ОН)3 превращается в АlОНСl2, т.е. в молекуле гидроксида алюминия замещаются два иона ОН—, каждый из которых эквивалентен одному иону водорода, на ионы Сl—. Следовательно, ее эквивалент в данной конкретной реакции составляет 1/2 молекулы Аl(ОН)3. fЭ=1/2; Э= 1/2{Аl(ОН)3}; МЭ = fЭ∙МАl(ОН)3 = 1/2(27,0 + 3∙17,0) = 39 г/моль.
Молекула НСl в любой ионообменной реакции может отдавать только 1 ион водорода Н+, следовательно, содержит 1 эквивалент. fЭ=1, Э = {НСl}. МЭ = fЭ∙МНСl = 1∙(1,0 + 35,5) = 36,5 г/моль.
Реакция 2 окислительно-восстановительная. В ней сера меняет свою С.О. от -2 (в Н2S) до +4 (в SО2). Перемещаются 6 электронов. Следовательно, в данной конкретной реакции молекула сероводорода содержит 6 эквивалентов. fЭ = 1/6, Э = 1/6{Н2S} МЭ = fЭ∙МН2S = 1/6(2,0 + 32,1) = 5,7 г/моль. Сероводород — газ. VЭ = fЭ∙22,4 = 3,73 л.
Кислород в реакции 2 меняет свою С.О. от 0 до -2. При этом у каждого атома кислорода перемещаются 2 электрона. В молекуле кислорода О2 неразрывно связаны 2 атома. Следовательно, молекула кислорода содержит 4 эквивалента. fЭ = 1/4, Э = ¼{О2} МЭ = fЭ∙МО2 = 1/4(2∙16) = 8 г/моль. Кислород — газ. VЭ = fЭ∙22,4 = 5,6 л.
Итак, обобщая вышеизложенный материал, расчет фактора эквивалентности для некоторых классов химических соединений можно представить в виде таблицы 1.
Таблица 1 — Расчет фактора эквивалентности
Частица | Фактор эквивалентности | Примеры |
Простое вещество |
где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента | fЭ(H2) = 1/(2×1) = 1/2; fЭ(O2) = 1/(2×2) = 1/4; fЭ(Cl2)= 1/(2×1) = 1/2; fЭ(O3) = 1/(3×2) = 1/6 |
Оксид |
где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента | fЭ(Cr2O3)=1/(2×3)= 1/6; fЭ(CrO) = 1/(1×2) = 1/2; fЭ(H2O) = 1/(2×1) = 1/2; fЭ(P2O5)=1/(2×5) = 1/10 |
Кислота |
где n(H+) – число ионов водорода (основность кислоты) | fЭ(HCl) = 1/1 = 1 fЭ(H2SO4) = 1/2 fЭ(H3PO4) = 1/3 |
Основание |
где n(ОH–) – число гидроксид-ионов (кислотность основания) | fЭ (KOH) = 1 fЭ (Cu(OH)2) = 1/2 |
Соль |
где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка | fЭ(Cr2(SO4)3) = 1/(2 × 3) = 1/6(расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3 × 2) = 1/6(расчет по кислотному остатку) fЭ (ZnCl2) = 1/(1×2 ) =1/2 (расчет по металлу) fЭ (NaCl) = 1/(1 × 1 ) =1/2 (расчет по металлу) |
Частица в окислительно-восстановительных реакциях |
где | Fe2+ + 2 fЭ(Fe2+) =1/2; MnO4–+8H++ 5 =Mn2+ + 4H2O fЭ(MnO4–) = 1/5 |
Ион |
| fЭ(SO42–) = 1/2 |
Как определить эквивалент вещества | Сделай все сам
Эквивалент вещества – это условная либо настоящая частица, которая может высвобождать, присоединять либо любым иным методом быть равнозначна катиону водорода, участвующему в ионно-обменных реакциях, либо электрону в окислительно-восстановительных реакциях. При решении задач под эквивалентом вещества подразумевают равнозначную молярную массу вещества .
Вам понадобится
- – молярная масса;
- – валентность;
- – кислотность;
- – основность.
Инструкция
1. Эквивалент ная масса является одной из важнейших колляций веществ. При решении задач она обозначается как M экв. Определяется молярная масса эквивалента какого-нибудь соединения, исходя из химической формулы исследуемого вещества и его принадлежности к определенному классу химических соединений.
2. Для того дабы удачно находить молярные массы эквивалентов, вам понадобится знать такие показатели, как молярная масса – масса одного моля вещества . Основность кислоты – число атомов водорода, которое кислота может присоединить. Кислотность основания определяется числом ионов OH-. Валентность – число химических связей, которое образует атом с другими элементами в соединении.
3. Формула нахождения равнозначной массы вещества зависит от того, к какому классу относится исследуемое соединение. К примеру, для нахождения эквивалента вещества у оксидов, вам будет нужно поделить молярную массу соединения на число атомов кислорода, заранее умноженное на два. К примеру, для оксида железа Fe2O3 равнозначная масса будет равняться 56*2 + 16*3/3*2 = 26,7 г/моль.
4. Для нахождения молярной массы эквивалента вещества у основания, поделите молярную массу основания на его кислотность. Так, для основания Ca(OH)2 эквивалент будет равняться 40 + (16+2)*2/2 = 37 г/моль.
5. Дабы обнаружить эквивалент вещества для кислоты, вам будет нужно сделать следующее действие: поделите молярную массу кислоты на ее основность. Для нахождения молярной массы эквивалента вещества серной кислоты h3SO4 поделите 1*2 + 32 + 16*4/2 = 49 г/моль.
6. Наконец, для нахождения эквивалента вещества соли поделите молярную массу вещества на число атомов металла, помноженное на его валентность. К примеру, молярная масса эквивалента вещества соли Al2(SO4)3 = 27*2 + (32 + 16*4)*3/1*2 = 171 г/моль.
Вначале определите химический состав и агрегатное состояние вещества. Если изучается газ, измерьте его температуру, объем и давление либо разместите в типичные данные и измерьте только объем. Позже этого рассчитайте количество молекул и атомов . Для определения числа атомов в твердом теле либо жидкости обнаружьте их массу и молярную массу, а после этого количество молекул и атомов .
Вам понадобится
- манометр, термометр, весы и таблица Менделеева, узнать непрерывную Авогадро.
Инструкция
1. Определение числа атомов в газеС подмогой манометра и термометра измерьте давление в Паскалях и температуру газа в Кельвинах. После этого геометрически определите объем газа в помещении либо посудине в кубических метрах. Позже этого перемножьте значения давления и объема и поделите на числовое значение температуры и число 8,31. Полученный итог умножьте на непрерывную Авогадро, которая равна 6,022*10^23.Если температура газа составляет 273,15 Кельвин (00С), а давление 760 мм.рт.ст., что является типичными условиями, довольно измерить объем газа, в котором определяется количество частиц в кубических метрах, поделить его на число 0,224 и умножить на 6,022*10^23. При обоих методах, если молекула газа многоатомная, умножьте полученное число на количество атомов в молекулах.
2. Определение числа атомов в твердом теле либо жидкости из чистого веществаНайдите массу исследуемого тела в граммах. Позже этого в таблице Менделеева обнаружьте молекулярную массу данного чистого вещества, которая будет равна его молярной массе, выраженной в граммах на моль. После этого значение массы поделите на молярную массу и умножьте на 6,022*10^23.
3. Число атомов в веществе с многоатомными молекуламиУзнайте химическую формулу вещества. После этого измерьте его массу в граммах. С подмогой таблицы Менделеева узнайте молярную массу всякого из элементов, которые входят в конструкцию молекулы исследуемого вещества. Скажем, для поваренной соли это натрий и хлор. Если в формуле не один атом одного элемента, умножьте молярную массу на их количество . Позже этого сложите все получившиеся массы – получите молярную массу данного вещества. Поделите массу вещества на его молярную массу и умножьте на 6,022*10^23. Полученное число умножьте на всеобщее число атомов в молекуле.
4. Определение числа атомов в смеси веществЕсли есть смесь, раствор либо расплав нескольких веществ, то узнайте их массовые доли в нем. После этого обнаружьте массы этих веществ. Скажем, в 10 % растворе поваренной соли содержится еще 90 % воды. Обнаружьте массу раствора, позже чего эту массу умножьте на 0,1, дабы узнать массу поваренной соли и на 0,9, дабы узнать массу воды. Позже этого действуйте как в пункте для веществ с многоатомными молекулами, а итоги по соли и воде сложите.
Видео по теме
Соли – это химические вещества, состоящие из катиона, то есть позитивно заряженного иона, металла и негативно заряженного аниона – кислотного остатка. Типов солей много: типичные, кислые, основные, двойные, смешанные, гидратные, комплексные. Это зависит от составов катиона и аниона. Как дозволено определить основание соли?
Инструкция
1. Представим, у вас есть четыре идентичные емкости с жгучими растворами. Вы знаете, что это – растворы углекислого лития, углекислого натрия, углекислого калия и углекислого бария. Ваша задача: определить, какая соль содержится в всякой емкости.
2. Припомните физические и химические свойства соединений этих металлов. Литий, натрий, калий – щелочные металлы первой группы, их свойства дюже схожи, активность усиливается от лития к калию. Барий – щелочноземельный металл 2-й группы. Его углекислая соль отлично растворяется в жгучей воде, но дрянно растворяется в холодной. Стоп! Вот и первая вероятность сразу определить, в какой емкости содержится углекислый барий.
3. Охладите емкости, скажем, разместив их в сосуд со льдом. Три раствора останутся прозрачными, а четвертый стремительно помутнеет, начнет выпадать белый осадок. Вот в нем-то и находится соль бария. Отложите эту емкость в сторону.
4. Дозволено стремительно определить углекислый барий и иным методом. Поочередно отливайте немножко раствора в иную емкость с раствором какой-нибудь сернокислой соли (скажем, сульфата натрия). Только ионы бария, связываясь с сульфат-ионами, мигом образуют плотный белый осадок.
5. Выходит, углекислый барий вы определили. Но как вам различить соли 3 щелочных металлов? Это достаточно легко сделать, вам потребуются фарфоровые чашки для выпаривания и спиртовка.
6. Отлейте малое число всего раствора в отдельную фарфоровую чашку и выпарите воду на огне спиртовки. Образуются мелкие кристаллики. Внесите их в пламя спиртовки либо горелки Бунзена – с поддержкой стального пинцета, либо фарфоровой ложечки. Ваша задача – подметить цвет запылавшего «язычка» пламени. Если это соль лития – цвет будет ясно-красным. Натрий окрасит пламя в интенсивный желтый цвет, а калий – в пурпурно-фиолетовый. Кстати, если бы таким же образом испытали соль бария – цвет пламени должен был быть зеленым.
Полезный совет
Один известный химик в молодости приблизительно так же разоблачил алчную хозяйку пансиона. Он посыпал остатки недоеденного блюда хлористым литием – веществом, безусловно безопасным в мелких числах. На дальнейший день за обедом ломтик мяса из поданного к столу блюда был сожжен перед спектроскопом – и жильцы пансиона увидели ясно-красную полосу. Хозяйка готовила еду из вчерашних остатков.
Эквивалентом какого-нибудь химического элемента именуется такое его число, которое вступает во взаимодействие с одним молем атомов водорода. Взаимодействие может заключаться в соединении с водородом, либо его вытеснении (в реакциях замещения). Молярной массой эквивалента элемента именуется, соответственно, масса одного моля эквивалента .
Инструкция
1. Дабы осознать, как вычислить массу эквивалента , разглядите пример. Щелочной металл литий вступил в соединение с водородом, образовав гидрид лития: LiH. Требуется обнаружить массу эквивалента этого металла.
2. Ядерная масса лития составляет 6,94 а.е.м. (ядерных единиц массы), водорода – 1,008 а.е.м. Для облегчения расчетов, немножко округлите эти величины и примите их за 7 и 1.
3. Выходит, какова же массовая доля (массовый процент) обоих компонентов в этом веществе? 7/8 = 0,875 либо 87,5% для лития, и 1/8 = 0,125 либо 12, 5% для водорода. Согласно закону эквивалентов, открытому немецким химиком И.В. Рихтером в конце 18-го столетия, все вещества реагируют друг с ином в равнозначном соотношении, следственно, в вашем определенном случае массовая доля водорода во столько же раз поменьше массовой доли лития, во сколько раз равнозначная масса лития огромнее равнозначной массы водорода. Следственно, вычислите: 0,875/0,125 = 7. Задача решена: равнозначная масса лития в его гидриде равна 7г/моль.
4. Сейчас разглядите такие данные. Представим, какой-то металл (Ме) подвергся реакции окисления. Она протекла всецело, из 30 г металла в результате получилось 56, 64 г его оксида. Какова же равнозначная масса этого металла?
5. Припомните, какова равнозначная масса (МЭ) кислорода. Его молекула двухатомная, следственно, МЭ = 8г/моль. Сколько кислорода содержится в образовавшемся оксиде? Вычитая из всеобщей массы оксида изначальную массу металла, получите: 56,64 – 30 = 26,64 г.
6. По тому же закону эквивалентов, равнозначная масса металла определяется как произведение равнозначной массы кислорода на величину дроби: масса металла/масса кислорода. То есть 8г/моль * 30/26,64. Произведя эти вычисления, вы получите результат: 9,009 г/моль либо округленно 9 г/моль. Вот такова равнозначная масса этого металла.
Видео по теме
Полезный совет
Вы пользовались округленными величинами для убыстрения расчетов. Если по условиям задачи требуется высокая точность, к округлениям прибегать невозможно.
Эквивалентом именуется частица, которая химически равноценна (равнозначна) в кислотно-основных реакциях одному иону водорода, а в реакциях окислительно-восстановительного типа – одному электрону. Эквивалент выражается числом без размерности, тогда как равнозначная масса измеряется в г/моль.
Вам понадобится
- – калькулятор;
- – периодическая таблица
Инструкция
1. Дабы дозволено было обнаружить эквивалент того либо другого вещества, вы обязаны применять формулу: 1/z (какое-то вещество),где 1/z – фактор эквивалентности (fэ), то есть число, которое показывает, какая доля частицы вещества равноценна эквиваленту. Эта величина неизменно поменьше либо равна единице. Проще говоря, фактор эквивалентности – это некоторый показатель, тот, что записывается непринужденно перед формулой вещества при нахождении эквивалента. Скажем, вам нужно обнаружить эквивалент фосфорной кислоты при ее взаимодействии с гидроксидом натрия. Запишите уравнение реакции:2NaOH + h4PO4 = Na2HPO4 + 2h3OОтсюда видно, что на атомы натрия замещаются только два атома водорода, то есть кислота является двуосновной (в реакции участвуют 2 иона Н+). Таким образом, согласно определению, эквивалентом фосфорной кислоты будет условная частица ? h4PO4.
2. Учтите, что эквивалент одного и того же вещества изменяется в зависимости типа реакции, в которую это вещество вступает. Помимо того, эквивалент элемента находится в зависимости от вида соединения, в состав которого входит. Возьмите те же вещества, что и в предыдущем случае, но реакция пускай пойдет по-иному:3NaOH + h4PO4 = Na 3PO4 + 3h3O.Тут fэ(h4PO4) = 1/3, fэ(NaOH) =1. Следственно, эквивалент фосфорной кислоты – частица 1/3 h4PO4, а эквивалент щелочи равен единице.
3. Для удачного нахождения эквивалентов разных веществ вам нужно запомнить формулы для нахождения fэ в зависимости от типа химического соединения. Так для примитивных элементов fэ = 1/ валентность элемента. Пример: fэ ( h3SO4) = 1/6, а эквивалент серы в h3SO4 равен 6.Для солей – fэ = 1/n (мет.) – B(мет.) = 1/ n (к.о.) – B(к.о.), гдеn (мет.) – число атомов металла,B(мет.) – валентность металла,n (к.о.) – число кислотных остатков,B(к.о.) – валентность кислотного остатка и т.д.
4. Труднее находить эквивалент вещества в реакциях окислительно-восстановительного типа, потому что расчет вы будете вести по числу электронов, которые принимают участие в процессе поправления либо окисления. Дано задание обнаружить эквивалент гидроксида марганца в реакции: 2Mn(OH)2 + 12NaOH + 5Cl2 = 2NaMnO4 + 10NaCl + 8h3OИз уравнения видно, что марганец отдает 5 электронов и переходит из Mn +2 в Mn +7. Значит, фактор эквивалентности Mn(OH)2 – 1/5, а эквивалент гидроксида равен 5.
Полезный совет
При расчете не забывайте о том, что эквивалентом может быть сама молекула либо же какая-либо иная единица вещества.
§2. Понятие о химическом эквиваленте и факторе эквивалентности.
Одним из основных законов химии является закон эквивалентов:
Вещества вступают в химические реакции и образуются в результате химических реакций в количествах, пропорциональных их эквивалентам.
Закон эквивалентов широко используется для количественных расчетов, необходимых при проведении химических реакций, и математически может быть записан следующим образом : m1 : Э1 = m 2 : Э 2 (1),
где m1, m2 и Э1, Э2 соответственно массы и эквиваленты реагирующих веществ.
Для объемых отношений закон эквивалентов записывается таким образом:
N1V1=N2V2(2)
Преобразуя первое и второе выражение можем записать, что n 1 = n 2 где n- количество моль — эквивалентов реагирующих веществ, а это значит, что в точке эквивалентности количество моль-эквивалентов реагирующих и образующихся веществ равны. Для описания закона эквивалентов в химии широко используют понятие эквивалента и фактора эквивалентности.
Эквивалентом называют реальную или условную частицу вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции — одному электрону.
Например, в реакции:
аА + bB ↔ cC + dD
которую можно переписать в виде:
A + B ↔ C + D
условная частица В, равноценная одной частице А, является эквивалентом вещества В данной реакции.
Множитель f называют фактором эквивалентности вещества В и обозначают fэкв (В).
Фактор эквивалентности fэкв (Х) – число, обозначающее какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
fэкв (Х) = 1/z
Молярная масса эквивалента (размерность г/моль)- равна массе вещества, эквивалентной 1 молю водорода или 1 молю электронов в химической реакции. Численно равна эквиваленту вещества.
Молярная масса эквивалента равна молярной массе вещества, умноженной на фактор эквивалентности:
М(1/z X) = M(X) • fэкв (X) = M(X) / z
Существуют следующие формулы для определения молярных масс эквивалентов сложных веществ:
Кислоты:
М(Х)
М(1/z кислоты) = —————————
Основность кислоты
М(НСl)
НС1 — f (НС1) =1 М(1/1 НС1) = ————
1
M(h3SO4)
Н2SO4 — f (h3SO4 ) = ½ M(½ H2SO4) =—————
2
M(h4PO4)
H3PO4 — f (h4PO4) = ⅓ M(⅓ H3PO4) = —————
3
Основания:
М(Х)
М(1/z основания) = ——————————
кислотность основания
M(NaOH)
NaOH — f (NaOH) = 1 M(NaOH) = —————
1
M (Ba(OH)2
Ba(OH)2 — f (Ba(OH)2 =½ M(½ Ba(OH)2) = —————-
2
M (Al(OH)3)
Al(OH)3 — f (Al(OH)3) = ⅓ M(⅓ Al(OH)3 )= —————-
3
Соли:
М (Х)
М (1/z cоли) = —————————————————
число атомов Ме • степень окисления Ме
M (K2SO4)
К2SO4 — f (K2SO4) = ½ M(½ K2SO4) = ————-
2
M ( CaCL2)
CaCl2 — f (CaCl2) = ½ M(½ CaCL2) = —————
2
M(Fe2(SO4)3)
Fe2(SO4)3 — f ( Fe2(SO4)3) = 1/6 ; M(1/6 Fe2(SO4)3) = ——————
6
Оксиды:
М (Х)
М (1/z оксида) = ———————————————————
число атомов эл-та • степень окисления эл-та
M(Na2O)
Na2O — f ( Na2O) = ½ M(½ Na2O) = ————-
2
M(NiO)
NiO — f (NiO) = ½ M(½ NiO) = ———
2
M(N2O5)
N2O5— f (N2O5) = 1/10 M(1/10N2O5) = ————
10
Пример 1:
Укажите фактор эквивалентности щавелевой кислоты в реакции:
Н2С2О4 + 2 NaOH ↔ Na2C2O4 + 2 H2O
Найдите молярную массу эквивалента щавелевой кислоты.
Решение:
В данной реакции одна молекула Н2С2О4 равноценна (соответствует, эквивалентна) двум ионам водорода, следовательно:
fэкв (Н2С2О4) = ½ , а молярная масса эквивалента кислоты:
М(Н2С2О4) 90
М(½ Н2С2О4) = ————- = —- = 45 (г/моль)
2 2
Пример 2:
Укажите факторы эквивалентности и молярные массы эквивалента КМО4 в реакциях:
а) 2 КМnО4 + 5 Na2C2O4 + 16 HCl ↔ 2 MnCl2 + 2 KCl + 10 CO2 + 8 H2O + 10 H2O
б) 2 KMnO4 + 3 MnCL2 + H2O ↔ 5 MnO2↓ + 4 KCl + 4 HCl
Решение:
а) В полуреакции восстановления участвуют 5 электронов, следовательно:
MnO4— + 8H+ + 5 ê ↔ Mn2+ + 4 H2O
fэкв (KMnO4) = 1/5 , а следовательно
M (KMnO4) 158
М(1/5 KMnO4) = ————— = ——- = 31,67 (г/моль)
5 5
б) Поскольку в полуреакции восстановления KMnO4 участвуют 3 электрона:
MnO4— + 2 H2O + 3 ê ↔ MnO2 + 4 OH—
fэкв(KMnO4) = 1/3 , следовательно
M (KMnO4) 158
М(1/3 KMnO4) = —————— = ——— = 52, 67 (г/моль)
3 3
Определение эквивалента и эквивалентной массы металла по водороду
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть.
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами.
Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль— это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02 .1023). Например: 3 .1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль. Эквивалентом элемента называется такое его количество, которое соединяется 1с молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВг, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах, эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ, пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
 (1)
(1)
где: m, (V) — массы (объемы) реагирующих веществ;
Э, (Vэкв.) — эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
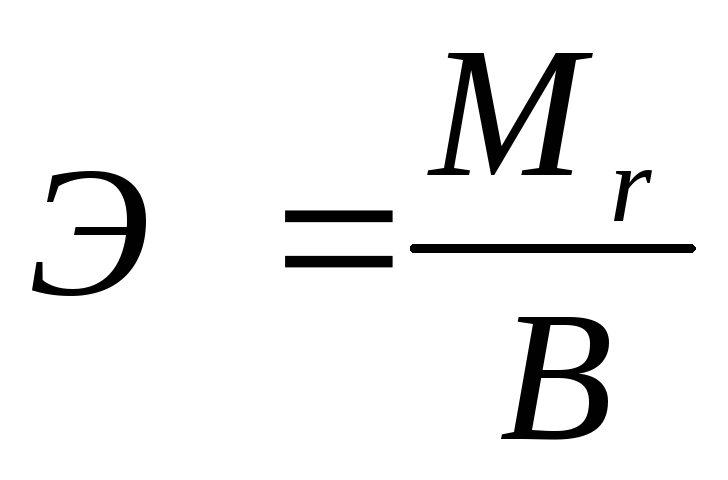
где  — мольная масса атома элемента,
— мольная масса атома элемента,
В — валентность элемента.
Так, например, эквивалентные массы водорода и кислорода соответственно равны:

Эквивалентный объем газа можно вычислить по формуле:

Так, например, эквивалентные объемы водорода и кислорода соответственно равны:

Эквивалентные массы сложных веществ можно вычислить по формулам:
 (2)
(2)
nO, nOH, nH, nMe– число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли; В – валентность, 8 – эквивалентная масса кислорода, 1 – эквивалентная масса водорода, 17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:

Затем по формуле (1) определяют эквивалентную массу.
Рисунок и описание прибора для определения эквивалента металла
Рис.1.1
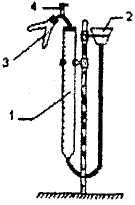
Прибор состоит из бюретки 1, соединенной резиновыми трубками с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.
Реактивы и посуда.
Прибор для определения эквивалента металла (рис.1.1), барометр, термометр, мерный цилиндр емкостью 10 мл, воронка, 10 % — ный раствор соляной кислоты, металлический магний.
Практическая часть
1. В одно колено пробирки 3 внесите магний, а в другое колено пробирки через воронку налейте около 12мл 10%- ного раствора соляной кислоты. Наденьте двухколенную пробирку на пробку, соединенную резиновой трубкой с бюреткой.
2. Необходимым условием протекания опыта является герметичность всей системы, поэтому проверьте прибор на герметичность. Для этого воронку 2 опустите или поднимите на 25-30 см и держите на одном уровне 1 -2 минуты. Если уровень воды в бюретке 1 не изменится за это время, то прибор герметичен. Если же уровень воды в бюретке будет снижаться или подниматься до уровня воды в воронке, то вращательными движениями добейтесь плотного прилегания всех пробок и снова проверьте герметичность прибора.
3. Убедившись в герметичности прибора, отметьте уровень воды в бюретке 1, а затем постепенно (первая порция кислоты должна быть небольшой во избежание бурного выделения газа) наклоните двухколенную пробирку так, чтобы кислота перелилась в колено с магнием.
4. По окончании реакции подождите 1 минуту, пока газ примет температуру помещения и измерьте объем водорода, вытесненного магнием. Для этого установите воронку на такой высоте, чтобы вода в воронке и бюретке была на одном уровне, то есть газ находился при атмосферном давлении. Деление бюретки, против которого установится уровень воды, будет соответствовать объему выделившегося водорода при условиях проведения опыта. ( Если в начале опыта уровень воды находился не на нулевой отметке, то из конечного показания уровня воды надо вычесть число, соответствующее начальному уровню воды). В таблицу 1.1 запишите значения указанных в ней величин.
Таблица 1.1 Параметры для расчета эквивалента металла.
m, г | P, Па | Т, К | V , мл | Р0, Па | Т0, К | V0, мл | h, Па |
Определите давление Р по барометру и температуру Т по термометру.
Давление насыщенного водяного пара h, соответствующее температуре опыта Т, выпишите из следующей таблицы:
Таблица 1.2 Давление насыщенного водяного пара при различных температурах
Т, К | h, Па |
293 | 2300 |
294 | 2500 |
295 | 2700 |
296 | 2900 |
297 | 3100 |
298 | 3300 |
299 | 3500 |
300 | 3700 |
Р0 — давление при нормальных условиях, равное 101325 Па;
Т0 — температура при нормальных условиях, равная 273 К.
Расчет
Напишите уравнение реакции магния с соляной кислотой.
Измеренный объем водорода V приведите к нормальным условиям по уравнению Клапейрона (3):
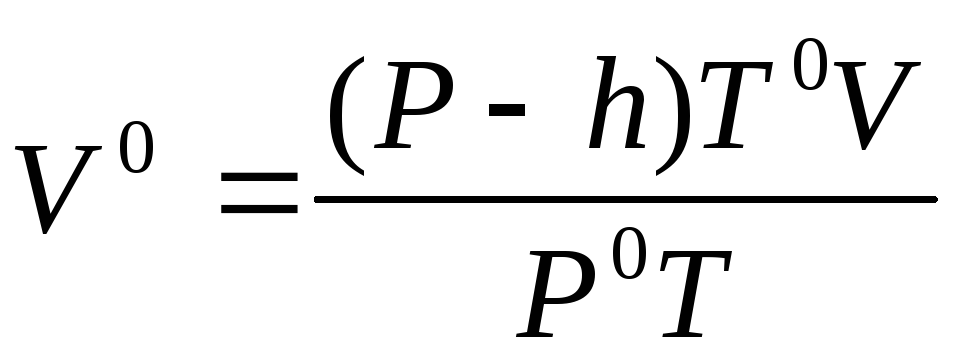
Из математического выражения (1) закона эквивалентов определите эквивалентную массу магния:

Определите теоретическое значение эквивалентной массы магния по формуле:

где  — мольная масса металла, В валентность
металла.
— мольная масса металла, В валентность
металла.
Сравните полученное практическое значение эквивалентной массы Э магния с теоретическим значением Эт.
Рассчитайте процент относительной ошибки опыта по формуле:

Указания по технике безопасности
Необходимым условием протекания опыта является герметичность всей системы. Она в основном определяется тем, насколько плотно прилегают пробки к двухколенной пробирке и бюретке. При проверке герметичности прибора во избежание порезов рук стеклом, которые могут возникнуть при чрезмерном нажиме пробки на стекло, необходимо двухколенную пробирку, пробку и бюретку держать полотенцем.
Лабораторная работа №2




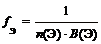 ,
, ,
,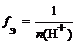 ,
, ,
,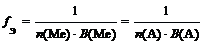 ,
, ,
, –
число электронов, участвующих в
процессе окисления или восстановления
–
число электронов, участвующих в
процессе окисления или восстановления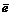 →
Fe0
→
Fe0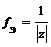 ,где z – заряд иона
,где z – заряд иона