Получение водорода электролизом воды / Публикации / Элек.ру
Получение чистого водорода путем электролиза воды — самая очевидная и эффективная технология, и один из наиболее перспективных способов получения альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду.
По сравнению с прочими методами получения водорода, электролиз воды отличается целым рядом преимуществ. Во-первых, в ход идет доступное сырье — деминерализованная вода и электроэнергия. Во-вторых, во время производства отсутствуют загрязняющие выбросы. В-третьих, процесс целиком автоматизирован. Наконец, на выходе получается достаточно чистый (99,99%) продукт. Из всех методов электролиза наиболее перспективным считают высокотемпературный электролиз (себестоимость водорода от 2,35 до 4,8 $/кг). Его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
Электролизом воды называется физико-химический процесс, при котором под действием постоянного электрического тока дистиллированная вода разлагается на кислород и водород. В результате разделения на части молекул воды, водорода по объему получается вдвое больше, чем кислорода. Эффективность электролиза такова, что из 500 мл воды получается около кубометра обоих газов с затратами около 4 квт/ч электрической энергии.
Технологический ток для протекания процесса электролиза воды для получения водорода и кислорода получается, как правило, при помощи промышленного выпрямителя с необходимыми рабочими параметрами, Обычно это напряжение до 90В и силой тока до 1500 А. Подходящим агрегатом является Пульсар СМАРТ.
На электронном дисплее выпрямителя Пульсар СМАРТ или в специальном ПО для компьютера можно контролировать все стадии процесса производства, что позволяет оператору следить за параметрами, и круглосуточно журналировать протекание технологического процесса. Полностью автоматическая работа, включающая непрерывный мониторинг всех параметров для безаварийного функционирования без надзора оператора.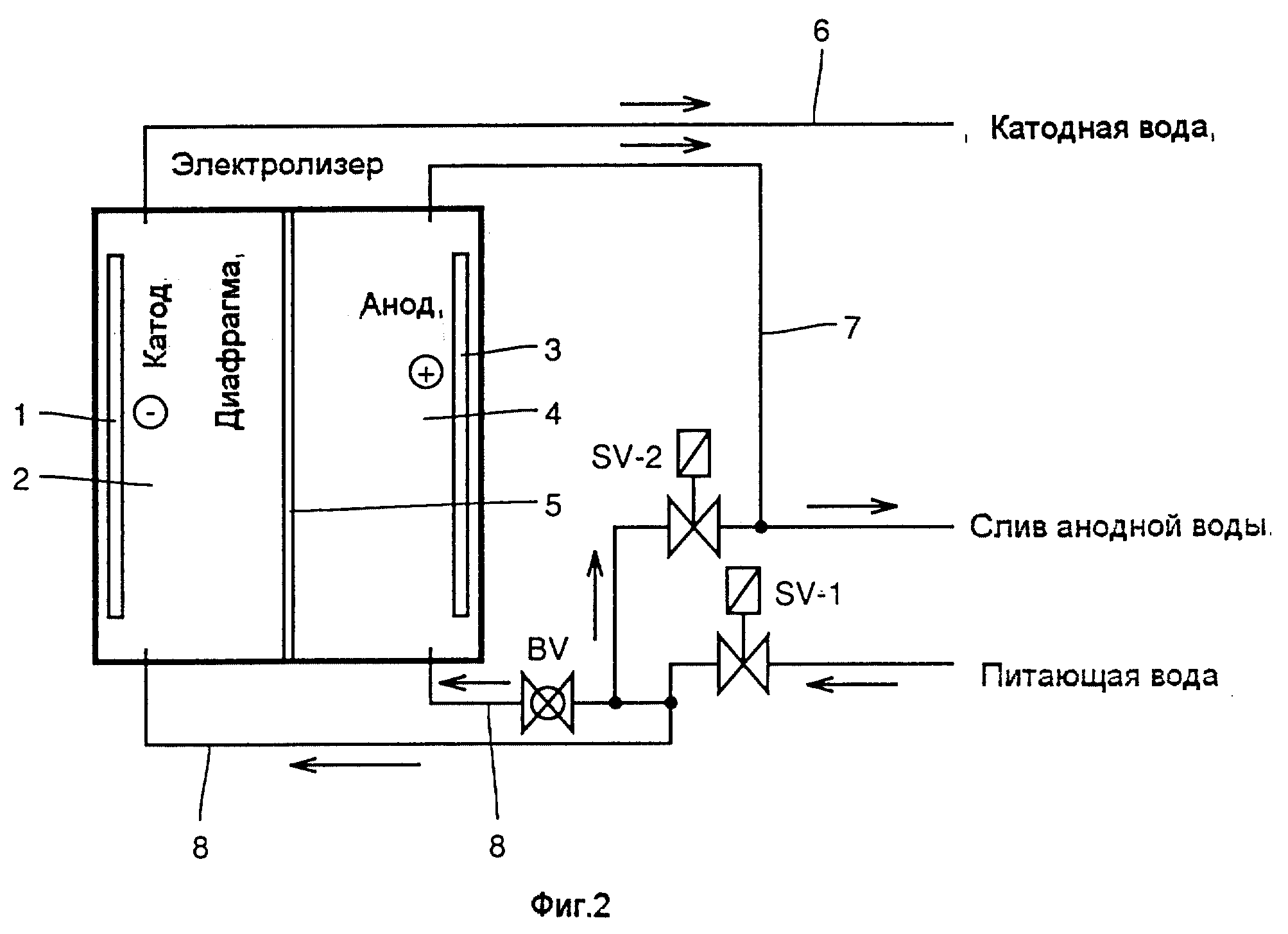 Все параметры, касающиеся напряжения и силы тока постоянно измеряются и контролируются микропроцессором выпрямителя. Более того, все контролируемые параметры фиксируются устройством, которое в случае сбоя или отклонения может автоматически остановить процесс и сигнализирует об этом при помощи световой колонны.
Все параметры, касающиеся напряжения и силы тока постоянно измеряются и контролируются микропроцессором выпрямителя. Более того, все контролируемые параметры фиксируются устройством, которое в случае сбоя или отклонения может автоматически остановить процесс и сигнализирует об этом при помощи световой колонны.
Выпрямители тока серии Пульсар СМАРТ разработаны в соответствии с самыми высокими требованиями промышленной эффективности и международными стандартами. При этом технологическое программное обеспечение допускает гибкую адаптацию к требованиям Заказчика, и постоянно совершенствуется.
Даёшь дешёвый водород. Найден упрощённый способ электролиза воды / Хабр
Схема электролиза без мембраны: два параллельных электрода располагаются на расстоянии в несколько сотен микрометров
Не секрет, что чистый водород — один из наиболее перспективных видов альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду, что может быть прекраснее?
Проблема только в стоимости добычи водорода. Электролиз воды предполагает, что электроды погружаются в воду, а между ними находится полимерная мембрана. Ток идёт от катода к аноду, а на своём пути он (при помощи катализатора) расщепляет воду на кислород и водород. Полимерная мембрана выполняет важную функцию, разделяя получившиеся газы.
Электролиз воды предполагает, что электроды погружаются в воду, а между ними находится полимерная мембрана. Ток идёт от катода к аноду, а на своём пути он (при помощи катализатора) расщепляет воду на кислород и водород. Полимерная мембрана выполняет важную функцию, разделяя получившиеся газы.
На сегодняшний в качестве мембраны с ионной проводимостью практически повсеместно используется нафион или другой тип мембраны. Но все они отличаются дороговизной и ограниченным сроком службы. К тому, мембраны требуют особых условий проведения электролиза. Например, нафион работает в жидкости только с низкой кислотностью и только с определёнными катализаторами.
Изобретение химиков из EPFL под руководством Деметри Псалтиса (Demetri Psaltis) позволяет избавиться от этих ограничений и намного удешевить электролиз воды.
Они провели ряд экспериментов с микроустройством, размещая электроды на разном расстоянии друг от друга и прогоняя между ними воду на разной скорости. Оказалось, что при определённом расстоянии между электродами H2 и O2 сами разлетаются в разные стороны, без всякой мембраны!
Причина такого поведения ионов — эффект Сегре-Зильберберга, когда при движении жидкости находящиеся в ней частицы поток уносит в стороны.
Учёные надеются, что им удастся приспособить прибор для работы с любыми видами жидких электролитов и любыми катализаторами, поскольку больше нет риска повреждения хрупкой мембраны. Исчезнут обязательные требования использовать только благородные металлы вроде платины из-за ограничений на кислотность (pH) жидкости.
Если получится масштабировать микроустройство до промышленного образца, то это кардинально снизит стоимость водорода, получаемого при электролизе воды.
Научная работа “A membrane-less electrolyzer for hydrogen production across the pH scale” опубликована в журнале “Energy & Environmental Science”, DOI: 10.1039/C5EE00083A (зеркало).
Новый метод электролиза производит в 4 раза больше водорода
Присутствующий в изобилии природе, водород может стать перспективным чистым источником топлива, однако из-за ряда проблем его применение пока не может получить широкого распространения. Ученые из Южной Кореи разработали новую систему получения газа из воды, которая, по их словам, намного эффективнее других электролизных технологий.
За основу своего изобретения исследовательская группа, в состав которой вошли ученые из Ульсанского национального института науки и техники, Корейского института энергетических исследований и женского университета Сукмун, взяла уже существующую конструкцию под названием «твердая оксидная электролизная ячейка» (SOEC).
В усовершенствованной модели, так же, как и в других электролизерах, электрический ток расщепляет воду на молекулы водорода и кислорода, которые затем отдельно улавливаются. Отличие заключается в том, что в предложенной установке оба электрода являются твердотельными, как и электролит, служащий проводником ионов.
В системах, использующих жидкие электролиты, необходимо постоянно контролировать уровень жидкости. К тому же со временем жидкие электролиты становятся причиной коррозии других компонентов. Твердотельные электролизёры лишены этих недостатков, работают при более высоких температурах и могут извлекать электричество из этого тепла, соответственно, энергозатраты при их функционировании минимальны.
До сегодняшнего дня существовало два варианта ячейки SOEC, в которых использовались разные электролиты: первая конструкция позволяла пропускать только ионы кислорода, а вторая – только ионы водорода. Такое одностороннее движение ограничивало количество производства водорода и требовало улучшений.
Сохранив все преимущества твердотельного электролизера, исследователи разработали новую высокоэффективную гибридную систему (Hybrid-SOEC), в которой используется проводник со смешанными ионами для одновременного переноса как отрицательно заряженных ионов кислорода, так и положительно заряженных ионов водорода (протонов).
Используя смешанный ионный проводник и электроды из слоистого перовскита, Hybrid-SOEC произвел 1,9 литра водорода в час, работая при напряжении ячейки 1,5 В и температуре 700° С. Исследователи говорят, что это в четыре раза эффективнее существующих систем электролиза воды, а после непрерывного функционирования устройства в течение 60 часов признаки ухудшения производительности полностью отсутствовали.
Читайте также: Плавучие солнечные платформы будут добывать водород из морской воды за счет электролиза
Источник: news.unist.ac.kr
А вы что думаете по этому поводу? Дайте нам знать – напишите в комментариях!
Понравилась статья? Поделитесь ею и будет вам счастье!
Химики создали устойчивый к хлоридной коррозии анод для электролиза воды
Ученые из Китая и США создали электрод, покрытый слоями из сульфида никеля и соединения никеля с железом, с высокой эффективностью разложения морской воды и устойчивостью к хлоридной коррозии.
Водород считается одним из самых перспективных носителей чистой энергии, так как способен запасать ее в малых объемах (142 мегаджоуля на килограмм, почти в три раза больше, чем бензин) и не образует загрязняющих отходов при использовании.
Наиболее эффективным методом получения водородного топлива по сравнению с конверсией природного газа является электролиз воды (разложение под действием электрического тока). Использование пресной воды в качестве сырья нежелательно для этих целей, так как ее на Земле меньше трех процентов, а обессоливание морской воды весьма дорогостоящий процесс. Поэтому инженеры ищут способы получения водорода напрямую из морской воды.
Основная проблема, возникающая при продолжительном электролизе соленой воды, заключается в том, что хлориды, которые в ней содержатся, взаимодействуют с материалом анода. Сначала они адсорбируются на положительно заряженной поверхности электрода, образуя полианионы, затем хлорид заменяется на гидроксид и материал электрода разрушается. Помимо этого, в щелочной среде хлорид окисляется до гипохлорида легче, чем гидроксид-ион до кислорода. Поэтому последнюю реакцию необходимо катализировать, чтобы не расходовать энергию электролиза на побочные процессы.
Сначала они адсорбируются на положительно заряженной поверхности электрода, образуя полианионы, затем хлорид заменяется на гидроксид и материал электрода разрушается. Помимо этого, в щелочной среде хлорид окисляется до гипохлорида легче, чем гидроксид-ион до кислорода. Поэтому последнюю реакцию необходимо катализировать, чтобы не расходовать энергию электролиза на побочные процессы.
Юнь Куан (Yun Kuang) с коллегами из Стэнфордского университета создали и протестировали устойчивый к хлоридной коррозии анод, покрытый проводящим слоем сульфида никеля и слоем катализатора из железа и никеля. Небольшую пористую пластинку из никеля (1×3,5 сантиметра) кипятили в растворе серы в толуоле, а на полученный слой сульфида никеля (NiSx) путем электрохимического восстановления нанесли каталитический слой интерметаллического соединения железа с никелем (FeNi). Для того, чтобы проверить элеткролитические способности анода, ученые соединили двуслойный анод с катодом и провели электролиз модельных щелочных растворов хлорида натрия и морской воды из залива Сан-Франциско.
Этапы создания и состав двуслойного анода из пористого никеля
Yun Kuang et al., / Proceedings of the National Academy of Sciences, 2019
Исследователи учли и тот факт, что по мере прохождения электролиза концентрация соли будет увеличиваться, и протестировали систему на растворах с бóльшим содержанием хлорида натрия, чем в морской воде, а также в промышленных условиях (сильнощелочной среде и повышенных температурах). В паре с никелевым катодом, покрытым оксидами никеля и хрома, анод функционировал без видимых разрушений более тысячи часов.
Проанализировав газы после электролиза, авторы исследования не обнаружили следов хлора, что свидетельствует о том, что анод селективно окислял только кислород. Проводящий сульфидный слой обеспечивал наличие анионных групп, которые, как предполагают химики, отталкивали хлорид-ионы, не позволяя им сорбироваться на материале анода и разрушать его. Чистые никелевые пористые пластинки или пластинки только с сульфидным слоем функционировали меньше 20 минут, а никелевый анод, покрытый интерметаллидом железа с никелем продержался 12 часов. Эти эксперименты демонстрируют ключевую роль наличия обоих слоев (NiSx и FeNi) для того, чтобы анод долгое время не подвергался коррозии.
Чистые никелевые пористые пластинки или пластинки только с сульфидным слоем функционировали меньше 20 минут, а никелевый анод, покрытый интерметаллидом железа с никелем продержался 12 часов. Эти эксперименты демонстрируют ключевую роль наличия обоих слоев (NiSx и FeNi) для того, чтобы анод долгое время не подвергался коррозии.
Для стабильной работы такой электролитической ячейки в морской воде с плотностью тока 800 миллиампер на квадратный сантиметр оказалось достаточно наложить напряжение в два-три вольта. Такое значение разности потенциалов смогла обеспечить относительно небольшая панель солнечной батареи.
Электролиз морской воды под действием солнечной энергии
Yun Kuang et al., / Proceedings of the National Academy of Sciences, 2019
Ранее уже создавали устройства для электролиза, которые работают на энергии солнца. Американские ученые предложили автоматизировать процесс электролиза воды и создали плавучую электролитическую ячейку для генерации водородного топлива со встроенной солнечной батареей.
Американские ученые предложили автоматизировать процесс электролиза воды и создали плавучую электролитическую ячейку для генерации водородного топлива со встроенной солнечной батареей.
Алина Кротова
Химики собрали дешевый электролизер на солнечных батареях
Микрофотография наностержней оксида кобальта
Liang et al / ACS Nano, 2020
Американские
и китайские химики разработали
новый солнечный
электролизер — устройство для получения
водорода из воды при помощи солнечной
энергии. Ученые
намеренно отказались от использования
дорогостоящих материалов: в основе электролизера — катализаторы из наностержней оксида кобальта и
перовскитный солнечный элемент, которые заключены в упаковочную пленку.
Эффективность
преобразования
солнечной энергии в водород — 6,7
процента.
Результаты
исследования опубликованы
в журнале ACS
Nano.
Ученые
намеренно отказались от использования
дорогостоящих материалов: в основе электролизера — катализаторы из наностержней оксида кобальта и
перовскитный солнечный элемент, которые заключены в упаковочную пленку.
Эффективность
преобразования
солнечной энергии в водород — 6,7
процента.
Результаты
исследования опубликованы
в журнале ACS
Nano.
Один из главных недостатков солнечных элементов — прерывистый характер работы. Мощность, выдаваемая солнечной электростанцией, зависит от сезона, времени суток и погоды. Поэтому для эффективного использования солнечной энергетики нужно научиться запасать энергию в светлое время суток, чтобы затем использовать ее, например, ночью.
Проблему можно решить совмещением двух технологий: фотовольтаики
и электрокаталитического
получения водорода.
В
таком устройстве электричество, которое
выработала солнечная батарея, сразу же
используется для выделения водорода из воды путем
электролиза. Далее водород можно использовать для
получения электричества в темное время суток,
а
также хранить и перевозить.
Энергия в таком устройстве преобразуется дважды: сначала энергия падающих фотонов переходит в электрическую энергию, а затем — в энергию химических связей молекулы водорода. Потери происходят на обоих этапах, поэтому эффективность таких устройств пока не очень высока: лучшие показывают эффективность в 16–19 процентов.
Обычно такие устройства изготавливают из кремниевых солнечных элементов, а в качестве катализаторов используют металлы платиновой группы — платину, иридий и рутений — и их соединения. Все эти материалы достаточно дороги, что затрудняет дальнейшее масштабирование солнечно-водородных систем.
Химики под руководством Цзюнь Лоу (Jun Lou) из Университета Райса впервые разработали солнечный электролизер, в котором не используются дорогостоящие материалы: солнечный элемент сделан из свинцово-галогенидного перовскита CH3NH3PbI3, а катализатор для электролиза воды — из наностержней оксида кобальта.
Схема электролизера
Liang et al / ACS Nano, 2020
Перовскит выбрали еще и потому, что такие элементы демонстрируют более
высокие значения напряжения холостого
хода, чем кремниевые —
в случае электролиза воды это преимущество
очень важно. Наностержни
оксида кобальта, в свою очередь, — это материал
с большой удельной площадью поверхности,
который наносят
на электроды для улучшения эффективности
электролиза.
Наностержни
оксида кобальта, в свою очередь, — это материал
с большой удельной площадью поверхности,
который наносят
на электроды для улучшения эффективности
электролиза.
Наностержни синтезировали гидротермальным методом из раствора нитрата кобальта и мочевины, а затем дополнительно допировали фосфором: для этого их нагрели в печи вместе с гидрофосфатом натрия при 300 градусах Цельсия. Добавка фосфора улучшает электрокаталитическую активность стержней, позволяя проводить электролиз при более низких значениях потенциала.
Авторы намеренно отказались от использования дорогостоящих и редких материалов везде, где это было возможно. Например, в перовскитном солнечном элементе они заменили золотой катод на катод из угля, а также отказались от полимерного слоя между активным слоем и катодом. Этот слой изготавливают из полимера, который пропускает только дырки, но не пропускает электроны. Синтез подобных полимеров очень сложен, поэтому отказ от них делает устройство значительно дешевле.
Кроме того авторы впервые поместили перовскитный солнечный элемент непосредственно в раствор электролита. Это позволило снизить омические потери и добиться лучшей эффективности устройства. Вода для перовскитных солнечных элементов очень опасна — даже небольшие ее количества воды приводят к необратимой деградации таких устройств. Поэтому солнечный элемент нужно было надежно инкапсулировать — здесь авторы тоже не отступили от своих принципов и использовали коммерчески доступную упаковочную пленку Surlyn. Их эксперименты показали, что, нагрев такую пленку до 150 градусов Цельсия в течение нескольких секунд, можно получить полностью герметичное покрытие, которое надежно предохраняет солнечный элемент от влаги.
Эффективность
преобразования
солнечного света в электричество
составила 10,6 процентов, а суммарная
эффективность электролизера
—
6,7 процентов. Это пока
меньше,
чем у
лучших
электролизеров на кремнии
и металлах платиновой группы, однако
авторы
полагают, что в будущем их электролизер
можно будет улучшить
— например, используя другой
состав
перовскитного материала или экспериментируя
с
составом катализатора.
Фотоэлектролиз планируют использовать в том числе для обеспечения энергией космических кораблей. Для этих целей голландские химики разработали и испытали ячейку, которая может работать в условиях микрогравитации.
Наталия Самойлова
Ученые из США разработали эффективный способ извлечения водорода из воды — Социальная ответственность
Исследователи из Университета штата Вашингтон разработали быстрый и недорогой способ извлечения водорода из воды. Для проведения химической реакции ученые предлагают использовать катализатор, представляющий собой нанопену из никеля и железа. О результатах исследования, опубликованного в журнале Nano Energy, сообщил портал The New Atlas.
Водород считается возобновляемым источником энергии. Несмотря на то, что это самый распространенный химический элемент во Вселенной, он практически не встречается в чистом виде. Получение водорода в процессе электролиза (распад вещества на составные части при прохождении через него постоянного электрического тока) воды является самым чистым способом, но для химической реакции необходимы катализаторы — редкоземельные металлы, такие как платина. Электролиз воды еще не достиг промышленного масштаба, в основном, из-за затрат на катализаторы и энергию.
Получение водорода в процессе электролиза (распад вещества на составные части при прохождении через него постоянного электрического тока) воды является самым чистым способом, но для химической реакции необходимы катализаторы — редкоземельные металлы, такие как платина. Электролиз воды еще не достиг промышленного масштаба, в основном, из-за затрат на катализаторы и энергию.
Ученые из Университета штата Вашингтон использовали в качестве катализатора два дешевых и широко распространенных металла. За счет большой площади поверхности, контактирующей с водой, нанопена из никеля и железа сама вызывает реакцию распада. Исследователи также отметили, что этот материал работает эффективнее и требует меньше энергии, чем более дорогие катализаторы, при этом не намного снижая активность в процессе 12-часового испытания.
Большое количество нанопены может быть произведено относительно быстро, процесс создания исследователи описывают как «очень простой метод, который можно легко использовать в крупномасштабном производстве».
После лабораторных испытаний исследователи проведут более масштабные тесты.
Согласно результатам исследования Программы по окружающей среде ООН (ЮНЕП) о перспективах перехода на возобновляемые источники энергии, сейчас на долю возобновляемых источников приходится 20% глобального производства энергии.
Материал предоставлен проектом «+1».
Ученые из России и США разработали эффективный и недорогой катализатор для электролиза воды в щелочных растворах
Фото: СколтехСколковский институт науки и технологий (Сколтех), Университет Техаса в Остине и Массачусетский технологический институт (MIT) открыли новый катализатор, существенно повышающий эффективность электролитического разложения воды в щелочных растворах, сообщает пресс-служба Сколтеха. Отчет о работе опубликован в журнале Nature Communications.
Выделение кислорода и водорода из воды путем электролиза является ключевым процессом в технологии получения водородного топлива. Но широкое применение электролиза воды в современной энергетике ограничено некоторыми нерешенными технологическими проблемами. К ним относятся высокое энергопотребление, высокая стоимость электролизеров и ограниченный срок их работы. В частности, возможности крупномасштабного применения ограничены высокой стоимостью катализаторов на основе благородных металлов, таких как платина и иридий.
К ним относятся высокое энергопотребление, высокая стоимость электролизеров и ограниченный срок их работы. В частности, возможности крупномасштабного применения ограничены высокой стоимостью катализаторов на основе благородных металлов, таких как платина и иридий.
«Реакция выделения кислорода из воды остается существенной проблемой не только электролизеров, но и топливных элементов и металл-воздушных батарей. Если бы мы разработали катализатор разложения воды на водород и кислород на основе дешевых и доступных материалов, мы бы получили коммерчески выгодный метод производства водорода с использованием возобновляемых источников энергии. Например, это позволило бы нам сконструировать автомобиль, работающий на воде, с пробегом, сопоставимым с пробегом автомобилей, использующих газ в качестве топлива. Чтобы разработать такие катализаторы, мы должны на атомном уровне понять процессы и факторы, влияющие на их работу и характеристики», — цитируются в пресс-релизе пояснения одного из авторов исследования Тайлера Меффорда.
Команда исследователей под руководством проф. К. Стивенсона синтезировала ряд перовскитоподобных оксидов кобальта и лантана, свойства которых можно контролируемо изменять путем замещения части лантана на стронций. Исследователи из Сколтеха детально изучили структуры материалов на поверхности и в объеме кристаллов с помощью методов просвечивающей электронной микроскопии. Полученные данные ученые из MIT использовали для математического моделирования реакции электролиза воды в щелочных растворах.
В результате команда сформулировала два наиболее важных критерия, определяющих функциональные свойства катализатора: степень ковалентности связи кобальт-кислород (энергетическая близость валентных электронов кобальта и кислорода) и концентрация кислородных вакансий (позиций в кристаллической структуре материала, которые должны были бы быть заняты атомами кислорода, но остаются вакантными в активном катализаторе).
Основываясь на этих критериях, команда Стивенсона предложила смешанный кислород-дефицитный оксид кобальта и стронция, SrCoO2. 7, в качестве основы для катализатора, в 20 раз более активного в электролизе воды, чем лучший промышленный катализатор IrO2 при намного меньшей стоимости.
7, в качестве основы для катализатора, в 20 раз более активного в электролизе воды, чем лучший промышленный катализатор IrO2 при намного меньшей стоимости.
Результаты, полученные исследователями, привели к более глубокому пониманию механизмов работы таких катализаторов, хотя, как отмечается в сообщении, для дальнейшего прогресса в увеличении активности катализаторов электролиза воды потребуется дополнительная работа.
«Сейчас в наших руках находится прототип улучшенного катализатора щелочного электролиза воды, дающий нам импульс для преодоления затруднений на пути к успешному внедрению электролизеров, топливных элементов и батарей», – цитируются слова Стивенсона.
Повышение эффективности производства водорода за счет солнечного электролиза воды
Основные моменты
- •
Использование водорода в качестве возобновляемого энергоносителя.
- •
Повышение эффективности производства водорода с использованием пульсирующих электрических полей.

- •
Повышение эффективности производства водорода с помощью магнитных полей.
- •
Повышение эффективности производства водорода с использованием полей световой энергии.
- •
Важность учета молекулярной динамики H 2 O во время электролиза.
Реферат
Рост антропогенной деятельности привел к значительному росту потребления энергии в мире. В настоящее время большая часть выработки энергии использует ископаемое топливо, что приводит к экологически вредной деятельности и образованию токсичных побочных продуктов, которые способствуют ухудшению состояния окружающей среды и изменению климата.Возобновляемый водород — это экологически чистый энергоноситель, который может заменить ископаемое топливо в качестве глобального источника энергии. Однако низкая эффективность коммерчески жизнеспособных электролизеров ограничивает использование возобновляемого водорода в качестве энергоносителя. В этом исследовании представлен обзор текущего состояния электролиза воды с использованием солнечной энергии, а также некоторых инновационных приложений, используемых для повышения общей эффективности таких систем. Такие подходы включают приложение магнитных полей; поля световой энергии; ультразвуковые поля; и пульсирующие электрические поля.Это исследование также дает новое понимание того, почему такие приложения могут повысить эффективность электролиза. Включая новые взгляды на то, почему рассмотрение некоторых аспектов молекулярной динамики воды может еще больше повысить эффективность таких приложений из-за способности приложенных энергетических полей уменьшать прочность молекулярных связей внутри и между молекулами воды за счет изменения энергетического спинового состояния молекул воды. ; уменьшение количества водородных связей в воде; и увеличение расстояния между водородом и кислородом и кислородом с кислородными связями в воде.Основываясь на результатах этого исследования, дальнейшие успехи в эффективном производстве возобновляемого водорода потребуют рассмотрения молекулярной динамики молекулы воды.
В этом исследовании представлен обзор текущего состояния электролиза воды с использованием солнечной энергии, а также некоторых инновационных приложений, используемых для повышения общей эффективности таких систем. Такие подходы включают приложение магнитных полей; поля световой энергии; ультразвуковые поля; и пульсирующие электрические поля.Это исследование также дает новое понимание того, почему такие приложения могут повысить эффективность электролиза. Включая новые взгляды на то, почему рассмотрение некоторых аспектов молекулярной динамики воды может еще больше повысить эффективность таких приложений из-за способности приложенных энергетических полей уменьшать прочность молекулярных связей внутри и между молекулами воды за счет изменения энергетического спинового состояния молекул воды. ; уменьшение количества водородных связей в воде; и увеличение расстояния между водородом и кислородом и кислородом с кислородными связями в воде.Основываясь на результатах этого исследования, дальнейшие успехи в эффективном производстве возобновляемого водорода потребуют рассмотрения молекулярной динамики молекулы воды.
Ключевые слова
Возобновляемый водород
Производство водорода
Электролиз воды
Возобновляемая энергия
Гибрид солнечно-водородного
Молекулярная динамика
Аббревиатуры
PEMПротонообменная мембрана KJM 9000 9000 Молярный электролит 9000 SOEL 9000 на моль
кВтч Нм −3Киловатт-час на нормальный кубический метр
Акм −2Ампер на квадратный сантиметр
Нм 3 / часНормальных кубических метров в час
долларов США / кВтдолларов США за киловатт
PTFEПолитетрафторэтилен
EDLЭлектродинамический диффузионный слой
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть аннотацию© 2020 Elsevier Ltd.Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Высокоэффективный недорогой катализатор для электролиза воды
Выделение кислорода на поверхности Co @ NC электрода ядро-оболочка при электролизе щелочной воды. Фото: Институт науки и технологий Тэгу Кёнбук (DGIST)
Фото: Институт науки и технологий Тэгу Кёнбук (DGIST)Исследовательская группа под руководством профессора Сангараджу Шанмугама из отдела энергетических наук и инженерии DGIST разработала высокоэффективный, сверхпрочный наноструктурированный электрокатализатор типа ядро-оболочка и успешно заменила ценный анод при электролизе воды благодаря сотрудничеству с исследовательской группой Pacific Northwest National Лаборатория (ПННЛ).
Замена традиционных видов топлива возобновляемыми источниками энергии является подходящим подходом к созданию экологически чистой окружающей среды и снижению спроса на энергию в будущем. Таким образом, электрохимическое производство или преобразование энергии в устройствах возобновляемой энергии, которое зависит от анодных и катодных реакций, привлекло большое внимание.
При электрокаталитическом расщеплении воды на аноде образуется газообразный кислород из-за реакции выделения кислорода (OER), медленной электрохимической реакции по сравнению с реакцией выделения водорода (HER). Таким образом, для стабильного электрокаталитического расщепления воды необходим подходящий электрокатализатор.
Таким образом, для стабильного электрокаталитического расщепления воды необходим подходящий электрокатализатор.
Разработка эффективных, долговечных и недорогих электрокатализаторов на основе ООР важна для энергетических устройств электролизеров воды. До сих пор оксиды рутения и иридия считались современными электрокатализаторами в ООР, но отсутствие стабильности ограничивает их использование в крупномасштабном расщеплении воды, препятствуя широкомасштабной коммерциализации.
Команда профессора Шанмугама вместе с исследователями из PNNL сосредоточила свои усилия на разработке альтернативного недорогого электрокатализатора из неблагородных металлов для замены анодного электрода из благородного металла при эффективном расщеплении воды.Металл на углеродной основе считается эффективным электрокаталитическим материалом для повышения OER при расщеплении воды. До сих пор большинство разработанных электрокатализаторов характеризовались более высоким содержанием углерода и меньшим содержанием активных металлов. Более высокое количество углерода затопило активные участки настоящего металла и привело к более быстрой коррозии углерода. Это привело к снижению электрокаталитической активности.
Более высокое количество углерода затопило активные участки настоящего металла и привело к более быстрой коррозии углерода. Это привело к снижению электрокаталитической активности.
В ходе исследования исследователи обнаружили, что большое количество неорганических ионов металлического кобальта, соединенных органическими лигандами в берлинской синей, является подходящим прекурсором для разработки сверхстабильных, богатых металлами, легированных азотом графитовых электрокатализаторов ядро-оболочка, инкапсулированных наноуглеродом. для вялого ООР (анода) при расщеплении воды.
При нагревании (от 600 до 900 градусов C) в инертной атмосфере ионы металлического кобальта и органические лиганды в соли превращаются в металлические кобальтовые и легированные азотом тонкие углеродные слои графита, соответственно, которые образуют тонкий углеродный слой, инкапсулированный металлическим , кобальтовые наноструктуры ядро-оболочка (Core-Shell Co @ NC). Тонкие углеродные слои имеют сильное взаимодействие с металлическим кобальтом, что способствует меньшей углеродной коррозии, демонстрирует отличное движение электронов и больше подвержено воздействию металлического кобальта в реакционной среде, включая формирование наноразмерной морфологии без агрегации частиц.
Комбинированное действие углерода и металлического кобальта в электродах обеспечивает более эффективную электрокаталитическую активность OER, чем электроды из драгоценных металлов, для эффективного разделения воды. Следовательно, электрод, богатый неблагородными металлами, является альтернативным, активным, стабильным и менее дорогим анодом OER для рентабельного производства газа h3 при электролизе воды в промышленных масштабах.
«Мы ожидаем, что это будет уникальный подход к разработке богатых металлами композитных наноструктур с пониженным содержанием углерода с улучшенными металлическими активными центрами, с защитой тонким углеродным слоем и сверхбыстрым движением электронов на поверхности катализатора, что улучшит электрохимические свойства. активность и стабильность электрокатализаторов », — говорит профессор Шанмугам. «Мы проведем последующие исследования, которые могут быть использованы для понимания реального механизма ООР активных частиц в присутствии наноуглеродного покрытия.«
«Мы проведем последующие исследования, которые могут быть использованы для понимания реального механизма ООР активных частиц в присутствии наноуглеродного покрытия.«
Этот результат исследования был опубликован в интернет-издании Advanced Energy Materials 11 января 2018 года, авторитетном международном журнале в области новейших материалов.
Схематическое изображение расщепления воды и возможных движений электронов через слои наноуглерода в одиночном атоме кобальта, захваченном NC. Фото: Институт науки и технологий Тэгу Кёнбук (DGIST)Интервью с профессором Сангараджу Шанмугам (Департамент энергетики и инженерии):
Q.В чем разница по сравнению с предыдущими исследованиями?
A. В предыдущих исследованиях исследователи получали металлы с углеродным покрытием из различных прекурсоров, включая металлоорганические каркасы (MOF). Полученные катализаторы демонстрируют больше углерода с пониженной графитовой природой, и углерод покрывает центры активного металла. Таким образом, большинство активных металлических центров не используются должным образом в электрохимических реакциях. Кроме того, из-за значительной углеродной коррозии эти катализаторы недостаточно подходят для медленного OER при расщеплении воды при более высоком положительном потенциале с отсутствием нестабильности в жестких условиях электролита.Соответственно, в этой работе мы приготовили богатые металлами, тонкие слои наноуглерода (NC), инкапсулированные электрокатализатором наноструктур Co @ NC ядро-оболочка из единственного аналога прекурсора берлинской синей (PB). Co @ NC показал повышенную активность выделения кислорода и сверхстабильность на токоприемнике из пены никеля. В целом, тонкие и однородные углеродные слои обеспечивают быстрое движение электронов, использование большего количества активных центров металла с легким проникновением электролита. Что наиболее важно, он может защитить активные металлические участки от коррозии с минимальным воздействием, а также сильное взаимодействие между металлическими и углеродными слоями демонстрирует синергетический эффект в отношении превосходной активности и сверхстабильности (более 350 ч) ядра-оболочки Co @ NC.
Таким образом, большинство активных металлических центров не используются должным образом в электрохимических реакциях. Кроме того, из-за значительной углеродной коррозии эти катализаторы недостаточно подходят для медленного OER при расщеплении воды при более высоком положительном потенциале с отсутствием нестабильности в жестких условиях электролита.Соответственно, в этой работе мы приготовили богатые металлами, тонкие слои наноуглерода (NC), инкапсулированные электрокатализатором наноструктур Co @ NC ядро-оболочка из единственного аналога прекурсора берлинской синей (PB). Co @ NC показал повышенную активность выделения кислорода и сверхстабильность на токоприемнике из пены никеля. В целом, тонкие и однородные углеродные слои обеспечивают быстрое движение электронов, использование большего количества активных центров металла с легким проникновением электролита. Что наиболее важно, он может защитить активные металлические участки от коррозии с минимальным воздействием, а также сильное взаимодействие между металлическими и углеродными слоями демонстрирует синергетический эффект в отношении превосходной активности и сверхстабильности (более 350 ч) ядра-оболочки Co @ NC. наноструктуры с меньшей вероятностью окисления углерода.
наноструктуры с меньшей вероятностью окисления углерода.
В. Как это можно использовать?
A. Основываясь на выдающихся характеристиках OER, кинетике и долгосрочной стабильности наноструктур Co @ NC ядро-оболочка по сравнению с современными электрокатализаторами на основе благородных металлов, такими как IrO2 и RuO2, он является наиболее эффективным. подходящий кандидат для замены электродов OER из драгоценных металлов для снижения общей стоимости системы водного электролизера. Таким образом, разработка эффективного и долговечного электрокатализатора на основе неблагородных металлов в водном электролизере является основным препятствием для успешной коммерциализации водных электролизеров.
В. Сколько времени потребуется для коммерциализации?
A. Этот процесс легко доступен для изготовления экономичных катализаторов. Но нам все еще предстоит оценить интеграцию этой каталитической системы в мембранный электролизер с полимерным электролитом. Ведутся исследования, чтобы понять механизм OER на этом электрокатализаторе. Так что для коммерциализации может потребоваться год с полным пониманием активности и стабильности.
Ведутся исследования, чтобы понять механизм OER на этом электрокатализаторе. Так что для коммерциализации может потребоваться год с полным пониманием активности и стабильности.
Q.Какие проблемы возникают при коммерциализации?
A. Мы должны сделать равномерное покрытие этого катализатора на токосъемниках большего размера без отслаивания. Поэтому нам нужно найти более подходящую методику нанесения покрытия. Кроме того, как и в случае с драгоценными электрокатализаторами OER, мы должны понимать точный механизм OER на этих электрокатализаторах, чтобы поддерживать / избегать потерь активности из-за нежелательных побочных реакций и т. Д.
В. Какова мотивация вашего исследования?
А.Основная цель этой работы — заменить драгоценный анод в системах водного электролизера на высокую активность и стабильность. Поэтому для повышения активности и стабильности мы попытались нанести очень тонкое углеродное покрытие на активные центры металла. В целом, разработка богатых металлами и безуглеродных электрокатализаторов OER с надлежащим использованием металл-активных частиц и синергетическим эффектом металл-углерод для преодоления вялой анодной реакции при электролизе воды.
В. Какой конечной цели вы хотели бы достичь с помощью этого исследования?
А.Основываясь на этом исследовании, мы понимаем, что богатые металлами электрокатализаторы являются одними из наиболее подходящих материалов для превосходной активности ООР. Поэтому мы хотим приготовить самые дешевые анодные электрокатализаторы, используя ту же самую методологию, и исключить использование драгоценных электродов в системе водного электролизера для производства экологически чистого и экологически безопасного водорода в больших масштабах.
Новый материал создает катализаторы топливных элементов за сотую часть стоимости
Дополнительная информация: Арумугам Сиванантам и др., Стабильный графитовый, инкапсулированный в нанокарбоны, обогащенный кобальтом электрокатализатор с сердечником и оболочкой в качестве кислородного электрода в водном электролизере, Advanced Energy Materials (2018).
 DOI: 10.1002 / aenm.201702838
DOI: 10.1002 / aenm.201702838Предоставлено DGIST
Ссылка : Высокоэффективный недорогой катализатор электролиза воды (14 февраля 2018 г.) получено 22 июня 2021 г. с https: // физ.org / news / 2018-02-high-efficiency-low-cost-Catalyst-electrolysis.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Контент предоставляется только в информационных целях.
Повышение эффективности разделения воды в процессе электролиза воды с помощью высокопроводящих наноматериалов при более низких напряжениях
Альфедо У., Гандиа Л.М., Санчис П. (2012) Производство водорода при электролизе воды: текущее состояние и будущие тенденции.Proc Inst Electr Electron Eng 100 (2): 410–426. https://doi.org/10.1109/JPROC.2011.2156750
Артикул Google Scholar
Асматулу Р. (2013) Безопасность нанотехнологий. Эльзевир, Амстердам
Забронировать Google Scholar
Asmatulu R, Khan A, Adigoppula G, Hwang G (2017) Улучшенные транспортные свойства тонкой мембраны Nafion ® на основе графена для топливных элементов с полимер-электролитной мембраной. Int J Energy Res 42: 508–519. https://doi.org/10.1002/er.3834
Int J Energy Res 42: 508–519. https://doi.org/10.1002/er.3834
Артикул Google Scholar
Ball M, Basile A, Veziroglu TN (2015) Сборник водородной энергии: использование водорода, безопасность и водородная экономика. Woodhead Publishing Series в Energy, Нью-Йорк
Google Scholar
Bhuyan MSA, Uddin MN, Bipasha FA, Islam MM, Hossain SS (2015) Обзор функционализированного графена, свойств и его приложений.Int J Innov Sci Res 17 (2): 303–315
Google Scholar
Бхуян М.С., Уддин М.Н., Бипаша Ф.А., Хоссейн С.С. (2016) Синтез графена. Int Nano Lett 6: 65–83. https://doi.org/10.1007/s40089-015-0176-1
Артикул Google Scholar
De Souza FR, Loget G, Padilha JC, Martini EMA, de Souza MO (2008) Молибденовые электроды для производства водорода электролизом воды с использованием ионных жидких электролитов. Electrochem Commun 10: 1673–1675. https://doi.org/10.1016/j.elecom.2008.08.029
Electrochem Commun 10: 1673–1675. https://doi.org/10.1016/j.elecom.2008.08.029
Артикул Google Scholar
Desai FJ, Dave P, Tailor H (2014) Оценка производительности и выбросов окси-газа в 4-тактном двигателе. Int J Mech Eng Technol 5 (9): 455–462
Google Scholar
Дубей П.К., Синха АСК, Талапатра С., Кораткар Н., Аджаян П.М., Шривастава О.Н. (2010) Производство водорода путем электролиза воды с использованием анода из углеродных нанотрубок.Int J Hydrog Energy 35: 3945–3950. https://doi.org/10.1016/j.ijhydene.2010.01.139
Артикул Google Scholar
Эспозито В.Д., Хант С.Т., Киммел Ю.К., Чен Дж.Г. (2012) Новый класс электрокатализаторов для получения водорода путем электролиза воды: монослои металлов, нанесенные на недорогие карбиды переходных металлов. J Am Chem Soc 134: 3025–3033. https://doi. org/10.1021/ja208656v
org/10.1021/ja208656v
Артикул Google Scholar
Freda C, Nanna F, Villone A, Barisano D, Brandani S, Cornacchia G (2019) Воздушная газификация дигестата и его совместная газификация с остаточной биомассой в пилотной вращающейся печи.Int J Energy Environ Eng 8: 1–12. https://doi.org/10.1007/s40095-019-0310-3
Артикул Google Scholar
Технический отчет Международного энергетического агентства (2013 г.) 2013 г. Ключевые мировые источники энергии. Статистика. http://www.iea.org/publications/freepublications/publication/KeyWorld2013_FINAL_WEB.pdf
Jayabal S, Saranya G, Wu J, Liu Y, Geng D, Meng X (2017) Понимание высоких электрокаталитических характеристик двумерных нанолистов MoS 2 и их композиционных материалов.J Mater Chem A 5: 24540–24563
Артикул Google Scholar
Камински М. П. (2007) Каталитическая активность интерметаллидов на основе Pt для получения водорода — влияние ионного активатора. Appl Catal A Gen 321: 93–99. https://doi.org/10.1016/j.apcata.2007.01.036
П. (2007) Каталитическая активность интерметаллидов на основе Pt для получения водорода — влияние ионного активатора. Appl Catal A Gen 321: 93–99. https://doi.org/10.1016/j.apcata.2007.01.036
Артикул Google Scholar
Кришна С.В., Кумар П.К., Верма К., Бхагаван Д., Химабинду В., Нарасу М.Л., Сингх Р. (2019) Повышение уровня производства биогидрогена из отработанных промывных стоков винокурни с использованием процесса электрокоагуляции.Energy Ecol Environ 4 (4): 160–165. https://doi.org/10.1007/s40974-019-00122-9
Артикул Google Scholar
Кумар SSA, Уддин М.Н., Рахман М.М., Асматулу Р. (2018) Внедрение тонких пленок графена в композитные структуры из углеродного волокна для защиты от ударов молнии. Polym Compos 40 (S1): E517 – E525
Артикул Google Scholar
Merki D, Fierro S, Vrubel H, Hu X (2011) Аморфные пленки сульфида молибдена как катализаторы электрохимического производства водорода в воде.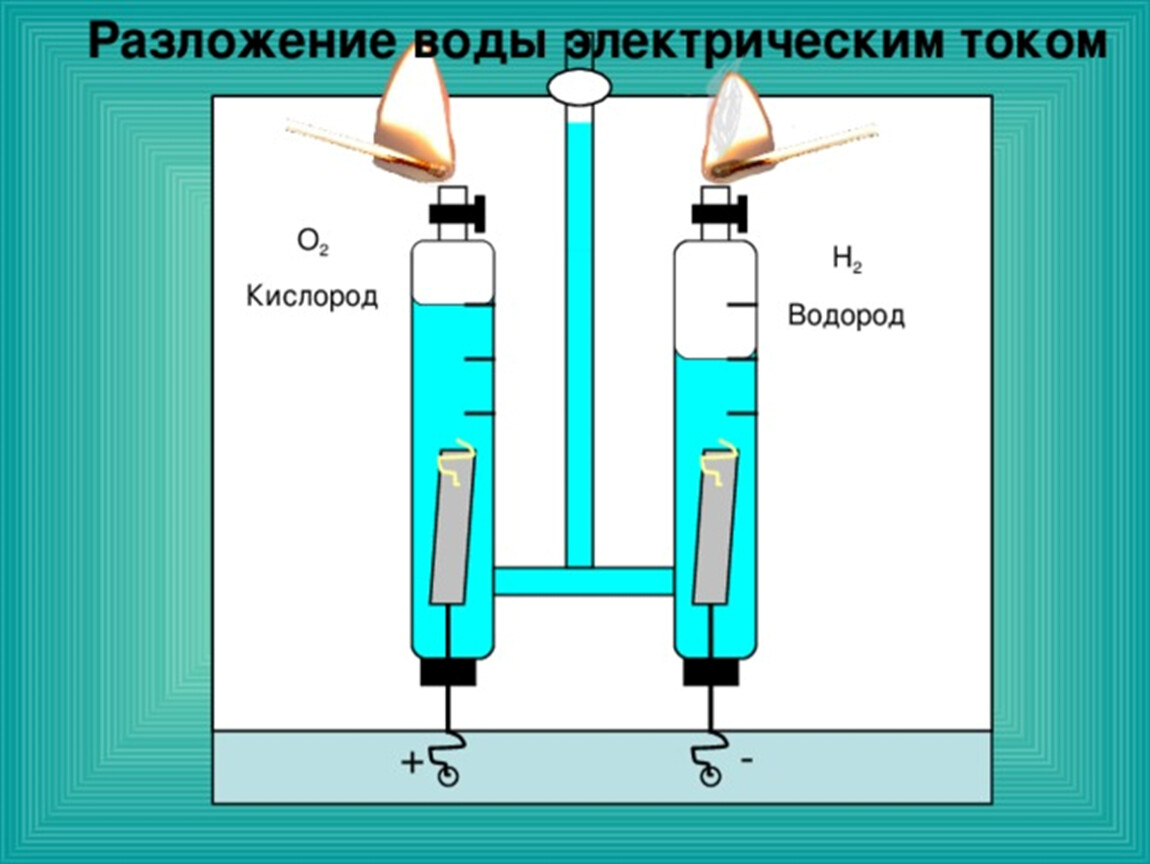 Chem Sci 2: 1262–1267. https://doi.org/10.1039/C1SC00117E
Chem Sci 2: 1262–1267. https://doi.org/10.1039/C1SC00117E
Артикул Google Scholar
Nageshkar V, Srikanth M, Jurak E, Asmatulu R (2013) Влияние проводящих наноматериалов на производство водорода во время электролиза. В: Международный конгресс и выставка машиностроения ASME, Сан-Диего, Калифорния, 2014 г., https://doi.org/10.1115/imece2013-66512
Nuraje N, Asmatulu R, Mul G (2015) Зеленые фотоактивные наноматериалы: устойчивая энергетика и восстановление окружающей среды.Издательство RSC Publishing, Кембридж
Книга Google Scholar
Patel CRP, Tripathi P, Vishwakarma AK, Talat M, Soni PK, Yadav TP, Srivastava ON (2018) Повышенное образование водорода при электролизе воды с использованием композитов с углеродной наноструктурой. Int J Hydrog Energy 43: 3180–3189. https://doi.org/10.1016/j.ijhydene.2017.12.142
Артикул Google Scholar
Сакинтуна Б. , Ламари-Даркрим Ф, Хиршер М. (2007) Металлогидридные материалы для хранения водорода: обзор.Int J Hydrog Energy 32 (9): 1121–1140. https://doi.org/10.1016/j.ijhydene.2006.11.022
, Ламари-Даркрим Ф, Хиршер М. (2007) Металлогидридные материалы для хранения водорода: обзор.Int J Hydrog Energy 32 (9): 1121–1140. https://doi.org/10.1016/j.ijhydene.2006.11.022
Артикул Google Scholar
Салахуддин М., Уддин М.Н., Хванг Г., Асматулу Р. (2018) Супергидрофобные нановолокна PAN для газодиффузионных слоев топливных элементов с протонообменной мембраной для управления катодной водой. Int J Hydrog Energy 43 (25): 11530–11538. https://doi.org/10.1016/j.ijhydene.2017.07.229
Артикул Google Scholar
Тао Х, Гао Й, Талреджа Н., Гуо Ф, Текстер Дж, Ян С., Сан Зи (2017) Двумерные нанолисты для электрокатализа при производстве и преобразовании энергии.J Mater Chem A 5: 7257–7284
Статья Google Scholar
Уддин М.Н., Хуанг З.Д., Май Ю.В., Ким Дж.К. (2014) Свойства разрушения при растяжении и разрыве бумаги из оксида графена, интеркалированной углеродными нанотрубками. Углерод 77: 481–491. https://doi.org/10.1016/j.carbon.2014.05.053
Углерод 77: 481–491. https://doi.org/10.1016/j.carbon.2014.05.053
Артикул Google Scholar
Уддин М.Н., Диллон М., Мисак Х., Асматулу Р. (2018) Пострастущие УНТ на проволоке УНТ для изучения изменений физических свойств.В: Конференция выставки Composite and Advanced Materials Expo (CAMX), Даллас, Техас
Uddin MN, Le L, Nair R, Asmatulu R (2019) Влияние тонких пленок оксида графена и нанокомпозитных покрытий на огнестойкость и термостойкость самолетов композиты: сравнительное исследование. J Eng Mater Technol 141 (3): 031004. https://doi.org/10.1115/1.4042663
Артикул Google Scholar
Ван М., Ван З., Гонг З., Го З (2014) Технологии интенсификации электролиза воды для производства водорода — обзор.Renew Sustain Energy Rev 29: 573–588. https://doi.org/10.1016/j.rser.2013.08.090
Артикул Google Scholar
Yoro KO, Sekoai PT, Isadiade AJ, Daramola MO (2019) Обзор методов интеграции тепла и массы для минимизации энергии и материалов во время улавливания CO 2 . Int J Energy Environ Eng 10: 1–21. https://doi.org/10.1007/s40095-019-0304-1
Артикул Google Scholar
Новый процесс расщепления воды может дать толчок «зеленой» водородной экономике
Австралийские ученые утверждают, что они разработали гораздо более дешевый и эффективный способ выделения водорода из воды с использованием легко добываемых катализаторов из железа и никеля вместо дорогие, редкие рутениевые, платиновые и иридиевые катализаторы, предпочитаемые нынешними крупными производителями водорода, которые буквально в тысячи раз дороже.
Многое делается из развивающейся идеи «водородной экономии», согласно которой сжатое водородное топливо станет таким же распространенным источником энергии, как бензин, а автомобили на топливных элементах займут место в транспортной системе наряду с двигателями внутреннего сгорания и электромобилями.
Вчера мы писали о первом в мире судне для перевозки жидкого водорода, предназначенном для перевозки по воде водорода, произведенного в Австралии, для использования в Японии в качестве экологически чистой энергии. Однако прямо сейчас Австралия производит водород одним из самых грязных способов: используя бурый уголь, процесс, который требует 160 тонн угля для производства трех тонн сжатого жидкого водорода с чудовищными 100 тоннами углекислого газа в качестве побочного продукт.
Водородный пирог «чистой энергии», особенно в Японии и Корее, оценивается в триллионы долларов в ближайшие десятилетия, поэтому многие старатели ощущают огромные возможности экспорта энергии, но на самом деле, пока математика не начнет складываться. При использовании более экологически чистых способов производства водорода экологические издержки производства этого вещества в больших количествах могут быть огромными.
«Зеленый» способ получения водорода — выделение его из воды с помощью электролиза. Вы наливаете воду в емкость с парой электродов и включаете питание.Кислород собирается на аноде, водород — на катоде, и если электричество, которое вы вкладываете в этот процесс, было устойчивым, то поздравляю, у вас есть достаточно зеленого водорода — до тех пор, пока вы не возите его в дизельных грузовиках. и корабли, и энергия, которую вы используете для сжатия и суперохлаждения, тоже зеленая.
Проблема до сих пор заключалась в том, что расщепление воды дорого и неэффективно, что затрудняет конкуренцию зеленого водорода с коричневым водородом или даже бензином.Все это делает недавнюю разработку исследовательской группы из трех крупных австралийских университетов — UNSW, Griffith и Swinburne — интересной и важной.
В статье, опубликованной в Nature Communications , команда заявила, что ей удалось заменить дорогостоящую платину на углеродном катализаторе, используя «катализатор на основе наночастиц Януса с границей раздела никель-оксид железа», и что полученная схема смогла чтобы разделить воду с «насколько нам известно, наивысшей энергоэффективностью» (83.7 процентов), о которых сообщалось на сегодняшний день ».
« Мы покрываем электроды нашим катализатором, чтобы снизить потребление энергии », — говорит профессор Химической школы UNSW Чуан Чжао.« На этом катализаторе есть крошечный наноразмерный интерфейс, на котором железо и никель встречаются на атомарном уровне, который становится активным местом для расщепления воды. Именно здесь водород может быть отделен от кислорода и захвачен в качестве топлива, а кислород может быть выпущен как экологически безопасные отходы ».
«Наноразмерный интерфейс коренным образом меняет свойства этих материалов», — продолжает он.«Наши результаты показывают, что никель-железный катализатор может быть таким же активным, как и платиновый, для производства водорода. Дополнительным преимуществом является то, что наш никель-железный электрод может катализировать образование как водорода, так и кислорода, поэтому мы можем не только сократить производственные затраты за счет использования элементов, богатых землей, но также и затраты на производство одного катализатора вместо двух ». Еще неизвестно, как это развитие может повлиять на стоимость крупномасштабного производства водорода, но Чжао настроен очень оптимистично: «Мы говорили о водородной экономике целую вечность, но на этот раз похоже, что это действительно произойдет.
Также еще предстоит выяснить, смогут ли такие страны, как Австралия, получить достаточно солнечных или ветряных генераторов, построенных для того, чтобы быть экспортерами действительно «зеленого» водорода в масштабах, способных существенно снизить уровень смога в Токио или Сеуле. Или, действительно, если такие голодные к экспорту страны пожалеют о том, что отправили за границу большие объемы воды в виде топлива. До тех пор, пока каучук не встретится с дорогой в международной цепочке поставок водорода, кажется, что есть основания для здорового скептицизма.
Источник: Университет Нового Южного Уэльса
% PDF-1.7 % 687 0 объект > эндобдж xref 687 97 0000000016 00000 н. 0000003446 00000 н. 0000003748 00000 н. 0000003800 00000 н. 0000004160 00000 н. 0000004346 00000 п. 0000004718 00000 н. 0000004755 00000 н. 0000005024 00000 н. 0000005287 00000 н. 0000006423 00000 н. 0000006861 00000 н. 0000007116 00000 н. 0000007596 00000 п. 0000008076 00000 н. 0000008570 00000 н. 0000008819 00000 н. 0000009399 00000 н. 0000009655 00000 н. 0000035024 00000 п. 0000064716 00000 п. 0000108853 00000 н. 0000129626 00000 н. 0000148533 00000 н. 0000151184 00000 н. 0000151248 00000 н. 0000151312 00000 н. 0000151609 00000 н. 0000151961 00000 н. 0000152436 00000 н. 0000274350 00000 н. 0000274422 00000 н. 0000274526 00000 н. 0000274616 00000 н. 0000274671 00000 н. 0000274768 00000 н. 0000274823 00000 н. 0000275018 00000 н. 0000275073 00000 н. 0000275190 00000 н. 0000275321 00000 н. 0000275475 00000 н. 0000275530 00000 н. 0000275702 00000 н. 0000275802 00000 н. 0000275998 00000 н. 0000276053 00000 н. 0000276209 00000 н. 0000276337 00000 н. 0000276512 00000 н. 0000276567 00000 н. 0000276781 00000 н. 0000276835 00000 н. 0000276983 00000 н. 0000277075 00000 н. 0000277226 00000 н. 0000277280 00000 н. 0000277335 00000 н. 0000277456 00000 н. 0000277510 00000 н. 0000277564 00000 н. 0000277619 00000 н. 0000277674 00000 н. 0000277729 00000 н. 0000277902 00000 н. 0000277957 00000 н. 0000278012 00000 н. 0000278067 00000 н. 0000278243 00000 н. 0000278467 00000 н. 0000278613 00000 н. 0000278668 00000 н. 0000278762 00000 н. 0000278856 00000 н. 0000278984 00000 н. 0000279039 00000 н. 0000279137 00000 н. 0000279241 00000 н. 0000279371 00000 н. 0000279426 00000 н. 0000279511 00000 н. 0000279566 00000 н. 0000279621 00000 н. 0000279730 00000 н. 0000279785 00000 н. 0000279840 00000 н. 0000279895 00000 н. 0000279950 00000 н. 0000280005 00000 н. 0000280060 00000 н. 0000280115 00000 н. 0000280209 00000 н. 0000280319 00000 п. 0000280374 00000 п. 0000280429 00000 н. 0000003254 00000 н. 0000002281 00000 н. трейлер ] / Назад 455152 / XRefStm 3254 >> startxref 0 %% EOF 783 0 объект > поток h ޔ TKLQ = ZNR (TPU- uPEDD * nX] 1Q7 & Ҙpa \ ՝ Qb \ ogEэ / soe? @ | fD! RlZ1ƩM) s)} m & DxOSh4 fs ߐ Tw] NI> t | Wf * Zb`M8] n 푥 ‘w [uME] j} m + ZvWmW / Ԗ.2dYv {‘1YNeXf1 # Ha` Y2H q1, / et] v ռ H87)> dЏc «ם? ˦9 fUF # p, w վ Ѩ0} d_8 $ ʍ.l | \ 9! * 8P d
Производство водорода при электролизе воды: роль катализаторов | Нано-конвергенция
Как указывалось ранее, ООР является другой ключевой полуреакцией в реакции расщепления воды. Эта реакция происходит на аноде и включает процесс переноса четырех электронов, который требует чрезвычайно высокого перенапряжения по сравнению с HER. Известно, что ООР является основным узким местом в повышении общей эффективности электрохимического расщепления воды.Следовательно, крайне важно искать высокоэффективные катализаторы OER, которые могут эффективно снизить кинетическое ограничение. Значительный прогресс был достигнут в недавнем развитии понимания механизма OER для рационального проектирования электрокатализаторов OER. Широко признано, что OER может протекать по двум различным механизмам: обычному выделению адсорбата (AEM) и решеточному кислородно-опосредованному механизму (LOM), которые обсуждаются в двух из следующих подразделов.
Реакционные стадии в OER — механизм выделения адсорбата (AEM)
Для OER, механизм выделения адсорбата (AEM) обычно использовался для описания различных стадий реакции.{-} + {\ text {M}}. $
(3д)
Рис. 9(Рисунок перепечатан с разрешения [57])
a Механизмы OER в кислотных (синяя линия) и щелочных (красная линия) электролитах (Рисунок перепечатан с разрешения из [5]) ). b Диаграмма свободной энергии при U = 0 и U = 1,23 В для OER на идеальном катализаторе (рисунок перепечатан с разрешения [55]). c Зависимость между энергиями адсорбции * OOH и * OH на серии оксидных катализаторов OER (рисунок перепечатан с разрешения Ref.[56]). d Вулканообразная зависимость между активностями ООР на поверхностях оксидов металлов и энтальпией для оксидов переходных металлов в кислотном (черный квадрат) и основном растворе (белый квадрат)
Во-первых, гидроксид-анионы адсорбируются на активном центре металла с образованием M – OH. Затем M – OH после депротонирования образует M – O. После этого существует два разных пути образования молекул O 2 . Один из способов состоит в том, что M – O реагирует с OH – с образованием промежуточного соединения M – OOH, производя O 2 посредством депротонирования M – OOH с регенерацией активного центра.Другой путь, показанный зеленым путем на рис. 9a, включает объединение двух частиц M – O и их превращение в O 2 вместе с регенерацией активного центра M, который, как считается, имеет большой активационный барьер. . Что касается механизма кислотного OER, общее мнение состоит в том, что участвуют те же промежуточные соединения, как M – OH, M – O и M – OOH. Для электрокатализа OER детальное понимание силы связывания промежуточных продуктов реакции на поверхности электрода имеет решающее значение для улучшения общих характеристик OER, поскольку сила связывания является ключевым параметром, определяющим перенапряжение реакции.
Как показано на диаграмме идеальной свободной энергии различных стадий реакции в OER на рис. 9b, для возникновения OER не требуется перенапряжения, если щель свободной энергии для каждой из элементарных стадий останется неизменной на уровне 1,23 эВ [ 55]. Однако достичь этого идеального случая практически невозможно. Перенапряжение OER определяется этапом определения скорости (RDS), который исходит из этапа с наиболее положительной свободной энергией реакции (ΔG) на четырех этапах. На основе базы данных различных моделей оксидных катализаторов существует масштабная зависимость (линейная корреляция), установленная в AEM с точки зрения энергий связи этих промежуточных соединений (M – OH, M – OOH и M – O), как показано на Инжир.9c. Энергии связи адсорбированных M – OH и M – OOH имеют постоянную разницу в 3,2 эВ (ΔG HOO * — ΔG HO * ). Это связано с тем, что как HOO *, так и HO * связываются с поверхностью катализатора через аналогичные адсорбционные конфигурации с атомом кислорода через одинарную связь [56]. Согласно масштабному соотношению, существует минимальное теоретическое перенапряжение 0,37 эВ ((3,2 — 1,23 * 2 эВ) / 2), которое представляет собой разницу между постоянной разницей в энергии связи (3,2 эВ) и идеальным значением 2.46 эВ.
Более того, поскольку вторая (образование M – O) и третья стадии (образование M – OOH) рассматриваются как RDS в большинстве катализаторов OER, разница между ΔG O * и ΔG HO * используется как универсальный дескриптор для прогнозирования их активности OER. Это представлено вулканической зависимостью Сабатье, которая традиционно использовалась для объяснения тенденций активности ООР для оксидов металлов как в кислой, так и в щелочной среде. Лучшими катализаторами с точки зрения самого низкого теоретического перенапряжения для OER являются IrO 2 и RuO 2 , которые демонстрируют оптимальную прочность связывания на поверхности катализатора, т.е.е., ни слишком сильным, ни слишком слабым, как показано на рис. 9d [57].
Электрокатализаторы OER
В таблице 2 перечислены некоторые выбранные электрокатализаторы OER с точки зрения их дескрипторов производительности, которые будут дополнительно обсуждаться в следующих разделах при различных условиях реакции. Существует два основных типа электрокатализаторов на основе ООР: электрокатализаторы на основе благородных металлов и электрокатализаторы на основе неблагородных металлов. Для электрокатализаторов на основе благородных металлов катализаторы на основе Ru и Ir считаются самыми современными электрокатализаторами для OER, особенно в кислотном электролите, который имеет большее сопротивление растворению по сравнению с другими металлами.Чтобы снизить высокую цену, улучшить активность электрокатализатора, стабильность и даже усилить сопротивление растворению в кислой среде, существует несколько стратегий для разработки и оптимизации состава, структуры и морфологии катализатора. Помимо Ir и Ru, другие благородные металлы, такие как катализаторы на основе Rh, Au, Pt и Pd, также были разработаны в качестве бифункциональных или трехфункциональных электрокатализаторов, которые показывают многообещающие характеристики для OER, HER и реакции восстановления кислорода (ORR). . Что касается катализаторов на основе неблагородных металлов, электрокатализаторы на основе оксидов и (окси) гидроксидов с высоким содержанием земли вызывают большой интерес для ООР, особенно оксидов и (окси) гидроксидов на основе Ni-Fe, некоторые из которых являются наиболее распространенными ООР. катализатор, применяемый в промышленных разработках.В следующих подразделах мы выделим различные стратегии, которые применяются для дальнейшего повышения активности и стабильности электрокатализаторов на основе NiFe.
Таблица 2 Сводка показателей OER заявленных электрокатализаторовЭлектрокатализаторы на основе благородных металлов
Электрокатализаторы на основе благородных металлов и оксидов металлов долгое время считались наиболее мощными электродными материалами в ООР. Примеры включают RuO 2 и IrO 2 , которые обычно рассматриваются как современные электрокатализаторы для OER.Однако высокая цена и серьезное растворение RuO 2 и IrO 2 являются основными проблемами, которые привлекают большое внимание модификации катализаторов для обеспечения оптимизации состава и структуры / морфологии. Было предложено несколько стратегий для повышения активности и стабильности электрокатализатора и снижения его высокой стоимости.
Гетероатомное легирование для настройки состава электрокатализаторов ООР на основе IrO 2 вызвало большой интерес.Однако разные гостевые атомы генерировали различные энергетические домены для системы-хозяина. Chen et al. получен RuO 2 , легированный медью, с полой пористой полиэдрической морфологией, состоящий из ультрамалых нанокристаллов, путем термического разложения производных металлоорганического каркаса (MOF), замененных Ru. Катализатор демонстрирует замечательные характеристики OER с низким перенапряжением 188 мВ при 10 мА · см –2 в кислотном электролите и отличной стабильностью при испытаниях на долговечность в течение 10 000 циклов [58].Данные просвечивающей электронной микроскопии высокого разрешения (HRTEM) и XRD показывают, что Cu включена в решетку RuO 2 с образованием рутиловой фазы RuO 2 , легированной медью, как показано границами поверхности с высоким показателем преломления на рис. 10a. Высокая активность OER приписывается поверхности с высоким индексом, которая содержит сильно недокоординированные сайты Ru (CN = 3), которые могут эффективно снижать перенапряжение OER, как показано расчетом DFT на рис. 10b. Образование * OOH на RuO 2 (110) (рис. 10б) оказалось RDS с энергетическим барьером 0.78 эВ. Для других граней с высоким показателем преломления поверхности RuO 2 (111) требуется всего 0,66 эВ для преодоления энергетического барьера, что способствует уменьшению перенапряжения на 120 мВ. Cu-допант RuO 2 не только может индуцировать образование ненасыщенных позиций Ru за счет генерируемых допант Cu O вакансий на поверхности, но также может модулировать электронную структуру, которая демонстрирует широкую область связывания, близкую к уровню Ферми p-зоны. центр, ведущий к усилению деятельности ООР.
Рис. 10(Рисунок перепечатан с разрешения [58])
a ПЭМ высокого разрешения (ПЭМВР) RuO, легированного медью 2 с указанием граней поверхности с высоким показателем преломления. b Профиль свободной энергии OER на поверхностях (110) и (111)
Легирование Ru или Ir другими переходными металлами — интригующая стратегия для разработки катализаторов OER, которые могут эффективно изменять электронную структуру и оптимизировать энергию адсорбции промежуточные продукты реакции.Zhang et al. [59] разработали класс катализаторов IrM (M = Ni, Co, Fe) с уникальной сетчатой структурой, состоящей из переплетенных непористых нанопроволок, с помощью стратегии самотемпинга, направленной на эвтектику. Результаты показывают свойство, зависящее от переходного металла. По сравнению с НП IrFe и НП IrCo, НП IrNi демонстрируют лучшую активность OER с самым низким перенапряжением 283 мВ при 10 мА · см -2 . Высокая активность IrNi NW была объяснена результатами расчетов методом DFT (рис. 11). Во время процесса OER Ir и M окисляются под высоким потенциалом с образованием IrMO x. Центры d-полосы для IrO 2 , IrFeO x , IrCoO x и IrNiO x составляют -3,61, -3,72, -4,09 и -4,34 эВ соответственно (рис. 11а). Происходит отрицательный сдвиг плотности состояния (DOS). Смещение центра d-зоны Ir вниз указывает на то, что электроны d-зоны распределяются от уровня Ферми, что вызвано эффектом лиганда после легирования. Как показано на рис. 11b – d, активность OER сильно зависит от энергий связи O, OH и OOH.Следовательно, введение 3d-переходных металлов может сместить центр d-полосы Ir вниз и ослабить адсорбционную силу промежуточных частиц реакции, что приведет к проявлению активности OER, зависящей от 3d-переходного металла.
Рис. 11(Рисунок перепечатан с разрешения [59])
a Прогнозируемая DOS полос Ir 5d для IrO 2 и модели IrMOx. b — d Взаимосвязь между активностью (обозначается логарифмом измеренной плотности тока при 1.55 В по сравнению с RHE) и энергий связи различных промежуточных частиц: b O, c OH и d OOH
Модификации структуры поверхности играют чрезвычайно важную роль в выявлении каталитически активных центров и использовании преимущества межфазный эффект. Регуляция морфологии как один из аспектов модификации структуры поверхности привлекает все большее внимание. Например, было доказано, что полые наночастицы, такие как наноклетки, нанооболочки и нанокристаллы, обладают повышенной каталитической активностью, отражая их наиболее открытую структуру с увеличенными каталитически активными центрами.Ли и др. [60] продемонстрировали, что полиметаллический двухслойный нанокаркасный электрокатализатор на основе Ir может быть сформирован путем простого одностадийного синтеза. Данные HAADF-STEM, TEM, HRTEM и элементного картирования показали, что желаемая структура IrNiCu DNF сохраняет ромбическую додекаэдрическую морфологию после сильного кислотного травления и имеет равномерное распределение компонентов во всей структуре DNF (тройной сплав), как показано на рис. 12А. Превосходная электрокаталитическая активность и долговечность катализатора IrNiCu для OER объясняются каркасной структурой, которая предотвращает укрупнение и агломерацию частиц и образование in situ прочной фазы рутила IrO 2 во время процесса OER.Также показано, что контроль морфологии влияет на электрическую проводимость катализатора, что улучшает электрокаталитическую активность OER. Ли и др. синтезировали ультратонкие наноиглы IrO 2 (рис. 12B (a, b)) методом масштабируемой расплавленной соли, которые показывают лучшую активность и стабильность OER по сравнению с наночастицами IrO 2 . Как показано электрохимическими характеристиками наноигл IrO 2 и IrO 2 для ООР на рис. 12B (c, d), наноиглы IrO 2 демонстрируют лучшую активность и стабильность, чем наночастицы IrO 2 .По сравнению с электропроводностью 25,9 См см −1 для неформованных наночастиц IrO 2 , проводимость ультратонких наночастиц IrO 2 составляет 318,3 См см −1 , что позволяет предположить, что форма катализатора играет важную роль. роль в переносе электрона вызвала высокую активность ОЭР [61].
Рис. 12(Рисунок перепечатан с разрешения [61])
A HAADF-STEM, TEM, HRTEM и элементарное отображение желаемой структуры IrNiCu DNF (рисунок перепечатан с разрешения Ref.[60]). B (a, b) ПЭМ-изображения наночастиц IrO 2 и наночастиц IrO 2 , (c, d) характеристики OER до и после 2-часовой гальваностатической операции, (c) кривые LSV для IrO 2 NN и неформованные наночастицы, (d) Tafel slope
Нобелевские металлы, кроме Ir и Ru, такие как Rh, Au, Pt и Pd, также стали жизнеспособными электрокатализаторами OER. Конструкция катализаторов Pt, Pd, Ru и Au включает создание бифункциональных или трехфункциональных электрокатализаторов для OER, реакции восстановления кислорода (ORR) и реакции выделения водорода (HER).Поскольку Rh, Pt, Au и Pd имеют меньшее сопротивление растворению, чем Ir и Ru в кислотном электролите с большим перенапряжением, оценка их поведения OER обычно проводилась в щелочном растворе. Возможность контролировать морфологию и состав катализаторов имеет решающее значение для достижения желаемых электрокаталитических свойств. Лу и др. [62] продемонстрировали дизайн наночастиц AuCo в качестве катализаторов ООР в щелочных средах. Наночастицы AuCo демонстрируют однородное распределение по размерам со структурой ядро – оболочка (рис.13а). Катализаторы показали зависимость активности от состава, демонстрируя максимальную активность OER для соотношения Au: Co 2: 3, как показано на рис. 13c [62]. Наночастицы AuCo частично легированы сегрегированными фазами ГЦК-Au, ГПУ-Со и ГЦК-Co, как обнаружено с помощью XRD. Поверхностные участки наночастиц AuCo, частично сегрегированные по фазам, демонстрируют бифункциональную синергию Co и Au, где Co действует как активный центр в более высоком валентном состоянии, тогда как поверхность Au служит сильным стоком электронов, способствующим различным этапам OER (рис.13б).
Рис. 13(Рисунок перепечатан с разрешения [62])
a ПЭМ-изображения наночастиц ядро-оболочка AuCo (вставка: ПЭМ с большим увеличением, показывающая полосы решетки, соответствующие ГЦК Au и ГЦК Со ), b схематическая иллюстрация OER на частично сегрегированных фазах наночастиц AuCo, c сравнение каталитической активности при 1,67 В в 0,1 М КОН. На вставке: поляризационные кривые (а) Au 23 Co 77 / C, (б) Au 40 Co 60 / C, (в) Au 71 Co 29 / C, (г) Au 95 Co 5 / C, (m) CoO x / C, (n) Au / C в 0.1 M KOH
Электрокатализаторы на основе неблагородных металлов
Электрокатализаторы OER, не содержащие благородных металлов, привлекли значительный интерес исследователей из-за их низкой стоимости и большого количества поставок. Все больше усилий было направлено на поиск эффективных электрокатализаторов OER, не содержащих благородных металлов. За последние десятилетия был достигнут значительный прогресс в демонстрации превосходной каталитической активности, сравнимой с катализатором из благородных металлов. В этом подразделе мы выделим некоторые недавние стратегии с точки зрения увеличения активных центров путем управления морфологией, манипулирования составом, настройки электронной структуры и энергии связи промежуточных продуктов посредством элементарного легирования, инженерии дефектов и улучшения электропроводности и переноса электронов за счет включения гибридные структуры в композиты для рационального проектирования высокоэффективных электрокатализаторов ООР.
Недавно Zhang et al. [63] приготовили гелеобразный оксигидроксид FeCoW (W, Fe-легированный CoOOH, G-FeCoW) с однородным распределением металла методом золь-гель-изготовления. Оксигидроксид FeCoW показал самое низкое перенапряжение 191 мВ при плотности тока 10 мА · см -2 и стабильности цикла 500 ч. По своим характеристикам превосходит эталонный катализатор на основе Ni – Fe. На рис. 14а сравниваются перенапряжения при плотности тока 10 мА · см -2 для Au (111), GCE (стеклоуглеродный электрод) и позолоченной пены Ni.Результат показывает, что каталитическая активность G-FeCoW намного выше, чем у отожженного A-FeCoW, гелеобразного FeCo без W (G-FeCo) и LDH FeCo на различных подложках. Синергетический эффект оксигидроксида Со, допированного Fe и W, позволил получить оптимальную энергию адсорбции промежуточного OH, что подтверждается теорией функции плотности (DFT) плюс поправка Хаббарда U, т. Е. Расчет DFT + U, который широко используется в первую очередь. изучение принципов некоторых сильно коррелированных систем (рис. 14б). Расчетное теоретическое перенапряжение OER, представленное на двумерном (2D) графике вулкана (рис.14c), проявляет значительно повышенную каталитическую активность по отношению к OER. Теоретическое перенапряжение всего 0,4 В получается путем модуляции локальной электронной и геометрической среды.
Рис. 14(Рисунок перепечатан с разрешения [63])
a Перенапряжения, полученные из поляризационных кривых OER для Au (111), GCE (стеклоуглеродный электрод) и позолоченной пены Ni при 10 мА см −2 . b Иллюстрация настройки энергетики промежуточных продуктов OER на CoOOH посредством легирования Fe и W. c Карта активности OER для чистых оксигидроксидов Fe, Co и W, оксигидроксидов Co, легированных Fe, вольфрамата кобальта и оксидов W, рассчитанная с помощью DFT + U
Разработка дефектов — еще один эффективный способ регулирования структурных и электронных свойств электрокатализаторы. Повышение активности OER может быть достигнуто путем модуляции промежуточной энергии адсорбции, которая иногда приводит к неожиданным активным центрам. Dai et al. сообщили о способе создания достаточного количества кислородных вакансий с помощью стратегии плазменной гравировки на нанолисте Co 3 O 4 .Анализ катализаторов с помощью SEM и TEM показал, что нанолист Co 3 O 4 с плазменной гравировкой имеет шероховатую, прерывистую и рыхлую поверхность с увеличенным экспонированием площади поверхности. Кроме того, Co 3+ частично восстанавливается до Co 2+ обработкой плазмой Ar с образованием кислородных вакансий, что подтверждается рентгеновской фотоэлектронной спектроскопией (XPS). Этот метод позволяет не только получить большую площадь поверхности, но и изменить его электронную структуру, контролируя соотношение Co 2+ / Co 3+ , что приводит к превосходной каталитической активности OER с перенапряжением 153 эВ при плотности тока 10 мА. см −2 [64].Помимо внутреннего изменения оптимальной энергии поглощения промежуточных частиц, способность настраивать перенос электронов имеет решающее значение для улучшения активности OER. Дуан и др. выполнили in situ рост трехмерных пористых пленок вертикально ориентированных нанопластин NiFe-LDH (многослойный двойной гидроксид) (НЧ NiFe-LDH) на пенопласте никеля (рис. 15a). Катализатор демонстрирует небольшое перенапряжение 151 мВ при 30 мА · см -2 лучше, чем катализатор с 20 мас.% Ir / C, и обладает значительной долговечностью [65]. Наблюдаемая высокая электрокаталитическая активность была приписана синергетическому эффекту трехмерной пористой структуры, которая обеспечивает большую площадь поверхности с высокой плотностью активных центров.Подложка из вспененного никеля, как показано на рис. 15A (b), считается идеальной подложкой на основе ее пористой структуры и металлической электронной проводимости, которая ускоряет перенос электронов, участвующий в OER. Для исследования активной фазы использовали метод комбинационного рассеяния in situ (рис. 15A (c)). При потенциале выделения кислорода обнаруженные новые полосы указывают на преобразование СДГ в NiOOH, демонстрируя, что NiOOH является активной фазой для OER. Включение Fe в гидроксид Ni в активном центре может создать более активный центр для повышения активности OER.Доу и др. [66] синтезировал легированный Fe нанолист Ni (OH) 2 , обладающий нанопористой структурой поверхности с большим количеством дефектов, с помощью простого и универсального процесса катионообмена, который демонстрирует повышенную активность ОЭР. По сравнению с типичными нанолистами из слоистого двойного гидроксида (LDH) NiFe, богатые дефектами нанолисты Ni 0,83 Fe 0,17 (OH) 2 демонстрируют самое низкое перенапряжение 245 мВ при плотности тока 10 мА · см −2. . Превосходная активность OER объясняется сочетанием обогащенных активных участков поверхности, большого количества дефектов и повышенной смачиваемости поверхности.Успех в использовании процесса катионообмена для получения активного нанолиста Co (OH) 2 , легированного Fe, продемонстрировал новый путь для изготовления высокоэффективных катализаторов OER.
Рис. 15(Рисунок перепечатан с разрешения [67])
A (a) Схематическое изображение нанопластин NiFe-LDH, выращенных на пене никеля, (b) СЭМ-изображение пены Ni, (c ) спектры комбинационного рассеяния in situ пленок NiFe-LDH с OER и без него (рисунок перепечатан с разрешения из Ref.[65]). B iR-скорректированные поляризационные кривые LSV для Ni 0,83 Fe 0,17 (OH) 2 , NiFe LDH и Ni (OH) 2 (Рисунок перепечатан с разрешения [66]). C СЭМ изображения (a) Ni x Fe 1 − x Se 2 и (b) Ni x Fe 1 − x Se 2 -До (c) сравнение Ni x Fe 1 − x Se 2 и Ni x Fe 1 − x Se 2 -Do на изображениях элементарного картирования
Большинство катализаторов неблагородных металлов включают оксиды металлов и (окси) гидроксиды.В последнее время многие другие многообещающие электрокатализаторы демонстрируют отличную каталитическую активность OER, которые состоят из фосфидов, сульфидов и селенидов переходных металлов. Однако эти соединения демонстрируют неудовлетворительную стабильность при высоком окислительном потенциале в щелочном растворе. Таким образом, понимание химической природы настоящих активных центров привлекло большое внимание при разработке катализаторов, связанных с ООР. Ху и его сотрудники синтезировали наноструктурированный диселенид никеля и железа (Ni x Fe 1 − x Se 2 ) в качестве исходного материала для создания на месте высокоактивного катализатора на основе оксида никеля и железа.Этот катализатор показал отличную активность OER с перенапряжением всего 195 мВ для 10 мВ см -2 [67]. Анализ SEM-изображений Ni x Fe 1 − x Se 2 в синтезированном виде и Ni x Fe 1-x Se 2 производного оксида (Ni x Fe 1 − x Se 2 -Do) после испытания OER, как показано на рис. 15C (a, b), показывают, что Ni x Fe 1 − x Se 2 -Do имеет общую морфологию, аналогичную Ni x Fe 1 − x Se 2 наночастиц, выращенных на нанопластинах.Элементное отображение изменения состава после преобразования in situ из Ni x Fe 1 − x Se 2 в Ni x Fe 1 − x Se 2 -Do (рис. 15C ( c)) показали, что содержание Se было удалено, кислород был включен в структуру, а Ni и Fe оставались однородно распределенными в структуре. Порошковый XRD и XPS анализ структуры и состава Ni x Fe 1 − x Se 2 и Ni x Fe 1 − x Se 2 -Do подтвердили гипотезу о том, что Ni x Fe 1-x Se 2 частично превращается in situ в соответствующие гидроксиды металлов на поверхности катализатора в условиях OER, которые соответствуют реальным активным центрам OER.
Механизм OER с участием решеточных форм кислорода
В обычном AEM вся реакция протекает на одном участке металла, и существует ограничение масштабным соотношением между промежуточными соединениями OER, где минимальное теоретическое перенапряжение составляет 0,37 эВ. Недавно был предложен новый механизм OER с участием решеточных форм кислорода, то есть решеточный кислородно-опосредованный механизм (LOM) [68,69,70,71]. В LOM решеточный кислород на катализаторе непосредственно участвует в реакции выделения кислорода.Участие решеточного кислорода — явление, недавно продемонстрированное для катализаторов из сплавов в реакциях газофазного каталитического окисления [72]. Любопытно, что это явление рассматривается как альтернативный, а иногда и самый благоприятный путь реакции в электрокатализе ООР.
В самом деле, прогресс был достигнут благодаря нескольким ключевым исследованиям механизма с участием решеточных форм кислорода. Стивенсон и др. [73] предложили первичный путь реакции, при котором кислород решетки участвует в реакции OER через обратимое образование поверхностных кислородных вакансий на основе исследования DFT.Они представили серию структур кобальтитовых перовскитов и продемонстрировали взаимосвязь между кислородными вакансиями, металл-кислородной ковалентностью и активностью ОЭР. Рисунок 16A (a) показывает взаимосвязь между концентрацией кислородных вакансий и ковалентностью связи Co – O. Исследования методом DFT показали, что при замене Co 3+ на Sr 2+ уровень Ферми (E F ) приближается к полосе O 2p, что сопровождается увеличением перекрытия между полосой M 3d и Полоса O 2p, указывающая на повышенную ковалентность связи металл – кислород.В то же время он создает дыры для лиганда. Структурное устройство следует для уменьшения энергии, достигающей стабильного состояния, путем образования и высвобождения O 2 , что приводит к появлению кислородных вакансий. Следовательно, повышенная ковалентность между связью металл-кислород демонстрирует более высокую концентрацию вакансий в катализаторе, которую можно контролировать путем замещения более низкой валентности Sr 2+ на La 1- x Sr x CoO 3 — δ (LSCO) структура.Результаты моделирования DFT и экспериментальных данных показывают прямую взаимосвязь между кислородными вакансиями, скоростью диффузии кислорода и активностью OER (рис. 16A (b)). Данные показывают, что повышенная кинетика вакансий и поверхностного обмена коррелирует с повышенной активностью ОЭР. На основе корреляции предлагается механизм LOM в качестве механизма параллельной реакции с AEM, который показан на рис. 16A (c). Кислород решетки реагирует с адсорбированным кислородом на металлическом узле с образованием адсорбированных интермедиатов –OO и оставляет кислородную вакансию в решетке.Это отличается от механизма AEM с участием обычно предлагаемых адсорбированных частиц –O. Для данной композиции LSCO ключом к определению, проходит ли OER через AEM или LOM, является относительная стабильность этих двух промежуточных продуктов. Прогнозируется, что при увеличении x в системе La 1− x Sr x CoO 3 − δ произойдет переход от AEM к LOM, что снизит энергию образования вакансии O и уменьшит объем стабильность.
Фиг.16(Рисунок перепечатан с разрешения [70])
A (a) Иллюстрация концентрации кислородных вакансий и ковалентности связи Co – O. (б) Связь между кислородными вакансиями, коэффициентом диффузии кислорода и активностью ОЭР. (c) Предлагаемый механизм LOM (рисунок перепечатан с разрешения [73]). B Возможные механизмы OER с участием согласованного протон-электронного переноса на поверхностных кислородных центрах с образованием (a) 34 O 2 ( 16 O 18 O) и (b) 36 O 2 ( 18 O 18 O), соответственно (Рисунок перепечатан с разрешения Ref.[68]). C График вулкана для OER на некоторых перовскитах с AEM и LOM
Использование in situ 18 Масс-спектрометрия с мечением изотопом O, Shao-Horn et al. предоставляют прямые экспериментальные доказательства того, что кислород решетки участвует в производстве молекул кислорода во время OER. Они продемонстрировали, что в высококовалентных оксидах металлов, таких как La 0,5 Sr 0,5 CoO 3 — δ и SrCoO 3 − δ (δ представляет параметр вакансии), кислород решетки позволяет образовывать оксиды во время Процесс OER, который включает в себя этапы несогласованного протон-электронного переноса и проявляет pH-независимую активность OER [68].Следовательно, механизм OER запускается, когда ковалентность металл-кислород увеличивается. Интерактивная электрохимическая масс-спектрометрия (OLEMS) используется для обнаружения участия кислорода решетки в реакции окисления перовскитами на основе 18 O-меченными Co La 0,5 Sr 0,5 CoO 3-δ , SrCoO 3 − δ и Pr 0,5 Ba 0,5 CoO 3 — δ , которые имеют разную металл-кислородную ковалентность. Газообразный кислород был измерен in situ с помощью масс-спектроскопии с точки зрения различных молекулярных масс, таких как 32 O 2 ( 16 O 16 O), 34 O 2 ( 16 O 18 O) и 36 O 2 ( 18 O 18 O).В механизме окисления участвуют две различные возможные формы кислорода в решетке, которые, как предполагается, объясняют образование 34 O 2 ( 16 O 18 O) и 36 O 2 ( 18 O 18 O), как показано на фиг. 16B. Все эти этапы включали химический этап по производству молекулярного O 2 и активность кислородных вакансий, происходящую на участках, насыщенных кислородом. Кроме того, Колпак и др. построили графики активности вулканов AEM и LOM, как показано на рис.16C. LOM демонстрирует более высокую активность OER, чем AEM, за счет минимизации термодинамически необходимого перенапряжения [70]. Для AEM, исходя из соотношения масштабирования, существует минимальное теоретическое перенапряжение 0,37 эВ. Однако для LOM относительная константа ΔG от 1,4 до 1,6 эВ для V O + OO * → V O + OH * намного меньше, чем ΔG на основе AEM, которая составляет 3,2 эВ. Следовательно, минимальное перенапряжение OER составляет всего 0,17 эВ для LOM, демонстрируя новый путь для разработки лучших электрокатализаторов OER.
Проточные электроды делают водород в 50 раз быстрее
ДУРЭМ, Северная Каролина — Электролиз, пропускающий ток через воду, чтобы разбить ее на газообразные водород и кислород, может быть удобным способом хранения избыточной энергии ветра или солнца. Водород можно хранить и использовать в качестве топлива позже, когда солнце садится или ветер стихает.
К сожалению, без какого-либо доступного хранилища энергии, подобного этому, миллиарды ватт возобновляемой энергии тратятся впустую каждый год.
Чтобы водород стал решением проблемы хранения, электролиз с разделением воды должен быть гораздо более доступным и эффективным, сказал Бен Уайли, профессор химии в Университете Дьюка. И у него и его команды есть идеи, как этого добиться.
Уайли и его лаборатория недавно испытали три новых материала, которые можно было бы использовать в качестве пористого проточного электрода для повышения эффективности электролиза. Их цель состояла в том, чтобы увеличить площадь поверхности электрода для проведения реакций, избегая при этом захвата образующихся пузырьков газа.
«Максимальная скорость производства водорода ограничена пузырьками, блокирующими электрод, буквально блокируя попадание воды на поверхность и раскол», — сказал Уайли.
В статье, опубликованной 25 мая в журнале Advanced Energy Materials, они сравнили три различные конфигурации пористого электрода, через который щелочная вода может течь в процессе реакции.
Они изготовили три вида проточных электродов, каждый из которых представляет собой квадрат размером 4 миллиметра из губчатого материала, толщиной всего один миллиметр.Один был сделан из пены никеля, другой был «войлоком» из микроволокон никеля, а третий был войлоком из нанопроволок никель-медь.
Пульсируя ток через электроды в течение пяти минут, они обнаружили, что войлок, сделанный из нанопроволок никель-медь, первоначально производил водород более эффективно, потому что он имел большую площадь поверхности, чем два других материала. Но в течение 30 секунд его эффективность резко упала, потому что материал забился пузырьками.
Пеноникелевый электрод лучше всего позволял пузырькам выходить, но он имел значительно меньшую площадь поверхности, чем два других электрода, что делало его менее продуктивным.
«Золотая середина» оказалась фетром из никелевого микроволокна, который производил больше водорода, чем фетр из нанопроволоки, несмотря на то, что площадь поверхности для реакции была на 25 процентов меньше.
В течение 100-часового испытания войлок из микрофибры выделял водород при плотности тока 25 000 миллиампер на квадратный сантиметр. При такой скорости он будет в 50 раз более производительным, чем обычные щелочные электролизеры, которые в настоящее время используются для электролиза воды, подсчитали исследователи.
Самый дешевый способ производства водорода в промышленных количествах прямо сейчас — не расщепление воды, а расщепление природного газа (метана) на части очень горячим паром — энергоемкий подход, который создает от 9 до 12 тонн CO 2 на каждую тонну водород, который он производит, не считая энергии, необходимой для создания пара с температурой 1000 градусов Цельсия.
Уайли сказал, что коммерческие производители электролизеров для воды, возможно, смогут улучшить структуру своих электродов на основе того, что узнала его команда.Если бы они могли значительно увеличить скорость производства водорода, стоимость водорода, получаемого при расщеплении воды, могла бы снизиться, возможно, даже настолько, чтобы сделать его доступным решением для хранения возобновляемой энергии.
Он также работает с группой студентов программы Duke Bass Connections, которые изучают возможность расширения проточного электролиза для получения водорода из обильной солнечной энергии Индии.
Это исследование было поддержано наградой Национального научного фонда CAREER (DMR-1253534) и грантом Энергетической инициативы Университета Дьюка.
ЦИТАТА: «Электролиз щелочной воды при 25 А / см2 с микроволоконным проточным электродом», Фейхен Ян, Мён Джун Ким, Мика Браун и Бенджамин Дж. Уайли. Advanced Energy Materials, 25 мая 2020 г. DOI: 10.1002 / aenm.202001174
.



