Водород — Википедия
| Водород | |
|---|---|
| Гелий → | |
| Газ без цвета, запаха и вкуса | |
 Водород в разрядной трубке | |
| Название, символ, номер | Водород / Hydrogenium (H), 1 |
| Атомная масса (молярная масса) | [1,00784; 1,00811][комм 1][1] а. е. м. (г/моль) |
| Электронная конфигурация | 1s1 |
| Радиус атома | 53 пм |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
| Электроотрицательность | 2,20[2] (шкала Полинга) |
| Степени окисления | +1, 0, −1 |
| Энергия ионизации (первый электрон) | 1311,3 (13,595) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ |
| Температура плавления | 14,01 K; −259,14 °C |
| Температура кипения | 20,28 K; −252,87 °C |
| Уд. теплота плавления | 0,117 кДж/моль |
| Уд. теплота испарения | 0,904 кДж/моль |
| Молярная теплоёмкость | 28,47[3] Дж/(K·моль) |
| Молярный объём | 14,1 см³/моль |
| Структура решётки | гексагональная |
| a = 3,780 c = 6,167 Å | |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Номер CAS | 12385-13-6 |
 | |
Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород[4][5].
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода[6][7].
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал[8]:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Во Вселенной[править | править код]
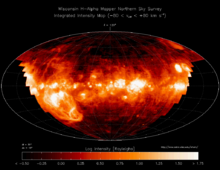
В настоящее время водород — самый распространённый элемент во Вселенной[9]. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %)[10]. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы[править | править код]
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %[13].
В промышленности[править | править код]
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа.[14] Почти все остальное получают из угля. Около 0,1 % (~100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает ~830 млн тонн CO
- Ch5+h3O ⇄ CO+3h3{\displaystyle {\mathsf {CH_{4}+H_{2}O\ \rightleftarrows {}\ CO+3H_{2}}}}
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- h3O+C ⇄ CO↑+h3↑{\displaystyle {\mathsf {H_{2}O+C\ \rightleftarrows {}\ CO\uparrow +H_{2}\uparrow }}}
- 2NaCl+2h3O → 2NaOH+Cl2↑+h3↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\ {\xrightarrow {}}\ 2NaOH+Cl_{2}\uparrow +H_{2}\uparrow }}}
- 2h3O→4e−2h3↑+O2↑{\displaystyle {\ce {2h3O ->[4e^{-}] 2h3 ^ + O2 ^}}}
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной[15] (англ.).
- 2Ch5+O2⇄ 2CO+4h3{\displaystyle {\mathsf {2CH_{4}+O_{2}\rightleftarrows {}\ 2CO+4H_{2}}}}
В лаборатории[править | править код]
- Zn+h3SO4→ZnSO4+h3↑{\displaystyle {\mathsf {Zn+H_{2}SO_{4}\rightarrow ZnSO_{4}+H_{2}\uparrow }}}
- Ca+2h3O→Ca(OH)2+h3↑{\displaystyle {\mathsf {Ca+2H_{2}O\rightarrow Ca(OH)_{2}+H_{2}\uparrow }}}
- NaH+h3O→NaOH+h3↑{\displaystyle {\mathsf {NaH+H_{2}O\rightarrow NaOH+H_{2}\uparrow }}}
- 2Al+2NaOH+6h3O→2Na[Al(OH)4]+3h3↑{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}\uparrow }}}
- Zn+2KOH+2h3O→K2[Zn(OH)4]+h3↑{\displaystyle {\mathsf {Zn+2KOH+2H_{2}O\rightarrow K_{2}[Zn(OH)_{4}]+H_{2}\uparrow }}}
- 2h4O++2e−→2h3O+h3↑{\displaystyle {\mathsf {2H_{3}O^{+}+2e^{-}\rightarrow 2H_{2}O+H_{2}\uparrow }}}
Очистка[править | править код]
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ)[16].
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: Настоящий метод на сегодняшний день наиболее распространён в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80-85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 Н2/сут. Образуется водород высокой чистоты 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95-96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Стоимость[править | править код]
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг.[17] В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
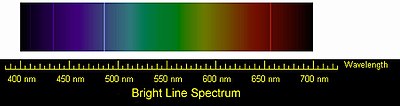
 Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера
Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии БальмераВодород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх[18]. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9⋅106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2[⇨].
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл[19]. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением[20][21].
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация параводорода в смеси в зависимости от температурыРазделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25[22]. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
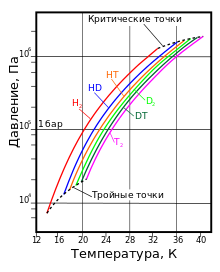 Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Термодинамическое состояние насыщенного пара водорода с различным изотопным составомНаиболее известны три изотопа водорода: протий 1H (атомное ядро — протон), дейтерий 2Н (ядро состоит из одного протона и одного нейтрона) и тритий 3Н (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно[23]. Оно может незначительно меняться в зависимости от источника и способа получения водорода. Тритий нестабилен, претерпевает бета-распад с периодом 12,32 года, превращаясь в стабильный гелий-3[23]. Тритий встречается в природе в следовых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с[23].
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[24].
Температура
плавления,
KТемпература
кипения,
KТройная
точкаКритическая
точкаПлотность,
кг/м³T, K P, кПа T, K P, МПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов[
применение и использование в промышленности
Водород является востребованным компонентом для большого количества производственных процессов, относящимся к промышленности. Чтобы его использовать для решения технических задач количество примесей в составе вещества не должно превышать 0, 05%, относится к марке, А и 0,01% — марка Б.
Популярность и востребованность химического элемента связана напрямую с его положительными особенностями:
- универсальность;
- высокая химическая активность;
- малый вес;
- хорошая теплопроводность;<.li>
- большое количество тепла, образовывающееся в процессе горения;
- безопасность использования.
Востребованность водорода для промышленных целей
Водород требуется для получения аммиака, выступающим неотъемлемым компонентом для добычи удобрений азотного типа, производства пластмассы, волокон из синтетических материалов и лекарств. Сочетание его с хлором дает возможность получить хлороводород и соляную кислоту. Также благодаря нему изготавливается множество веществ, относящимся к органическим.
Для пищевой промышленности водород используется во время изготовления маргарина, состоящего из твердых жиров растительного происхождения. Гидрогенизация дает возможность жидкие растительные масла превратить в затверделый жир. Химический элемент может выступать как пропеллент — защитная среда упаковки с пищевыми продуктами.
Использование водорода в металлургии
С помощью водорода удается восстановить первоначальные свойства определенных металлов,состоящих из их оксидов (вольфрам). При его горении в кислороде достигается температура в среднем 3000 °C. Данные условия позволяют выполнять плавление и сваривание металлов тугоплавкого типа.
Использование водорода в промышленности можно наблюдать на примере металлургии. данной отрасли он задействуется с целью восстановительного процесса металлов из оксидов. В результате удается получить сплавы, относящиеся к тугоплавким. Затем водородно-кислородное пламя, отличающееся высокой температурой, обладает способностью расплавлять их и сваривать. Для таких целей задействуется горелка, спроектированная по аналогии ацетиленокислородной.
Преимущества применения водорода
Водород, пребывающий в жидком состоянии, является отличным вариантом топлива для ракет. Также активно идет работа, чтобы в будущем использовать его в виде горючего для силового агрегата машин. Воплощение в жизнь данной идеи положительно скажется на экологической ситуации, так как при сгорании водорода в атмосферу не попадают опасные компоненты, наносящиеся непоправимый вред окружающей среде.
Одним из основных потребителем химического элемента являются предприятия, работающие в сфере нефтехимии и занимающиеся переработкой нефти. Здесь расход водорода, который добывается промышленным методом, достигает отметки 50% от общего числа. Большое количество полимеров, соединений углеводородного типа и масс, с пластическими свойствами, получают исключительно из водорода.
Газообразное вещество благодаря отличной теплопроводности и отсутствию в составе вредных компонентов оптимально подходит для снижения уровня нагрева турбогенераторов, характеризующихся высоким запасом мощности. В условиях повышенной температуры водород демонстрирует регенерацию, беря на себя атомы кислорода, находящиеся в оксидах металлов. Это дает возможность применять его для прямого восстановления руды.
В зависимости от отрасли газообразная консистенция выступает как основной элемент, дополнительный материал либо горючее.
Cогласно статистическим данным востребованность водорода стремительно растет и его использование каждые 15 лет удваивается в несколько раз.
Нужна консультация по выбору генератора водорода? Звоните!
+7 (800) 505-42-68
или оставте заявку онлайн
Наши консультанты помогут Вам в выборе подходящего оборудования и предложат различные варианты модификаций товара.
Оставить заявкуПрименение водорода в промышленности
Основным потребителем водорода является химическая промышленность, где водород применяется в основном для производства аммиака и метанола, а также нефтехимическая промышленность. В нефтепереработке водород используется в процессах гидрокрекинга и гидроочистки, в ходе которых происходит расщепление тяжёлых молекул углеводородов на более мелкие, насыщение водородом непредельных углеводородов и очистка сырья от сера-азотсодержащих соединений. Такие крупнотоннажные потребители используют водород, получаемый различными химическими способами – паровой конверсией природного газа, риформингом высших углеводородов и газификацией угля. Доля водорода, производимого методом электролиза воды, по разным оценкам составляет всего от 5 до 10% от общемирового объёма производства водорода. Несмотря на более высокую стоимость электролитического водорода по сравнению с водородом, получаемым из природного газа, метод электролиза воды обладает рядом существенных преимуществ, обуславливающих целесообразность его применения во многих отраслях промышленности.
Генераторы водорода, работающие по принципу электролиза воды, являются достаточно компактными системами, что позволяет применять их для производства водорода на месте, то есть локализовать получение водорода непосредственно на предприятии потребителя. Такие системы отличаются относительной простотой, высоким ресурсом, высокой степенью автоматизации и надёжностью. Они позволяют получать водород высокой чистоты в широком диапазоне производительности – от 200 мл/мин до 400 м3/час и более, при этом подавая водород на выходе из генератора под высоким давлением – до 30 бар и выше.Ввиду описанных преимуществ электролизные установки для получения водорода находят применение на предприятиях пищевой промышленности, металлургии, производстве полупроводников, стекольной промышленности, метеорологии, в энергетике – для охлаждения мощных турбогенераторов. Генераторы небольшой производительности широко применяются в лабораторных целях. Активно развивается направление водородной энергетики, где водород рассматривается в качестве энергоносителя.
Жидкий водород — Википедия
Жи́дкий водоро́д (ЖВ, жh3, жH2, Lh3, LH2) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C)[1]. Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде[en] составляет: 99,79 % — параводород; 0,21 % — ортоводород[2]. Коэффициент расширения[en] водорода при смене агрегатного состояния на газообразное при комнатной температуре составляет 848:1.
Как и для любого другого газа, сжижение водорода приводит к уменьшению его объёма. После сжижения жидкий водород хранится в термически изолированных контейнерах под давлением. Жидкий водород используется в промышленности (в качестве формы хранения газа) и в космонавтике (в качестве ракетного топлива).
Первое документированное использование искусственного охлаждения в 1756 году было осуществлено английским учёным Вильямом Калленом[3], Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовал кондиционер в 1851 году[4][5], Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения[6] в 1876 году. В 1885 году польский физик и химик Зигмунд Вро́блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервые водород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, сосуда Дьюара. Первый синтез устойчивого изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Водород при комнатной температуре состоит на 75 % из спинового изомера, ортоводорода. После производства жидкий водород находится в метастабильном состоянии и должен быть преобразован в параводородную форму, для того чтобы избежать спонтанной экзотермической реакции его превращения, приводящей к сильному самопроизвольному испарению полученного жидкого водорода. Преобразование в параводородную фазу обычно производится с использованием таких катализаторов, как оксид железа, оксид хрома, активированный уголь, покрытых платиной асбестов, редкоземельных металлов или путём использования урановых или никелевых добавок

Жидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные проекты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например DeepC
Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен.
Преимущества[править | править код]
Преимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с кислородом в воздухе является вода, но в реальности — как и в случае с обычными ископаемыми энергоносителями — из-за наличия в воздухе молекул азота при его горении образуется также незначительное количество оксидов этого газа. В качестве топлива для транспортных средств, эксплуатируемых на открытом воздухе, водород при авариях и протечках не скапливается на месте, а уходит вверх, в атмосферу, что снижает пожароопасность.
Препятствия[править | править код]
Один литр «ЖВ» весит всего 0,07 кг. То есть его удельная плотность составляет 70,99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные теплоизолированные ёмкости и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с ёмкостями с тепловой изоляцией его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день[8]). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом («Водородная безопасность») — он достаточно холоден для сжижения воздуха, что взрывоопасно. Жидкий водород при атмосферном давлении имеет очень узкий температурный диапазон стабильности — всего 7 градусов Цельсия, что создает определенные трудности при хранении.
Жидкий водород является распространенным компонентом ракетного топлива, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателей на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульса двигателя за счет уменьшения молекулярного веса, это ещё сокращает эрозию сопла и камеры сгорания.
Такие препятствия использования ЖВ в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель («Дельта-4»), которая целиком является водородной ракетой. В основном ЖВ используется либо на верхних ступенях ракет, либо на разгонных блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы ЖВ.
Водород с разными окислителями[править | править код]
Данные приводятся на основании[9] таблиц, опубликованных в США в рамках проекта сбора термодинамических данных «JANAF» (англ. Joint Army Navy Air Force, «Сборник ВМС и ВВС армии США»), которые широко используются в этих целях. Изначально вычисления производились компанией «Рокетдайн».[10] При этом делались предположения, что имеет место адиабатическое сгорание, изоэнтропийное расширение в одном направлении и имеет место смещение равновесного состояния. Кроме варианта использования водорода в качестве топлива, приводятся варианты с использованием водорода в качестве рабочего тела, что объясняется его небольшим молекулярным весом. Все данные рассчитаны для давления в камере сгорания («КС»), равного 68,05 атмосфер. Последняя строка таблицы содержит данные для газообразных водорода и кислорода.
| Оптимальное расширение от 68.05 атм до условий: | поверхности Земли (1 атм) | вакуума (0 атм, расширение сопла 40:1) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Окислитель | Топливо | Комментарий | Ve | r | Tc | d | C* | Ve | r | Tc | d | C* |
| жO2 | H2 | распространено | 3816 | 4.13 | 2740 | 0.29 | 2416 | 4462 | 4.83 | 2978 | 0.32 | 2386 |
| H2-Be 49/51 | 4498 | 0.87 | 2558 | 0.23 | 2833 | 5295 | 0.91 | 2589 | 0.24 | 2850 | ||
| CH4/H2 92.6/7.4 | 3126 | 3.36 | 3245 | 0.71 | 1920 | 3719 | 3.63 | 3287 | 0.72 | 1897 | ||
| F2 | H2 | 4036 | 7.94 | 3689 | 0.46 | 2556 | 4697 | 9.74 | 3985 | 0.52 | 2530 | |
| H2-Li 65.2/34.0 | 4256 | 0.96 | 1830 | 0.19 | 2680 | |||||||
| H2-Li 60.7/39.3 | 5050 | 1.08 | 1974 | 0.21 | 2656 | |||||||
| OF2 | H2 | 4014 | 5.92 | 3311 | 0.39 | 2542 | 4679 | 7.37 | 3587 | 0.44 | 2499 | |
| F2/O2 30/70 | H2 | 3871 | 4.80 | 2954 | 0.32 | 2453 | 4520 | 5.70 | 3195 | 0.36 | 2417 | |
| O2 | H2 | 3997 | 3.29 | 2576 | — | 2550 | 4485 | 3.92 | 2862 | — | 2519 | |
при этом «Ve» является той же единицей, что и удельный импульс, но приведена к размерности скорости [Н*сек/кг], а «C*» вычисляется путём умножения давления в камере сгорания на коэффициент расширения площади сопла и последующего деления на массовый расход топлива и окислителя, что дает приращение скорости на единицу массы.
Жидкий водород довольно опасен для человека. Попадание ЖВ на кожу может вызвать обморожение, а вдыхание паров привести к отёку легких.
- ↑ IPTS-1968 (en)
- ↑ Жидкий воздух/водород (en)
- ↑ Уильям Каллен, «О производстве холода, произведенного при испарении жидкостей и некоторые другие способы получения холода», в «Essays and Observations Physical and Literary Read Before a Society in Edinburgh and Published by Them, II», (Эдинбург, 1756) (en)
- ↑ США: 1851 Джон Гори (en)
- ↑ США: 1851 Патент 8080 (en)
- ↑ НАСА: Водород в течение XIX века (en)
- ↑ Преобразование водорода «Орто-Пара». Стр. 13 Архивировано 16 декабря 2008 года. (en)
- ↑ Водород в качестве альтернативного топлива Архивировано 8 августа 2008 года. (en)
- ↑ NIST-JANAF Thermochemical Tables 2 Volume-Set, (Journal of Physical and Chemical Reference Data Monographs), Hardcover: 1951 pp, Publisher: American Institute of Physics; 4th edition (1 августа 1998), Language: English, ISBN 1-56396-831-2, ISBN 978-1-56396-831-0
- ↑ Modern Engineering for Design of Liquid-Propellant Rocket Engines, (Progress in Astronautics and Aeronautics), Huzel and Huang, Rocketdyne division of Rockwell International
Что такое водород? | Vunderkind.Info
Цель сегодняшней публикации – представить неподготовленному читателю исчерпывающие сведения о том, что такое водород, каковы его физические и химические свойства, сфера применения, значение и способы получения.
Мы также проследим историю открытия этого удивительного вещества, изложив теорию по возможности кратко и без использования излишне заумной терминологии.
Что такое водород: общие сведения
Водород – это один из самых распространенных в природе химических элементов. Доля водорода в массе Солнца составляет примерно половину. Во Вселенной же доля атомов водорода приближается к 90 %, являясь основой межзвездного газа и звезд.
Водород присутствует в подавляющем большинстве органических веществ и живых клеток, в которых на его долю приходится почти две трети атомов.

Фото 1. Водород считается одним из самых распространенных элементов в природе
В периодической системе элементов Менделеева водород занимает почетную первую позицию с атомным весом, равным единице.
Название «водород» (в латинском варианте – Hydrogenium) ведет происхождение от двух древнегреческих слов: ὕδωρ — «вода» и γεννάω — «рождаю» (буквально – «рождающий воду) и впервые было предложено в 1824 г. русским химиком Михаилом Соловьевым.
Водород является одним из водообразующих (наряду с кислородом) элементов (химическая формула воды H2O).
По физическим свойствам водород характеризуется как бесцветный газ (легче воздуха). При смешении с кислородом или воздухом крайне взрывоопасен и горюч.
Способен растворяться в некоторых металлах (титане, железе, платине, палладии, никеле) и в этаноле, однако очень плохо растворим в серебре.
Молекула водорода состоит из двух атомов и обозначается H2. Водород имеет несколько изотопов: протий (H), дейтерий (D) и тритий (T).
История открытия водорода
Еще в первой половине XVI века при проведении алхимических опытов, смешивая металлы с кислотами, Парацельс заметил доселе неизвестный горючий газ, который отделить от воздуха он так и не смог.
Спустя почти полтора столетия – в конце XVII века – французскому ученому Лемери удалось-таки отделить водород (еще не зная, что это именно водород) от воздуха и доказать его горючесть.

Фото 2. Генри Кавендиш — первооткрыватель водорода
Химические опыты в середине XVIII века позволили Михаилу Ломоносову выявить процесс выделения некоего газа в результате некоторых химических реакций, не являющегося, однако, флогистоном.
Настоящий прорыв в исследовании горючего газа удалось совершить английскому химику Генри Кавендишу, которому и приписывается открытие водорода (1766).
Этот газ Кавендиш называл «горючим воздухом». Им же проведена реакция сжигания этого вещества, в результате которой получалась вода.
В 1783 г. французским химикам во главе с Антуаном Лавуазье был осуществлен синтез воды, а впоследствии – разложение воды с выделением «горючего воздуха».
Эти исследования окончательно доказали присутствие водорода в составе воды. Именно Лавуазье предложил именовать новый газ Hydrogenium (1801).
Полезные свойства водорода
Водород легче воздуха в четырнадцать с половиной раз.
Его же отличает и самая высокая теплопроводность среди прочих газов (белее чем в семь раз превышает теплопроводность воздуха).
В былые времена воздушные шары и дирижабли заполняли водородом. После серии катастроф в середине 1930-х, закончившихся взрывами дирижаблей, конструкторам пришлось искать водороду замену.
Теперь для подобных летательных аппаратов используется гелий, который намного дороже водорода, зато не так взрывоопасен.
Водород хорошо зарекомендовал себя в качестве компонента ракетного топлива.

Фото 3. Водород применяется для изготовления ракетного топлива
Во многих странах ведутся исследования по созданию экономичных двигателей для легковых и грузовых автомобилей на основе водорода.
Автомобили на водородном топливе значительно экологичнее своих бензиновых и дизельных собратьев.
При обычных условиях (комнатная температура и естественное атмосферное давление) водород неохотно вступает в реакции.
При нагревании смеси водорода и кислорода до 600 °C начинается реакция, завершающаяся образованием молекул воды.
Эту же реакцию можно спровоцировать с помощью электрической искры.
Реакции при участи водорода завершаются, лишь когда участвующие в реакции компоненты будут израсходованы целиком.
Температура горящего водорода достигает 2500-2800 °C.
С помощью водорода производят очистку различных типов топлива на основе нефти и нефтепродуктов.
В живой природе водород заменить нечем, так как он присутствует в любой органике (включая нефть) и во всех белковых соединениях.
Без участия водорода жизнь на Земле была бы невозможна.
Агрегатные состояния водорода
Водород способен пребывать в трех основных агрегатных состояниях:
- газообразном;
- жидком;
- твердом.
Обычное состояние водорода – газ. Понижая его температуру до -252,8 °C, водород превращается в жидкость, а после температурного порога -262 °C водород становится твердым.

Фото 4. Уже несколько десятилетий вместо дешевого водорода для наполнения воздушных шаров используют дорогой гелий
Ученые предполагают, что водород способен находиться в дополнительном (четвертом) агрегатном состоянии – металлическом.
Для этого нужно всего лишь создать давление в два с половиной миллиона атмосфер.
Пока, увы, это всего лишь научная гипотеза, так как получить «металлический водород» еще никому не удавалось.
Жидкий водород – из-за своей температуры — при попадании на кожу человека способен вызвать сильное обморожение.
Водород в таблице Менделеева
В основе распределения химических элементов в периодической таблице Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода.

Фото 5. В таблице Менделеева водороду отведена ячейка с порядковым номером 1
Правильность такого подхода долгие годы никто не мог ни опровергнуть, ни подтвердить.
С возникновением квантовой физики в начале XX века и, в частности, появлением знаменитых постулатов Нильса Бора, объясняющих с позиций квантовой механики строение атома, удалось доказать справедливость гипотезы Менделеева.
Верно и обратное: именно соответствие постулатов Нильса Бора периодическому закону, лежащему в основе таблицы Менделеева, и стало самым веским доводом в пользу признания их истинности.
Участие водорода в термоядерной реакции
Изотопы водорода дейтерий и тритий являются источниками невероятно мощной энергии, высвобождающейся в процессе термоядерной реакции.

Фото 6. Термоядерный взрыв без водорода был бы невозможен
Такая реакция возможна при температуре не ниже 1060 °C и протекают очень быстро – в течение нескольких секунд.
На Солнце термоядерные реакции протекают медленно.
Задача ученых – понять, почему так происходит, чтобы использовать полученные знания для создания новых – практически неисчерпаемых – источников энергии.
Что такое водород (видео):
>

ВОДОРОД — это… Что такое ВОДОРОД?
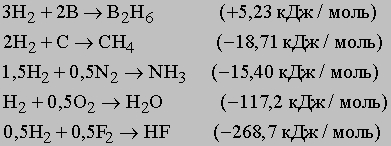
Неметаллы образуют летучие гидриды общей формулы MHx (х — целое число) с относительно низкой температурой кипения и высоким давлением паров. Эти гидриды существенно отличаются от солевых гидридов, в которых водород имеет более отрицательный заряд. У летучих гидридов (например, углеводородов) преобладает ковалентная связь между неметаллами и водородом. По мере усиления неметаллического характера образуются соединения с частично ионной связью, например H+Cl-, (h3)2+O2-, N3-(h4)3+. Отдельные примеры образования различных гидридов приведены ниже (в скобках указана теплота образования гидрида):
Изомерия и изотопы водорода. Атомы изотопов водорода непохожи. Обычный водород, протий, всегда представляет собой протон, вокруг которого вращается один электрон, находящийся от протона на огромном расстоянии (относительно размеров протона). Обе частицы обладают спином, поэтому атомы водорода могут различаться либо спином электрона, либо спином протона, либо и тем, и другим. Водородные атомы, различающиеся спином протона или электрона, называются изомерами. Комбинация двух атомов с параллельными спинами приводит к образованию молекулы «ортоводорода», а с противоположными спинами протонов — к молекуле «параводорода». Химически обе молекулы идентичны. Ортоводород имеет очень слабый магнитный момент. При комнатной или повышенной температуре оба изомера, ортоводород и параводород, находятся обычно в равновесии в соотношении 3:1. При охлаждении до 20 K (-253° C) содержание параводорода возрастает до 99%, так как он более стабилен. При сжижении методами промышленной очистки ортоформа переходит в параформу с выделением теплоты, что служит причиной потерь водорода от испарения. Скорость конверсии ортоформы в параформу возрастает в присутствии катализатора, например древесного угля, оксида никеля, оксида хрома, нанесенного на глинозем. Протий — необычный элемент, так как в ядре его нет нейтронов. Если в ядре появляется нейтрон, то такой водород называется дейтерий 21D. Элементы с одинаковым количеством протонов и электронов и разным количеством нейтронов называются изотопами. Природный водород содержит небольшую долю HD и D2. Аналогично, природная вода содержит в малой концентрации (менее 0,1%) DOH и D2O. Тяжелая вода D2O, имеющая массу больше, чем у h3O, отличается по физическим и химическим свойствам, например, плотность обычной воды 0,9982 г/мл (20° С), а тяжелой — 1,105 г/мл, температура плавления обычной воды 0,0° С, а тяжелой — 3,82° С, температура кипения — соответственно 100° С и 101,42° С. Реакции с участием D2O протекают с меньшей скоростью (например, электролиз природной воды, содержащей примесь D2O, с добавкой щелочи NaOH). Скорость электролитического разложения оксида протия h3O больше, чем D2O (с учетом постоянного роста доли D2O, подвергающейся электролизу). Благодаря близости свойств протия и дейтерия можно замещать протий на дейтерий. Такие соединения относятся к так называемым меткам. Смешивая соединения дейтерия с обычным водородсодержащим веществом, можно изучать пути, природу и механизм многих реакций. Таким методом пользуются для изучения биологических и биохимических реакций, например процессов пищеварения. Третий изотоп водорода, тритий (31T), присутствует в природе в следовых количествах. В отличие от стабильного дейтерия тритий радиоактивен и имеет период полураспада 12,26 лет. Тритий распадается до гелия (32He) с выделением b-частицы (электрона). Тритий и тритиды металлов используют для получения ядерной энергии; например, в водородной бомбе происходит следующая реакция термоядерного синтеза: 21H + 31H -> 42He + 10n + 17,6 МэВ
Получение водорода. Зачастую дальнейшее применение водорода определяется характером самого производства. В некоторых случаях, например при синтезе аммиака, небольшие количества азота в исходном водороде, конечно, не являются вредной примесью. Примесь оксида углерода(II) также не будет помехой, если водород используют как восстановитель. 1. Самое крупное производство водорода основано на каталитической конверсии углеводородов с водяным паром по схеме Cnh3n + 2 + nh3O (r) nCO + (2n + 1)h3 и Cnh3n + 2 + 2nh3O (r) nCO2 + (3n + 1)h3. Температура процесса зависит от состава катализатора. Известно, что температуру реакции с пропаном можно снизить до 370° С, используя в качестве катализатора боксит. До 95% производимого при этом CO расходуется при дальнейшей реакции с парами воды: h3O + CO -> CO2 + h3
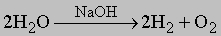
2. Метод водяного газа дает значительную часть общего производства водорода. Сущность метода заключается в реакции паров воды с коксом с образованием смеси CO и h3. Реакция эндотермична (DH° = 121,8 кДж/моль), и ее проводят при 1000° С. Нагретый кокс обрабатывают паром; выделяющаяся очищенная газовая смесь содержит некоторое количество водорода, большой процент CO и небольшую примесь CO2. Для повышения выхода h3 монооксид CO удаляют дальнейшей паровой обработкой при 370° C, при этом получается больше CO2. Углекислый газ довольно легко удалить, пропуская газовую смесь через скруббер, орошаемый водой противотоком. 3. Электролиз. В электролитическом процессе водород является фактически побочным продуктом производства главных продуктов — хлора и щелочи (NaOH). Электролиз проводят в слабощелочной водной среде при 80° C и напряжении около 2В, используя железный катод и никелевый анод:
4. Железо-паровой метод, по которому пар при 500-1000° C пропускают над железом: 3Fe + 4h3O Fe3O4 + 4h3 + 160,67 кДж. Получаемый этим методом водород обычно используют для гидрогенизации жиров и масел. Состав оксида железа зависит от температуры процесса; при nC + (n + 1)h3
6. Следующим по объему производства является метанол-паровой метод: Ch4OH + h3O -> 3h3 + CO2. Реакция эндотермична и ее проводят при ВОДОРОД260° C в обычных стальных реакторах при давлении до 20 атм. 7. Каталитическое разложение аммиака: 2Nh4 -> Реакция обратима. При небольших потребностях в водороде этот процесс неэкономичен. Существуют также разнообразные способы получения водорода, которые, хотя и не имеют большого промышленного значения, в некоторых случаях могут оказаться экономически наиболее выгодными. Очень чистый водород получается при гидролизе очищенных гидридов щелочных металлов; при этом из малого количества гидрида образуется много водорода: LiH + h3O -> LiOH + h3
(Этот метод удобен при непосредственном применении получаемого водорода.) При взаимодействии кислот с активными металлами также выделяется водород, однако при этом он обычно загрязнен парами кислоты или другим газообразным продуктом, например фосфином Ph4, сероводородом h3S, арсином Ash4. Наиболее активные металлы, реагируя с водой, вытесняют водород и образуют щелочной раствор: 2h3O + 2Na -> h3 + 2NaOH Распространен лабораторный метод получения h3 в аппарате Киппа по реакции цинка с соляной или серной кислотой:
Zn + 2HCl -> ZnCl2 + h3. Гидриды щелочноземельных металлов (например, Cah3), комплексные солевые гидриды (например, LiAlh5 или NaBh5) и некоторые бороводороды (например, B2H6) при реакции с водой или в процессе термической диссоциации выделяют водород. Бурый уголь и пар при высокой температуре также взаимодействуют с выделением водорода.
Очистка водорода. Степень требуемой чистоты водорода определяется его областью применения. Примесь углекислого газа удаляют вымораживанием или сжижением (например, пропуская газообразную смесь через жидкий азот). Эту же примесь можно полностью удалить барботированием через воду. CO может быть удален каталитическим превращением в Ch5 или CO2 или сжижением при обработке жидким азотом. Примесь кислорода, образующаяся в процессе электролиза, удаляется в виде воды после искрового разряда.
Применение водорода. Водород применяется главным образом в химической промышленности для производства хлороводорода, аммиака, метанола и других органических соединений. Он используется при гидрогенизации масел, а также угля и нефти (для превращения низкосортных видов топлив в высококачественные). В металлургии с помощью водорода восстанавливают некоторые цветные металлы из их оксидов. Водород используют для охлаждения мощных электрогенераторов. Изотопы водорода находят применение в атомной энергетике. Водородно-кислородное пламя применяется для резки и сварки металлов.
ЛИТЕРАТУРА
Некрасов Б.В. Основы общей химии. М., 1973 Жидкий водород. М., 1980 Водород в металлах. М., 1981
Энциклопедия Кольера. — Открытое общество. 2000.
Синонимы:- КАЙРУАН
- ИОСИЯ
Смотреть что такое «ВОДОРОД» в других словарях:
Водород-4 — Таблица нуклидов Общие сведения Название, символ Водород 4, 4H Нейтронов 3 Протонов 1 Свойства нуклида Атомная масса 4,027810(110) … Википедия
Водород-5 — Таблица нуклидов Общие сведения Название, символ Водород 5, 5H Нейтронов 4 Протонов 1 Свойства нуклида Атомная масса 5,035310(110) … Википедия
Водород-6 — Таблица нуклидов Общие сведения Название, символ Водород 6, 6H Нейтронов 5 Протонов 1 Свойства нуклида Атомная масса 6,044940(280) … Википедия
Водород-7 — Таблица нуклидов Общие сведения Название, символ Водород 7, 7H Нейтронов 6 Протонов 1 Свойства нуклида Атомная масса 7,052750(1080) … Википедия
ВОДОРОД — (Hydrogenium), H, первый, наиболее легкий химический элемент периодической системы, атомная масса 1,00794; газ, tкип 252,76шC. Ядро атома водорода называют протоном. Водород входит в состав воды, живых организмов, нефти, каменного угля,… … Современная энциклопедия
Водород — (Hydrogenium), H, первый, наиболее легкий химический элемент периодической системы, атомная масса 1,00794; газ, tкип 252,76°C. Ядро атома водорода называют протоном. Водород входит в состав воды, живых организмов, нефти, каменного угля,… … Иллюстрированный энциклопедический словарь
ВОДОРОД — (символ Н), газообразный, неметаллический элемент, впервые выделенный и идентифицированный в 1766 г. Генри КАВЕНДИШЕМ, который назвал его «горючим воздухом». Водород бесцветен и не имеет запаха, его относят вместе со щелочными металлами к первой… … Научно-технический энциклопедический словарь
Водород — Н (лат. hydrogenium; a. hydrogen; н. Wasserstoff; ф. hydrogene; и. hidrogeno), хим. элемент периодич. системы элементов Mенделеева, к рый относят одновременно к I и VII группам, ат. н. 1, ат. м. 1,0079. Природный B. имеет стабильные… … Геологическая энциклопедия
Водород — h3 газ без цвета, запаха и вкуса. Молярная масса 2,0157 кг/кмоль, температура плавления 13,95 К, температура кипения 71,07 кг/м3, низшая теплота сгорания 114460 кДж/кг, газовая постоянная 4,124 Дж/(кг*К), стехиометрический коэффициент 34,25 кг… … Энциклопедия техники
водород — протий, дейтерий, тритий, гидроген Словарь русских синонимов. водород сущ., кол во синонимов: 10 • водотвор (1) • газ … Словарь синонимов
Водород — получают путем электролиза воды или из водяного газа, коксового газа или углеводородов. Водород обычно рассматривается как неметалл. Он хранится под давлением в стальных баллонах. Он используется для гидрирования масел (получение твердых жиров),… … Официальная терминология
Книги
- ВОДОРОД. параметры горения и взрыва, Б. Е. Гельфанд. Обобщены результаты преимущественно экспериментальных исследований процессовгорения, воспламенения/самовоспламенения, быстрой дефлаграции и детонации в водородсодержащих горючих системах. Для… Подробнее Купить за 772 руб
- Водород: параметры горения и взрыва, Гельфанд Борис Ефимович, Попов Олег Евгеньевич, Чайванов Борис Борисович. Обобщены результаты преимущественно экспериментальных исследований процессов горения, воспламенения/самовоспламенения, быстрой дефлаграции и детонации в водородсодержащих горючих системах.… Подробнее Купить за 717 руб
- Водород. Параметры горения и взрыва, Б. Е. Гельфанд, О. Е. Попов, Б. Б. Чайванов. Обобщены результаты преимущественно экспериментальных исследований процессов горения, воспламенения/самовоспламенения, быстрой дефлаграции и детонации в водородсодержащих горючих системах.… Подробнее Купить за 508 руб
Применение водорода | Химическая энциклопедия
Водород находит широкое практическое применение. Основные области его промышленного использования известны всем. Более половины водорода идет на переработку нефти. Четверть производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Например, самая мощная ракета «Энергия» использует более 2000 тонн топлива, большую часть которого составляют жидкий водород и кислород.
Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам, необходимые в производстве нитей накаливания электролампочек. Водород также находит применение в производстве маргарина из растительных масел.
Реакцию горения водорода в кислороде применяют и для сварочных работ. Температура водородно-кислородного пламени достигает 3000 °C. Если же использовать специальные горелки, то можно повысить температуру пламени до 4000 °C. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт – вода, а углекислый газ, вызывающий парниковый эффект, не выделяется.
Ученые предполагают, что в середине XXI века должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом. Вам необходимо включить JavaScript, чтобы проголосовать



