Катодный и анодный процессы
Электрохимия – это раздел химии, который изучает процессы, протекающие в расплавах или растворах электролитов при прохождении через них постоянного электрического тока.
Данные процессы сопровождаются окислительно-восстановительными реакциями.
Собственно электрохимические превращения называются электролизом.
Любой процесс электролиза протекает с применением электродов – положительно или отрицательно заряженных материалов, которые участвуют в переносе электронов на границе двух фаз: расплав или раствор электролита – материал электрода.
Электрохимические процессы исследуют в т.н. электрохимических ячейках, состоящих из сосуда с расплавом или раствором электролита и помещёнными в него электродами, через которые пропускают постоянный электрический ток
Электроды могут состоять из различных материалов. Нерастворимые электроды, как правило, состоят из графита, золота, платины а растворимые – из любых металлов (кроме щелочных).
Как известно, процесс диссоциации электролита сопровождается распадом его на катионы (положительно заряженные частицы) и анионы (отрицательно заряженные частицы).
Например, в случае диссоциации хлорида натрия, это можно изобразить схемой:
NaCl ↔ Na+ + Cl—
Если расплав данного электролита поместить в электрохимическую ячейку и пропустить через него электрический ток, то на катоде будут восстанавливаться катионы, а на аноде будут окисляться анионы.
Таким образом, в совокупности, процесс электролиза представляет собой катодный и анодный процессы
Продукты электролиза зависят прежде всего от того, в каком виде находится электролит (расплав или раствор), от материала электрода (инертный или растворимый) и от положения металла, входящего в состав соли, в ряду напряжения. В общем виде, всё это может быть сведено в следующие правила:
1) Катион электролита расположен в ряду напряжения до алюминия (включительно), то на катоде идёт процесс восстановления воды – выделяется водород.
2) Катион металла находится в ряду напряжения между алюминием и водородом, то на катоде одновременно восстанавливаются ионы металла и молекулы воды.
3) Катион металла расположен в ряду напряжения после водорода, то на катоде восстанавливается металл.
4) В растворе содержатся катионы разных металлов, то сначала восстанавливаются катионы металла, стоящего в ряду напряжения правее.
5) При растворимом аноде окисляется металл анода, независимо от вида катиона в электролите и природу аниона.
6) При нерастворимом аноде
— а) в случае электролиза раcтворов бескислородных кислот ( кроме фторидов) на аноде идёт процесс окисления аниона.
— б) в случае электролиза растворов солей кислородсодержащих кислот и фторидов на аноде идёт процесс окисления воды (выделяется кислород). Анионы не окисляются.
— в) анионы по их способности окисляться располагаются в следующем порядке:
Электролиз расплавов электролитов.
Как правило, электролиз данного вида осуществляется для соединений с ионным типом связей (соли, щёлочи).
При электролизе расплава гидроксида калия происходят следующие процессы:
Электролиз растворов электролитов.
В растворах электролитов, помимо катионов и анионов, присутствуют молекулы воды. При электролизе воды происходят следующие процессы:
Рассмотрим электролиз хлорида натрия в случае нерастворимого и растворимого анода.
а) Анод нерастворимый.
В растворе протекает процесс электролитической диссоциации:
NaCl = Na+ + Cl—
на катоде (-) ионы натрия не восстанавливаются, остаются в растворе: 2H2O + 2ē → h3 + 2OH—
на аноде (+): 2Cl— — 2ē → Cl2
Суммарное ионное уравнение:
2H2O + 2Cl— = H2 + Cl2 + 2OH—
Учитывая присутствие ионов натрия в растворе, составим молекулярное уравнение:
2NaCl + 2H2O → H2 + Cl2 + 2NaCl
б) Анод растворимый (например, медный).
Cuо — 2ē → Cu2+
Катионы меди в ряду напряжений стоят после водорода, поэтому они будут восстанавливаться на катоде.
на катоде (-): Cu2+ + 2ē → Cuо
на аноде (+): Cuо — 2ē → Cu2+
При этом концентрация хлорида натрия в растворе не меняется.
Если Вам нужна помощь по химии, записывайтесь в расписании на сайте ко мне на занятия.
С уважением, Ваш Владимир Смирнов.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Аноды в химии что такое. Что такое анод и катод — простое объяснение
Анод в электрохимии
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде . Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление . При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны , соответственно, наоборот.
См. также
- Мнемонические правила запоминания знака анода
Литература
Ссылки
- // Энциклопедический словарь Брокгауза и Ефрона : В 86 томах (82 т. и 4 доп.). — СПб. , 1890-1907.
- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов
Wikimedia Foundation . 2010 .
Синонимы :Смотреть что такое «Анод» в других словарях:
— (греч. anodos восходящая дорога). В гальваническом элементе, одна из двух пластинок или проволок, по которой вступает или выходит из жидкости электрический ток. Противоположность катоду. Словарь иностранных слов, вошедших в состав русского языка … Словарь иностранных слов русского языка
анод — а, м. anode f., англ. anode <гр. anodos путь вверх, восхождение. физ. Положительно заряженный электрод. В действии таких приборов, как гальваническая батарея, полярности нет и быть не может.. <положительный и отрицательный полюс..… … Исторический словарь галлицизмов русского языка
Отрицательный электрод Словарь русских синонимов. анод сущ., кол во синонимов: 1 электрод (10) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
анод — электровакуумного прибора; анод; отрасл. коллектор Электрод, основным назначением которого обычно является прием основного потока электронов при электрическом разряде … Политехнический терминологический толковый словарь
анод — (устройства) электрод, через который электрический ток входит в среду, имеющую удельную проводимость, отличную от удельной проводимости анода [СТ МЭК50(151) 78] анод EN anode electrode capable of emitting positive charge… … Справочник технического переводчика
— (от греческого anodos движение вверх, восхождение), электрод электронного или электротехнического прибора (например, электронной лампы, гальванического элемента, электролитической ванны), характеризующийся тем, что движение электронов во внешней… … Современная энциклопедия Толковый словарь Ожегова
— (от греч. anodos движение вверх), 1) электрод электронного или ионного прибора, соединяемый с положит. полюсом источника. 2) Положит. электрод источника электрич. тока (гальванич. элемента, аккумулятора). 3) Положит. электрод электрич. дуги.… … Физическая энциклопедия
Инструкция
1. Анод – электрод, на котором протекает реакция окисления. А электрод, на котором происходит поправление, именуется катодом.
2. Возьмите для примера гальванический элемент Якоби-Даниэля. Он состоит из цинкового электрода, опущенного в раствор сульфата цинка, и медного электрода, находящегося в растворе сульфата меди. Растворы соприкасаются между собой, но не смешиваются – для этого между ними предусмотрена пористая перегородка.
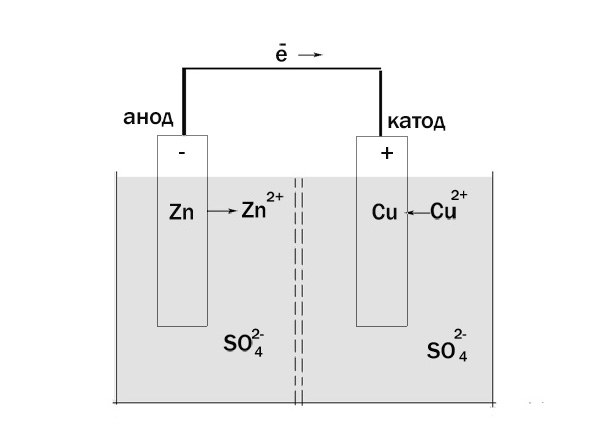
3. Цинковый электрод, окисляясь, о
Анод — Википедия




Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода (кроме гальванических элементов).[источник не указан 1317 дней]
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
Анод в вакуумных электронных приборах
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.
См. также
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Что такое электролиз? Анод и катод. Физико-химический процесс
Долгое время людям не удавалось получать многие чистые вещества в свободном виде. Такие, например, как:
- металлы;
- щелочи;
- хлор;
- водород;
- перекись водорода;
- хлорорганика и прочие.
Их получали либо с большим содержанием примесей, от которых невозможно было избавиться, либо не синтезировали вовсе. А ведь соединения очень важные для использования в промышленности и быту. Но с открытием такого процесса, как электролиз, задача огромного масштаба была решена. Сегодня он применяется не только для синтеза, но и для многих других процессов.

Что такое электролиз? Как он происходит, из каких этапов складывается, в чем заключается основное преимущество данного метода, попробуем разобраться в ходе статьи.
Что такое электролиз?
Чтобы ответить на данный вопрос, следует сначала обратиться к терминологии и уяснить некоторые основные физико-химические понятия.
- Постоянный ток — это направленный поток электронов, исходящий от любого источника электричества.
- Электролит — вещество, раствор которого способен проводить электрический ток.
- Электроды — пластинки из определенных материалов, соединенные между собой, которые пропускают электричество через себя (анод и катод).
- Окислительно-восстановительная реакция — это процесс, при котором происходит изменение степеней окисления участников. То есть одни ионы окисляются и повышают значение степени окисления, другие, напротив, восстанавливаются, понижая ее.
Уяснив все эти термины, можно ответить на вопрос о том, что такое электролиз. Это окислительно-восстановительный процесс, заключающийся в пропускании постоянного тока через раствор электролита и завершающийся выделением разных продуктов на электродах.
Простейшая установка, которую можно назвать электролизером, включает в себя всего несколько компонентов:
- два стакана с электролитом;
- источник тока;
- два электрода, соединенных между собой.
В промышленности использует гораздо более сложные автоматизированные конструкции, позволяющие получать большие массы продуктов — электролизные ванны.
Процесс электролиза достаточно сложный, подчиняется нескольким теоретическим законам и протекает по установленным порядкам и правилам. Чтобы правильно предсказать его исход, необходимо четко усвоить все закономерности и возможные варианты прохождения.

Теоретические основы процесса
Самые главные основополагающие каноны, на которых держится электролиз, — законы Майкла Фарадея — знаменитого ученого-физика, известного своими работами в области изучения электрического тока и всех сопровождающих его процессов.
Всего таких правил два, каждое из которых описывает суть происходящих при электролизе процессов.
Первый закон
Первый закон Фарадея, формула которого записывается как m=kI*Δt, звучит следующим образом.
Масса вещества, выделяющегося на электроде, прямо пропорциональна тому электричеству, которое прошло через электролит.
Из формулы видно, что m — это масса вещества, I — сила тока, Δt — время, в течение которого он пропускался. Также имеется значение k, которое называется электрохимическим эквивалентом соединения. Эта величина зависит от природы самого соединения. Численно k равно массе вещества, которое выделяется на электроде при пропускании через электролит одной единицы электрического заряда.

Второе правило электролиза
Второй закон Фарадея, формула которого — m=M*I*Δt/n*F, звучит следующим образом. Электрохимический эквивалент соединения (k) прямо пропорционален его молярной массе и обратно пропорционален валентности вещества.
Приведенная формула является результатом вывода из всех объединенных. Она отражает суть второго закона электролиза. М — молярная масса соединения, I — сила тока, пропущенного за весь процесс, Δt — время всего электролиза, F — постоянная Фарадея, n — электроны, которые участвовали в процессе. Их число равно заряду иона, принимавшего участие в процессе.
Законы Фарадея помогают понять, что такое электролиз, а также рассчитать возможный выход продукта по массе, спрогнозировать необходимый результат и повлиять на ход процесса. Они и составляют теоретическую основу рассматриваемых преобразований.

Понятие об аноде и его типы
Очень важное значение в электролизе имеют электроды. Весь процесс зависит от материала, из которого они изготовлены, от их специфических свойств и характера. Поэтому рассмотрим более подробно каждый из них.
Анод — плюс, или положительный электрод. То есть такой, который присоединяется к «+» полюсу источника питания. Соответственно, к нему из раствора электролита будут двигаться отрицательные ионы или анионы. Они будут окисляться здесь, приобретая более высокую степень окисления.
Поэтому можно изобразить небольшую схему, которая поможет запомнить анодные процессы: анод «плюс» — анионы — окисление. При этом существует два основных типа данного электрода, в зависимости от которых, будет получаться тот или иной продукт.
- Нерастворимый, или инертный анод. К такому типу относят электрод, который служит лишь для передачи электронов и процессов окисления, однако сам он при этом не расходуется и не растворяется. Таковыми анодами являются изготовленные из графита, иридия, платины, угля и так далее. Используя такие электроды, можно получать металлы в чистом виде, газы (кислород, водород, хлор и так далее).
- Растворимый анод. При окислительных процессах он сам растворяется и влияет на исход всего электролиза. Основные материалы, из которых изготавливаются подобного типа электроды: никель, медь, кадмий, свинец, олово, цинк и прочие. Использование таких анодов необходимо для процессов электрорафинирования металлов, гальванопластике, нанесения защитных покрытий от коррозии и так далее.
Суть всех происходящих процессов на положительном электроде сводится к тому, чтобы разрядились наиболее электроотрицательные по значению потенциала ионы. ИВот почему это делают анионы бескислородных кислот и гидроксид-ион, а потом вода, если речь идет о растворе. Кислородсодержащие анионы в водном растворе электролита вообще на аноде не разряжаются, так как вода делает это быстрее, высвобождая кислород.

Катод и его характеристика
Катод — это отрицательно заряженный электрод (за счет скопления на нем электронов при пропускании электрического тока). Именно поэтому к нему движутся положительно заряженные ионы — катионы, которые претерпевают восстановление, то есть понижают степень окисления.
Здесь для запоминания также уместна схема: катод «минус» — катион — восстановление. В качестве материала для катода могут служить:
- нержавейка;
- медь;
- углерод;
- латунь;
- железо;
- алюминий и прочие.
Именно на этом электроде происходит восстановление металлов до чистых веществ, что является одним из основных способов получения их в промышленности. Также возможен переход электронов от анода к катоду, а если первый — растворимый, то его ионы восстанавливаются на отрицательном электроде. Здесь же происходит восстановление катионов водорода до газа Н2. Поэтому катод — это одна из самых важных частей в общей схеме процесса электролиза веществ.

Электролиз расплавов
С точки зрения химии рассматриваемый процесс имеет свое уравнение. При помощи него можно изобразить всю схему на бумаге и предугадать результат. Самое главное, на что следует обращать внимание, — наличие или отсутствие водной среды и тип анода (растворимый или нет).
Если необходимо получение следующих продуктов: щелочных и щелочноземельных металлов, щелочей, алюминия, бериллия, газы из кислородсодержащих анионов, тогда не может идти речь об электролизе раствора электролита. Только расплав, потому что иначе требуемых соединений не получится. Именно поэтому часто в промышленности синтезируют перечисленные вещества, используя их безводные сухие соли и гидроксиды.
В целом уравнение электролиза расплава выглядит достаточно просто и стандартно. Например, если рассмотреть и записать его для йодида калия, то вид будет следующий:
KI = K+ + I—
Катод (К) «-«: К+ + 1е = К0
Анод (А) «+»: 2I— — 2e = I20
Итог процесса: KI = K + I2.
Точно так же будет записываться электролиз любого металла, независимо от значения его электродного потенциала.
Электролиз водного раствора
Если речь идет о растворах электролитов, то исход процесса будет совсем другой. Ведь вода становится активным участником. Она способна также диссоциировать на ионы и разряжаться у электродов. Поэтому в подобных случаях важное значение имеет электродный потенциал ионов. Чем его отрицательное значение ниже, тем больше вероятность более быстрого окисления или восстановления.
Электролиз водного раствора подчиняется нескольким правилам, которые следует запомнить.
- Анодные процессы: разряжаются только анионы бескислородных кислот (кроме фтороводородной). Если ион кислородсодержащий или фторид-ион, то окисляться будет вода с высвобождением кислорода.
- Катодные процессы: металлы в электрохимическом ряду напряжений (до алюминия включительно) на катоде не восстанавливаются вследствие высокой химической активности. Это делает вода с высвобождением водорода. Металлы от алюминия до водорода восстанавливаются одновременно с водой до простых веществ. Те же, что стоят после водорода в ряду напряжений (малоактивные), легко подвергаются восстановлению до простых веществ.
Если следовать этим правилам, то можно изобразить любой электролиз и просчитать выход продукта. В случае с растворимым анодом схема меняется и становится гораздо более сложной.

Электролиз солей
Данные процессы используют для получения чистых металлов и газов, так как это технологически просто и экономически выгодно. К тому же продукты выходят с большой долей чистоты, что немаловажно.
Например, электролиз меди позволяет быстро получать ее в чистом виде из раствора любой соли. Чаще всего используется медный купорос или сульфат меди (II) — CuSO4.
Как из расплава, так и из раствора данной соли можно извлечь чистый металл, который так необходим практически во всех отраслях электротехники и металлостроительстве.
Значение и применение процесса
Электролиз — очень важный процесс. На его основе базируются такие необходимые технические операции, как:
- Рафинирование металлов.
- Электроэкстракция.
- Гальванотехника.
- Электросинтез.
- Нанесение антикоррозионных покрытий и другие.
Катодная защита — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 июля 2018; проверки требуют 14 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 июля 2018; проверки требуют 14 правок. Катодная защита днища судна с использованием жертвенных анодов
Катодная защита днища судна с использованием жертвенных анодовКатодная защита — это электрохимическая защита от коррозии, основанная на наложении отрицательного потенциала на защищаемую деталь[1][2]. Катодную защиту, как правило, совмещают с нанесением защитных покрытий.
Сдвиг потенциала защищаемого металлического объекта осуществляется с помощью внешнего источника постоянного тока (станции катодной защиты) или же соединением с протекторным анодом, изготовленным из металла, более электроотрицательного относительно объекта. При этом поверхность защищаемого образца (детали конструкции) становится эквипотенциальной и на всех её участках протекает только катодный процесс. Обусловливающий коррозию анодный процесс перенесён на вспомогательные электроды. Отсюда названия — жертвенный анод, жертвенный электрод. Если, однако, сдвиг потенциала в отрицательную сторону превысит определённое значение, возможна так называемая перезащита, связанная с выделением водорода, изменением состава приэлектродного слоя и другими явлениями, что может привести к деградации защитного (изоляционного) покрытия и протеканию процесса стресс-коррозии катодно защищаемого объекта.
Катодная защита была впервые описана сэром Гемфри Дэви в серии докладов, представленных Лондонскому королевскому обществу[3] по развитию знаний о природе в 1824 году. После продолжительных испытаний впервые катодную защиту применили в 1824 г. на судне HMS Samarang[4]. Анодные протекторы из железа были установлены на медную обшивку корпуса судна ниже ватерлинии, что значительно снизило скорость корродирования меди. Медь, корродируя, высвобождает ионы меди, которые обладают антиобрастающим эффектом. В связи с чрезмерным обрастанием корпуса и снижением эффективности корабля Королевский военно-морской флот Великобритании принял решение отказаться от протекторной защиты, чтобы получить преимущества от антифоулингового эффекта вследствие корродирования меди.
Катодная защита широко применяется для защиты от коррозии наружной поверхности:
- больших металлоемких объектов энергетического комплекса, таких как подземные и наземные магистральные и промысловые трубопроводы нефти, газа и нефтепродуктов, тепловые сети, крупные резервуары и т. д. В случае невозможности или нецелесообразности применения катодной защиты для защиты от коррозии небольших объектов может применяться протекторная защита.
- металлических свайных фундаментов в грунте.
- морских причалов, оснований нефтегазовых платформ, опор мостов или любых других металлических конструкций в морской воде, причём для разных зон контакта сооружения с морской водой (зона переменного смачивания, зона полного погружения и зона погружения в морской грунт) необходимо применять разные технические решения по катодной защите.
- судов от коррозии в морской воде (преимущественно протекторная защита).
- стальной арматуры в железобетоне для свай, фундаментов, дорожных сооружений (в том числе горизонтальных покрытий) и зданий.
Не очень известным, но очень эффективным способом электрохимической защиты от коррозии является катодная защита внутренней поверхности трубопроводов и резервуаров (сосудов) любой ёмкости и назначения, имеющих контакт с агрессивным водным электролитом (промышленными сточными водами или просто водой с высоким содержанием минеральных солей и кислорода). В этом случае применение катодной защиты позволяет продлить срок безремонтной эксплуатации объекта в несколько раз.
Основным вредным последствием работы систем катодной защиты подземных сооружений (преимущественно трубопроводов), возникающим вследствие ошибок при проектировании и строительстве подобных систем, может быть ускоренная электрокоррозия (коррозия блуждающими токами) соседних с защищаемым металлических объектов. Для ее предотвращения обычно используется дренажная защита при помощи устройств с источником наложенного (принудительного) тока и устройств без источника тока (поляризованный дренаж).
- DNV-RP-B401 — Cathodic Protection Design — Det Norske Veritas
- EN 12068:1999 — Cathodic protection. External organic coatings for the corrosion protection of buried or immersed steel pipelines used in conjunction with cathodic protection. Tapes and shrinkable materials
- EN 12473:2000 — General principles of cathodic protection in sea water
- EN 12474:2001 — Cathodic protection for submarine pipelines
- EN 12495:2000 — Cathodic protection for fixed steel offshore structures
- EN 12499:2003 — Internal cathodic protection of metallic structures
- EN 12696:2000 — Cathodic protection of steel in concrete
- EN 12954:2001 — Cathodic protection of buried or immersed metallic structures. General principles and application for pipelines
- EN 13173:2001 — Cathodic protection for steel offshore floating structures
- EN 13174:2001 — Cathodic protection for harbour installations
- EN 13509:2003 — Cathodic protection measurement techniques
- EN 13636:2004 — Cathodic protection of buried metallic tanks and related piping
- EN 14505:2005 — Cathodic protection of complex structures
- EN 15112:2006 — External cathodic protection of well casing
- EN 50162:2004 — Protection against corrosion by stray current from direct current systems
- BS 7361-1:1991 — Cathodic Protection
- NACE SP0169:2007 — Control of External Corrosion on Underground or Submerged Metallic Piping Systems
- NACE TM 0497 — Measurement Techniques Related to Criteria for Cathodic Protection on Underground or Submerged Metallic Piping Systems
- ГОСТ 26251-84 — Протекторы для защиты от коррозии. Технические условия
- ГОСТ 9.056-75 — Единая система защиты от коррозии и старения. Стальные корпуса кораблей и судов. Общие требования к электрохимической защите при долговременном стояночном режиме
- ГОСТ Р 51164-98 — Трубопроводы стальные магистральные. Общие требования к защите от коррозии
- ГОСТ 9.602-2016 — Единая система защиты от коррозии и старения. Сооружения подземные. Общие требования к защите от коррозии
- ↑ Защита металлов от коррозии (ГРИГОРЬЕВ В. П., 1999), ХИМИЯ
- ↑ Электрохимическая защита
- ↑ Davy, H., Phil. Trans. Roy. Soc., 114,151,242 and 328 (1824)
- ↑ Ashworth V., Corrosion Vol. 2, 3rd Ed., 1994, 10:3
Анод — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода (кроме гальванических элементов).К:Википедия:Статьи без источников (тип: не указан)[источник не указан 1802 дня]
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
Анод в вакуумных электронных приборах
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.
См. также
Напишите отзыв о статье «Анод»
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
- Анод // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- [www.xumuk.ru/bse/189.html Анод в Большой Советской Энциклопедии]
- [electrik.info/main/fakty/99-znaem-li-my-chto-takoe-anod.html Знаем ли мы, что такое АНОД?]
- [www.iupac.org/objID/Article/pac4502x0131 Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов]
Отрывок, характеризующий Анод
Болконский узнал князя Репнина, которого он встречал в петербургском свете. Рядом с ним стоял другой, 19 летний мальчик, тоже раненый кавалергардский офицер.Бонапарте, подъехав галопом, остановил лошадь.
– Кто старший? – сказал он, увидав пленных.
Назвали полковника, князя Репнина.
– Вы командир кавалергардского полка императора Александра? – спросил Наполеон.
– Я командовал эскадроном, – отвечал Репнин.
– Ваш полк честно исполнил долг свой, – сказал Наполеон.
– Похвала великого полководца есть лучшая награда cолдату, – сказал Репнин.
– С удовольствием отдаю ее вам, – сказал Наполеон. – Кто этот молодой человек подле вас?
Князь Репнин назвал поручика Сухтелена.
Посмотрев на него, Наполеон сказал, улыбаясь:
– II est venu bien jeune se frotter a nous. [Молод же явился он состязаться с нами.]
– Молодость не мешает быть храбрым, – проговорил обрывающимся голосом Сухтелен.
– Прекрасный ответ, – сказал Наполеон. – Молодой человек, вы далеко пойдете!
Князь Андрей, для полноты трофея пленников выставленный также вперед, на глаза императору, не мог не привлечь его внимания. Наполеон, видимо, вспомнил, что он видел его на поле и, обращаясь к нему, употребил то самое наименование молодого человека – jeune homme, под которым Болконский в первый раз отразился в его памяти.
– Et vous, jeune homme? Ну, а вы, молодой человек? – обратился он к нему, – как вы себя чувствуете, mon brave?
Несмотря на то, что за пять минут перед этим князь Андрей мог сказать несколько слов солдатам, переносившим его, он теперь, прямо устремив свои глаза на Наполеона, молчал… Ему так ничтожны казались в эту минуту все интересы, занимавшие Наполеона, так мелочен казался ему сам герой его, с этим мелким тщеславием и радостью победы, в сравнении с тем высоким, справедливым и добрым небом, которое он видел и понял, – что он не мог отвечать ему.
Да и всё казалось так бесполезно и ничтожно в сравнении с тем строгим и величественным строем мысли, который вызывали в нем ослабление сил от истекшей крови, страдание и близкое ожидание смерти. Глядя в глаза Наполеону, князь Андрей думал о ничтожности величия, о ничтожности жизни, которой никто не мог понять значения, и о еще большем ничтожестве смерти, смысл которой никто не мог понять и объяснить из живущих.
Император, не дождавшись ответа, отвернулся и, отъезжая, обратился к одному из начальников:
– Пусть позаботятся об этих господах и свезут их в мой бивуак; пускай мой доктор Ларрей осмотрит их раны. До свидания, князь Репнин, – и он, тронув лошадь, галопом поехал дальше.
На лице его было сиянье самодовольства и счастия.
Солдаты, принесшие князя Андрея и снявшие с него попавшийся им золотой образок, навешенный на брата княжною Марьею, увидав ласковость, с которою обращался император с пленными, поспешили возвратить образок.
Князь Андрей не видал, кто и как надел его опять, но на груди его сверх мундира вдруг очутился образок на мелкой золотой цепочке.
«Хорошо бы это было, – подумал князь Андрей, взглянув на этот образок, который с таким чувством и благоговением навесила на него сестра, – хорошо бы это было, ежели бы всё было так ясно и просто, как оно кажется княжне Марье. Как хорошо бы было знать, где искать помощи в этой жизни и чего ждать после нее, там, за гробом! Как бы счастлив и спокоен я был, ежели бы мог сказать теперь: Господи, помилуй меня!… Но кому я скажу это! Или сила – неопределенная, непостижимая, к которой я не только не могу обращаться, но которой не могу выразить словами, – великое всё или ничего, – говорил он сам себе, – или это тот Бог, который вот здесь зашит, в этой ладонке, княжной Марьей? Ничего, ничего нет верного, кроме ничтожества всего того, что мне понятно, и величия чего то непонятного, но важнейшего!»
Носилки тронулись. При каждом толчке он опять чувствовал невыносимую боль; лихорадочное состояние усилилось, и он начинал бредить. Те мечтания об отце, жене, сестре и будущем сыне и нежность, которую он испытывал в ночь накануне сражения, фигура маленького, ничтожного Наполеона и над всем этим высокое небо, составляли главное основание его горячечных представлений.
Тихая жизнь и спокойное семейное счастие в Лысых Горах представлялись ему. Он уже наслаждался этим счастием, когда вдруг являлся маленький Напoлеон с своим безучастным, ограниченным и счастливым от несчастия других взглядом, и начинались сомнения, муки, и только небо обещало успокоение. К утру все мечтания смешались и слились в хаос и мрак беспамятства и забвения, которые гораздо вероятнее, по мнению самого Ларрея, доктора Наполеона, должны были разрешиться смертью, чем выздоровлением.
– C’est un sujet nerveux et bilieux, – сказал Ларрей, – il n’en rechappera pas. [Это человек нервный и желчный, он не выздоровеет.]
Князь Андрей, в числе других безнадежных раненых, был сдан на попечение жителей.
В начале 1806 года Николай Ростов вернулся в отпуск. Денисов ехал тоже домой в Воронеж, и Ростов уговорил его ехать с собой до Москвы и остановиться у них в доме. На предпоследней станции, встретив товарища, Денисов выпил с ним три бутылки вина и подъезжая к Москве, несмотря на ухабы дороги, не просыпался, лежа на дне перекладных саней, подле Ростова, который, по мере приближения к Москве, приходил все более и более в нетерпение.
Ответы@Mail.Ru: про катод и анод
Катод отдает электроны — остаютя, + заряженные частицы, Анод принимает электроны, следовательно, на нем избыток отрицательного заряда, то есть — .
Движение электронов от анода к катоду. Да подсоединяют Анод+,Катод-
я те вот тут ответил как есть: <a rel=»nofollow» href=»http://otvet.mail.ru/question/24302061/» target=»_blank» >http://otvet.mail.ru/question/24302061/</a>
Чисто по физике — всё правильно. Ну вот нравится Химикам, что любая пластина, опущенная в электролит — АНОД. Отсюда и непонятки…



