Анод, катод, положительный и отрицательный: основы химии батарей
04 мая 2020г.
В последнее время были совершены важные открытия в области аккумуляторных батарей (иногда называемых вторичными элементами), и большую часть этой работы можно отнести к разработке электромобилей. Эта работа помогла получить Нобелевскую химическую премию 2019 года за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» приобрели все большую важность.
В статьях о новых батарейных электродах и станциях циклирования батарей часто используются названия анод и катод без указания того, разряжается ли батарея или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, их иногда можно спутать, что может привести к ошибкам.
Цель этой статьи — прояснить и четко определить эти разные термины.
Реакции окисления и восстановления
Реакция окисления является электрохимической реакцией, которая производит электроны.
Zn + 4OH— → Zn (OH) 2-4 + 2e—
реакция окисления. Окисление — это потеря электронов.
Реакция восстановления — это электрохимическая реакция, которая потребляет электроны. Электрохимическая реакция, происходящая на положительной стороне литий-ионного аккумулятора во время разряда:
Li1 — xCoO2 + XLI++ Xe— → LiCoO2
является реакцией восстановления. Сокращение — это выигрыш электронов.
Анод, катод
- Анод — это электрод, в котором происходит реакция окисления. Потенциал анода, через который протекает ток, выше его равновесного потенциала: Ea (I)> EI = 0 (рис. 1).
- Катод — это электрод, в котором происходит реакция восстановления.
 Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Рис.1: (E
I≠0−EI=0) I > 0Положительные и отрицательные электроды
Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом упоминается как положительный, электрод с более низким потенциалом упоминается как отрицательный. Электродвижущая сила, эдс в V батареи — это разность потенциалов положительного и отрицательного электродов, когда батарея не работает.
Исследуя батарею
Разряд батареи
Во время разряда напряжение элемента U, разность между положительным и отрицательным, уменьшается (рис. 2, 3).
- Потенциал положительного электрода E+I≠0 становится меньше его значения в состоянии покоя E+I = 0 : E+I≠0 → положительный электрод является катодом.

- Потенциал отрицательного электрода E—I≠0 становится больше его значения в состоянии покоя E—I=0 : E—I>0 > E—I=0 → отрицательный электрод является анодом.
Рис. 2: Разряд и заряд батареи: слева — потенциальное изменение положительного и отрицательного электродов; справа — изменение напряжения батареи
Зарядка аккумулятора
Во время зарядки напряжение элемента U, разность между положительным и отрицательным, увеличивается (рис. 2, 3).
- Потенциал положительного электрода E+I≠0 становится больше его значения в состоянии покоя E+I=0 : E+I>0 > E+I=0 → положительный электрод является анодом.
- Потенциал отрицательного электрода E—I≠0 становится меньше его значения в состоянии покоя E—I=0 : E—I<0 < E—I=0 → отрицательный электрод является катодом.

Рис. 3: Разрядка / зарядка вторичной батареи, представленной в виде электрохимической ячейки, с электронами и направлением тока.
Вывод
При обычном использовании перезаряжаемой батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода. С другой стороны, роль каждого электрода переключается во время цикла разрядки / зарядки.
- Во время разряда положительным является катод, отрицательным является анод.
- Во время заряда положительным является анод, отрицательным является катод.
Тексты, описывающие аккумуляторные аноды или катоды, безусловно, косвенно рассматривают случай разряда, что является неполным предсталением о процессах, происходящих внутри вторичного элемента.
Поделиться в соцсетях:
Анод — это… Что такое Анод?
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода.
Электрический потенциал анода положителен по отношению к потенциалу катода.
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины.
Анод в вакуумных электронных приборах
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу —

Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.
См. также
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
РАЗНИЦА МЕЖДУ АНОДОМ И КАТОДОМ | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ — НАУКА
В ключевое отличие между анодом и катодом это то, что анод — это положительный вывод, а катод — отрицательный вывод.Аноды и катоды — это электроды с противоположной полярностью.
В ключевое отличие между анодом и катодом это то, что анод — это положительный вывод, а катод — отрицательный вывод.
Аноды и катоды — это электроды с противоположной полярностью. Чтобы узнать разницу между анодом и катодом, нам сначала нужно понять, что они собой представляют. Аноды и катоды — это электроды, которые используются для подачи электрического тока в любое устройство, использующее электричество, или из него. Электрод — это проводящий материал, который позволяет току проходить через него. Электроды обычно изготавливаются из металлов, таких как медь, никель, цинк и т. Д., Но некоторые электроды также сделаны из неметаллов, таких как углерод. Кроме того, электрод замыкает цепь, пропуская через него ток.
1. Обзор и основные отличия
2. Что такое анод
3. Что такое катод
4. Параллельное сравнение — анод и катод в табличной форме
5. Резюме
Что такое анод?
Анод — это электрод, на котором ток покидает ячейку и где происходит окисление. Мы также называем его положительным электродом. Простая батарея состоит из трех основных частей: анода, катода и электролита. Традиционно электроды находятся на концах батареи. Когда мы соединяем эти концы с электричеством, внутри батареи начинается химическая реакция. Здесь электроны возмущаются и должны реорганизоваться. Они отталкиваются друг от друга и движутся к катоду, на котором меньше электронов. Это уравновешивает электроны во всем растворе (электролите).
Мы также называем его положительным электродом. Простая батарея состоит из трех основных частей: анода, катода и электролита. Традиционно электроды находятся на концах батареи. Когда мы соединяем эти концы с электричеством, внутри батареи начинается химическая реакция. Здесь электроны возмущаются и должны реорганизоваться. Они отталкиваются друг от друга и движутся к катоду, на котором меньше электронов. Это уравновешивает электроны во всем растворе (электролите).
Как правило, ток течет через катод, когда устройство разряжается. Однако направление тока меняется на противоположное, когда устройство заряжается, и катод начинает работать как анод, а анод становится катодом.
В первичном элементе или батарее выводы необратимы, а это означает, что анод всегда будет положительным. Это потому, что мы всегда используем это устройство для разряда электрического тока. Но в случае вторичных элементов или батарей электроды обратимы, поскольку устройство разряжается, но также получают ток для зарядки.
Что такое катод?
Катод — это электрод, по которому ток входит в ячейку и происходит восстановление. Мы также можем назвать это отрицательным электродом. Однако катод может быть отрицательным в электролитических ячейках и положительным в гальванических элементах.
Катод обеспечивает электроны для катионов (положительно заряженных ионов). Эти ионы попадают на катод через электролит. Более того, катодный ток — это поток электронов от катода к катионам в растворе. Однако термины катод и анод могут иметь разные значения в разных приложениях.
В чем разница между анодом и катодом?
Анод — это электрод, на котором ток покидает ячейку и где происходит окисление, а катод — это электрод, через который ток входит в ячейку и происходит восстановление. Ключевое различие между анодом и катодом состоит в том, что анод является положительным выводом, а катод — отрицательным выводом. Однако есть также биполярные электроды, которые могут работать как аноды, так и катоды. Обычно анод притягивает анионы, а катод притягивает катионы, что привело к названию этих электродов именно так.
Обычно анод притягивает анионы, а катод притягивает катионы, что привело к названию этих электродов именно так.
Резюме — анод против катода
Анод — это электрод, на котором ток покидает ячейку и где происходит окисление, а катод — это электрод, через который ток входит в ячейку и происходит восстановление. Ключевое различие между анодом и катодом состоит в том, что анод является положительным выводом, а катод — отрицательным выводом.
Определение анода и катода — Энциклопедия по машиностроению XXL
ОПРЕДЕЛЕНИЕ АНОДА И КАТОДА [c.22]Обычно поляризуются как катодные, так и анодные участки. Это явление называется сл(е-шанным контролем. Следует заметить, что степень поляризации зависит не только от природы металла и электролита, но и от истинной площади корродирующего электрода. Если площадь поверхности анодных участков корродирующего металла очень мала, например из-за пористых поверхностных пленок, коррозия может сопровождаться значительной анодной поляризацией, даже если измерения показывают, что при данной плотности тока незащищенные участки анода поляризуются незначительно. Следовательно, отношение площадей поверхности анода и катода также является важным фактором в определении скорости коррозии. Если на график вместо суммарного коррозионного тока нанести плотность тока, например для случая, когда площадь анода составляет половину площади катода, мы получим поляризационные кривые, представленные на рис 4.9.
[c.63]
Следовательно, отношение площадей поверхности анода и катода также является важным фактором в определении скорости коррозии. Если на график вместо суммарного коррозионного тока нанести плотность тока, например для случая, когда площадь анода составляет половину площади катода, мы получим поляризационные кривые, представленные на рис 4.9.
[c.63]
Электроды, между которыми измеряют ток, должны быть укреплены на строго определенном расстоянии один от другого. Отношение между поверхностями анода и катода выбирают исходя из [c.143]
При биметаллической коррозии решающее значение для определения степени поражения имеет соотношение между площадями анодов и катодов. Если площадь анода велика по сравнению с площадью катода и раствор имеет хорошую электропроводность, то поражение распределяется по широкой площади и поэтому в большинстве случаев несущественно бис. 44, а). Однако, если последнее условие не выполняется, то вблизи катода может иметь место значительное поражение (рис. 44, б). Опасность атаки велика тогда, когда по сравнению с площадью катода, площадь анода мала (рис. 44, в).
[c.40]
Однако, если последнее условие не выполняется, то вблизи катода может иметь место значительное поражение (рис. 44, б). Опасность атаки велика тогда, когда по сравнению с площадью катода, площадь анода мала (рис. 44, в).
[c.40]
Для определения соотношения площади анода и катода, при которых возможно пассивирование анода, было изучено поведение пар нержавеющая сталь (анод) — протектор (катод) в тех же растворах серной кислоты. Проведены две серии опытов. В первой серии образцы предварительно контактировали с протектором, а затем погружали в раствор. Во второй серии образцы сначала погружали в раствор, а после начала коррозии контактировали с протектором. Результаты опытов приведены в табл. 35. [c.160]
Электроды, между которыми измеряют ток, должны быть укреплены на строго определенном расстоянии один от другого. Отношение между поверхностями анода и катода выбирают, исходя из поставленной задачи и с учетом возможного при эксплуатации, равным 1 1, 1 10,4 100 или 1 1000. [c.53]
[c.53]
Тиратрон представляет собой трехэлектродную лампу, наполненную парами ртути или инертным газом. Сетка тиратрона располагается между анодом и катодом. Если к сетке тиратрона подвести некоторый отрицательный потенциал по отношению к катоду, то движение электронов от катода к аноду будет замедлено. При определенном значении отрицательного потенциала на сетке, называемого напряжением зажигания, скорости движения электронов становятся достаточными для ионизации атомов ртути или газа. В результате ионизации появится ионный ток и возникнет дуговой разряд. Тиратрон зажжется. После этого сетка [c.122]
Реальный металл, способный корродировать в данной среде, неизбежно содержит примеси других металлов, частью более благородных, чем основной металл. Эти примеси могут либо представлять собой отдельные фазы, либо приводить к образованию их в процессе коррозии. Поэтому поверхность металла рассматривается как своего рода инкрустация, состоящая из анодов (основной металл) и микроскопических катодов. Более благородные катоды и основной металл представляют собой серию многочисленных короткозамкнутых гальванических элементов. Между катодами и анодами существует определенная разность потенциалов, которая вызывает протекание электрических токов, заставляющих металл растворяться. Чем больше разность потенциалов между катодами и анодами, тем больше сила токов, текущих в местных элементах, тем больше, следовательно, скорость коррозии. Конечно, на поверхности металла необязательно должны находиться только два типа участков — аноды и катоды. Одновременное присутствие нескольких примесей приведет к образованию системы многоэлектродных элементов, характеризуемой наличием нескольких типов катодов и анодов, обла-, дающих различными потенциалами и поляризационными характеристиками.
[c.188]
Более благородные катоды и основной металл представляют собой серию многочисленных короткозамкнутых гальванических элементов. Между катодами и анодами существует определенная разность потенциалов, которая вызывает протекание электрических токов, заставляющих металл растворяться. Чем больше разность потенциалов между катодами и анодами, тем больше сила токов, текущих в местных элементах, тем больше, следовательно, скорость коррозии. Конечно, на поверхности металла необязательно должны находиться только два типа участков — аноды и катоды. Одновременное присутствие нескольких примесей приведет к образованию системы многоэлектродных элементов, характеризуемой наличием нескольких типов катодов и анодов, обла-, дающих различными потенциалами и поляризационными характеристиками.
[c.188]
Сближение потенциалов анода и катода при замыкании элемента на конечное сопротивление зависит от поляризуемости электродов, т.
 е. от перенапряжения анодного и катодного процессов. Следовательно, оно подчиняется закономерностям кинетики электродных реакций. Закон Ома, описывающий скорость движения электрических зарядов в некоторой среде, имеющей определенное электрическое сопротивление, непригоден для описания скоростей химических или электрохимических реакций. Скорость последних экспоненциально зависит от потенциала, так как изменение его изменяет энергию активации. Использование закона Ома в рассматриваемом случае не оправдано.
[c.190]
е. от перенапряжения анодного и катодного процессов. Следовательно, оно подчиняется закономерностям кинетики электродных реакций. Закон Ома, описывающий скорость движения электрических зарядов в некоторой среде, имеющей определенное электрическое сопротивление, непригоден для описания скоростей химических или электрохимических реакций. Скорость последних экспоненциально зависит от потенциала, так как изменение его изменяет энергию активации. Использование закона Ома в рассматриваемом случае не оправдано.
[c.190]Убедившись в том, что скорость коррозии пропорциональна силе тока, дальнейшее изучение влияния величины поверхностей анода и катода на скорость коррозии анода следует вести путем определения плотности анодного тока. Для этого, выбрав наименьший размер анода (цинка), произвести последовательно испытание его в контакте с медным катодом различных размеров. Записать силу коррозионного тока в начальный момент после погружения и через 10 мин. (весь опыт продолжается лишь 10 мин. ). Затем взять наименьшую медную пластинку и контактировать ее с цинковым анодом разных размеров. Показания прибора также записывать в начальный момент испытания и через 10 мин. Если полученные результаты измерений силы тока элемента разделить на поверхность цинка, то получим плотность анодного тока (4 ) для двух серий опытов — при переменном значении поверхностей анода и катода. Эти результаты нужно выразить графически, обозначив поверхность катода через 5 , а поверхность анода через 5а
[c.51]
). Затем взять наименьшую медную пластинку и контактировать ее с цинковым анодом разных размеров. Показания прибора также записывать в начальный момент испытания и через 10 мин. Если полученные результаты измерений силы тока элемента разделить на поверхность цинка, то получим плотность анодного тока (4 ) для двух серий опытов — при переменном значении поверхностей анода и катода. Эти результаты нужно выразить графически, обозначив поверхность катода через 5 , а поверхность анода через 5а
[c.51]
Электрохимический способ укрепления грунтов состоит Б следующем в грунт опускают два электрода (анод и катод) на определенном расстоянии друг от друга. При пропуске постоянного тока частицы воды перемещаются от анода к катоду, изготовленному в виде перфорированной трубы, по которой стекает вода. Грунт в зоне анода осушается. Термическая обработка грунтов производится обжигом однородных глинистых грунтов при температуре 400—1000°С. [c.43]
Система контроля и регулирования необходима для определения следующих технологических параметров температуры рабочего раствора, pH, электропроводности, содержания сухого остатка, количества органических растворителей в растворе (не для всех материалов), а также электрического напряжения и силы тока, потребляемого токосъемной шиной, отсутствия электрического контакта между анодом и катодом, работы мешалки в ванне, степени засорения фильтров и др. [c.226]
[c.226]
Для каждого типа связки наиболее эффективным является определенный диапазон зернистости алмазного порошка. Зернистость круга определяет величину зазора между анодом и катодом, а следовательно, оказывает большое влияние на интенсивность протекания электрохимического процесса, так как изменение зазора приводит к изменению сопротивления электрической цепи. Однако при выборе зернистости следует учитывать, что алмазные зерна не только обеспечивают величину межэлектродного зазора, но и сами являются режущими элементами. [c.192]
Помимо состояния поверхности покрываемого металла, на структуру получаемого осадка в значительной степени влияют состав электролита, режим электролиза и характер применяемых электродов (анодов и катодов). Выделение металла на катоде рассматривается как процесс кристаллизации, протекающий в две стадии образование центров (зародышей) кристаллизации и рост этих центров кристаллизации. Каждый из процессов протекает с определенной скоростью и, в зависимости от условий электролиза (температуры, плотности тока, перемешивания, природы электродов, наличия в электролите примесей и т. д ), преобладает тот или иной процесс, в связи с чем получается та или иная структура металла.
[c.72]
д ), преобладает тот или иной процесс, в связи с чем получается та или иная структура металла.
[c.72]
Процесс ПМО налагает определенные требования на размеры с/с и I также и потому, что они влияют на интенсивность локализованного пятна нагрева на поверхности заготовки. Опыт показывает, что диаметр пятна нагрева и сосредоточенность теплового источника зависят от диаметра и длины соплового канала, силы тока дуги, расхода и состава плазмообразующего газа. Уменьшение ёс приводит при прочих равных условиях к повышению температуры потока газа, но увеличивает вероятность замыкания дуги на стенку сопла и возникновения так называемой двойной дуги — аварийного режима, когда сопло вынуждено работать и в качестве анода и катода. Это ведет к разрушению соплового канала. Аналогичное явление возникает и при увеличении длины I свыше определенных пределов, при превышении предельного значения силы тока, нарушении отклонения от соосности электрода и отверстия сопла, а также снижении расхода рабочего газа ниже определенного значения. Практически в плазмотронах, применяемых на производстве для ПМО, каналы сопла имеют диаметр йс— =4…6 мм, длину 1= (0,8… 1,5)с/с.
[c.16]
Практически в плазмотронах, применяемых на производстве для ПМО, каналы сопла имеют диаметр йс— =4…6 мм, длину 1= (0,8… 1,5)с/с.
[c.16]
Схема установки для электролитического травления показана на фиг. 79. В ванну с электролитом 1 погружают отшлифованный шлиф 2, являющийся анодом, и катод 5 из платины или нержавеющей стали. При пропускании через электролит постоянного тока плотностью 5—20 а/дм происходит растворение структурных составляю-пщх сплава, причем различные структурные составляющие растворяются с различной скоростью, в связи с чем после определенной выдержки (от 10 сек. до 5 мин.) получается четко выявленная микроструктура сплава. При электролитическом травлении применяют различные составы электролита например, щавелевая кислота [c.93]
По приведенной формуле можно определить продолжительность электролиза при заданной толщине покрытия. Толщина покрытия, определенная по этой формуле, будет соответствовать действительной толщине осадка при условии, что он распределен по поверхности равномерно. В действительности же толщина осадка на различных участках детали не одинакова. На выпуклых поверхностях толщина слоя больше. Разные электролиты обладают различной степенью равномерности осаждения, или различной рассеивающей способностью. Рассеивающая способность зависит от силовых линий тока, которые распределяются в электролите между анодом и катодом неравномерно, а сосредоточиваются преимущественно на выступах, краях и различных рельефных участках поверхности детали.
[c.271]
В действительности же толщина осадка на различных участках детали не одинакова. На выпуклых поверхностях толщина слоя больше. Разные электролиты обладают различной степенью равномерности осаждения, или различной рассеивающей способностью. Рассеивающая способность зависит от силовых линий тока, которые распределяются в электролите между анодом и катодом неравномерно, а сосредоточиваются преимущественно на выступах, краях и различных рельефных участках поверхности детали.
[c.271]
Потенциалам анодов и катодов на поверхности корродирующего металла можно приписать определенные значения Е и Е , отнеся их, например, к потенциалу стандартного водородного электрода (рис. 1). [c.963]
Коррозионный процесс вследствие электрохимического характера реакций, протекающих раздельно у анода и катода, сопровождается перемещением электронов от анода к катоду, т. е. протеканием электрического тока. Количество электричества, перетекающего за определенное время от анода к катоду, эквивалентно скорости коррозии. [c.14]
[c.14]
Распределение потенциала. Результаты определения распределения потенциала в растворе, полученные Агаром при помощи перемещающегося электрода, описаны при обсуждении результатов измерения коррозионных токов на стр. 782. Измерения падения потенциала в прикатодной или при-анодной зонах у железного образца, частично погруженного в раствор соли, неоднократно производились раньше. Эти измерения проводились при помощи трубочки, слегка прижатой к определенному участку поверхности. Результаты показывают, что разность потенциалов между анодом и катодом гораздо больше в разбавленных растворах, чем в концентрированных. Зти опыты представляют не только исторический интерес [53]. [c.726]
Рабочей средой служит непроводящая жидкость (вода, керосин,. масло и пр.), заполняющая МЭП (рис. 6). Когда импульсное напряжение и между анодом 1 и катодом 2 достигает определенной величины, происходит электрический пробой жидкости. В последней возникает плазменный канал разряда 3, где протекают процессы нагревания, распада и ионизации вещества рабочей среды.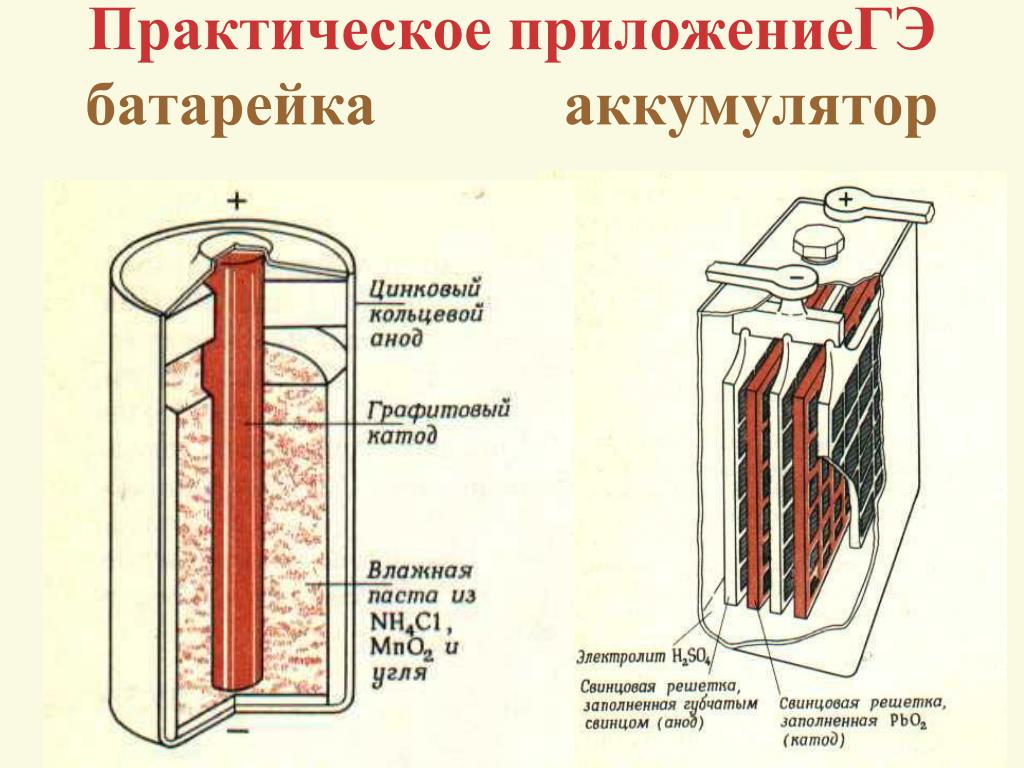 Между электродами через канал переносится электрический заряд, в плазме выделяется джоулева теплота, а переход зарядов через границу между плазмой и электродами сопровождается поступлением импульсных тепловых потоков на анод и катод. Материал ЭЗ из лунки 4 выбрасывается в МЭП.
[c.13]
Между электродами через канал переносится электрический заряд, в плазме выделяется джоулева теплота, а переход зарядов через границу между плазмой и электродами сопровождается поступлением импульсных тепловых потоков на анод и катод. Материал ЭЗ из лунки 4 выбрасывается в МЭП.
[c.13]
Сопоставляя полученные обоими способами значения плотности тока на аноде и катоде, можно оценить точность метода определения коррозии сплава, основанного на непосредственных электрических измерениях на структурных составляющих. [c.27]
Экспериментально можно определить числа переноса для ионного кристалла в опыте, схема которого дана на рис. 40. Исследуемый полупроводник берется в виде трех одинакового диаметра цилиндров I, II, III, спрессованных между токоподводящими металлическими электродами, сделанными из металла катиона испытываемого полупроводника. Убыль концентрации соли у анода и катода определяется как убыль весов анодного (/) или соответственно катодного (III) цилиндриков в результате пропускания определенного количества электричества Q. Цилиндр II является как бы полупроницаемой перегородкой между катодным и анодным пространством. Его вес в процессе опыта остается неизменным. Количество электричества, пошедшего на электролиз, q оп-
[c.66]
Цилиндр II является как бы полупроницаемой перегородкой между катодным и анодным пространством. Его вес в процессе опыта остается неизменным. Количество электричества, пошедшего на электролиз, q оп-
[c.66]
Повышение КПД ЯЭГ может быть достигнуто 1) применением вместо U-235 элементов U-233 или Ри-239, что позволит при меньшей критической массе создать более тонкие слои с большим полезным выходом, 2) более совершенной конструкцией анода и экранирующих устройств, 3) применением вместо пластинчатых электродов цилиндрических, 4) использованием делящихся материалов в виде пылинок или капель, циркулирующих в системе, что позволит улавливать коллектором все частицы, разлетающиеся в разные стороны, 5) применением двухстороннего катода, при котором плазма из делящегося матерна.ча, заключается в определенную область, действующую как двухсторонний катод. Эти и ряд [c.146]
Предварительная ультразвуковая обработка мелкодисперсного устойчивого золя гидроокиси никеля- вызывает резкое увеличение катодной поляризащш в процессе осаждения никеля и увеличение плотности покрытия. Положительный эффект снижения пористости достигается при определенном соотношении времени обработки на аноде и катоде. Для каждого вида покрытия есть оптимальная величина соотношения, выбранная в соответствии с применяемым электролитом. Реверсивный ток используется для снижения пористости покрытий при оса>кдении меди, цинка, кадмия, никеля.
[c.68]
Положительный эффект снижения пористости достигается при определенном соотношении времени обработки на аноде и катоде. Для каждого вида покрытия есть оптимальная величина соотношения, выбранная в соответствии с применяемым электролитом. Реверсивный ток используется для снижения пористости покрытий при оса>кдении меди, цинка, кадмия, никеля.
[c.68]
Электроды, между которыми измеряется ток, должны быть укреплены на строго определенном расстоянип друг от друга. Соотношение поверхностей анода и катода выбирается, исходя из возможного соотношения при эксплуатации или близкого к нему (1 1 1 10 1 100 и 1 1000). [c.33]
По мысли Эриксон-Аурена, оба электрода коррозионной пары — анод и катод — обладают различными элекТ рохими-ческими потенциалами и эта разность потенциалов в определенной мере характеризует скорость процесса. Однако в последующем это положение не удержалось в теории коррозии. [c.147]
НАПОР [массе жидкости в этом объеме температурный — разность температур двух различных смежных или разделенных стенкой сред, между которыми происходит теплообмен] НАПРЯЖЕНИЕ механическое [служит мерой внутренних сил, возникающих в деформированном теле и определяемой отношением выявленной силы к величине элементарной площадки, выбранной внутри или на поверхности тела в гидроаэростатике определяется как сила, отнесенная к единице площади поверхности, на которую она действует касательное возникает под действием сил, касательных к нормальное возникает под действием сил, нормальных к> поверхности тела трение численно равно силе внутреннего трения в газе, действующей на единицу площади поверхности слоя] электрическое (численно равно суммарной работе, совершаемой кулоновскими и сторонними силами при перемещении по участку цепи единичного положительного заряда анодное прилагается между анодом и катодом электронной лампы или гальванической ванны зажигания обеспечивает переход несамостоятельного газового разряда в самостоятельный переменное, действующее значение которого вычисляют (для периодического напряжения) как среднеквадратичное значение напряжения за период его изменения пробивное вызывает разряд через слой диэлектрика сеточное приложено между сеткой и катодом электронной лампы и служит для запирания лампы при определенном значении его на участке цепи равно произведению его сопротивления на силу тока) НАПРЯЖЕНИЯ механические (контактные возникают на площадках соприкосновения деформируемых тел температурные образуются в теле вследствие различия температур составных его частей и ограничения возможностей теплового расширения со стороны окружающих частей тела или других тел остаточные вызываются крупными дефектами материала, неоднородностью кристаллической структуры и дефектами атомно-кристаллических решеток) [c.
 253]
253]ПОД действием электронной бомбардировки происходит распыление аморфной составляющей материала анода и высвобождение на его поверхности пластинок графита. Материал, напыляемый из этих пластинок на катод, на фотографии наблюдается в виде светлых пятен. При увеличении дозы электронной бомбардировки (рис. 4.19в) происходит увеличение количества переносимого на катод материала и более равномерное распределение его по рабочей поверхности. Соответственно увеличивается шероховатость поверхности анода. В конечном итоге (при дозе электронной бомбардировки >20мА ч) происходит образование одинаковых по виду (рис. 4.19г) структур на рабочих поверхностях катода и анода, характеризующихся большим количеством микровыступов. При этом на поверхности анода наблюдаются отдельные шарообразные образования со средним радиусом закругления около 2 мкм, связанные с сублимацией графита при выделении во время электронной бомбардировки большой локальной мощности. Структуры поверхностей анода и катода свидетельствуют о существовании при определенных режимах токоотбора состояния динамического равновесия для процесса переноса материала с анода на катод и наоборот. В результате анод по структуре своей рабочей поверхности становится похожим на катод и при перемене полярности питающего напряжения работает как автокатод. Следовательно, конструкция автоэлектронного прибора с электродами из одинакового материала неприменима для выпрямительных диодов, но вполне может быть пригодной для других типов приборов, например электронно-лучевых. Основное направление для устранения вышеуказанных явлений — это улучшение теплоотвода, охлаждение электродов (особенно анода), отделение электродов друг от друга, например, сеткой и т. д.
[c.196]
В результате анод по структуре своей рабочей поверхности становится похожим на катод и при перемене полярности питающего напряжения работает как автокатод. Следовательно, конструкция автоэлектронного прибора с электродами из одинакового материала неприменима для выпрямительных диодов, но вполне может быть пригодной для других типов приборов, например электронно-лучевых. Основное направление для устранения вышеуказанных явлений — это улучшение теплоотвода, охлаждение электродов (особенно анода), отделение электродов друг от друга, например, сеткой и т. д.
[c.196]
Основной задачей при количественной оценке контак1ной коррозии является определение фактического распределения плотности токов на аноде и катоде. Задача поддается решению при выполнении следующих условий [c.75]
При определении потенциалов электродов переключателем Пр в измерительную схему перио,дически включается либо анод либо катод в паре с каломельным электродом. Из полученных значений э. д. с. вычисляют величины потенциалов анода и катода исследуемого элемента так, как это указано на стр. 37.
[c.78]
д. с. вычисляют величины потенциалов анода и катода исследуемого элемента так, как это указано на стр. 37.
[c.78]
Задача данной работы— Определение влияния изменения величины пов е,рхности анода и катода и омичеокого сопротивления на -силу така элемента [c.92]
Имея кривые распределения потенциалов, можно методом совмещения анодных и катодных кривых на одном графике построить своеобразную коррозионную диаграмму для коррозионного элемента с любым соотношением площадей. Такие диаграммы для пары медь—цинк (1 1), находящейся под тонким слоем и в объеме 0,1 N раствора Na l, приведены на рис. 91. Из этих диаграмм можно непосредственно определить разность потенциалов между участками анода и катода, возникающую вследствие омического падения потенциала в электролите. Очевидно, на границе контакта электродов омическое падение потенциала практически равно нулю, и потенциал катода равен потенциалу анода. По мере удаления от границы контакта градиент потенциала увеличивается. Отрезок, полученный от пересечения кривых распределения потенциалов на аноде и катоде, с перпендикуляром, восстаг[овленным из любой точки модели, есть не что иное, как омическое падение потенциала между плоскими электродами, находящимися на определенном расстоянии от границы контакта. Наклон кривых распределения потенциалов на аноде и катоде характеризует анодное и катодное поляризационное сопротивление. Такая своеобразная коррозионная диаграмма у1[c.144]
Отрезок, полученный от пересечения кривых распределения потенциалов на аноде и катоде, с перпендикуляром, восстаг[овленным из любой точки модели, есть не что иное, как омическое падение потенциала между плоскими электродами, находящимися на определенном расстоянии от границы контакта. Наклон кривых распределения потенциалов на аноде и катоде характеризует анодное и катодное поляризационное сопротивление. Такая своеобразная коррозионная диаграмма у1[c.144]
Для определения тока I необходимо найти проводимость электролита С. Проводимость электролита определяется при допущении, что силовые линии электрического поля имеют радиальные направления. В действительности же они должны подходить к поверхностям анода и катода по нормалям и, следовательно, обладать кривизной. Поверхность анода в осевом направлении имеет больщую кривизну, поэтому такое допущение является вполне обоснованным и не вносит значительных погрещностей в расчет. [c.245]
Для определения оптимальной защитной плотности тока при более высоких температурах использовали стеклянную колбу емкостью I л, снабженную обратным холодильником и термометром. Анод и катод, как и в предыдущих опытах, располагали концентрически. Температуру поддерживали постоянной при помощи ультратермостата и ванночки, в которую помещали колбы.
[c.88]
Анод и катод, как и в предыдущих опытах, располагали концентрически. Температуру поддерживали постоянной при помощи ультратермостата и ванночки, в которую помещали колбы.
[c.88]
Токи дифференциальной аэрации, возникающие в разделенной перегородкой ячейке. В Кембридже проводилась работа по изучению токов дифференциальной аэрации, возникающих между двумя электродами из одного металла, разделенными перегородками, в условиях, когда кислород в виде пузырьков продувался над одним из электродов. Нельзя утверждать, что подобные элементы дают точную модель обычного процесса коррозии, наблюдающегося, например, на пластинках, погруженных частично в электролит, поскольку анод и катод не являются смежными или компланарными. К тому же внешнее сопротивление будет определенно очень высоким и внутреннее сопротивление также, вероятно, будет необычно большим. В 1932 г. Хору удалось измерить дифференциальные токи на полупогруженной пластинке, не прибегая к разделению электродов или к введению других необычных внешних фак-. торов начиная с этого времени, изуче-
[c.122]
торов начиная с этого времени, изуче-
[c.122]
Опыт показывает, что для реальных микроструктурных составляющих сплава в условиях их коррозии очень редко можно наблюдать разницу эффективных потенциалов катода и анода более чем на 10 мв. Гораздо чаще имеют место заметно меньшие различия эффективных потенциалов катодной и анодной фаз корродирующего сплава. В этом случае для определения общего потенциала бинарной системы надо пользоваться уже не соотношением омических сопротивлений анодного и катодного участков цепи, как в предыдущем случае, ьо (так как эффективные потенциалы анода и катода близки друг к другу) соотношением между поляризуемостями для катодной и анодной фаз. Это наиболее наглядно поясняется поляризационной диаграммой коррозии (рис. 89), Здесь уодБ — кривая поляризации анодов бинарной системы, показывающая смещение потенциала анодов с увеличением тока пары в положительную сторону (анодная поляризация), а — кривая катодной поляризации, показывающая смещение потенциала катода с увеличением тока в отрицательную сторону (катодная поляризация).
 [c.194]
[c.194]Если рассматривать пару пора-пленка, как пару полностью заполяризо-ванную (короткозамкнутую), то определение потенциала коррозии и коррозионного тока можно легко произвести графически на основании известных поляризационных кривых для анода и катода, аналогично тому как это обсуждалось при разборе бинарных короткозамкнутых гальванических систем. Общгй измеряемый потенциал в этом случае также будет определяться удельной поляризуемостью пленки (катод) и поры (анод) и соотношением между суммарной площадью работающих катодами участков пленки и общей площадью пор. [c.207]
Рис 150 Определение характера контроля при работе модели коррозионного элемента Fe—Си в растворе 0,5 Ы Na l при равных площадях анода и катода [c.285]
А. Н. Фрумкиным и В. Г. Левичем было теоретически доказано, что поверхность корродирующего металла остается приблизительно эквипотенциальной и при наличии неоднородностей, если только размеры включений малы, а электропроводность электролита достаточно велика, что подтверждено измерениями Г. В. Акимова и А. И. Голубева (рис. 129). Как видно из рис. 129, наблюдаются заметные изменения потенциала при переходе от одной составляющей сплава (анод—цинк, катод — FeZn,) к другой, но абсолютная величина их невелика. В тех случаях, когда нас интересует только общая величина коррозии, а не распределение ее по поверхности (например, при определении величины само-
[c.185]
В. Акимова и А. И. Голубева (рис. 129). Как видно из рис. 129, наблюдаются заметные изменения потенциала при переходе от одной составляющей сплава (анод—цинк, катод — FeZn,) к другой, но абсолютная величина их невелика. В тех случаях, когда нас интересует только общая величина коррозии, а не распределение ее по поверхности (например, при определении величины само-
[c.185]
Никель анод, катод
Цветной металлопрокат/Никелевый прокат/Никель анод, катод
По вопросам цены и наличия обращайтесь
по телефонам: +7 (3435) 48-50-92; 92-26-99 +7-922-109-57-42
или отправьте Вашу заявку на E-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Анодный никель (используется для электролитических покрытий) изготавливают двух типов: непассивирующийся — марки НПАН и обычный — марок НПА-1 и НПА-2. Аноды из НПАН растворяются при электролизе равномерно, без образования шлама и являются предпочтительными.
| Марка | Ni+Co не менее |
Примеси, не более | ||||||||||||
| Fe | Si | Mg | Mn | Cu | Pb | S | C | P | Bi | As | Другие | Всего | ||
| НПАН | 99,4 | 0,1 | 0,03 | — | 0,05 | 0,01-0,1 | — | 0,002-0,01 | — | — | — | — | 0,03-0,3 (O2) | 0,6 |
| НПА1 | 99,7 | 0,1 | 0,03 | 0,1 | 0,1 | 0,1 | — | 0,005 | 0,02 | — | — | — | — | 0,3 |
| НПА2 | 99,0 | 0,25 | 0,15 | 0,1 | 0,15 | 0,15 | — | 0,005 | 0,1 | — | — | — | — | 1 |
Примечание: знак «–» в графах химического состава обозначает, что примесь не регламентирована.
| Марка | Виды изделий | Применение |
| Анод никелевый НПАН | Полосы, овальные стержни | Для электролитических покрытий |
| Анод никелевый НПА-1 | Полосы, овальные стержни | |
| Анод никелевый НПА-2 |
Никелевые катоды (для электролитических покрытий) изготавливают двух типов: непассивирующийся — марки НПАН и обычный — марок НПА-1 и НПА-2. Катоды из НПАН растворяются при электролизе равномерно, без образования шлама и являются предпочтительными.
| Марка | Ni+Co не менее |
Примеси, не более | ||||||||||||
| Fe | Si | Mg | Mn | Cu | Pb | S | C | P | Bi | As | Другие | Всего | ||
| НПАН | 99,4 | 0,1 | 0,03 | — | 0,05 | 0,01-0,1 | — | 0,002-0,01 | — | — | — | — | 0,03-0,3 (O2) | 0,6 |
| НПА1 | 99,7 | 0,1 | 0,03 | 0,1 | 0,1 | 0,1 | — | 0,005 | 0,02 | — | — | — | — | 0,3 |
| НПА2 | 99,0 | 0,25 | 0,15 | 0,1 | 0,15 | 0,15 | — | 0,005 | 0,1 | — | — | — | — | 1 |
Примечание: знак «–» в графах химического состава обозначает, что примесь не регламентирована.
| Марка | Виды изделий | Применение |
| Анод никелевый НПАН | Полосы, овальные стержни | Для электролитических покрытий |
| Анод никелевый НПА-1 | Полосы, овальные стержни | |
| Анод никелевый НПА-2 |
Цветной металлопрокат/Никелевый прокат/Никель анод, катод
И анод, и катод, 8 (восемь) букв
Примеры употребления слова электрод в литературе.
Электроды присоединялись к универсальному Центру Поэтического Восприятия, в который, кроме всего прочего, входили усилители образной структуры, ритм-модуляторы, микшеры уподоблений, аллитерационный синтезатор — все для того, чтобы слушатель в полной мере насладился стихами и проникся всеми оттенками поэтической мысли творца.
При свете раннего солнца город был похож на огромный ящик с сокровищами, обитый черным и серым бархатом пепелищ и наполненный миллионами сверкающих драгоценных камней: осколками аккумуляторов, амперметров, анализаторов, батарей, библиотечных автоматов, бутылок, банкнотов, бобин, вентиляторов, генераторов, громкоговорителей, динамо-машин, динамометров, детекторов, калориметров, конденсаторов, копилок, консервных автоматов, вакуумных установок, изоляторов, ламп, магнето, массспектрометров, масштабных линеек, машин по учету личного состава, моек для посуды, мотогенераторов, моторов, механических уборщиков, осциллографов, очистителей, записывающих устройств, напильников, колосников, обогревателей, панелей управления, понижающих трансформаторов, прерывателей, преобразователей, приводных ремней, потенциометров, пылеулавливателей, резцов, распылителей, регуляторов частоты, радиоприемников, реакторов, реле, реостатов, рентгеновских установок, сварочных аппаратов, счетных машин, счетчиков Гейгера, светофоров, сопротив
Выглядела она блистательно и дико — как в предутреннем сне интеллигентного пьяницы, по определению Корнева: сверкали в свете прожекторов конусами сходящиеся в перспективу алюминиевые дуги электродов, стеклянные чаши высоковольтных изоляторов растягивались между ними гирляндами, выстраивались в многоугольные фигуры керамические распорные балки, матово лоснились серые бока аэростатных баллонов, от натяжения капроновых тросов вокруг кабины веерами растопыривались выравнивающие пластины.
Хотя примеси давно уже загрязнили контрольные электроды, а бакта стала такой зеленой и темной, что Илису почти не было видно, Лея знала, что мастерджедай проснулась.
Так вот, после вживления электродов, добились, управляете некоторыми функциями мозга.
Источник: библиотека Максима Мошкова
Что такое анод, а что такое катод | Инженерные знания
В статьях и заметках на нашем канале частенько проскакивают слова анод и катод. Эти термины пронизываются все технические науки и будут встречаться регулярно. На первый взгляд они должны быть знакомы нам ещё этак класса из 8 школьной программы, но кто же её когда помнит 🙂 Давайте раз и навсегда разберемся с тем, что такое анод и что такое катод и когда используются эти термины.
Начнем с самого простого. Анод и катод впервые встречаются нам в курсе химии. Катод от греческого «ход вниз», анод от греческого «ход вверх».
На момент появления этих хитрых слов мы ещё не до конца понимаем, что такое электричество (советую прочитать вот эту статейку) и знаем только самые основы электрофизики. Главная путаница тут с тем, где плюс, а где минус. Однозначно тут ответить нельзя, так как зависит всё от ситуации.
Электрический ток, как нам известно, есть упорядоченное направленное движение частиц. Если всё сильно упростить (и даже немного исказить, что допустимо для общего понимания вопроса), то для существования этого тока нужны сами частицы. Их нужно где-то брать. Берутся они из источника тока. Рассматривая устройство обычной батарейки, где электрический ток получается «химическим» образом, мы наблюдаем следующую картинку.
Частицы берутся из протекающей химической реакции. На одном электроде идёт окисление, на другом — восстановление. Помним, что окисление — это отдача электронов, а восстановление — это принятие электронов. Чем не электрический ток, если увязать всё это в единую систему :)…Так, собственно говоря, и поступили.
Поместили два электрода из разных металлов в раствор электролита. Раствор электролита начал реагировать с каждым из электродов параллельно выполняя транспортную функцию для переноса заряженных частиц от одной пластины к другой пластине. Один электрод восстанавливается, а другой окисляется. Получается электрический ток. Если к этим электродам подключить внешнюю нагрузку, то получится электрическая цепь. Заряд будет «пробегать» по этой внешней нагрузке (например по лампочке) и появится электрический ток.
Если же запустить процесс в обратном направлении, то при правильном подборе химии процесса, мы сможем зарядить этот элемент питания и получится аккумулятор.
Ну а катод и анод — это просто заумные названия положительного и отрицательного электрода в такой системе.
На аноде происходит окислительная реакция а сам он восстановитель в системе. С него уходят заряженные частицы в цепь. На катоде происходит восстановительная реакция, а сам он окислитель. В цепи он принимает заряженные частицы.
Есть тут и заковырка, куда же без неё 🙂 Мало запомнить, что анод — это минус, а катод — это плюс. Очень важно понимать логику процесса и анализировать его химию. Пока мы находимся в рамках системы «элемент питания» всё будет действительно так, как мы описали выше. Но что, если мы рассматриваем электролиз? Про электролиз можно написать ещё одну огромную статью, но пока рано. Усвоим главное!
Электролиз есть процесс выделения на электродах растворённых веществ из электролита. Те самые хромированные детали, как вариант, делают именно этим способом.
В этом процессе необходим внешний источник тока, который создаст разность потенциалов между электрическими проводниками. Нужен внешний источник тока, который будет вкачивать ток в систему. Тогда на аноде будет плюс, а на катоде — противоположно.
Ещё полезно запомнить, что особенности процессов на анодах и катодах породили множество разных методик обработки. Анодировка, хромирование, различные прочие процессы гальванической обработки и активно используются в технике. Про обработку металла подобным образом я рассказывал здесь.
Ещё некоторая путаница встречается и в полупроводниках. Там тоже катод минус, а анод — плюс.
Для того, чтобы «открыть» прибор, нужно подать на анод плюс, а на катод минус. Полезно почитать вот этот материал.
Анод, катод, положительный и отрицательный: основы батареи
Обновлено: 26 августа 2021 г.Значительные разработки были сделаны в области аккумуляторных батарей (иногда называемых вторичными элементами), и большая часть этой работы может быть отнесена к разработке электромобилей. Эта работа привела к присуждению Нобелевской премии по химии 2019 года за разработку литий-ионных аккумуляторов.Следовательно, термины «анод», «катод», «положительный» и «отрицательный» стали все более заметными.
В статьях о новых электродах батареи часто используются названия анод и катод без указания того, разряжается батарея или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, иногда их можно путать, что может привести к ошибкам.
Целью данной статьи является прояснение и четкое определение этих различных терминов.
Реакции окисления и восстановления
- Реакция окисления — это электрохимическая реакция, при которой образуются электроны.- \ to LiCoO_2} $
— реакция восстановления. Уменьшение — это выигрыш электронов.
Анод, катод
- Анод — это электрод, на котором протекает реакция окисления. Потенциал анода, через который протекает ток, превышает его равновесный потенциал: $ E_ \ text a (I)> E_ {I = 0} $ (рис. 1).
- Катод — это электрод, на котором протекает реакция восстановления. Потенциал катода, по которому протекает ток, ниже его равновесного потенциала: $ E_ \ text c (I)
Рисунок 1: $ (E_ {I \ neq 0} -E_ {I = 0}) \; I> 0 $
Положительный и отрицательный электроды
Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом называется положительным, электрод с более низким потенциалом — отрицательным. Электродвижущая сила, ЭДС в В, батареи — это разность потенциалов положительного и отрицательного электродов, когда батарея не работает.- $ → отрицательный электрод является анодом.
Рисунок 2: Разряд и заряд батареи: слева, изменение потенциала положительного и отрицательного электродов; справа, изменение напряжения АКБ
Зарядная батарея
Во время зарядки аккумулятора напряжение элемента U , разница между положительным и отрицательным, увеличивается (рис. + $ → положительный электрод является анодом.- $ → отрицательный электрод является катодом.
Рисунок 3: Разряд / заряд вторичной батареи, представленной в виде электрохимической ячейки, с электронами и направлением тока.
Заключение
При нормальном использовании аккумуляторной батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода.С другой стороны, роль каждого электрода переключается во время цикла разряд / заряд.
- Во время разряда положительный полюс является катодом, отрицательный — анодом.
- Во время зарядки положительный полюс является анодом, отрицательный — катодом.
Тексты, описывающие аноды или катоды батарей, безусловно, косвенно рассматривают случай разряда. Давайте, не колеблясь, напишем, перефразируя Резерфорда, неявное — не что иное, как плохое явное.
Узнать больше о потенциостатах
Чтобы узнать больше о потенциостатах BioLogic, которые используются в исследованиях аккумуляторов и тестировании аккумуляторов среди других областей исследования, пожалуйста, щелкните нашу страницу обзора потенциостатов и страницу обзора тестирования аккумуляторов / циклического режима аккумуляторов.
Узнайте больше о кривых цикла заряда аккумулятора
Может быть интересна следующая статья «Как считывать кривые циклирования батареи»
аккумулятор анод катод положительный отрицательный электрод
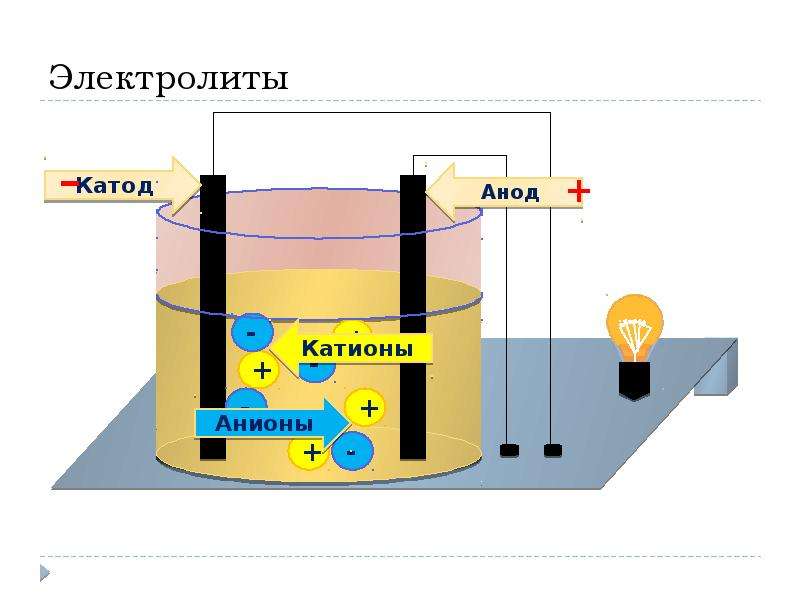
Катод и анод — определение и различие между анодом и катодом
Что такое анод и катод?
Прежде чем мы познакомимся с терминами катод и анод, сначала нам необходимо понять, что такое электрод.Согласно общему определению электрод — это вещество, которое способствует проводимости электричества, при этом электрический ток либо выходит, либо входит в неметаллическую среду, такую как электролитическая ячейка.
В чистом виде электрод можно определить как проводник, который помогает установить электрический контакт с неметаллической частью цепи. Электроды состоят из двух основных точек, называемых катодом и анодом, которые в основном описывают направление потока тока.
Объяснение анода и катода
Давайте обсудим, что именно означают катод и анод.Оба эти термина можно определить по течению тока. Таким образом, катод можно рассматривать как электрод, с которого ток выходит из поляризованного электрического устройства. Таким же образом анод можно описать как электрод, от которого ток входит в поляризованное электрическое устройство.
Термины «катод» и «анод» были окончательно определены в 1834 году Уильямом Уэвеллом. Он адаптировал слова из греческого слова (имя, катодос), «путь вниз» или «спуск». Уильям консультировался с Майклом Фарадеем при разработке терминов.
Графическое изображение катода и анода приведено ниже.
[Изображение скоро будет загружено]
Что такое катод?
Когда мы говорим о катоде в химии, можно сказать, что это электрод, на котором происходит восстановление. В электрохимической ячейке это обычное дело. Здесь катод дает отрицательные результаты из-за того, что электрическая энергия, подаваемая в элемент, приводит к разложению химических соединений. Однако можно также сказать, что он положительный, как и в случае гальванического элемента, в котором химическая реакция имеет тенденцию к выработке электрической энергии.
Кроме того, катодом называется холодный катод или горячий катод. Катод, который нагревается в присутствии нити накала для испускания электронов с помощью термоэлектронной эмиссии, называется горячим катодом, тогда как холодные катоды не нагреваются никакой нитью накала. В общем, катод помечается как «холодный», если он испускает больше электронов, чем те, которые генерируются только термоэлектронной эмиссией.
Что такое анод?
В самом общем виде анод в электрохимии определяется как точка, в которой происходит реакция окисления.Как правило, на аноде анионы или отрицательные ионы из-за своего электрического потенциала имеют тенденцию реагировать и испускать электроны. Затем эти электроны движутся вверх и попадают в цепь управления.
Если рассматривать гальванический элемент, анод имеет отрицательную природу, и в основном электроны движутся к внешней части цепи. Тогда как в электролитической ячейке он снова дается как положительный. Кроме того, анодом может быть проволока или пластина, имеющая избыточный положительный заряд.
Давайте обсудим некоторые ключевые различия между анодом и катодом:
Разница между анодом и катодом
Катод | Анод |
Анод — это электрод, в который проникает электричество. | |
Катод — это электрод с отрицательной стороной. | Анод — это электрод с положительной стороной. |
Катод действует как акцептор электронов. | Анод действует как донор электронов. |
Реакция восстановления происходит на катоде в электролитической ячейке. | На аноде электролитической ячейки происходит реакция окисления. |
Катод может стать анодом в гальванических элементах. | Анод может стать катодом в гальванических элементах. |
Заряд на аноде и катоде
На аноде наблюдается реакция окисления. Окисленные частицы потеряют электроны, оставив на этом электроде скопление электронов. Таким образом, анод заряжен отрицательно.
Но, в отличие от катода, существует реакция восстановления, при которой разновидности уменьшенных частиц будут получать электроны.Следовательно, электрод, то есть катод, не имеет электронов и поэтому заряжен положительно.
Причина, по которой катод отрицательный, а анод положительный
Это из-за того, как они были определены изначально, что датируется временем до открытия электронов. Катод был образован от греческого слова «kathodos», что означает «путь вниз», как терминала, с которого обычный ток («течет» от положительного электрода к отрицательному, противоположно направлению движения электронов) покидает устройство (с анод является выводом, куда входит обычный ток).
Катод не всегда бывает положительным или отрицательным. Но в разряженной батарее катод действует как положительный вывод, в то время как в вакуумной лампе или диоде катод действует как отрицательный вывод, поскольку обычный ток входит в них через анод или положительный вывод.
Заряды катода и анода гальванического элемента
Окислительно-восстановительные реакции в обоих полуэлементах гальванического элемента являются спонтанными. На катоде происходит восстановление, создавая положительный заряд и расходуя электроны.В то время как на аноде происходит реакция окисления, и избыточные электроны создают отрицательный заряд.
Аноды и катод — обзор
6.1.1 Принципы
Анод и катод закорочены и подключены к «низковольтной» клемме измерителя LCR. Затвор находится под «высоким потенциалом» и принимает постоянное напряжение VFG, а также слабый сигнал переменного тока (рис. 6.1a). Независимый источник напряжения подключен к заднему затвору, имитируемому заземляющим слоем или подложкой.Частота выбирается около 10 кГц, чтобы ослабить шум 1 / f и дать несущим достаточно времени для создания каналов инверсии / накопления [2].
Рисунок 6.1. (а) Установка для измерения разделенной емкости в закрытом PIN-диоде. (b) Полная емкость в зависимости от смещения переднего затвора, показывающая компоненты затвор-анод C GA и затвор-катод C GK ( t ox = t коробка = 25 нм, адаптировано из [2]).
Типичная кривая раздельного CV имеет две ветви (рис. 6.1b). Левая ветвь объясняет образование дырочного канала на границе раздела пленка / затвор-оксид и аналогична кривой расщепления CV, измеренной в МОП-транзисторе с P-каналом. Что касается правой ветви, то она описывает поведение электронного канала, точно так же, как в N-канальном MOSFET. Каждую из этих ветвей также можно измерить независимо, отсоединив одну из клемм. Это означает, что общая разделенная емкость складывает емкость затвор-анод (измеренную при разомкнутой клемме N +) и емкость затвор-катод (при отключенной клемме P +).
Разделенная емкость суммирует вклады электронов и дырок на одной кривой C – V. Это заметное преимущество PIN-диодов: для получения одинакового количества информации от транзисторов потребуется проверка двух отдельных устройств (полевые МОП-транзисторы с N- и P-каналом).
Максимальное значение емкости на рис. 6.1b одинаково для двух ветвей и указывает емкость оксида, C1 = Cox. Это происходит, когда поверхностный канал находится в состоянии сильной инверсии или сильного накопления, и его емкость превышает емкость диэлектрика затвора.С обеих сторон емкость уменьшается с | VFG | поскольку носители стремятся испаряться с поверхности. Численное моделирование показывает, что электронные или дырочные каналы никогда не могут занимать всю площадь поверхности раздела. Электронный канал закорочен на катод N + , но отделен от анода небольшой боковой обедненной областью. И наоборот, дырочный канал соединен с анодом P + и немного отделен от катода. Теперь легко понять, что минимальное значение емкости мало, но отлично от нуля, поскольку оно включает паразитные вклады переходов.
Еще более значимыми являются кривые C – V, измеренные при изменении напряжения на заднем затворе VBG (рис. 6.2a). Когда задний интерфейс сильно инвертирован (VBG = 6 В) или накапливается, емкость изменяется между двумя граничными значениями, C1 и C2, для которых линии электрического поля заканчиваются либо в верхнем канале, либо в обратном канале. В последнем случае общая емкость представляет собой последовательную комбинацию вкладов затвор-диэлектрик и полностью обедненного тела:
Рисунок 6.2. (a) Разделенная емкость C FG и (b) производная емкости в зависимости от смещения затвора, измеренная для переменного напряжения на затворе.Положения отрицательного и положительного пиков производной указывают на пороговые напряжения для дырочных и электронных фронтальных каналов. Промежуточный отрицательный пик, наблюдаемый для В BG = −2 В, обозначает пороговое напряжение обратного канала дырки (пленка толщиной 25 нм и BOX, адаптировано из [2]).
(6.1) 1C2 = 1Cox + 1Csi
Измерения с заземленным задним затвором дают квазисимметричную кривую. Поскольку задний интерфейс истощен, минимальная емкость C3 ниже, C3 Детализированная и сложная кривая C – V измеряется путем смещения заднего затвора непосредственно перед пороговым напряжением дырочного канала (VBG = −2 В, на рис. 6.2a). Изменение напряжения на переднем затворе от накопления до инверсии модулирует через интерфейсную связь переход обратного канала от накопления дырок к истощению.На этой уникальной кривой собраны несколько режимов работы. На левом конце (VFG = −2 В) дыры в теле повсюду. Общая емкость уменьшается до диэлектрической емкости C1 = Cox. По мере увеличения VFG отверстия больше не поддерживаются на переднем интерфейсе, и емкость падает. Пока задний канал все еще накапливается, емкость стремится достичь C2. Одновременно пороговое напряжение дырочного обратного канала становится все более и более отрицательным из-за эффекта связи [3], пока VBG = -2 В не станет недостаточным для поддержания дырочного канала.В этот момент (VFG = 0,2 В) задний интерфейс переходит в режим истощения, материализованный третьей точкой перегиба (перегибом). За пределами перегиба все тело полностью разряжено, в результате чего емкость падает до минимального значения C3 (для VFG = +0,5 В на рис. 6.2a). Наконец, по мере того, как VFG продолжает расти, электроны начинают заполнять переднюю границу раздела, и емкость быстро увеличивается, чтобы в конечном итоге снова достичь максимального значения C1. Симметричные вольт-фарадные кривые получаются заменой дырок электронами в обратном канале ( i.е. , VBG = + 2 В). % PDF-1.4
%
6 0 obj
>
эндобдж
xref
6 180
0000000016 00000 н.
0000004376 00000 п.
0000004453 00000 п.
0000004632 00000 н.
0000006128 00000 н.
0000006423 00000 н.
0000006687 00000 н.
0000006822 00000 н.
0000007108 00000 н.
0000007608 00000 н.
0000008307 00000 н.
0000008793 00000 н.
0000008925 00000 н.
0000009305 00000 п.
0000009353 00000 п.
0000009401 00000 п.
0000009449 00000 н.
0000009497 00000 н.
0000009545 00000 н.
0000009593 00000 н.
0000009641 00000 п.
0000009689 00000 н.
0000009737 00000 н.
0000009785 00000 п.
0000009833 00000 н.
0000009881 00000 н.
0000009929 00000 н.
0000009977 00000 н.
0000010025 00000 п.
0000010073 00000 п.
0000013757 00000 п.
0000013896 00000 п.
0000014059 00000 п.
0000014193 00000 п.
0000017681 00000 п.
0000021554 00000 п.
0000024729 00000 п.
0000028011 00000 п.
0000031403 00000 п.
0000031860 00000 п.
0000032198 00000 п.
0000035475 00000 п.
0000039125 00000 п.
0000039836 00000 п.
0000040670 00000 п.
0000041468 00000 п.
0000042233 00000 п.
0000043058 00000 п.
0000043805 00000 п.
0000044618 00000 п.
0000045365 00000 п.
0000046151 00000 п.
0000046967 00000 п.
0000047801 00000 п.
0000048635 00000 п.
0000049424 00000 п.
0000049964 00000 н.
0000050790 00000 п.
0000051642 00000 п.
0000051744 00000 п.
0000051836 00000 п.
0000064225 00000 п.
0000064499 00000 н.
0000064721 00000 п.
0000065026 00000 п.
0000075317 00000 п.
0000075580 00000 п.
0000088528 00000 п.
0000088801 00000 п.
0000088886 00000 п.
0000101411 00000 н.
0000101679 00000 п.
0000101887 00000 н.
0000102173 00000 п.
0000117542 00000 н.
0000117797 00000 н.
0000130752 00000 п.
0000131015 00000 н.
0000149558 00000 н.
0000149826 00000 н.
0000171069 00000 н.
0000171330 00000 н.
0000182373 00000 н.
0000182632 00000 н.
0000182722 00000 н.
0000194652 00000 н.
0000194920 00000 н.
0000195137 00000 н.
0000195435 00000 н.
0000220375 00000 н.
0000220630 00000 н.
0000242216 00000 н.
0000242484 00000 н.
0000242573 00000 н.
0000256035 00000 н.
0000256298 00000 н.
0000256511 00000 н.
0000256809 00000 н.
0000276729 00000 н.
0000276980 00000 н.
0000295446 00000 н.
0000296379 00000 н.
0000298014 00000 н.
0000299830 00000 н.
0000301620 00000 н.
0000303246 00000 н.
0000304833 00000 н.
0000306547 00000 н.
0000308342 00000 п.
0000310308 00000 н.
0000312330 00000 н.
0000328905 00000 н.
0000330947 00000 н.
0000332763 00000 н.
0000334012 00000 н.
0000334533 00000 н.
0000338405 00000 н.
0000339433 00000 н.
0000340790 00000 н.
0000342696 00000 н.
0000344879 00000 п.
0000347030 00000 н.
0000407227 00000 н.
0000409412 00000 н.
0000411737 00000 н.
0000413885 00000 н.
0000415481 00000 н.
0000417653 00000 н.
0000419820 00000 н.
0000422067 00000 н.
0000424383 00000 п.
0000426688 00000 н.
0000428840 00000 н.
0000454683 00000 н.
0000456722 00000 н.
0000458787 00000 н.
0000461001 00000 н.
0000463031 00000 н.
0000464408 00000 п.
0000466395 00000 н.
0000468529 00000 н.
0000470677 00000 н.
0000472641 00000 н.
0000474286 00000 н.
0000488516 00000 н.
0000489677 00000 н.
00004 00000 н.
0000492557 00000 н.
0000494446 00000 н.
0000496514 00000 н.
0000498753 00000 н.
0000500717 00000 н.
0000502076 00000 н.
0000504173 00000 н.
0000506427 00000 н.
0000509532 00000 н.
0000511803 00000 н.
0000513751 00000 н.
0000515920 00000 н.
0000518262 00000 н.
0000520569 00000 н.
0000522832 00000 н.
0000525019 00000 н.
0000527045 00000 н.
0000528634 00000 н.
0000530717 00000 н.
0000556400 00000 н.
0000558596 00000 н.
0000560811 00000 н.
0000563039 00000 н.
0000565269 00000 н.
0000567247 00000 н.
0000568615 00000 н.
0000569715 00000 н.
0000576249 00000 н.
0000611735 00000 н.
0000648593 00000 п.
0000669992 00000 н.
0000676695 00000 н.
0000003896 00000 н.
трейлер
] / Назад 739146 >>
startxref
0
%% EOF
185 0 объект
> поток
h ބ K (a3 # Rn1I3 # PlJM \ ۂ ,, d64bC) Bj6n% ir %% dBz: Электрохимические элементы, о которых вы узнали, являются гальваническими элементами.Гальванический элемент — это элемент, в котором спонтанная окислительно-восстановительная реакция производит электричество. В гальваническом элементе, как вы знаете, реакция окисления на аноде заставляет электроны проходить через провод, соединяющий катод с анодом. Он называется электрическим потенциалом и измеряется в вольтах (В). Более конкретно, потенциал электрода — это разность потенциалов между электродом и его раствором или величина притяжения электронов. Это количество энергии, необходимое для перемещения электрического заряда по ячейке. Каждая из двух полуэлементов батареи имеет потенциал — потенциал либо отдавать электроны, либо принимать электроны. Разница между ними — это электродный потенциал всей ячейки или напряжение. К счастью, потенциал электрода — это не то, что вам нужно запоминать. Ученые определили стандартные электродные потенциалы для многих различных типов электродов. Чтобы определить напряжение любой ячейки, посмотрите таблицу электродных потенциалов. Вычтите электродный потенциал анода из потенциала катода, и вы получите электродный потенциал ячейки или напряжение: ячейка Eo = катод Eo — анод Eo. Это число легко вычислить. Например, рассчитайте напряжение ячейки для реакции жидкого ртутного электрода в растворе нитрата ртути (I) и металлического кадмиевого электрода в растворе нитрата кадмия. Если Eo вам не предоставлено, вы можете обратиться к диаграмме для определения значения. Формула полуреакций: Ячейка Eo = 0,850 В — (-0,403 В). Помните, что два негатива дают положительный результат. Ячейка Eo = 1,253 В. Попробуйте другой. Ячейка Eo = (-0,762 В) — (-0,828 В). Итак, ячейка Eo = 0,066 В. Как вы знаете, трубопровод Аляски представляет собой длинную стальную трубу, по которой нефть доставляется с Аляски в 48 нижних штатов. Что бы произошло, если бы он заржавел? Не разольется ли нефть в окружающей среде? Как защитить металл от коррозии? Коррозия — это постепенное разрушение металла в результате химических реакций. Поскольку это химическая реакция, мы можем предотвратить ее с помощью химических реакций, а именно окислительно-восстановительных реакций. Одним из металлов, наиболее подверженных коррозии, является железо.Когда железо подвергается коррозии, ржавчина образуется в реакции 4Fe (s) + 3O2 (g) + h3 = 2Fe2O3h3O (s). Количество образующейся ржавчины зависит от количества воды, с которой железо может реагировать. Две электрохимические полуреакции: Анод и катод находятся на одной и той же железке, но в разных ее частях. Вы знаете, что для того, чтобы эта реакция сработала, электронам нужен какой-то провод или какой-то способ проведения электронного потока.В этом случае проволокой выступает сам утюг. Итак, когда кусок железа подвергается воздействию кислорода и воды, участок на железе окисляется и теряет электроны. Эти электроны перетекают через железо к другому участку, где они восстанавливаются. Здесь они образуют твердое вещество, называемое гидратированным оксидом железа, 2Fe2sub) 3sub) 2. Слой воды на поверхности железа действует как барьер или солевой мостик, необходимый для работы электрохимической ячейки или реакции. Чтобы предотвратить коррозию, используйте другой металл, который окисляется легче, чем металл, который вы хотите защитить. Цинк окисляется легче, чем железо, поэтому, если вы покроете железо цинком, цинк будет коррозировать раньше, чем железо. Это защищает утюг. Это называется катодной защитой, потому что вы добавляете к металлу защитный катод. Гвозди являются примером. Железные гвозди часто покрывают цинком в процессе, называемом гальванизацией, чтобы защитить их от ржавчины. Трубопровод на Аляске — еще один прекрасный пример такого типа защиты. Вместо того, чтобы покрывать все цинком, трубопровод подключается к цинковой проволоке. Цинк будет корродировать раньше, чем сталь, и если корродированный цинк будет периодически заменяться, сама труба не подвергнется коррозии. Это отличная вещь. Электрохимические реакции в ячейке состоят из двух полуреакций: на анодном электроде и на катодном электроде. Две полуреакции можно сложить вместе, чтобы получить полноценную клеточную реакцию.Потенциал электродной ячейки измеряется в вольтах. Достаточно легко определить напряжение любой электрохимической ячейки, если у вас есть таблица, в которой указаны напряжения для каждого типа электрода. Чтобы определить напряжение любой ячейки, вычтите потенциал электрода анода из потенциала катода, и вы получите электродный потенциал ячейки или напряжение. Ячейка Eo = катод Eo — анод Eo . Коррозия — это постепенное разрушение металла в результате химических реакций, и это реальная проблема в нашей повседневной жизни.Поскольку коррозия — это химическая реакция, мы можем предотвратить ее с помощью химических реакций, а именно окислительно-восстановительных реакций. Чтобы предотвратить коррозию, используйте другой металл, который окисляется легче, чем металл, который вы хотите защитить. Как и в большинстве случаев в жизни, химические реакции протекают по пути наименьшего сопротивления и наименьшей энергии, поэтому металл, который легче окисляется, подвергнется коррозии, а другой металл будет защищен. По окончании этого урока вы сможете: В окислительно-восстановительных реакциях электроны передаются от одного вида к другому.Если реакция спонтанная, высвобождается энергия, которую затем можно использовать для полезной работы. Чтобы использовать эту энергию, реакция должна быть разделена на две отдельные половинные реакции: реакции окисления и восстановления. Реакции помещаются в два разных контейнера, и для перемещения электронов с одной стороны на другую используется проволока. При этом создается вольтово-гальванический элемент . Когда происходит окислительно-восстановительная реакция, электроны передаются от одного вида к другому.-_ {3 \; (aq)} \) ионы. Ионы NO 3 — (водн.) можно игнорировать, поскольку они являются ионами-наблюдателями и не участвуют в реакции. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра. Ag + (водн.) будет легко окислять Cu (s) , что приводит к Cu 2 + (водн.) , восстанавливаясь до Ag (s) . Эта реакция высвобождает энергию. Однако когда твердый медный электрод помещают непосредственно в раствор нитрата серебра, энергия теряется в виде тепла и не может использоваться для выполнения работы.Чтобы обуздать эту энергию и использовать ее для полезной работы, мы должны разделить реакцию на две отдельные половинные реакции; Реакции окисления и восстановления. Проволока соединяет две реакции и позволяет электронам перемещаться с одной стороны на другую. При этом мы создали гальванический / гальванический элемент . Рисунок \ (\ PageIndex {1} \): Гальванический элемент Гальванический элемент (также известный как гальванический элемент) — это электрохимический элемент, который использует спонтанные окислительно-восстановительные реакции для выработки электричества.Он состоит из двух отдельных полуэлементов . Полуячейка состоит из электрода (полоски металла, M) в растворе, содержащем ионы M n + , в котором M — любой произвольный металл. Две полуэлементы связаны между собой проводом, идущим от одного электрода к другому. Соляной мостик также соединяется с полуячейками. Функции этих частей обсуждаются ниже. Половина окислительно-восстановительной реакции происходит в каждой половине ячейки. Следовательно, можно сказать, что в каждой полуячейке происходит полуреакция.Когда две половинки соединяются вместе проволокой и солевым мостиком, создается электрохимическая ячейка. Электрод — это металлическая полоска, на которой происходит реакция. В гальваническом элементе окисление и восстановление металлов происходит на электродах. В гальванической ячейке два электрода, по одному в каждой полуячейке. Катод — это место, где происходит восстановление, а окисление происходит на аноде . В электрохимии эти реакции протекают на металлических поверхностях или на электродах . Между металлом и веществами в растворе устанавливается окислительно-восстановительное равновесие. Когда электроды погружаются в раствор, содержащий ионы того же металла, он называется полуячейкой . Электролиты — это ионы в растворе, обычно в жидкости, который проводит электричество за счет ионной проводимости. Между атомами металла на электроде и ионными растворами могут происходить два возможных взаимодействия. Когда электрод окисляется в растворе, он называется анодом , а когда электрод восстанавливается в растворе. он называется катодом . Вспоминая окисление и восстановление Когда дело доходит до окислительно-восстановительных реакций, важно понимать, что означает «окисление» или «восстановление» металла.+ _ {(aq)} \) получает электрон, что означает его сокращение. \ (Cu _ {(s)} \) теряет два электрона и окисляется. Соляной мостик — жизненно важный компонент любого гальванического элемента. Это трубка, заполненная раствором электролита, например KNO 3 (s) или KCl (s) . Назначение солевого мостика состоит в том, чтобы сохранять растворы электрически нейтральными и обеспечивать свободный поток ионов от одной ячейки к другой. Без солевого мостика вокруг электродов будут накапливаться положительные и отрицательные заряды, что приведет к остановке реакции. Назначение солевого мостика — поддерживать электрическую нейтральность растворов и обеспечивать свободный поток ионов от одной ячейки к другой. Электроны всегда текут от анода к катоду или от полуэлемента окисления к полуэлементу восстановления. С точки зрения ячейки E o полуреакций, электроны будут течь от более отрицательной половины реакции к более положительной половине реакции. Схема ячейки — это изображение электрохимической ячейки.На рисунке ниже показана диаграмма ячеек для гальваники, показанная на рисунке \ (\ PageIndex {1} \) выше. Рисунок \ (\ PageIndex {2} \): Диаграмма ячеек . На рисунке ниже показана диаграмма ячеек для гальваники, показанная на рисунке \ (\ PageIndex {1} \). При рисовании диаграммы ячеек мы придерживаемся следующих соглашений. Анод всегда размещается на левой стороне , а катод размещается на правой стороне . Соляной мост изображен двойными вертикальными линиями (||).o_ {cell} \) для гальванической ячейки, образованной каждой реакцией. Решение 1.a) Ba 2+ (водн.) → Ba (s) + 2e- с SRP (для противоположной реакции) E o = -2,92 В (анод; где происходит окисление) Cu 2+ (водн.) + 2e- → Cu (s) с SRP E o = +0,340 В (катод; там, где происходит восстановление) 1.b) Al 3+ (водн.) → Al (s) + 3e — с SRP (для противоположной реакции) E o = -1.66 В (анод; там, где происходит окисление) Sn 2+ (вод.) + 2e — → Sn (s) с SRP E o = -0,137 В (катод; там, где происходит восстановление) 2.a) Ba 2+ (водн.) | Ba (s) || Cu (s) | Cu 2+ (водн.) 2.b) Al (s) | Al 3+ (водн.) || Sn 2+ (водн.) | Sn (т) 3.а) E o ячейка = 0,34 — (-2,92) = 3,26 В 3.b) E o ячейка = -0,137 — (-1,66) = 1,523 В Показания вольтметра дают реактивное напряжение ячейки или разность потенциалов между двумя двумя полуячейками. Напряжение ячейки также известно как потенциал ячейки или электродвижущая сила (ЭДС) и обозначается символом \ (E_ {cell} \).о_ {анод} \] Значения E o сведены в таблицу для всех растворенных веществ при 1 M и всех газов при 1 атм. Эти значения называются стандартными потенциалами восстановления . Каждая полуреакция имеет различный восстановительный потенциал, разность двух восстановительных потенциалов дает напряжение электрохимической ячейки. Если ячейка E o положительна, реакция является спонтанной, и это гальваническая ячейка. Если ячейка E o отрицательная, реакция не является спонтанной и называется электролитической ячейкой. Дом »
Коррозия »
Защита от коррозии стали » Расходные аноды Одним из типов системы катодной защиты является расходуемый анод.Анод изготовлен из металлического сплава с более «активным» напряжением (более отрицательным электрохимическим потенциалом), чем металл конструкции, которую он защищает (катод). Разница потенциалов между двумя металлами означает, что расходный материал анода корродирует, а не структуру. Это эффективно останавливает реакции окисления на металле защищаемой конструкции. Должны существовать два других условия, помимо анода и катода, чтобы метод протекторного анода работал.Должен быть путь обратного тока для электронов, чтобы течь от анода к материалу, который он защищает (физический контакт — обычный путь), и электролит (вода, влажность) для переноса электронов. Жертвенные аноды обычно изготавливаются из трех металлов: магния, алюминия и цинка. Магний имеет самый отрицательный электропотенциал из трех (см. Гальваническую серию справа) и больше подходит для береговых трубопроводов, где удельное сопротивление электролита (грунта или воды) выше.Если разница в электропотенциале слишком велика, защищаемая поверхность (катод) может стать хрупкой или вызвать отслоение покрытия. Цинк и алюминий обычно используются в соленой воде, где удельное сопротивление обычно ниже. Типичное применение — корпус судов и катеров, морских трубопроводов и производственных платформ, в морских двигателях с водяным охлаждением, на гребных винтах и рулях малых лодок, а также для внутренней поверхности резервуаров для хранения. Преимущество расходуемых анодных систем перед другими заключается в том, что они не нуждаются во внешнем источнике питания, просты в установке, низкое напряжение и ток между анодом и защищаемой поверхностью нечасто генерируют паразитный ток, чрезмерная защита маловероятна, а проверка и контроль невозможны. просто для обученного персонала. Есть несколько недостатков, в том числе ограниченная токовая нагрузка в зависимости от массы анода, неэффективность в средах с высоким удельным сопротивлением. Увеличенный вес защищаемой конструкции и увеличенный поток воздуха и воды на движущиеся конструкции, такие как корабли. Катодные и анодные реакции полуячейки — Видео и стенограмма урока
Расчет потенциала напряжения элемента
Электрод Реакционный электрод Eo Вольт Cd2 + Кд2 + Коррозия
Резюме урока
Результаты обучения
Voltaic Cells — Chemistry LibreTexts
Введение
Полуэлементы
Электроды
Поток электронов
Напряжение ячейки / потенциал ячейки
Список литературы
Авторы и указание авторства
расходных анодов | Американская ассоциация гальванизаторов




 Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
