Что такое емкость аккумуляторной батареи.
Емкость аккумуляторов — это количество электрической энергии, которое может отдать полностью заряженный аккумулятор при определенном режиме разряда и температуре от начального до конечного напряжения. Единицей СИ для электрического заряда является кулон (1Кл), но на практике емкость обычно выражается в ампер-часах (Ач).
Емкость измеряют в ампер-часах и определяют по формуле:
C=Iptp,
где С – емкость, Ач;
p – сила разрядного тока, А;
tp – время разряда, Ч.
Номинальная емкость — емкость, которую должен отдать новый полностью заряженный аккумулятор в нормальных условиях разряда, указанных в стандарте на этот аккумулятор. При этом напряжение не должно упасть ниже определенной величины.
Так как емкость зависит от разрядного тока и конечного разрядного напряжения, в условном обозначении аккумуляторов указывается емкость, соответствующая определенному режиму разряда. Для стартерных аккумуляторов за номинальную принимается емкость при 20-часовом, стационарных при 10-часовом, тяговых при 5-часовом режимах разряда.
Пример оценки ёмкости батареи 20-ти часовым режимом разряда током 0.05С20 (током, равным 5% от номинальной ёмкости). Если ёмкость батареи 55Ач, то разряжая ее током 2.75А, она полностью разрядится за 20 часов. Аналогично для батарей ёмкостью 60Ач полный 20-ти часовой разряд произойдет при чуть большем токе разряда — 3А.
Емкость зарядная — количество электричества, принимаемое аккумуляторной батареей во время заряда. Зарядная емкость акб всегда больше разрядной из-за потерь энергии на побочные реакции и процессы.
Отдача по емкости — отношение количества электричества, полученного от аккумулятора при разряде, к количеству электричества, необходимого для заряда аккумулятора до первоначального состояния при определенных условиях.
Она зависит от полноты заряда. Часть же заряда теряется на газообразование, это уменьшает коэффициент отдачи.
Емкость остаточная – величина, соответствующая количеству электричества, которое может отдать частично разряженный аккумулятор при установленном режиме разряда до конечного напряжения.
Резервная ёмкость аккумуляторной батареи — время, в течение которого батарея сможет обеспечить работу потребителей в аварийном режиме. Величина резервной ёмкости, выраженная в минутах, последнее время все чаще проставляется изготовителями стартерных аккумуляторных батарей после значения тока холодного старта.
Емкость зарядная — количество электричества, сообщаемое аккумулятору во время заряда.
При постоянном токе заряда l зарядная емкость С= It, где t — время заряда.
Измерение емкости ведется до падения напряжения хотя бы одного элемента аккумуляторной батареи до величины, регламентированной для конкретного режима разряда.
В течение срока службы емкость акб изменяется. В начале срока службы она возрастает, так как происходит разработка активной массы пластин. В процессе эксплуатации емкость некоторое время держится стабильной, а затем начинает постепенно уменьшаться из-за устаревания активной массы пластин.
Емкость батареи зависит от количества активного материала и конструкции электродов, количества и концентрации электролита, величины тока разряда, температуры электролита, степени изношенности аккумулятора, наличия посторонних примесей в электролите и других факторов.
При увеличении тока разряда емкость батареи уменьшается. АКБ при форсированных режимах разряда отдают емкость меньше, чем при разряде более длительными режимами (небольшой величиной тока). Поэтому на аккумуляторах могут быть обозначения при 3,5,6,10,20 и 100 часах разряда. При этом емкости одной и той же батареи будут совершенно разные. Наименьшая будет при 3-х часовом разряде, наибольшая при 100 часовом.
С повышением температуры электролита емкость растет, но при излишне высоких температурах уменьшается срок их службы. Это происходит потому что, при повышении температуры электролит легче проникает в поры активной массы, так как уменьшается его вязкость и увеличивается внутреннее сопротивление.Поэтому в реакции разряда принимает участие больше активной массы, чем при заряде, производившемся при более низкой температуре.
При низких же температурах емкость и полезное действие АКБ быстро уменьшается.
Если увеличить концентрацию (плотность электролита), то емкость также увеличится, но аккумулятор быстро выйдет из строя из-за разрыхления активной массы батареи.
как рассчитать емкость аккумуляторной батареи
Любой современный аккумулятор (хоть от мобильного телефона, хоть от автомобиля) обладает двумя важнейшими характеристиками: это номинальное напряжение источника питания и его электрическая емкость. Совокупностью двух этих показателей определяется полная энергия аккумулятора, то есть та максимальная энергия, которую только возможно накопить при его полной зарядке.

Аккумуляторы
Что такое емкость аккумулятора
От этого параметра зависит количество времени, в течение которого аккумулятор способен отдавать предварительно накопленную в результате зарядки электроэнергию. Этот показатель одинаково важен как для аккумуляторной батареи автомобиля, так и для «пальчикового» аккумулятора от плеера или фотоаппарата. То же самое относится и к источникам питания сотовых телефонов.
Особенно большие неприятности могут случиться, если взять не ту емкость для АКБ автомобиля. Во-первых, емкости может не хватить для питания бортовой сети при неработающем двигателе, самое страшное – могут возникнуть проблемы с запуском в зимнее время. О том, как рассчитать емкость аккумулятора, должен иметь представление каждый автомобилист.
Исчерпывающую информацию об этом параметре современного источника питания можно получить, взглянув на его маркировку. Например, 1200 mAh (1200 миллиампер-часов), 60 Ah (60 ампер-часов). В отличие от емкости конденсатора, которая измеряется в фарадах, для аккумулятора используется внесистемная единица измерения – Ah (Ampere hour, «ампер-час»). Часы в этой единице измерения присутствуют по той причине, что, в отличие от конденсатора, который разряжается мгновенно, аккумулятор призван обеспечить питание в течение достаточно продолжительного времени.

Емкость данного аккумулятора составляет 60 ампер-часов
Емкость, выраженная в ампер-часах, показывает на то, в течение какого времени данный аккумулятор способен питать нагрузку с указанным током потребления.
Обратите внимание! О чем говорит такая аббревиатура, как, например, 30 Ah? Полностью заряженный аккумулятор с емкостью в 30 ампер-час может работать в течение одного часа, поддерживая нагрузку в сети в 30 А с номинальным напряжением в 12,7 V.
30 А – это довольно большое значение силы тока, при напряжении 12,7 V мощность аккумулятора будет составлять: I*V=30*12,7=0,381 kW. Этой мощности достаточно для освещения всего дома в течение суток, если там стоят светодиодные лампы, которые потребляют от 3 до 5 W за один час эксплуатации. Время работы находится в обратной зависимости от тока нагрузки: чем он меньше, тем дольше аккумулятор способен поддерживать работу сети. Если ток нагрузки составляет 10 А, он будет работать 3 часа, если 5 А, то 6 часов.

Аккумулятор сотового телефона
Емкость АКБ сотового телефона колеблется в пределах от 500 до 2000 mAh. Такая батарея позволит телефону или смартфону работать в активном режиме в течение недели. При этом надо учитывать активность самого пользователя: если человек разговаривает по телефону более часа каждый день, пользуется будильником, различными играми, тогда самой большой емкости хватит на день-два.
Дополнительная информация. Расчет полной емкости аккумулятора возможен только эмпирическим путем. Когда он отрабатывает указанные на маркировке положенные ампер-часы, это отнюдь не значит, что после этого он больше не способен выдавать электричество. Без подзарядки аккумулятор еще достаточно продолжительное время способен вырабатывать электрическую энергию. Однако силы тока при этом будет недостаточно для той цели, с которой он используется.
Аккумулятор и аккумуляторная батарея
Как добиться увеличения емкости источника питания? Самый простой и очевидный способ – это увеличение вещества, участвующего в химической реакции. При этом произойдет увеличение силы тока, и процесс выработки электроэнергии будет протекать дольше, то есть число ампер-часов станет больше. Однако этот метод далеко не всегда можно применить на практике. Получить рассчитанную емкость путем увеличения или уменьшения количества реактивов не всегда представляется возможным.
Дело в том, что будь аккумулятор самых больших размеров, и на его изготовление потрачено огромное количество лития, напряжение вырабатываемого электричества нисколько не увеличится. Этот показатель заложен в самой основе химической реакции. Для кислотного аккумулятора он составляет 2 V, для литий-ионного – 3,7 V.
Так как же получить напряжение 12 V, необходимое для запуска автомобильного двигателя? Для этого нужно аккумуляторы объединить в батарею. Например, 6 свинцово-кислотных аккумуляторов с напряжением 2 V соединить последовательно между собой.
Существует два способа соединения аккумуляторов:
- последовательное, при котором возрастает напряжение, при неизменной емкости;
- параллельное, когда количество ампер-часов увеличивается, напряжение остается постоянным.
Емкость аккумуляторной батареи, как и ее напряжение, посчитать нетрудно, для этого может не понадобится даже обычного калькулятора. Если, например, два кислотных аккумулятора емкостью 1 Ah соединить между собой параллельно, то фактически произойдет удвоение емкости при неизменном напряжении. При их последовательном соединении получится наоборот: напряжение увеличится в 2 раза, емкость останется прежней. При этом в обоих случаях количество электроэнергии от двух источников питания увеличится вдвое.
Моноблок
Собрать батарею из отдельных аккумуляторов можно с помощью медного провода или шины с клеммами. Этот процесс, хотя и несложный, все же довольно трудоемкий, поэтому на заводах изготавливают готовые моноблоки. Они представляют из себя несколько элементов, собранных в одном корпусе из прочной пластмассы. Моноблок свинцово-кислотных аккумуляторов, как правило, состоит из 6 или 12 отдельных элементов. Напряжение составляет, соответственно, 12 V или 24 V.

Моноблок
Все элементы моноблока ничем не отличаются друг от друга, и их старение протекает одновременно, поэтому срок эксплуатации моноблока больше, чем у каждого отдельного аккумулятора. В процессе сборки моноблока возможно использование как параллельного, так и последовательного соединения его отдельных элементов.
Обратите внимание! Срок службы АКБ измеряется не в годах или месяцах, а количеством зарядных циклов. Чтобы батарея могла служить как можно дольше, повторную зарядку желательно производить после использования лишь малой части ее номинальной емкости.
Видео
Емкость аккумулятора
Стандартная современная 12-вольтовая автомобильная аккумуляторная батарея выполнена из шести последовательно соединенных между собой блоков разноименно заряженных пластин, каждый из которых и представляет собой простейший аккумулятор с выходным напряжением около 2 вольт. Положительно заряженная пластина (электрод) представляет собой свинцовую решетку с активной массой из двуокиси свинца (PbO2), а электрод со знаком минус — решетку с активной массой из губчатого свинца (Pb). Полублоки разноименно заряженных пластин вставляются друг в друга. Во избежание возникновения короткого замыкания между пластинами, их разделяют пористыми сепараторами из изоляционного материала. Собранные блоки помещаются в корпус и заливаются электролитом (раствором серной кислоты плотностью 1,27-1,29 г/см3). Полюса (баретки) крайних элементов соединяются с расположенными снаружи корпуса контактными выводами — борнами.
Если к аккумулятору подключить нагрузку, то свинцовые пластины с активной массой, электролит и нагрузка образуют замкнутую цепь. Внутри аккумулятора начинается химическая реакция, в результате которой активная масса обоих электродов начнет менять первоначальный состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат свинца PbSO4), а плотность электролита начинает падать. В итоге в цепи образуется направленное движение ионов, и течет электрический ток. Такой процесс представляет собой разряд аккумулятора. При подключении к аккумулятору внешнего источника тока начинается обратный процесс — заряд. При заряде активная масса пластин восстанавливает свой первоначальный состав, плотность электролита растет. Эти химические процессы можно описать следующими уравнениями:
— на положительной пластине: PbO2 + H2SO4 = PbSO4 + H2O + 2e;
— на отрицательной пластине: Pb + H2SO4 = PbSO4 + H2 — 2e.
Из всего вышесказанного следует, что количество запасаемой аккумулятором энергии (емкость) определяется объемом активной массы и электролита.
Поскольку автомобильная 12-вольтовая аккумуляторная батарея состоит из шести аккумуляторных элементов, соединенных в батарею последовательно, то по сути устройство, в повседневном обиходе просто называемое «аккумулятор», на самом деле является батареей из нескольких аккумуляторов.
Впервые серийно аккумуляторные батареи стали устанавливать на автомобили Cadillac в 1912 г. На первых автомобилях аккумуляторные батареи были снимаемые, т. к. из-за отсутствия бортового генератора после разряда их приходилась подзаряжать от внешнего источника тока.
В автомобиле аккумуляторная батарея выполняет три функции: во-первых, запускает двигатель, во-вторых, питает бортовые электрические устройства в то время, когда двигатель не работает, и, наконец, при работающем двигателе помогает генератору, когда тот не справляется с нагрузкой в бортовой электрической сети.
Аналогична работа и аккумулятора BMW, выбрать который вы сможете в разделе нашего сайта.
Свинцово-кислотный аккумулятор — Википедия
Схема свинцово-кислотного аккумулятора при зарядке (слева) и при подключении потребителя электрического тока Схема расположения электродов в свинцово-кислотном аккумуляторе, пластины катода и анода располагаются попеременно с прослойкой изолятора и объединяется каждый токонесущей полоской в выводы аккумулятора Строение свинцово-кислотного аккумулятора: слева — пластины положительного электрода, изолятора из стекловаты, отрицательного электрода; справа — аккумулятор в сборе (извлечён из корпуса с электролитом). Пластины электродов представляют собой свинцовую (чаще сплав свинца и сурьмы для повышения механической прочности[1]) решётку, ячейки которой заполнены сульфатом свинца со связующим материалом, токонесущие полосы и выводы аккумулятора изготовлены из свинца
Строение свинцово-кислотного аккумулятора: слева — пластины положительного электрода, изолятора из стекловаты, отрицательного электрода; справа — аккумулятор в сборе (извлечён из корпуса с электролитом). Пластины электродов представляют собой свинцовую (чаще сплав свинца и сурьмы для повышения механической прочности[1]) решётку, ячейки которой заполнены сульфатом свинца со связующим материалом, токонесущие полосы и выводы аккумулятора изготовлены из свинца  Варианты электрода свинцово-кислотного аккумулятора
Варианты электрода свинцово-кислотного аккумулятора  Свинцово-кислотный аккумулятор в сборе
Свинцово-кислотный аккумулятор в сбореСвинцо́во-кисло́тный аккумуля́тор — тип аккумуляторов, получивший широкое распространение ввиду умеренной цены, неплохого ресурса (от 500 циклов и более), высокой удельной мощности. Основные области применения: стартерные аккумуляторные батареи в транспортных средствах, аварийные источники электроэнергии, резервные источники энергии. Строго говоря, аккумулятором называется один элемент аккумуляторной батареи, но в просторечии «аккумулятором» называют аккумуляторную батарею (сколько бы в ней ни было элементов).
Свинцовый аккумулятор изобрёл в 1859—1860 годах Гастон Планте, сотрудник лаборатории Александра Беккереля[2]. В 1878 году Камилл Фор усовершенствовал его конструкцию, предложив покрывать пластины аккумулятора свинцовым суриком. Русский изобретатель Бенардос применил покрытие губчатым свинцом для увеличения мощности батарей, которые использовал в своих работах со сваркой.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца (в классическом варианте аккумулятора). Проведённые в СССР исследования показали, что при разряде аккумулятора протекает как минимум ~60 различных реакций, порядка 20 из которых протекают без участия кислоты электролита[3].
Во время разряда происходит восстановление диоксида свинца на катоде[3][4] и окисление свинца на аноде. При заряде протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца, начинается электролиз воды, при этом на аноде (положительный электрод) выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
- PbO2+SO42−+4H++2e−⇆PbSO4+2h3O{\displaystyle PbO_{2}+SO_{4}^{2-}+4H^{+}+2e^{-}\leftrightarrows PbSO_{4}+2H_{2}O}
- Pb+SO42−−2e−⇆PbSO4{\displaystyle Pb+SO_{4}^{2-}-2e^{-}\leftrightarrows PbSO_{4}}
При разряде аккумулятора из электролита расходуется серная кислота и выделяется относительно более лёгкая вода, плотность электролита падает. При заряде происходит обратный процесс. В конце заряда, когда количество сульфата свинца на электродах снижается ниже некоторого критического значения, начинает преобладать процесс электролиза воды. Газообразные водород и кислород выделяются из электролита в виде пузырьков — так называемое «кипение» при перезаряде. Это нежелательное явление, при заряде его следует по возможности избегать, так как при этом вода необратимо расходуется, нарастает плотность электролита и есть риск взрыва образующихся газов. Поэтому большинство зарядных устройств снижает зарядный ток при повышении напряжения аккумулятора. Потери воды восполняют доливкой в аккумуляторы дистиллированной воды при обслуживании аккумуляторной батареи (некоторые автомобильные батареи не имеют открывающихся/отвинчивающихся пробок)[5].
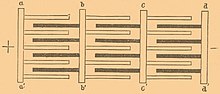
Элемент свинцово-кислотного аккумулятора состоит из электродов и разделительных пористых пластин, изготовленных из материала, не взаимодействующего с кислотой, препятствующих замыканию электродов (сепараторов), которые погружены в электролит. Электроды представляют собой плоские решётки из металлического свинца. В ячейки этих решёток запрессованы порошки диоксида свинца (PbO2) — в анодных пластинах и металлического свинца — в катодных пластинах. Применение порошков увеличивает поверхность раздела электролит — твердое вещество, тем самым увеличивает электрическую ёмкость аккумулятора.
Электроды вместе с сепараторами погружены в электролит, представляющий собой водный раствор серной кислоты. Для приготовления раствора кислоты применяют дистиллированную воду.
Электрическая проводимость электролита зависит от концентрации серной кислоты и при комнатной температуре максимальна при массовой доле кислоты 35%[6], что соответствует плотности электролита 1,26 г/см³[7]. Чем больше проводимость электролита, тем меньше внутреннее сопротивление аккумулятора, и, соответственно, ниже потери энергии на нём. Однако, на практике в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1,29−1,31 г/см³, это связано с тем, что при снижении концентрации из-за разряда электролит может замёрзнуть, а при замерзании образуется лёд, который может разорвать банки аккумулятора и повреждает губчатый материал пластин.
Существуют экспериментальные разработки аккумуляторов, где свинцовые решетки заменяют пластинами из переплетённых нитей углеродного волокна, покрытых тонкой свинцовой плёнкой. При этом используется меньшее количество свинца, распределённого по большой площади, что позволяет изготовить аккумулятор не только компактным и лёгким, при прочих равных параметрах, но и значительно более эффективным — помимо большего КПД, заряжается значительно быстрее традиционных аккумуляторов[8].
В аккумуляторах, применяемых в бытовых ИБП, систем охранной сигнализации и др. жидкий электролит загущают водным щелочным раствором силикатов натрия (Na2Si2O4) до пастообразного состояния. Это так называемые гелевые аккумуляторы (GEL), имеющие длительный ресурс. Другой вариант исполнения − с пористыми сепараторами из стеклоткани (AGM), допускающими более жёсткие режимы заряда[9].
Электрические и эксплуатационные параметры[править | править код]
- Удельная предельная теоретическая энергоёмкость (Вт·ч/кг): около 133.
- Удельная энергоёмкость (Вт·ч/кг): 25—40[10].
- Теоретическая удельная энергоплотность (Вт·ч/дм³): 1250[11].
- ЭДС одного заряжённого аккумулятора = 2,11—2,17 В, рабочее напряжение 2,1 В (3 или 6 аккумуляторов в итоге дают в батарее стандартные 6,3 В или 12,6 В соответственно)[3].
- Напряжение полностью разряженного аккумулятора = 1,75—1,8 В. Ниже разряжать их нельзя[3].
- Рабочая температура: от −40 °C до +40 °C.
- КПД: порядка 80—90 % (по току). КПД по энергии 70-80%[10].
Чаще всего свинцово-кислотные аккумуляторы применяются в составе аккумуляторной батареи с номинальным напряжением 6, 12 вольт, реже с другим кратным 2 напряжением. Промышленностью выпускаются варианты обслуживаемых (заливание электролита, дистиллированной воды, контроль плотности электролита, его замена) и не обслуживаемых в герметичном корпусе (исключается проливание электролита при изменений положения, переворачиваний) аккумуляторных батарей. Обслуживаемые аккумуляторные батареи могут выпускаться сухозаряженными (без залитого электролита), что увеличивает их срок хранения и не требует периодического обслуживания при хранении, заливка производится перед вводом в эксплуатацию[12].
-

Герметичная не обслуживаемая свинцово-кислотная аккумуляторная батарея напряжением 12 В и ёмкостью 4,5 А·ч бытовой электротехники
Свинцово-кислотные аккумуляторные батареи напряжением 8 В и ёмкостью 3,5 А·ч ИБП
-

Вариант обслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники в эбонитовом корпусе, в подобных батареях была даже возможность заменить отдельный вышедший из строя аккумулятор
-

Вариант не обслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники, нет доступа к заливным горловинам банок аккумуляторов
- Номинальная ёмкость, показывает количество электричества, которое может отдать данный аккумулятор. Обычно указывается в ампер-часах, и измеряется при разряде малым током (1/20 номинальной ёмкости, выраженной в А·ч)[13].
- Стартерный ток (для автомобильных аккумуляторов). Характеризует способности отдавать сильные токи при низких температурах. В большинстве случаев измеряется при −18 °C (0 °F) в течение 30 секунд. Различные методики замера отличаются (главным образом, допускаемым конечным напряжением) поэтому дают различные результаты[14].
- Резервная ёмкость (для автомобильных аккумуляторов) — характеризует время, в течение которого аккумулятор может отдавать ток 25 А до конечного напряжения 10,5 В согласно ГОСТ Р 53165-2008[15].
При эксплуатации «обслуживаемых» аккумуляторов (с открываемыми пробками на банках) на автомобиле при движении по неровной дороге неизбежно происходит просачивание электролита из-под пробок на корпус аккумулятора. Через электропроводную не высыхающую, из-за гигроскопичности, плёнку электролита происходит постепенный саморазряд аккумулятора. Во избежание глубокого саморазряда необходимо периодически нейтрализовать электролит протиранием корпуса аккумулятора, например, слабым раствором пищевой соды или разведённым в воде до консистенции жидкой сметаны хозяйственным мылом. Кроме того, особенно в жаркую погоду, происходит испарение воды из электролита; также количество воды в электролите уменьшается при перезаряде аккумулятора за счёт её электролиза. Потеря воды увеличивает плотность электролита, увеличивая напряжение на аккумуляторе. При существенной потере воды могут оголиться пластины, что одновременно увеличивает саморазряд и вызывает сульфатацию батареи. Поэтому необходимо следить за уровнем электролита и при необходимости доливать дистиллированную воду.
Эти меры вместе с проверкой автомобиля на паразитную утечку тока в его электрооборудовании и периодической подзарядкой аккумулятора могут существенно продлить срок эксплуатации аккумуляторной батареи.
Работа свинцово-кислотного аккумулятора при низких температурах[править | править код]
По мере снижения окружающей температуры параметры аккумулятора ухудшаются, однако, в отличие от прочих типов аккумуляторов, у свинцово-кислотных аккумуляторов это снижение относительно мало, что и обуславливает их широкое применение на транспорте. Эмпирически считается, что свинцово-кислотный аккумулятор теряет ~1 % отдаваемой ёмкости при снижении температуры на каждый градус от +20 °C. То есть, при температуре −30 °C свинцово-кислотный аккумулятор покажет примерно 50 % ёмкости.
Снижение ёмкости и токоотдачи при низких температурах обусловлено, в первую очередь, снижением скорости химических реакций (закон Аррениуса). Единственным способом повышения отдаваемой ёмкости является подогрев холодной батареи, как вариант — встроенным подогревателем (6СТ-190ТР-Н).
Разряженный аккумулятор в мороз может раздуться из-за замерзания электролита низкой плотности (близкой к 1,10 г/см3) и образования кристаллов льда, что приводит к необратимому повреждению свинцовых пластин внутри аккумулятора.
Низкие температуры электролита негативно влияют на работоспособность и зарядно-разрядные характеристики аккумулятора[16]:
- при температуре от 0 °C до −10 °C снижение зарядных и разрядных характеристик несущественно влияют на работоспособность аккумулятора;
- при температуре от −10 °C до −20 °C происходит снижение тока в стартерном режиме и ухудшение заряда;
- при температуре ниже −20 °C аккумуляторные батареи не обеспечивают надежного пуска двигателя и не способны принимать заряд от генератора.
Из-за большего внутреннего сопротивления, присущего современным аккумуляторам закрытого типа (т. н. «необслуживаемым», герметичным, герметизированным) при низких температурах по сравнению с обычными аккумуляторами (открытого типа), для них эти вопросы ещё более актуальны[17].
Для эксплуатации транспортных средств при очень низких температурах предназначены конструкции аккумулятора с внутренним электроподогревом[18].
Хранение[править | править код]
 | Статья или раздел содержит противоречия и не может быть понята однозначно. Следует разрешить эти противоречия, используя более точные авторитетные источники или корректнее их цитируя. На странице обсуждения должны быть подробности. |
Свинцово-кислотные аккумуляторы следует хранить только в заряженном состоянии. При температуре ниже −20 °C подзаряд аккумуляторов должен проводиться постоянным напряжением 2,45 В/элемент 1 раз в год в течение 48 часов. При комнатной температуре — 1 раз в 8 месяцев постоянным напряжением 2,35 В/элемент в течение 6—12 часов. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется.
Слой грязи, солей и плёнки электролита на поверхности корпуса аккумулятора создаёт проводник для тока между электродами и приводит к саморазряду аккумулятора, при глубоком разряде начинается сульфатация пластин с образованием более плотного сульфида который меньше и труднее потом вступает в реакцию , чем сульфид образующиеся при нормальном рабочем разряде, что и является причиной потери ёмкости. Поэтому поверхность аккумулятора необходимо поддерживать в чистоте. Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере их работоспособности.
При длительном хранении аккумуляторов и разряде их большими токами (в стартерном режиме), или при уменьшении ёмкости аккумуляторов, нужно проводить контрольно-тренировочные циклы, то есть разряд-заряд токами номинальной величины.
При подготовке аккумуляторной батареи к зимнему хранению, что актуально для автомобилей не эксплуатируемых в холодное время года специалисты старейшей лаборатории НИИАЭ рекомендуют следующие действия:
1. Правильно и до конца зарядите аккумуляторную батарею. 2. Нанесите на положительный вывод АКБ пластичную смазку (допускается только технический вазилин т.к. имеет нетральную кислотность, и не в коем случее не использовать литол, солидол и т. п. т.к. они имеют небольшую кислотность и со временем такие смазки попросту разъедают выводные клеммы АКБ), так как плёнка электролита способна абсорбировать влагу из атмосферы, что может приводить к повышенному саморазряду. 3. Хранить аккумуляторы на холоде, так как при низких температурах саморазряд намного ниже. Электролит полностью заряженного аккумулятора начинает замерзать при температуре ниже −55 С.
В случае необходимости поездки в морозы следует перенести аккумулятор в отапливаемое помещение и в течение 7—9 часов (например, за ночь) он придёт в пригодное для пуска двигателя состояние.
Износ свинцово-кислотных аккумуляторов[править | править код]
При использовании технической серной кислоты и недистиллированной воды ускоряются саморазряд, сульфатация, разрушение пластин и уменьшение ёмкости аккумуляторной батареи[19].
Основными процессами износа свинцово-кислотных аккумуляторов являются:
- сульфатация пластин[3], заключающаяся в образовании крупных кристаллов сульфата свинца, который препятствует протеканию обратимых токообразующих процессов;
- коррозия электродов, то есть электрохимические процессы окисления и растворения материала электродов в электролите, что вызывает осыпание материала электродов;
- слабая механическая прочность или плохое сцепление активной массы с электродными решётками, что приводит к опаданию активной массы[3][20];
- оползание и осыпание активной массы положительных электродов, связанное с разрыхлением, нарушением однородности[3].
Хотя батарею, вышедшую из строя по причине физического разрушения пластин, в домашних условиях восстановить нельзя, в литературе описаны химические растворы и прочие способы, позволяющие «десульфатировать» пластины. Простой, но чреватый полным отказом аккумулятора способ предполагает использование раствора сульфата магния[3]. Раствор сульфата магния заливается в секции, после чего батарею разряжают и заряжают несколько раз. Сульфат свинца и прочие остатки химической реакции осыпаются при этом на дно банок, это может привести к замыканию элемента, поэтому обработанные банки желательно промыть и заполнить новым электролитом номинальной плотности. Это позволяет несколько продлить срок использования устройства.
 Кодовый символ, указывающий на то, что свинцовые батареи могут быть вторично переработаны
Кодовый символ, указывающий на то, что свинцовые батареи могут быть вторично переработаныВторичная переработка для этого вида аккумуляторов играет важную роль, так как свинец, содержащийся в аккумуляторах, является токсичным тяжёлым металлом и наносит серьёзный вред при попадании в окружающую среду. Свинец и его соли должны быть переработаны для возможности его вторичного использования.
Свинец из изношенных аккумуляторов используется для кустарной переплавки, например, при изготовлении грузил рыболовных снастей, охотничьей дроби или гирь. Кустарное извлечение свинца из аккумуляторов серьезно вредит как окружающей среде, так и здоровью плавильщиков, поскольку свинец и его соединения с парами и дымом разносятся по всей округе[21][22].
- ↑ Курзуков Н. И., Ягнятинский В. М. Аккумуляторные батареи. Краткий справочник // М.: ООО «Книжное издательство „За рулём“». — 2008. — 88 с., ил. ISBN 978-5-9698-0236-0. (С. 15).
- ↑ Bertrand Gille Histoire des techniques. — Gallimard, coll. «La Pléiade», 1978, ISBN 978-2070108817.
- ↑ 1 2 3 4 5 6 7 8 Свинцовые аккумуляторы. Эксплуатация: Правда и вымыслы.
- ↑ Н. Ламтев. Самодельные аккумуляторы. Москва: Государственное издательство по вопросам радио, 1936 год.
- ↑ Как отрыть автомобильный аккумулятор: делаем батарею обслуживаемой (рус.), AkkumulyatorAvto.ru (2 августа 2017). Дата обращения 12 августа 2018.
- ↑ Удельная электропроводность х водных растворов серной кислоты и температурный коэффициент аt (неопр.). chemport.ru. Дата обращения 1 июля 2018.
- ↑ Концентрация и плотность серной кислоты. Зависимость плотности серной кислоты от концентрации в аккумуляторе автомобиля (рус.), FB.ru. Дата обращения 1 июля 2018.
- ↑ http://auto.lenta.ru/news/2006/12/19/battery/ Американцы облегчили и уменьшили аккумуляторы
- ↑ Аккумуляторы для бесперебойного питания. Статьи компании «ООО Новая система» (неопр.) (недоступная ссылка). aegmsk.ru. Дата обращения 12 августа 2018. Архивировано 12 августа 2018 года.
- ↑ 1 2 Свинцовый кислотный аккумулятор. Устройство и принцип действия аккумулятора. (рус.). www.eti.su. Дата обращения 1 июля 2018.
- ↑ Расчет идеального свинцового аккумулятора.
- ↑ [1].
- ↑ ГОСТ 26881-86 Методика проверки свинцовых аккумуляторов
- ↑ Краткий аналитический обзор существующих способов оценки ёмкости ХИТ и приборов, реализующих эти способы (неопр.) (недоступная ссылка). Дата обращения 21 октября 2011. Архивировано 4 марта 2016 года.
- ↑ ГОСТ Р 53165-2008: Батареи аккумуляторные свинцовые стартерные для автотракторной техники. Общие технические условия
- ↑ Руководство, 1983, с. 70.
- ↑ Железнодорожный транспорт. — 2011. № 12. — c.35. (неопр.) (недоступная ссылка). Дата обращения 13 декабря 2015. Архивировано 22 декабря 2015 года.
- ↑ Руководство, 1983, с. 21-23.
- ↑ Вредные добавки к электролиту свинцовых аккумуляторов
- ↑ О противоречиях в теории работы свинцового кислотного аккумулятора к. т. н., проф. Кочуров А. А. Рязанский военный автомобильный институт Архивировано 20 сентября 2011 года.
- ↑ Отравление свинцом | ProfMedik Медицинский Портал (рус.) (неопр.) ?. profmedik.ru (22 февраля 2016). Дата обращения 4 февраля 2017.
- ↑ Кочуров. http://echemistry.ru/assets/files/books/hit/statya-o-protivorechiyah-v-teorii-raboty-svincovogo-kislotnogo-akkumulyatora.pdf (рус.). Новости. Первоуральск.Ru (17 июля 2014). Дата обращения 4 февраля 2017.






