Устройство батарейки: Что внутри? Химический состав
За частую хочется узнать, что внутри батарейки? Из чего она состоит? Каково устройство батарейки? И поэтому многие люди начинают ее разбирать. Но вскрыв элемент питания обнаруживают какие-то непонятные элементы. Информация изложенная здесь будет понятной даже для детей. Статья внесет ясность и постарается ответить на ваши вопросы.
Что внутри батарейки?
Ниже будет рассмотрено строение четырех типов источников питания. По сути принцип работы один и тот же, но состоят эти энергетические накопители из разных составляющих.
Состав пальчиковой батарейки
В состав батареи входят следующие элементы:
- Катод – это отрицательный полюс
- Вкладыш служит некой прокладкой
- Диафрагма
- Футляр
- Электролит – жидкость вследствие которой идет химическая реакция
- Стержень сделанный из угля
- Крепежная шайба
- Анод или положительный полюс

Примерно так выглядит состав батареек пальчиковых. Но иногда их устройство бывает иным. Например, в строение может быть использован лишь угольный стержень, специальный темный порошок и металлические элементы.
Устройство круглой батарейки
Приплюснутый элемент питания имеет своеобразную форму. Вот строение батарейки в разрезе:
- Положительный торец
- Отрицательный полюс
- Пористая прокладка, вымоченная в электролите
- Оксид ртути
- Порошок Zn

Устройство батарейки может быть и немного иным:

Детали энергетического элемента:

Если сильно нагреть данный эелмент, то под напором внутреннего газа она запросто может взорваться. Таким образом сейчас вы можете созерцать что внутри у батарейки.
Устройство батареи телефона
Принцип устройства батарейки мобильника:
- Положительный и отрицательный полюс
- Анодный стакан
- Катодный контакт
- Сепаратор
- Уплотнение
- Защитный клапан
- Изолятор
- Колпачок
- Перегородка
- Корпус алюминиевый или иной

Таким образом устройство батарейки мобильного телефона немного сложнее обычного солевого источника питания.

Из чего состоит батарейка Крона?
Данный источник энергии устроен следующим образом. Контакты плюс и минус находятся друг на против друга в верхней части элемента питания. Под ними расположена пластмассовая основа. От отрицательного контакта идет пластина на минусовой полюс. И там она плотно прикрепляется. Состав батарейки схож с выше приведенными источниками питания.
Внутри металлического прямоугольного стаканчика находятся 6-ь закругленных сплющенных прямоугольников. Каждый из которых является отдельной батареей. Размер данных элементов: Длинная: 2,2 см; Ширина 1,5 см; Высота: 0,5 см. Каждый такой бочонок имеет заряд 1,5 вольта. Друг от друга они отделены специальными пластинами. Но все же они соединены между собой в середине. Подобное устройство батарейки экономически выгодно!
Что находится внутри батарейки крона?
Вот собственно батарейка в разрезе. Иногда она может быть такой.


Но обычно можно заметить, что крона выполнена по такому типу как на рисунки ниже.



Ее строение достаточно простое:
- 2 контакта «+» и «-».
- Металлический корпус.
- Нижняя и верхняя пластины, выполненные из пластика.
- Шесть прямоугольников на 1,5 вольта соединенных между собой.
- Электролит.
- Угольный стержень
- Внутренняя пленка.
- Изоляционные пластины.
- Устройство батарейки включает в себя так же обертку.
Корпус для батареек и из чего он сделан?
Такая деталь батарейки как корпус играет очень значительную роль. По сути она удерживает все ее содержимое и предотвращает от распада деталей в разные стороны.
В каких батарейках цинковый корпус?
Многих интересует данный вопрос и это не спроста. Цинк можно использовать для различных экспериментов. Или же его можно просто продать. Цинковым корпусом обладают солевые источники питания. Обычно на них стоит надпись что они солевые.
Последнее время встречаются элементы питания, поверхность которых сделана из железа, жести. Это связано с тем что находится внутри источников энергии. Для повышенной прочности и защиты требуется именно такой кожух.
Из чего состоит корпус пальчиковой батарейки?
Он имеет простое устройство и состоит из нескольких частей:
- Верхняя
- Нижняя
- Боковая овальная
- Маркировка
Но под корпусом порой люди имеют ввиду отсек куда вставляются элементы питания. Например, по типу такого:

Корпус для батареек xbox 360
Он выглядит по типу так:

Можно изготовить корпус для батареек своими руками. Но на это нужно время. Ниже в видео представлено как это можно сделать из подручных средств.
Примерный химический состав всех батареек
В каждом типе энергетических накопителей содержатся разные химические элементы. Вот химические элементы, встречающиеся в источниках энергии:
- Никель
- Кадмий
- Свинец
- Ртуть – сейчас уже редко используется.
- Литий
- Цинк
- Марганец
- Алюминий
- Железо
Таким образом по составу элементы питания выглядит как-то так! Но устройство энергетического элемента не может включать в себя сразу все эти вещества.
В итоге из чего сделаны батарейки теперь понятно.
Завод по производству батареек
В России имеется 5 лучших производителей элементов питания.
Космос
Осуществляет производство источников энергии в России с 1993 года. Имеет 35 заводов как на родине, так и за рубежом. А именно есть фабрики в Китае. В торговых точках можно отыскать элементы питания от этой компании под именем «Kosmos Premium» и «Космос». Данная торговая марка широко известна и имеет своих дилеров в разных странах. Каждый год фирма делает до ста миллионов продаж своих источников питания.
На рынке данный завод батареек себя уже давно зарекомендовал с положительной стороны. Многократно компания получала разные награды за свою работу.
Фотон
Подобная компания стала заниматься источниками энергии с 2011 года и уже успела вырваться в лидеры. Успех компании обусловлен качественной продукцией. Устройство батарейки от этой компании имеет отличные характеристики.
Батареи от этой компании были протестированы и оказалось, что они работают достаточно долго и стоят дешевле, например, того же Дюрасел. Компания фотон занимается производством солевых источников питания.
Лиотех
Этот завод батареек был открыт совместно с китайцами. Он производит литий-ионные аккумуляторные элементы. Находится фабрика около города Новосибирска. Площадь производства очень громадна она занимает 4 Га.
Таким образом данный завод доказывает всем что в России может действовать большое конкурентное производство гальванических элементов. Кроме этого они улучшают устройство гальванических элементов.
Энергия
Данная компания находится в городе Елец. С ней сотрудничает Министерство обороны. И это дает повод думать, что это действительно надежный производитель. В 2011 году были запущены специальные цеха для производства литий ионных полимерных источников питания. В основном здесь идет производство пальчиковых батареек и аккумуляторов.
CCK
Данная компания работает с 1993 года и выпускает свинцовые элементы питания 4 и 5-го поколений. Кроме этого завод работает над увеличением емкости энергетических элементов и разрабатывает новые материалы. Вся продукция этой фирмы служит достаточно долго.
Аккумулятор выпущенный этой фабрикой имеет большое число циклов разряда-заряда. Это означает что подобный элемент питания будет служить достаточно долго. И не придется его менять каждые 2-3 месяца.
Как делают батарейки?
Производство батарей начинается с нарезки пластинок из стали в овальные детали. Дальше выполняется сворачивание в металлическую трубочку. Которая затем будет именоваться корпусом. В него помещают химические составляющие, такие как графит, серебряный катализатор, диоксид марганца, сульфат бария, цинк, загуститель, гидрооксид калия. Устройство батарейки не всегда бывает простым.
Дальше пресс скатывает химикаты катода в гранулы. После этого на корпус наноситься бороздка для того, чтобы упростить запайку. Затем на отрицательный полюс наноситься герметик. Параллельно с этим на другом станке идет нарезка перфорированной бумаги. Производиться нанос клея около минусового полюса. Пока корпус передвигается по конвейеру клей высыхает.
Затем производиться впрыскивание гидрооксида калия или электролита. Далее в полость анода впрыскивается цинковый гелий. Цинк придает гелию серебристо белый цвет. Сварочный станок приваривает 4-и сантиметровых гвоздя к крышке батареи. Там будет скапливаться заряд прежде чем разрядиться. После происходит закрытие отрицательного полюса. Затем все края загибаются, и энергетический элемент становиться похожим сам на себя.
Специальный электронный станок проверяет каждый элемент питания на брак и наличие заряда в 1,5 вольт. Дальше остается сделать контрольный штрих приклеить наклейку. Как только это будет сделано каждому источнику питания предстоит пройти через печь. Температура в подобном устройстве 198 градусов, и они будут там находиться всего 3 секунды. Это нужно для того чтобы наклейка хорошо закрепилась.
Как делают батарейки на заводе видео?
Оборудование для производства батареек
В качестве установок для создания элементов питания используют различные автоматизированные машины. Изготовлением специальных станков занимается компания ЛИК и многие другие. Зачастую устройство батарейки улучшают и видо изменяют.
По сути выстраивается автоматизированная линия, состоящая из нескольких станков. Ведь требуется создать полый цилиндр, выполнить прессовку, нанести клей, добавить нужные химические элементы, создать и приклеить наклейку, а затем еще и подвергнуть элемент питания тепловому воздействию.
Вот примерный состав линии:
- Вибрационная машина
- Станок создающий корпус, машина на перевернутый корпус
- Автомат разделения потока на рукава
- Станок для управления бумагой
- Собирающая машина
- Отжимной станок
- Лента
- Шлюз
- Тарелка
Каждая компания производит линии по-своему и поэтому состав может заметно отличаться.
Читайте так же:
Принцип работы батарейки
Batareykaa.ru
Что такое батарейка? Состав батарейки?
В электротехнике термином батарейка называют некий источник электрического тока в котором несколько электрохимических элементов соединёны между собой. Электричество в батарейке вырабатывается под действием химического процесса. Обратите внимание, что именно «несколько», а не одиночный элемент называется батарейкой. Но, всё же, мы привыкли батарейкой называть всё, что даёт нам постоянный ток, не вникая в то, из чего она там внутри состоит. Тем более, что как правило, снаружи всё упаковано в единую форму.
Изобретателем батарейки считается итальянский физик Алессандро Вольта. И произошло это примерно в 1800 году.
Принцип работы батарейки
У любой батарейки есть анод (положительный полюс, обозначается значком +), катод (отрицательный полюс, обозначается, соответственно значком -), между ними электролит (как правило сухой).
Электрический ток бежит от анода (-) к катоду (+), но между ними обязательно должна быть нагрузка (например лампочка или, что-то ещё).
Если нет нагрузки — нет тока!
А если соединить полюса в батарейке без нагрузки, то произойдёт короткое замыкание.
Качество батарейки (мощность, продолжительность работы, параметры нагрузки..) зависят от состава и качества материалов в её составе.
Виды батареек
Классификация батареек по типу химической реакции
| Тип | Описание | Достоинства | Недостатки |
| Первичные | Гальванические элементы. Реакции, происходящие в них, необратимы, поэтому их нельзя перезарядить. | Дешевле стоят, меньше саморазряд. | Одноразовые. |
| Вторичные | Аккумуляторы. Реакции в них обратимы, поэтому они способны не только отдавать энергию, но и накапливать её. | Многократность применения. Более экологичные. | Дороже. Сильнее саморазряд. |
Классификация батареек по типу электролита
(список не полный, указаны только самые распространённые в быту)
| Тип | Достоинства | Недостатки | Фото |
| «Солевые» (угольно-цинковые) | Самый дешёвый. Рабочая температура: от −40 до +55 °C (данные Википедии). | Малая емкость, не позволяющая использовать изделия в мощных устройствах, малый срок хранения. |  |
| «Щелочные» (алкалиновые, щёлочно-марганцевые) | Ёмкость в 1,5–10 раз больше, чем у солевых элементов, в зависимости от режима работы, при том же типоразмере элемента. Меньший саморазряд, длительный срок хранения. Лучше работают при больших токах нагрузки. Меньше падение напряжения по мере разряда. Меньше газовыделение, благодаря чему элемент можно делать полностью герметичным. Рабочая температура: от -30 до +55 °С. | Спадающая кривая разряда, большая масса. |  |
| «Литиевые» | Наивысшая ёмкость на единицу массы. Пологая кривая разряда. Превосходен при низких и высоких температурах (лучше чем у предыдущих элементов). Длительное время хранения. Лёгкий вес. | Высокая цена |  |
Типы батареек по размеру и их обозначения
Здесь мы разместили таблицу в которой указаны, помимо размеров и характеристик, «название» и «маркировка». По сути это одно и то же, и даже, как правило, на всех элементах указывается одновременно. В США принято буквенное обозначение (в колонке «название»), и оно ориентированно на физический размер «батарейки».
| Название |
Фото | Маркировка |
Диаметр (мм) |
Высота (мм) |
Емкость (мАч) |
|---|---|---|---|---|---|
| A |  |
Солевая (R23) Щелочная (LR23) |
17 | 50 | — |
| AA |  |
Солевая (R6) Щелочная (LR6) Литиевая (FR6) |
14,5 |
50,5 |
1100-3500 |
| AAA |  |
Солевая (R6) Щелочная (LR6) Литиевая (FR6) |
10,5 | 44,5 | 540-1300 |
| AAAA |  |
Щелочная (LR8D425) |
8.3 | 42.5 | 625 |
| B |  |
Щелочная (LR12 или 3R12) |
22 | 62 × 67 | 8350 |
| C |  |
Солевая(R14)
Щелочная(LR14) |
26.2 | 50 | 3800-8000 |
| D |  |
Солевая(R20) Щелочная(LR20) |
34.2 | 61.5 | 8000-19500 |
| F |  |
Солевая(R25) Щелочная(LR25) |
33 | 91 | — |
| N |  |
Солевая(R1) Щелочная(LR1) |
12 | 30.2 | 1000 |
| 1/2AA |  |
Солевая (R14250) |
14.5 | 25 | 250 |
* Параметры ёмкости и тока в батарейке могут отличаться в зависимости от производителя.
Маркировки батареек
Маркировку гальванических источников тока делают исходя из состава электролита и активного металла в их конструкции. Регламентирует всё это IEC (Международная электротехническая комиссия).
По этой классификации существует 5 самых распространенных типов круглых (цилиндрических) батареек:
солевые, щелочные, литиевые, серебряные и воздушно-цинковые.
Мы рассмотрим первые три, поскольку в предыдущей таблице не стали описывать стандарты для двух последних (серебряных и воздушно-цинковых батареек). Разнообразие этих элементов гораздо шире и мы не уместимся в рамки статьи.
Буква R в их маркировке означает круглую форму (от английского round).
Солевые батарейки (R).
Катод состоит из марганца (MnO2) в смеси с графитом (около 9,5 %), анод из цинка (Zn), и электролит из раствора хлорида аммония NH4Cl. Они обеспечивают напряжение 1,5 вольта, имеют небольшую емкость, высокий саморазряд и низкий срок хранения (примерно 2 года).
Солевые батарейки самые дешевые и имеют посредственные технические характеристики. В обиходе их также называют цинк-карбоновыми и угольно-цинковыми. Наиболее эффективной областью применения солевых батареек являются приборы со средним и низким энергопотреблением. Например, пульты ДУ и настенные часы.
Щелочные батарейки (LR).
Имеют катод из диоксида марганца, анод из цинка (порошок), и электролит из гидроксида щелочного металла (обычно гидроксид калия). Они имеют напряжение 1,5 вольта, увеличенную емкость, низкий саморазряд и большой срок хранения до 10 лет.
Эти источники тока несколько дороже солевых, в обиходе их еще называют алкалиновыми и щелочно-марганцевыми.
Литиевые батарейки (CR).
Имеют анод из лития, катод чаще из диоксида марганца (но используются и другие составы для катода). Они имеют большую емкость, малый саморазряд и большой срок хранения до 10-12 лет. Они сохраняют работоспособность при низких температурах. Эти источники тока довольно дороги.
Надеемся, что вы нашли ответ на вопрос «что такое батарейка?».
Полезные статьи
 Как выбрать часы Как выбрать часы |
 Ремонт часов Ремонт часов |
 Замена батареек Замена батареек |
 Таблица сравнения батареек Таблица сравнения батареек |
типы батареек, устройство, принцип работы, виды
 Батарейка — это слово плотно вошло в нашу повседневную жизнь. Но, к сожалению, сегодня мало кого интересует её история, устройство, её виды. Давайте вместе разберёмся с этими и другими интересными вопросами о батарейке. А точнее «что такое батарейка», «как работает батарейка». Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Батарейка — это слово плотно вошло в нашу повседневную жизнь. Но, к сожалению, сегодня мало кого интересует её история, устройство, её виды. Давайте вместе разберёмся с этими и другими интересными вопросами о батарейке. А точнее «что такое батарейка», «как работает батарейка». Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Самые первые прототипы батареек появились ещё в Месопотамии около 2000 лет назад. Состояла она в то время из глиняной вазы, медного и железного стержней, залитыми битумом. Кстати, если такой сосуд залить кислотой (уксусной, серной), то получим напряжение примерно в 1В. Назвали такой прототип «Багдадской батарейкой » в связи с местом, на котором были обнаружены.
Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
____________________________________________
Возможно, вам будет интересно: Почему батарейки кислые на вкус?
__________________________________________________________________
Как работает батарейка
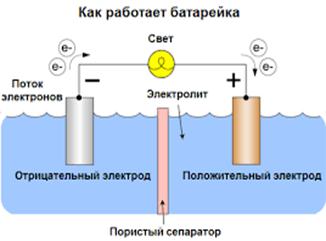
 Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким). Именно эти составляющие и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.).
Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким). Именно эти составляющие и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.).
Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Как устроена батарейка
Внутри металлического корпуса щелочной ячейки находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.
 Щелочная батарейка. /Роджер Кларк
Щелочная батарейка. /Роджер КларкЭто может показаться сложным, но способ производства электричества в батарейке на самом деле довольно прост: происходит химическая реакция, которая перемещает крошечные отрицательно заряженные частицы, называемые «электронами», вокруг, чтобы создать электрический ток.
Когда элемент подключен к цепи – например, к лампочке, – цинк внутри реагирует с диоксидом марганца и теряет электроны.
Электроны собираются с помощью металлического стержня внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательный), через провода к лампе (чтобы она загорелась), а затем обратно в верхнюю часть ячейки. (положительный).
Эта реакция производит около 1,5 вольт электроэнергии. Поскольку не так много устройств могут работать при напряжении 1,5 В, очень часто два или четыре элемента используются вместе для увеличения мощности. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
 Источник Shutterstock
Источник ShutterstockКогда большая часть цинка прореагировала с диоксидом марганца, мы говорим, что элемент «плоский», что означает, что он больше не может производить электричество. Поскольку химическая реакция, происходящая в щелочных элементах, не может быть легко изменена, это означает, что элемент не может быть перезаряжен.
Но помните, что большинство элементов и батарей можно утилизировать, поэтому убедитесь, что вы тщательно от них избавились.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены – так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.
 Shutterstock
ShutterstockРаньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Типы батареек
- Солевые (угольно-цинковые, марганцево-цинковые) батарейки.
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.

- Алкалиновые (щёлочные) батарейки
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.

- Литиевые батарейки – li ion
Литиевые батарейки что это такое
Самые современные. В отличие от щелочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.

Пальчиковые батарейки АА или ААА: это какие?
Что такое батарейка АА
Батарейка АА – это пальчиковые. Они более большие, чем мизинчиковые.
Что такое батарейка ААА
Это мизинчиковые батареи (те, что мы привыкли использовать в пультах).
Батарейки. Виды и устройство. Работа и применение. Как выбрать
Батарейки являются одними из наиболее популярных и распространенных источников питания. Их часто применяют для различной электроники и мелкой техники. Это разнообразные игрушки, ручные часы, дистанционные устройства, фонари, электронные весы, бритвы, небольшие устройства с моторчиком. Потребность в этих источниках питания постоянная, поэтому в магазинах их можно встретить практически повсеместно.
Большую часть этих источников питания нельзя перезарядить, они не вечны и через некоторое время разряжаются. Но при этом один вид батареек может служить на порядок дольше, чем другие виды. Естественно, что стоят они несколько дороже. Также необходимо учитывать, что некоторые источники питания плохо держат напряжение, могут течь и даже портить электронику и другую технику. Чтобы выбрать правильные источники питания, необходимо знать их особенности и учитывать нюансы их использования.
Виды
Батарейки имеют пять основных видов. Во многом это зависит тем, какие материалы применяются при их производстве. В особенности это касается их активных компонентов, в частности электролита, катода и анода.
Можно выделить следующие виды элементов питания:
- Солевые.
- Щелочные.
- Серебряные.
- Ртутные.
- Литиевые.
Особенности, плюсы и минусы
Солевые источники питания. К примеру, это Duracell и Energizer из США, «Орион» из России, Toshiba из Японии. К преимуществам таких элементов относится невысокая цена. Однако у них имеются существенные минусы — небольшая емкость заряда.
Щелочные или так называемые алкалайновые источники питания. В данном случае применяется щелочной электролит. Создателем данных элементов была фирма Duracell. Электрод здесь выполнен из двуокиси марганца и цинка, при этом в виде электролита применяется гидроксид калия. Данные источники питания особенно популярны среди создателей электроники. В большей части случаев на корпусе щелочного элемента питания пишется название «ALKALINE».
К преимуществам таких элементов относится существенный срок действия. При эксплуатации напряжение на электродах изменяется меньше. Минусом будет высокая цена, которая превосходит стоимость солевых элементов.
Серебряные. Электролитом в данном случае является гидроксид калия либо гидроксид натрия. Эксплуатационные свойства этих устройств во многом схожи с ртутными элементами. К их преимуществам относятся значительное время хранения, плотность энергии, постоянное напряжение, отсутствие токсичности, большая емкость на единицу массы. Среди минусов можно назвать достаточно высокую цену.
Ртутные. Здесь анодом выступает цинк, а катодом — оксид ртути. Их разделяют сепараторный элемент и диафрагма, которые пропитаны электролитным составом, выполненного из адсорбентированного гидроксида калия. Необходимо отметить, что ртутный элемент на цинковой основе может действовать как аккумуляторное устройство, но его емкость будет постепенно снижаться от заряда к разряду. Вызвано это слипанием ртути при разряде, а также увеличением дендритов цинка во время заряда.
К преимуществам этих элементов питания можно отнести постоянство напряжения, емкость и энергоплотность. Однако их цена достаточна высока, а ртуть токсична. Поэтому при их использовании нельзя нарушать герметичность корпуса устройства.
Литиевые источники питания. Здесь используется литиевый катод, а также органический электролит. Такие элементы выделяются значительным сроком хранения, работоспособностью при различных температурах, плотностью энергии. К минусам следует отнести сравнительно высокую цену.
Батарейки можно классифицировать по форме и размерам. В большей части случаев их разделяют по американскому стандарту, которая признана и применяется в большинстве стран мира. Вместе со стандартом США используются и другие классификации в виде международных систем ANSI, IEK, а также ГОСТ. Они могут различаться по диаметру и иным габаритам, химсоставу, емкостным параметрам и напряжению.
Типы
- Пальчиковые либо AA.
- Мизинчиковые либо AAA.
- Четыре А, либо AAAA.
- Дюймовочка, либо C.
- Бочка, либо D.
- Квадратная.
- Крона, либо PP3.
- Миниатюрные источники питания.
Устройство
Конструктивно щелочной элемент имеет общее строение с солевым. Однако главные части в нем располагаются в обратном порядке. Анод выполнен из цинка, который пропитан электролитом из щелочи. Сепаратор отделяет анод от общей электролитной массы. Вывод с «плюсом» сделан из стального никелированного элемента, вывод с «минусом» изготавливается в виде тарелки из стали.
Чтобы не было замыкания, оболочка изолируется. Прокладка удерживает газы, которые образуются во время работы. Камера сбора газов в данном элементе питания небольшая, так как газы здесь образуются в небольшом количестве. Предохранительная мембрана защищает от взрыва элемента питания в случае неправильной эксплуатации, к примеру, в случае короткого замыкания. Если долго и неправильно использовать элемент питания, то мембрана может порваться, вследствие чего может произойти разгерметизация. В итоге вытечет электролит.
Принцип действия
Все батарейки имеют положительный и отрицательный полюс, а также электролит. Все эти три элемента являются основой источника питания. Электроток идет от анода к катоду, однако между ними должна иметься нагрузка в виде диода или лампочки. Катод выступает в качестве восстановителя, то есть он запитывается электронами от анода. Электролит является средой, где движутся ионы, образующиеся в результате химреакции.
В процессе химреакции происходит разрушение электродов, в том числе появление новых веществ. Это приводит к тому, что емкость падает и уже невозможно использовать элемент питания по-прежнему.
Применение
Солевые батарейки применяются в часах, фонарях, где небольшое потребление электротока, в разнообразных игрушках, а также пультах дистанционного управления.
Щелочные применяются в устройствах, где требуется высокое потребление электротока, к примеру, фотоаппараты с вспышкой, видеокамеры, магнитофоны, игрушки с моторчиком, а также иные устройства.
Серебряные применяются в калькуляторах, наручных часах, различных электрических инструментах, слуховых аппаратах.
Литиевые элементы питания применяются в фотоаппаратах, мобильниках, электронных книжках, пультах дистанционного управления, устройствах, которые требуют постоянного и надежного потребления электротока.
Как выбрать батарейки
- Батарейки следует выбирать с умом. Для начала нужно определиться с видом техники, ведь разное оборудование потребляет различное количество энергии. Вследствие этого солевые элементы питания, к примеру, подойдут для дистанционного пульта управления, а для фотокамеры не подойдут. Поэтому необходимо учитывать мощность и тип источника питания
- Присмотритесь к типу электролита. Оборудованию со слабой мощностью вполне достаточно угольно-цинковых или солевых элементов питания. Для приборов средней мощности подойдут щелочные устройства. Для оборудования высокой мощности необходимо выбирать литиевые или серебряные элементы питания.
Нельзя обходить вниманием стоимость данных устройств. Серебряные, литиевые и щелочные элементы питания выделяются высокой стоимостью, однако они могут работать длительное время. При правильной их эксплуатации они могут окупить себя несколько раз, тогда как солевые батарейки буквально за короткое время будут выходить из строя.
- Также следует присмотреться к упаковке и производителю элементов питания. В большинстве случаев изготовители всегда маркируют корпус элементов питания, чтобы покупатель мог определить тип электролита.
- При подборе элемента питания необходимо учитывать, что при различных нагрузках он будет вести себя совершенно по-разному. К тому же на функциональность будет влиять окружающая среда. Так зимой, но холоде будет ухудшаться электропроводность электролита, вследствие чего будет снижаться и его емкость.
- Необходимо учитывать тот факт, что при длительном хранении элементов питания они могут терять порядка 30% начальной емкости. Поэтому рекомендуется внимательно присмотреться к дате производства. Следует знать, что отечественные изготовители маркируют дату изготовления, а иностранные производители указывают последнюю дату использования батарейки.
- Необходимо тщательно осмотреть элементы устройства, чтобы убедиться в отсутствии дефектов, которые могут уменьшить эффективность эксплуатации.
- Подбирая источники питания для конкретного прибора, необходимо учитывать размеры посадочного пространства под них, оно может быть различным. К примеру, для пульта дистанционного управления будут нужны мизинчиковые батарейки, а для какого-нибудь плеера придется приобретать пальчиковые элементы питания. Для электронных весов, слухового аппарата или другого небольшого прибора потребуется купить таблеточные элементы питания. При этом необходимо учитывать маркировку, толщину и диаметр «таблетки», чтобы она подошла для конкретного прибора.
Похожие темы:
Щелочной элемент — Википедия

Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно гидроксида калия.
Впервые использовать щелочной электролит в химических источниках тока предложили независимо друг от друга Вальдемар Джангнер (англ.) в 1899 году и Томас Эдисон в 1901 году[1][2]. Они использовали щелочной электролит в никель-кадмиевых аккумуляторах.
В марганцево-цинковых элементах питания щелочной электролит впервые применил канадский инженер Льюис Урри (англ.)русск. в середине 1950-х годов, работавший в Union Carbide (англ.), выпускавшей элементы питания под маркой «Eveready». Льюис Урри использовал наработки Томаса Эдисона[3]. В 1960 году Урри вместе с Карлом Кордешем и Полом Маршалом получил патент на конструкцию щелочного элемента[4].
Типичные характеристики щелочного элемента питания[5][6]:
- ЭДС элемента: 1,5 В;
- Удельная энергия: 65—90 Вт∙ч/кг;
- Удельная мощность: 100—150 кВт/м³;
- Рабочая температура: -30…+55 °С.
На аноде проходят реакции окисления цинка. Вначале образуется гидроксид цинка:
Zn + 2OH− → Zn(OH)2 + 2e−
Который затем разлагается на оксид цинка и воду.
Zn(OH)2 → ZnO + H2O
На катоде, в свою очередь, происходят реакции восстановления оксида марганца (IV) в оксид марганца (III):
2MnO2 + H2O + 2e− → Mn2O3 + 2OH−
В целом, химические процессы внутри элемента при использовании KOH в качестве электролита можно описать следующим уравнением:
Zn + 2KOH + 2MnO2 + 2e− → 2e− + ZnO + 2KOH + Mn2O3
В отличие от солевого элемента, в щелочном электролит в процессе разрядки батареи практически не расходуется, а значит, достаточно малого его количества. Поэтому в щелочном элементе в среднем в 1,5 раза больше диоксида марганца.
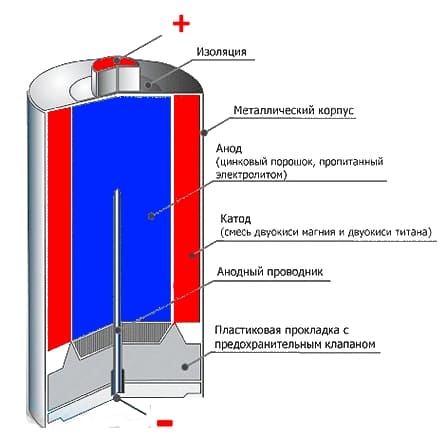
 Основные части щелочного элемента
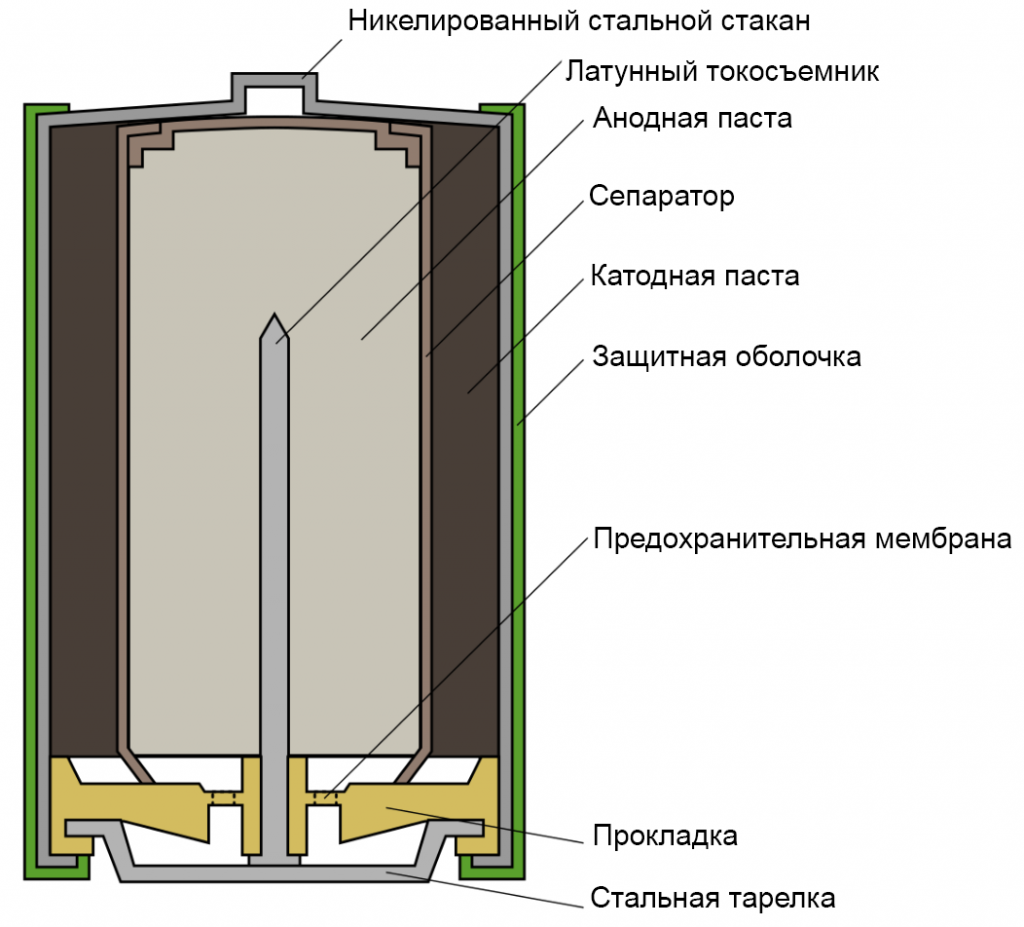
Основные части щелочного элементаПо конструкции щелочной элемент похож на солевой, но основные части в нём расположены в обратном порядке. Анодная паста (3) в виде цинкового порошка, пропитанного загущённым щелочным электролитом, располагается во внутренней части элемента и имеет отрицательный потенциал, который снимается латунным стержнем (2). От активной массы, диоксида марганца, смешанного с графитом или сажей (5), анодная паста отделена сепаратором (4), также пропитанным электролитом. Положительный вывод, в отличие от солевого элемента, выполнен в виде стального никелированного стакана (1), а отрицательный — в виде стальной тарелки (9). Оболочка (6) изолирована от стакана и предотвращает короткое замыкание, которое может возникнуть при установке нескольких элементов в батарейный отсек. Прокладка (8) воспринимает давление газов, образующихся при работе. Выделение газов в щелочном элементе значительно меньше, чем в солевом, поэтому объём камеры для их сбора тоже меньше. Для предотвращения взрыва батареи при неправильном использовании (например, коротком замыкании), в ней имеется предохранительная мембрана (7). При превышении давления газов происходит разрыв мембраны и разгерметизация элемента — результатом обычно становится течь электролита.
Для увеличения срока хранения в ранних конструкциях элементов производилось амальгамирование цинкового порошка, однако такой способ продления срока хранения элементов делает элементы опасными для использования в быту. Поэтому в современные элементы вводят специальные органические ингибиторы коррозии.
Срок хранения щелочного элемента больше, чем у солевого, за счёт герметичной конструкции, также он не столь требователен к условиям хранения.
В отличие от солевых элементов щелочные могут работать при большем разрядном токе. Кроме того, отсутствует эффект «усталости» элемента, когда после работы на большой нагрузке происходит значительное падение напряжения на выводах элемента, и для восстановления его работоспособности требуется определённое время «отдыха». Однако при коротком замыкании или установке в неверной полярности также возможна течь электролита.
Щелочной элемент имеет то же рабочее напряжение, что и обычный марганцево-цинковый при большей ёмкости, разрядном токе, сроке хранения и рабочем диапазоне температур. Щелочные элементы выпускаются в тех же типоразмерах, что и солевые, и потому могут применяться в тех же приборах, например, в фонарях, электронных игрушках, переносных магнитофонах и т.д. Однако за счёт лучших разрядных характеристик возможно применение их как в устройствах, потребляющих значительный ток (фотовспышки, радиоуправляемые модели), так и в устройствах, потребляющих относительно небольшой ток в течение длительного времени (электронные часы).
Сравнение солевых и щелочных элементов[править | править код]
Благодаря такой конструкции, у щелочного элемента есть следующие особенности:
- Отсутствие расхода электролита, а значит меньшее его количество, необходимое для работы
- Анодом является порошкообразный цинк, а не цинковый стакан, поэтому реакция идёт на значительно большей поверхности.
- Меньше газовыделение, благодаря чему элемент можно делать полностью герметичным.
Отсюда можно выделить следующие преимущества и недостатки:
Преимущества[править | править код]
- Ёмкость — в 1,5–10 раз больше, чем у солевых элементов, в зависимости от режима работы, при том же типоразмере элемента
- Меньший саморазряд, длительный срок хранения
- Лучшая работа при низких температурах
- Лучшая работа при больших токах нагрузки
- Меньше падение напряжения по мере разряда
Недостатки[править | править код]
- Более высокая цена
- Большая масса
- Неприемлемы способы восстановления работоспособности, применимые для солевых элементов. Однако существуют особые конструкции щелочных элементов, допускающие определённое количество (обычно, до 25) перезарядок. Такие элементы называют «Rechargeable Alkaline Manganese» (RAM, перезаряжаемые щелочные марганцевые).
- Вересов Г.П. Электропитание бытовой радиоэлектронной аппаратуры. — М.: Радио и связь, 1983. — С. 85—95. — 128 с.
- В.В. Китаев, Бокуняев А.А. Колканов М.Ф. Электропитание устройств связи. — М.: Связь, 1975. — С. 225—235. — 328 с. — 24 000 экз.
- Костиков В.Г. Парфенов Е.М. Шахнов В.А. Источники электропитания электронных средств. Схемотехника и конструирование: Учебник для ВУЗов. — 2. — М.: Горячая линия — Телеком, 2001. — 344 с. — 3000 экз. — ISBN 5-93517-052-3.
Принцип работы и устройство батарейки
Батарейки являются незаменимыми источниками электроэнергии. Благодаря ним человек не зависит от проводов и становится более мобильным. В этой статье будет рассказано о том, из чего состоит элемент питания и в чем заключается принцип работы батареек.
Из чего состоит
Батарейка состоит из картонного, пластмассового или металлического корпуса. В портативных источниках напряжение внешняя оболочка, как правило, не участвует в электрохимической реакции.
Внутри батареи находится положительный стержень и электролит, который также принимает участие в передаче электрического тока. Конструкция элемента питания может быть различной, но практически у всех типов источников тока присутствуют перечисленные детали.
При необходимости, можно достать такие элементы, аккуратно разобрав батарейку и достав содержимое из её корпуса для изучения.
Устройство батарейки
Конструкционные особенности батареек связаны, прежде всего, с их размерами и формой.
Цилиндрической
Цилиндрическая батарейка имеет вытянутый корпус. Оболочка в таких элементах чаще состоит из металла. Эта часть надёжно изолирована от внутренних деталей.
Сразу после диэлектрической оболочки следует тонкий стакан из токопроводящего металла (цинка в солевых батареях). Этот элемент соединяется с отрицательным выводом батарейки.
В середине цилиндрического элемента питания располагается графитовый стрежень, который является положительным выводом. В контактной части на эту деталь надевается металлический колпачок для защиты от механических повреждений.
В пространстве между центральным стержнем и отрицательной оболочкой находится электролит и деполяризующая смесь.

Круглой (миниатюрной)
Кнопочная батарея является незаменимым элементом питания в наручных часах и других миниатюрных электрических устройствах. Срок службы таких батареек, как правило, выше чем у пальчиковых, но причина длительной работы связана, прежде всего, с небольшим электропотреблением устройств, в которые устанавливается данный элемент.
Состоит такая батарейка из положительного и отрицательного полюсов, между которыми находятся вещества, вступающие в химическую реакцию при подключении к источнику тока потребителей.
Разноимённые контакты в таких изделиях надёжно изолированы друг от друга диэлектрическим материалом. Наиболее часто кнопочные батареи производят по воздушно-цинковой технологии.
Крона
Крона отличается от других батареек тем, что внутри элемента находится 6 небольших источников питания по 1,5 Вольт. Принцип работы каждого отдельного изделия не отличается от пальчиковых или кнопочных батарей.
Корпус батарейки «Крона» изготавливается из металла, но также может использоваться прочный пластик. Отдельные элементы располагаются сверху вниз и подключаются последовательно. Положительный и отрицательный выводы находятся на одной из плоскостей, которая изготавливается из диэлектрика.
Особенности химического состава
В зависимости от веществ, которые используют внутри батареи, такие изделия могут быть солевыми, щелочными или литиевыми. Каждая группа имеет свои особенности химического состава.
Солевой
В качестве катода в солевой батарее используется цинк, а анод представляет собой стержень, изготовленный из графита и MnO2. Электролит в элементе этого типа – это хлорид аммония или калия. Для придания необходимой консистенции в него также добавляют специальный загуститель.

Элементы питания этого типа, в которых в качестве анода используются серебро, обладают значительно большим сроком годности. Называются такие элементы серебряно-цинковыми и стоят значительно дороже простых солевых батареек.
Щелочной
Строение алкалиновой батарейки практически не отличается от солевой. Разница заключается только в том, что в щелочном элементе серединный стержень устанавливается на отрицательный вывод, а не на положительный.
Химический состав изделия этого типа следующий:
- Катод – диоксид марганца.
- Анод – порошкообразный цинк.
- Электролит – гидрооксид калия.
Основное преимущество марганцево-щелочных элементов перед солевыми батареями заключается в большей ёмкости.
Литиевой
Литиевые неперезаряжаемые элементы имеют следующий химический состав:
- Анод – литий или литиевые соединения.
- Катод – диоксид марганца, пирит и другие.
- Электролит – перхлорат лития, тионилхлорид.
Литиевые элементы питания работает в различных устройствах значительно дольше щелочных и солевых изделий, но и стоимость их на порядок выше.

Откуда берётся ток
В отличие от аккумуляторов, батарея сделана таким образом, что её невозможно перезарядить. Тем не менее, этот источник тока имеет на контактах необходимый ток для питания различных устройств. Физика такого явления очень проста:
- Металлический элемент помещается в окислитель, в который и переходят положительно заряженные частицы.
- При этом в металле будут накапливаться отрицательные ионы.
При подключении потребителя механизм этот будет поддерживаться до тех пор, пока металл практически полностью не расходуется.
Принцип работы батарейки
Принцип работы батареи довольно прост для понимания. Схема образования электричества выглядит следующим образом:
- Цинковый стакан элемента питания в результате химической реакции приобретает отрицательный заряд.
- Графитовый стержень становится положительно заряженным.
Отрицательные ионы, которые поступают на соответствующий вывод, потекут к положительному полюсу при подключении какой-либо нагрузки, например, лампочки или моторчика.
В общем, устройство батарейки представляет собой очень простую схему, которую, при желании, можно повторить самостоятельно в домашних условиях, используя при этом вполне доступные химикаты и металлические изделия.
Остались вопросы или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полезным, полным и точным.
какие процессы скрыты под оболочкой

 Батарейки являются наиболее распространенным источником питания. Современный мир не представляет себя без различной электроники, для них необходима электроэнергия. Не всегда получается применять обычные сетевые источники, для этого и нужны гальванические элементы. Глядя на них наверняка каждый задавался вопросом из чего состоит батарейка и как она работает.
Батарейки являются наиболее распространенным источником питания. Современный мир не представляет себя без различной электроники, для них необходима электроэнергия. Не всегда получается применять обычные сетевые источники, для этого и нужны гальванические элементы. Глядя на них наверняка каждый задавался вопросом из чего состоит батарейка и как она работает.Что такое батарейка
Обыкновенная батарейка представляет собой электрический источник питания на основе химических реакций. При взаимодействии двух металлических электродов в жидком или твердом электролите происходит выработка энергии в результате взаимодействия элементов. Первая батарейка была изобретена более 2000 лет тому назад, при реакции меди и железа в уксусе вырабатывалось напряжение 1 В.
Важно! Одиночные гальванические элементы не подлежат восстановлению заряда.
Разновидности
По форме и размерам согласно мировым стандартам элементы питания разделяются на такие виды:
- АА- пальчиковая;
- ААА- мизинчиковая;
- АААА;
- С- дюймовочка;
- D- бочка;
- квадратная;
- РР3- крона;
- Источники питания миниатюрных размеров.
В настоящее время существует большое количество разнообразных источников питания. Между собой они отличаются материалами, применяемыми для изготовления электродов и электролита. Среди многочисленных батареек выделяют несколько основных видов:
- солевые;
- щелочные;
- ртутные;
- серебряные;
- литиевые.
Солевые
Такие гальванические элементы имеют низкую стоимость относительно аналогов, однако имеется один существенный недостаток это низкая внутренняя емкость таких батареек.
Щелочные
Состав батарейки такого вида отличается от своих аналогов применяемым электролитом, в них используется активная щелочь гидроксид калия KOH. Электрод выполнен из двуокиси таких металлов, как цинк и марганец. Нашли широкое применение в современной электронике, на корпусе элементов указывается маркировка «ALKALINE».
Основным плюсом такой батарейки является продолжительный срок службы, в процессе эксплуатации номинальное напряжение понижается с меньшей скоростью. К минусам относят повышенную стоимость.
Серебряные
В качестве электролита применяют КОН, в состав электродов включено серебро. В таких элементах отмечают значительно увеличение срока службы, повышенную энергетическую плотность, постоянное номинальное напряжение, а также полную безвредность. Недостатками являются высокая цена.
Ртутные
В строении таких батареек используется цинк в качестве металла для анода, катод выполняется из ртутного оксида. Электроды разделяются сепаратором пропитанным электролитом. Такой элемент питания способен выполнять функции аккумулятора, однако емкость будет постепенно понижаться с каждым циклом восстановления заряда. При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
Внимание! Ртутные источники питания являются опасными для здоровья человека и окружающей среды.
Литиевые
Данные элементы питания постепенно вытесняют все аналоги. Отрицательные электроды такой батарейки сделаны из лития. В них постоянно совершенствуются основные технические характеристики. К плюсам батареек с литиевым электродом относят увеличение срока хранения, широкий диапазон рабочих температур, повышенная внутренняя емкость. Основным минусом является повышенная стоимость.
Устройство батарейки
Рассмотрим, как устроена батарейка на примере щелочного элемента в разрезе. В качестве материала для отрицательного электрода применяется цинк, он пропитывается щелочным электролитом. Вывод анода на корпус изготавливается в виде стальной тарелки. Положительный электрод производят из никелированной стали.

Для того, чтобы не возникало коротких замыканий необходимо изолировать оболочку. Специальная прокладка удерживает газы, которые образуются в ходе химических реакций, так как их количество незначительно, камера для сбора выполняется малых размеров. В конструкции присутствует предохранительная мембрана, она защищает батарейку от возникновения короткого замыкания. Мембрана прорывается, и излишний электролит вытекает наружу.
Принцип работы батарейки
Любой химический источник питания имеет в своей конструкции положительно и отрицательно заряженные электроды, а также активный электролит. Заряженные частицы электроны перемещаются от минуса к плюсу при подключении нагрузки. Катод выполняет восстановительную функцию, напитываясь зарядом от анода. Жидкий или твердый электролит выполняет функцию проводника для заряженных частиц.

Интересно знать! В результате химических реакций внутри элемента питания происходит необратимое разрушение металлических элементов питания, батарейка теряет свою емкость.
Применение
Различные виды могут применяться по-разному, зависит это от их основных конструктивных свойств и характеристик:
- Элементы питания с твердым электролитом используют в устройствах с малым значением потребляемого тока. Например, часы фонарики с малой мощностью, а также пульты дистанционного управления.
- Щелочные батарейки применяют в электротехнике с повышенным значением тока, к ним можно отнести различные камеры и магнитофоны, а также игрушки с электродвигателем.
- Источники питания с серебряными электродами способны обеспечить электроэнергией в калькуляторах, переносных инструментах и аппаратах для улучшения слуха.
- Литиевые батарейки используют в портативной электронике, где необходимо стабильное значение емкости и потребляемого тока.
Выбор источника питания
Для правильного выбора элементов питания необходимо обратить внимание на следующие факторы:
- В аппаратах и оборудовании какого вида он будет применяться.
- Электролит какого состава используется в конструкции.
- Стоимость батарейки, иногда более выгодно приобрести несколько дешевых, чем один очень дорогой.
- Каждый элемент питания на корпусе имеет маркировку, по которой можно определить вид и состав источника питания.
- Необходимо ориентироваться по условиям окружающей среды в процессе эксплуатации.
- Рекомендуется приобретать источники питания, произведенные сравнительно недавно, так как с течением времени емкость может понижаться.
- Перед покупкой следует обратить внимание на целостность упаковки и самого корпуса элемента.
- Батарейка должна конструктивно соответствовать своему посадочному месту в электроприборе.
Правильный выбор и соблюдение требований к безопасной эксплуатации позволит продлить работу любого элемента питания. Для определенных видов техники необходим свой вид батарейки.



